Что такое факторные инфекции
Обновлено: 24.04.2024
Классификация ( формы ) инфекционных заболеваний. Экзогенные инфекции. Эндогенные инфекции. Регионарные и генерализованные инфекции. Моноинфекции. Микстинфекции.
Инфекционные болезни обычно сопровождаются нарушениями гомеостаза организма и его физиологических функций. Множество взаимодействующих параметров в системе конкретный возбудитель-конкретный организм находит отражение в различных формах инфекционного процесса и его вариантах. Другими словами, в зависимости от эпидемиологической ситуации, типа и свойств возбудителя (например, инфицирующей дозы, вирулентности и т.д.), состояния параметров гомеостаза человека, а также от конкретных особенностей взаимодействия возбудителя и организма инфицированного человека, инфекционный процесс может принимать различные формы (от клинически выраженных до бессимптомных, от суперинфекций до бактерионосительства). Ниже рассмотрены основные формы инфекционных процессов.
Экзогенные инфекции. Эндогенные инфекции.
Экзогенные инфекции развиваются в результате проникновения в организм патогенных микроорганизмов из внешней среды.
Эндогенные инфекции обычно развиваются в результате активации и, реже, проникновения условно-патогенных микроорганизмов нормальной микрофлоры из нестерильных полостей во внутреннюю среду организма (например, занос кишечных бактерий в мочевыводящие пути при их катетеризации). Особенность эндогенных инфекции — отсутствие инкубационного периода.

Регионарные инфекционные заболевания. Генерализованные инфекции
• Регионарные инфекционные заболевания — инфекционный процесс протекает в каком-либо ограниченном, местном очаге и не распространяется по организму.
• Генерализованные инфекционные заболевания развиваются в результате диссеминирования возбудителя из первичного очага, обычно по лимфатическим путям и через кровоток.
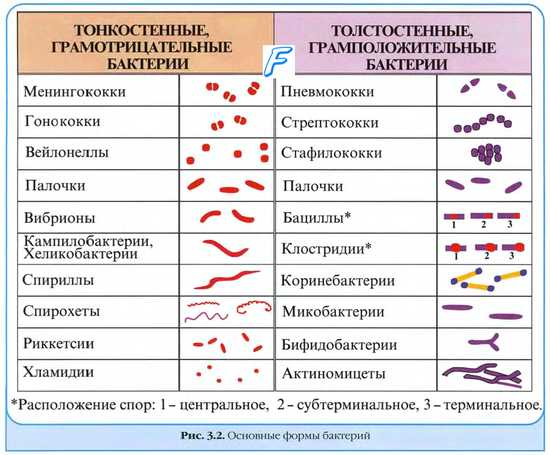
Моноинфекции. Микстинфекции ( миксты )
Моноинфекции — заболевания, вызванные одним видом микроорганизмов.
Смешанные инфекции ( микстинфекции, миксты ) развиваются в результате заражения несколькими видами микроорганизмов; подобные состояния характеризует качественно иное течение (обычно более тяжёлое) по сравнению с моноинфекцией, а патогенный эффект возбудителей не имеет простого суммарного характера. Микробные взаимоотношения при смешанных (или микст-) инфекциях вариабельны:
• если микроорганизмы активизируют или отягощают течение болезни, их определяют как активаторы, или синергисты (например, вирусы гриппа и стрептококки группы Б);
• если микроорганизмы взаимно подавляют патогенное действие, их обозначают как антагонисты (например, кишечная палочка подавляет активность патогенных сальмонелл, шигелл, стрептококков и стафилококков);
• индифферентные микроорганизмы не влияют на активность других возбудителей.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Первоначально причину факторных болезней объясняли теми факторами, которые сформировались в новых условиях. Но, без особых усилий подтверждали инфекционную природу этих болезней. Разумеется, предпринимали меры разработать специфические биологические препараты для диагностики и профилактики по аналогии с классическими инфекционными болезнями. Такие препараты готовили, но их эффективность, как правило, была очень низкой.
Потребовался пересмотр взгляда на природу инфекционных болезней животных. Безусловно, причиной всех таких болезней являются микроорганизмы. Но одни из них вызывают заболевание животных после заноса к ним возбудителя инфекции. В организме таких животных этот возбудитель инфекции закономерно не переживает. Такие болезни получили название классические. Другие микробы закономерно переживают в организме тех животных, которые при каких-то обстоятельствах заболевают соответствующей болезнью. Такие болезни получили название факторные.
Таким образом, основным признаком факторных инфекционных болезней является то, что их возбудители постоянно и закономерно переживают в организме животных тех видов, которым она (болезнь) свойственна. Инфекционные болезни этой группы подразделяются по эпизоотологическому признаку на болезни, которым не свойственна эстафетная передача возбудителя инфекции и болезни, которым свойственна эстафетная передача возбудителя инфекции.
Раздел 1 факторные инфекционные болезни, которым не свойственна эстафетная передача возбудителя инфекции
Кроме основного признака, свойственного факторным инфекционным болезням (закономерное переживание возбудителя инфекции в организме животных тех видов, которым свойственна болезнь) и признака, по которому их относят к болезням, без эстафетной передача возбудителя инфекции, имеются и другие характерные особенности болезней этой группы. К ним можно отнести то, что:
- животные заболевают этими болезнями после заметного изменения условий содержания, кормления и ухода. Такие изменения определяют как результат стрессового воздействия. Это воздействие порождается различными факторами внешней среды.
- Кроме основного возбудителя инфекции в формировании инфекционного процесса принимают участие другие убиквитарные сопутствующие микроорганизмы.
- Низкая эффективность специфической профилактики и значительное улучшение эпизоотической ситуации после устранения факторов, породивших стрессовую ситуацию, ставшую пусковым механизмом инфекции.
Возбудитель инфекции, вызвавший болезнь, переживает в организме животных многих видов. Всем им свойственна соответствующая болезнь. Но заболевают ею только те животные, которые попали под стрессовое воздействие.
- Передача возбудителя инфекции реализуется паравертикальным путем. При этом практически не происходит его вынос за пределы эпизоотического очага.
- Эпизоотические процессы факторных инфекционных болезней животных, которым несвойственна эстафетная передача возбудителя инфекции, подчинены действию закона стресса
Уместно отметить, что факторными инфекционными болезнями, которым не свойственна эстафетная передача возбудителя инфекции, заболевают животные многих видов. Например, колибактериозом, пастереллезом, стрептостафилококкозами и др. болеют крупный и мелкий рогатый скот, свиньи, лошади, птица. Но больные не выполняют функцию источника возбудителя инфекции для животных других видов. Такую функцию они могут выполнять только для животных своей популяции в пределах эпизоотического очага. Надо помнить, что заболевание животных болезнями этой подгруппы начинается и продолжается в результате стрессового воздействия на них. Напротив, функцию источника возбудителя инфекции факторных инфекционных болезней, которым свойственна эстафетная его передача, выполняют только облигатные хозяева соответствующего возбудителя инфекции. В случаях заболевания болезнями этой подгруппы сельскохозяйственных и домашних животных-потенциальных хозяев, они тяжело переболевают, зачастую с летальным исходом, но функцию источника возбудителя инфекции не выполняют. При этом в эпизоотическом процессе формируется тупиковая ситуация.
Колибактериоз
Определение - колибактериоз это факторная бактериальная инфекционная болезнь новорожденных телят, поросят и ягнят, которой не свойственна эстафетная передача возбудителя инфекции. Переболевание телят характеризуется энзотичностью, отказом от корма, профузным изнурительным поносом, обезвоживанием организма. Новорожденные заболевают колибактериозом в течение всего года. Число заболевших находится в прямой зависимости от числа растелившихся коров. В первые сутки переболевания температура тела у некоторых больных телят поднимается до 40 о С, иногда даже несколько выше, и на таком уровне поддерживается 3-4 дня. У других больных телят она несколько дней поддерживается на уровне 38 о С, но у всех перед смертью резко снижается.
Этиология - причиной заболевания являются переживающие вне организма животного энтеропатогенные серовары кишечной палочки (Escherichia coli). Благоприятными условиями для такой жизнедеятельности являются постоянно заполненные телячьими и поросячьими экскрементами канализационные лотки в крупных однозальных помещениях. Такие условия создаются и в условиях летних лагерей, если в них имеются условия для жизнедеятельности кишечной палочки вне организма животных.
При этом энтеропатогенные серовары кишечной палочки выделяют в окружающую среду большое количество продуктов своей жизнедеятельности, являющихся токсичными для новорожденных.
Заболевание телят с повышением температуры тела указывает на то, что они инфицированы переживающими вне организма животных энтеропатогенными сероварами кишечной палочки. В этом случае животные болеют колибактериозом.
Массовая заболеваемость новорожденных телят с нормальной температурой тела обусловлена токсикозом продуктами жизнедеятельности такой кишечной палочки, живущей вне организма животного. В этом случае болезнь расценивают как колитоксикоз.
Уместно напомнить, что отмеченная патология, как правило, сопровождается поражением слизистой оболочки пищеварительного тракта и, особенно, тонкого отдела кишечника различными вирусами из родов Rotavirus, Coronavirus и др. Болезнетворное действие энтеропатогенной кишечной палочки, продуктов ее жизнедеятельности (токсинов) и различных вирусов взаимосвязано и взаимообусловлено. Но пусковым механизмом патологии являются необычные для новорожденных санитарно-гигиенические условия, которые можно расценивать как стрессовые.
Все это формирует патологию, которую зачастую определяют как массовые желудочно-кишечные болезни новорожденных. Но, поскольку переболевание происходит на фоне стрессовых воздействий на новорожденных и обусловлено одновременным действием нескольких этиологических агентов, а ведущим из них является кишечная палочка, то болезнь оправдано называть колибактериозом.
Диагностика - диагностируют колибактериоз на основе клинических, эпизоотологических, патологоанатомических данных и лабораторных исследований.
Это типичный и весьма характерный клинический признак переболевания телят колибактериозом. Поэтому диагностировать эту инфекцию у телят следует по ежесуточному приросту живой массы. Нормально развивающийся теленок, поедающий утвержденную норму молозива и молока, должен ежедневно давать не менее 600-700 гр. прироста живой массы. Недополучение такого прироста указывает на патологию.
Эпизоотологический диагноз - заболевают, как правило, все телята с первого дня жизни. Число заболевших зависит от напряженности растелов коров. Патология проявляется в телятниках различной конструкции, но особо злокачественно болезнь протекает в крупных однозальных помещениях с большой сетью, заполненных телячьими экскрементами, канализационных лотков. В таких телятниках новорожденные заболевают, даже если растелы коров единичны. Подобную патологию новорожденных не отмечают в приусадебных хозяйствах сотрудников ферм и других жителей сел.
Во вновь построенных телятниках новорожденные начинают заболевать через 3-4 месяца после ввода их в эксплуатацию. Если в таких помещениях регулярно убирают канализационные лотки, то этот период может быть более продолжительным. Безусловно, животные всех возрастных категорий должны получать полноценные корма в достаточном количестве. Но заболевание телят колибактериозом не зависит от качества и уровня кормления коров.
В случае массового заболевания новорожденных желудочно-кишечными болезнями для уточнения диагноза проводят эпизоотологический опыт: выводят 3-7 глубоко стельных коров из родильного отделения и размещают их в каком-либо приспособленном, но свободном от животных, помещении. Родившихся телят около месяца содержат отдельно от коров в этом же помещении. Если массовая заболеваемость новорожденных телят на ферме происходит по причине колибактериоза, то родившиеся в обособленном помещении болеть не будут.
Патологоанатомический диагноз - характерные для колибактериоза изменения органов и тканей локализуются преимущественно в желудочно-кишечном тракте. В тонком отделе кишечника, слепой и прямой кишках просматривают характерное резко выраженное катарально-геморрагическое воспаление. Нередко при патологоанатомическом вскрытии встречают точечные и полосчатые кровоизлияния Они бывают на слизистой оболочке сычуга. Брыжеечные лимфоузлы увеличены в размере, их разрез имеет красно-вишневый цвет. Печень с признаками перерождения, глинистого цвета. Бывают кровоизлияния под эпикардом и на эндокарде. Сосуды головного мозга инъецированы. Мозговая ткань отечна. Такие патологоанатомические изменения описаны многими авторами (Я.Е.Коляков, С.С.Гительсон, Л.С.Коврук, 1970). Они подтверждают токсикоз в организме новорожденных. Об этом же говорят сгустки створоженного молока в сычуге погибших телят.
Лабораторный диагноз - бактериологическим исследованием удается выделить возбудителя колибактериоза в тех случаях, когда телят содержали в плохих санитарно-гигиенических условиях, способствовавших их инфицированию переживающими вне организма животных энтеропатогенными сероварами кишечной палочки. Если возбудителя колибактериоза выделить не удается, то заболевание телят следует расценивать, как токсикоз продуктами жизнедеятельности, переживающих вне организма животных, энтеропатогенных сероваров кишечной палочки. Такой токсикоз происходит независимо от санитарно-гигиенического уровня содержания телят.
Извещение ветеринарной лаборатории следует учитывать во взаимосвязи с клиническими, эпизоотологическими и патологоанатомическими данными. Решающим для подтверждения диагноза на колибактериоз является эпизоотологический эксперимент проведения растелов коров вне традиционного родильного отделения.
Эпизоотология - на колхозных и совхозных фермах нашей страны колибактериоз, как массовое переболевание телят, начали регистрировать в тридцатые-сороковые годы, после обобществления животных и содержания их большими группами. В то время характерным для животноводческих ферм был низкий уровень санитарии и гигиены. В примитивных животноводческих помещениях формировались условия для жизнедеятельности энтеропатогенных сероваров кишечной палочки вне организма животных. Но обильное выделение продуктов жизнедеятельности этих микроорганизмов блокировала регулярная очистка примитивных жижесборных ям.
Вот почему преобладало заболевание телят колибактериозом, подтверждаемым ветеринарными лабораториями. Колитоксикоз отмечали сравнительно редко.
По мере укрупнения и обустройства животноводческих ферм добротными помещениями с современной канализацией, в лотках которой постоянно поддерживаются экскременты и моча телят, более часто болезнь стала проявляться как колитоксикоз. При бактериологическом исследовании патологического материала от таких больных зачастую не удавалось выделить возбудителя этой инфекции. Все это стало основанием квалифицировать болезнь как диспепсия и отнести ее к категории незаразных. Однако нормализация факторов, предполагаемых как причина этого заболевания (витаминно-минеральный и белково-сахарный обмены) не оказывала влияния на изменение патологического процесса. Больше того, на фоне такой нормализации условий содержания и кормления животных в ряде мест массовая заболеваемость телят желудочно-кишечными болезнями принимала более тяжелое злокачественное течение. Не оказала желаемого результата и специфическая профилактика.
В то же время, как до укрупнения общественных ферм, так и после него в приусадебных хозяйствах жителей сел и деревень, телята не болеют этой инфекцией, даже в том случае, когда на фермах проявляется массовая патология в тяжелой злокачественной форме.
Сезонность колибактериоза находится в прямой зависимости от сезонности растелов коров. Вывод телят в новые летние лагеря предупреждает их заболевание. Но после формирования в таких лагерях условий для жизнедеятельности кишечной палочки вне организма животных, новорожденные переболевают массовыми желудочно-кишечными болезнями.
Весьма показательно, что телята первых дней жизни в новых телятниках длительное время вообще не болеют. Перемещение животных из старого животноводческого помещения, где все новорожденные тяжело переболевали, в новое, резко обрывало заболеваемость. Но после эксплуатации такого помещения 3-4 месяца, болезнь начинает проявляться с характерными для нее признаками. Такое наблюдение описал Я.Е.Коляков с сотрудниками еще в 1970 году. Господствовавший в то время этиоцентрический подход понимания природы инфекционных болезней животных не позволял рационально использовать этот пример для раскрытия сущности факторных инфекций.
Понять проблему колибактериоза можно только на основе многочисленных эпизоотологических наблюдений и опытов. Для этого на неблагополучных по этой факторной инфекции фермах надо проводить растелы групп коров вне традиционных родильных отделений. Рождение и выращивание в таких условиях здоровых телят подтвердит неблагополучие фермы по колибактериозу с сопутствующими ему другими бактериальными и вирусными факторными инфекциями. Уже много лет на современных животноводюческих фермах колибактериоз проявляется как эпизоотия или даже – панзоотия.
Лечение. Если на ферме имеется фактор, исполняющий роль пускового механизма колибактериоза, то все новорожденные переболевают с первых дней жизни. Даже при интенсивном их лечении, как уже отмечалось, телята ежедневно теряют по 300-400 гр. живой массы. В этот период новорожденные подвергаются таким
воздействиям, которые весьма отрицательно сказываются на развитии продуктивных генетически заложенных возможностей.
Вот почему борьбу с этой патологией надо строить, прежде всего, на профилактике. Массовое лечение больных колибактериозом телят надо проводить только в тот промежуток времени, который требуется для оборудования ветеринарно-санитарных технологий, обеспечивающих его профилактику.
Разумеется, ветеринарный врач всегда должен иметь определенный запас лекарственных средств, показавших положительный результат при лечении этой инфекции. Такой запас нужен на тот случай, когда произойдет срыв в процессе профилактики технологией.
Но лечение этой патологии в различных местах и разные авторы проводят по-разному, в зависимости от понимания ее причины. Многие научные сотрудники и ветеринарные врачи причиной массовых желудочно-кишечных болезней новорожденных телят считают неполноценное кормление глубоко- стельных коров. По их мнению, эта болезнь появляется там, где стельным коровам в рационе не дают достаточного количества кормовых единиц, переваримого протеина, витаминов и минеральных веществ. Учитывают, что появлению этой болезни могут способствовать нарушения ветеринарно-санитарных правил содержания и выращивания телят и изменение состава молозива при заболевании коров маститами.
Если такие нарушения стали причиной массовых желудочно-кишечных болезней телят, то их устранение предупредит патологию и изменит эпизоотическую ситуацию. На практике же такое не происходит. Многие признают, что массовая патология новорожденных телят характеризуется признаками обезвоживания организма, как следствия профузного поноса. Но такой симптом говорит о токсикозе.
На основе всего этого болезнь стали определять как диспепсия (В.А.Аликаев, В.М.Подкопаев, 1966) Соответственно ее лечение предлагали проводить:
противотоксическими средствами и средствами, восстанавливающими водно-солевой обмен, регулирующими сердечную деятельность и диурез,
глубокой очистительной клизмой,
диетическими средствами и режимом кормления,
средствами, стимулирующими биологический тонус организма.
В ряде мест такое лечение дополняют применением различных препаратов, изготовленных местными научно-исследовательскими и учебными ветеринарными учреждениями.
Такое лечение продолжают считать основным при массовых желудочно-кишечных болезнях новорожденных телят, хотя оно не дает желаемого результата. Одновременно для лечения этой патологии широко используют антибиотики и другие, бактерицидные и бактериостатические препараты с высоким лечебным эффектом. Хотя достаточной аргументации для их применения при описанном объяснении причин этой патологии, не приводят.
Вместе с тем, если причиной массовых желудочно-кишечных болезней телят считать колибактериоз и колитоксикоз переживающими вне организма животных сероварами энтеропатогенной кишечной палочки и продуктами ее жизнедеятельности, то лечение следует проводить препаратами, способными сорбировать эти продукты, как энтеротропные яды. Поэтому Ю.Я.Дольников (1983, 1986, 1988) предложил серию препаратов, способных сорбировать и обезвреживать такие эндотоксины. Предложенные им препараты разработаны на основе неприродных, нетоксичных растворимых полимеров (поливинилпиролидон, метилцеллюлеза, натриевая соль карбоксиметилцеллюлезы очищенная, полиоксиэтилен высокомолекулярный, поливиниловый спирт и др.). На основе этих полимеров были приготовлены препаративные формы (лерс, стартин, камацел, метицел, и др.), оказавшиеся очень эффективными для лечения колибактериоза новорожденных телят.
Все эти препараты имели в своем составе антимикробное вещество, связанное с растворимым полимером в виде химического комплекса, который не удавалось разделить диализом и хромографией. В этих комбинированных лекарственных препаратах (комбитерах, по определению автора) присутствовало несколько химических веществ патогенетического действия, которые препятствовали образованию в сычуге казеиновых безоаров, уменьшали катаральное состояние слизистой оболочки желудка и тонкого отдела кишечника, восстанавливали водно-солевой баланс организма телят и стимулировали ферментативное пищеварение.
Ю.Я.Дольников (1983) показал, что выпаивание раствора лерса с молоком сохраняет в сычуге телят консистенцию сметаны. Такая консистенция предупреждает образование казеиновых безоаров и препятствует бактериальному гниению пищи. Молекулы полимера связывают токсические вещества и способствуют их удалению. Раствор лерса нормализует водно-солевой баланс.
Препараты-комбитеры применяют в виде водного раствора с молоком или питьевой водой в первые дни жизни новорожденных. Содержимое пакета лерса (500 гр.) растворяют в 10 литрах воды при температуре 70-80 о С. С лечебной целью выпаивают больным телятам по одному литру раствора. Затем в течение 2-3 дней на каждый литр молозива или молока добавляют 250 гр. раствора лерса.
По данным автора и нашим наблюдениям эти препараты оказались во много раз эффективнее официально рекомендованных для лечения больных телят. Данные об эффективности камацела представлены в таблице 2
Лечебная эффективность камацела при колибактериозе новорожденных телят (по материалам 24 хозяйств Иркутской, Семипалатинской областей, Бурятской АССР и Красноярского края за 1986 год, данные Ю.Я.Дольникова)
Индустриальные методы производства продукции животноводства с высокой концентрацией животных на ограниченных площадях изменили эволюционно сложившиеся взаимоотношения между микро- и макроорганизмами. Большая плотность размещения поголовья и насыщенность ферм машинами влияют не только на физикохимический, но и микробный состав среды обитания животных. В связи с этим за последние годы появились новые, ранее не известные болезни сельскохозяйственных и диких животных, особенно вирусной, микоплазменной и смешанной этиологии (3,4,5).
Создание широкой сети промышленных комплексов и специализированных хозяйств по производству мяса, молока, яиц, пушнины и других продуктов животноводства, особенности технологии выращивания таких животных на специализированных предприятиях, поставили перед ветеринарной наукой много проблем, связанных с совершенствованием диагностики заболеваний, средств профилактики, с разработкой эффективной системы охраны хозяйств от заноса возбудителей инфекционных заболеваний, с охраной внешней среды от загрязнения вредными отходами химического, биологического и радиоактивного производства, а также с углублением изучения эпизоотологии и патогенеза этих заболеваний (2, 4, 5, 8).
Благодаря научным разработкам в области ветеринарии в 70-80-х годах прошлого столетия (3,4), а также значительной работе, проведенной практической ветеринарной службой, было достигнуто улучшение эпизоотического состояния в специализированных хозяйствах, снизилась заболеваемость, уменьшились потери продуктивности и гибель животных. Однако, некоторые инфекционные и незаразные болезни все еще представляют серьезную проблему для интенсивного развития сельскохозяйственного производства, т.е. отраслям животноводства, в том числе скотоводства, свиноводства, птицеводства и т.д. (5,6).
Наиболее ощутимый ущерб животноводству, и особенно свиноводству в последние годы, наносят возбудители заболеваний, вызывающие поражения желудочно-кишечного тракта, дыхательного аппарата, органов воспроизводства и молочной железы, т.е. болезни открытых полостей. Они представляют собой важную проблему в ветеринарии и причиняют значительный экономический ущерб животноводству, особенно крупным фермам. Как правило, такие заболевания имеют инфекционную природу, обусловлены разнообразными этиологическими агентами (бактериями, вирусами, грибами, гельминтами и пр.) и протекают чаще в форме факторных смешанных инфекций. При этом, на каждой животноводческой ферме структура этиологических агентов, как и факторов, способствующих возникновению и течению энзоотической вспышки болезни, различные.
При этом индивидуальными, даже самыми современными, высокоэффективными препаратами широкого спектра действия бывает трудно губительно воздействовать на разночувствительную микрофлору.
Если еще учесть генетические возможности микроорганизмов по достаточно быстрой селекции устойчивых к химиотерапевтическим препаратам рас возбудителей, то станет понятной актуальность проблемы создания не только высоко, но и устойчиво эффективных композиционных средств лечения бактериальных инфекций, особенно у молодняка сельскохозяйственных животных (2,3,4,5).
В последние годы ощутимый ущерб свиноводству наносят высоко контагиозные вирусные инфекции, такие как: репродуктивно-респираторный синдром свиней, парвовирусная болезнь, трансмиссивный гастроэнтерит, рото- и энтеровирусные гастроэнтериты, а также ряд других болезней у этого вида животных. Причем, если вирусные гастроэнтериты появились вскоре после перевода свиноводства на промышленную основу и поражали поросят от 10 до 100% в постнатальный период, то парвовирусная болезнь и репродуктивно-респираторный синдром свиней появились гораздо позже и поражают эмбрионы со смертельным исходом, не причиняя большого вреда взрослому свинопоголовью. При развитии иммунологической толерантности вирус внедряется в плод до или непосредственно после рождения (1,2). Антитела к вирусу вырабатываются, но образуют иммунные комплексы с антигеном. Клеточный иммунитет выражен минимально или отсутствует. Вирусы персистируют в зараженных клетках за счет ограничения экспрессии своей генетической информации, либо прекращают синтез всех вирусных белков или только поверхностных.
Парадоксальность явлений вирусной персистенции in vivo состоит в сохранении вируса в организме, несмотря на сильный и разнообразный иммунный ответ. Если антитела имеют КС (комплемент-связывающий) участок, вирион может быть разрушен путем виролиза, так как нейтрализующие антитела только связывают внеклеточный вирус, предупреждая его адсорбцию на клетку. В этих случаях инфицированные клетки не подвергаются иммунному лизису и сохраняют вирусный геном нередко на протяжении всей жизни индивидуума. Исходя из этого, следует считать, что присутствие антител не только защищает организм от острой инфекции, но и способствует становлению персистентной инфекции. Кроме того, установлено, что существование большого числа антигенных вариантов вирусов, а также изменения их антигенных свойств в процессе персистенции, является результатом мутации в соответствующих генах. При репликации ДНК ошибки считывания составляют 10 -8 -10 - ¹º на включающийся нуклеотид, что контролируется корректирующими экзонуклеазами, удаляющими ошибочно включившие основания из вновь синтезированной цепи ДНК. Правильному считыванию родительской цепи ДНК способствует также ее метилирование через определенные интервалы. Частота мутаций у РНК-содержащих вирусов в 10 -4 -10 -6 раз выше, чем у ДНК-содержащих вирусов и становятся недоступными для иммунных антител, т.е. неспособностью иммуноцитов контролировать определенные мутантные вирусы из всей массы вирусных мутантов.
Вся эта совокупность живых систем разнообразных в видовом отношении канонические паразиты-гельминты, членистоногие, простейшие, грибы, бактерии, и вирусы и т.д. была названа Е.Н. Павловским паразитоценозом. По своему составу паразитоценоз не только разнообразен, но и подвижен, так как он может меняться у здорового и больного организма в зависимости от возраста, режима питания, численности на единицу площади и других факторов (1,3).
В последние годы значение приобрели исследования не только вирусов, но и патогенов необычной природы, т.е. прионов, вироидов и трансмиссивных генетических детерминант патогенности (ТГД-П). Последние по природе относятся к внехромосомным циркулярным двуспиральным ДНК (плазмидам), подвижным элементам генома (транспозонам) и вирусам бактерий (фагам).
При изучении вирусов было замечено, что в одной и той же культуре клеток или в организме животного можно одновременно культивировать 2 и более вирусов, бактерий, регистрировать среди них явление синергизма, интерференции или симбиоза и наблюдать смешанную инфекцию у животных.
Это часто обуславливает неадекватность клинико-морфологических изменений при экспериментальных и естественно протекающих простых и смешанных инфекциях (гельминты - простейшие, бактерии - вирусы, вирусы-вирусы, ТГД-П и прочие) в ассоциации с незаразными болезнями (нарушения обмена веществ, пневмонии, энтериты, эндометриты, маститы и т.д.) может проявляться не только симбиоз, экзальтация и синергизм, но и антогонизм (интерференция) возбудителей. Эти процессы представляют большой практический интерес при проведении диагностики, профилактики, терапии и ликвидации факторных смешанных персистентных инфекций.
Причиной тому могут быть эписомы - или трансмиссивные генетические детерменанты. Они несут в клетке дополнительную информацию и могут находиться в ней в одном из двух состояний: автономном, когда они локализуются в цитоплазме или интегрированном, когда они прикреплены к хромосоме. В автономном состоянии эписомы проявляют себя как цитоплазматические структуры, реплицирующиеся независимо от бактериальной хромосомы, а в интегрированном состоянии они являются неотъемлемой частью бактериальной хромосомы, которая контролирует их репликацию. Если эписомы находятся в автономном состоянии, то они могут быть трансмиссивными и инфекционными (трансмиссивными генетическими детерменантами патогенности - ТГД-П) и передаваться другим экологически связанным микроорганизмам при конъюгации, трансдукции и трансформации. Для микробов, постоянно существующих в организме в условиях паразитоценоза или биоценоза, все механизмы приспособления реализуются с помощью эписом (1,3,4,5). К категории эписом относят не только умеренные фаги, генетические детерминанты синтеза бактериоцинов (факторы бактериоциногенности), фертильности (F-фактор) и факторы, контролирующие передачу множественной лекарственной устойчивости (R-фактор).
Умеренные фаги при попадании в клетку (бактерию) либо размножаются автономно, либо индуцируют литический цикл, подобно вирулентному фагу, либо интегрируются с бактериальной хромосомой (профаг), в результате чего фаговая ДНК реплицируется вместе с хромосомой и передается всему потомству (пулу) данной бактерии, т.е. наступает явление лизогении. Такие бактерии способны продуцировать и освобождать фаг, т.е. служат культурой клеток, как у патогенных вирусов и быть иммунными к заражению тем же или близкородственным фагом. Наряду с этим возможна смешанная инфекция у бактерий разными типами фагов, в результате чего происходит фаговая конверсия. В тех случаях, когда фаги являются эписомными элементами, они принимают участие в генетическом обмене между микроорганизмами с помощью трансдукции, т.е. они могут перенести реципиенту углеводы, вирулентность и т.д.
Таким образом, умеренные фаги, представляющие одну из разновидностей эписом, осуществляют генетическую рекомбинацию путем фаговой конверсии и трансдукции, рекомбинации, кросс-реактивации, а также гетерозиготности (1,3,4,5). Если в результате этих взаимодействий происходит потеря функциональной полноценности одного из них в смешанной инфекции, то возникает проблема дефектности и хелпер-факторов (помощников). Хорошо известны дефектные аденоассоциированные вирусы, размножающиеся в культуре клеток только в присутствии вирусов-помощников (аденовирусов).
При детальном изучении этих вопросов было установлено, что заразиться - не значит заболеть, а выздороветь - не значит освободиться от возбудителя болезни (вируса, бактерии и т.д.). Эти понятия появились после того, как из тканей миндалин внешне здоровых животных были выделены аденовирусы. Скрытое размножение аденовирусов происходит благодаря присутствию вируснейтрализующих антител, которые не способны нейтрализовать внутриклеточный вирус, а, соединяясь с внеклеточным вирусом лишают эти вирионы адсорбции на клетки и тем самым создаются условия для его персистенции, когда они мирно сосуществуют с хозяином. Кроме аденовирусов из организма внешне здоровых животных были выделены вирусы: гриппа, Ауески, ТГС, рота- и энтеровирусы, парвовирусной болезни, респираторно-репродуктивного синдрома свиней, бешенства, а также ряд других.
Множество таких факторов заставляет нас признать, что разнообразные вирусы могут длительное время скрыто размножаться и переживать в организме человека, животных, насекомых, бактерий и даже растений. Следовательно, вирусо- и бактерионосительство среди людей, животных и растений встречается также довольно часто (эшерихии, сальмонеллы, пастереллы, клостридии, различные кокки и т.д.) и являются одной из главных причин возникновения и распространения возбудителей факторных персистентных инфекций.
В.В. Макаров с соавторами рассматривают ТГС-П (плазмиды, транспозоны и фаги) как самостоятельных индивидуальных носителей собственной чужеродной для реципиентов (бактерий) генетической информации, которые сообщают им дополнительные свойства, а именно: плазмиды за счет конъюгации и трансформации передают способность к переносу ТГД лекарственной устойчивости, бактериоциногенности, синтеза антибиотиков, биодеградации камфоры, толуола, ксилола, иммунитета к некоторым фагам, опухолеродности, патогенности, токсигенности, гемолитичности, транспозоны за счет трансфекции и транспозиции - лекарственную устойчивость, патогенность и токсигенность (3,6,7,8).
Современные методы диагностики, в частности определение антител в крови методом ИФА и определение ДНК возбудителя методом ПЦР, продемонстрировали, что инфицированность людей оппортунистическими инфекциями достигает 90–99%.
Что такое оппортунистические инфекции
Так обозначаются распространенные хронические инфекционные заболевания, вызываемые условно патогенными микроорганизмами разных типов (вирусы, бактерии, простейшие, внутриклеточные микробы), поражающими преимущественно слизистые оболочки и лимфатическую систему, передающимися разными путями и имеющими ряд закономерностей.
Формирование очагов хронических (оппортунистических) инфекций происходит так, как изображено на рисунке 2. Инфицирование становится заболеванием, если нарушается баланс между количеством возбудителя, попавшего в организм, и состоянием иммунной системы. При ослабленном иммунитете даже небольшое количество микроба может создать проблемы, а большое количество микроорганизмов вызовет заболевание и при неослабленном иммунитете. Некоторые микроорганизмы могут вызвать острое заболевание, а потом перейти в хроническую форму; например, это характерно для вируса Эпштейн Барр – возбудителя инфекционного мононуклеоза. Другие возбудители могут формировать хроническое заболевание без стадии острой болезни, например лямблии (острая форма лямблиоза встречается очень редко). Активизация хронической инфекции может произойти на фоне инфицирования любым другим микробом, тогда к клиническим проявлениям, характерным для этого микроорганизма, присоединяются клинические проявления, характерные для хронического очага. Например, ребенок заболевает ОРВИ, через несколько дней присоединяются симптомы кишечных нарушений. Это может быть активизацией очага хронической инфекции в ЖКТ, спровоцированной ОРВИ.
Эпидемиология
Для оппортунистических инфекций характерны всевозможные пути заражения:
- воздушно капельный (хламидии, легочные микоплазмы); передаваться могут как активные, так и неактивные формы, если человек является не только носителем, но и выделителем микроба в окружающую среду (большинство людей являются носителями, примерно 15% – выделители);
- фекально оральный (хламидии – Ch. psittaci, лямблии); хламидийная инфекция характерна для птиц, животных. Экскременты перемешиваются с землей, загрязняют руки и продукты, при попадании загрязненных и инфицированных элементов в кишечник там может сформироваться очаг хронической инфекции;
- половой (урогенитальный хламидиоз, оппортунистические инфекции); вертикальный (трансплацентарно, во время родов); за счет того, что хронические инфекции существуют в виде активных и неактивных форм (рис. 1), возможен такой способ передачи инфекции от матери плоду: у беременной женщины существует оппортунистическая инфекция в латентной форме, клинических проявлений нет, антитела в крови – в пределах нормы или не выявляются. Происходит вертикальная передача инфекции плоду (передаются неактивные формы), у родившегося ребенка в какой-то момент происходит активизация инфекции;
- трансмиссивный (через кровь и насе комых).
Закономерности влияния на организм
Любой очаг хронической инфекции может вызвать следующие нарушения в организме:
Наличие даже одного направления клинической картины должно наводить педиатра на предположение о поиске хронических (оппортунистических) инфекций.
Принципы диагностики
Выявление инфекционного фактора может идти по двум направлениям.
Трактовка результатов анализов представлена в таблице 2. В двух последних строках – ситуации, не требующие лечения.
| IgG | IgM | IgA | ПЦР | Трактовка |
| ↑ | N | N | ↑ или N | Инфекция есть (или есть иммунная память) |
| ↑ или N | ↑ | N | — | Активная фаза (недавнее первичное инфицирование) |
| ↑ или N | ↑ или N | ↑ | — | Активизация хронической инфекции |
| N | N | N | ↑ | Инфекция неактивна (или убитые микробы) |
| N | N | N | N | Инфекции нет (или нет клинически значимой) |
Повышение антител класса G выше диагностически значимых титров к какой либо хронической инфекции при первичной диагностике должно трактоваться как наличие этой инфекции и требует терапевтических действий: иммунокоррекции или активной этиотропной терапии.
Актуальные в педиатрии хронические инфекции
Бактериальные инфекции, вызванные условно патогенной флорой (УПФ)
Возбудители: гемолизирующая кишечная палочка, золотистый стафилококк, гемолизирующие стрептококки, клебсиеллы, лактозонегативные энтеробактерии и др. Живут на слизистых оболочках и в просвете ЖКТ, дыхательных, мочевыводящих путей.
Тактика педиатра: иммунокоррекция, применение фаготерапии, антисептиков. Применение антибиотиков показано в острую фазу (фебрильная температура, выраженность клинических проявлений).
Хламидийная инфекция
Возбудители: Ch. trachomatis, Ch. pneumoniae, Ch. psittaci. Вызывают внутриклеточные инфекции, поражающие слизистые оболочки и лимфатическую систему. Могут поражать все системы, где есть слизистая оболочка: конъюнктива глаза (интранатальное инфицирование); верхние дыхательные пути (ВДП), нижние дыхательные пути (воздушно капельный путь); слизистая ЖКТ (фекально оральный путь); мочеполовая система (половой путь или занос через лимфатическую систему);
Источники заражения:
- Человек, как здоровые носители, так и те, у кого активная форма болезни, при условии локализации на слизистых, сообщающихся с окружающей средой. Считается, что носителями хламидий являются более 90% людей.
- Птицы (попугаи, голуби, воробьи и др.). Хламидии выделяются с птичьим пометом, помет попадает в почву и на продукты питания, заражение человека происходит фекально оральным или воздушно-капельным путем.
- Кошки, мелкий рогатый скот (козы).
Инфицирование – еще не заболевание. Клинические признаки появляются при ослаблении иммунитета.
Клиническая картина зависит от локализации и активности хламидий:
- конъюнктивит (бывает у новорожденных детей при интранатальном инфицировании);
- хронические рецидивирующие заболевания ВДП (тонзиллит, фарингит), а также острые заболевания (ангина);
- рецидивирующие бронхиты или пневмонии, бронхообструкция, астма;
- хроническая дисфункция ЖКТ, дисбактериоз, не поддающийся лечению;
- атопический дерматит (хламидии, будучи внутриклеточной инфекцией, могут приводить к повреждению гистаминобразующих тучных клеток слизистых оболочек) с торпидным течением без эффекта от лечения;
- острые и рецидивирующие заболевания мочевыводящих путей, вульвиты и другие поражения половой системы.
- у детей диагноз подтверждается методом ИФА по выявлению антител;
- метод ПЦР и другие исследования, направленные на выявление возбудителя, практически не имеют смысла, поскольку локализация инфекции происходит чаще всего в труднодоступных для исследования местах (например, глубоко в бронхах или в слизистой оболочке кишечника);
- мазок из зева на выявление хламидий (методом ПЦР) нужен только для выявления степени эпидемиологической опасности, но не может быть основанием для назначения лечения;
- направление на анализы крови для выявления антител к хламидиям – по клинической картине и при наличии эпидемиологических указаний (при выявлении хламидийной инфекции в близком окружении).
Врачебная тактика при хламидийной инфекции. Применение антибактериальной терапии показано только при наличии признаков активности хламидийной инфекции, иначе не будет эффекта.
Показания для антибактериальной терапии:
- любое острое состояние, требующее назначения антибиотика: ангина, пневмония, острый бронхит, гнойный отит, гнойный тонзиллит, гайморит в стадии обострения;
- ОРЗ с высокой температурой (более 38,0 °С) более 3–5 дней;
- ОРЗ с температурой выше 37,0 °С, если она держится более 7–10 дней подряд;
- бронхообструктивный синдром; приступ бронхиальной астмы (если наличие хламидийной инфекции подтверждено анализами);
- затяжной кашель более 3 недель;
- обострение дерматита (если наличие хламидийной инфекции подтверждено анализами);
- неэффективность лечения аллергических болезней.
Примерная схема лечения в острый период хламидийной инфекции:
- Свечи Виферон и/или КИПферон для укрепления иммунной системы и повышения эффективности антибиотика, 10 дней.
- Антибиотик – макролид (кларитромицин, рокситромицин, мидекамицин, джозамицин, спирамицин), курс 10 дней.
Вне периода активности применяются общеукрепляющие средства и иммунокоррекция.
Микоплазменная инфекция
Возбудители: М. pneumoniae, М. hominis. Вызывают внутриклеточные инфекции, поражающие слизистые оболочки. Излюбленная локализация: дыхательные пути (как верхние, так и нижние) и мочеполовая система (МПС).
Источники заражения: человек – как здоровые носители, так и те, у кого активная форма при условии локализации на слизистых, сообщающихся с окружающей средой. Считается, что носителями микоплазм являются более 90% людей.
Клиническая картина – заболевания дыхательных путей и МПС. До 30% бронхиальной астмы ассоциировано с наличием микоплазменной инфекции, удачное лечение которой может избавить человека от заболевания или существенно улучшить его течение.
Диагностика и лечебная тактика при микоплазменной инфекции не отличаются от таковой при хламидийной инфекции.
Вирусные хронические инфекции Возбудители: вирус Эпштейн Барр (ВЭБ), вирусы простого герпеса 1 го, 2 го, 6 го типов (ВПГ), цитомегаловирусы (ЦМВ) и др.
Для ВЭБ характерны как острое заболевание (инфекционный мононуклеоз), так и хроническое течение по типу оппортунистической инфекции. Для ВПГ 6 го типа характерны острые состояния по клинической картине, напоминающие инфекционный мононуклеоз.
Диагностика. Исследование крови на антитела (ИФА), диагностически значимым критерием является повышение уровня IgG; возможно также выявление методом ПЦР со слизистых зева.
Лечебная тактика. При выявленном носительстве ВЭБ в период протекания ОРЗ нужно проводить противовирусную терапию (Арбидол, Виферон, Изопринозин) в сочетании с иммунокоррекцией; лечебные мероприятия наиболее эффективны в период обострения.
До этого такие болезни встречались в виде единичных случаев заболевания или вообще не встречались. Промышленное ведение отраслей животноводства потребовало концентрировать большое число животных на ограниченных площадях, Для реализации такой технологии отказались от традиционно сложившихся требований по обеспечению животных подстилкой, прогулками, ежедневной чисткой и другими санитарными и гигиеническими мерами. В поиске механизации трудоемких процессов животноводства не учли, что эти традиционные меры составляли основу профилактики тех болезней, которые теперь названы факторными.
Первоначально причину факторных болезней объясняли теми факторами,
которые сформировались в новых условиях. Но, без особых усилий подтверждали инфекционную природу этих болезней. Разумеется,
предпринимали меры разработать специфические биологические препараты для диагностики и профилактики по аналогии с классическими инфекционными болезнями. Такие препараты готовили, но их эффективность, как правило, была
Потребовался пересмотр взгляда на природу инфекционных болезней животных. Безусловно, причиной всех таких болезней являются
микроорганизмы. Но одни из них вызывают заболевание животных после заноса к ним возбудителя инфекции. В организме таких животных этот возбудитель инфекции закономерно не переживает. Такие болезни получили название
классические. Другие микробы закономерно переживают в организме тех животных, которые при каких-то обстоятельствах заболевают соответствующей болезнью. Такие болезни получили название факторные.
Таким образом, основным признаком факторных инфекционных болезней является то, что их возбудители постоянно и закономерно переживают в организме животных тех видов, которым она (болезнь) свойственна. Инфекционные болезни этой группы подразделяются по эпизоотологическому
признаку на болезни, которым не свойственна эстафетная передача возбудителя инфекции и болезни, которым свойственна эстафетная передача возбудителя инфекции.
Читайте также:

