Что такое инфекции вызванные мас
Обновлено: 18.04.2024
Атипичная микобактериальная инфекция — комплекс гранулематозных поражений, вызываемых микобактериями, отличающимися от классических патогенов — возбудителей туберкулёза и лепры.
Этиология. Возбудители — кислотоустойчивые бактерии Mycobacterium ulcerans, M. marinum (M. balnei), M. kansasii, M. avium-intracellulare, M. xenopi, M. scrofulaceum.
Эпидемиология. Большинство возбудителей широко распространено в окружающей среде; некоторые обитают в воде и прибрежной зоне, вызывая заболевания у рыб, другие (например, Mycobacterium avium-intracellulare) — у птиц. Наиболее часто заражение происходит при вдыхании микобактерий, употреблении заражённых продуктов и проникновении возбудителя через микротравмы кожи и слизистых оболочек.
Патогенез. Проникшие микобактерии фагоцитируются макрофагами и транспортируются в регионарные лимфатические узлы; фагоцитарные реакции незавершённые, и возбудитель персистирует в цитоплазме макрофагов. Воспалительная реакция незначительная, но в месте проникновения развивается первичный аффект. В динамике по ходу регионарных лимфатических путей и узлов формируется первичный комплекс, характеризующийся развитием гранулём. Микроскопия биоптатов выявляет в последних очаги неказеозного некроза, содержащие кислотоустойчивые бактерии.
Клиническая картина
• Туберкулёзоподобные поражения. В патологический процесс вовлекаются лёгкие, почки, кожные покровы и костно-суставная система. Часто осложняют течение эмфизематозных процессов. У 40–50% больных с иммунодефицитными состояниями вызывают генерализованные поражения.
• Лимфадениты. Клинически чаще проявляются поражениями шейных лимфатических узлов (так называемые скрофулы); последние безболезненны, могут изъязвляться либо дренироваться наружу; системные проявления слабые или чаще отсутствуют.
• Кожные поражения. Типичным считают инфицирование ран конечностей, полученных при ударе о стенку бассейна или любой объект на дне и берегах водоёма. Чаще наблюдают образование изъязвляющейся гранулёмы, спонтанно ограничивающейся в течение нескольких недель, в более редких случаях формируется хроническая инфекция.
Методы исследования • Выделение и идентификация возбудителя по скорости роста, образованию пигментов (на свету или в темноте) и патогенности для лабораторных животных • АТ к Mycobacterium kansasii перекрёстно реагируют с Аг Mycobacterium tuberculosis и у инфицированных лиц отмечают положительную реакцию Манту.
Дифференциальная диагностика • Лепра • Туберкулёз • Боррелиоз • Чума.
Лечение • При лёгочных поражениях •• Рекомендовано сочетание изониазида 600 мг, рифампицина 300 мг, стрептомицина 1 г и этамбутола 15–25 мг/кг 1 р/сут •• При поражении M. marinum — миноциклин по 100 мг каждые 12 ч в течение 6–8 нед •• При поражении M. kansasii и M. xenopi эффективна стандартная противотуберкулёзная терапия с обязательным назначением рифампицина •• Оперативное вмешательство рекомендовано при локализованных поражениях у пациентов молодого возраста без патологии других органов и систем • При лимфадените — у детей от 1 до 5 лет показано хирургическое лечение • При кожных поражениях, вызванных M. marinum, — тетрациклин (1–2 г/сут) и сочетание рифампицина и этамбутола в течение 3–6 мес • При инфекциях, вызванных ранами или инородными телами •• Хирургическая обработка раны и удаление инородного тела •• Лекарственная терапия: доксициклин (200–400 мг/сут), цефокситин (200 мг/кг/сут), амикацин (10–15 мг/сут) в течение 3–6 мес • При диссеминированных поражениях — сочетание противотуберкулёзных средств (как при лёгочных поражениях) лишь уменьшает бактериемию и временно ослабляет симптомы.
Течение и прогноз. Течение — прогрессирующее. Более чем у 20% пациентов отмечают рецидивы заболевания в течение 5 лет.
МКБ-10. A31 Инфекции, вызванные другими микобактериями
Код вставки на сайт
Атипичная микобактериальная инфекция — комплекс гранулематозных поражений, вызываемых микобактериями, отличающимися от классических патогенов — возбудителей туберкулёза и лепры.
Этиология. Возбудители — кислотоустойчивые бактерии Mycobacterium ulcerans, M. marinum (M. balnei), M. kansasii, M. avium-intracellulare, M. xenopi, M. scrofulaceum.
Эпидемиология. Большинство возбудителей широко распространено в окружающей среде; некоторые обитают в воде и прибрежной зоне, вызывая заболевания у рыб, другие (например, Mycobacterium avium-intracellulare) — у птиц. Наиболее часто заражение происходит при вдыхании микобактерий, употреблении заражённых продуктов и проникновении возбудителя через микротравмы кожи и слизистых оболочек.
Патогенез. Проникшие микобактерии фагоцитируются макрофагами и транспортируются в регионарные лимфатические узлы; фагоцитарные реакции незавершённые, и возбудитель персистирует в цитоплазме макрофагов. Воспалительная реакция незначительная, но в месте проникновения развивается первичный аффект. В динамике по ходу регионарных лимфатических путей и узлов формируется первичный комплекс, характеризующийся развитием гранулём. Микроскопия биоптатов выявляет в последних очаги неказеозного некроза, содержащие кислотоустойчивые бактерии.
Клиническая картина
• Туберкулёзоподобные поражения. В патологический процесс вовлекаются лёгкие, почки, кожные покровы и костно-суставная система. Часто осложняют течение эмфизематозных процессов. У 40–50% больных с иммунодефицитными состояниями вызывают генерализованные поражения.
• Лимфадениты. Клинически чаще проявляются поражениями шейных лимфатических узлов (так называемые скрофулы); последние безболезненны, могут изъязвляться либо дренироваться наружу; системные проявления слабые или чаще отсутствуют.
• Кожные поражения. Типичным считают инфицирование ран конечностей, полученных при ударе о стенку бассейна или любой объект на дне и берегах водоёма. Чаще наблюдают образование изъязвляющейся гранулёмы, спонтанно ограничивающейся в течение нескольких недель, в более редких случаях формируется хроническая инфекция.
Методы исследования • Выделение и идентификация возбудителя по скорости роста, образованию пигментов (на свету или в темноте) и патогенности для лабораторных животных • АТ к Mycobacterium kansasii перекрёстно реагируют с Аг Mycobacterium tuberculosis и у инфицированных лиц отмечают положительную реакцию Манту.
Дифференциальная диагностика • Лепра • Туберкулёз • Боррелиоз • Чума.
Лечение • При лёгочных поражениях •• Рекомендовано сочетание изониазида 600 мг, рифампицина 300 мг, стрептомицина 1 г и этамбутола 15–25 мг/кг 1 р/сут •• При поражении M. marinum — миноциклин по 100 мг каждые 12 ч в течение 6–8 нед •• При поражении M. kansasii и M. xenopi эффективна стандартная противотуберкулёзная терапия с обязательным назначением рифампицина •• Оперативное вмешательство рекомендовано при локализованных поражениях у пациентов молодого возраста без патологии других органов и систем • При лимфадените — у детей от 1 до 5 лет показано хирургическое лечение • При кожных поражениях, вызванных M. marinum, — тетрациклин (1–2 г/сут) и сочетание рифампицина и этамбутола в течение 3–6 мес • При инфекциях, вызванных ранами или инородными телами •• Хирургическая обработка раны и удаление инородного тела •• Лекарственная терапия: доксициклин (200–400 мг/сут), цефокситин (200 мг/кг/сут), амикацин (10–15 мг/сут) в течение 3–6 мес • При диссеминированных поражениях — сочетание противотуберкулёзных средств (как при лёгочных поражениях) лишь уменьшает бактериемию и временно ослабляет симптомы.
Течение и прогноз. Течение — прогрессирующее. Более чем у 20% пациентов отмечают рецидивы заболевания в течение 5 лет.
Микобактерии могут являться возбудителями инфекционных заболеваний желудочно-кишечного тракта, в частности, туберкулёза различных отделов кишечника, инфекционных гастрита и дуоденита.
Микобактерии выявлены у больных язвенным колитом (Карпеева Ю.С. и др.).
 |
| Микобактерии Mycobacterium tuberculosis (палочка Коха) — возбудитель туберкулёза человека |
Туберкулёз кишечника
-
и прямой кишки † (K93.0*)
- кишечника (толстого) (тонкого) † (K93.0*)
- ретроперитонеальный (лимфатических узлов)
Примечание. В МКБ-10 крестиком † помечены главные коды основной болезни, которые должны использоваться обязательно. Звёздочкой * помечены факультативные дополнительные коды, относящиеся к проявлению болезни в отдельном органе или области тела, представляющей собой самостоятельную клиническую проблему.
Туберкулёз кишечника — хроническая инфекционная болезнь, вызываемая микобактериями Mycobacterium tuberculosis. Обычно является вторичным процессом, возникающим на фоне туберкулёза лёгких. Проявляется образованием специфических гранулём в различных отделах кишечника, чаще в илеоцекальной области.
Туберкулёзный илеотифлит (бугорчатка слепой кишки) — туберкулёзное поражение илеоцекального отдела.
Желудок обладает высокой резистентностью к туберкулёзной инфекции. Поэтому даже систематическое заглатывание большого числа вирулентных бактерий при туберкулёзе лёгких далеко не всегда приводит к вторичному поражению желудка и кишечника.
Патологический процесс локализуется в основном в дистальном отделе тонкой кишки и местах сосредоточения пейеровых бляшек или в слепой кишке. Но могут поражаться и другие отделы тонкой кишки, включая двенадцатиперстную. Реже язвенно-деструктивные поражения образуются в восходящей и поперечной частях ободочной кишки. Очень редко встречается туберкулёз прямой кишки и аноректальной зоны.
Прогноз при туберкулёзе кишечника серьёзный и в значительной степени зависит от своевременности диагностики и лечения (Парфёнов А.И.)
Туберкулёз желудка
- резким увеличением миграции населения;
- недостаточным уровнем противотуберкулезных мероприятий;
- учащением случаев туберкулеза, вызванного лекарственно-устойчивыми микобактериями.
Поражение желудка чаще наблюдается при вторичном туберкулезе, что обусловлено заглатыванием больным мокроты, содержащей микобактерии. Кроме того, поражение слизистой оболочки желудка может быть следствием распространения инфекции по лимфатическим сосудам из пораженных мезентериальных лимфоузлов.
- язвенную
- гипертрофическую (опухолевидную)
- фиброзно-склеротическую
- язвенно-гипертрофическую (смешанную)
Распознавание гастроинтестинального туберкулеза является достаточно сложной задачей. Диагноз верифицируется преимущественно на основании результатов бактериологического или гистологического исследования. Помимо сбора анамнеза, направленного на выявление связи заболевания с туберкулезной инфекцией, необходимо использовать все существующие на сегодня методы диагностики: осмотр, перкуссию, пальпацию больного, выявление микобактерии туберкулеза в содержимом желудка и кишечника, туберкулинодиагностику, полимеразную цепную реакцию для идентификации специфического возбудителя, выявление в крови антигенов микобактерий и антител иммунологическими методами (иммуноферментный анализ), рентгенологические, инструментальные методы, гистологическое и бактериологическое исследования биопсийного материала, сонографию (Фролова-Романюк Э.Ю.).
Гастриты и дуодениты обусловленные микобактериями в перспективных классификациях
В МКБ-10 нет упомянутых в явном виде заболеваний желудка и двенадцатиперстной кишки, вызываемых микобактериями. В проекте МКБ-11ß (от 20.01.2015) микобактериальным гастритам и дуоденитам посвящено несколько строк (Sugano K. et al., перевод по Маев И.В. и др.):
- Mycobacterial gastritis (микобактериальный гастрит)
- Tuberculous gastritis (туберкулезный гастрит)
- Non-tuberculous mycobacterial gastritis (нетуберкулезный микобактериальный гастрит)
- Mycobacterium avium-intracellulare gastritis (гастрит, обусловленный инфицированием Mycobacterium avium)
- Gastritis due to other specified non-tuberculous mycobacteria (гастрит вследствие инфицирования другими нетуберкулезными микобактериями)
- Mycobacterial duodenitis (микобактериальный)
- Non-tuberculous mycobacterial duodenitis (нетуберкулёзный микобактериальный)
- Tuberculous duodenitis (туберкулёз ДПК)
Микобактерии в современной* систематике бактерий
Род микобактерии (лат. Mycobacterium) относится к семейству Mycobacteriaceae, порядку Corynebacteriales, классу Actinobacteria, типу Actinobacteria, Terrabacteria group, царству Бактерии.
Род микобактерий включает в свой состав большое число видов (ниже перечислены только виды, имеющие имена собственные, виды обозначаемые буквенно-цифровым кодом, опущены). Часть из них объединены в комплексы и группы:
Mycobacterium avium complex (МАС), включает виды: M. arosiense, M. avium, M. bouchedurhonense, M. chimaera, M. colombiense, M. indicus pranii, M. intracellulare, M. mantenii, M. marseillense, M. paraintracellulare, M. timonense, M. vulneris, M. yongonense.
- Подгруппа Mycobacterium abscessus subgroup включает в свой состав один вид M. abscessus, в который включены три подвида: Mycobacterium abscessus subsp. abscessus, Mycobacterium abscessus subsp. bolletii,Mycobacterium abscessus subsp. massiliense.
Mycobacterium terrae complex, включает виды: M. algericum, M. arupense, M. hiberniae, M. kumamotonense, M. nonchromogenicum, M. paraterrae, M. senuense, M. terrae, M. virginiense.
Mycobacterium tuberculosis complex (MTBC), включает виды: M. africanum, M. bovis, M. canettii, M. caprae, M. microti, M. mungi, M. orygis, M. pinnipedii, M. tuberculosis, M. tuberculosis complex bacterium.
Виды микобактерий, не включённые в комплексы и группы: M. acapulcensis, M. aemonae, M. agri, M. aichiense, M. album, M. alsense, M. alvei, M. angelicum, M. anthracenicum, M. anyangense, M. aquaticum, M. aquiterrae, M. arabiense, M. arcueilense, M. aromaticivorans, M. asiaticum, M. aubagnense, M. aurum, M. austroafricanum, M. bacteremicum, M. barrassiae, M. bohemicum, M. botniense, M. bourgelatii, M. branderi, M. brasiliensis, M. brumae, M. buckleii, M. canariasense, M. celatum, M. celeriflavum, M. chesapeaki, M. chitae, M. chlorophenolicum, M. chubuense, M. coloregonium, M. columbarii, M. conceptionense, M. confluentis, M. conspicuum, M. cookii, M. cosmeticum, M. crocinum, M. diernhoferi, M. dioxanotrophicus, M. doricum, M. duvalii, M. eburneum, M. elephantis, M. engbaekii, M. europaeum, M. fallax, M. farcinogenes, M. flavescens, M. florentinum, M. fluoranthenivorans, M. fragae, M. frederiksbergense, M. fuerthensis, M. gadium, M. gallinarum, M. gastri, M. genavense, M. gilvum, M. goodii, M. gordonae, M. hackensackense, M. haemophilum, M. hassiacum, M. heckeshornense, M. heidelbergense, M. helvum, M. heraklionense, M. hippocampi, M. hodleri, M. holsaticum, M. icosiumassiliensis, M. insubricum, M. interjectum, M. intermedium, M. iranicum, M. isoniacini, M. jacuzzii, M. kansasii, M. komanii, M. komossense, M. koreense, M. kubicae, M. kuopiense, M. kyorinense, M. lacticola, M. lactis, M. lacus, M. lentiflavum, M. leprae, M. lepraemurium, M. lepromatosis, M. liflandii, M. litorale, M. llatzerense, M. longobardum, M. lufu, M. lutetiense, M. madagascariense, M. mageritense, M. malmesburyense, M. malmoense, M. manitobense, M. marinum, M. minnesotense, M. monacense, M. montefiorense, M. montmartrense, M. moriokaense, M. mucogenicum, M. murale, M. nebraskense, M. neglectum, M. neoaurum, M. noviomagense, M. novocastrense, M. obuense, M. pallens, M. palustre, M. paraense, M. paraffinicum, M. parafortuitum, M. paragordonae, M. parakoreense, M. parascrofulaceum, M. paraseoulense, M. parmense, M. peregrinum, M. persicum, M. petroleophilum, M. phlei, M. phocaicum, M. piscinum, M. porcinum, M. poriferae, M. pseudoshottsii, M. psychrotolerans, M. pulveris, M. pyrenivorans, M. rhodesiae, M. riyadhense, M. rufum, M. rutilum, M. sacrum, M. salmoniphilum, M. sarraceniae, M. saskatchewanense, M. savoniae, M. scrofulaceum, M. sediminis, M. senegalense, M. seoulense, M. septicum, M. setense, M. sherrisii, M. shigaense, M. shimoidei, M. shinjukuense, M. shottsii, M. siernhoferi, M. simiae, M. simulans, M. sinense, M. smegmatis, M. sphagni, M. stomatepiae, M. suricattae, M. sydneyiensis, M. szulgai, M. talmoniae, M. thermoresistibile, M. tilburgii, M. tokaiense, M. triplex, M. triviale, M. tusciae, M. ulcerans, M. vaccae, M. vanbaalenii, M. visibile, M. wolinskyi, M. xenopi, M. yunnanensis.
МКБ-10
![Омикрон-штамм COVID-19]()
![Симптомы, вызываемые омикрон-штаммом]()
![Лабораторная идентификация омикрон-штамма]()
Общие сведения
![Омикрон-штамм COVID-19]()
Причины
Омикрон-штамм представляет собой новую линию мутации в S-белке SARS-CoV-2 – В.1.1.529 по классификации Pango, также в нее входят линии ВА.1, ВА.2, ВА.3. Подавляющее большинство выявляемых у пациентов генетических последовательностей вируса относятся к подвиду ВА.1. Однако со второй половины января 2022 года возрастает число мутаций ВА.2. Пока точно не установлено, почему возник штамм омикрон. Существует четыре основных гипотезы:
- Хроническое течениеCOVID-19. Ученые замечают, что пациенты с ВИЧ-инфекцией и другими формами иммунодефицита остаются носителями коронавируса 6 и более месяцев. На фоне этого возможны нетипичные мутации генетического материала возбудителя, которые в результате вызывают образование новых штаммов.
- Заражение от животных. Часть экспертов отмечают, что новый штамм коронавируса мог развиваться у грызунов или других животных, где претерпел нетипичные изменения генома. Затем возбудитель повторно попал к человеку и продолжил свою циркуляцию в популяции.
- Недостаточная изученность вируса. Высказывается мнение, что в странах с недостатком оборудования для выделения и секвенирования вируса могут возникать неконтролируемые штаммы и мутации, которые ускользают от внимания мировой науки.
- Низкий уровень иммунизации. Появление омикрона может быть связано с плохой организацией вакцинации в ряде стран мира. Специалисты в сфере инфектологии говорят, что в организме непривитых людей создаются благоприятные условия для длительной циркуляции и изменения вируса.
Первый случай варианта В.1.1.529 был обнаружен при секвенировании пробы биоматериала 9 ноября 2021 года в ЮАР. В этот период в Южной Африке развивалась третья волна коронавирусной инфекции, возник резкий всплеск заражений. Затем рост штамма В.1.1.529 был выявлен во всех провинциях страны, после чего омикрон начали обнаруживать в других государствах. Большинство экспертов здравоохранения связывают распространение вируса с авиапутешествиями.
Патогенез
В геноме омикрона более 50 видов точечных мутаций, которые изменяют хорошо изученные свойства предыдущих штаммов вируса и вызывают атипичное течение COVID-19. Ключевая особенность патогенеза – высокая контагиозность. Возбудитель распространяется в 2-4 раза быстрее варианта Delta, для инфицирования человека достаточно короткого контакта. Также в 3,2 раза чаще определяются семейные вспышки болезни, если в доме заразился хотя бы один человек.
При этом набирающий силу подвид ВА.2 отличается от классического Омикрон-штамма ВА.1 дополнительными мутациями в спайковом белке. Они помогают возбудителю COVID-19 ускользать от иммунного ответа организма пациента. Также предполагается, что ВА.2 имеет повышенную вирулентность. На сегодня продолжаются изучения обоих типов омикрона и сравнение их основных характеристик.
![Симптомы, вызываемые омикрон-штаммом]()
Симптомы омикрон-штамма COVID-19
Коронавирусная инфекция, спровоцированная новым типом патогена, отличается более мягким и легким течением. Инкубационный период при омикрон-штамме составляет в среднем 2-3 суток. Не исключено появление первых признаков недомогания на следующий день после контакта с больным COVID-19. У многих людей заражение протекает бессимптомно, особенно это касается полностью вакцинированных пациентов с достаточным уровнем иммунитета.
Типичное течение Омикрон-штамма COVID-19 приближено к классической ОРВИ. Сначала пациенты жалуются на умеренные головные боли, слабость, ломоту в теле. При этом температура повышается в пределах 38°С, держится в среднем 2-5 дней. Более 70% случаев инфекции сопровождаются насморком, заложенностью носа и чиханием, однако способность ощущать запахи и вкусы частично или полностью сохранена. До 60% пациентов испытывают першение и боли в горле.
Осложнения
После успешного выздоровления у перенесших омикрон-штамм COVID-19 сохраняется риск постковидного синдрома, который диагностируется в среднем спустя 3 месяца. В механизме его развития участвует эндотелиальная дисфункция, аутоиммунный и неврологический компоненты, из-за чего женщины более подвержены тяжелым остаточным явлениям после коронавируса.
Диагностика
В условиях пандемии все случаи острой респираторной инфекции считаются подозрительными на COVID-19, пока не было доказано обратное. Обследованием пациентов занимаются семейные врачи, педиатры и терапевты. В сложных случаях привлекают инфекционистов, специалистов отделения интенсивной терапии. Для подтверждения омикрон-штамма назначаются следующие виды исследований:
Дифференциальная диагностика
При постановке диагноза эксперты отличают омикрон от других респираторных инфекций, вызванных вирусом гриппа, респираторно-синцитиальным вирусом, риновирусами и метапневмовирусами. При атипичном COVID-19 дифференциация проводится с бактериальным респираторным заболеваниями, обострением туберкулеза, вирусными гастроэнтеритами. Помимо лабораторных анализов, большое значение имеет сбор эпидемиологического анамнеза и факторов риска.
![Лабораторная идентификация омикрон-штамма]()
Лечение инфекции, вызванной омикрон-штаммом SARS-CoV-2
Медикаментозная терапия
Программа лечения коронавирусной инфекции, в том числе вызванной омикрон-штаммом, регламентирована документами ВОЗ, на основании которых в каждой стране выпускаются методические рекомендации. Сейчас в России действует 14 версия клинического протокола (от 27 декабря 2021 года), в которой уточнены данные по особенностям омикрона и новейшим вариантам терапии. Ключевой задачей лечения называют предупреждение развития пневмонии, ОРДС, сепсиса.
Большинство пациентов с Омикрон-штаммом COVID-19 проходят лечение дома под контролем семейного врача. Основу терапии составляют немедикаментозные меры, такие как теплое питье, промывание носа, регулярное проветривание и увлажнение воздуха. Пациентам, которые проживают вместе с семьей, рекомендуется по возможности изолироваться в отдельной комнате. При среднетяжелом или тяжелом течении болезни назначаются следующие группы препаратов:
- Этиотропные средства. При терапии омикрон-штамма COVID-19 по показаниям применяются синтетические противовирусные медикаменты. Также используют препараты альфа-интерферона, антиковидную плазму, человеческий иммуноглобулин.
- Патогенетические препараты. В амбулаторных условиях возможен прием ингибиторов янус-киназ, антикоагулянтов, ингаляционных форм ГКС. Для пациентов на стационарном лечении дополнительно применяют ингибиторы интерлейкинов, системные ГКС, антагонисты рецептора ИЛ-6.
- Симптоматические лекарства. С учетом клинических проявлений омикрона назначаются жаропонижающие препараты из группы НПВС, назальные деконгестанты, мукоактивные и бронхолитические средства.
- Инфузионные растворы. Больным с тяжелым течением COVID-19 показано внутривенное вливание солевых и коллоидных растворов под контролем суточного диуреза и динамики артериального давления.
Респираторная поддержка
В случае снижения сатурации менее 92% начинается стандартная оксигенотерапия через назальные канюли или лицевую маску, чтобы достичь уровня SpO2 более 96%. При неэффективности таких мер или у пациентов с хронической бронхолегочной патологией применяется неинвазивная легочная вентиляция в режимах BIPAP, S/T, Pressure Support. Если на фоне лечения гипоксемия сохраняется, переходят на интубацию трахеи для проведения ИВЛ.
Прогноз и профилактика
Несмотря на большое число заражений и продолжающуюся пандемию, в отношении омикрон-штамма COVID-19 есть обнадеживающие мнения экспертов. На фоне дальнейшего ослабления вирулентности возбудитель SARS-CoV-2 может стать одним из привычных патогенов, вызывающих сезонные ОРВИ у населения. Однако не исключено появление новых мутаций коронавируса с нетипичными свойствами, которые приведут к ухудшению эпидемической обстановки.
В ситуации с пандемией COVID-19 и омикрон-штаммом ключевая роль уделяется своевременной, полноценной и тотальной вакцинации как можно большего процента населения, в том числе детей и подростков. Людям, у которых прошло более 6 месяцев с момента двухдозной иммунизации мРНК-вакцинами, рекомендовано сделать бустерную прививку для усиления защиты против омикрона.
Не теряют актуальность базовые противоэпидемические меры, ограничивающие распространение COVID-19. Правильное ношение медицинских масок или респираторов в общественных местах – строгая рекомендация инфекционистов и эпидемиологов. Регулярное мытье рук или обработка их антисептиком, соблюдение дистанции, ограничение посещений мест скоплений людей – меры индивидуальной профилактики, с помощью которых каждый человек снижает свои риски заболеть.
3. Omicron variant of SARS-CoV-2: Genomics, transmissibility, and responses to current COVID-19 vaccines / Araf Y, Akter F, Tang YD, Fatemi R, Parvez MSA, Zheng C, Hossain MG // Med Virol. 2022 Jan 12.
4. Assessment of the further spread and potential impact of the SARS-CoV-2 Omicron variant of concern in the EU/EEA, 19th update. – 2022.
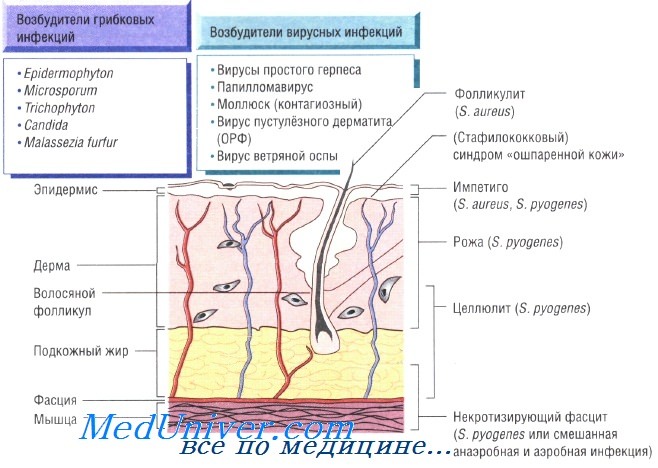
Инфекции кожи и мягких тканей: причины, диагностика, лечение, профилактика
Бактериальные инфекции кожи. Передача кожных инфекций осуществляется посредством контактного механизма. Заболевания быстро распространяются в местах скопления людей и в условиях антисанитарии. Возбудителями кожных инфекций могут быть многие микроорганизмы. Наиболее распространены Staphylococcus aureus и Streptococcus pyogenes.
Бактерии возбудители инфекций кожи и мягких тканей:
- S. aureus: импетиго, фурункулёз, невскрывающийся фурункул, токсический эпидермальный некролиз, острая паронихия
- S. pyogenes: целлюлит, рожа, импетиго
- С. diphtheriae: дифтерия (кожная форма)
- М. tuberculosis: волчанка обыкновенная
- М. marinum: хронические язвенные поражения кожи
- М. ulcerans: деструктивные язвы (язва Бурули)
- С. minutissimum: эритразма
- Pseudomonas aeruginosa: колонизация ожогов
- Erysipelothrix rhusiopathiae: эризипелоидПри целлюлите, вызванном S. pyogenes, S. aureus, Pasteurella multocida, реже вибрионами, обитающими в морской воде, и грамотрицательными бациллами, происходит поражение всех слоев кожи. Микроорганизмы проникают в организм человека через повреждённые участки кожи, раны и места укусов насекомых. Эмпирическое лечение флуклоксациллином необходимо начинать до получения результатов бактериологического исследования. В тяжёлых случаях применяют внутривенные антибактериальные препараты (бензилпенициллин и флуклоксациллин).
Некротизирующий фасцит — быстро прогрессирующая инфекция, поражающая также кожу и подкожную клетчатку. Заболевание развивается в результате микст-инфекции, вызванной аэробными и анаэробными микроорганизмами, а также вследствие моноинфекции S. pyogenes. Болезнь быстро прогрессирует и может привести к смерти пациента за очень короткое время. Большую роль в лечении играет успешное иссечение инфицированных некротических тканей, проводимое на фоне лечения бензилпенициллином, цефалоспоринами третьего поколения и метронидазолом.
Эритразма — поверхностная инфекция, возникающая на сгибательных поверхностях конечностей и вызываемая Corynebacterium minutissimum. Очаги поражения флюоресцируют в ультрафиолетовом свете. Возбудитель может быть выделен при посеве. Для лечения применяют эритромицин или тетрациклин.
Рожа — стрептококковая инфекция, поражающая органические участки кожи на лице или голенях. При обследовании отмечают обычно повышение количества лейкоцитов в периферической крови. Для лечения назначают приём внутрь амоксициллина и флуклоксациллина; в тяжёлых случаях может потребоваться внутривенное введение антибиотиков.
Эризипелоид — зоонозная инфекция, вызываемая Erysipelothrix rhusiopathiae. Местный очаг (обычно пальцы рук) характеризуется развитием эритемы красно-фиолетового цвета. В группу риска входят мясники (поражаются пальцы рук при работе с инфицированным мясом, чаше свиньи) и рыбаки. В большинстве случаев заболевание разрешается самостоятельно, но применение внутрь пенициллина или тетрациклина позволяет ускорить процесс выздоровления, назначение антибиотиков обязательно при развитии вторичной бактериемии.
Ожоги могут стать причиной инфекции, вызванной Pseudomonas aeruginosa, S. aureus, S. pyogenes и иногда бактериями кишечной группы. Возможно заражение антибиоти-коустойчивыми формами микроорганизмов. Бактериальное поражение может привести к отторжению пересаженной кожи и вторичной бактериемии.
Паронихия. Паронихия, или воспаление околоногтевой ткани, — распространённое заболевание, возникающее вследствие бактериальной инвазии (например, S. aureus) в местах повреждения кутикулы. При этом возникают боль, отёчность с последующим формированием небольшого абсцесса. Абсцесс дренируют и назначают антибактериальную терапию (флуклоксациллин и др.).
![причины инфекций кожи]()
Причины инфекций кожи
Кожные проявления системных инфекций
На коже могут отражаться проявления системных инфекций. Ярким примером может служить петехиальная сыпь при менингококковой септицемии — несомненный признак тяжёлого сепсиса. У пациентов с синегнойной септицемией на коже возникают гангренозные очаги (гангренозная эктима). Менее выражены кожные изменения при эндокардите (кровоизлияния у оснований ногтей). При стафилококковой септицемии возникают участки инфаркта кожи, а при некоторых вирусных заболеваниях высыпания на коже становятся частью характерной клинической картины (ветрянка и корь).
Для вируса простого герпеса кожные покровы — первичный очаг инфекции. Некоторые штаммы Staphylococcus aureus и бета-гемолитических стрептококков вызывают системные заболевания, обусловленные действием токсинов и сопровождающиеся различными кожными изменениями: при синдроме токсического шока — генерализованная и сыпь на ладонях, при скарлатине — сыпь с бледностью носогубного треугольника, а при синдроме ошпаренной кожи у новорождённых — сильное шелушение.
Бородавки как инфекция кожи
Папилломавирус человека поражает клетки кожи и усиливает их репликацию, в результате чего формируется бородавка (папиллома). Существуют папулёзные, пятнистые и мозаичные виды папиллом, а также подошвенная (роговая) бородавка. Заболевание передаётся при непосредственном контакте с больным, а также через предметы общего пользования особенно при повышенной влажности (при совместном купании в бассейне).
Передача генитальных бородавок (остроконечных кондилом) осуществляется половым путём. Диагноз устанавливают на основании клинических признаков. Для определения вируса остроконечных кондилом применяют реакцию иммунофлюоресценции и полимеразную цепную реакцию.
Папилломавирусы вызывают злокачественные новообразования шейки матки (тип 16 и 18) и гортани (тип 6 и 11). В настоящее время существуют вакцины против виусов типа 16 и 18, которые формируют продолжительный иммунитет.
Папилломы со временем самостоятельно исчезают, не оставляя рубцов (за исключением случаев у людей со сниженным иммунитетом). Очень часто для самолечения применяют местные кератолитические вещества (салициловая кислота). При генитальных бородавках используют подофил щитовидный*. В качестве альтернативы применяют криотерапию, ускоряющую исчезновение папиллом. Прижигание в настоящее время не рекомендуют для частого использования у одного пациента.
Некоторые штаммы поксвирусов поражают кожный покров и вызывают возникновение характерных симптомов (например, контагиозный моллюск и контагиозный пустулёзный дерматит).
Дерматофитозы - грибковые инфекции кожи
Клинические признаки дерматофитозов. При дерматофитии (стригущем лишае) возникают бляшки, сопровождаемые зудом и покраснением. Со временем их диаметр увеличивается, а в центре образуется бледное пятно. При хроническом поражении ногтей наблюдают обесцвечивание и истончение ногтей, а при заболеваниях кожи головы — облысение и рубцевание. В основе названия заболевания лежит место заражения, например дерматофития головы (tinea capitis — стригущий лишай), дерматофития туловища (tinea corporis).
Лабораторная диагностика грибковых инфекций кожи. При инфекции кожного покрова отмечают свечение поражённых участков в ультрафиолетовом свете.
В лабораторию доставляют сухие соскобы с поражённых участков кожи, образцы ногтей и волос. При нагревании в растворе натрия гидроксида они обесцвечиваются, и во время микроскопии становятся видны гифы грибов. Дерматофиты растут на декстрозосодержащем агаре Сабурада при температуре 30 °С в течение четырёх недель.
В основе идентификации лежат морфологические свойства колоний, особенности микроскопической картины (окраска лактофеноловым синим), биохимическое исследование, а также секвенирование 18S рибосомальной РНК гена.
Лечение грибковых инфекций кожи. При дерматофитозах применяют местные препараты группы имидазола (миконазол, клотримазол, тиоконазол или аморолфин). При некоторых формах инфекции назначают тербинафин (внутрь) в течение нескольких недель.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Инфекции вызванные микобактериями (Mycobacterium tuberculosis, leprae, avium и т.д.): диагностика, лечение, профилактика
Насыщенная липидами клеточная стенка микобактерии обусловливает их кислотоустойчивость. Существует более пятидесяти видов микобактерии, большинство из которых присутствует в окружающей среде и не представляет опасности для человека.
Эпидемиология и патогенез туберкулеза (Mycobacterium tuberculosis)
Основной путь передачи туберкулёза — воздушно-капельный. Лёгкие являются первым органом, поражаемом при туберкулёзе. В месте проникновения возбудителя формируется воспалительный очаг (первичный комплекс), из которого инфекция может распространиться по всему организму (милиарное распространение). Заболевание может неожиданно разрешиться либо перейти в локализованный процесс (например, менингит).
Устойчивость к туберкулёзу обеспечивает Т-клеточное звено иммунитета. При его нарушении болезнь может рецидивировать (предполагаемый риск составляет 10%). Яркую клиническую картину заболевания чаще обнаруживают у пациентов со сниженным иммунитетом (например, у больных с ВИЧ-инфекцией).
Mycobacterium tuberculosis фагоцитируются макрофагами, но не инактивируются фаголизосомами, а размножаются в цитоплазме клеток. Выраженный иммунный ответ приводит к локальному разрушению тканей (образование полостей в лёгких — каверн) и возникновению симптомов, обусловленных цитокин-индуцированной системной воспалительной реакцией (лихорадка, потеря массы тела).
В качестве факторов вирулентности выступает большое количество антигенов, в том числе липоарабиноманнан (стимулятор цитокинов) и супероксиддисмутаза (обеспечивает выживаемость внутри макрофагов).
Клинические признаки туберкулеза
Возбудитель может поражать любой орган: он имитирует как воспалительные заболевания, так и злокачественные новообразования. Симптомы туберкулёза лёгких — хронический кашель, кровохаркание, лихорадка, потеря массы тела, рецидивирующая бактериальная пневмония. При отсутствии лечения болезнь переходит в хроническую форму, характеризующуюся постепенным ухудшением состояния.
При туберкулёзном менингите отмечают повышение температуры, помутнение сознания, при поражении почек — лихорадку, потерю массы тела, а также признаки локальной инфекции, осложнённой фиброзом мочеточников и гидронефрозом. Прогрессирование туберкулёза костей, обычно поражающего пояснично-крестцовый отдел позвоночника, характеризуется признаками вертебрального коллапса и сдавления нервов.
Кроме того, гной из очага инфекции может проникать под оболочку поясничной мышцы, в результате чего возникает паховый абсцесс. Поражение крупных суставов приводит к артриту и разрушению суставной ткани. При абдоминальной инфекции наблюдают брыжеечную лимфаденопатию, хронический перитонит, а также лихорадку, потерю массы тела, асцит, признаки нарушения всасывания в кишечнике. Диссеминированная (милиарная) инфекция может протекать без симптомов поражения лёгких.
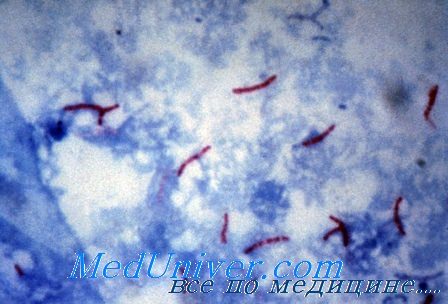
![микобактерии туберкулеза]()
Микобактерии туберкулеза
Лабораторная диагностика туберкулеза (Mycobacterium tuberculosis)
• Культивирование на средах, обогащенных липидами (яичные среды), или с добавлением малахитового зелёного (среда Левенштейна—Йенсена) для подавления роста других бактерий. Препарат окрашивают по методу Циля—Нильсена.
• Определение чувствительности штаммов на скошенной питательной среде Левенштейна—Йенсена.
• Молекулярно-генетические методы (помогает уточнить наличие гена ргоВ, идентифицировать туберкулёзный антигенный комплекс и определить устойчивость к рифампицину).
• Типирование Mycobacterium tuberculosis с помощью анализа полиморфизма длины рестрикционных фрагментов.
• Измерение уровня цитокинов периферической крови, продуцируемых моноцитами (для диагностики остроты процесса).Лечение и профилактика туберкулеза
Для лечения туберкулёза лёгких применяют этамбутол в комплексе с пиразинамидом (в первые 2 мес) и рифампицин и изониазид (на протяжении 6 мес). При поражении других органов используют такую же схему лечения, основанную на способности лекарственного препарата проникать в различные ткани (например, в спинномозговую жидкость). В последнее время всё чаще выделяют мультирезистентные штаммы возбудителя туберкулёза.
Вероятность их обнаружения зависит от числа случаев неполного излечения, уровня жизни и др. В этом случае для лечения используют препараты второй линии: аминогликозиды, фторхинолоны, этионамид или циклосерин (после обязательного определения чувствительности возбудителя к антибиотикам).
Вакцинация аттенуированными (ослабленными) штаммами (вакцина для профилактики туберкулёза, синоним — вакцина Кальметт—Герена, БЦЖ) позволяет избежать милиарного распространения инфекции, но клинические исследования в некоторых странах не подтвердили её эффективности. Пациентам с высоким риском развития туберкулёза назначают профилактическое лечение рифампицином и изониазидом, а лицам с ВИЧ-инфекцией рекомендован приём рифабутина или кларитромицина в течение длительного времени.
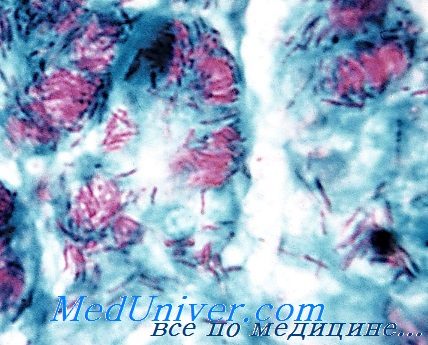
![микобактерии лепры]()
Микобактерии лепры
Инфекция вызванная Mycobacterium leprae - Лепра
Возбудителя лепры (проказы) до настоящего времени не удалось культивировать на искусственных питательных средах.
Mycobacterium leprae вызывает поражение периферических нервов, сопровождаемое нарушением болевой чувствительности. Разрушение и деформация суставов и фаланг пальцев делают пациентов физически недееспособными. Итог заболевания индивидуален и зависит от иммунного ответа. В настоящее время выделяют три типа иммунного ответа при лепре:
• туберкулоидный (превалирует Thl-ответ);
• лепроматозный (преобладает Тh2-ответ);
• пограничный.При туберкулоидном типе инфекции у пациентов развивается стойкий клеточный иммунитет, возникает большое количество гранулём, трофические поражения нервов. В тканях обнаруживают небольшое количество бактерий. Для лепроматозного типа характерен слабый клеточный иммунитет, отсутствие гранулём и генерализованная инфекция (леонтиаз, депигментация и нарушение чувствительности).
Диагноз основан на результатах микроскопического исследования препаратов поражённой кожи (окраска по Цилю-Нильсену) и биоптатов кожных покровов гистологического исследования. Для лечения применяют рифампицин, дапсон и клофазимин, эффективные на ранних стадиях заболевания, но неспособные препятствовать повреждению нервов и деформации конечностей, при возникновении которых необходимо хирургическое вмешательство.
Микобактерии не вызывающие туберкулез
Различные виды микобактерий могут вызывать локализованные или диссеминированные заболевания у лиц со сниженным иммунитетом. Некоторые из них могут инфицировать имплантируемые ткани.
Mycobacterium avium. В состав комплекса входят Mycobacterium avium, M. intracellular и М. scrofulaceum. Некоторые из них поражают птиц, других животных, являясь санрофитами окружающей среды. Их считают наиболее распространённой причиной микобактериального лимфаденита у детей, остеомиелита у пациентов со сниженным иммунитетом и пневмонии у лиц пожилого возраста. При прогрессирующей ВИЧ-инфекции эти микроорганизмы способны вызывать диссеминированные инфекции и бактериемию.
Возбудители из авиум-внутриклеточного комплекса устойчивы к действию большинства противотуберкулёзных препаратов, поэтому для лечения инфекций, вызванных ими, применяют методы комплексной терапии с использованием рифабутина, кларитромицина и этамбутола. При развитии лимфаденита иногда требуется хирургическое вмешательство.
Mycobacterium kansasi, M. Malmoense, M. Xenopi. Вызывают вялотекущую инфекцию лёгких, похожую на туберкулёз, у пациентов с хроническими заболеваниями лёгких (бронхоэктазией, силикозом, хронической обструктивной болезнью лёгких). Начальную терапию осуществляют с помощью стандартных препаратов после определения чувствительности микроорганизмов к антибиотикам.
Mycobacterium marinum, М. ulcerans. Mycobacterium marinum вызывают хронические гранулематозные инфекции кожи. Возбудитель обитает в реках, запущенных бассейнах и неухоженных садках для рыбы. Заболеванию свойственно возникновение множественных гнойничковых очагов, покрытых твёрдой коркой. Инфекции, вызванные М. ulcerans, распространены в сельскохозяйственных зонах Африки и Австралии. Бактерии обычно поражают нижние конечности, при этом обнаруживают папулёзные очаги, сопровождаемые изъязвлением и глубоким повреждением тканей (включая костную).
Видео диагностика и лечение микобактериоза. Д.м.н., профессор В.Н. Зимина
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также: