Что такое инфекция цитоплазма
Обновлено: 19.04.2024
Моноцитоз – это патологическое состояние, при котором наблюдается увеличение содержания моноцитов больше 1000 в 1 мкл крови. Причинами служат инфекционные, воспалительные, а также онкогематологические заболевания. У детей наиболее частой причиной выступает инфекционный мононуклеоз. Специфических симптомов нет. Клиническая картина определяется основной патологией. Уровень моноцитов исследуется в капиллярной или венозной крови при подсчете лейкоцитарной формулы. Для возврата моноцитов к референсным показателям (от 1 до 10%) проводится лечение болезни, послужившей фоном для возникновения моноцитоза.
Классификация
Четких цифровых разделений моноцитоза нет. Условно различают умеренный и выраженный моноцитоз. По патогенетическому механизму выделяют:
- Реактивный моноцитоз. Причиной данной разновидности являются воспалительные и инфекционные патологии.
- Неопластический (злокачественный) моноцитоз. Встречается у больных миелопролиферативными и лимфопролиферативными заболеваниями (у детей при лимфогранулематозе и остром монобластном лейкозе).
У детей с момента рождения наблюдается небольшое повышение моноцитов, оно достигает максимума к концу 1 недели жизни (до 15%), далее медленно снижается и к 12 месяцу становится как у взрослых.
Причины моноцитоза
Реконвалесценция
Несмотря на большое многообразие патологических причин, чаще всего моноцитоз свидетельствует о выздоровлении после острого инфекционного заболевания. Как правило, в основном это наблюдается у детей. Повышение уровня моноцитов после инфекции означает, что произошла полная элиминация инфекционного агента. Моноцитоз обычно незначительный, может сохраняться до 2-х недель, затем уровень моноцитов возвращается к нормальным показателям.
Вирусные инфекции
Моноциты являются первой линией противоинфекционной защиты. Мигрируя в ткани, они превращаются в мононуклеарные фагоциты (макрофаги). При проникновении микроорганизма (бактерии, вируса) макрофаги его поглощают (фагоцитируют), а также презентируют на своей поверхности чужеродные антигены патогена для распознавания их Т- и B-лимфоцитами. Кроме того, макрофаги выделяют широкий спектр различных медиаторов и цитокинов, вызывая хемотаксис нейтрофилов к очагу инфекционного воспаления. Нередко вирусные инфекции, кроме моноцитоза, становятся еще и причиной увеличения лимфоцитов (лимфомоноцитоз).
- Острые вирусные инфекции. Из всех заболеваний, самой распространенной причиной моноцитоза среди взрослых являются грипп, ОРВИ (парагрипп, аденовирусная, риновирусная инфекции). Обычно моноцитоз незначительный, он возникает резко наряду с симптоматикой, затем уменьшается до нормы примерно через 1-2 недели после стихания воспалительного процесса.
- Инфекционный мононуклеоз. Еще одной вирусной причиной моноцитоза, особенно часто встречающейся у детей, признан инфекционный мононуклеоз, вызванный вирусом Эпштейн-Барра. Ввиду длительного персистирования вируса в организме, моноцитоз может сохраняться несколько месяцев и даже лет. Также в острый период мононуклеоза в крови появляется большое количество лимфоцитов, приобретающих моноцитарные морфологические свойства (атипичных мононуклеаров) – увеличивается размер клетки и клеточного ядра, цитоплазма становится базофильной.
Бактериальные инфекции
Моноцитоз характерен для хронических бактериальных инфекций, сопровождающихся эпителиоидноклеточной пролиферацией с образованием гранулем. В первую очередь к ним относятся туберкулез, бруцеллез, сифилис. Также моноцитоз встречается при подостром бактериальном эндокардите, риккетсиозах. Патогенез повышения содержания моноцитов в крови при этих заболеваниях несколько отличается от такового от вирусных инфекций.
Таким образом поддерживается хроническое течение болезни. Повышение концентрации моноцитов умеренное, из-за хронического течения патологии может сохраняться месяцами, годами, опускается до нормальных цифр только после этиотропного лечения. Единственной острой бактериальной инфекцией, вызывающей моноцитоз у детей, признана скарлатина.

Системные гранулематозные процессы
Хронические неинфекционные системные воспалительные заболевания также сопровождаются моноцитозом, механизм развития которого заключается в следующем. По неизвестным причинам запускается клеточно-опосредованная иммунная реакция. Макрофаги (тканевые моноциты), наряду с лимфоцитами и тучными клетками начинают скапливаться в различных органах, постепенно образуя гигантоклеточные гранулемы. Секретируя интерлейкины, цитокины и другие медиаторы, макрофаги поддерживают хроническое воспаление.
У взрослых причиной становятся саркоидоз, гистиоцитоз из клеток Лангерганса, гранулематоз Вегенера. Из системных гранулематозных патологий у детей чаще встречаются воспалительные заболевания кишечника (неспецифический язвенный колит, болезнь Крона). Моноцитоз умеренной степени, но несколько выше, чем при бактериальных и вирусных инфекциях, снижается под влиянием патогенетического лечения.
Диффузные болезни соединительной ткани
Причины моноцитоза при коллагенозах точно неизвестны. Существует теория, что под влиянием аутоантител к различным компонентам соединительной ткани и цитокинов стимулируется костномозговое созревание моноцитов. Также изучена роль моноцитов в индукции и поддержании хронического воспаления. Причиной моноцитоза у взрослых выступают системная красная волчанка, системная склеродермия, у детей в основном наблюдается дермато- и полимиозит. Степень моноцитоза коррелирует с активностью заболевания, во время ремиссии находится в пределах референсных значений.
Злокачественные болезни крови
Довольно частой причиной моноцитоза являются онкогематологические заболевания. Механизм увеличения количества моноцитов заключается в опухолевой трансформации стволовых клеток костного мозга. Моноцитоз очень высокий, клетки могут составлять более 50% от общего числа лейкоцитов. Моноцитоз сохраняется длительное время, снижается только после лечения химиотерапевтическими препаратами или трансплантации костного мозга.
Для взрослых более характерен хронический миелолейкоз. У детей причинами моноцитоза чаще выступают лимфогранулематоз (лимфома Ходжкина), острый монобластный (моноцитарный) лейкоз. Помимо количественных изменений, при острых лейкозах встречается такой феномен как лейкемический провал, подразумевающий наличие только зрелых форм лейкоцитов и большого количества бластных клеток, отсутствие промежуточных форм.
Нейтропении
Еще одной причиной моноцитоза, часто наблюдаемой у детей, признаны заболевания, сопровождающиеся снижением (главным образом генетически детерминированным) выработки костным мозгом нейтрофильных гранулоцитов - нейтрофилов. К ним относят циклическую нейтропению, синдром Костмана (детский агранулоцитоз), хроническую нейтропению с нарушением выхода гранулоцитов из костного мозга (миелокахексию). Точный механизм моноцитоза при этих патологиях неизвестен. Обычно наблюдается умеренный моноцитоз в сочетании с эозинофилией.
Редкие причины
- Паразитарные инфекции: висцеральный, кожный лейшманиоз, малярия.
- Отравления: фосфором, тетрахлорэтаном.
- Прием ЛС: длительное введение глюкокортикостероидов.
- Восстановление костномозгового кроветворения: после миелосупрессии химиотерапевтическими препаратами.
Диагностика
Уровень моноцитов измеряется во время подсчета лейкоцитарной формулы в клиническом анализе крови. Обнаружение моноцитоза требует консультации медицинского специалиста, желательно терапевта. Врач должен провести опрос жалоб больного, собрать анамнестические данные, выполнить общий осмотр на предмет выявления признаков того или иного заболевания. Полученные данные служат подспорьем для назначения дополнительного обследования для выяснения причины моноцитоза:
- Анализы крови. В общем анализе крови проводится подсчет общего количества, процентного соотношения всех форм лейкоцитов (лейкоцитарная формула), определяется СОЭ. В мазке крови проверяется наличие атипичных мононуклеаров. Исследуется уровень аутоантител (к ДНК, мышечным клеткам, к топоизомеразе), антигранулоцитарных антител, СРБ. Проводится иммуногистохимический анализ и иммунофенотипирование клеток для выявления поверхностных специфических или опухолевых CD-маркеров.
- Микробиологические исследования. Для идентификации инфекционного возбудителя выполняется бактериологический посев и микроскопия мокроты. Методом иммуноферментного анализа и полимеразной цепной реакции определяются антитела к вирусам, бактериям, их ДНК. Проводятся серологические анализы (реакции непрямой гемагглютинации, микропреципитации).
- Рентгенография. При туберкулезе, саркоидозе на рентгенографии легких обнаруживается увеличение медиастинальных, прикорневых лимфатических узлов, при гистиоцитозе – двусторонние мелкоочаговые затемнения. Также для гистиоцитоза характерны участки остеолизиса и деструкции на рентгенограммах плоских костей черепа, длинных трубчатых костей.
- Сонография. Во время проведения УЗИ брюшной полости у пациентов с инфекционным мононуклеозом, бруцеллезом, онкогематологическими заболеваниями отмечается спленомегалия, реже гепатомегалия. На эхокардиографии у больных коллагенозами иногда удается выявить утолщение листков перикарда, выпот в перикардиальную сумку.
- Гистологические исследования. При злокачественных болезнях крови в мазке костного мозга, полученном путем стернальной пункции либо трепанобиопсии, обнаруживается большое количество бластных клеток. При микроскопическом исследовании бронхоальвеолярной жидкости у пациентов с гистиоцитозом отмечаются гигантские клетки Лангерганса, имеющие эозинофильную цитоплазму. В биоптате лимфоузла при лимфомах выявляются пролиферация лимфоидных клеток, клетки Березовского-Штернберга.

Коррекция
Консервативная терапия
Привести уровень моноцитов к нормальным значениям напрямую невозможно. Для этого необходимо бороться с причиной, т.е. лечить основную патологию, на фоне которой развился моноцитоз. Если моноцитоз обнаружен в крови у человека, недавно перенесшего острое инфекционное заболевание, то лечение не требуется. Это абсолютно нормальное явление, концентрация моноцитов самостоятельно нормализуется через несколько дней. В случае продолжительного и, тем более, высокого моноцитоза, необходимо медицинское вмешательство:
- Противоинфекционное лечение. Для лечения большинства вирусных инфекций достаточно лишь постельного режима, обильного горячего питья, использования нестероидных противовоспалительных препаратов (парацетамол, ибупрофен), а также симптоматической терапии (полоскание или орошение горла антисептическими, обезболивающими растворами, спреями, закапывание в нос сосудосуживающих капель). При бактериальных инфекциях назначаются антибиотики, при туберкулезе – комбинация противотуберкулезных средств.
- Противовоспалительное лечение. В качестве патогенетического лечения хронических гранулематозных заболеваний, коллагенозов используются лекарственные препараты, подавляющие воспаление – глюкокортикостероиды (преднизолон, метилпреднизолон). Для более мощного противовоспалительного действия эффективны иммуносупрессанты – метотрексат, циклофосфамид.
- Химиотерапия. Для лечения злокачественных болезней крови, гистиоцитоза необходимо проведение курсов химиотерапевтического лечения. Иногда приходится прибегать к интратекальному введению препаратов (введению в цереброспинальную жидкость).
Хирургическое лечение
Существует хирургический способ лечения онкогематологических заболеваний и некоторых видов врожденных нейтропений, позволяющий добиться полного исцеления от болезни, – это пересадка донорских гемопоэтических стволовых клеток. Для проведения этой операции необходимо выполнить HLA-типирования (генетический тест, определяющий антигены гистосовместимости) с целью подбора подходящего донора. Однако к данному методу лечения прибегают в крайнем случае при безуспешности консервативной терапии, так как он ассоциирован с высоким риском летального исхода.
Прогноз
Сам моноцитоз не является индикатором прогноза. Исход напрямую определяется причиной моноцитоза. Например, физиологический моноцитоз у детей никак не влияет на продолжительность жизни. Некоторые хронические гранулематозные заболевания, в частности, саркоидоз, иногда даже без всякого лечения заканчиваются самостоятельной ремиссией. Онкогематологические патологии и наследственные нейтропении у детей, напротив, характеризуются неблагоприятным прогнозом и большой вероятностью смерти.
3. Синдромная диагностика и базисная фармакология заболеваний внутренних органов. Том 2/ под рел. Федосеева Г.Б., Игнатова Ю.Д. – 2004.
4. Дифференциальный диагноз внутренних болезней: Алгоритмический подход/ Хили П.М., Джекобсон Э.Дж. - 2014.
Плазмоцитома – это злокачественная опухоль из плазматических клеток, которая поражает кости и внутренние органы. Заболевание может протекать в солитарной форме при наличии только одного патологического очага либо в генерализованном варианте, когда в процесс вовлекаются разные системы организма. Плазмоцитома отличается многообразием и неспецифичностью клинической симптоматики, которая зависит от вида и локализации опухоли. Диагностика заболевания включает рентгенографию и КТ, исследование биоптатов костного мозга, клинический и биохимический анализы крови. Для лечения используется лучевая терапия, полихимиотерапия, комплексная реабилитация.
МКБ-10


Общие сведения
В клинической онкогематологии плазмоцитома относится к парапротеинемическим лейкозам. Она встречается с частотой около 3 случаев на 100 тыс. населения, однако распространенность болезни резко увеличивается с возрастом ‒ до 37 случаев на 100 тыс. пожилых людей. Средний возраст пациентов при диагностике опухоли составляет 55-74 года. Среди всех больных мужчины составляют 61%. Более подвержены заболеванию лица негроидной расы. Среди опухолевых процессов кроветворной системы на долю всех типов плазмоцитомы приходится 10-14%.

Причины плазмоцитомы
Этиологическая структура плазмоклеточных опухолей точно не установлена. Важная роль в развитии заболевания отводится продолжительной антигенной стимуляции иммунных клеток на фоне хронических инфекций, аутоиммунных заболеваний, воздействия экзогенных токсинов и радиации. Доказана генетическая предрасположенность к возникновению парапротеинемических опухолей. Риск развития болезни повышается у людей с хромосомными аберрациями.
Основным немодифицируемым фактором риска плазмоцитомы признан возраст. Единичные (солитарные) опухоли более характерны для пациентов предпенсионного возраста 55-60 лет, около 30% случаев болезни развиваются среди людей младше 50 лет. Генерализованная форма болезни имеет возрастную медиану около 70 лет, только у 35% людей она выявляется до 65-летнего возраста. К модифицируемым предрасполагающим факторам относят профессиональные вредности, проживание в регионах с неблагоприятной экологической ситуацией.
Патогенез
Парапротеинемические гемобластозы, к которым относится плазмоцитома, представляют собой опухоли из единого клона В-лимфоцитов. Под действием провоцирующих факторов происходит злокачественная трансформация первичной клетки, из которой образуется линия с аналогичными мутациями и способностью к неограниченному делению. Новообразование секретирует определенный вид иммуноглобулинов, наличие которых является основой для постановки диагноза.

Классификация
Существует несколько вариантов систематизации новообразований. По степени зрелости мутантных клеток бывают высоко- и низкодифференцированные плазмоцитомы. По иммуногистохимическим особенностям выделяют А-миелому, D-миелому, G-миелому. Наиболее важна классификация по клинико-морфологическим признакам, согласно которой выделяют две разновидности плазмоцитомы:
- Солитарная. Составляет до 5% всех опухолевых образований, характеризуется наличием локальной пролиферации клональных плазматических клеток. Признана прогностически благоприятным вариантом заболевания.
- Генерализованная (множественная миелома). Характеризуется неконтролируемой пролиферацией В-лимфоцитов в разных органах и тканях тела, развивается на фоне хромосомных нарушений и патологии стромального окружения. Распространенная форма, которая составляет до 1% среди всех злокачественных новообразований.
Единичные парапротеинемические опухоли дополнительно делятся на две подгруппы: солитарная плазмоцитома кости (СПК) и экстрамедуллярная плазмоцитома (ЭМП). СПК встречается в 2-5 раз чаще, чем ЭМП. В основном поражаются кости позвоночника (42-61%), таза (15%), ребер (12%). Среди экстрамедуллярных новообразований до 85% расположено в зоне головы и шеи, также возможно вовлечение в процесс легких, органов ЖКТ, урогенитального тракта.
Симптомы плазмоцитомы
Клинические проявления солитарного новообразования определяются расположением опухолевого очага. При поражении костной ткани на первый план выходит локализованный болевой синдром, который беспокоит пациента постоянно, не имеет четкой связи с физической нагрузкой или сменой положения тела. При сдавлении близлежащих нервных структур развиваются нейропатии и радикулопатии, для которых характерны стреляющие боли, нарушения чувствительности.
Ведущими симптомами при ЭМП считаются признаки поражения ЛОР-органов, что связано с типичной локализацией опухоли. Пациенты жалуются на заложенность носа, которая не купируется сосудосуживающими каплями, периодические носовые кровотечения, образование сухих корок в назальной полости. Реже встречается осиплость голоса, затруднения глотания, снижение слуха и боль в ухе.
ЭМП в нижних дыхательных путях манифестирует эпизодами одышки на фоне бронхообструкции, длительным кашлем, тяжестью и болями в грудной клетке. При расположении экстрамедуллярной плазмоцитомы в брюшной полости возникают неспецифические боли в животе, хронические запоры, тошнота и рвота. Парапротеинемическая опухоль урогенитального тракта проявляется расстройствами мочеиспускания, появлением крови в моче, болями в области поясницы.
Множественная миелома в 10-20% случаев протекает бессимптомно, манифестные варианты заболевания характеризуются разнообразными сочетаниями вышеописанных признаков. Чаще всего появляются боли в позвоночнике, грудине и ребрах, которые сопровождаются патологическими переломами и остеопорозом. Пациентов беспокоят диспепсические и дизурические расстройства, мелкие кровоизлияния в кожу, желудочные, носовые и легочные кровотечения.
Осложнения
У 60% больных с множественной миеломой обнаруживается средняя или тяжелая степень анемии, которая сопровождается гемической гипоксией. В 50-90% случаев присоединяется почечная патология, которая является одной из основных причин сокращения продолжительности жизни пациентов. На фоне приобретенной иммунной недостаточности развиваются рецидивирующие и генерализованные инфекции органов дыхания, мочевыводящих путей.
При плазмоцитоме наблюдается гиперпродукция моноклональных иммуноглобулинов, которая вызывает амилоидоз внутренних органов. Экстрамедуллярная опухоль может стать причиной механической желтухи, перфорации кишечника, межпетлевой фистулы. При появлении опухолевых масс в области шеи происходит компрессия дыхательных путей, которая в ряде случаев вызывает асфиксию и требует неотложной медицинской помощи.
Диагностика
Обследование пациента проводится врачом-онкогематологом. Диагностические мероприятия начинаются со сбора жалоб, выяснения условий появления симптоматики, физикального осмотра с пальпацией болезненных участков тела. Выявление парапротеинозов требует всестороннего обследования здоровья, которое включает следующие лабораторно-инструментальные методы:

Дифференциальная диагностика
- саркому Юинга;
- моноклональные доброкачественные гаммапатии;
- макроглобулинемию Вальденстрема;
- гиперпаратиреоз;
- остеохондроз;
- хронический гломерулонефрит.
Лечение плазмоцитомы
Консервативная терапия
Злокачественные плазмоцитарные клетки имеют высокую чувствительность к радиации, поэтому при солитарных новообразованиях методом выбора является локальная лучевая терапия. Она способствует стабилизации или регрессу плазмоцитомы у 80% пациентов. Рентгенологическими маркерами эффективности лечения считаются склероз и реминерализация пораженной костной ткани. Курсовая лучевая терапия проводится всем пациентам с множественной миеломой.
Эффективным направлением лечения плазмоцитомы является полихимиотерапия, которая показывает наилучшие результаты у пациентов младше 65 лет без тяжелых сопутствующих заболеваний. Лечение направлено на максимально возможную редукцию клона опухолевых клеток. Для химиотерапии плазмоцитарной опухоли могут назначаться 5 классов лекарственных средств:
- алкилирующие агенты;
- глюкокортикостероиды;
- ингибиторы протеосомы;
- иммуномодулирующие препараты;
- антрациклины.
Хирургическое лечение
Оперативное вмешательство рассматривается как метод выбора при солитарной плазмоцитоме, которая находится в доступном для удаления месте. Иссечение основного объема опухолевых клеток улучшает функцию пораженного органа или кости, повышает эффективность радиотерапии. При патологических переломах требуется помощь травматолога-ортопеда для репозиции костных отломков, проведения оптимального метода остеосинтеза.
Паллиативная помощь
Несмотря на усовершенствование методов лечения, средняя выживаемость при генерализованной плазмоцитоме составляет около 3 лет. Пациентам в терминальной стадии заболевания показано паллиативное лечение, которое включает адекватные дозы наркотических анальгетиков и других обезболивающих препаратов, профилактику и лечение инфекционных осложнений, дистантную лучевую терапию. Больным необходим уход в рамках специализированных стационаров.
Реабилитация
Всем пациентам с плазмоцитомой требуется диспансерное наблюдение у онкогематолога на протяжении жизни. Для улучшения качества жизни подбирается программа комплексной реабилитации, которая включает симптоматическое лечение, контроль свертывающей способности крови, применение ортезов для улучшения функции опорно-двигательного аппарата. Большое внимание уделяется психосоциальной реабилитации.
Прогноз и профилактика
Результативность лечения и ожидаемая продолжительность жизни зависит от формы и степени тяжести парапротеиноза. Генерализованная плазмоцитома считается прогностически неблагоприятным заболеванием, особенно в сочетании с выраженной миелодепрессией, быстрым ростом опухолей, стремительным нарастанием уровня сывороточного парапротеина. Учитывая неясную этиологию, эффективные меры профилактики не разработаны.
1. Солитарная (экстрамедуллярная) плазмоцитома. Клинические рекомендации/ Н.А. Фалалеева, А.Ю. Терехова, В.В. Птушкин, Е.А. Османов// Клиническая онкология. – 2020. – №1.
2. Цитологические особенности плазмоцитомы и дифференциальные признаки опухоли Юинга, неходжкинских лимфом и железистого рака/ Л.С. Болгова, О.И. Алексеенко, Т.Н. Туганова, Т.М. Ярощук// Клиническая онкология. – 2019. – №1.
Гистоплазмоз - глубокий микоз, вызываемый диморфным дрожжевым грибком Histoplasma capsulatum, который поражает тканевые макрофаги легких, печени, селезенки, лимфатических узлов, кожи и слизистых оболочек. Среди различных форм заболевания преобладает острый гистоплазмоз легких, характеризующийся лихорадкой, болями в груди, кашлем, слабостью, лимфаденопатией, рентгенологическими изменениями. В диагностике гистоплазмоза используются культуральные, микроскопические, гистологические исследования; серологические реакции, аллергические пробы. Больным гистоплазмозом назначаются противомикотические препараты (амфотерицин В, меглюмин натрия сукцинат, кетоконазол и др.)
МКБ-10
Общие сведения
Гистоплазмоз (болезнь Дарлинга, ретикулоэндотелиальный цитоплазмоз) – грибковое заболевание, вызывающее поражение системы мононуклеарных фагоцитов и протекающее с ограниченными или генерализованными проявлениями. Гистоплазмоз является эндемической инфекцией для западных и южных штатов США, стран Центральной и Южной Америки, Африки; реже встречается в Европе и Азии. Известны единичные эпизоды заболеваемости гистоплазмозом в России, однако не исключены завозные случаи микоза. Мужчины болеют гистоплазмозом в 2 раза чаще женщин, дети вдвое чаще, чем взрослые.
По клиническому течению выделяют гистоплазмоз легких, внелегочной гистоплазмоз (кожи, слизистых оболочек, ЦНС и др. органов) и диссеминированный гистоплазмоз. Течение легочного гистоплазмоза может быть бессимптомным, острым (клинически выраженным) и хроническим. Важным фактором, определяющим тяжесть течения и прогноз гистоплазмоза, является состояние клеточного иммунитета. Тяжелые диссеминированные формы болезни Дарлинга обычно возникают у детей, пожилых людей, ВИЧ-инфицированных, пациентов с лейкемией и лимфомами.

Причины гистоплазмоза
Диморфный гриб Histoplasma capsulatum, являющийся возбудителем гистоплазмоза, может существовать в 2-х формах: тканевой (дрожжевой) и мицелиальной (культуральной). В организме человека встречается тканевая форма микроорганизма, поражающего клетки органов ретикулоэндотелиальной системы (печени, селезенки, лимфоузлов и др.). Культуральная форма гриба развивается вне организма, при температуре ниже 30°С и хорошо растет на питательных средах. Гистоплазмы длительно сохраняются в воде и во влажной почве; быстро гибнут под воздействием дезинфицирующих средств.
Природным резервуаром грибка служит почва, загрязненная пометом и фекалиями инфицированных животных и птиц (летучих мышей, собак, кошек, кур, голубей и др.). Благоприятной средой для развития грибов являются заброшенные строения и колодцы, пещеры, гроты, дупла старых деревьев, кондиционеры и пр. Заражение человека гистоплазмозом происходит воздушно-пылевым путем при вдыхании элементов грибка с частицами пыли, часто при проведении строительно-земляных работ. В группе риска по заболеваемости гистоплазмозом находятся сельские жители, фермеры, рабочие птицеферм, шахтеры, геологи, туристы, спелеологи и др. Передача гистоплазмоза от животных человеку или от человека человеку исключена.
В большинстве случаев входными воротами инфекции служат дыхательные пути. Попав в бронхи и альвеолы, споры гистоплазм превращаются в тканевую форму и обусловливают развитие первичного очага в легких и регионарных лимфатических узлах. В легочной ткани развивается гранулематозный процесс с исходом в некроз, изъязвление или кальциноз, реже – абсцедирование. Острый легочный гистоплазмоз по своему патогенезу похож на первичный туберкулез легких. Попадая в системный кровоток гистоплазмы вызывают сенсибилизацию организма и выработку специфических антител. Иногда патологический процесс этим ограничивается, что соответствует субклинической форме гистоплазмоза. В других случаях гематогенное распространение грибковой инфекции обусловливает развитие диссеминированного гистоплазмоза.
Симптомы гистоплазмоза
В связи с аэрогенным путем инфицирования в клинике гистоплазмоза преобладает легочная форма. Первичные внелегочные формы болезни Дарлинга встречаются редко; обычно поражение кожи, слизистых оболочек, кишечника служат проявлениями диссеминированного гистоплазмоза. Инкубационный период в среднем длится 7-14 суток, иногда меньше или дольше (от 4 до 30 дней).
У 80% инфицированных острый гистоплазмоз легких имеет бессимптомное течение, обнаруживаясь по положительным результатам внутрикожных проб с гистоплазмином, серологических реакций, рентгенологическим изменениям в легких. При легком течении гистоплазмоза самочувствие больных практически не страдает; изредка беспокоит кратковременная лихорадка, катар верхних дыхательных путей, кашель, которые купируются в течение недели. Для тяжелых форм легочного гистоплазмоза типично внезапное начало, высокая лихорадка (до 40-41°С) со значительными суточными изменениями температуры; смена ознобов диффузным потоотделением; сильная головная боль, оссалгии и миалгии. Характерны боли в грудной клетке, кашель с гнойной мокротой, кровохарканье; возможны тошнота, диарея, боли в животе. Лихорадочный период продолжается от 2 до 6 недель, после чего наступает затяжная стадия реконвалесценции, протекающая с субфебрилитетом, астенизацией, снижением трудоспособности.
Хроническая форма гистоплазмоза легких имеет длительное прогрессирующее течение. Характеризуется умеренной лихорадкой, кашлем с мокротой, рентгенологическими изменениями (кавернами, фиброзом, множественными кальцинатами в легочной ткани). Гистоплазмоз нередко сочетается с саркоидозом, туберкулезом, лейкозами, ретикулезами.
При развитии острого диссеминированного гистоплазмоза на фоне лихорадки и выраженной общей интоксикации возникают множественные вторичные очаги грибковой инфекции в различных органах. Поражение кожи и слизистых может проявляться различными высыпаниями (макулопапулезной, геморрагической, фурункулоподобной сыпью, эритемой), язвенным стоматитом и фарингитом, абсцессами подкожной клетчатки, язвами наружных половых органов, трещинами ануса. В числе прочих органных проявлений диссеминированного гистоплазмоза могут встречаться лимфаденопатия, менингоэнцефалит, ретинит, хориоидит, перикардит, инфекционный эндокардит, язвенный колит, гепатоспленомегалия, мезаденит, перитонит. Течение хронического диссеминированного гистоплазмоза более стертое и вялое, однако неизбежно приводящее к полиорганным поражениям.
Свои особенности течение гистоплазмоза имеет у детей раннего возраста и ВИЧ-инфицированных - в этих случаях заболевание развивается как диссеминированный процесс. У детей отмечается резко выраженный гепатолиенальный синдром, генерализованная лимфаденопатия, поражение легких, кожи и кишечника. ВИЧ-инфицированные лица болеют гистоплазмозом примерно в 0,5% случаев, т. е. реже, чем кандидозом или аспергиллезом. Клинико-рентгенологическая картина характеризуется лимфаденопатией, высокой лихорадкой, значительной гепатоспленомегалией, кашлем и инфильтратами в легких. Летальность от гистоплазмоза у данной категории пациентов достигает 80%.
Диагностика гистоплазмоза
Распознавание гистоплазмоза является непростой задачей для инфекционистов, пульмонологов и других специалистов, к которым могут обращаться пациенты. Диагноз подтверждается выделением Histoplasma capsulatum из мокроты, промывных вод бронхов; при диссеминированной форме – из крови, мочи, кала, содержимого абсцессов, стернального пунктата, цереброспинальной жидкости. В пользу гистоплазмоза свидетельствует получение культуры гриба при посеве этих материалов на питательные среды. Для диагностики гистоплазмоза также используются серологические реакции (РСК, реакция преципитации и латекс агглютинации), биопсия бронха, лимфатических узлов, краев язв с последующим гистологическим исследованием. Высокоспецифичным тестом служит внутрикожная проба с гистоплазмином.
При рентгенографии легких в острой стадии легочного гистоплазмоза обнаруживаются крупно- и среднеочаговые инфильтраты. В дальнейшем на месте инфильтратов образуются очаги фиброза и кальциноза. При подозрении на острый легочный гистоплазмоз исключаются ОРВИ, бактериальная пневмония, атипичная пневмония, орнитоз, лихорадка Ку, микоплазмоз, туберкулез. Хронический гистоплазмоз легких требует дифференциации с легочными формами глубоких микозов (нокардиозом, аспергиллезом, кокцидиоидомикозом, бластомикозом), лимфогранулематозом. Диссеминированные формы микоза следует разграничивать с сепсисом и милиарным туберкулезом.
Лечение, прогноз и профилактика гистоплазмоза
Лицам с бессимптомной или острой локализованной формой гистоплазмоза противогрибковое лечение обычно не проводится. В этих случаях ограничиваются симптоматической терапией и общеукрепляющими мероприятиями. При длительном течении или тяжелых формах гистоплазмоза показано назначение противомикозных препаратов – итраконазола, кетоконазола, амфотерицина В, меглюмина натрия сукцината. Наряду с системным применением антимикотиков, целесообразно проведение лекарственных ингаляций. Дополнительно рекомендуются витамины, антигистаминные препараты, полноценное питание. При развитии осложнений гистоплазмоза может потребоваться хирургическое лечение (пункция перикарда, удаление лимфатических узлов, резекция легких, протезирование клапанов сердца и др.).
Острый гистоплазмоз легких нередко протекает в бессимптомной форме и обычно заканчивается благоприятно для больного. Отдаленными последствиями хронического гистоплазмоза могут являться фиброз легких, артрит, узловатая эритема, увеит, энцефалопатия, судороги, сердечная недостаточность. Диссеминированные формы наибольшую угрозу представляют для детей, пожилых людей, пациентов с ВИЧ-инфекцией. Неспецифическая профилактика гистоплазмоза должна включать обеззараживание почвы, снижение запыленности воздуха, использование респираторов при проведении земляных работ.
Что такое токсоплазмоз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, паразитолога со стажем в 14 лет.
Над статьей доктора Александрова Павла Андреевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Токсоплазмоз — это острое и хроническое паразитарное заболевание человека в виде манифестных форм или носительства, вызываемое простейшими внутриклеточными паразитами — токсоплазмами, которые попадая в организм человека могут при условиях иммунодефицита поражать нервную ткань, среды глаза, сердечно-сосудистую и ретикулоэндотелиальную системы, вызывая поражение организма той или иной степени тяжести. Болезнь относится к группе TORCH-комплекса, т. е. вызывает врождённую патологию.
Этиология
Таксономия:
Вид — Toxoplasma gondii
Токсоплазмы обитают в мире в трёх формах:
- трофозоиты (тахизоиты);
- цисты (брадизоиты);
- ооцисты.
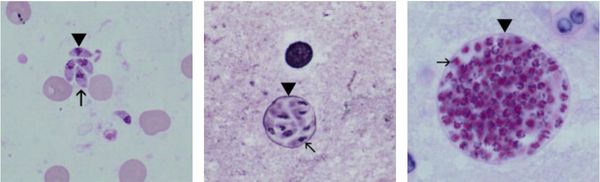
Трофозоиты достигают 4-7 мкм в длину и 2-4 мкм в ширину. Их тело по форме напоминает полумесяц с заострённым передним и закруглённым задним концами, состоит из пелликулы (покровной ткани) и различных органелл. Такие паразиты обитают во всех клетках млекопитающих кроме эритроцитов, размножаются путём деления. Могут создавать движение, активно проникая в клетки хозяина через клеточную мембрану или посредством фагоцитоза (захвата и переваривания клетки). Обнаруживаются в тканях в острой стадии инфекции. Их скопление внутри одной клетки называют псевдоцистой. Трофозоиты неустойчивы вне клетки и во внешней среде, быстро погибают при высушивании, прогревании и применении дезинфицирующих средств. Хорошо окрашиваются по Романовскому. Чувствительны к различным химиопрепаратам (сульфаниламидам, некоторым макролидам и другим).
Цисты размерами до 100 мкм отличаются плотной оболочкой, через которую не могут проникнуть антитела или лекарственные препараты. Внутри оболочки сосредоточено 3000-5000 паразитов, со временем они увеличиваются. Цисты формируются в организме хозяина (в основном в скелетных мышцах, миокарде и ЦНС) и живут там десятки лет. Чрезвычайно устойчивы к воздействиям внешних факторов. При адекватной иммунной системе могут пожизненно находиться в состоянии функционального покоя и не приносить никакого вреда организму человека.
Ооцисты играют основную роль в передаче инфекции. Они представляют собой овальные образования 10-12 мкм в диаметре. Их развитие и формирование длится 3-24 дня и проходит в слизистой оболочке тонкой кишки кошек. Затем в течение 7-20 дней паразиты выделяются с испражнениями, после этого срока новые фекалии кошки уже не заразны. За сутки с испражнениях животного выделяется до 10 миллионов ооцист. Спустя 2-3 дня при температуре 24 °C происходит споруляция ооцист — образование спор. При благоприятных условиях микроорганизмы сохраняются во внешней среде до года и дольше.
Существует множество штаммов токсоплазм, одни из которых отличаются высокой вирулентностью, а другие относительно маловирулентны. [1] [2] [7] [9]
Эпидемиология
Учитывая большое количество латентных форм, заболевание не поддаётся общему исчислению — им может быть заражено не менее 1,5 миллиардов человек. Только ежегодно регистрируется около 200 тысяч случаев внутриутробного инфицирования.
Распространение возбудителя повсеместное — токсоплазма обнаружена на всех материках. После заражения паразиты способны пожизненно сохранятся в организме большинства животных и птиц. Количество случаев приобретённого токсоплазмоза в разных странах колеблется: от 85 % во Франции и Мадагаскаре до 15 % в США и Англии.
- Фекально-оральный:
- водный и пищевой путь — при недостаточной термической обработке, чаще при употреблении сырого мяса и фарша;
- контактно-бытовой путь — при несоблюдении санитарных норм в повседневной жизни, например, при общении с кошками.
- Вертикальный путь (от матери к плоду) — преимущественно при первичном заражении матери во время беременности, часто у ВИЧ-инфицированных в стадии СПИДа.
- Артифициальный путь — при пересадке органов, в которых расположены цисты, пациенту с плохим иммунитету.
- Аэрогенный путь — при попадании инфицированной ооцистами пыли в рот человека.
- Контактный путь — при повреждении целостности кожных покровов. Встречается крайне редко, в основном у работников лабораторий и скотобоен, отмечен лишь в некоторых источниках, явного практического значения не имеет.
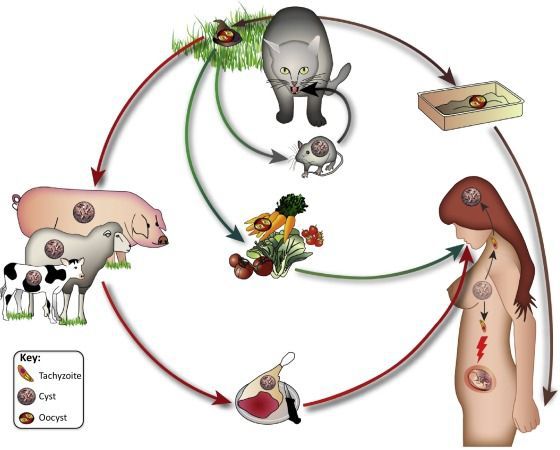
От человека к человеку заболевание не предаётся (кроме случаев каннибализма). Нельзя заразиться посредством укуса насекомых и при половом контакте.
Инфицирование токсоплазмой вызывает устойчивый пожизненный иммунитет к повторному заражению, однако известны случаи рецидива первичной инфекции при заражении другим высоковирулентным штаммом (у беременных, заразившихся при употреблении сырого мяса с другого континента). [1] [3] [5] [8] [9]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы токсоплазмоза
Инкубационный период при манифестных формах (явных проявлениях болезни) длится от двух недель до двух месяцев.
Специфичных симптомов, характерных именно для токсоплазмоза, не существует.
В большинстве случаев приобретённого токсоплазмоза заболевание протекает бессимптомно или со стёртой клиникой, напоминающей нетяжёлое ОРЗ: кратковременная лихорадка, слабость, недомогание, повышение температуры до 38,0 °C, увеличение периферических лимфоузлов, небольшое увеличение печени и селезёнки.
Доказано, что токсоплазма может оказывать влияние на психику человека. Это выражается в учащении рискованных действий, снижении концентрации внимания, повышенной нервозности, у лиц с тяжёлым острым или длительным хроническим активным течением повышен риск развития шизофрении.
Иногда заболевание проявляется изолированной глазной формой — длительно текущие увеиты, иридоциклиты и хориоретиниты. Как правило, эти нарушения являются поздними проявлениями нераспознанного ранее врождённого процесса.
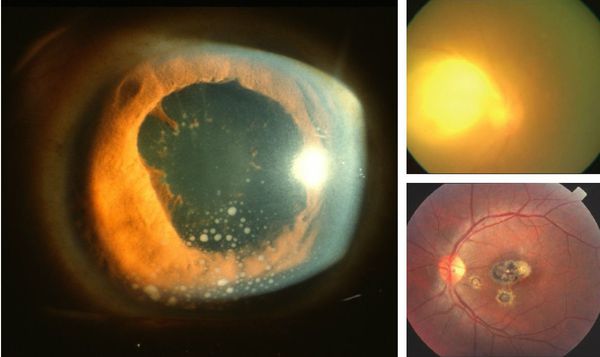
У людей с выраженным иммунодефицитом (ВИЧ, пересадка органов с последующей цитостатической терапией) возможно развитие генерализованного процесса с поражением нескольких органов (головного мозга, сердца, печени, почек, лёгких), нередко очень тяжёлого течения, проявляющегося в виде синдрома полиорганной недостаточности.
Токсоплазмоз у беременных может протекать в различных клинических вариантах и представляет опасность не столько для самой беременной (исключая тяжело протекающие патологии у беременных со СПИДом), сколько для плода.
При первичном заражении беременной токсоплазмозом имеет значение срок гестации:
- При инфицировании в первом триместре передача возбудителя плоду происходит лишь в 4 % случаев (к 13 неделе — в 6 %), но заканчивается, как правило, гибелью плода и выкидышем на ранних сроках. Если первичная инфекция у матери в первом триместре доказано, но выкидыш до 13 недели беременности не произошёл, то крайне высока вероятность, что внутриутробной передачи не было и ребёнок будет здоров.
- При инфицировании во втором триместре (особенно на 24-26 неделях) риск внутриутробной передачи резко возрастает и достигает 30-40 %, причём сопровождается развитием тяжёлых проявлений заболевания — одновременное увеличение селезёнки и печени, воспаление сосудистой оболочки и сетчатки глаза, поражения ЦНС в виде гидроцефалии, кальцификация, сыпь, миокардит, пневмония и другие.
- При заражении матери в третьем триместре передача инфекции ребёнку происходит с частотой до 90 %, однако проявления заболевания являются латентными или субклиническими и могут появиться спустя годы после рождения (отставание в развитии, нарушения зрения). [1][2][4][9]
Патогенез токсоплазмоза
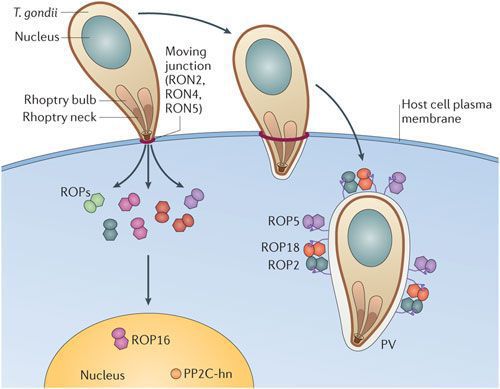
По мере развития и размножения токсоплазм поражённые клетки разрушаются, происходит заражение новых здоровых клеток, и при попадании возбудителя в кровоток паразиты разносятся по всему организму. Образуются некрозы с формированием фиброзной ткани и кальцификацией (отложение солей кальция в организме).
Под воздействием иммунитета безоболочечные трофозоиты превращаются в брадизоиты (оболочечные скопления токсоплазм), т.е. в тканевые цисты, которые сохраняются десятками лет в неактивном состоянии и при значительном снижении иммунитета способны к обратной трансформации с развитием обострения.
При первичной инфекции у беременных возбудитель проникает в ткани плода и вызывает воспалительный процесс, причём в разные периоды развития наблюдается различный характер воспаления: у эмбриона происходит лишь альтерация (дистрофия и некроз ткани без фиброза), в раннем фетальном периоде дополняется повышенным образованием соединительной ткани (фиброзом), а в позднем фетальном периоде присоединяется сосудистый компонент. Отсюда вытекают различные по характеру и тяжести поражения плода, которые зависят от сроков инфицирования матери. [1] [2]
Классификация и стадии развития токсоплазмоза
По течению процесса токсоплазмоз бывает:
- острым — до одного месяца;
- подострым - 1-3 месяц;
- хроническим — более трёх месяцев.
По клиническим признакам выделяют пять форм заболевания:
- Врождённый острый токсоплазмоз:
- манифестная форма (с указанием ведущих проявлений);
- субклиническая форма (с указанием способа верификации диагноза).
- Врождённый хронический токсоплазмоз:
- обострение / ремиссия;
- с резидуальными (остаточными) явлениями / без резидуальных явлений.
- Врождённый латентный токсоплазмоз.
- Приобретённый острый токсоплазмоз.
- Приобретённый хронический токсоплазмоз.
По степени тяжести заболевание бывает:
- лёгким;
- среднетяжёлым;
- тяжёлым (врождённая инфекция, токсоплазмоз при СПИДе).
По наличию осложнений выделяют:
- осложнённый токсоплазмоз;
- неосложнённый токсоплазмоз.
В Международной классификации болезней 10 пересмотра выделены шесть типов заболевания:
- B58.0 Токсоплазмозная окулопатия;
- B58.1 Токсоплазмозный гепатит (K77.0*);
- B58.2 Токсоплазмозный менингоэнцефалит (G05.2*);
- B58.3 Легочный токсоплазмоз (J17.3*);
- B58.8 Токсоплазмоз с поражением других органов;
- B58.9 Токсоплазмоз неуточнённый. [1][2][3]
Осложнения токсоплазмоза
При врождённой форме может возникнуть гидроцефалия, микроцефалия, задержка психомоторного развития и слепота. Эти осложнения сопровождаются увеличением или уменьшением размеров черепа, различными неврологическими расстройствами — косоглазием, судорогами, трудностью с сидением и держанием головы, рвотой и другими.
При глазной форме заболевания развивается слепота, снижение остроты зрения и воспалительные явления всех сред глаза. Причём возможно как рождение с грубыми дефектами зрения, так и появление воспалительных явлений и нарушения зрения спустя много лет после рождения.
Токсоплазмоз у иммунокомпрометированных людей осложняется шизофренией, токсоплазменный энцефалитом и полиорганной недостаточностью — тяжёлой патологией различных органов при выраженном иммунодефиците. При этом свойственна картина тяжёлого энцефалита. Прогноз, как правило, неблагоприятный. [1] [5] [8] [9]
Диагностика токсоплазмоза
Лабораторная диагностика:
- Клинический анализ крови: снижение уровня тромбоцитов, увеличение количества лимфоцитов и эозинофилов.
- Биохимический анализ крови: возможно повышение уровня трансаминаз и билирубина.
- Иммуноферментный анализ (ИФА):
- Выявление специфических антител класса M — острая инфекция или её реактивация. Имеет ряд недостатков — низкая специфичность, длительная циркуляция в организме, иногда до года после острого процесса. В сложных случаях уточнение следует производить при помощи метода "двойной сэндвич" или "иммунозахват" IgM ELISA.
- Выявление специфических антител класса G (клеток памяти) — носительство, инфицированность — появляются в среднем со второй недели заболевания и достигают пика на 1-2 месяце, сохраняются пожизненно, за исключением СПИД-ассоциированных заболеваний.
- Авидность IgG — уточнение давности заболевания. Недостатком является отсутствие стандартизации результатов, что зачастую приводит к различным ошибкам интерпретации. Наибольшее значение имеет высокая авидность, остальные результаты низкой и слабой авидности могут быть ошибочными и не должны трактоваться как недавно перенесённое заболевание при отсутствии других подтверждающих этот факт тестов.
- ПЦР-диагностика: выявление ДНК токсоплазмы в крови, других жидкостях и тканях человеческого организма. Особенно информативна в диагностике генерализованного, глазного и врождённого токсоплазмоза, в т. ч. в антенатальном периоде путём проведения амнио (не ранее 16 недель) и кордоцентеза (с 18 недели беременности).
- УЗИ-диагностика: внутриутробное выявление гидро- и микроцефалии, кальцификатов, гепатоспленомегалии и выраженной задержки развития. [1][2][4][5][6]
Дифференциальная диагностика
Токсоплазмоз — это инфекция с необычайно разнообразными проявлениями, поэтому ввиду неспецифичности проявлений основное место в дифференциальной диагностике отводиться лабораторному обследованию, а именно специфическим серологическим тестам.
Необходимо исключить следующие заболевания:
-
(ВЭБ-инфекцию) — боли в горле, преимущественное увеличение затылочных и заднешейных лимфоузлов, характерные изменения гемограммы (появление большого количества атипичных мононуклеаров и отсутствие столь выраженных изменений при врождённом течении), положительные IgM и ПЦР крови; — лимфоцитарный характер гемограммы, частое поражение слюнных желёз, положительные IgM, ПЦР крови;
- туберкулёз — длительное постепенное начало, лёгкий субфебрилитет (до 38,0 °C), ночная потливость, нездоровый румянец на щеках, кашель, специфические изменения в лёгких, положительные пробы на туберкулёз, выявление бациллы Коха в мокроте;
- лимфопролиферативные заболевания (лимфома Ходжкина, неходжкинские лимфомы) — специфические изменения при биопсии поражённой ткани (лимфоузлов);
- ВИЧ-инфекция — наличие факта возможного заражения, увеличение всех групп лимфоузлов, положительная серология;
- саркоидоз — специфические изменения в лёгких, положительные результаты гистологического исследования. [1][2][5]
Лечение токсоплазмоза
Большинство случаев приобретённого токсоплазмоза протекают в лёгкой или бессимптомной форме, они не регистрируются и, по-видимому, не нуждаются в каком-либо лечении.
Необходимость проведения специфической этиотропной терапии возникает лишь у некоторых групп пациентов:
- беременные с доказанным первичным инфицированием (в ряде случаев при реактивации хронической инфекции);
- дети с врождённой формой токсоплазмоза (при наличии явных клинических и лабораторных проявлений заболевания, субклинических и инаппарантных формах) — сроки и объём терапии зависят от конкретных данных;
- иммунокомпрометированные люди, у которых токсоплазмоз (острый или в фазе реактивации хронического процесса) протекает с выраженными клинико-лабораторными проявлениями. Основное направление воздействия в этом случае должно быть на устранение причины иммунодефицита, повышение уровня СД4 клеток.
Проведение лечения может осуществляться как в стационаре, так и амбулаторно в зависимости от выраженности процесса, реакции пациента на вводимые препараты, необходимости тех или иных вариантов патогенетического и симптоматического обеспечения. [1] [4] [7]
Прогноз. Профилактика
При приобретённом токсоплазмозе у иммунокомпетентных лиц прогноз благоприятный, у иммунокомпрометированных лиц (СПИД) прогноз серьёзен, нередки летальные исходы.
При врождённом токсоплазмозе исход заболевания зависит от сроков инфицирования плода:
- при инфицировании в первом триместре, как правило, происходит выкидыш;
- в более поздние сроки последствия варьируются от тяжёлых до резидуальных форм.
Основным методом профилактики приобретённого и врождённого токсоплазмоза является соблюдение санитарно-гигиенических правил, особенно беременными, не имеющими антител класса G к токсоплазмам:
- ограничение контакта с кошками;
- запрет на употребление сырого мяса, фарша и морепродуктов;
- тщательная промывка зелени, фруктов и овощей;
- мытьё рук перед едой;
- работа на приусадебном участке только в перчатках.
Для беременных особенно важен скрининг антител к токсоплазме, позволяющий выявить активно протекающее заболевание или риск его возникновения, а также вовремя провести медикаментозную профилактику острого токсоплазмоза беременной и снизить риск врождённой инфекции на 60 %. При отсутствии антител класса G в первом триместре необходимо отслеживать антитела IgM и IgG не только в тертьем, но и во втором триместре беременности.
В очаге токсоплазмоза противоэпидемические мероприятия не проводятся, вакцина на разработана. [2] [3]
Читайте также:

