Что такое интоксикация суставов
Обновлено: 23.04.2024
Общие сведения о заболевании
Посттравматический артрит – это воспаление сустава, развивающееся сразу или через некоторое время после травмы. Воспаление после травмы развивается всегда. В некоторых случаях оно протекает незаметно и проходит без последствий, но чаще дает о себе знать в виде болей и нарушения функции суставов через несколько месяцев или даже лет.
Встречается чаще у мужчин молодого возраста. Код по МКБ-10 М13.8 – другие уточненные артриты.
Причины посттравматического артрита
В развитии посттравматического артрита основное значение имеют травмы. Острые травмы: ушибы, растяжения связок, вывихи, переломы пострадавший всегда замечает и связывает с ними дальнейшее воспаление сустава. В большинстве случаев это является поводом для своевременного обращения к врачу.
Травма может иметь и хронический характер. Это случается при постоянном подъеме тяжестей, лишнем весе в сочетании с малоподвижным образом жизни. Иногда острая травма кажется пострадавшему незначительной, и он не связывает с ней появление через некоторое время признаков артрита. Это самые опасные травмы, так как с ними пациент почти никогда не обращается вовремя к врачу, упускает время и позволяет болезни принять хронический деструктивный характер.
Развитию травматического артрита подвержены спортсмены, люди тяжелого физического труда (шахтеры, грузчики), лица, страдающие ожирением и ведущие малоподвижный образ жизни. В группу риска входят также лица, страдающие хроническими воспалительными заболеваниями опорно-двигательного аппарата: ревматоидным артритом, подагрическим артритом и др.
Патогенез – механизм развития болезни
В последние годы было установлено, что даже незначительная травма запускает развитие воспалительного процесса. Происходит это на клеточном уровне. Клетки внутрисуставных тканей вырабатывают провоспалительные (поддерживающие воспаление) биологически активные вещества – простагландины, цитокины и др. Начавшийся воспалительный процесс при острой незначительной травме (небольшом ушибе) может через некоторое время закончиться полным выздоровлением.
Но при наличии таких факторов риска, как сниженный иммунитет, различные хронические заболевания, ожирение воспаление поддерживается длительное время и постепенно приводит к дегенеративно- дистрофическим изменениям в суставе и нарушению его функции.
При сильных травмах кроме описанного механизма включается процесс некроза (отмирания) клеток хрящевой ткани (хондроцитов) непосредственно от механического воздействия. У хондроцитов, окружающих зону некроза, включается механизм аутолиза – саморазрушения. Хрящевая ткань разрушается, процесс поддерживается длительно протекающим воспалением. На месте разрушенного хряща развивается соединительная ткань (паннус), ограничивающая подвижность сустава. Подхрящевая костная ткань начинает разрастаться, что приводит к деформации сустава. Со временем паннус заменяется костной тканью и формируется анкилоз – полная неподвижность сустава.
Подробнее об артрите, его симптомах и лечении в этой статье.
Формы
По характеру течения посттравматический артрит делится на:
- Острый – встречается нечасто, протекает с выраженными симптомами, заканчивается выздоровлением, иногда самопроизвольным, но всегда есть риск перехода острого течения в хроническое. При открытых (ножевых, огнестрельных) ранах воспаление может осложняться гнойной инфекцией и тогда протекает как острый гнойный артрит.
- Хронический – самый частый вариант течения. Патологический процесс начинается и протекает незаметно с медленным формированием нарушения функции сустава.
Симптомы посттравматического артрита
Проявления посттравматического артрита зависят от особенностей и тяжести травмы, характера течения и состояния организма больного.
Первые признаки
При сильной травме и выпоте в полость сустава крови (гемартроз) признаки воспаления в виде отека, покраснения кожи, сильных болей появляются сразу после травмы. При открытых травмах и присоединении гнойной инфекции резко повышается температура тела, появляется озноб, признаки интоксикации, резкий отек и покраснение кожи над суставом. Боли очень сильные, больной не может пошевелить конечностью.
Но очень часто первые признаки воспаления малозаметны. Они появляются через несколько дней и даже недель, нарастают постепенно и проявляются легкой болезненностью при нагрузке или движении, иногда незначительной припухлостью пострадавшего сустава.
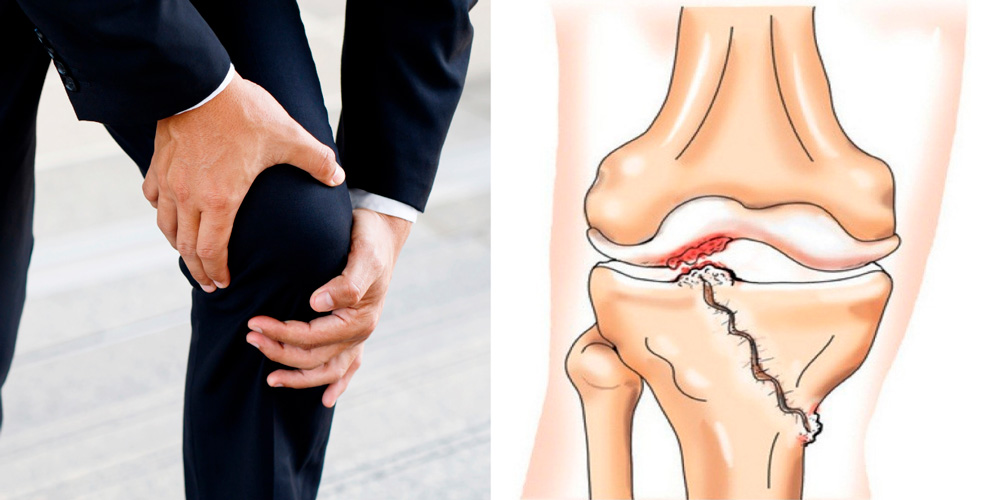
Сразу после травмы появляются первые симптомы посттравматического артрита
Явные симптомы
К явным симптомам острого посттравматического артрита относятся: покраснение, припухлость сустава. Характерна болезненность, усиливающаяся при движении. При гнойном остром артрите -нарастание общей интоксикации, болевого синдрома, покраснения и отека околосуставных тканей, ухудшение общего состояния больного.
При хроническом течении явными признаками будут небольшая, но нарастающая болезненность в суставе. Движение сопровождается похрустыванием (особенно отчетливо это ощущается в коленном и голеностопном суставах). Со временем болевой синдром становится постоянным и ограничивает движение конечности. Может пройти несколько лет, прежде, чем появятся признаки деформации сустава. Одновременно появляется сначала частичное, а затем полное ограничение подвижности, связанное с разрастанием соединительной и костной ткани.
Опасные симптомы
Сигналом к обращению за медицинской помощью должны стать любые нарушения со стороны суставов, появившиеся, как сразу после травмы, так и через некоторое время (иногда через несколько месяцев) после нее:
- припухлость, покраснение, боли в области сустава, появившиеся сразу после травмы, нарастающие признаки интоксикации с лихорадкой и недомоганием;
- боли при движении с нарастающей интенсивностью, возникшие через несколько недель после травмы;
- усиление болевого синдрома после травмы у лиц, страдающих хроническим артритом;
- внезапное повышение температуры тела в сочетании с покраснением, отеком и сильными болями в суставе после травмы у лиц, страдающих хроническими артритами.
Чем опасен посттравматический артрит
Травматический артрит опасен тем, что может протекать незаметно, переходя из одной стадии с другую с постепенным нарушением функции сустава и многочисленными осложнениями.
Стадии
Стадии заболевания зависят от характера его течения. Но чаще всего патологический процесс протекает хронически. Выделяют следующие стадии посттравматического артрита:
- Начальная – воспаление синовиальной оболочки – синовит с выпотом в суставной полости. При сильном травмировании разрушается хрящ, покрывающий суставные сочленения. Интенсивность отека, покраснения и болевого синдрома зависит от тяжести перенесенной травмы.
- Развернутая – при остром процессе все симптомы воспаления усиливаются. При хроническом - воспалительный процесс протекает медленно, но постепенно прогрессирует. На участках воспаления и эрозий хряща разрастается соединительная ткань, покрывающая поверхность суставных сочленений. Все симптомы сглажены и протекают незаметно.
- Завершающая при остром течении – все симптомы воспаления постепенно проходят, наступает выздоровление. Или острый процесс переходит в хронический с постепенным прогрессированием.
- Прогрессирующая при хроническом течении - происходит прогрессирование патологического процесса во время обострения, которое сменяется разрастанием плотной соединительной ткани (пролиферацией) во время ремиссии. Развивается мягкий анкилоз – частичная неподвижность. Болевой синдром в области пораженного сустава нарастает, беспокоит постоянно. Небольшие отечность и покраснение появляются во время обострений. Конечность с трудом и в неполном объеме сгибается и разгибается.
- Запущенная – итог хронического воспалительного процесса. Плотная соединительная ткань в суставной полости заменяется на костную и развивается полная неподвижность – костный анкилоз. Костная ткань по краям суставных поверхностей разрастается, деформируя сустав. Болевой синдром постоянный, функция сустава утеряна полностью.
Возможные осложнения
Помочь больному травматическим артритом можно на любой стадии, но чем длительнее протекает патология, тем больше необратимых изменений появляется в суставе. Все возможные осложнения делятся на ранние и поздние. Ранние:
- присоединение инфекции и развитие гнойного воспалительного процесса;
- переход гнойного воспаления на околосуставные ткани с образованием флегмон и абсцессов;
- гнойная инфекция может стать генерализованной, распространиться на многие органы и системы (сепсис).

Осложнения травматического артрита - инфекции, гнойный процесс, абсцесс
- медленное и незаметное развитие болезни с переходом хронического воспаления в дегенеративно-дистрофический; постоянный изматывающий болевой синдром с полной утратой суставной функции.
Что делать, если началось обострение артрита
Алгоритм действий во время обострения посттравматического артрита:
- вызвать врача на дом;
- принять внутрь любое обезболивающее средство: Анальгин, Пенталгин, Ибурофен, Найз и т.д.; на кожу в околосуставной области нанести мазь или гель с обезболивающими свойствами (Вольмарен, Фастум-гель и др.);
- лечь и принять положение, обеспечивающее неподвижность сустава.
Первая помощь при травме сустава:
- вызвать на дом врача или скорую помощь (при сильной травме);
- принять внутрь обезболивающее средство; наружно нанести на травмированную область гепариновую мазь;
- приложить к месту травмы холод;
- лечь и обеспечить неподвижность пострадавшему суставу.
Хондропротекторы что это как выбрать, насколько они эффективны
Боль в суставах в состоянии покоя
Локализации
Травмировать можно любой сустав. Но некоторые из них страдают чаще и значительнее остальных. Эти колени, голеностопы, локти.
Травматический артрит ног
Суставы ног несут самую высокую нагрузку, поэтому часто страдают при ожирении, малоподвижном образе жизни и постоянном воздействии мелких травм. Эти же суставы в первую очередь травмируются при острых травмах – падениях, ударах и т.д.:
Посттравматический артрит тазобедренного сустава
Посттравматические артриты встречаются не так часто, но протекают тяжело, осложняются гнойными процессами и формированием неподвижности. Особенно часто этот сустав травмируется у пожилых людей с лишним весом и остеопорозом – хрупкостью костей из-за утраты кальция.
Посттравматический артрит коленного сустава
Травмируется чаще остальных суставных сочленений. Особенностью колена является наличие плоской кости – надколенника, который обычно принимает на себя удар. Травматические поражения коленного сустава разнообразны из-за того, что могут пострадать не только сустав, но и многочисленные связки. Это будет поддерживать воспалительный и дегенеративно-дистрофический процессы. В группе риска спортсмены.
Посттравматический артрит голеностопного сустава
Голеностоп также очень часто страдает, в основном не от прямых ударов, а при подворачивании стопы и разрыве связок. В группе риска женщины, которые носят неудобную обувь на высоком неустойчивом каблуке.
Артрит пятки - таранно-пяточно-ладьевидный сустав
Удерживает пяточную кость и передает амортизацию с голеностопного сустава на стопу. Травмируется у спортсменов-тяжеловесов, лиц, страдающих ожирением и плоскостопием. Артрит часто протекает хронически с развитием ограничений подвижности сустава.
Посттравматический артрит рук
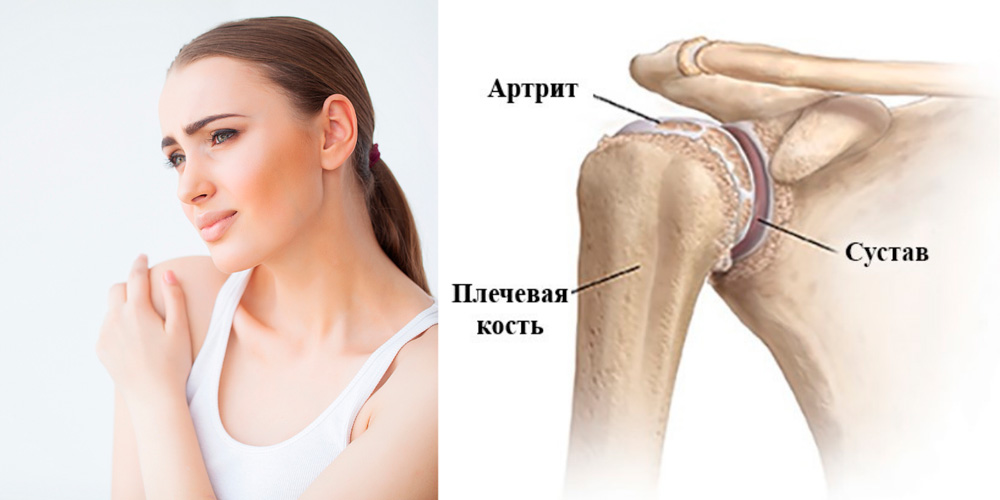
Посттравматический артрит плечевого сустава
Травматические поражения суставов рук встречаются реже, чем ног. Обычно от травматических артритов страдают спортсмены и лица, поднимающие тяжести. Артриты отдельных суставов.
Посттравматический артрит плечевого сустава
Воспаление сустава чаще всего появляется как следствие падения на руку, прямого удара по плечу, а также при резком разгибании руки в плече. Опасны плече-лопаточные артриты, они склонны к длительному течению с постоянным болевым синдромом и снижением функции верхней конечности.
Посттравматический артрит локтевого сустава
Частые мелкие травмы встречаются у теннисистов. Характерно развитие не только артрита, но и эпикондилита – воспаление прикрепляющихся снаружи сухожилий (локоть теннисиста). Протекает артрит длительно, с нарастающим болевым синдромом. Если не лечить, приводит к инвалидности.
Посттравматический артрит суставов запястья и кисти
Артриты встречаются не так часто, причина – бытовое травмирование. Хронические артриты лучезапястного сустава бывают у пианистов, лиц, длительно работающих на компьютере и т.д. При выраженном воспалении часто присоединяется тоннельный синдром запястья – сдавливание отекшими тканями срединного нерва.
Посттравматический артрит пальцев рук
Пальцы травмируются часто. Это могут быть острые бытовые, спортивные и профессиональные травмы. Незначительные травмы вызывают легко протекающие артриты, заканчивающиеся выздоровлением. Переломы и ушибы пальцев опасны лицам с ревматоидным артритом: вызванное травмой воспаление приводит к развитию обострения и стимулирует разрушение суставов.
Травматический артрит височно-нижнечелюстного сустава
Артрит может быть следствием одномоментной травмы или длительного постоянного травмирования. В первом случае развивается острый воспалительный процесс, если его не лечить, то может развиваться стойкий анкилоз с болями и трудностями при открытии рта. Хронический артрит развивается на фоне неправильно прикуса или отсутствия некоторых зубов в зубном ряду и также со временем приводит к постоянным болям и нарушению суставной функции.
Посттравматический шейный артрит
Травматические поражения шейного отдела позвоночника могут приводить к развитию артрита. Острый артрит начинается после удара или ранения шеи. Течение зависит от тяжести травм: отек околосуставных тканей вызывает сдавливание нервных корешков и питающих мозг кровеносных сосудов. Поэтому данная локализация требует своевременного назначения адекватного лечения.
Хронические процессы могут развиваться из недолеченных острых или носить изначально незаметный характер. Развиваются при длительном неправильном положении шеи (во время сна, при работе за компьютером), постоянном мелком травмировании при занятиях спортом и т.д. Проявляется в виде постоянных болей и ограничении подвижности в шее, а также головных болей и перепадов артериального давления.
Диагностика
Поставить правильный диагноз в домашних условиях невозможно, поэтому при подозрении на травму сустава нужно обращаться к врачу. Во время обследования выявляется характер течения заболевания и степень поражения сустава.
Диагностика начинается с осмотра врача, затем он направляет пациента на дополнительные исследования:
Васкулиты кожи — группа заболеваний мультифакторной природы, при которых ведущим признаком является воспаление кровеносных сосудов дермы и подкожной клетчатки.
Васкулиты кожи — группа заболеваний мультифакторной природы, при которых ведущим признаком является воспаление кровеносных сосудов дермы и подкожной клетчатки.
Трудность в освещении этой темы заключается в том, что до настоящего времени нет общепринятой классификации и даже согласованной терминологии васкулитов. В настоящее время описано около 50 различных нозологических форм, и разобраться в этом многообразии непросто. Пестрота клинических проявлений и недостаточно изученные патогенетические механизмы привели к тому, что под разными названиями может скрываться лишь вариант основного типа поражения кожи. Также, помимо первичных васкулитов, в основе которых лежит воспалительное поражение сосудов кожи, выделяют и вторичные васкулиты (специфические и неспецифические), развивающиеся на фоне определенного инфекционного (сифилис, туберкулез и др.), токсического, паранеопластического или аутоиммунного (системная красная волчанка, дерматомиозит и др.) процесса. Возможна трансформация васкулита кожи в системный процесс с поражением внутренних органов и развитием тяжелых, иногда опасных для жизни осложнений.
Васкулиты кожи — заболевания полиэтиологические. Наиболее часто наблюдается связь с фокальной инфекцией (стрептококки, стафилококки, микобактерии туберкулеза, дрожжевые грибы, вирусы и др.). Определенное значение имеет повышенная чувствительность к ряду лекарственных веществ, в частности к антибиотикам и сульфаниламидным препаратам. Нередко, несмотря на тщательно собранный анамнез и проведенное обследование, этиологический фактор остается невыясненным. Среди факторов риска при васкулитах следует учитывать: возраст (наиболее уязвимы дети и пожилые люди), переохлаждение, чрезмерную инсоляцию, тяжелые физические и психические нагрузки, травмы, операции, заболевания печени, сахарный диабет, гипертонию. Патогенетическим механизмом развития васкулитов кожи в настоящее время считается образование циркулирующих иммунных комплексов с последующей их фиксацией в эндотелии, хотя окончательно это доказано не для всех заболеваний данной группы.
Васкулиты кожи — это неоднородная группа заболеваний, и клинические проявления их чрезвычайно разнообразны. Однако существует целый ряд общих признаков, объединяющих эти дерматозы:
1) воспалительный характер изменений кожи;
2) симметричность высыпаний;
3) склонность к отеку, кровоизлияниям и некрозу;
4) первичная локализация на нижних конечностях;
5) эволюционный полиморфизм;
6) связь с предшествующими инфекционными заболеваниями, приемом лекарств, переохлаждением, аллергическими или аутоиммунными заболеваниями, с нарушением венозного оттока;
7) острое или обостряющееся течение.
Поражения кожи при васкулитах многообразны. Это могут быть пятна, пурпура, узелки, узлы, некрозы, корки, эрозии, язвы и др., но основным клиническим дифференциальным признаком является пальпируемая пурпура (геморрагическая сыпь, возвышающаяся над поверхностью кожи и ощущаемая при пальпации).
Общепринятой классификации васкулитов не существует. Систематизируют васкулиты по разным принципам: этиологии и патогенезу, гистологической картине, остроте процесса, особенностям клинических проявлений. Большинство клиницистов пользуются преимущественно морфологическими классификациями кожных васкулитов, в основу которых обычно положены клинические изменения кожи, а также глубина расположения (и соответственно калибр) пораженных сосудов. Выделяют поверхностные (поражение сосудов дермы) и глубокие (поражение сосудов на границе кожи и подкожной клетчатки) васкулиты. К поверхностным относят: геморрагический васкулит (болезнь Шенлейна–Геноха), аллергический артериолит (полиморфный дермальный ангиит), лейкокластический геморрагический микробид Мишера–Шторка, а также хронические капилляриты (гемосидерозы): кольцевидная телеангиэктатическая пурпура Майокки и болезнь Шамберга. К глубоким: кожную форму узелкового периартериита, острые и хронические узловатые эритемы.
Геморрагический васкулит — системное заболевание, поражающее мелкие сосуды дермы и проявляющееся пальпируемой пурпурой, артралгиями, поражением желудочно-кишечного тракта (ЖКТ) и гломерулонефритом. Встречается в любом возрасте, но наибольшему риску подвергаются мальчики в возрасте от 4 до 8 лет. Развивается после инфекционного заболевания, через 10–20 дней. Острое начало заболевания, с повышением температуры и симптомами интоксикации чаще всего наблюдается в детском возрасте. Выделяют следующие формы геморрагического васкулита: кожная, кожно-суставная, кожно-почечная, абдоминально-кожная и смешанная. Течение может быть молниеносным, острым и затяжным. Длительность заболевания различна — от нескольких недель до нескольких лет.
Процесс начинается симметрично на нижних конечностях и ягодицах. Высыпания имеют папулезно-геморрагический характер, нередко с уртикарными элементами, при надавливании не исчезают. Окраска их меняется в зависимости от времени появления. Высыпания возникают волнообразно (1 раз в 6–8 дней), наиболее бурными бывают первые волны сыпи. Суставной синдром появляется либо одновременно с поражением кожи, либо через несколько часов. Чаще всего поражаются крупные суставы (коленные и голеностопные).
Одним из вариантов заболевания является так называемая некротическая пурпура, наблюдаемая при быстром течении процесса, при котором появляются некротические поражения кожи, изъязвления, геморрагические корки.
Наибольшие трудности вызывает диагностика абдоминальной формы геморрагического васкулита, так как высыпания на коже не всегда предшествуют желудочно-кишечным явлениям (рвоте, схваткообразным болям в животе, напряжению и болезненности его при пальпации, кровью в стуле).
Почечная форма проявляется нарушением деятельности почек различной степени выраженности, от кратковременной нестойкой гематурии и альбуминурии до выраженной картины острого гломерулонефрита. Это поздний симптом, он никогда не встречается до поражения кожи.
Молниеносная форма геморрагического васкулита характеризуется крайне тяжелым течением, высокой лихорадкой, распространенными высыпаниями на коже и слизистых, висцерапатиями, может закончиться смертью больного.
Диагностика заболевания базируется на типичных клинических проявлениях, в атипичных случаях проводится биопсия. При абдоминальной форме необходимо наблюдение хирурга. Рекомендуется наблюдение нефролога в течение трех месяцев после разрешения пурпуры.
Патогенетическими факторами болезни считают простуду, фокальные инфекции. Высыпания располагаются обычно симметрично и имеют полиморфный характер (пятна, папулы, пузырьки, пустулы, некрозы, изъязвления, телеангиэктазии, волдыри). В зависимости от преобладающих элементов выделяют три формы заболевания: геморрагический тип, полиморфно-узелковый (соответствует трехсимптомной болезни Гужеро–Дюперра) и узелково?некротический (соответствует узелково?некротическому дерматиту Вертера–Дюмлинга). При регрессе сыпи могут оставаться рубцовые атрофии и рубчики. Заболевание склонно к рецидивам. Нередко перед высыпаниями больные жалуются на недомогание, усталость, головную боль, в разгар заболевания — на боли в суставах (которые иногда припухают) и в животе. Диагностика всех типов заболевания сложна из-за отсутствия типичных, характерных симптомов. При гистологическом исследовании выявляется фибриноидное поражение сосудов мелкого калибра с образованием инфильтративных скоплений из нейтрофилов, эозинофилов, лимфоцитов, плазматических клеток и гистиоцитов.
Геморрагический лейкокластический микробид Мишера–Шторка по клиническому течению сходен с другими формами полиморфных дермальных васкулитов. Признаком, позволяющим выделить это заболевание как самостоятельное, является наличие феномена — лейкоклазии (распад ядер зернистых лейкоцитов, приводящий к образованию ядерной пыли) при гистологическом исследовании. Таким образом, геморрагический лейкокластический микробид может трактоваться как дерматоз, обусловленный хронической фокальной инфекцией (внутрикожные тесты со стрептококковым антигеном положительные), протекающий с выраженной лейкоклазией.
Хронические капилляриты (гемосидерозы), в отличие от остро протекающих пурпур, характеризуются доброкачественным течением и являются исключительно кожными заболеваниями.
Болезнь Шамберга — представляет собой лимфоцитарный капиллярит, который характеризуется наличием петехий и коричневых пурпурных пятен, возникающих чаще всего на нижних конечностях. Пациентов беспокоит исключительно как косметический дефект.
Пурпура Майокки характеризуется появлением на нижних конечностях розовых и ливидно-красных пятен (без предшествующей гиперемии, инфильтрации), медленно растущих с образование кольцевидных фигур. В центральной части пятна развивается небольшая атрофия и ахромия, выпадают пушковые волосы. Субъективные ощущения отсутствуют.
Иногда единственным проявлением заболевания может быть сетчатое или ветвистое ливедо (стойкие фиолетово?красные пятна), локализующиеся на дистальных отделах конечностей, преимущественно на разгибательных поверхностях или пояснице. Характерно обнаружение по ходу ливедо узелков.
Диагностика заболевания основывается на сочетании поражения ряда органов и систем с признаками значительного воспаления, с лихорадкой, изменениями прежде всего в почках, в сердце, наличии полиневрита. Специфических для этой болезни лабораторных показателей не существует. Решающее значение для диагноза имеет динамическое клиническое наблюдение за больным.
Острая узловатая эритема — это панникулит, который характеризуется наличием болезненных розовых узлов на разгибательной поверхности нижних конечностей. Сопровождается лихорадкой, недомоганием, диареей, головной болью, конъюнктивитом и кашлем. Среди взрослых узловатая эритема в 5–6 раз чаще встречается у женщин, пиковый возраст — 20–30 лет. В основе заболевания гиперчуствительность к различным антигенам (бактерии, вирусы, грибы, новообразования и заболевания соединительной ткани). Половина случаев является идиопатическими. Диагностика основывается на данных анамнеза и физического осмотра. Необходимо провести полный анализ крови, рентгенограмму легких (выявляется двусторонняя аденопатия в области корней легких), мазок из зева или быстрый тест на стрептококки.
Хроническая узловая эритема — это группа различных видов узловатых дермогиподермитов. Чаще болеют женщины 30–40 лет. На голенях возникают узлы различной величины с покрасневшей над ними кожей, без наклонности к некрозу и изъязвлению. Воспалительные явления в области высыпаний и субъективные ощущения (артралгии, миалгии) мало выражены. Клинические варианты хронической узловатой эритемы имеют свои особенности, например наклонность узлов к миграции (мигрирующая эритема Беферштедта) или асимметрия процесса (гиподермит Вилановы–Пиноля).
Тактика ведения больного васкулитом кожи
- Классифицировать заболевание (характерная клиническая картина, анамнез, гистологическое исследование).
- Поиск этиологического фактора, но в 30% случаев его установить не удается (поиск очагов хронической инфекции, микробиологические, иммунологические, аллергологические и другие исследования).
- Оценка общего состояния и определение степени активности заболевания: общий анализ крови и мочи, биохимический анализ крови, коагулограмма, иммунограмма. Степень активности васкулитов: I. Высыпания не обильные, температура тела не выше 37,5, общие явления незначительные, СОЭ не выше 25, С-реактивный белок не более ++, комплемент более 30 ед. II. Высыпания обильные (выходят за пределы голени), температура тела выше 37,5, общие явления — головная боль, слабость, симптомы интоксикации, артралгии; СОЭ выше 25, С-реактивный белок более ++, комплемент менее 30 ед., протеинурия.
- Оценка признаков системности (исследование по показаниям).
- Определение вида и режима лечения в зависимости от степени активности: I ст. — возможно лечение в амбулаторных условиях; II ст. — в стационаре. Во всех случаях обострений васкулитов кожи необходим постельный режим, так как у таких больных обычно резко выражен ортостатизм, который следует соблюдать до перехода в регрессирующую стадию. Рекомендуется диета с исключением раздражающей пищи (алкогольные напитки, острые, копченые, соленые и жареные блюда, консервы, шоколад, крепкий чай и кофе, цитрусовые).
- Этиологическое лечение. Если есть возможность устранить причинный агент (лекарство, химикаты, инфекции), то быстро следует разрешение кожных очагов и другого лечения не требуется. Но надо помнить, что при санации очагов инфекции может наблюдаться усиление сосудистого процесса.
- Патогенетическое лечение.
- Профилактические мероприятия: диспансеризация, предупреждение провоцирующих факторов (инфекции, переохлаждение, инсоляции, стрессы и др.), рациональное использование лекарственных средств, трудоустройство, лечебная физкультура, санаторно-курортное лечение.
Лечение геморрагического васкулита
- Глюкокортикостероиды (преднизалон до 1,5 мг/кг) — облегчают проявление кожно-суставного синдрома, но не укорачивают заболевание и не предотвращают поражение почек. Назначаются в тяжелых случаях и под прикрытием гепарина, т. к. повышают свертываемость крови.
- Нестероидные противовоспалительные средства (НПВС) в обычных терапевтических дозировках. Выбор конкретного препарата принципиального значения не имеет (индометацин, диклофенак, ацетилсалициловая кислота).
- Антикоагулянты и антиагреганты. Гепарин при распространенном процессе 300–400 ЕД/кг/сутки. Продолжительность курса должна составлять не менее 3–5 недель. Под контролем коагулограммы.
- Лечебный плазмаферез, когда проявления заболевания не устраняются перечисленными средствами.
- Никотиновая кислота в переносимых дозах в/в капельно.
- Не следует применять: антигистаминные препараты (возможно только в самом начале заболевания), препараты кальция, все витамины.
Лечение васкулитов кожи
1) НПВС (напроксен, диклофенак, Реопирин, индометацин и др.);
2) салицилаты;
3) препараты Са;
4) витамины Р, С, антиоксидантный комплекс;
5) сосудорасширяющие средства (ксантинола никотинат, пентоксифиллин);
6) 2% раствор йодида калия по 1 ст. л. 3 раза в день (узловатая эритема);
7) антикоагулянты и антиагреганты;
8) методы детоксикации в/в капельно;
9) глюкокортикостероиды (ГКС) по 30–35 мг/сутки в течение 8–10 дней;
10) цитостатики;
11) ультравысокочастотная терапия, диатермия, индуктотермия, ультразвук с гидрокортизоном, ультрафиолетовое облучение.
Наружное лечение. При эрозивно-язвенных высыпаниях
1) 1–2% растворы анилиновых красителей;
2) эпителизирующие мази (солкосерил);
3) мази, содержащие глюкокортикоиды, и др.;
4) примочки или мази протеолитическими ферментами (Химопсин, Ируксол);
5) апликации Димексида;
При узлах — сухое тепло.
Лечение не должно заканчиваться с исчезновением клинических проявлений заболевания. Оно продолжается до полной нормализации лабораторных показателей, а в последующие полгода-год больным проводится поддерживающее лечение
В статье рассматриваются особенности течения суставных проявлений при хронических воспалительных заболеваниях кишечника, а также приводится клинический пример течения болезни Крона с дебютом с внекишечных проявлений в виде суставного синдрома.
Изучение хронических воспалительных заболеваний кишечника (ХВЗК) является актуальной проблемой не только детской гастроэнтерологии, но и детской ревматологии вследствие частого дебюта этих патологических состояний именно с суставных проявлений и дальнейшего течения клинически взаимосвязанных кишечного и суставного синдромов.
Распространенность ХВЗК среди детского населения составляет 2,2–6,8 на 100 тыс. детей [1, 2]. С наибольшей частотой в детском возрасте диагностируются такие заболевания этой группы, как болезнь Крона и язвенный колит. Отмечено, что язвенный колит чаще встречается у мальчиков, а болезнь Крона — у мальчиков и девочек с примерно с одинаковой частотой [2].
Болезнь Крона (регионарный энтерит, гранулематозный илеит) — воспалительное заболевание с вовлечением в процесс всех слоев кишечной стенки; характеризуется прерывистым (сегментарным) характером поражения различных разделов желудочно-кишечного тракта. Для него характерна диарея с примесью слизи и крови, боли в животе (часто в правой подвздошной области), потеря массы тела, лихорадка.
Язвенный колит (неспецифический язвенный колит, идиопатический колит) — язвенно-деструктивное поражение слизистой оболочки толстой кишки, которое локализуется преимущественно в ее дистальных отделах. В клинической картине характерны: кровотечения из прямой кишки, учащенное опорожнение кишечника, тенезмы; боли в животе менее интенсивны, чем при болезни Крона, локализуются чаще всего в левой подвздошной области. Примерно у 30% пациентов юношеского возраста язвенный колит начинается внезапно с появления болей в животе и диареи с примесью крови.
По данных разных авторов, внекишечные проявления ХВЗК отмечаются в 5–25% случаев. Наибольшая их доля приходится на тотальные формы неспецифического язвенного колита (87,5%) и болезни Крона с вовлечением в процесс толстой (29%) или толстой и тонкой кишки (58,1%) [3]. Системные проявления ХВЗК по патогенетическому принципу разделяют на три группы. К первой группе относят проявления, возникающие вследствие системной гиперсенсибилизации, — поражения суставов, глаз, кожи, слизистой оболочки рта; ко второй — обусловленные бактериемией и антигенемией в портальной системе — поражения печени и билиарного тракта. Выделяют также явления, развивающиеся вторично при длительно существующих нарушениях в толстой кишке, — анемии, электролитные расстройства.
Патогенез суставных проявлений остается неясным. Обсуждается значение повышенной проницаемости стенки кишечника, отмечающейся у больных язвенным колитом и болезнью Крона, в результате чего в кровь в большом количестве попадают компоненты оболочки стенок бактерий. Эти компоненты выступают в качестве пептидных антигенов, способных приводить к развитию артритов. Связываясь с молекулами комплексов гистосовместимости и активируя в дальнейшем Т-лимфоциты, пептиды приводят к возникновению воспаления суставов [3].
С точки зрения ревматолога суставные проявления ХВЗК относят к т. н. серонегативным спондилоартропатиям. Это большая гетерогенная группа клинически пересекающихся, хронических воспалительных ревматических заболеваний [4]. Помимо артритов, связанных с воспалительными заболеваниями кишечника, в эту группу включают такие ревматические заболевания детского возраста, как ювенильный спондилоартрит, ювенильный реактивный артрит, ювенильный псориатический артрит, а также недифференцированные спондилоартропатии (дактилит, увеит, сакроилеит в отсутствии полного набора критериев). Несмотря на гетерогенность заболеваний данной группы, клинически серонегативные спондилоартропатии имеют общие признаки и характеризуются:
- патологическими изменениями в крестцово-подвздошном отделе и/или других суставах позвоночника;
- синдромом периферической воспалительной артропатии, проявляющейся асимметричным артритом преимущественно нижних конечностей;
- энтезопатическим синдромом;
- ассоциацией с антигеном гистосовместимости HLA-B27;
- тенденцией к накоплению этих заболеваний в семьях;
- частым наличием внесуставных симптомов (поражение глаз, клапанов аорты, кожи) [5, 6]. В МКБ-10 поражения суставов при рассматриваемых нами заболеваниях кодируются следующим образом: М07.4 Артропатия при болезни Крона (К50); М07.5 Артропатия при язвенном колите (К51).
Поражения суставов при ХВЗК встречаются в 20–40% случаев и протекают в виде артритов (периферической артропатии), сакроилеита и/или анкилозирующего спондилита [3].
Артриты
Артриты относятся к наиболее частым суставным проявлениям хронических воспалительных заболеваний кишечника. Нередко они сочетаются с поражением кожи в виде узловатой эритемы. Частота возникновения артритов, распространенность поражения толстой кишки коррелируют с воспалительной активностью основного заболевания. В некоторых случаях артриты могут предшествовать кишечным проявлениям за много месяцев и даже лет, а также сохраняться в фазу ремиссии [7].
Клиническая картина артритов при болезни Крона и язвенном колите идентична. Характерно ассиметричное, мигрирующее поражение суставов чаще нижних конечностей. Преимущественно страдают коленные и голеностопные суставы, далее следуют локтевые, тазобедренные, межфаланговые и плюснефаланговые суставы. Число пораженных суставов обычно не превышает пяти. Суставной синдром течет с чередованием периодов обострений, длительность которых не превышает 3–4 месяцев, и ремиссий. Могут выявляться энтезопатии, талалгии. Артриты, как правило, начинаются остро. Однако нередко больные предъявляют жалобы только на артралгии, и при объективном обследовании изменения не обнаруживаются. Со временем обострения артритов становятся реже. У большинства больных артриты не приводят к деформации или деструкции суставов.
Выделяют два типа поражения периферических суставов. Для первого характерно поражение небольшого количества крупных суставов, ассиметричность суставного синдрома, острое течение. Часто при этом типе суставной синдром предшествует клинической картине основного заболевания, ассоциируется с его обострениями и сочетается с другими внекишечными проявлениями ХВЗК. Второй тип протекает по типу симметричного полиартрита, его обострения не совпадают по времени с обострениями основного процесса в кишечнике и другими системными проявлениями заболевания [7, 8].
Проведение колэктомии у больных язвенным колитом способствует прекращению рецидивирующих артритов [3].
Сакроилеит
По данным рентгенологического исследования, сакроилеит обнаруживается примерно у 50% больных ХВЗК. При этом у 90% он имеет бессимптомное течение. Он не ассоциируется с повышенной частотой выявления у больных HLA-B27. Также наличие сакроилеита не коррелирует с активностью воспалительного заболевания кишечника. Существуя на протяжении нескольких лет, может быть предшественником язвенного колита или болезни Крона. Сакроилеит может быть единственной локализацией изменений со стороны суставов, но часто сочетается с первым типом течения артритов. Необходимо помнить, что сакроилеит может быть ранним симптомом анкилозирующего спондилита. Терапия кишечного синдрома не приводит к изменению клинической картины сакроилеита [7].
Анкилозирующий спондилит
Анкилозирующий спондилит (АС) при ХВЗК клинически, как и сакроилеит, не отличается от идиопатического анкилозирующего спондилита. Чаще встречается у лиц мужского пола. По наблюдениям, у лиц женского пола поражение шейного отдела позвоночника манифестирует в более молодом возрасте и протекает тяжелее. Симптомы АС обычно предшествуют манифестации болезни Крона или язвенного колита и не коррелируют с активностью воспаления в кишечнике. Отмечаются боли в позвоночнике, чувство утренней скованности, нарастает ограничение подвижности в шейном, грудном, поясничном отделах позвоночника. Активная терапия основного заболевания не приводит к изменению клинической картины спондилита [3, 7, 9, 10].
Клиническое наблюдение
Иллюстрацией к вышеизложенному материалу может служить клиническое наблюдение за течением болезни Крона с внекишечными суставными проявлениями у пациента подросткового возраста.
Клинический диагноз: болезнь Крона (поражение тонкого, толстого кишечника, желудка, пищевода), фаза ремиссии, внекишечные проявления (лихорадка в анамнезе, лимфаденопатия, гепатомегалия, железодефицитная анемия). Осложнения: стеноз устья баугиниевой заслонки, сужение входа в слепую кишку.
Ювенильный спондилоартрит, активность I степени, рентгенологическая стадия I–II, НФ-1.
Из анамнеза жизни следует отметить, что мальчик от 2-й беременности, протекавшей физиологически, от первых срочных родов, осложнившихся слабостью родовой деятельности (акушерское пособие — наложение проходных щипцов). Находился на раннем искусственном вскармливании. На первом году жизни наблюдался неврологом. В дальнейшем редкие ОРВИ. Привит по календарю. Детскими инфекциями не болел. Наследственность отягощена по заболеваниям сердечно-сосудистой системы.
Анамнез заболевания: в сентябре 2008 г. после травмы левого голеностопного суставе у ребенка отмечался отек и болезненность в левом голеностопном сустава. Получал местно мази с нестероидными противовоспалительными препаратами (НПВП). Также применялось физиотерапевтическое лечение, что вызвало ухудшение состояния: появилась субфебрильная лихорадка, усилились артралгии в левом голеностопном суставе, также появилась болезненность в височно-нижнечелюстных суставах с ограничением подвижности в них. За три месяца мальчик похудел на 12 кг. Обследован по месту жительства: в анализе крови скорость оседания эритроцитов (СОЭ) 47–55 мм/ч, лейкоцитоз, в биохимическом анализе повышение аспартатаминотрансферазы (АСТ) до 2 норм, С-реативный белок (СРБ)++. Выявлена кишечная инфекция: титр к S. flexneri 1:400. Проводимая терапия (НПВП, антибиотики — цефазолин, цефтриаксон, амикацин) эффекта не дала. На фоне приема антибиотиков появился неустойчивый, разжиженный стул, боли в околопупочной области. В НИИ фтизиатрии исключен туберкулез. При компьютерной томографии левого голеностопного сустава выявлено: сужение суставной щели, краевая узура в медиальной лодыжке, выпот в полость сустава. Исключена ортопедическая патология. С января 2009 г. наблюдается в Университетской детской клинической больнице (УДКБ) Первого МГМУ им. И. М. Сеченова. При поступлении состояние средней степени тяжести. Бледен, выражены симптомы интоксикации. Дистрофия. Суставной синдром в виде выпота, ограничения подвижности, повышения местной температуры и болезненности в левом голеностопном суставе, ахиллобурсит слева, умеренная атрофия мышц левой голени, походка нарушена. Ригидность грудного отдела позвоночника (+ 1 см), ограничение подвижности в височно-нижнечелюстных суставах. Отмечаются боли в животе, разжиженный стул. Высокая гуморальная активность: СОЭ до 50 мм/ч, лейкоцитоз до 22 000 в 1 мкл с палочкоядерным сдвигом до 24%, анемия — гемоглобин (Hb) 109 г/л, однократно повышения уровней АСТ и аланинаминотрансферазы (АЛТ) до 1,5–2 норм. Обследован на артритогенные инфекции: результат отрицателен. При иммуногенетическом обследование выявлены HLA 1-го класс: А2, В 64 (14), В38 (16). Ребенку выставлен предварительный диагноз: ювенильный спондилоартрит. Использовали пульс-терапию глюкокортикоидами, введение внутривенного иммуноглобулина, НПВП, проведена внутрисуставная пункция левого голеностопного сустава с введением Депо-медрола. В качестве базисного препарата ребенку назначен сульфасалазин 1500 мг/сутки. На фоне проводимой терапии отмечалась положительная динамика, несколько снизилась лабораторная активность, купированы боли в животе, нормализовался стул, возрос объем движений в левом голеностопном суставе, однако сохранялась отечность и утренняя скованность в нем. В марте 2009 г. вновь обострение суставного синдрома, лихорадка до 37,8 °C, боли в животе, неустойчивый стул, появилась отечность правого голеностопного сустава. Ребенок вновь госпитализирован в УДКБ в мае-июне 2009 г.: СОЭ 29 мм/ч, гипохромная анемия, тромбоцитоз, СРБ ++, IgG 2150 мг/дл, в копрограмме эритроциты до 40 в поле зрения однократно. Выполнена ректороманоскопия: сигмоидит, проктит, эндоскопические признаки колита. На эзофагогастродуоденоскопии: эрозивный гастрит, дуоденит, еюнит. Рекомендовано проведение колоноскопии, от проведения которой родители ребенка отказались. Мальчику была повышена доза сульфасалазина до 1750 мг/сутки. Но состояние пациента оставалось нестабильным: сохранялись неустойчивый стул, отечность, болезненность и нарушение функции левого голеностопного сустава. В октябре 2009 г. вновь госпитализирован в УДКБ: СОЭ 34 мм/ч, наросла гипохромная анемия Hb 90 г/л, тромбоцитоз, лейкоцитоз до 16 тыс. в 1 мкл, СРБ ++. Ребенку проведена колоноскопия: болезнь Крона, глубокие язвы в ободочной кишке, язвенный терминальный илеит, проктит, колит, сигмоидит. По данным магнитно-резонасной томографии илеосакральных сочленений — левосторонний сакроилеит. Мальчику проводилась коррекция терапии: сульфасалазин отменен, назначен Салофальк 2000 мг/сутки, продолжал получать НПВП. На фоне терапии состояние с положительным эффектом — купирован кишечный синдром, нормализовался стул. Однако в декабре 2009 г. после ОРВИ вновь обострение основного заболевания: повышение температуры до фебрильных цифр, СОЭ 50 мм/ч, отек голеностопных суставов, скованность в них. С конца декабря 2009 г. отмечаются схваткообразные боли в животе, разжиженный стул. В январе 2010 г. в связи с высокой лабораторной и клинической активностью основного заболевания, неэффективностью традиционной терапии (монотерапии Салофальком), прогрессирующей инвалидизацией пациента начата терапия инфликсимабом. 3.02.2010 г. проведено первое введение, на фоне которого отмечена выраженная положительная динамика, купирован кишечный синдром, возрос объем движений в голеностопных суставах, уменьшилась экссудация в них, снизилась активность лабораторных показателей. 17.02.2010 и 17.03.2010 проведены второе и третье внутривенное введение Ремикейда по 100 мг на 1 введение. На фоне лечения отчетливая положительная динамика, полностью купирован кишечный синдром, прибавил в весе 7 кг, однако сохранялось снижение Hb до 87 г/л. При госпитализации в мае-июле 2010 г. СОЭ 23 мм/ч, Hb 91 г/л. При повторной колоноскопии выявлено сужение поперечной ободочной кишки, не проходимое для эндоскопа. Проведена ирригоскопия: слепая, восходящая, 1/2 поперечной кишок деформированы, с выраженным спазмом, с постстенотическим расширением поперечной и нисходящей ободочной кишки. Продолжилась терапия инфликсимабом, с учетом увеличения веса пациента доза повышена. Всего мальчик получил 24 введений инфликсимаба. Состояние его полностью стабилизировалось. Он поправился на 22 кг, вырос на 25 см. Полностью купированы кишечный и суставные синдромы. Полностью нормализовались лабораторные показатели СОЭ 5–14 мм/час. Hb 151 г/л. Мальчик ведет активный образ жизни.
Литература
- Яблокова Е. А. Клинические особенности и нарушение минерализации костной ткани у детей с воспалительными заболеваниями кишечника. Дисс. канд. мед. наук. М., 2006. 185 с.
- Tourtelier Y., Dabadie A., Tron I., Alexandre J. L., Robaskiewicz M., Cruchant E., Seyrig J. A., Heresbach D., Bretagne J. F. Incidence of inflammatory bowel disease in children in Britani (1994 –1997). Breton association of study and research on digestive system diseases (Abermad) // Arch Pediatr. 2000 Apr; 7 (4): 377–384.
- Гвидо Адлер. Болезнь Крона и язвенный колит. М.: ГЭОТАР-МЕД, 2001.
- Шостак Н. А., Правдюк Н. Г., Абельдяев Д. В. Серонегативные спондилоартропатии — совершенствование подходов к ранней диагностике и лечению // РМЖ. 2013, № 6, 1002–1008.
- Справочник по ревматологии / Хаким А., Клуни Г., Хак И.; пер. с англ. Н. И. Татаркиной. М.: ГЭОТАР-Медиа, 2010. 560 с.
- Dougados M., Hermann K. G., Landewe R. et al. Assess spondyloarthritis to international Society (ASAS) handbook: a guide The Assessment of spondyloArthritis // Ann Rheum Dis. 2009. Vol. 68. Р. 1–44.
- Ревматология. Национальное руководство под ред. Е. Л. Насонова, В. А. Насоновой. М.: ГЭОТАР-Медиа, 2008. 720 с.
- D’Incà R., Podswiadek M., Ferronato A., Punzi L., Salvagnini M., Sturniolo G. C. Articular manifestation in inflammatory bowel disease patients. A prospective study // Dig Liver Dis. 2009, Mar 9.
- Rodriguez V. E., Costas P. J., Vazquez M., Alvarez G., Perez-Kraft G., Climent C., Nazario C. M. Prevalence of spondyloarthropathy in Puerto Rican patients with inflammatory bowel disease/Ethn Dis. 2008, Spring; 18 (2 Suppl 2): S2–225–9.
- Руководство по детской ревматологии / под ред. Н. А. Геппе, Н. С. Подчерняевой, Г. А. Лыскиной. М.: ГЕОТАР-Медиа, 2012. 720 с.
А. В. Мелешкина 1 , кандидат медицинских наук
С. Н. Чебышева, кандидат медицинских наук
Е. С. Жолобова, доктор медицинских наук, профессор
М. Н. Николаева
ГБОУ ВПО Первый МГМУ им. И. М. Сеченова МЗ РФ, Москва
Abstract. The article covers specifics of development of articular manifestations under chronic inflammatory bowel diseases and provides clinical example of crohn’s disease development starting with un-bowel manifestations in forn of articular syndrome.
Одной из частных форм наркоманий является опийная (опиоидная) наркомания — заболевание, развивающееся в результате употребления опиатов (опиоидов) и формирования наркотической зависимости. В последние годы стала заметно прослеживаться тенденция к разг
Одной из частных форм наркоманий является опийная (опиоидная) наркомания — заболевание, развивающееся в результате употребления опиатов (опиоидов) и формирования наркотической зависимости.

Опийные вещества подразделяются по происхождению: природные, полусинтетические, синтетические (табл.), а также по типу их фармакологического действия: полные и частичные агонисты опиоидных рецепторов, антагонисты и препараты смешанного (агонист-антагонистического) действия.
В основе развития зависимости от природных, полусинтетических или синтетических опийных веществ лежат единые патогенетические механизмы, что, несмотря на ряд различий (в картине наркотического опьянения, абстиненции и т. п.), позволяет рассматривать эту зависимость как единое заболевание — опийную наркоманию, с ее наиболее распространенными клиническими вариантами (героинизм/героиновая наркомания; кодеинизм/кодеиновая наркомания и т. п.).
В последнее время на территории России наиболее часто употребляемым наркотиком из группы опийных производных является героин.
Следует выделить ряд неотложных состояний, связанных с приемом наркотических (токсикоманических) веществ, среди которых, согласно статистике, опиаты занимают одну из лидирующих позиций:
Такие неотложные состояния можно условно разделить на две группы: I группа — состояния, непосредственно связанные с употреблением психоактивного вещества (первые пять пунктов); II группа — состояния, возникающие в процессе проводимых терапевтических мероприятий (последние два пункта). На догоспитальном этапе (ДГЭ) в практике врача скорой медицинской помощи (СМП) наиболее часто встречаются два первых состояния — опийная передозировка (острое отравление) и абстиненция (синдром отмены). Этот факт определяет необходимость сосредоточить внимание врача именно на этих двух неотложных состояниях. Остальные перечисленные патологические состояния встречаются значительно реже и обычно требуют симптоматического лечения.
Передозировка опиатами смертельно опасна. По разным данным, до 50–60% опийных наркоманов, вводящих себе препараты опия парентеральным путем, хотя бы раз перенесли передозировку наркотика. Среди причин смертности больных опийной наркоманией лидирует летальная передозировка наркотиков — до 30–40%. Передозировка может быть обусловлена значительным превышением привычной дозы наркотика у хронических его потребителей (большинство случаев). Реже состояние передозировки оказывается связано с физиологическими причинами и наступает при поступлении в организм привычной дозы наркотика.
Как правило, наибольшую опасность в отношении передозировки представляют полные опиоидные агонисты — морфин, героин, метадон, а также короткодействующий полный опиоидный агонист — фентанил и его производные.
Опасность для жизни больных с передозировкой наркотиков заключается в нарушении двух жизненно важных функций — дыхания и кровообращения.
Наиболее типичным для токсического действия опиатов является угнетение внешнего дыхания с уменьшением его частоты и глубины до брадипноэ с частотой дыхания до 4–6 в минуту, вплоть до полного прекращения дыхательных движений (апное), в том числе у больных, находящихся в состоянии сопора или поверхностной комы. Это состояние сопровождается побледнением или цианозом кожных покровов. Именно нарушение дыхания определяет тяжесть течения, исход заболевания и необходимость выбора лечебных мероприятий. Наиболее тяжело протекают сочетанные отравления опиатами с алкоголем или иными препаратами психотропного ряда.
Угнетение гемодинамики у больных с передозировкой опиатов проявляется острой левожелудочковой недостаточностью, выраженной периферической вазодилатацией и сосудистым коллапсом (артериальное давление (АД) критически снижено, пульс приобретает нитевидный характер).
На ДГЭ при передозировке опиатов/опиоидов смертельно опасными могут быть необратимая остановка дыхания, аспирация рвотных масс и респираторный дистресс-синдром взрослых, отек легких, угнетение сердечной деятельности. Из перечисленных осложнений характерным и наиболее опасным для жизни больного является некардиогенный отек легких.
Основные принципы лечения опийного отравления на ДГЭ не отличаются от тех, которые разработаны для лечения других отравлений, в том числе иными психоактивными веществами (ПАВ). Это обеспечение нормализации дыхания и гемодинамики, прекращение поступления яда в организм, нейтрализация яда, проведение симптоматической и начало инфузионной терапии, транспортировка больного в стационар.
В свою очередь, лечебные мероприятия, снижающие вред, наносимый воздействием яда на организм при острых отравлениях опиатами, включают:
- уменьшение адсорбции, в том числе: а) зондовое промывание желудка (при сопоре или коме — аспирация рвотных масс с предварительной интубацией трахеи); б) введение активированного угля (до и после промывания желудка);
- усиление элиминации, проводимое путем: а) введения жидкости внутрь в виде обильного питья, когда это возможно, и парентерально; б) стимуляции диуреза (введение диуретиков); в) введения солевого слабительного; г) повторного введения активированного угля (с целью предотвращения повторного всасывания опиатов в кишечнике и желудке);
- антидотную терапию — введение блокатора опиатных рецепторов налоксона.
Введение налоксона в настоящее время можно считать единственным патогенетически обоснованным и результативным медицинским мероприятием.
Налоксон (синонимы: наркан, интренон, нарканти) — полный антагонист опиатных рецепторов, выпускается в виде 0,04% раствора в ампулах (по 0,4 мг/мл) или 0,1% (по 1 мг/мл), вытесняет опиаты из специфичных рецепторов, в результате чего быстро восстанавливаются угнетенное дыхание и сознание. Препарат особо показан на ДГЭ, даже в том случае, если нет возможности провести интубацию трахеи и начать искусственную вентиляцию легких (ИВЛ).
Налоксон применяют при опийной интоксикации любой тяжести. Для лечения опийного отравления препарат вводят внутривенно струйно, медленно, в начальной дозе 0,4 мг (1 мл 0,04% раствора), разведенной в изотоническом растворе хлорида натрия, или эндотрахеально. Действие налоксона при внутривенном введении начинается практически сразу — уже через 2 мин — и продолжается в течение 20–45 мин. В случае необходимости через 3–5 мин введение препарата (1,6–2 мг, 4–5 мл 0,04% раствора) повторяют до повышения уровня сознания, восстановления спонтанного дыхания и появления мидриаза. Для устранения гиперсаливации, бронхореи и брадикардии назначают 1–2 мл 0,1% раствора атропина подкожно.
Показанием к повторному введению налоксона является ухудшение состояния пациента. При этом необходимо принимать во внимание, что период полувыведения большинства опиоидов (например, героина) превышает период полувыведения налоксона. В таких случаях введение препарата повторяют через 20–30 мин. При повторном назначении возможно комбинированное внутривенное и подкожное введение препарата. При достижении стойкого терапевтического эффекта введение прекращают, закрепляя результат однократным внутримышечным или внутривенным капельным введением дополнительной дозы налоксона в дозе 0,4 мг (1 мл — 0,04% раствора).
Схема применения налоксона при подозрении на острые отравления ПАВ приведена на рисунке.
Следует отметить, что некоторые авторы, например J. C. M. Brust, считают, что прекращение введения налоксона и поиск иных и/или сопутствующих причин коматозного состояния следует осуществлять после достижения суммарной дозы в 20 мг (Ю. П. Сиволап, В. А. Савченков, 2005).
Проведенное Национальным научно-практическим обществом СМП в 2000–2003 гг. открытое многоцентровое контролируемое исследование, целью которого было улучшение качества оказания неотложной помощи пациентам с острыми отравлениями ПАВ на ДГЭ, включало и изучение эффективности применения налоксона при опийных комах.
В группе лиц с острыми отравлениями ПАВ, получавших налоксон, отмечено на 18% больше случаев, когда восстановление сознания на ДГЭ достигалось в более короткие сроки. При этом значительно реже возникала необходимость в проведении ИВЛ, втрое меньшее число больных было направлено на госпитализацию. Кроме того, значительно сократилось (в среднем на 7,6 мин) время пребывания на выезде бригад СМП, что свидетельствует о явном экономическом эффекте применения налоксона.
Как показали результаты исследования, на ДГЭ, вне зависимости от введенной дозы, налоксон не вызывал осложнений и хорошо переносился больными.
При назначении налоксона важно помнить следующее.
- При длительной тяжелой гипоксии, особенно при возможной аспирации (рвота), введению налоксона должны предшествовать интубация трахеи (после премедикации показано внутривенное введение атропина) и ИВЛ.
- У больных с аспирационным синдромом при длительной гипоксии в случае введения налоксона можно получить нежелательный эффект в виде выраженного психомоторного возбуждения и отека легких, наступающих через 30–60 мин.
Кроме того, существуют некоторые особенности, которые необходимо учитывать при лечении опийной комы. В тяжелых случаях, при отсутствии эффекта от введения антагонистов или невозможности назначения других лекарственных средств, необходимо проводить ИВЛ в режиме гипервентиляции. Необходимо постоянно давать пациенту вдыхать кислород до устранения нарушений дыхания.
В настоящее время на ДГЭ, особенно при отсутствии в оснащении бригад СМП современных иммунохроматографических стрип-тестов на наличие различных ПАВ в слюне и моче, важное дифференциально-диагностическое значение имеет проведение пробы с налоксоном. При проведении такой лечебно-диагностической пробы налоксон используют в указанных выше дозах (по 1–2 мл 0,04% раствора внутривенно) в качестве средства, позволяющего провести фармакологическую диагностику неясных случаев отравлений.
Следует помнить, что использование неоправданно высоких доз налоксона при отравлении опиатами (до 1,2–1,6 мг — 3–4 ампулы изначально) ведет к быстрому развитию опийного абстинентного синдрома (см. ниже).
Кроме введения налоксона, для повышения АД проводят внутривенную капельную инфузию растворами электролитов. Делают это, как правило, с осторожностью — из-за возможности развития отека легких. Обычно сосудистый тонус и АД восстанавливаются самопроизвольно, по мере устранения гипоксемии и увеличения объема циркулирующей крови. Однако выраженный коллапс и значительное снижение давления в малом круге кровообращения являются показанием для введения добутамина в высоких дозах.
Следует обратить внимание на тот факт, что при метадоновых комах (при передозировке метадон часто приводит к отеку легких) введение больших доз налоксона без интубации трахеи и перевода на ИВЛ категорически противопоказано, особенно больным с аспирационным синдромом, из-за вероятного развития трудноустранимых нарушений дыхания.
Опийный абстинентный синдром (ОАС), синдром отмены, представлен интенсивными психическими, соматовегетативными и неврологическими нарушениями, возникающими при прекращении приема препаратов опийного мака.
Тяжесть любого абстинентного синдрома определяется конкретным веществом, имеют значение также степень его наркогенности и токсичности, давность заболевания, дозировка применяемого препарата, спектр возможных осложнений, общая реактивность организма.
Темпы развития ОАС, как и его продолжительность, также обусловлены рядом факторов, в первую очередь фармакокинетическими особенностями опиатов. Так, при зависимости от метадона, вводимого внутривенно, абстиненция начинается в более поздние сроки, чем при зависимости от ацетилированных препаратов опийного мака. Различные психоактивные добавки (например, антигистаминные средства, производные бензодиазепина и др.) могут значительно пролонгировать действие опиатов.
Обычно ОАС развивается через 6–18 ч после употребления последней дозы наркотика. В типичных случаях героиновой наркомании максимальное развитие симптомов абстиненции фиксируется через 48–72 ч после последнего употребления наркотика. При лечении ОАС его длительность в зависимости от характера терапии колеблется в пределах от 3 до 10 дней (редко 12–15 дней), тогда как в отсутствие лечения продолжительность ОАС может существенно возрастать.
Признаки второй фазы ОАС оказываются наиболее выраженными через 30–36 ч после последнего приема опиатов. Характерны озноб, сменяющийся чувством жара, приступы потливости и слабости, постоянная пилоэрекция. В мышцах спины, затем ног, шеи и рук появляется ощущение неудобства. Мышцы тела напряжены. Появляется боль в височно-нижнечелюстных суставах и жевательных мышцах. Сохраняются и усиливаются симптомы первой фазы: зрачки широкие, частое чихание (до 50–100 раз), интенсивное зевание и слезотечение.
Третья фаза ОАС развивается через 40–48 ч после приема последней дозы. Влечение к наркотику приобретает компульсивный (непреодолимый) характер. Признаки первых двух фаз усиливаются. Появляются мышечные боли. Мышцы спины, конечностей, реже — шеи сводит, тянет, крутит.
У части больных возникают судороги периферических мышц (икроножных, мышц стопы и др.), потребность постоянно двигаться, поскольку в начале движения боли ослабевают, но затем усиливаются. Больные не могут найти себе места, ложатся, встают, вновь ложатся, крутятся в постели. Боли в суставах отсутствуют. Больные напряжены, недовольно-злобны, депрессивны, испытывают чувство безнадежности и бесперспективности.
Четвертая фаза ОАС появляется на третьи сутки с момента лишения наркотика и длится до 5–10 дней. Отличие этой фазы от предыдущей — в развитии нового симптома диспептических явлений: появляются боли в животе, а затем, по истечении несколько часов, — рвота и диарея (жидкий стул до 10–15 раз в сутки, сопровождается тенезмами).
Симптоматика тяжелого ОАС обычно представлена сильным влечением к наркотику с целью облегчить свое мучительное состояние. Резко выражены расстройства со стороны соматовегетативной сферы (интенсивные мышечные и суставные боли, мышечная гипертензия и судороги мышц, гипергидроз, озноб или чувство жара, тошнота, рвота, лабильность АД, частоты сердечных сокращений), психопатологические проявления (пониженный фон настроения с дисфорическим оттенком, тревога, чувство страха, двигательное беспокойство, бессонница). Присутствуют общая слабость, разбитость, капризность, злобность с дисфороподобными вспышками, которые, однако, быстро сходят на нет.
Несмотря на многогранность проявлений ОАС, к основным мишеням терапии при купировании острых проявлений синдрома отмены опиатов относят вегетативно-алгический симптомокомплекс и нарушения сна.
Следует помнить об аггравационных тенденциях, характерных для поведения многих больных опийной наркоманией, которым свойственно преувеличивать тяжесть собственного состояния. Обычно это объясняется рядом причин. Отметим некоторые основные моменты.
На ДГЭ врачу СМП, столкнувшемуся с проявлениями тяжелого ОАС, следует уведомить больного о необходимости лечения в условиях профильного психиатрического (наркологического) стационара. Решение о госпитализации больной опийной наркоманией принимает самостоятельно. Исключение составляют случаи, когда развившиеся осложнения угрожают жизни больного.
В. Г. Москвичев, кандидат медицинских наук
МГМСУ, ННПОСМП, Москва
Читайте также:

