Что такое интракраниальные инфекции
Обновлено: 19.04.2024
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Вирус Эпштейна–Барр: причины появления, симптомы, диагностика и способы лечения.
Вирус Эпштейна–Барр может инфицировать различные типы клеток, включая B-клетки иммунной системы (разновидность лейкоцитов – белых кровяных телец) и эпителиальные клетки слизистых оболочек.
ВЭБ является представителем ДНК-содержащих вирусов из семейства Herpesviridae (герпесвирусы), подсемейства гамма-герпесвирусов и рода лимфокриптовирусов. В процессе репликации (самокопирования) вируса экспрессируется свыше 70 различных вирусспецифических белков. В настоящее время выделены группы иммуногенных белков, определение антител к которым дает возможность дифференцировать стадию инфекции (ЕА – ранний антиген, ЕВNА-1 — ядерный антиген, VCA — капсидный антиген, LMP — латентный мембранный белок).
Другой способ заражения – контактно-бытовой (вирус передается через зубные щетки, столовые приборы, полотенца и т.д.). ВЭБ также может распространяться через кровь и сперму.
ВЭБ размножается в В-лимфоцитах и эпителиальных клетках, в связи с чем характерно многообразие клинических проявлений данной патологии. Важной отличительной чертой вируса является то, что он не тормозит и не нарушает размножение В-лимфоцитов, а, наоборот, стимулирует его. В этом заключается особенность возбудителя - он размножается в клетках иммунной системы, заставляя их клонировать свою, вирусную, ДНК.
Хронический воспалительный процесс, вызванный ВЭБ, приводит к структурным и метаболическим нарушениям пораженных тканей, что является причиной возникновения разнообразной соматической патологии.
Классификация вируса Эпштейна-Барр
Единой классификации вирусной инфекции Эпштейна-Барр (ВИЭБ) не существует, к использованию в практической медицине предлагается следующая:
- по времени инфицирования – врожденная и приобретенная;
- по форме заболевания – типичная (инфекционный мононуклеоз) и атипичная: стертая, асимптомная, с поражением внутренних органов;
- по тяжести течения – легкая, средней степени и тяжелая;
- по продолжительности течения – острая, затяжная, хроническая;
- по фазе активности – активная и неактивная;
- смешанная инфекция – чаще всего наблюдается в сочетании с цитомегаловирусом.
- Инфекционный мононуклеоз (железистая лихорадка, болезнь Филатова) – распространенное инфекционное заболевание, основными проявлениями которого является подъем температуры до высоких значений, увеличение лимфатических узлов, воспаление слизистой оболочки глотки, увеличение печени и селезенки. ВЭБ в данном случае проникает через эпителий слизистых оболочек верхних дыхательных путей.
- Лимфогранулематоз (болезнь Ходжкина) и некоторые виды неходжкинских лимфом – группа заболеваний, объединенных злокачественной моноклональной пролиферацией лимфоидных клеток в лимфоузлах, костном мозге, селезенке, печени и желудочно-кишечном тракте.
- Синдром хронической усталости – состояние, характеризующееся длительным чувством усталости, которое не проходит после продолжительного отдыха.
- Синдром Алисы в стране чудес – состояние, клиническим проявлением которого является нарушение ощущения своего тела и отдельных его частей. Человек ощущает себя или части своего тела очень большими или очень маленькими по сравнению с действительностью.
- Гепатит, спровоцированный ВЭБ, часто является осложнением инфекционного мононуклеоза. Появляется слабость, тошнота, желтушность кожи и слизистых, увеличивается печень.
- Герпетическая инфекция в виде генитального или лабиального (на губах) поражения. Также возможен стоматит, вызванный ВЭБ. При активации инфекции появляется чувство жжения и боль, а затем множество маленьких пузырьков.
- Посттрансплантационная лимфопролиферативная болезнь – вторичное злокачественное заболевание, развивающееся после трансплантации гемопоэтических стволовых клеток (метод лечения, применяемый при онкологии, заболеваниях крови и др.), ассоциированное с ВЭБ-инфекцией.
- Рассеянный склероз – хроническое аутоиммунное заболевание, при котором поражается миелиновая оболочка нервных волокон головного и спинного мозга. Характеризуется большим количеством симптомов и зависит от уровня поражения: часто снижается мышечная сила, угасают рефлексы, появляются параличи (обездвиженность) различных локализаций.
- Волосатая лейкоплакия – на слизистой оболочке языка по бокам, на спинке либо на его нижней части появляются белые участки с шероховатой поверхностью. Они безболезненны и не причиняют существенного дискомфорта. Основная опасность заключается в возможности озлокачествления измененных клеток слизистой.
- Назофарингеальная карцинома – злокачественное образование глотки. Среди его симптомов часто встречаются заложенность носа, потеря слуха, частые отиты, появление крови в слюне, кровянистые выделения из носа, увеличение лимфоузлов, головные боли.
- Аутоиммунный тиреоидит – хроническое заболевание щитовидной железы, при котором в организме образуются антитела к тканям щитовидной железы. При данном заболевании возможно появление зоба (увеличение щитовидной железы), развитие симптомов гипотиреоза: отеки, повышенная утомляемость, сонливость, запоры, сухость кожи, выпадение волос.
Лабораторное обследование включает:
-
вирус Эпштейна–Барр, определение ДНК в крови (Epstein Barr virus, DNA);

Интракраниальная патология – общий термин, охватывающий весь спектр нарушений, имеющих внутричерепную локализацию.
Интракраниальные заболевания могут не проявляться выраженной симптоматикой. В ряде случаев, они наоборот, весьма мучительны для больного. В связи с тем, что речь идёт о патологии, непосредственно относящейся к мозгу, нередко интракраниальные нарушения являются жизнеугрожающими и требуют экстренной помощи.
Последствиями интракраниальной патологии могут стать: устойчивая функциональная несостоятельность, психические отклонения, органические нарушения вплоть до инвалидизации. Тактика лечения интракраниальной патологии нередко разрабатывается с участием врачей нескольких специальностей. Направленная медикаментозная терапия и хирургические манипуляции в непосредственной близости к мозгу могут иметь нежелательные побочные эффекты и риски, поэтому план лечения зачастую утверждается на медицинском консилиуме.
2. Диагностика и классификация
Мозг является одной из наиболее закрытых и труднодоступных частей человеческого тела. Диагностика и лечение по этой причине зачастую затруднены. Современные методики позволяют проводить исследования не только путём направленного изучения внутричерепных структур и их функций (посредством МРТ, рентген диагностики, ангиографии, электроэнцефалографии, биопсии), но и косвенно уточнять диагноз в ходе исследований крови и спинномозговой жидкости, бактериологического посева, суточного мониторинга мозговой активности и внутричерепного давления.
- воспалительные и инфекционные заболевания (с первичным очагом непосредственно в тканях мозга, развившиеся вторично на фоне общесоматических инфекций или распространившиеся интракраниально от соседних тканей/органов – уха, глаз, гайморовых пазух);
- кисты и новообразования;
- механические травмы головы (в том числе родовые травмы, гематомы, сотрясение мозга);
- проблемы мозгового кровообращения (внутричерепная гипертензия, аневризмы, инсульты, стеноз);
- гипоксические нарушения;
- паразитарное инфицирование.
3. Лечение и экстренная помощь при интракраниальной патологии
- психневролог;
- нейрохирург;
- травматолог;
- онколог;
- инфекционист;
- паразитолог;
- ангиохирург.
По результатам всесторонней диагностики выясняется, какой тип интракраниальной патологии провоцирует имеющуюся симптоматику. Нередко в ходе обследования выявляются скрытые или перенесённые внутричерепные нарушения. Вероятность такой случайной диагностики по статистике составляет около 2%.
Больной переходит под наблюдение конкретного профильного специалиста, который разрабатывает тактику лечения, проводит динамический контроль её эффективности, делает прогноз на излечение.
- медикаментозную терапию;
- хирургическое лечение;
- лазерную терапию;
- физиопроцедуры;
- психологическую помощь;
- реабилитационные мероприятия;
- санаторно-курортное лечение;
- меры профилактики рецидивов заболевания.
Экстренная помощь необходима при открытых ранах, родовых травмах, остром нарушении мозгового кровообращения, отёках, инсультах, сотрясении мозга. Её оказывают врачи неотложной помощи, реаниматологи, хирурги, анестезиологи.
- потеря сознания;
- потеря памяти;
- спутанность сознания;
- нарушения речи;
- параличи;
- судороги;
- рвота;
- нарушения дыхательной и сердечной деятельности;
- отсутствие или нарушение рефлексов;
- потеря зрения, слуха.
Хирургическая помощь при интракраниальной патологии может быть плановой или экстренной. По плану оперативное лечение проводится в случае неэффективности терапии. Однако препятствием для операции может стать риск осложнений из-за близости жизненно важных мозговых центров. Кроме того, операция может быть невозможна по причине затруднённого доступа. Хирургическое лечение проводится малоинвазивно, либо требуется трепанации черепа.
Риногенные внутричерепные осложнения – это группа заболеваний, развивающихся при распространении инфекции из первичного очага в придаточных синусах или полости носа внутрь черепной коробки. Клинические проявления зависят от конкретной патологии, могут включать в себя интоксикационный, менингеальный, очаговый, оптохиазмальный, гипертензивный и общемозговой синдромы. Диагностика основывается на данных анамнеза и результатах физикального осмотра, люмбальной пункции, общего анализа крови, бактериального посева, ЭХО-ЭГ, МРТ, КТ. Лечение подразумевает санацию очага инфекции, антибактериальную и патогенетическую фармакотерапию.
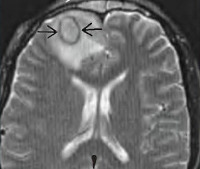
Общие сведения
Риногенные внутричерепные осложнения – достаточно редкие состояния в современной отоларингологии, что связано с широким использованием антибиотиков в медицинской практике. Согласно статистическим данным, они встречаются в 12-15 раз реже аналогичных патологий отогенного происхождения. Более чем в 70% интракраниальные осложнения возникают при обострениях хронических синуситов, и только у 1/4 больных – на фоне острых процессов. В 55-60% случаях источником инфекции является лобная пазуха, решетчатый и верхнечелюстной синусы – в 20-25% и 15-20% случаях соответственно. Чаще всего бактериальные осложнения наблюдаются среди лиц в возрасте от 11 до 35 лет. Соотношение частоты развития риногенных осложнений у мужчин и женщин составляет 2:1.

Причины риногенных внутричерепных осложнений
Основная причина развития этой группы заболеваний – распространение бактериальной микрофлоры из полости носа и/или придаточных синусов внутрь полости черепа. В качестве возбудителя обычно выступают стрептококки и стафилококки, реже – пневмококки, фузоспириллы, анаэробная микрофлора. Зачастую внутричерепные осложнения возникают в результате следующих состояний и процессов:
- Воспаление носовой полости и придаточных синусов. Сюда относятся острые респираторные вирусные инфекции, которые приводят к острым ринитам, гайморитам, фронтитам, этмоидитам и сфеноидитам или обострению хронических форм перечисленных заболеваний. Второй вариант – наиболее частая причина формирования септических осложнений. Реже в роли пусковых факторов выступают специфические инфекционные заболевания: скарлатина, корь, краснуха и другие.
- Гнойные заболевания области носа. Бактериальные процессы в зоне внутричерепных структур могут развиваться на фоне абсцесса носовой перегородки, фурункулов и карбункулов наружного носа и т. д.
- Травматические повреждения. Сюда входят тяжелые открытые травмы, огнестрельные повреждения полостей носа и синусов с формированием проникающего отверстия в черепной коробке, реже – переломы основания черепа. Изредка причиной генерализации инфекции становятся проведенные хирургические вмешательства в этой области.
Отдельно выделяют предрасполагающие факторы, на фоне которых возрастает вероятность распространения инфекции в мозговые структуры. К ним относятся общее переохлаждение, врожденные аномалии развития лицевого черепа, иммунодефицитные состояния – ВИЧ-инфекция, раковые заболевания, онкогематологические патологии.
Патогенез
В основе механизма развития риногенных внутричерепных осложнений лежит проникновение гноеродных бактерий из первичного инфекционного очага к мозговым оболочкам. Больное значение в формировании осложнений имеет проходимость естественных отверстий околоносовых пазух. При нарушении дренирования в синусах создаются благоприятные условия для размножения бактериальной микрофлоры и ее проникновения внутрь черепной полости гематогенным, контактным или лимфогенным путем.
Образование прямого соустья между первичным очагом инфекции и полостью черепа считается наиболее распространенным механизмом. Важную роль в этом играют анатомо-физиологические особенности, непосредственная близость параназальных синусов и передней черепной ямки. Гематогенный механизм передачи характеризуется проникновением инфекционных агентов к тканям головного мозга через вены или периваскулярные пространства. Лимфогенный путь распространения реализуется за счет лимфатических сосудов и наличия анастомозов между периневральными и эпиневральными оболочками обонятельного нерва.
Классификация
К риногенным внутричерепным осложнениям относятся:
- Арахноидит. Это воспаление паутинной оболочки головного мозга, зачастую – в зоне средней черепной ямки. Развивается при воспалении верхнечелюстных пазух. Клинически преимущественно проявляется оптохиазмальным синдромом.
- Менингит. Представляет собой гнойное либо серозное воспаление оболочек головного мозга. Диагностируется при фронтитах и этмоидитах. Характеризуется односторонними очаговыми и менингеальными симптомами, синдромом повышения внутричерепного давления.
- Абсцессы головного мозга. В эту группу относятся экстрадуральный и субдуральный абсцессы, которые представляют собой очаги гнойного воспаления твердой мозговой оболочки. Возникают при фронтитах, реже – этмиодитах. В клинике превалируют общемозговые признаки. Очаговая симптоматика наблюдается редко и на поздних этапах развития.
- Тромбоз пещеристой пазухи. Это патология, которая проявляется образованием тромбов в полости венозного синуса или его полной закупоркой тромботическими массами. Обычно выступает в качестве осложнений этмоидитов, сфеноидитов, гайморитов. Клинически характеризуется общими неврологическими и офтальмологическими признаками.
Симптомы риногенных внутричерепных осложнений
У основной массы больных первичным проявлением при всех вариантах внутричерепных осложнений становится резкое обострение общего интоксикационного синдрома. Это проявляется резким повышением температуры тела до 39,5-41,0° C, ознобом, выраженной слабостью, недомоганием, учащением пульса и дыхания, спутанностью сознания. Также для многих риногенных поражений головного мозга характерны общемозговые симптомы: ярко выраженная диффузная головная боль, головокружение, тошнота, не приносящая облегчения рвота, лабильность настроения, генерализованные судороги и нарушения сознания – сомноленция, сопор или кома.
Оптохиазмальный синдром преимущественно проявляется зрительными нарушениями. У больных выявляется прогрессирующее ухудшение зрения, возникновение центральных скотом, ухудшение цветового восприятия и концентрическое сужение зрительных полей. Головная боль наиболее выражена в лобной и затылочной областях, имеет жгучий, давящий характер. Несколько реже обнаруживается опущение век, косоглазие, диплопия, экзофтальм, гипосмия, обонятельные галлюцинации.
Диагностика
Состояние пациентов с риногенными внутричерепными осложнениями зачастую тяжелое и нестабильное, поэтому диагностика должна осуществляться в сжатые сроки. Диагноз выставляется отоларингологом совместно с анестезиологом-реаниматологом, неврологом или нейрохирургом. Основными диагностическими критериями являются анамнестические сведения и результаты объективных исследований. Полная программа обследования включает:
- Сбор анамнеза, жалоб. При опросе больного или родственников определяется связь между перенесенными острыми ринитами или синуситами, обострениями хронических вариантов этих патологий, другими потенциальными этиологическими факторами и текущим состоянием. При выяснении имеющихся жалоб и последовательности их развития устанавливается характер и локализация поражений структур головного мозга.
- Объективный осмотр. При физикальном исследовании отмечаются позитивные менингеальные симптомы Кернига и Брудзинского, гипертонус затылочных мышц, специфическая поза и др. Если пациент в сознании, специалисты обращают внимание на работу всех анализаторов, ясность сознания и адекватность поведения.
- Общий анализ крови. В ОАК определяется высокий лейкоцитоз в пределах 11-15´10 9 /л со смещением лейкоцитарной формулы влево, увеличение СОЭ, анэозинофилия, диспротеинемия с повышением уровня a1-, a2-, g-глобулинов.
- Люмбальная пункция. При воспалительных поражениях центральной нервной системы спинномозговая жидкость становится мутной или беловатой, вытекает под большим давлением. При ее микроскопическом исследовании обнаруживается нейтрофильный плеоцитоз до 1,5 тыс. клеток на 1 мкл, повышенное содержание белка и низкий уровень глюкозы.
- Бактериологическое исследование. Для бактериального посева используется материал, взятый из носоглотки, кровь и спинномозговая жидкость, которые высеваются на питательные среды. Это позволяет определить характер патогенной микрофлоры, ее чувствительность к различным группам антибиотиков.
- ЭХО-энцефалография. Методика дает возможность выявить внутримозговую гипертензию, тромбоз пещеристого синуса, наличие ограниченных скоплений гнойных масс (абсцессы). Зачастую используется как метод предварительного исследования перед проведением КТ или МРТ, а при наличии противопоказаний к последним – заменяет их.
- Лучевые методы визуализации. Выполняется КТ лицевого скелета, КТ и МРТ головного мозга. Первая методика позволяет визуализировать горизонтальный уровень гнойных масс в околоносовых синусах, гнойное расплавление костных стенок их полостей. Магнитно-резонансная томография отображает воспалительные изменения мозговых оболочек, наличие абсцессов, их точную локализацию и размеры. КТ головного мозга с контрастным усилением при синустромбозе визуализирует дефект наполнения, общую деформацию и расширение полости синуса.
Лечение риногенных внутричерепных осложнений
Лечение риногенных внутричерепных осложнений проводится в экстренном порядке в условиях неврологического, нейрохирургического отделения или блока интенсивной терапии. Используется комплексный подход, включающий как хирургическое вмешательство, так и фармакотерапию. Терапевтическая схема выглядит следующим образом:
- Оперативное лечение. Осуществляется немедленно или сразу после стабилизации состояния больного. Суть хирургических вмешательств заключается в санации первичного очага инфекции, дренировании сформировавшихся абсцессов головного мозга, удалении тромботических масс из венозной пазухи.
- Антибиотикотерапия. Проводится при любом из внутричерепных осложнений риногенного происхождения. Предпочтение отдается препаратам широкого спектра действия, проникающим через гематоэнцефалический барьер, которые назначаются в субмаксимальных или максимальных дозах. Применяются цефалоспорины II-III поколения, некоторые аминопенициллины и аминогликозиды, гликопептиды, фторхинолоны. После получения результатов бактериологического исследования используются медикаменты, к которым высеянная флора проявляет наибольшую чувствительность.
- Патогенетическая фармакотерапия. Включает проведение дезинтоксикационной и дегидратационной терапии, назначение противовоспалительных препаратов, коррекцию водно-электролитного баланса, поддержание нормального уровня артериального давления, вспомогательную витаминотерапию и иммунокоррекцию. При синустромбозе показано использование антикоагулянтов.
Прогноз и профилактика
Прогноз при риногенных внутричерепных осложнениях всегда серьезный. Исход напрямую о пределяется быстротой и полноценностью оказания медицинской помощи. При современной диагностике и правильно выбранной терапевтической тактике средняя летальность для всех форм составляет около 6-12%. Самый высокий показатель летальности наблюдается при гнойном менингите и его сочетании с тромбофлебитом пещеристого синуса. Профилактика интракраниальных осложнений подразумевает полноценное лечение хронических синуситов, ринитов и абсцессов носовой области, предотвращение челюстно-лицевых травм, переломов основания черепа, общих переохлаждений, коррекцию иммунодефицитных состояний.
Внутриутробные инфекции – группа заболеваний плода и новорожденного, развивающихся вследствие заражения в дородовом периоде или в родах. Внутриутробные инфекции могут приводить к гибели плода, самопроизвольному аборту, задержке внутриутробного развития, преждевременным родам, формированию врожденных пороков, поражению внутренних органов и ЦНС. Методы диагностики внутриутробных инфекций включают микроскопические, культуральные, иммуноферментные, молекулярно-биологические исследования. Лечение внутриутробных инфекций проводится с использованием иммуноглобулинов, иммуномодуляторов, противовирусных, антибактериальных препаратов.

Общие сведения
Внутриутробные инфекции – патологические процессы и заболевания, обусловленные антенатальным и интранатальным инфицированием плода. Истинная распространенность внутриутробных инфекций не установлена, однако, согласно обобщенным данным, с врожденными инфекциями рождается не менее 10% новорожденных. Актуальность проблемы внутриутробных инфекций в педиатрии обусловлена высокими репродуктивными потерями, ранней неонатальной заболеваемостью, приводящей к инвалидизации и постнатальной гибели детей. Вопросы профилактики внутриутробных инфекций лежат в плоскости рассмотрения акушерства и гинекологии, неонатологии, педиатрии.

Причины внутриутробных инфекций
Внутриутробные инфекции развиваются в результате инфицирования плода в дородовом периоде или непосредственно во время родов. Обычно источником внутриутробной инфекции для ребенка выступает мать, т. е. имеет место вертикальный механизм передачи, который в антенатальном периоде реализуется трансплацентарным или восходящим (через инфицированные околоплодные воды) путями, а в интранатальном - аспирационным или контактным путями.
Реже происходит ятрогенное инфицирование плода в период беременности при проведении женщине инвазивной пренатальной диагностики (амниоцентеза, кордоцентеза, биопсии ворсин хориона), введении плоду препаратов крови через сосуды пуповины (плазмы, эритроцитарной массы, иммуноглобулинов) и т. д.
В антенатальном периоде инфицирование плода обычно связано с вирусными агентами (вирусами краснухи, герпеса, цитомегалии, гепатита В и С, Коксаки, ВИЧ) и внутриклеточными возбудителями (токсоплазмоза, микоплазмоза).
В интранатальном периоде чаще происходит микробная контаминация, характер и степень которой зависит от микробного пейзажа родовых путей матери. Среди бактериальных агентов наиболее распространены энтеробактерии, стрептококки группы В, гонококки, синегнойная палочки, протей, клебсиелла и др. Плацентарный барьер непроницаем для большинства бактерий и простейших, однако при повреждении плаценты и развитии фетоплацентарной недостаточности, может произойти антенатальное микробное инфицирование (например, возбудителем сифилиса). Кроме этого, не исключается и интранатальное вирусное заражение.
Факторами возникновения внутриутробных инфекций служат отягощенный акушерско-гинекологический анамнез матери (неспецифические кольпиты, эндоцервициты, ЗППП, сальпингофориты), неблагополучное течение беременности (угроза прерывания, гестозы, преждевременная отслойка плаценты) и инфекционная заболеваемость беременной. Риск развития манифестной формы внутриутробной инфекции существенно выше у недоношенных детей и в том случае, когда женщина инфицируется первично во время беременности.
Известно, что тяжесть проявлений инфекционного процесса у беременной и у плода может не совпадать. Бессимптомное или малосимптомное течение инфекции и у матери может вызвать тяжелые поражения плода, вплоть до его гибели. Это связано с повышенным тропизмом вирусных и микробных возбудителей к эмбриональным тканям, преимущественно ЦНС, сердца, органа зрения.
Классификация
Этиологическая структура внутриутробных инфекций предполагает их деление на:
- вирусные (вирусный гепатит, герпес, краснуха, ОРВИ, цитомегалия, эпидемический паротит, энтеровирусная инфекция)
- бактериальные (туберкулез, сифилис, листериоз, сепсис)
- паразитарные и грибковые (микоплазмоз, токсоплазмоз, хламидиоз, кандидоз и др.)
Для обозначения группы наиболее распространенных внутриутробных инфекций используется аббревиатура TORCH-синдром, объединяющий токсоплазмоз (toxoplasmosis), краснуху (rubella), цитомегалию (cytomegalovirus), герпес (herpes simplex). Буквой О (other) обозначаются другие инфекции, в числе которых - вирусные гепатиты, ВИЧ-инфекция, ветряная оспа, листериоз, микоплазмоз, сифилис, хламидиоз и др.).
Симптомы внутриутробных инфекций
Наличие внутриутробной инфекции у новорожденного может быть заподозрено уже во время родов. В пользу внутриутробного инфицирования может свидетельствовать излитие мутных околоплодных вод, загрязненных меконием и имеющих неприятный запах, состояние плаценты (полнокровие, микротробозы, микронекрозы). Дети с внутриутробной инфекцией часто рождаются в состоянии асфиксии, с пренатальной гипотрофией, увеличенной печенью, пороками развития или стигмами дисэмбриогенеза, микроцефалией, гидроцефалией. С первых дней жизни у них отмечается желтуха, элементы пиодермии, розеолезных или везикулезных высыпаний на коже, лихорадка, судорожный синдром, респиратрные и кардиоваскулярные расстройства.
Ранний неонатальный период при внутриутробных инфекциях нередко отягощается интерстициальной пневмонией, омфалитом, миокардитом или кардитом, анемией, кератоконъюнктивитом, хориоретинитом, геморрагическим синдромом и др. При инструментальном обследовании у новорожденных могут обнаруживаться врожденная катаракта, глаукома, врожденные пороки сердца, кисты и кальцификаты мозга.
В перинатальном периоде у ребенка отмечаются частые и обильные срыгивания, мышечная гипотония, синдром угнетения ЦНС, серый цвет кожных покровов. В поздние сроки при длительном инкубационном периоде внутриутробной инфекции возможно развитие поздних менингитов, энцефалитов, остеомиелита.
Рассмотрим проявления основных внутриутробных инфекций, составляющих TORCH-синдром.
Врождённый токсоплазмоз
Внутриутробное инфицирование одноклеточным протозойным паразитом Toxoplasma Gondii приводит к тяжелым поражениям плода – задержке развития, врожденным порокам развития мозга, глаз, сердца, скелета.
После рождения в остром периоде внутриутробная инфекция проявляется лихорадкой, желтухой, отечным синдромом, экзантемой, геморрагиями, диареей, судорогами, гепатоспленомегалией, миокардитом, нефритом, пневмонией. При подостром течении доминирую признаки менингита или энцефалита. При хронической персистенции развивается гидроцефалия с микроцефалией, иридоциклит, косоглазие, атрофия зрительных нервов. Иногда встречаются моносимптомные и латентные формы внутриутробной инфекции.
К числу поздних осложнений врожденного токсоплазмоза относятся олигофрения, эпилепсия, слепота.
Врождённая краснуха
Внутриутробная инфекция возникает из-за заболевания краснухой при беременности. Вероятность и последствия инфицирования плода зависят от гестационного срока: в первые 8 недель риск достигает 80%; последствиями внутриутробной инфекции могут служить самопроизвольное прерывание беременности, эмбрио- и фетопатии. Во II триместре риск внутриутробного инфицирования составляет 10-20%, в III – 3-8%.
Дети с внутриутробной инфекцией обычно рождаются недоношенными или с низкой массой тела. Для периода новорожденности характерна геморрагическая сыпь, длительная желтуха.
Классические проявления врожденной краснухи представлены триадой Грега: поражением глаз (микрофтальмией, катарактой, глаукомой, хориоретинитом), ВПС (открытым артериальным протоком, ДМПП, ДМЖП, стенозом легочной артерии), поражением слухового нерва (сенсоневральной глухотой). В случае развития внутриутробной инфекции во второй половине беременности у ребенка обычно имеется ретинопатия и глухота.
Кроме основных проявлений врожденной краснухи, у ребенка могут выявляться и другие аномалии: микроцефалия, гидроцефалия, расщелины нёба, гепатит, гепатоспленомегалия, пороки развития мочеполовой системы и скелета. В дальнейшем внутриутробная инфекция напоминает о себе отставанием ребенка в физическом развитии, ЗПР или умственной отсталостью.
Врождённая цитомегалия
Внутриутробное заражение цитомегаловирусной инфекцией может приводить к локальному или генерализованному поражению многих органов, иммунодефициту, гнойно-септическим осложнениям. Врожденные дефекты развития обычно включают микроцефалию, микрогирию, микрофтальмию, ретинопатию, катаракту, ВПС и др. Неонатальный период врожденной цитомегалии осложняется желтухой, геморрагическим синдромом, двусторонней пневмонией, интерстициальным нефритом, анемией.
К отдаленным последствиям внутриутробной инфекции относятся слепота, нейросенсорная глухота, энцефалопатия, цирроз печени, пневмосклероз.
Врождённая герпетическая инфекция
Внутриутробная герпес-инфекция может протекать в генерализованной (50%), неврологической (20%), слизисто-кожной форме (20%).
Генерализованная внутриутробная врожденная герпетическая инфекция протекает с выраженным токсикозом, респираторным дистресс-синдромом, гепатомегалией, желтухой, пневмонией, тромбоцитопенией, геморрагическим синдромом. Неврологическая форма врожденного герпеса клинически проявляется энцефалитом и менингоэнцефалитом. Внутриутробная герпес-инфекция с развитием кожного синдрома сопровождается появлением везикулярной сыпи на кожных покровах и слизистых оболочках, в т. ч. внутренних органов. При наслоении бактериальной инфекции развивается сепсис новорожденных.
Внутриутробная герпес-инфекция у ребенка может приводить к формированию пороков развития - микроцефалии, ретинопатии, гипоплазии конечностей (кортикальной карликовости). В числе поздних осложнений врожденного герпеса - энцефалопатия, глухота, слепота, задержка психомоторного развития.
Диагностика
В настоящее время актуальной задачей является пренатальная диагностика внутриутробных инфекций. С этой целью на ранних сроках беременности проводится микроскопия мазка, бактериологический посев из влагалища на флору, ПЦР-исследование соскоба, обследование на TORCH-комплекс. Беременным из группы высокого риска по развитию внутриутробной инфекции показана инвазивная пренатальная диагностика (аспирация ворсин хориона, амниоцентез с исследованием амниотической жидкости, кордоцентез с исследованием пуповинной крови).
Возможно выявление эхографических маркеров внутриутробных инфекций с помощью акушерского УЗИ. К косвенным эхографическим признакам внутриутробного инфицирования относятся маловодие или многоводие; наличие гиперэхогенной взвеси в околоплодных водах или амниотических тяжей; гипоплазия ворсин хориона, плацентит; преждевременное старение плаценты; отечный синдром плода (асцит, перикардит, плеврит), гепатоспленомегалия, кальцификаты и пороки развития внутренних органов и др. В процессе допплерографического исследования кровотока выявляются нарушения плодово-плацентарного кровотока. Кардиотокография обнаруживает признаки гипоксии плода.
После рождения ребенка с целью достоверной верификации этиологии внутриутробной инфекции используются микробиологические (вирусологические, бактериологические), молекулярно-биологические (ДНК-гибридизация, ПЦР), серологические (ИФА) методики обследования. Важное диагностическое значение имеет гистологическое исследование плаценты.
По показаниям новорожденные с внутриутробными инфекциями в первые сутки жизни должны быть осмотрены детским неврологом, детским кардиологом, детским офтальмологом и др. специалистами. Целесообразно провести ЭхоКГ, нейросонографию, офтальмоскопию, исследование слуха методом вызванной отоакустической эмиссии.
Лечение внутриутробных инфекций
Общие принципы лечения внутриутробных инфекций предполагают проведение иммунотерапии, противовирусной, антибактериальной и посиндромной терапии.
Иммунотерапия включает применение поливалентных и специфических иммуноглобулинов, иммуномодуляторов (интерферонов). Противовирусная терапия направленного действия осуществляется, главным образом, ацикловиром. Для противомикробной терапии бактериальных внутриутробных инфекций используются антибиотики широкого спектра действия (цефалоспорины, аминогликозиды, карбапенемы), при микоплазменной и хламидийной инфекциях – макролиды.
Посиндромная терапия внутриутробных инфекций направлена на купирование отдельных проявлений перинатального поражения ЦНС, геморрагического синдрома, гепатита, миокардита, пневмонии и т. д.
Прогноз и профилактика
При генерализованных формах внутриутробных инфекций летальность в неонатальном периоде достигает 80%. При локальных формах возникают серьезные поражения внутренних органов (кардиомиопатии, ХОБЛ, интерстициальный нефрит, хронический гепатит, цирроз и т. д.). Практически во всех случаях внутриутробные инфекции приводят к поражению ЦНС.
Профилактика внутриутробных инфекций заключается в проведении предгравидарной подготовки, лечении ЗППП до наступления беременности, исключении контактов беременной с инфекционными больными, коррекции программы ведения беременности у женщин групп риска. Женщины, ранее не болевшие краснухой и не получавшие прививки против краснухи, должны быть вакцинированы не позднее, чем за 3 месяца до предполагаемой беременности. В ряде случаев внутриутробные инфекции могут являться основанием для искусственного прерывания беременности.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Сепсис: причины появления, симптомы, диагностика и способы лечения.
Определение
Сепсис – это патологический процесс, в основе которого лежит реакция организма в виде генерализованного воспаления на инфекцию различной природы. При сепсисе бактерии преодолевают иммунную защиту человека и распространяются из очага воспаления по всему организму. Местное воспаление, сепсис, тяжелый сепсис и септический шок – это различные формы выраженности воспалительной реакции организма на инфекционный процесс.

Истинная частота возникновения случаев сепсиса остается неизвестной, однако по оценкам исследователей, во всем мире сепсис является лидирующей причиной летальности у пациентов в критическом состоянии. Согласно результатам большого европейского исследования SOAP, включившего 3147 пациентов из 198 европейских медицинских центров, сепсис развился в 37,4% случаев, а госпитальная летальность от него колебалась от 14% случаев в Швейцарии до 41% в Португалии, в среднем составив 24,1%. Данные другого крупного исследования PROGRES (12 881 больной тяжелым сепсисом в 37 странах) показали, что госпитальная летальность в среднем составила 49,6%.
Причины возникновения сепсиса
Возбудителями сепсиса могут быть бактерии, вирусы или грибы. Но чаще сепсис имеет бактериальную природу - его причиной становятся стафилококки, стрептококки, пневмококки, менингококки, сальмонеллы, синегнойная палочка и др.
В большинстве случаев патологический процесс вызывают условно-патогенные микроорганизмы, которые присутствуют на коже, слизистых оболочках дыхательного и пищеварительного трактов, мочевыводящих путей и половых органов. Иногда при сепсисе выделяют сразу 2-3 микроорганизма.
Причиной сепсиса могут стать гнойно-воспалительные заболевания кожи (абсцессы, фурункулы, флегмоны), обширные травмы, ожоги, инфекционно-воспалительные заболевания мочевыводящей системы (пиелонефрит), живота (например, гнойно-некротический деструктивный панкреатит), тяжелая ангина, гнойный отит, пневмония, инфицирование во время родов или абортов и др.

Возможность возникновения сепсиса зависит не только от свойств возбудителя, но и от состояния иммунной системы человека - нарушения в ее работе предрасполагают к распространению инфекции. Причинами таких нарушений могут быть врожденные дефекты иммунитета, хронические инфекционные болезни (ВИЧ, гнойные процессы), эндокринные заболевания (сахарный диабет), онкологические болезни, хронические интоксикации (алкоголизм, наркомания), проникающая радиация, прием иммуносупрессоров (кортикостероидов, цитостатиков) и др.
В ответ на внедрение возбудителя вырабатываются цитокины – особые белковые молекулы, которые выполняют защитные функции сначала на местном уровне, а затем, попадая в системный кровоток, продолжают работать уже на уровне всего организма. Цитокины бывают провоспалительными и противовоспалительными. В самом начале инфекционного процесса их количество находится в равновесии. Если регулирующие системы организма не способны поддерживать это равновесие, то цитокины накапливаются в кровотоке в сверхвысоких объемах, начинают доминировать их деструктивные, разрушающие эффекты, в результате повреждается сосудистая стенка, запускается синдром диссеминированного внутрисосудистого свертывания (ДВС-синдром) и полиорганная дисфункция. Вследствие полиорганной дисфункции печени, почек, кишечника появляются новые повреждающие факторы (лактат, мочевина, билирубин и др.), которые усиливают деструктивные процессы. При ДВС-синдроме в сосудах микроциркуляторного русла образуются множественные тромбы в сочетании с несвёртываемостью крови, приводящей к множественным кровоизлияниям.
Классификация заболевания
В зависимости от локализации входных ворот и первичного очага сепсис подразделяют на:
- перкутанный (чрескожный) – развивается при попадании возбудителя в организм через поврежденный кожный покров (ранки, царапины, фурункулы и др.);
- акушерско-гинекологический – развивается после родов и абортов;
- оральный (одонтогенный и тонзиллогенный) – развивается в результате первичной инфекции в полости рта;
- оториногенный – развивается в результате распространения инфекции из полости уха и/или носа;
- пневмогенный – при наличии инфекционного очага в нижних дыхательных путях;
- хирургический;
- урологический;
- пупочный – развивается у новорожденных вследствие проникновения инфекционных агентов в кровь через пупочную ранку;
- криптогенный (идиопатический, эссенциальный, генуинный) – сепсис неизвестного происхождения: первичный очаг гнойного воспаления неизвестен.
- молниеносный сепсис,
- острый сепсис,
- подострый сепсис,
- хронический сепсис (хрониосепсис).
По клиническим признакам:
1. Синдром системного воспалительного ответа (ССВО) – системная реакция организма на воздействие различных сильных раздражителей (инфекции, травмы, операции и др.) характеризуется двумя или более признаками:
- температура тела ≥ 38°С или ≤ 36°С;
- частота сердечных сокращений (ЧСС) ≥ 90 ударов в минуту;
- частота дыхания (ЧД) > 20 в минуту или гипервентиляция (РаСО2 ≤ 32 мм рт. ст.);
- лейкоциты крови > 12х109 /л или < 4х109 /л, или незрелых форм >10%.
По виду и характеру возбудителя:
- аэробный сепсис,
- анаэробный сепсис,
- смешанный сепсис,
- грибковый сепсис,
- вирусный сепсис.
Клинические проявления сепсиса могут варьировать от незначительных до критических. При молниеносном течении патологическое состояние развивается бурно - за несколько часов или суток. При остром сепсисе симптомы развиваются за несколько дней. Для хрониосепсиса характерно вялое течение и наличие малозаметных изменений, формирующихся месяцами. Рецидивирующий сепсис протекает с эпизодами обострений и затуханий.
Инкубационный период после выявления ворот инфекции или первичного очага составляет от 1 до 3-5 суток. Начало сепсиса, как правило, острое, хотя иногда может быть подострым или постепенным. Интоксикация проявляется резкой слабостью, адинамией, анорексией, нарушением сна, головной болью, расстройством сознания, менингеальным синдромом (поражением оболочек головного и спинного мозга), тахикардией, артериальной гипотензией. Температура тела держится высокой, со скачками утром и вечером. Признаки интоксикации особенно выражены на высоте лихорадки. На коже у трети больных появляется геморрагическая сыпь.
Со стороны дыхательной системы наблюдаются одышка и хрипы в легких. При нарушении функции почек снижается количество выделяемой мочи (олигурия) вплоть до полного прекращения мочеиспускания (анурия), в моче появляются следы крови, гноя. Наблюдается ухудшение функции печени с развитием желтухи и явлениями гепатита, увеличивается селезенка. Повреждение органов ЖКТ проявляется нарушением пищеварения, отсутствием аппетита, язык сухой, обложенный, нередко наблюдаются упорные септические поносы, тошнота и рвота. Метастазирование возбудителя из первичного очага с образованием вторичных очагов инфекции может приводить к инфаркту легкого, гангрене легкого, гнойному плевриту, эндокардиту (поражению внутренней оболочки сердца), воспалению сердечной мышцы (миокардиту), воспалению околосердечной сумки (перикардиту), гнойному циститу, абсцессам мозга и воспалению оболочек мозга (гнойному менингиту), гнойным артритам, флегмонам и абсцессам в мышцах.
Недостаточность функции одного органа длительностью более суток сопровождается летальностью до 35%, при недостаточности двух органов – 55%, при недостаточности функции трех и более органов летальность к четвертому дню возрастает до 85%.
Производят посевы крови, мочи, ликвора, мокроты, гнойного экссудата из элементов сыпи, абсцессов, пунктатов плевры, суставов и других септических очагов. Посевы делают многократно, чтобы определить чувствительность к максимальному количеству антибиотиков. Используется также обнаружение антигенов в крови методом ИФА и определение генома возбудителя методом ПЦР.
Одним из наиболее специфичных и чувствительных маркеров бактериальной инфекции служит прокальцитониновый тест. Прокальцитонин – один из основных маркёров системного воспаления, вызванного бактериями.
Синонимы: Анализ крови на прокальцитонин; ПКТ. Procalcitonin; PCT. Краткая характеристика определяемого вещества Прокальцитонин Прокальцитонин является прогормоном кальцитонина, состоящим из 116 аминокислот с молекулярной массой 14,5 кDa. Биосинтез прокальцитонина в физиологических условиях прои.
Читайте также:

