Что такое клостридиальное отравление
Обновлено: 24.04.2024
Широкое применение антибиотиков в России в течение 2020 (не в последнюю очередь обусловленное пандемией вируса SARS-Cov-2) привело к тому, что врачи-гастроэнтерологи стали чаще встречаться с такими осложнениями антибиотикотерапии как антибиотик-ассоциированные диареи и колиты. Одной из наиболее частых причин этих нарушений ―15-25% случаев ― является инфекция Clostridium difficile (по новой классификации Clostridiodes difficile).
Clostridium difficile (C.difficile) представляет собой споропродуцирующую бактерию, впервые описанную в 1935 году. Она вызывает широкий спектр желудочно-кишечных нарушений: от бессимптомного носительства до крайне тяжелого (фульминантного) колита. Споры бактерий, попав в желудочно-кишечный тракт здорового человека, пройдут транзитом, не вызывая никаких изменений. У части здоровых лиц бактерия может выявляться в образцах стула, опять же не проявляясь симптомами. У людей, имеющих факторы риска, споры прорастают, что приводит к образованию вегетативных форм C.difficile. Часть бактерий способны продуцировать токсины, что приводит к развитию заболевания.
Некоторые эпидемиологические данные.
- Заболеваемость C.difficile в США составляет 500-700 тыс. новых случаев ежегодно, при этом смертность от тяжелых форм достигает 15-20 тыс.случаев в год.
- C.difficile является основной причиной внутрибольничных диарей в США и других развитых странах
- В Европе и США 20-27% случаев клостридиальной инфекции ― внебольничные, т.е. возникшие на амбулаторном этапе. Из них почти треть эпизодов заболевания не имели указания на терапию антибиотиками в течение предшествующих 12 недель
- Частота бессимптомного носительства C.difficile у здоровых лиц 2-8%, у госпитализированных пациентов ― до 20%.
Факторы риска развития заболеваний, вызванных C.difficile.
1) Терапия антибиотиками в течение 8 недель до начала появления кишечных симптомов. Антибиотикотерапия увеличивает риск развития инфекции в 8 раз.
2) Возраст старше 65 лет (для амбулаторных пациентов риск ниже, чем для госпитализированных)
3) Стационарное лечение более 4 недель (и нахождение в учреждениях длительного ухода, хосписах). Каждая неделя пребывания в стационаре увеличивает риск инфицирования на 8%. Нахождение в отделении интенсивной терапии увеличивает риск в 2 раза.
4) Химиотерапия и применение иммуносупрессоров
5) Прием препаратов из группы ингибиторов протонной помпы (риск возрастает в 2,9-3,6 раза)
6) Сопутствующие заболевания (хроническая болезнь почек, в том числе требующая проведения диализа, инсульт, сахарный диабет, хроническая сердечная недостаточность, алкоголизм, хроническая обструктивная болезнь легких, недостаточность питания, ВИЧ-инфекция, онкопатология, воспалительные заболевания кишечника и т.д.) и состояния (беременность).
Как видим, на первом месте среди факторов риска развития клостридиальной инфекции находятся антибиотики. Именно антибиотик-ассоциированные нарушения, вызванные C.difficile, чаще всего встречаются в практике гастроэнтеролога. Все антибиотики по риску развития инфекции C.difficile делятся на три группы:
1) высокий риск ― фторхинолоны (ципрофлоксацин и т.д.), цефалоспорины 2 и 3 поколений, клиндамицин, ампициллин, пенициллины широкого спектра действия с клавулановой кислотой;
2) умеренный риск ― макролиды, триметоприм/сульфаметоксазол, сульфаниламиды, другие пенициллины;
3) низкий риск ― аминогликозиды, бацитрацин, метронидазол, тейкопланин, ванкомицин, рифампицин, хлорамфеникол, тетрациклин, карбапенемы, даптомицин, тигециклин.
Пути заражения и патогенез.
C.difficile широко распространена в окружающей среде и передается фекально-оральным путем. Как уже говорилось выше, бактерия образует споры, которые в неактивном виде долго сохраняются в окружающей среде. Устойчивость спор к высоким температурам, ультрафиолетовому излучению и антибиотикам делает бактерии очень жизнеспособными.
Споры могут сохраняться в желудочно-кишечном тракте человека и быть причиной рецидива инфекции C.difficile после успешного лечения.
Вспышки инфекций в стационарах обусловлены передачей спор через руки медицинского персонала или ухаживающих лиц (в том числе родственников). Споры C.difficile найдены в палатах половины инфицированных лиц.
Патогенность C.difficile обусловлена наличием двух токсинов ― токсин А и токсин В. Бактерии, которые токсины не продуцируют, не вызывают развитие болезни. Часть бактерий продуцирует только токсин В, некоторые ― оба токсина. В последние годы описаны штаммы бактерий, которые могут также выделять двойной токсин (CDT).
После попадания спор в желудочно-кишечный тракт человека, они прорастают с образованием вегетативных форм бактерий. Далее происходит адгезия (прилипание) бактерий к клеткам эпителия толстой кишки и продукция токсинов. Важную роль играет нарушение конкуренции со стороны нормальной кишечной микробиоты, которая меняется после антибиотикотерапии.
Токсин А вызывает воспаление слизистой толстой кишки и секрецию жидкости, именно с ним связано развитие водянистой диареи при инфицировании C.difficile.
Токсин В токсичен в отношении клеток, причем не только кишечника. Повышенная продукция этого токсина может приводить к развитию осложнений и поражению других органов и систем (например, сердечно-сосудистой) при тяжелом течении болезни.
Классификация заболеваний, вызванных C.difficile.
Российская гастроэнтерологическая ассоциация в своих рекомендациях от 2016 года выделяет следующие проявления C.difficile-ассоциированной болезни в зависимости от тяжести ее течения:
1) Легкое/среднетяжелое ― диарея (неоформленный стул 3 и более раз в сутки) в сочетании с болью в животе
2) Тяжелое течение:
- водянистая диарея с кровью
- снижение уровня альбумина в крови
- повышение уровня лейкоцитов
- болезненность при пальпации живота
- 3) Осложненное течение
4) Рецидив болезни ― повторное развитие симптомов менее чем через 8 недель после окончания терапии.
Представляется сомнительными следующие формулировки диагноза у пациента с инфекцией C.difficile:
Клиническая картина C.difficile-ассоциированной болезни.
- Нарушения стула по типу диареи. Стул жидкий, часто водянистый, иногда со слизью/кровью. Симптомы часто проявляются после воздействия причинного фактора (например, антибиотики), в среднем через 5-10 дней. Описаны случаи дебюта нарушений стула с первых дней лечения и даже спустя 10 недель после окончания терапии антибиотиками.
- Боли в животе возникают у пациентов с тяжелым течением болезни
- Снижение массы тела
- Повышение температуры тела могут отмечаться при более тяжелом течении C.difficile-ассоциированный болезни
- Осложнения в виде токсической дилатации кишки, перфорации возникают редко.
- Внекишечные проявления в виде артрита, абсцессов кожи редко встречаются при тяжелом (фульминантном) колите, вызванном C.difficile
Диагностика C.difficile-ассоциированной болезни.
1. Исследование кала. Образец кала для наилучшей диагностики инфекции C.difficile ― неоформленный (лучше жидкий) свежий кал. Для лиц с кишечной непроходимостью с отсутствием стула ― кишечный мазок.
Современные методы диагностики инфекции C.difficile в кале включают:
А. Полимеразную цепную реакцию (ПЦР) для диагностики токсин-продуцирующих штаммов C.difficile.
Недостатки: требует специализированной лаборатории для молекулярно-генетической диагностики. Может быть причиной гипердиагностики, так как выявляет не сами токсины в кале, а только бактерии, которые могут их продуцировать.
Б. Иммуноферментный анализ (ИФА) кала для выявления токсинов А и В C.difficile.
Преимущества: наиболее доступный метод, достаточно высокая специфичность.
Недостатки: низкая чувствительность, т.е. не все случаи явной инфекции будут выявлены тестом. Чувствительность зависит от вида тест-системы. Не все коммерческие тест-системы определяют токсин В.
В. Исследование глутаматдегидрогеназы (ГДД) в кале.
ГДД ― фермент, продуцируемый C.difficile.
Преимущества: высокая чувствительность и специфичность метода. Очень быстрое исследование (до 30 минут).
Недостатки: ГДД продуцируется как токсигенными, так и нетоксичными штаммами C.difficile. В России этот метод пока практически недоступен.
2. Эндоскопическая диагностика толстой кишки (колоноскопия).
При C.difficile-ассоциированной диарее изменения со стороны слизистой оболочки толстой кишки обычно неспецифичны: отек, гиперемия (покраснение), иногда в виде очагов.

Лечение C.difficile-ассоциированной болезни.
1. Процедуры по изоляции пациента и профилактике распространения инфекции (актуальны в стационаре):
- мытье рук с мылом под проточной водой для всех посетителей, которые контактируют с пациентом (посетители и персонал) ― удаление спор бактерий C.difficile с кожи рук
- использование перчаток и халатов персоналом и посетителями
- выделение отдельного помещения и туалета (при невозможности – использование судна)
- ежедневная обработка горизонтальных поверхностей в палате и оборудования хлорсодержащими растворами
2. Терапия заболевания включает:
- отмена антибиотика, который спровоцировал инфекцию C.difficile (кроме жизнеугрожающих ситуаций)
- использование антибиотиков для лечения инфекции C.difficile: ванкомицин, метронидазол, фидаксомицин*
- фекальная трансплантация (пересадка кала)* ― в случае неэффективности стандартной терапии или при частых рецидивах инфекции, эффективность превышает 90%.
- хирургическое лечение (колэктомия) в случае крайне тяжелого течения и/или неэффективности всех методов лечения
Профилактика возникновения инфекции C.difficile.
1) Использование антибиотикотерапии только по показаниям
2) Использовать минимально эффективную продолжительность лечения антибиотиками
3) Имеющиеся в настоящее время научные данные по эффективности про- и пробиотиков в профилактике развития инфекции C.difficile недостаточны. Имеется небольшая доказательная база в отношении Saccharomyces boulardii.
Прогноз
Зависит от тяжести течения болезни. Легкие/среднетяжелые формы C.difficile-ассоциированной болезни часто легко поддаются лечению и не рецидивируют. Тяжелое (фульминантное) течение может потребовать интенсивной терапии и даже оперативного вмешательства.
Симптомы инфекции Clostridium difficile и ее лечение
Инфекция, вызываемая Clostridium difficile, в настоящее время является серьезной угрозой госпитальной среде, удлиняет время пребывания многих больных в стационаре, а также становится причиной смерти некоторых из них.
а) Причины и механизмы развития. Носительство С. difficile как коменсалов отмечается у 2-3% взрослых и достигает 10-20% у лиц пожилого возраста.
Заражение этим микроорганизмом происходит контактным путем через руки и другие загрязненные поверхности. С. difficile представляет собой анаэробную спорообразующую грамположительную палочку. Это очень жизнестойкая бактерия, которая резистентна ко многим дезинфицирующим средствам, включая спиртсодержащий гель, но гибнет при воздействии дезинфектантов, выделяющих хлор.
Последовательность событий, лежащих в основе заболевания, состоит в колонизации кишечника госпитализированного больного токсигенным штаммом С. difficile, который при назначении больному антибиотиков, нарушающих нормальное микробное равновесие, трансформируется из спор в вегетативные формы.
Последние, пролиферируя, вызывают клостридиальную бактериальную инфекцию. Патогенные штаммы С. difficile продуцируют энтеротоксин (токсин А) и цитотоксин (токсин В), которые связываются поверхностью клеток слизистой оболочки кишечника. Осложнения клостридиальной инфекции включают дегидратацию, нарушение электролитного баланса, развитие псевдомембранозного колита, перфорацию толстой кишки, токсический мегаколон, смерть.
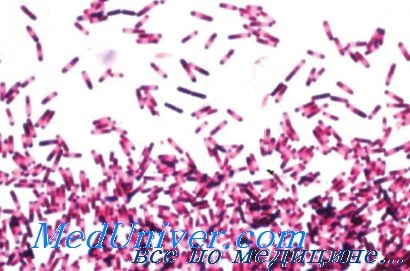
Возбудитель псевдомембранозного колита - Clostridium difficile
б) Факторы риска. Некоторые антибиотики, в частности антибиотики широкого спектра действия и клиндамицин, особенно склонны вызывать описанную последовательность событий.
Поэтому перечень предпочтительных для применения антибиотиков рекомендует микробиолог лечебного учреждения. а антибиотики, которые склонны вызывать клостридиальную инфекцию, назначают лишь при крайней необходимости.
Нередко больным до госпитализации назначают ингибиторы протонной помпы по поводу рефлюкс-эзофагита. Эти препараты способствуют росту С. difficile и потому являются серьезным фактором риска клостридиальной инфекции. Из других факторов риска следует отметить возраст больного старше 65 лет, лечение антибиотиками в последние 3 месяца до госпитализации, госпитализация в анамнезе, воспалительные заболевания кишечника, лечение цитотоксическими препаратами.
в) Симптомы и клиника. Критериями диагностики клостридиальной инфекции являются жидкий стул или токсический мегаколон и положительные результаты исследования кала на клостридиальный токсин иммуноферментным методом. При легкой форме инфекции отмечается лишь жидкий стул, но при среднетяжелой форме появляются также гипертермия, интенсивная боль в животе, кровотечение из нижних отделов ЖКТ и нейтрофилия.
Тяжелая форма характеризуется усугублением перечисленных симптомов. Диарея становится профузной, снижается уровень альбумина в сыворотке крови, повышается концентрация в ней лактата, нарушается функция почек.
г) Лечение инфекции Clostridium difficile. Важное значение имеют ранняя диагностика и своевременное лечение.
Инфекцию, вызванную Clostridium difficile, следует заподозрить при появлении у госпитализированного больного диареи, особенно если она повторилась более 3 раз в течение 24 ч. Больного следует перевести в изолированную палату в течение 4 ч и соблюдать меры, направленные на профилактику заражения и распространения инфекции (мытье рук после каждого контакта с больным, использование перчаток и фартука. Палату, где лежал больной, дезинфицируют раствором гипохлорита.
В течение 4 ч два образца кала больного направляют на микробиологическое исследование и анализ на энтеротоксин и консультируются с инфекционистом.
Лечение включает внутривенное возмещение потери жидкости. Назначают метронидазол или ванкомицин внутрь в течение 10 дней. При тяжелой форме инфекции препаратами выбора являются ванкомицин, назначаемый внутрь, и вводимый внутривенно метронидазол. Всем больным с подозрением на тяжелую форму клостридиальной инфекции следует незамедлительно выполнить рентгенологическое исследование брюшной полости и вызвать ответственного гастроэнтеролога, хирурга и микробиолога.
После консультации микробиолога ингибиторы протонной помпы и антибиотики следует отменить.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Пищевое отравление ботулинотоксином (Clostridium botulinum) и его лечение
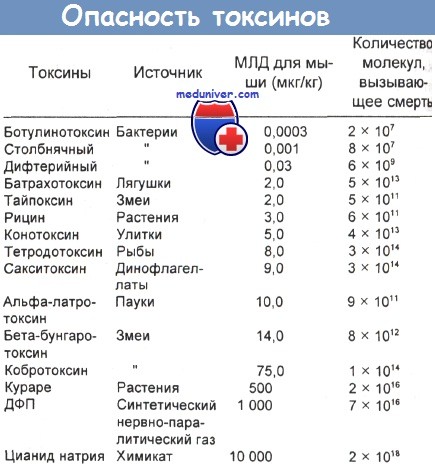
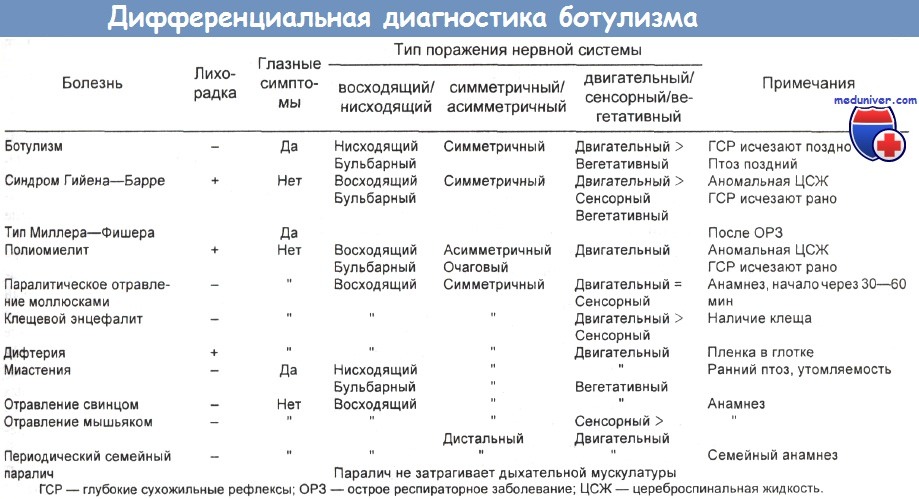
В таблице ниже приведены сравнительные данные по летальности ряда токсинов. Одну из схем дифференциальной диагностики ботулизма предложили Motenson и соавт..
а) Распространенность. В одной серии наблюдений токсин Clostridium botulinum типа А вызвал заболевание у 48 % пациентов, типа В — у 29 %, типа Е — у 23 %. Медиана инкубационного периода для всех пациентов составила 1 сут (общие диапазоны: 0 — 7 сут для типа А, 0 - 5 сут для типа В и 0 - 2 сут для типа Е).
б) Пробы кала. Невозможность выявить токсин в большинстве проб кала, полученных ранее или позднее 3 сут после перорального отравления, говорит о том, что за этот период вещество всасывается в пищеварительном тракте, расщепляется или выделяется. Влияет ли внутривенное введение антитоксина на исчезновение токсина из просвета кишечника, неизвестно.
в) Лабораторные данные. У каждого пациента с подозрением на ботулизм надо взять сыворотку, кал и, по возможности, желудочный аспират на выявление токсина и анаэробный посев. Однако, если при диагностике слишком большое значение придается только лабораторным данным, возможен ложноотрицательный результат.
г) Лечение отравление ботулинотоксином. Большинство вспышек пищевого ботулизма в США связано с потреблением неправильно приготовленных и/или плохо хранившихся домашних консервов, в основном овощных, прежде всего из спаржи, зеленой фасоли и паприки (Центры по борьбе с болезнями, неопубликованные данные).
Для консервирования овощей надо использовать автоклав, позволяющий в течение 10 мин поддерживать температуру выше 100 С: это убивает споры возбудителя, однако оптимальное время и давление такой термообработки зависят от конкретного пищевого продукта. Варенье можно без опасений "закатывать" и без автоклавирования, поскольку высокое содержание в нем сахара не позволяет размножаться Clostridium botulinum.
Инструкции по домашнему консервированию можно получить в окружных отделах службы здравоохранения. Прошедшую термообработку пищу нельзя хранить при температуре 4 — 60 °С более 4 ч. Кипячение продуктов в течение 10 мин перед едой уничтожает любой присутствующий в них токсин.
3,4-Диаминопиридин, испытанный двойным слепым методом с контролем-плацебо на больных ботулизмом А, не улучшает мышечной силы, дыхательной функции и сложного мышечного потенциала действия на электромиограмме.
Человеческий "ботулиновый" иммуноглобулин (БИГ) должен был выпускаться в Калифорнии с 1 января 1991 г., однако из-за войны в Заливе появился только 1 февраля 1992 г. Клинические испытания БИГ находятся в стадии уточнения эффективности (фаза И) и спонсируются Программой "лекарства для сирот" ("Orphan Drug Program") Управления FDA и Калифорнийским департаментом здравоохранения.
Накопленный опыт позволяет считать, что лучший результат в случае пищевого ботулизма достигается при скорейшем начале лечения. Врачи, подозревающие у пациентов детский ботулизм, могут получить БИГ в США, заказав его в любое время суток по телефону (510) 540-2646. Есть надежда, что применение БИГ существенно сократит продолжительность болезни и стоимость пребывания отравившихся младенцев в больнице.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021

Наиболее распространенной клостридиальной инфекцией является гастроэнтерит Гастроэнтерит Гастроэнтерит представляет собой воспаление слизистой оболочки желудка, а также тонкого и толстого кишечника. Он обычно возникает в результате микробной инфекции, но также может быть вызван. Прочитайте дополнительные сведения (пищевое отравление Clostridium perfringens), — эта инфекция обычно проявляется в легкой степени и проходит самостоятельно. Серьезное течение клостридиальной инфекции встречается относительно редко, но может приводить к летальному исходу.
Клостридии приводят к заболеванию разными путями в зависимости от их вида:
Споры клостридий, которые являются неактивными (находящимися в латентном состоянии) формами бактерий, могут попадать в организм через раны и становиться активными бактериями, вырабатывающими токсин, как это происходит при столбняке Против столбняка Столбняк возникает из-за токсина, который вырабатывается анаэробными бактериями Clostridium tetani. Токсины вызывают непроизвольные сокращения и ригидность мышц. Столбняк обычно развивается. Прочитайте дополнительные сведения . Споры позволяют бактериям выживать даже при сложных внешних условиях. При благоприятных условиях каждая спора превращается в активную бактерию.
Клостридии могут инфицировать желчный пузырь, ободочную кишку и женские репродуктивные органы. Если клостридии поражают толстую кишку у людей с низким уровнем лейкоцитов (например, у пациентов с лейкозом или получающих химиотерапию от рака), это может вызвать опасное для жизни заболевание под названием нейтропенический энтероколит.
Пищевое отравление, вызванное Clostridium perfringens

Пищевое отравление Clostridium perfringens Пищевое отравление энтеритной клостридией Пищевое отравление Clostridium perfringens возникает в результате употребления в пищу продуктов, зараженных бактерией Clostridium perfringens.Попав в тонкий кишечник, бактерия. Прочитайте дополнительные сведения (один из видов гастроэнтерита Гастроэнтерит Гастроэнтерит представляет собой воспаление слизистой оболочки желудка, а также тонкого и толстого кишечника. Он обычно возникает в результате микробной инфекции, но также может быть вызван. Прочитайте дополнительные сведения ) может развиться при поедании пищи (обычно говядины), которая содержит клостридии. Клостридии развиваются из спор, которые выживают при температуре приготовления пищи. Если пища, в которой находятся споры, не съедается немедленно после приготовления, споры развиваются в активные бактерии клостридии, которые начинают размножаться в пище. Если такая пища подается без соответствующего повторного прогрева, клостридии попадают в организм. Они начинают размножаться в тонкой кишке и вырабатывать токсины, которые вызывают водянистую диарею и спастические боли в животе.
Пищевое отравление Clostridium perfringens обычно протекает легко и проходит в течение 24 часов. Однако в редких случаях оно протекает тяжело, в особенности, у маленьких детей и пожилых людей.
Врачи обычно подозревают диагноз пищевого отравления Clostridium perfringens, если в данной местности наблюдалась вспышка заболевания. Диагноз подтверждают, анализируя зараженные продукты или образцы кала зараженных людей на наличие Clostridium perfringens и его токсина.
Для предотвращения пищевого отравления несъеденные мясные продукты следует немедленно поместить в холодильник, а перед употреблением надлежащим образом разогреть.
Лечение пищевого отравления Clostridium perfringens включает употребление большого количества жидкостей и отдых. Антибиотики не применяются.
Клостридиальные желудочно-кишечные инфекции и инфекции органов малого таза
Клостридиальные бактерии, обычно Clostridium perfringens, часто вызывают желудочно-кишечные инфекции, обычно с другими бактериями (смешанные анаэробные инфекции).
Клостридиальные инфекции могут развиваться при разрыве кишечника. Клостридии могут также инфицировать желчный пузырь и органы малого таза, такие как матка, фаллопиевы трубы и яичники. Клостридии обычно поражают матку после родов или после аборта в нестерильных условиях.
Клостридиальные желудочно-кишечные инфекции и инфекции органов малого таза являются серьезными и иногда приводят к летальному исходу. Клостридии вырабатывают большое количество газа, образовывая пузырьки и волдыри в инфицированной ткани. Часто инфекция блокирует мелкие кровеносные сосуды и инфицированные ткани отмирают, что приводит к газовой гангрене Газовая гангрена Газовая гангрена — это представляющее угрозу для жизни инфекционное заболевание мышечных тканей, возбудителем которого является анаэробная бактерия Clostridium perfringens, а также. Прочитайте дополнительные сведения .
Симптомы включают боль и повышение температуры. Живот болезнен при пальпации. При инфицировании матки у женщины может наблюдаться дурно пахнущие, кровянистые выделения из влагалища.
Для диагностики клостридиальных желудочно-кишечных инфекций и инфекций органов малого таза врачи берут образцы крови или инфицированных тканей. Эти образцы изучаются и направляются в лабораторию для бактериологического исследования (посев на флору) и идентификации возбудителя, если таковой присутствует. Врач может назначить рентгенографию для проверки на наличие газа, вырабатываемого клостридиями.
Лечение клостридиальных желудочно-кишечных инфекций и инфекций органов малого таза включает хирургическое вмешательство для удаления инфицированной и мертвой ткани (удаление омертвевших частей). Антибиотики, такие как пенициллин, назначаются как минимум на 1 неделю. Иногда пенициллин используется совместно с другим антибиотиком под названием клиндамицин. Иногда, если орган (например, матка) тяжело инфицирован, он удаляется. Такое лечение может спасти пациенту жизнь.
Клостридиальный некротизирующий энтерит
Клостридиальный некротизирующий энтерит также называют некротическим энтеритом или горящим кишечником. Эта инфекция вызвана Clostridium perfringens и обычно поражает тонкую кишку (в основном тощую кишку). Инфекция варьируется от легкой до тяжелой степени и может привести к летальному исходу, если ее не лечить немедленно. Эта редкая инфекция возникает в основном в местах, где люди употребляют рацион питания с низким содержанием белка, например, в отдаленных районах Новой Гвинеи и в некоторых частях Африки, Центральной и Южной Америки и Азии.
Диагноз клостридиального некротизирующего энтерита ставится на основе результатов анализов кала.
Лечение клостридиального некротизирующего энтерита проводится антибиотиками. Пациентам с очень тяжело протекающей инфекцией может потребоваться хирургическое вмешательство.
Нейтропенический энтероколит (тифлит) является аналогичным опасным для жизни синдромом, который развивается в начале толстой кишки (слепой кишки) у людей с низким уровнем лейкоцитов (например, у больных лейкемией или у получающих химиотерапию по поводу рака).
Некротизирующий энтероколит новорожденных встречается в основном у недоношенных новорожденных, вес которых составляет менее 1500 грамм. Он может быть вызван бактериями, которые называются клостридии.
Клостридии в кровотоке
Для диагностики сепсиса, вызванного клостридиями, врачи берут образцы крови. Эти образцы направляются в лабораторию для бактериологического исследования (посев на флору) и идентификации возбудителя, если таковой присутствует.
ПРИМЕЧАНИЕ: Это — пользовательская версия ВРАЧИ: Нажмите здесь, чтобы перейти к профессиональной версии
Clostridium perfringens – острый гастроэнтерит, вызванный приемом в пищу загрязненной еды. Симптомы включают водянистую диарею и боли в животе. Диагностика проводится путем выявления C. perfringens в зараженной пище или стуле. Лечение носит поддерживающий характер.
Пищевое отравление, вызванное C. perfringens является, как правило, легкой клостридиальной инфекцией.
C. perfringens широко распространен в экскрементах, почве, воздухе и воде. Загрязненное мясо вызывало много подобных вспышек. Поскольку споры C. perfringens иногда сохраняют жизнеспособность при приготовлении пищи, они могут созревать и размножаться, приводя к большому количеству бактерий, в случае, когда приготовленное мясо, зараженное C. perfringens, оставляют при комнатной температуре или даже при температуре до 60 (140° F, как на тепловом столе) в течение некоторого времени. Вспышки, как правило, происходят в учреждениях и редко дома.
После попадания в желудочно-кишечный тракт C. perfringens продуцирует энтеротоксин, который оказывает воздействие на тонкую кишку. Только C. perfringensтипа A имеет четкую связь с данным синдромом пищевого отравления.
Типична легкая форма гастроэнтерита Гастроэнтерит Гастроэнтерит представляет собой воспаление слизистой оболочки желудка, тонкой и толстой кишок. В большинстве случаев оно связано с инфекцией, но может развиваться вследствие воздействия лекарств. Прочитайте дополнительные сведения с появлением признаков в течение 6–24 часов после приема в пищу зараженной еды. Наиболее распространенные симптомы – водянистая диарея и боли в животе. Рвота и лихорадка не характерны. Симптомы, как правило, проходят в течение 24 часов; тяжелые или летальные случаи редки.
Диагностика пищевого отравления, вызванного Clostridium perfringens
Идентификация патогенных организмов в пище или стуле или энтеротоксина в стуле
Диагноз пищевого отравления, вызванного C. perfringens, основывается на эпидемиологических предпосылках и выявлении большого количества микроорганизмов в зараженной еде или стуле инфицированных людей, либо при непосредственном выявлении энтеротоксина в образцах кала.
Лечение пищевого отравления, вызванного Clostridium perfringens
Лечение пищевого отравления, вызванного C. perfringens, поддерживающее; антибиотики не назначаются.
Чтобы предотвратить болезнь, люди должны незамедлительно охлаждать остатки приготовленного мяса и тщательно прогревать его повторно (внутренняя температура, 75 ° C) перед подачей на стол.
Читайте также:

