Что такое лепра в фотографиях
Обновлено: 24.04.2024
В статье отражены современные представления о лепре, представлены современные данные литературы, посвященные вопросам эпидемиологии заболевания, особенностям клинической картины, диагностики, дифференциальной диагностики и лечения дерматоза.
The article summarizes information about the disease leprosy. Data of the literature on epidemiology of the disease, the features of the clinical picture, diagnosis, differential diagnosis and treatment of the dermatosis are presented.
Лепра (проказа, болезнь Хансена) — хроническое инфекционное заболевание из группы микобактериозов, характеризующееся продолжительным инкубационным периодом и рецидивирующим течением. Заболевание носит системный характер и поражает производные эктодермы — кожные покровы, слизистые оболочки и периферическую нервную систему. В настоящее время, несмотря на применение эффективной схемы антибиотикотерапии и устранение угрозы эпидемии лепры, по всему миру продолжают ежегодно выявляться новые случаи заболевания, поэтому перспектива полной ликвидации болезни ставится под сомнение [1–3].
Распространенность лепры в мире стабильно снижается из года в год. Согласно данным ВОЗ, количество новых случаев, каждый год выявляемых во всем мире, уменьшилось с 763 000 в 2001 г. до 249 000 в 2008 г. [1]. В 2013 г. было выявлено 215 656 новых случаев заболевания, в 2014 г. — 213 899, в 2015 г. — 211 973 [2, 3].
Глобальная статистика свидетельствует о том, что 96% (203 600 человек) новых случаев заражения лепрой были выявлены в 22 государствах (таких как Индия, Бразилия, Ангола, Конго, Судан, Эфиопия и др.). На долю других стран приходятся оставшиеся 4% [3].
Одной из шести стран мира с наиболее высокой распространенностью лепры является Бразилия, где ежегодно диагностируется более 30 000 новых случаев заболевания. В 2014 г. распространенность лепры в Бразилии составила 1,27 случая на 10 000 жителей. Уровень распространенности дерматоза по стране неравномерен: помимо эндемичных по лепре регионов существуют и такие, в которых отмечается низкий уровень распространенности лепры [4].
В России эндемичным регионом по лепре является Астраханская область. За последние десятилетия больные лепрой были выявлены и в других субъектах Российской Федерации: в Сибири, на Северном Кавказе и Дальнем Востоке [9, 10]. Однако стоит отметить, что, благодаря внедрению в практику целого комплекса противолепрозных мероприятий, заболеваемость лепрой в России носит устойчивый спорадический характер. В 2015 г. на учете состояло 240 больных, из них в Астраханской области — 135 [10].
Возбудителями лепры являются Mycobacterium leprae (M. leprae) и Mycobacterium lepromatosis (M. lepromatosis). M. leprae была впервые открыта норвежским врачом Герхардом Хансеном в 1873 г. [11]. Данный микроорганизм относится к семейству Mycobacteriaceae и является кислото- и спиртоустойчивой бактерией, которая представляет из себя грамположительную прямую или изогнутую палочку длиной 1–7 мкм и диаметром 0,2–0,5 мкм [12]. M. leprae может длительное время сохранять жизнеспособность при низких температурах и высушивании. Данному микроорганизму свойственен крайне медленный рост, который зачастую не характерен для бактерий (одно деление продолжается приблизительно 12 суток) [12]. Возбудитель заболевания является облигатным внутриклеточным паразитом. M. leprae способна продолжительно персистировать в макрофагах человека, что обеспечивается взаимодействием различных механизмов (антигенная изменчивость и пр.). Именно поэтому пациенты, выписанные из лепрозориев на амбулаторное лечение с персистирующими формами лепры, могут быть источником заражения [9].
В 2008 г. был открыт второй возбудитель лепры — M. lepromatosis, который, в отличие от M. leprae, является некислотоустойчивой бактерией и вызывает преимущественно тяжелый диффузный лепроматозный тип лепры [13, 14].
От других инфекционных заболеваний лепру отличает длительный инкубационный период, который варьирует от 2–3 месяцев до 50 лет (в среднем составляя 4–6 лет) [11].
Общепризнан воздушно-капельный путь передачи инфекционных агентов, однако не исключаются другие пути заражения — через укусы кровососущих насекомых и поврежденные кожные покровы. Лепра является малоконтагиозным заболеванием. Заражение микобактериями лепры происходит в результате длительного тесного общения с больным, не получающим лечения, вследствие сенсибилизации, нарастающей при повторяющихся контактах, снижения сопротивляемости организма (в результате неполноценного питания, тяжелых физических нагрузок, частых простудных заболеваний, алкоголизма и других интоксикаций) и иммуногенетической восприимчивости [11].
На восприимчивость к лепре оказывают влияние различные наборы генов, в том числе системы антигена лейкоцитов человека (HLA). В настоящее время изучаются изменения в генах-кандидатах, участвующих в ответной реакции организма хозяина на инфекционный агент. Исследования геномного сканирования выявили связывающие пики для лепры в областях хромосом 6p21, 17q22, 20p13 и 10p13 [15, 17].
Устойчивость к заражению M. leprae обеспечивается, с одной стороны, низкой вирулентностью M. leprae, с другой — индивидуальными особенностями врожденного иммунитета. Важную роль в поддержании врожденного иммунитета играет целостность эпителия, секрет желез и поверхностный иммуноглобулин A (IgA). Кроме того, уничтожать микобактерии, независимо от активации адаптивного иммунитета, могут NK-клетки, цитотоксические Т-лимфоциты и активированные макрофаги. При заражении регулирование воспалительных цитокинов и хемокинов приводит к пролиферации либо Т-хелперов 1-го типа (Th1), либо Т-хелперов 2-го (Th2) типа, что способствует активации клеточного или гуморального звена иммунитета, что определяет клиническую форму заболевания [16, 17].
Клеточный иммунитет неэффективен в отношении предотвращения развития заболевания у лиц с туберкулоидной формой лепры. Гуморальный иммунитет у лиц с лепроматозной формой заболевания, ответственный за продуцирование IgM против PGL-1 (фенольный гликолипид-1), не обеспечивает защиту и не предотвращает диссеминацию бактерий [17].
Высокий уровень ФНО-α в сыворотке крови у пациентов с туберкулоидной формой лепры свидетельствует об участии данного цитокина в деструкции M. leprae и образовании гранулемы. ФНО-α участвует в иммунной защите посредством активации макрофагов, однако гиперпродукция ФНО-α и его взаимодействие с ИФН-γ способствуют повреждению тканей и формированию узловатой лепрозной эритемы (ENL) [17].
При лепроматозной форме лепры наблюдается повышенный уровень трансформирующего фактора роста бета (ТФР-β), отсутствующего при туберкулоидной форме и проявляющегося в небольшом количестве при пограничной форме лепры. ТФР-β подавляет активацию макрофагов, что ингибирует продуцирование ФНО-α и ИФН-γ, способствуя персистенции инфекции [17].
О механизмах трансмиссии лепры известно, что микобактерии проникают в клетки эндотелия и оседают в Шванновских клетках нервов кожи, к которым имеют тропизм, где в дальнейшем происходит долговременный период их адаптации и размножения. Остается неизвестным, как колонизация Шванновских клеток микобактериями лепры приводит к распространению инфекции в другие ткани [18]. Нейронный тропизм M. leprae обусловлен его связыванием с областью G на мостике молекулы ламинина альфа-2, а альфа-дистрогликан служит рецептором для M. leprae на Шванновских клетках [18].
В работе Masaki и соавт. (2013), в исследовании in vitro и in vivo с использованием мышей, определялось взаимодействие M. leprae со Шванновскими клетками. Исследование показало, что M. leprae изменяют дифференцировку Шванновских клеток до клеток-предшественников [19]. Клеточная перестройка приводит к снижению регуляции Шванновской клеточной линии Sox10 [19]. Таким образом, M. leprae способствуют распространению инфекционного процесса через два механизма: прямая дифференцировка Шванновских клеток в мезенхимальные ткани и образование гранулемаподобных структур, которые выделяют бактерионесущие макрофаги [19]. Исследование расширяет понимание о пластичности зрелых клеток и демонстрирует свойства M. leprae, приводящих к перестройке взрослых клеток в стволовые [18]. Распространение инфекции путем дифференцировки Шванновских клеток возможно при их инфицировании большим количеством M. leprae. Методология, используемая на мышах, у которых нет Т-клеток, упрощает воспалительное микроокружение в преимущественно макрофаги [19]. Данная работа описывает перспективную in vitro модель для объяснения патогенеза M. leprae, но необходимы подробные исследования, прежде чем экстраполировать выводы на течение инфекционного процесса в организме человека [18].
Существует две классификации лепры: мадридская классификация, принятая в 1953 г., а также ее последующая модификация, предложенная Д. С. Ридли и В. Джоплингом в 1973 г. [11].
Согласно мадридской классификации выделяют два полярных типа лепры: туберкулоидный и лепроматозный и два промежуточных типа: недифференцированный и пограничный (диморфный) [11].
В классификации Ридли–Джоплинга выделяют три типа лепры — недифференцированный (I — Indeterminate), туберкулоидный (Tuberculoidtype — TT) и лепроматозный (Lepromatoustype — LL). Лепроматозный и туберкулоидный типы являются полярными. Кроме того, различают субполярные и пограничные группы заболевания. Классификация Ридли–Джоплинга не нашла широкого применения ввиду сложности, поэтому в практической деятельности различают лепроматозный и туберкулоидный тип лепры, а также пограничный тип, который в дальнейшем может трансформироваться в одну из первых двух форм [20].
При лепроматозном типе лепры поражается как периферическая, так и центральная нервная система с развитием невротических расстройств, реже — психозов и поражений по типу невритов и полиневритов. В большинстве случаев поражаются лучевые, малоберцовые и большие ушные нервы: они утолщаются и становятся доступными для пальпации. В последующем развиваются двигательные и трофические расстройства, а также нарушения чувствительности. Больным свойственны невралгии, гиперестезии, парестезии, неадекватное или замедленное реагирование на раздражение, аналгезия. На фоне трофических нарушений развивается процесс мутиляции кистей и стоп. Поражение внутренних органов характеризуется неспецифическими изменениями в печени, легких, селезенке и нарушением функции некоторых желез внутренней секреции [11].
При недифференцированной форме лепры специфические высыпания отсутствуют. Для данной формы характерно появление небольшого количества бледных пятен различной величины с нечеткими границами, а также поражение периферической нервной системы по типу полиневрита. Как правило, выявить возбудителя у этой категории лиц удается крайне редко [11].
При развитии обострений лепрозного процесса форма заболевания может меняться. Несмотря на множество клинических проявлений лепры, окончательная постановка диагноза не всегда является простой задачей, так как отсутствуют патогномоничные клинические признаки заболевания [25].
При диагностике лепры учитывают данные эпидемиологического анамнеза (пребывание в эндемичном регионе, контакты с больными лепрой), объективного осмотра (обращают внимание на характер и длительность существования высыпаний, наличие признаков нарушений периферической иннервации).
Общепринятым лабораторным методом диагностики лепры считается бактериоскопическое исследование. Соскобы для исследования берут с очагов поражения на коже и слизистой оболочке носа путем легкого поскабливания. Мазок помещают на предметное стекло и окрашивают по Цилю–Нильсену. Также исследуют пунктат из бедренных или паховых лимфатических узлов. Однако бактериоскопическое исследование имеет очень низкую чувствительность, особенно у больных с промежуточной или туберкулоидной формой поражения [26].
Лепроминовая реакция (проба Митсуды) является показателем способности хозяина поддерживать в своем организме клеточный иммунитет к M. leprae. Проба Митсуды не всегда является достоверной, так как у 10% здоровых по лепре людей может наблюдаться отрицательная реакция. Ограничивают применение лепроминового теста и технические трудности, связанные с получением лепромина и его внутрикожным введением [11].
Наиболее чувствительным методом диагностики, позволяющим определять M. leprae, является полимеразная цепная реакция (ПЦР). ПЦР на данный момент считается наиболее перспективной из прямых диагностических методик и применяется для диагностики любого типа лепры [10, 18]. Преимуществом ПЦР являются неинвазивность и простота получения клинического материала, что предоставляет возможность проведения скрининга большого количества образцов при обследовании пациентов в высокоэндемичных по этому заболеванию регионах. Применение ПЦР позволяет усовершенствовать диагностику лепры и выявлять заболевание на ранней стадии [26].
Используемые в настоящее время традиционные методы диагностики, такие как лепроминовая проба и бактериоскопическое исследование, не всегда позволяют подтвердить диагноз лепры на ранних стадиях заболевания. При этом эффективность лечебных и профилактических мероприятий определяется возможностью ранней диагностики заболевания. В мире постоянно регистрируются новые случаи лепры, поэтому актуальным вопросом остается разработка и внедрение новых, более точных, методов диагностики, которые стали бы доступными для широкого использования и позволили с высокой степенью достоверности диагностировать лепру на ранних стадиях развития заболевания.
Лечение заболевания стандартизовано ВОЗ в 1981 г. [28]. Комбинированная лекарственная терапия включает в себя использование трех основных препаратов: дапсон, рифампицин и клофазимин [28].
Дапсон — бактериостатический препарат, действующий как конкурентный ингибитор ферментов дигидрофолатсинтетазы и дигидрофолатредуктазы, которые являются ключевыми ферментами путей биосинтеза фолатов в микобактериях лепры [28].
Рифампицин — оказывает в отношении M. leprae бактерицидное действие. Является селективным ингибитором ДНК-зависимой РНК-полимеразы и блокирует синтез РНК [29].
Клофазимин — жирорастворимый кристаллический краситель красноватого цвета с бактериостатическим и противовоспалительным свойствами. Механизм антибактериального действия клофазимина изучен недостаточно. Вероятно, он связан с блокировкой матричной функции ДНК, повышением фагоцитарной активности макрофагов и синтеза лизосомальных ферментов [28]. Клофазимин и рифампицин обладают эффективностью в отношении дапсонрезистентных микроорганизмов.
В 1997 г. ВОЗ была установлена продолжительность курса лечения: 6 месяцев для мультибациллярных форм лепры и 12 месяцев для олигобациллярных. Дапсон назначается в дозировке 100 мг для взрослых один раз в день, рифампицин в дозировке 600 мг один раз в месяц, клофазимин в дозировке 300 мг один раз в месяц. Для лечения детей применяются более низкие дозы препаратов [28]. В случае невозможности применения одного или двух препаратов из вышеперечисленных существуют схемы лечения с применением фторхинолонов, которые также показали свою эффективность в отношении M. leprae [30].
Своевременная диагностика лепры, профилактика распространения лепры беженцами и вынужденными переселенцами, особенно из высокоэндемичных государств (Бангладеш, Филиппинские острова, Индия, Ангола, Бразилия, Шри-Ланка и др.), являются серьезной и актуальной проблемой для мирового здравоохранения, одной из приоритетных задач при осуществлении контроля над здоровьем иностранных граждан и лиц без гражданства, въезжающих на территорию страны. В Российской Федерации, в соответствии с существующим порядком, установленным на законодательном уровне, для контроля над распространением заболеваний среди населения, нерезидентам Российской Федерации необходимо пройти медицинское освидетельствование в медицинских организациях. Однако данная процедура освидетельствования осложнена отсутствием комплексной методологической платформы.
Таким образом, несмотря на снижение распространенности лепры, представляется актуальным усиление контроля за обязательным обследованием на лепру прибывающих в страну иностранных граждан, разработка отечественных аналогов лекарственных препаратов и поиск новых схем лечения больных лепрой.
Литература
А. А. Кубанов*, доктор медицинских наук, профессор, член-корреспондент РАН
Т. В. Абрамова**, кандидат медицинских наук
Е. К. Мураховская* , 1 , кандидат медицинских наук
В. А. Ласачко*
* ФГБОУ ДПО РМАНПО МЗ РФ, Москва
** ФГБУ ГНЦДК МЗ РФ, Москва

Незабытая болезнь
Лепра (ее еще называют проказой или болезнью Хансена) известна со Средних веков, изображения прокаженных нередко встречаются на старинных гравюрах и иллюстрациях. А о том, что для больных существовали организованные дома, говорят письменные свидетельства и данные раскопок. Прокаженных изолировали от общества, они считались практически мертвецами. Больные должны были носить одежду, полностью скрывавшую лицо и тело, и колокольчик, предупреждавших об их приближении.
Проказа является первой инфекцией, известной человечеству. Возбудитель лепры открыли в 1873 году, еще до туберкулеза. Но до сих пор многие механизмы действия и распространения лепры разгадать не удалось. Непонятно, как она передается, почему одни заражаются, а другие нет, когда болезнь проявляет себя (инкубационный период может длиться до 40 лет).


Чаще всего болезнь Хансена встречается в Индии, Бангладеш, Непале, Индонезии, Бразилии, Нигерии. В России лечатся единицы — на учете стоят 200 человек . В 2020 году выявили шесть новых случаев, а в 2017–2019 годах — десять. Исторически сложилось так, что больше всего больных лепрой в Нижнем Поволжье. Возможно, потому, что через Астрахань шел Шелковый путь, по которому болезнь пришла из Азии.

Что такое лепра
Лепра — это инфекция, вызываемая бактериями Mycobacterium leprae. Она поражает нервную систему, дыхательные пути, кожу, глаза. Пациенты с лепрой перестают чувствовать боль и часто травмируются, поэтому у них на тебе бывает много царапин и ожогов. Болезнь уродует людей: у них выпадают брови, мутилируют (рассасываются) кости конечностей, образуются страшные раны. Раньше доходило до ампутаций, хотя современные средства лечения позволяют этого избежать.
Я невольно таращил глаза на здешних жителей, не в силах отвести взгляд. У некоторых из них не было носов, у большинства — пальцев на руках; ноги их были обмотаны окровавленным тряпьем, а кое у кого процесс разложения зашел так далеко, что они были лишены губ или ушей. Однако у большинства детей не было видно следов болезни, они выглядели вполне здоровыми — разве что были очень истощены. Им приходилось трудиться не покладая рук, поскольку у старших, как правило, нормальных рук не было
Также не до конца понятно, как лепра передается. До пандемии врачи не носили маски при осмотрах и не заражались. Для того, чтобы человеку передалась инфекция нужен долгий бытовой контакт с больным, но многое зависит и от иммунитета. Спровоцировать дебют могут вредные привычки, ослабляющие организм.

Как живут больные с лепрой сегодня
В Астрахани, где находится самый крупный в России очаг заболевания (122 из 200 пациентов), есть Научно-исследовательский институт лепры. Вернее, был. Разговоры о закрытии единственного в стране центра изучения лепры ходили с 2015 года. А несколько дней назад на сайте института опубликовали приказ — НИИ расформировывают и присоединяют к Астраханскому государственному медицинскому университету.
НИИ лепры создали в 1947 году на базе лепрозория, который действовал еще с конца XIX века. Судя по фотографиям, территория лечебницы больше похожа на санаторий: малоэтажные здания, уютные тропинки, много зелени и цветов.


Пациенты рассказывали, что жить в обществе им трудно. Врачи районных поликлиник занимаются ими неохотно, близкие отворачиваются, узнав о прокаженных в роду. Раньше в Астраханском лепрозории старались создать условия реальной жизни: проводились спортивные соревнования и музыкальные выступления, для пациентов создавали рабочие места, была даже местная тюрьма. Теперь это в прошлом.
Мы волнуемся не за рабочие места, а из-за пациентов. Кто будет ими заниматься? Общей сети здравоохранения они не нужны. Ни в одном стационаре не станут годами лечить лепрозные трофические язвы. А они у наших пациентов ужасные — до костей
заведующая клиническим отделением Научно-исследовательского института по изучению лепры

Лепра – хроническая инфекция, обычно вызываемая кислотоустойчивой бациллой Mycobacterium leprae, которая обладает уникальным тропизмом к периферическим нервам, коже и слизистым оболочкам верхних респираторных путей. Симптомов много и они включают анестезирующие полиморфные поражения кожи и периферическую невропатию. Диагноз является клиническим и подтверждается биопсией. Лечение, как правило, проводят дапсоном в сочетании с другими противомикобактериальными препаратами. После начала терапии пациенты быстро становятся неконтагиозными.
До 2008 года M. leprae был единственным известным возбудителем лепры, пока в Мексике не был выявлен второй вид, M. lepromatosis.
Несмотря на то, что лепра не является очень контагиозной, редко вызывает смерть и может эффективно лечиться антибиотиками, она продолжает оставаться серьезным социальным клеймом. Вероятно, остается определенное непонимание этиологии болезни, потому что лепра была неизлечима до появления эффективных антибиотиков в 1940 году. Люди с этим заболеванием выглядели изуродованными и часто имели значительные признаки инвалидности, вызывая страх и стремление избежать с ними контактов со стороны других людей. Из-за этой социальной стигматизации психологическое воздействие лепры часто является значительным.
Эпидемиология проказы
Лепра может развиться в любом возрасте, но проявляется чаще всего у людей в возрасте 5–15 лет или > 30 лет.
Ссылки на эпидемиологию
Патофизиология проказы
Люди – это главный естественный резервуар M. leprae. Армадил (броненосец) – единственный подтвержденный источник, кроме людей, хотя могут быть и другие животные и источники окружающей среды.
Считается, что лепра распространяется от человека к человеку воздушно-капельным путем. Случайный контакт (например, просто касание кого-то с данной болезнью) или краткосрочный контакт, как правило, не опасен. Приблизительно половина людей, больных проказой, заразились непосредственно через близкий, длительный контакт с зараженным человеком. Даже после контакта с бактериями большинство людей не заболевают проказой; работники системы здравоохранения, работающие много лет с больными, у которых есть проказа, не заболевают. У большинства (95%) иммунокомпетентных людей, которые заражены M. leprae, из-за эффективного иммунитета проказа не развиваются. У людей, которые все-таки заболевают проказой, вероятно, есть определенная неблагоприятная генетическая склонность.
Бациллы M. leprae растут медленно (количество удваивается через 2 недели). Инкубационный период колеблется от 6 месяцев до 10 лет. При прогрессировании инфекции происходит ее гематогенное распространение.
Классификация
Лепра может быть классифицирована по типу и числу пораженных областей кожи:
Олигобациллярность: ≤ 5 поражений кожи без выявления бактерий на образцах, взятых из этих областей
Мультибациллярность: ≥ 6 поражений кожи, бактерии выявляются на образцах поражений кожи
Лепра может также быть классифицирована по клеточному ответу и клиническим результатам:
У людей с туберкулоидной лепрой, как правило, отмечается сильный опосредованный клеткой ответ, который ограничивает болезнь несколькими поражениями кожи (олигобациллярность), и болезнь является более умеренной, менее распространенной и менее заразной. Пациенты лепроматозной или пограничной лепрой обычно имеют слабый клеточный иммунитет к M. leprae, и у них развивается более тяжелая системная инфекция с широко распространенным бактериальным проникновением в кожу, нервы и другие органы (например, нос, яички, почки). У таких людей больше (мультибациллярность) поражений кожи, и болезнь является более заразной.
В обеих классификациях тип проказы определяет:
Симптомы и признаки проказы
Симптомы лепры обычно не проявляются до > 1 года после заражения (в среднем 5–7 лет). Как только симптомы начинают проявляться, они медленно прогрессируют.
Лепра поражает главным образом кожу и периферические нервы. Поражение нерва вызывает нечувствительность и слабость в тех областях, которые контролируются пораженными нервами.
Туберкулоидная лепра:поражения кожи состоят из одного или нескольких неэстетичных пятен с яркой пигментацией по центру и с острыми приподнятыми границами. Сыпь, как и при всех формах лепры, не вызывает зуда. Участки, пораженные этой сыпью, являются нечувствительными из-за поражения основных периферических нервов, которые могут быть осязаемо увеличенными.
Лепроматозная лепра: большая часть кожи и многие области тела, включая почки, нос и яички, могут быть поражены. У пациентов на коже расположены пятна, папулы, узелки или бляшки, которые часто бывают симметричными. Периферическая невропатия более тяжелая, чем при туберкулоидной лепре, с большим количеством областей без чувствительности; определенные группы мышц могут быть слабыми. Пациенты могут заболеть гинекомастией или потерять ресницы и брови.
Пограничная лепра: имеются особенности и туберкулоидной, и лепроматозной лепры. Без лечения пограничная лепра может стать менее тяжелой и больше похожей на туберкулоидную форму или может ухудшиться и стать похожей на лепроматозную форму.
Осложнения
Самые тяжелые осложнения являются следствием периферической невропатии, которая вызывает ухудшение осязания и неспособность чувствовать боль и температуру. Пациенты могут, не осознавая этого, обжечься, порезаться или причинить себе вред. Повторное повреждение может привести к потере пальцев. Слабость мышц может привести к уродствам (например, захват 4-ми и 5-ми пальцами, что вызвано поражением локтевого нерва, отвислая стопа ноги, что вызвано поражением малоберцового нерва).
Папулы и узелки могут особенно уродливо выглядеть на лице.
Другие области тела, которые могут быть поражены:
Ноги: язвы подошв ног с вторичной инфекцией – причина сильных болей при ходьбе.
Нос: повреждение слизистой оболочки носа может привести к хронической заложенности носа и кровотечениям из носа и, если не лечить, к эрозии и провалу носовой перегородки.
Половая функция: у мужчин с лепроматозной лепрой могут быть проблемы с эрекцией и бесплодие. Инфекция может уменьшить выработку тестостерона и выработку спермы яичками.
Реакции иммунной системы при проказе
В процессе развития нелечённой или даже лечённой лепры иммунная система может вырабатывать воспалительные реакции. Существует 2 типа.
Реакции типа 1 связаны с непосредственным усилением клеточного иммунитета. Эти реакции могут вызвать лихорадку и воспаление существующих ранее поражений кожи и периферических нервов, что приводит к отеку кожи, эритеме и болезненности и ухудшает функцию нерва. Эти реакции, особенно если нет лечения на раннем этапе, значительно способствуют поражению нервов. Поскольку иммунная реакция усилена, эти реакции называют обратными реакциями, несмотря на очевидное клиническое ухудшение.
Реакции типа 2 (эритема nodosum leprosum) являются системными воспалительными реакциями, которые напоминают васкулит или панникулит и, вероятно, включают отложение циркулирующих иммунных комплексов или увеличенную функцию клеток T-хелперов. Они стали менее распространенными, т.к. клофазимин был добавлен к схеме приема препарата. У пациентов могут появиться эритематозные и болезненные папулы или узелки, которые переходят в пустулы и язвочки и вызывают лихорадку, неврит, лимфаденит, орхит, артрит (особенно в больших суставах, обычно коленных) и гломерулонефрит. Гемолиз или подавление костного мозга может вызвать анемию, а воспаление печени может вызвать легкие отклонения в анализах функции печени.
Диагностика лепры
Микроскопическое исследование образцов биопсии кожи
В США диагноз проказы часто несвоевременный из-за того, что врачи незнакомы с клиническими проявлениями.
Диагноз проказы устанавливается на основании наличия поражений кожи и периферической невропатии и подтверждается микроскопированием биоптата. Mycobacterium leprae и M. lepromatosis не растут на искусственной культуральной среде. Материалы биопсии должны быть взяты из переднего края туберкулоидных поражений или, в случае лепроматозной лепры, из узелков или бляшек.
Антитела сывороточного IgM к M. leprae являются специфическим показателем, но с низкой чувствительностью (есть только у двух третьих пациентов с туберкулоидной лепрой). Диагностическая ценность ограничена в эндемичных областях вследствие того, что такие антитела могут быть и при бессимптомной инфекции.
Лечение проказы
Долгосрочные, со множеством лекарств схемы, включающие дапсон, рифампин и иногда клофазимин
Иногда поддерживающие антибиотики в течение всей жизни
Антибиотики могут остановить развитие лепры, но не приводят к полному восстановлению пораженных нервов или уродств. Таким образом, раннее выявление и лечение жизненно важны.
Из-за резистентности к антибиотикам используются схемы с применением многих препаратов. Выбранные препараты зависят от типа проказы; мультибациллярная проказа требует более интенсивных режимов и более длительной продолжительности, чем олигобациллярная.
Консультацию по диагностике и лечению данного заболевания можно получить в Национальной программе по лепре в Батон-Руже (National Hansen’s Disease Program in Baton Rouge), Луизиана (1-800-642-2477) или Управлении здравоохранения и медицинского обслуживания США (US Health Resources and Services Administration) при HRSA. Стандартные схемы, рекомендуемые ВОЗ, несколько отличаются от используемых в США.
Мультибациллярность
Стандартные схемы, рекомендуемые по ВОЗ, включают дапсон, рифампин и клофазимин. ВОЗ предоставляет эти лекарства бесплатно всем больным лепрой во всем мире. Пациенты принимают рифампин 600 мг перорально и клофазимин 300 мг перорально 1 раз в месяц под наблюдением врача, и дапсон 100 мг перорально плюс клофазимин 50 мг перорально 1 раз/день без наблюдения. Эта схема лечения продолжается в течение 12 мес.
В США предлагается схема лечения, включающая рифампин 600 мг перорально 1 раз/день, дапсон 100 мг перорально 1 раз/день и клофазимин 50 мг перорально 1 раз/день в течение 24 мес.
Олигобациллярность
Стандартная схема, рекомендуемая ВОЗ, включает рифампин 600 мг перорально раз в месяц с наблюдением и дапсон 100 мг перорально 1 раз/день без наблюдения в течение 6 мес. Людям, у которых имеется только одиночное поражение кожи, дают перорально одноразовую дозу рифампина 600 мг, офлоксацина 400 мг и миноциклина 100 мг.
В США предлагается схема лечения, включающая рифампин 600 мг перорально 1 раз/день и дапсон 100 мг перорально 1 раз/день в течение 12 мес.
Препараты при лепре
Дапсон относительно недорог и в общем безопасен для использования. Нежелательные реакции включают гемолиз и анемию (которые являются обычно легкими) и аллергический дерматоз (который может быть тяжелым); редко проявляется синдром дапсона (эксфолиативный дерматит, высокая температура, соотношение белых клеток крови как при мононуклеозе).
Рифампицин является в первую очередь бактерицидным для M. leprae и даже более эффективным, чем дапсон. Однако, если давать его в рекомендуемой в США дозировке 600 мг перорально 1 раз/день, это слишком дорогостоящее лечение для многих развивающихся стран, но ВООЗ обеспечивает его бесплатно. Отрицательные воздействия включают гепатотоксичность, подобные гриппу синдромы и изредка тромбоцитопению и почечную недостаточность.
Клофазимин абсолютно безопасен. Основной нежелательной реакцией является обратимая пигментация кожи, но устранение изменения цвета может занять несколько месяцев. Клофазимин может быть получен только в США от Управление здравоохранения и медицинского обслуживания в качестве исследуемого нового препарата. Запросить дополнительную информацию или статус исследователя, чтобы иметь возможность использовать клофазимин, клиницисты могут обратиться в Национальную программу по болезни Хамсона (проказе) (National Hansen's Disease (Leprosy) Program)по телефону 1-800-642-2477 .
Реакции иммунной системы при проказе
Пациентам с реакциями 1-го типа (кроме незначительного воспаления кожи) изначально дают преднизон 40–60 мг перорально 1 раз/день, что сопровождается более низкими дозами (часто до 10–15 мг 1 раз/день) в течение нескольких месяцев. Незначительное воспаление кожи не требует лечения.
Первый и второй эпизоды эритемы nodosum leprosum, если они легкие, можно лечить аспирином или, при более выраженной форме, преднизоном 40–60 мг перорально 1 раз/день в течение недели плюс антибактериальные препараты. Для случаев рецидива – талидомид 100–300 мг перорально 1 раз/день – является предпочитаемым препаратом (в США доступен через Национальную программу по лепре). Однако из-за его тератогенности талидомид нельзя давать женщинам, которые могут забеременеть. Отрицательные воздействия – умеренный запор, умеренная лейкопения и седативный эффект.
Профилактика проказы
Поскольку лепра не является очень контагиозной, то риск ее распространения низок. Только невылеченная лепроматозная форма является контагиозной, но даже и тогда инфекция не распространяется легко. Тем не менее, при развитии симптомов и признаков лепры должны контролироваться бытовые контакты (особенно с детьми) больных лепрой. Как только лечение началось, больной лепрой не может быть источником распространения болезни.
Лучшей профилактикой является
Избегание контактов с жидкостями человеческого организма и сыпью зараженных людей
Вакцина БЦЖ, используемая для профилактики туберкулеза, обеспечивает определенную защиту против лепры, но с этой целью используется редко. Химиопрофилактика не играет никакой роли.
Ключевые моменты относительно проказы
Лепра является хроническим инфекционным заболеванием и, как правило, вызывается кислото-устойчивыми бациллами Mycobacterium leprae.
Лепра не является очень контагиозной у пациентов, не проходивших лечение, и совсем не контагиозна после начала лечения.
Лепра поражает главным образом кожу и периферические нервы.
Наиболее тяжелые осложнения связаны с потерей чувств осязания, боли и температуры; мышечная слабость, которая может привести к деформации; и уродующие поражения кожи и слизистой оболочки носа.
Могут возникнуть воспалительные реакции, называемые лепрозными реакциями и требующими лечения кортикостероидами.
Диагностика основывается на результатах биопсии; М. leprae или M. lepromatosis не растут на питательных средах.
Лечение зависит от формы лепры, но включает в себя схемы комбинированного лекарственного лечения, обычно использующие дапсон, рифампин и клофазимин для полибактерий и дапсон и рифампицин для олигобацилл.

Заразное уродство
Лепра по сравнению с холерой и чумой — тихая и скрытая болезнь. После заражения может пройти десять или даже двадцать лет, прежде чем возникнут первые симптомы. Сначала на коже появляются нечувствительные к боли пятна, руки и ноги начинают неметь. Очень важно как можно быстрее начать лечение, ведь через несколько месяцев после того, как болезнь проявила себя, возникает необратимое повреждение периферических нервов. Человек теряет контроль над мышцами и оказывается парализованным. Но еще раньше организм атакуют вторичные инфекции, поражающие глаза, кожу, слизистые оболочки и суставные хрящи в кистях и стопах. Пальцы деформируются и укорачиваются из-за отмирания фаланг, черты лица искажаются, образуются трофические язвы.
Сам по себе возбудитель проказы — микобактерия Mycobacterium leprae — не является смертоносным убийцей, как чумная палочка или холерный вибрион. Это облигатный паразит, не способный жить вне клеток человека, поэтому в его интересах не убивать хозяина быстро. Но он разрушает первичный защитный барьер организма, делая человека уязвимым ко многим другим патогенам. Вторичные инфекции — основная причина смерти больных лепрой.
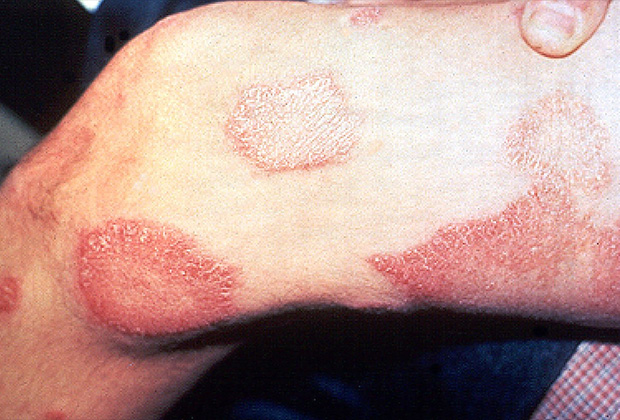
Пораженные участки кожи
Человек с лепрой становится разносчиком микобактерий, заражая других людей. В группу риска входят жители бедных стран, страдающие от недоедания и сниженного иммунитета. Хотя до сих пор не совсем понятно, как M. leprae проникает в организм, считается, что заражение происходит через верхние дыхательные пути. Сейчас известно, что однократный тесный контакт с заболевшим лепрой, например, рукопожатие или нахождение рядом с инфицированным, редко приводит к заражению. M. leprae не передается половым путем и не проникает в нерожденного ребенка, если носителем является беременная женщина.
Из глубин веков
До появления современной медицины в Африке и Евразии был распространен грибок трихофитон Trichophyton schoenleinii, вызывающий фавус, или паршу, при которой на коже образуется твердая корка. Больные фавусом или псориазом также объявлялись прокаженными, изгонялись из общества или попадали в лепрозории. Иногда с проказой путали и сифилис.

Вечные изгои

Изображение больного проказой
Лепрозории создавались при монастырях, где больные могли чувствовать себя в относительной безопасности, а здоровые граждане чувствовали облегчение из-за того, что прокаженные держались от них подальше. К XIII веку в Европе появилось до двадцати тысяч лепрозориев, в том числе больницы при Ордене Святого Лазаря, позднее названные лазаретами.
Борьба с проклятьем
Хотя лепрозории в какой-то мере ограничивали распространение болезни, главной причиной окончания эпидемии, как продемонстрировали недавние исследования, стала выработка у населения Европы устойчивости. Реконструкция генома микобактерии показала, что возбудитель проказы генетически почти не изменился, и современные штаммы идентичны древним. Это означает, что эпидемия закончилась не потому, что как-то изменился сам патоген. Высокая распространенность лепры привела к тому, что среди европейцев все чаще появлялись невосприимчивые к болезни люди. На это повлиял естественный отбор, в том числе пожизненная социальная изоляция заболевших, которые теряли возможность продолжить свой род.
Прорыв в понимании болезни был сделан в XIX веке, когда норвежский врач Герхард Хансен открыл истинного виновника проказы — M. leprae. Он показал, что болезнь не передавалась по наследству, как считали некоторые его коллеги. Хансен продемонстрировал, что изоляция больных имела строгое научное обоснование: болезнь вызывалась микроорганизмами, которые могли передаваться от человека к человеку. По рекомендациям врача в Норвегии больным запретили свободное передвижение по стране, они обязаны были находиться в изоляции в больницах или сидеть дома. Такие меры показали высокую эффективность, ведь в итоге заболеваемость проказой резко упала. Норвежский опыт затем переняли другие европейские страны.
Эффективного лечения проказы не было вплоть до 1940-х годов, когда был синтезирован промин — на тот момент единственный известный препарат, обладающий бактерицидной активностью против M. leprae. Однако уже в 60-х годах микобактерии выработали к нему устойчивость, поэтому врачи перешли на другие соединения: клофазимин и рифампицин. Затем врачи стали использовать все три препарата в качестве комбинированной терапии, что позволило предотвратить появление устойчивых штаммов бактерии.
Сейчас во всем мире фиксируется около 200 тысяч случаев проказы в год, однако при своевременной диагностике болезнь полностью излечима. Несмотря на международные меры по профилактике, лечению и просвещению, проблема стигматизации больных остается острой в развивающихся странах, где проказа все еще распространена и часто встречается среди бедных и маргинализованных групп населения.
Во многих частях мира до сих пор царят народные верования и религиозные трактовки болезней, что объясняется низким уровнем образования. В Бразилии верят, что проказа связана с сексуальной распущенностью, а болезнь послана как наказание за грехи и моральные проступки. В Индии прокаженных приравнивают к касте неприкасаемых, и этот статус сохраняется даже после того, как человек излечился. В результате заболевшие лепрой становятся изгоями, они теряют работу и дом, их выгоняют из семьи. Оправданный страх остаться в одиночестве затрудняет диагностику и раннее лечение проказы, и это одно из объяснений, почему человечеству до сих пор не удается окончательно победить болезнь.
Читайте также:

