Что такое микробиологический туберкулез
Обновлено: 18.04.2024
Диагностику туберкулеза органов дыхания проводят поэтапно. Методы обязательного диагностического минимума позволяют установить диагноз с наименьшими затратами. Двумя достоверными критериями диагностики остаются обнаружение микобактерий туберкулеза в материале, полученном от больного, и специфические морфологические изменения в биоптате из пораженного органа. В сложных и сомнительных случаях применяют дополнительные неинвазивные и инвазивные методы исследования, позволяющие верифицировать диагноз.
Diagnosis of tuberculosis of respiratory system is being established step by step. Two valid criteria of diagnosis are identification of mycobacteria in the material, received from the patient and specific morphological changes in complicated and doubtful cases a supplementary noninvasive and invasive methods of investigation are applied, which permitt to verify the diagnosis.
В.Ю. Мишин— доктор мед. наук, ведущий научный сотрудник ЦНИИ
туберкулеза РАМН, Москва
V.Yu. Mischin, Dr.Sci, leading research worker, Central Institute of Tuberculosis, Academy of Medical Sciences, Russia
П роцесс диагностики туберкулеза органов дыхания включает несколько этапов. Первый – выявление лиц с различными заболеваниями легких, подозрительными на туберкулез. Этот этап происходит, как правило, в поликлиниках и стационарах общей сети.
В течение многих лет основу выявления туберкулеза органов дыхания у взрослых составлял рентгенологический метод исследования. Раннее выявление туберкулеза осуществлялось с помощью флюорографии, которую проводили всем обратившимся в поликлиники и не обследованным в текущем году рентгенологическим методом, а также лицам, входящим в группы повышенного риска по заболеванию туберкулезом (больные сахарным диабетом, пациенты, получающие кортикостероидные препараты, лучевую терапию и др.). Флюорография также ежегодно проводилась “обязательным контингентам”, подлежащим обследованию на туберкулез (работникам детских и коммунальных учреждений, предприятий общественного питания, продуктовых магазинов, общественного транспорта и др.). Массовые флюорографические обследования подростков и взрослых, проводившиеся 1 раз в 2 года, охватывали большинство населения и позволяли выявлять больных туберкулезом органов дыхания на сравнительно ранних этапах его развития. С помощью флюорографического метода исследования определяли и отбирали больных в основном с ограниченными локальными процессами в виде очагового туберкулеза, ограниченных инфильтратов, диссеминаций и туберкулем. Клинические проявления заболеваний у таких больных были выражены незначительно или отсутствовали. Обследованные с такими формами заболевания часто не чувствовали себя больными, сохраняли трудоспособность. В процессе дообследования в первую очередь проводили рентгенографию органов дыхания для уточнения изменений, выявленных при флюорографии.
В последние годы профилактические флюорографические исследования населения в значительной степени сократились, что привело к весьма существенному уменьшению числа выявляемых больных туберкулезом. В сложившихся условиях особое значение приобрело выявление больных туберкулезом органов дыхания среди лиц, обратившихся за медицинской помощью.
Первоочередной задачей остается выявление бациллярных больных туберкулезом органов дыхания, так как у таких больных имеется, как правило, прогрессирующий туберкулезный процесс, и они представляют большую эпидемиологическую опасность для окружающих. Излечение выявленных бациллярных больных имеет как клиническое, так и эпидемиологическое значение, так как позволяет не только предотвратить смерть от прогрессирования туберкулеза, но и прекратить распространение микобактерий, избежать развития хронического процесса с постоянным или периодическим выделением микобактерий. В связи с сокращением флюорографических исследований возрастает роль правильной оценки имеющейся у больного клинической симптоматики и микроскопического исследования мокроты на микобактерии туберкулеза. Диагностика бациллярного туберкулеза должна проводиться в первую очередь у больных с проявлениями воспалительной интоксикации, выделяющих мокроту.
Все методы исследований для диагностики туберкулеза можно разделить на 3 группы: обязательный диагностический минимум (ОДМ), дополнительные методы исследования неинвазивного (ДМИ-1) и инвазивного (ДМИ-2) характера и, наконец, факультативные методы [1].
ОДМ включает изучение анамнеза, жалоб, клинических симптомов, физикальное исследование, рентгенографию органов грудной клетки в прямой и боковой проекциях, микроскопию и посев мокроты с целью выявления микобактерий туберкулеза, пробу Манту с 2 ТЕ, клинические анализы крови и мочи.
К ДМИ-1 относятся томография и зонография легких и средостения, в том числе компьютерная томография, ультразвуковое исследование при плеврите и субплеврально расположенных округлых образованиях; повторное исследование мокроты, промывных вод бронхов на микобактерии туберкулеза методами флотации и полимеразной цепной реакции; определение лекарственной чувствительности микобактерий; посев мокроты на неспецифическую микрофлору и грибы; углубленная туберкулинодиагностика.
ДМИ-2 включают бронхоскопию с биопсией и бронхоальвеолярным лаважем; пункцию плевральной полости и плевробиопсию; трансторакальную биопсию легкого; торакоскопию, медиастиноскопию и, наконец, открытую биопсию легкого с последующими цитологическими, гистологическими и микробиологическими исследованиями полученного материала. Факультативные методы весьма многочисленны и направлены не столько на диагностику туберкулеза, сколько на определение функционального состояния различных внутренних органов и обменных процессов. Это исследования уровня глюкозы в крови, функции печени, сердечно-сосудистой системы, функции внешнего дыхания, газового состава крови, легочного кровотока и т.д.
ОДМ следует выполнять, как это следует из самого названия, в полном объеме. ДМИ и факультативные методы применяют по показаниям.
Туберкулезу легких свойственно большое многообразие клинических симптомов, которые варьируют в широких пределах по выраженности и тяжести. Обычно отмечают прямую зависимость между выраженностью клинических симптомов и изменениями в легких, но возможно и их несоответствие: тяжелый туберкулезный процесс и маловыраженная клиническая симптоматика или незначительные изменения и достаточно яркая клиническая картина.
По тяжести локальных изменений можно выделить деструктивные формы туберкулеза легких (казеозная пневмония, кавернозный и фиброзно-кавернозный туберкулез) ; распространенный туберкулез без распада (милиарный, диссеминированный, инфильтративный туберкулез); малые формы туберкулеза (очаговый туберкулез, ограниченные инфильтраты, небольшие туберкулемы). Наиболее выражена клиническая симптоматика у больных с деструктивными и распространенными формами туберкулеза, при малых формах обычно отмечают малосимптомное течение заболевания.
В клинической картине туберкулеза органов дыхания в основном выделяют синдром воспалительной интоксикации и бронхолегочные (“грудные”) симптомы, обусловленные специфическим воспалительным процессом в легких. Синдром воспалительной интоксикации включает в себя такие клинические проявления, как повышение температуры тела, потливость и ночные поты, ознобы, повышенную утомляемость, слабость, снижение или отсутствие аппетита, потерю массы тела, тахикардию. “Грудные” симптомы – кашель, выделение мокроты, боль в грудной клетке, кровохарканье и легочное кровотечение, одышка.
Как известно, начало заболевания туберкулезом органов дыхания может быть острым и постепенным, а течение – волнообразным, с периодами обострения (вспышки) и затихания процесса.
У большинства больных туберкулез развивается постепенно, с малозаметных симптомов. Однако в последнее время стали чаще встречаться остро начинающиеся и прогрессирующие деструктивные формы по типу “скоротечной чахотки” (казеозной пневмонии), описанной еще в начале столетия, диссеминированного, в том числе милиарного, туберкулеза, иногда сопровождающегося туберкулезным менингитом и менингоэнцефалитом.
Внимательный расспрос больного о жалобах и клинических проявлениях болезни имеет большое значение для диагностики туберкулеза и определяет ход дальнейшего исследования. Необходимо попытаться установить время начала заболевания для определения его продолжительности, а также выяснить, обратился ли больной за медицинской помощью вскоре после появления клинической симптоматики или болезнь существует давно. При изучении анамнеза следует особое внимание уделить вопросу о контактах пациента с больными туберкулезом дома или на работе, наличии родственников, больных туберкулезом.
В настоящее время можно считать доказанным наследственную предрасположенность к туберкулезу. Определенное значение имеют сведения о результатах предшествующего медицинского обследования, времени и причинах его проведения (профилактические осмотры, обращение за медицинской помощью по поводу легочного заболевания и т.д.). Женщин детородного возраста опрашивают о беременностях, родах, так как иногда туберкулез может развиваться в период беременности и после родов. У лиц молодого возраста (до 25 лет) следует по возможности уточнить, проводили ли им вакцинацию и ревакцинацию БЦЖ против туберкулеза.
Врачебный осмотр больного при малых формах туберкулеза органов дыхания, диссеминации и туберкулемах, как правило, дает мало информации для диагностики. Более выраженные изменения могут быть при распространенных и деструктивных формах туберкулеза. У таких больных можно определить притупление перкуторного звука в области туберкулезных изменений, бронхиальное или жесткое дыхание, сухие или влажные хрипы. При наличии кашля с выделением мокроты и особенно кровохарканья необходимо в первую очередь исследовать мокроту методом микроскопии на микобактерии туберкулеза. Результативность возрастает при исследовании мокроты, собранной в течение суток, 3 дня подряд. Мазок, приготовленный из мокроты, окрашивают по Цилю – Нельсену и просматривают под микроскопом. Возможно также люминоскопическое исследование мазка, окрашенного ауромином. Выявление микобактерий туберкулеза в 2 из 3 исследованных мазков подтверждает диагноз туберкулеза легких. Одновременно с микроскопией обязательно проводят посев мокроты на питательные среды. При наличии роста культуры определяют чувствительность микобактерий к противотуберкулезным препаратам. Для установления клинической формы туберкулеза делают рентгенограмму грудной клетки в прямой и боковой проекциях. После определения клинической формы туберкулеза (в стационаре общего профиля или в поликлинике с обязательным участием фтизиатра) больного направляют в противотуберкулезные учреждения для лечения.
Наиболее трудная ситуация в диагностике туберкулеза органов дыхания возникает у больных с клинической симптоматикой в случае отсутствия мокроты, а также тогда, когда в мокроте микобактерии туберкулеза не обнаружены. У таких больных при рентгенологическом исследовании туберкулез может проявляться очаговыми, инфильтративными изменениями в легких, диссеминацией, кавернами, увеличением внутригрудных лимфатических узлов и плевритом. Несмотря на описание рентгенологической картины, характерной для туберкулеза, диагноз этого заболевания не следует ставить только на основании данных клинико-рентгенологического обследования. Перечисленные рентгенологические изменения можно наблюдать не только при туберкулезе, они требуют дифференциальной диагностики. Больным с клинико-рентгенологическими проявлениями, характерными для туберкулеза, при удовлетворительном общем состоянии можно провести бронхоскопию с исследованием аспирата из бронхов или бронхоальвеолярных смывов на микобактерии туберкулеза. Возможно также цитологическое и гистологическое исследование биоптата легочной ткани. Этот метод очень важен и информативен не только для верификации диагноза туберкулеза, но и для дифференциальной диагностики туберкулеза, рака и других заболеваний.
Существуют неинвазивные методы подтверждения диагноза туберкулеза, в частности определение специфических противотуберкулезных антител и антигенов микобактерий туберкулеза в сыворотке крови. Необходимо отметить определенное диагностическое значение туберкулиновых проб. В настоящее время в России применяют пробу Манту (внутрикожное введение 2 ТЕ очищенного туберкулина PPD). Отрицательная туберкулиновая реакция свидетельствует, как правило, об отсутствии инфицирования туберкулезом. Положительная реакция обусловлена сенсибилизацией к туберкулину в результате вакцинации БЦЖ или перенесенной первичной туберкулезной инфекции. Заболевание легких у таких пациентов может быть как туберкулезной, так и другой этиологии. Для диагностики туберкулеза важное значение имеет вираж туберкулиновой пробы (увеличение размеров папулы на 5 мм и более за год) и гиперергическая реакция Манту (размер папулы 21 мм и более). Особенно это характерно для случаев развития первичных форм туберкулеза органов дыхания у лиц молодого возраста.
В случаях, когда указанные методы не позволяют подтвердить активный туберкулез, можно использовать метод диагностики ex juvantibus. Больным с клиническими симптомами и рентгенологическими изменениями, которые свидетельствуют об активном туберкулезе или сомнительной активности процесса, а также при гиперергической туберкулиновой пробе назначают химиотерапию противотуберкулезными препаратами. В таких случаях через 2 – 3 мес необходимо повторное рентгенологическое исследование. При заболевании туберкулезной этиологии отмечается частичное или полное рассасывание воспалительных изменений. Это так называемый отсроченный диагноз [2]. К этому времени удается получить результаты посева мокроты на питательные среды, сделанного перед началом химиотерапии. Рост культуры при наличии в материале микобактерий туберкулеза обычно бывает отмечен через 4 – 8 нед, что служит подтверждением диагноза.
В настоящее время туберкулез органов дыхания часто сочетается с различными заболеваниями внутренних органов. Клинические проявления заболеваний нетуберкулезной этиологии вынуждают больного обращаться за медицинской помощью, а туберкулезный процесс протекает малосимптомно и незаметно для больного. В таких случаях больные обращаются в поликлиники, их госпитализируют в стационары различного профиля. При подозрении на малосимптомное течение туберкулеза нужно по возможности собрать мокроту и провести микроскопическое исследование мазка, назначить рентгенологическое исследование. Обнаружение микобактерий и соответствующих рентгенологических изменений в легких позволяет установить диагноз без особых затруднений. При отсутствии микобактерий в мокроте больного нужно дополнительно обследовать по описанной методике.
Диагноз туберкулеза нужно формулировать в соответствии с официальной клинической классификацией. Сначала указывают клиническую форму туберкулеза, локализацию процесса, фазу и результаты исследования мокроты: БК (+) или БК (-), по данным микроскопического исследования, уточненного результатами посева материала на питательные среды.
Правильная и своевременная диагностика туберкулеза органов дыхания позволяет выявить больных на ранних этапах развития заболевания, а химиотерапия, начатая вовремя, позволит предотвратить развитие у них распространенных, прогрессирующих форм с выделением микобактерий.
1. Хоменко А.Г. Основы диагностики туберкулеза // Российский мед. журнал. – 1995. – № 1. – С. 21–5.
2. Туберкулез. Руководство для врачей. – М.: Медицина, 1996.
Морфология туберкулёза человека. Палочка Коха. Тинкториальные свойства туберкулеза. Культуральные свойства возбудителя туберкулеза.
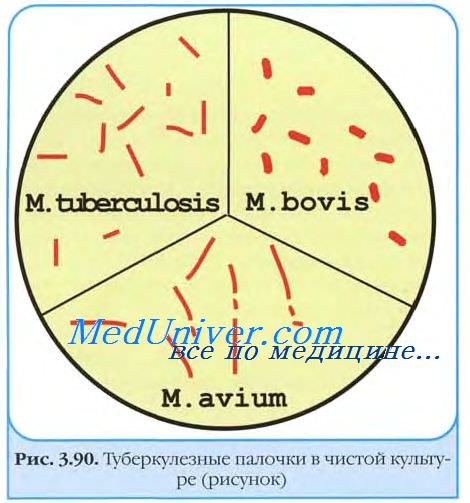
М. tuberculosis (палочка Коха) — тонкая, прямая или слегка изогнутая палочка, размером 1-10*0,2-0,6 мкм, со слегка закруглёнными концами (рис. 22-1). В молодых культурах палочки более длинные, а в старых склонны к ветвлению.
Бактерии туберкулёза способны образовывать L-формы, сохраняющие способность к инфицированию, а также фильтрующиеся формы, патогенетическая роль которых остаётся плохо изученной. Капсул не имеют, но образуют микрокапсулу.
Методом Циля-Нильсена окрашиваются в ярко-красный цвет. Содержат кислотонеустойчивые гранулы (зёрна Муха), располагающиеся в цитоплазме.
Культуральные свойства возбудителя туберкулеза
Туберкулёзные палочки могут расти как в аэробных, так и факультативно анаэробных условиях. Повышенное содержание СО2 (5-10%) способствует более быстрому росту. Оптимальная температура 37-38 °С; рН 7,0-7,2. Нуждаются в присутствии белков, глицерина, факторов роста (биотин, никотиновая кислота, рибофлавин и др.), ионов (Mg2+ K+, Na+ Fe2+) и др.
Для выращивания бактерий туберкулеза наиболее часто применяются глицериновые, картофельные с жёлчью, яичные, полусинтетические и синтетические среды. Наиболее оптимальна среда Лёвенштайна-Йёнсена.
На средах туберкулёзные палочки обычно образуют R-колонии; под влиянием антибактериальных препаратов бактерии могут диссоциировать с образованием мягких и влажных S-колоний.
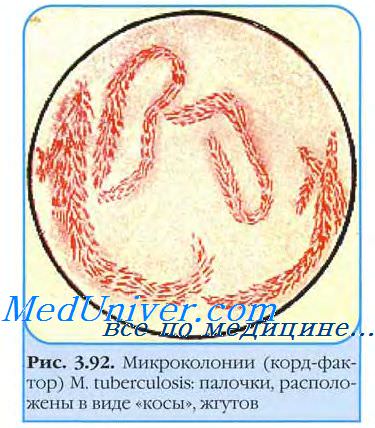
В жидких средах палочки туберкулеза образуют сухую морщинистую пленку (на 7-10-е сутки), поднимающуюся на края пробирки; среда остаётся прозрачной. В жидких средах выявляют корд-фактор — важный дифференциальный признак вирулентности. Наличие корд-фактора обусловливает сближение бактериальных клеток в микроколониях и их рост в виде серпантинообразных кос.
На плотных средах рост палочек туберкулеза отмечают на 14-40-е сутки в виде сухого морщинистого налёта желто-, вато-кремового цвета. Зрелые колонии напоминают цветную капусту, крошковатые, плохо смачиваются водой и имеют приятный запах. Культуры плохо снимаются со среды, а при прокаливании трещат. Отличительная особенность М. tuberculosis— способность к синтезу значительного количества никотиновой кислоты (ниацина); ниациновый тест — важный метод дифференцировки микобактерий.
Диагностика туберкулеза. Принципы микробиологической диагностики туберкулеза. Выделение возбудителя туберкулеза.
Для диагностики туберкулёза применяют бактериоскопические, бактериологические, биологические, серологические и аллергологические методы, входящие в обязательный диагностический минимум. Материалом для исследований служат мокрота, отделяемое свищей, моча, СМЖ, испражнения.
Микроскопия возбудителя туберкулеза в патологическом материале. В мазках, окрашенных по Цилю-Нильсену, обнаруживают кислотоустойчивые палочки возбудителя туберкулеза.
Нередко материал содержит мало бактерий туберкулеза и для повышения вероятности их обнаружения используют методы обогащения: центрифугирование и флотацию. В первом случае исследуемый материал обрабатывают смесью растворов NaCl и NaOH, центрифугируют и микроскопируют осадок. Второй метод включает обработку материала смесью NaOH, дистиллированной воды и ксилола (или бензола). Образец энергично встряхивают; образующаяся пена всплывает и захватывает микобактерии. Пену отсасывают и готовят мазки.
Наиболее результативна люминесцентная микросколия возбудителя туберкулеза. Материал обрабатывают аурамин-родамином и бактерии окрашиваются в бело-жёлтый цвет. Для выявления L-форм применяют AT, меченные флюорохромами.
Выделение возбудителя туберкулеза
Достоинство метода — возможность получения чистой культуры туберкулеза, позволяющая её идентифицировать, оценить вирулентные свойства и определить чувствительность к ЛС. Материал засевают, тщательно втирая, на твёрдые питательные среды.
Для повышения эффективности выделения возбудителя туберкулеза и уничтожения контаминирующей микрофлоры применяют методы обогащения или обрабатывают материал 6-12% серной кислотой. Основной недостаток бактериологического метода — длительность получения результата (от 2 до 12 нед). В связи с этим разработаны ускоренные микрометоды выделения возбудителя туберкулеза.
Один из распространённых методов выделения возбудителя туберкулеза, метод Прайса, заключается в следующем. Материал помещают на предметное стекло, обрабатывают серной кислотой, отмывают физиологическим раствором и вносят в питательную среду, дополненную цитратной лизированной кровью.
Стекло вынимают через 3-4 сут и окрашивают но Цилю-Нильсену. При микроскопии обнаруживают микроколонии микобактерии возбудителя туберкулеза. Вирулентные бактерии образуют змеевидные (рис. 22-2), а невирулентные — аморфные микроколонии. Культуры L-форм выделяют посевом в столбик полужидкой среды и инкубируют при 37 °С 1-2 мес.
Рост проявляется в виде облачка помутнения с мелкими вкраплениями. Вирулентность выделенной культуры возбудителя туберкулеза определяют заражением лабораторных животных и по наличию корд-фактора. Последний легко идентифицируют по способности микобактерии связывать нейтральный красный и нильский голубой и удерживать их после добавления щелочи. Вирулентные штаммы возбудителя туберкулеза удерживают красители, авирулентные — нет.
Лабораторная диагностика туберкулеза. Выявление бактерий туберкулеза.
В распознавании и дифференциальной диагностике туберкулеза, а также в определении эффективности проводимого лечения важную роль играют лабораторные методы исследования. Среди них большое значение имеют прежде всего способы обнаружения микобактерии туберкулеза в различных выделениях, воспалительных экссудатах, жидкостях и тканях организма больного.
При туберкулезе легких микобактерии находят прежде всего в мокроте. Частота, массивность и постоянство бацилловыделения зависят от формы процесса. Оно часто имеет место при инфильтративном и особенно деструктивном туберкулезе легких. Реже или периодически выделяют микобактерии больные очаговыми, диссеминированными и цирротическими формами туберкулеза без явного распада легочной ткани. Существенное значение имеет при этом состояние бронхов. При их специфическом поражении, но сохраненной дренажной функции микобактерии выявляются с мокротой сравнительно чаще и с большим постоянством, чем при нормальном состоянии бронхов или при их стенозе, вызывающем блокаду каверны.
Микобактерии туберкулеза находят в большом количестве в обильно выделяющейся мокроте, а в скудном отделяемом, наоборот, они встречаются реже и в виде единичных экземпляров. У больных, не выделяющих мокроту, лучшие результаты дает применение раздражающих аэрозольных ингаля пий 10—15% раствора поваренной соли в 1% растворе питьевой соды Н. М. Рудой и соавт. (1971) применяют с этой целью смесь, состоящую из 5 мл 10% раствора хлорида натрия, 1 мл химопсина, растворенного в физиологическом растворе, и 20 капель солутана.
Второе место по эффективности выявления бацилловыделения у больных, не выделяющих мокроту, занимает исследование промывных вод трахеи и бронхов, которое предложил Я. С. Зобин (1939). В настоящее время для анестезии гортани у взрослых применяют 0,25% раствор дикаина, разведенный в 10% растворе новокаина. Этот раствор наливают во время фонации на голосовые связки в количестве 0,5—1 мл. У больных с повышенным глоточным рефлексом этим раствором смазывают заднюю стенку глотки. Затем в трахею шприцем с напаянной канюлей вводят 10—20 мл физиологического раствора комнатной температуры.
При этом в результате раздражения слизистой оболочки бронхов возникает кашель, при котором из глубоких дыхательных путей вместе с введенной жидкостью выделяются слизь и мокрота. Это отделяемое исследуют на присутствие микобактерии туберкулеза или другой микробной флоры.
Исследование промывных вод бронхов редко сопровождается серьезными осложнениями. Только при сильном, длительном и приступообразном кашле иногда появляется кровохарканье, может аспирироваться инфекционный материал в здоровые участки легочной ткани, нарастает сердечная недостаточность. Такие явления отмечаются главным образом у больных с сопутствующей бронхиальной астмой, пороком сердца, гипертонией. В подобных случаях, очевидно, не следует прибегать к данному методу исследования. При отсутствии таких противопоказаний, особенно у больных с ограниченными формами процесса, у которых чаще всего и возникает необходимость в исследовании промывных вод бронхов, обычно не наблюдается каких-либо осложнений, и поэтому его можно производить не только в клинических, но и в амбулаторных условиях.
Менее эффективно производимое натощак исследование промывных вод желудка, в которых может содержаться бациллярная мокрота или бронхиальная слизь, чаще заглатываемая детьми, а иногда и взрослыми (Аrmand-Dellille, 1927). Кроме того, микобактерии могут проникать в желудок через его слизистую оболочку при гематогенном распространении инфекции в организме, а также при забрасывании бациоллосодержащей желчи (М. Д. Розанова, 1950). Пользоваться этим методом рекомендуется в тех случаях, когда не удается получить мокроту при раздражающих ингаляциях, при противопоказаниях к применению промывания бронхов или при невозможности их проведения по другим причинам.
Наименее информативно определение бацилловыделения с помощью исследований мазков слизи из гортани, а также промывания только верхних отделов дыхательных путей.
У части больных можно выделить микобактерии из крови. По наблюдениям 49 авторов, обобщенным в 1954 г. Dalencour, бациллемия отмечалась в среднем у 5,3% больных различными формами туберкулеза. П. И. Беневоленский (1945) установил ее у 3,7% больных туберкулезом легких (исключая страдающих гематогенным процессом). Чаще обнаруживают микобактерии в крови при туберкулезе кожи, обширных гематогенных диссеминациях в легких, при менингите. Однако, по сводным данным Kallos (1937). основанным на изучении гемокультур, выделенных от 14 502 больных, туберкулезная бациллемия имела место всего лишь у 1,13% из них.
Частота выявления микобактерии зависит не только от формы заболевания, метода получения материала, но и от способа его исследования (бактериоскопия, посев, заражение животных). Микобактерии туберкулеза обнаруживают при прямой бактериоскопии мазков мокроты, окрашенных по Цилю—Нельсену, при микроскопии с использованием метода обогащения — флотации и люминесцентного способа исследования. Методы обогащения повышают частоту обнаружения микобактерии туберкулеза в мокроте, промывных водах желудка и бронхов, в экссудате, спинномозговой жидкости, в каловых массах на 10—20% по сравнению с результатами прямой бактериоскопии.
Среди бактериоскопических методов выявления бацилловыделения наиболее чувствительным является люминесцентная микроскопия, повышающая возможность обнаружения в мокроте микобактерии на 15—20% по сравнению с обычной бактериоскопией, а при исследовании мазков из флотационных колец — на 8—10%. При этом облегчается изучение некоторых биологических свойств возбудителя — старения культур, аутолиза клеток и др.
Некоторые авторы утверждают, что при флюоресцентной (люминесцентной) микроскопии микобактерии туберкулеза можно выявить даже чаще, чем при посевах мокроты и других материалов на различные питательные среды. Kolbel (1955) обнаружил их при простой бактериоскопии у 39,7% больных, при бактериологическом методе — у 52,1%, а при люминесцентной микроскопии — у 73,6%. На преимущество последнего метода указывают Т. Н. Ященко и И. С. Мечева (1973), Н. С. Страхов и соавт. (1973).
Для суждения об эффективности проводимой антибактериальной терапии придают прогностическое значение уменьшению (или сохранению) в динамике массивности бацилловыделения. Поэтому целесообразно не только констатировать бацилловыделение, но и оценивать его количественный показатель. При этом при бактериоскопии бацилловыделение оценивается как обильное, если находят микобактерии в каждом поле зрения, умеренное — при наличии «единичных микробов в 40—50 полях зрения и скудное — при нахождении их единичных экземпляров в препарате.
Для цитирования: Черноусова Л.Н. Современные тенденции и возможности микробиологической диагностики туберкулеза. РМЖ. 2002;16:697.
ЦНИИ туберкулеза РАМН, Москва
В настоящее время лабораторная диагностика занимает ведущее место в выявлении многих инфекционных заболеваний. Подтверждение диагноза туберкулеза основывается на результатах микробиологических анализов при выделении из биологического материала возбудителя – микобактерий туберкулеза. Современная микробиологическая диагностика туберкулеза состоит из нескольких основных групп анализов, направленных на выявление возбудителя, определение лекарственной чувствительности и типирование микобактерий.
Обнаружение возбудителя
Обнаружение возбудителя начинается с наиболее простых и быстрых бактериоскопических методов с использованием светового микроскопа с окраской по Циль–Нильсену и люминесцентного с окраской флюорохромами. Преимущество бактериоскопии – в быстроте получения результата. Однако возможности ее ограничены из–за низкой чувствительности. Этот метод является наиболее экономичным и рекомендован ВОЗ в качестве основного для выявления заразных больных (табл. 1).
При антибактериальной терапии обнаружение микобактерий туберкулеза имеет прогностическое значение. Поэтому бактериовыделение оценивается количественно. Золотым стандартом выявления микобактерий признаны культуральные исследования. Для посева патологического материала используют яичные среды: Левенштейна–Йенсена, среду Финна II, Мордовского и др. Количество микобактерий (или колоний в пробирке при культуральном методе исследования) в процессе химиотерапии является ориентировочным показателем ее эффективности или косвенным свидетельством развития устойчивости микобактерий к противотуберкулезным препаратам.
Для повышения процента выделения микобактерий посевы патологического материала проводят на несколько сред, в том числе и на жидкие в автоматизированных системах учета роста типа BACTEC, что позволяет удовлетворить все культуральные потребности возбудителя. Посевы инкубируют до двух с половиной месяцев. При отсутствии роста к этому времени посев считается отрицательным. Наиболее чувствительным способом обнаружения микобактерий туберкулеза считается метод биологической пробы – заражение диагностическим материалом высокочувствительных к туберкулезу морских свинок.
Развитие молекулярной биологии позволило значительно повысить эффективность обнаружения микобактерий. Базовым методом молекулярно–генетических исследований является полимеразная цепная реакция (ПЦР), направленная на выявление ДНК микобактерий в диагностическом материале. ПЦР дает экспоненциальное увеличение специфического участка ДНК возбудителя: 20 циклов ПЦР приводят к увеличению исходной ДНК в 1 миллион раз, что позволяет визуализировать результаты методом электрофореза в агарозном геле.
Роль молекулярной диагностики в клинической практике повышается, поскольку увеличивается число больных со скудным бактериовыделением. Однако при постановке диагноза результаты ПЦР являются дополнительными и должны сопоставляться с данными клинического обследования, рентгенографии, микроскопии мазка, посева и даже ответа на специфическое лечение.
Интереснейшая область исследования, которая открывается благодаря ПЦР–диагностике, – изучение латентной инфекции M. tuberculosis. По современной концепции туберкулезной инфекции, из 100 человек, контактирующих с M. tuberculosis, 90 могут быть инфицированы, но только у 10 развивается активная болезнь. У остальных 90% инфекция будет оставаться латентной из–за противотуберкулезного иммунитета. Положительные ответы ПЦР при отрицательных результатах посевов патологического материала отмечаются у 55% лиц, подвергавшихся бытовым контактам с M. tuberculosis, и у 80% лиц, у которых туберкулез протекал без рентгенографических проявлений. Проведение ПЦР–исследований у пациентов из групп риска выявляло больных с отрицательными результатами микроскопии и посевов, но с субклинической инфекцией M. tuberculosis [11]. Подобные результаты были получены и в наших исследованиях [6].
Определение лекарственной устойчивости микобактерий
Для определения лекарственной устойчивости микобактерий используется несколько групп методов (табл. 2). По приказу № 558 МЗ РФ от 1978 г. в бактериологических лабораториях России используется метод абсолютных концентраций. В лаборатории ЦНИИТ РАМН внедрен ускоренный метод по тестированию нитратредуктазной активности микобактерий с помощью реактива Грисса.
В крупных противотуберкулезных центрах используются методы определения лекарственной устойчивости в жидких средах с автоматизированной радиометрической и флюоресцентной системой учета роста микобактерий типа ВАСТЕК, позволяющие сокращать срок анализа до 14 дней.
В последнее время разрабатываются новые методы оценки лекарственной устойчивости на уровне генотипа [10]. Работа по изучению молекулярных механизмов резистентности показала наличие у микобактерий генов, связанных с устойчивостью к различным препаратам: к изониазиду – гены katG, inhA, kasA, к рифампицину – rpoB, к стрептомицину – rpsL и 16SрРНК, к этамбутолу – emb1, к фторхинолонам – gyrA и т.д. [7].
Широкомасштабные исследования по изучению спектра мутаций в геноме устойчивых микобактерий показали, что наиболее распространенными были мутации в 531, 526 и 516 кодонах rpoB гена, устойчивость к изониазиду характеризовалась мутациями в 315 кодоне katG гена. В целом спектр мутаций не отличался от выявленных исследователями в разных регионах мира [2].
Доступность данных по молекулярной основе лекарственной устойчивости к противотуберкулезным препаратам дала возможность разработки новых, основанных на ПЦР, методов, представленных в табл. 2. Наши работы, проведенные совместно с Институтом физико–химической медицины МЗ РФ и Институтом молекулярной биологии РАН, продемонстрировали перспективность использования молекулярно–генетических методов для быстрого определения лекарственной устойчивости [1, 3, 4].
Наибольшие надежды по совершенствованию методов для определения лекарственной устойчивости микобактерий связаны с развитием микрочиповой технологии, позволяющей определять устойчивость одновременно к нескольким противотуберкулезным препаратам микобактерий непосредственно из диагностического материала в течение 2 дней [9].
Типирование микобактерий
Комплекс методов имеется и для типирования микобактерий, когда используются традиционные культуральные и биохимические методы, биологические, а также молекулярно–генетические (табл. 3). На основе молекулярно–генетического типирования микобактерий интенсивно развивается область молекулярно–эпидемиологических исследований, в которой по генотипу микобактерии выявляются очаги и прослеживаются пути распространения туберкулезной инфекции [5, 8].
2. Генерозов Э.В. и др. Молекулярная характеристика полирезистентных клинических штаммов Mycobacterium tuberculosis из России. // Молекулярная генетика, микробиология и вирусология, 2000; 1: 11–7.
3. Генерозов Э.В.и др. Детекция и характеристика мутаций в rроВ гене резистентных к рифампицину клинических штаммов Mycobacterium tuberculosis. // Проблемы туберкулеза, 1999; 2: 39–42.
4. В.М. Михайлович и др. Использование методов гибридизации и ПЦР на специализированном ТБ–микрочипе для обнаружения рифампицин–резистентных штаммов Mycobacterium tuberculosis // БЭБ и М, 2001, 1: 112–7.
5. Черноусова Л.Н.и др. Молекулярная эпидемиология туберкулеза в тюрьмах. // Актуальные проблемы пенитенциарной медицины. Мат–лы международной научно–практич. конференции, Минск, 2001: 48–50.
6. Черноусова Л.Н., Ларионова Е.Е., Севастьянова Э.В., Голышевская В.И. Роль ПЦР–анализа в комплексных бактериологических анализах во фтизиатрии. // Проблемы туберкулеза, 2001; 3: 58–60.
Читайте также:

