Что такое монотерапия при вич
Обновлено: 24.04.2024
В середине 1980-х ученые идентифицировали вирус иммунодефицита человека и сразу же стали искать лекарство. История антиретровирусной терапии началась в 1987 году, когда для лечения ВИЧ-инфекции стали использовать препарат зидовудин. Но его эффективность была невысокой, а побочные эффекты слишком сильными. Первая высокоэффективная терапия появилась только через десять лет — в 1996 году. Эта комбинация из нескольких лекарств блокирует размножение попавшего в организм вируса сразу на нескольких этапах его цикла. С тех пор ВИЧ-инфекция — не смертельное, а хроническое заболевание, которое можно контролировать при должном лечении.
Антиретровирусные препараты (АРВ) подавляют размножение ВИЧ, но неспособны полностью удалить вирус из организма, именно поэтому их нужно принимать постоянно в течение всей жизни. Как только концентрация препарата в крови падает ниже порогового значения, вирус снова начинает размножаться. Это особенно опасно, ведь если вирус размножается в присутствии небольшого количества лекарства, то он вырабатывает устойчивость к этому препарату.
Пить таблетки на протяжении всей жизни с точностью до минут — не самая простая задача. Этому мешают и банальная забывчивость, и разные случайные обстоятельства. А чем чаще человек нарушает время приема терапии, тем выше риск развития у вируса устойчивости. Именно поэтому врачи стараются назначать схемы с приемом лекарств один раз в день и с минимальным числом таблеток — чем реже и меньше нужно принимать лекарств, тем проще соблюдать режим. Правильное соблюдение режима приема терапии называют высокой приверженностью лечению.
Сейчас лучшими схемами считаются те, при которых пациенту нужно принимать одну таблетку один раз в день, да еще и независимо от приема пищи. Но настоящим прорывом в АРВТ станет разработка схем, при которых лекарство достаточно будет принимать всего один или несколько раз в месяц, — пролонгированных схем терапии. Хотя в настоящее время неизвестно, как поведут себя пролонгированные режимы в рутинной практике. Будет ли к ним сохраняться высокая приверженность — как это показывают исследования?
по теме

Общество
Грудное молоко VS смеси при ВИЧ: что говорят эксперты в 2020 году?
Основной недостаток таких таблеток — срок их действия ограничено временем нахождения таблетки в кишечнике и не превышает 12—24 часов. В случае же диареи таблетка может покинуть организм гораздо быстрее, а значит, уменьшится концентрация лекарства в крови, что может быть опасно. Для антиретровирусных препаратов создание таблеток или капсул с замедленным высвобождением лекарственного вещества не очень перспективно — современные схемы уже позволяют принимать терапию один раз в день. То есть удобство применения терапии такие таблетки не повысят.
Если нужно добиться продления эффекта препарата на дни и недели, а лекарство всасываться через кожу упорно не хочет, приходится прибегать к парентеральным пролонгированным формам. Можно зашить под кожу специальную стерильную таблетку, которая будет медленно растворяться и выделять лекарственное вещество: на коже делается небольшой разрез, в него вводят таблетку и зашивают рану.
Помимо таблеток, под кожу можно вводить специальные полимерные импланты, содержащие нужное лекарство. Преимущество имплантов — они могут выделять лекарственное вещество очень долго, до нескольких лет. Чаще всего такие импланты используют для гормональной контрацепции. Так как гормоны действуют в очень маленьких дозах, даже в небольшой по размерам имплант можно сразу поместить запас препарата на несколько лет. Например, противозачаточный препарат Имплантон, который вводится под кожу, продолжает действовать три года. Если действие препарата нужно прекратить — достаточно просто извлечь имплант.
Более простой вариант — ввести в мышцу взвесь маленьких крупинок лекарства в подходящем растворителе. Выглядит это как обычный укол, при этом крупинки лекарства задерживаются в мышце, медленно растворяются и попадают в кровь. Такие способы введения лекарства особенно удобны в случаях, когда пациент может часто пропускать прием препарата, или забывать, принял ли он лекарство. Например, в случае лечения психических заболеваний. Но есть и недостатки: вводить такой препарат должен медицинский работник, а в случае непереносимости или выраженных побочных эффектов лекарство очень трудно быстро удалить из организма.
Что уже доступно на рынке?
Многие фармацевтические компании проводят исследования пролонгированных АРВ-препаратов, но разработка одного такого препарата сама по себе очень большой пользы не принесет — ведь для лечения ВИЧ-инфекции необходимо сочетание нескольких препаратов, то есть нужна комбинированная пролонгированная схема.
Такую схему, разработанную ViiV Healthcare совместно с Janssen, одобрили в марте 2020 года в Канаде — первый пролонгированный комбинированный АРВ-препарат Cabenuva. Схема показала высокую эффективность и безопасность в клинических исследованиях LATTE-2, FLAIR, ATLAS с участием более тысячи пациентов. В состав Cabenuva входят каботегравир и рилпивирин, то есть это двухкомпонентная схема. Препарат вводят один раз в месяц внутримышечно.
Перед началом применения Cabenuva пациент не менее месяца принимает каботегравир в таблетках (называется Vocabria) в комбинации с Эдюрантом — таблетками рилпивирина. Это необходимо, чтобы проверить переносимость такой схемы у конкретного пациента и оценить побочные эффекты. Если схема переносится хорошо, пациенту вводят первую нагрузочную дозу Cabenuva — 3 миллилитра суспензии, содержащей 600 миллиграммов каботегравира, и 3 миллилитра суспензии, содержащей 900 миллиграммов рилпивирина. Суспензии вводятся в разные участки ягодичной мышцы, то есть делают два укола. После этого поддерживающие дозы вводят ежемесячно: 2 мл (400 мг) каботегравира и 2 мл (600 мг) рилпивирина. Если по каким-то причинам введение очередной ежемесячной поддерживающей дозы невозможно, пациент до момента следующей инъекции может принимать пероральную схему (Vocabria + Эдюрант). Пролонгированная форма каботегравира также имеет большие перспективы для использования в качестве доконтактной профилактики ВИЧ-инфекции.
Еще один препарат, который уже применяется в клинической практике, — ибализумаб (Трогарзо) — можно назвать пролонгированным с несколькими оговорками. По химической природе ибализумаб — моноклональное антитело, то есть близок к человеческим иммуноглобулинам. Ибализумаб связывается с некоторыми белками на поверхности вируса и мешает проникновению ВИЧ в клетки. Препарат вводят внутривенно один раз в две недели и часто сочетают с другими АРВ-препаратами. Такая схема — не самый удобный вариант, поэтому сейчас ибализумаб используется только для лечения ВИЧ с множественной лекарственной устойчивостью, когда другие схемы оказываются неэффективными. Поэтому ибализумаб правильнее будет отнести к нишевым препаратам.
К сожалению, на этом и заканчивается не очень длинный перечень пролонгированных АРВ-препаратов, которые уже применяются на практике. Дальше пойдет речь о препаратах, находящихся на разных стадиях исследований.
Что сейчас находится в разработке?
PRO 140
С точки зрения места в клинической практике на ибализумаб похоже еще одно моноклональное антитело, находящееся в стадии клинических исследований, — PRO 140. Этот препарат также можно будет использовать для лечения ВИЧ-инфекции, если у пациента не работают другие схемы. А по механизму действия PRO 140 похож на уже существующий на рынке препарат маравирок (Целзентри). Он связывается с CCR-5 рецепторами на поверхности клеток-мишеней и мешает проникновению вируса в клетку. Строение активного центра молекулы PRO 140 отличается от маравирока, поэтому он активен даже в тех случаях, когда вирус выработал устойчивость к маравироку. Как и маравирок, PRO 140 активен только против CCR-5-тропных подтипов ВИЧ, то есть подойдет не всем пациентам. Препарат вводят внутривенно, один раз в неделю.
Нейтрализующие антитела
На разных стадиях клинических исследований находятся несколько перспективных антител, которые связываются с вирусным белком gp120 и нейтрализуют вирус: VRC01, 3BNC117 и 10-1074. Предполагается, что эти препараты достаточно будет вводить раз в месяц или даже реже и их можно будет применять совместно с другими пролонгированными АРВ-препаратами.
Албувиртид
Аналог уже применяющегося на практике энфувиртида (Фузеон). Этот препарат связывается с вирусным белком gp-41 и мешает проникновению вируса в клетку. Основное отличие в том, что Фузеон вводят подкожно два раза в сутки, что очень неудобно, а албувиртид — только один раз в 2—4 недели. Препарат должен применяться совместно с другими АРВ-лекарствами.
Вирусы могут размножаться только внутри клетки-хозяина, перестраивая ее работу так, что клетка начинает производить новые вирусные частицы. Это серьезно нарушает работу самой клетки и в большинстве случаев ведет к ее гибели. Процесс проникновения и размножения вируса в ней сложный и содержит много стадий, но специальные лекарства могут блокировать его на различных этапах.
В случае с ВИЧ это выглядит так.
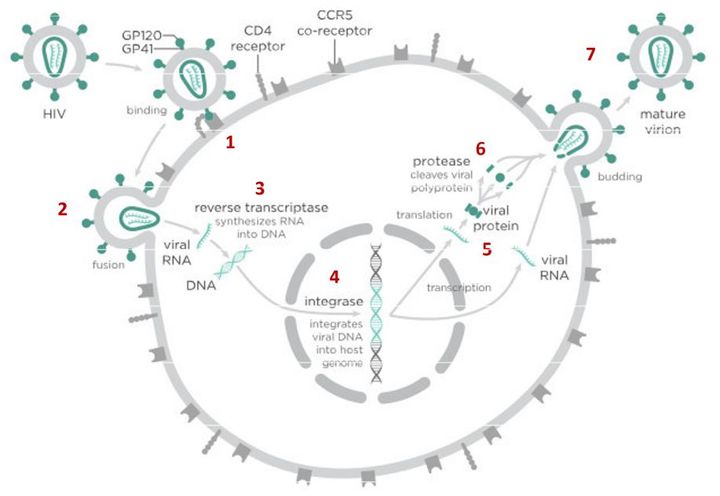
На первом этапе (цифра 1 на схеме) вирус проникает в клетку.
На этом этапе работает другой препарат против ВИЧ — маравирок. Молекула этого лекарства связывается с рецептором CCR5 и блокирует его, что не позволяет вирусу перейти к следующему этапу проникновения в клетку и останавливает заражение. Но у этого вещества есть недостаток — дело в том, что некоторые типы вируса иммунодефицита человека используют на втором этапе другой рецептор — CXCR4. Такому вирусу маравирок не помешает проникнуть в клетку.
(На этом видео можно увидеть как протекает этот и другие этапы репликации вируса в клетке)
После того как вирусная частица приклеилась к рецепторам CD4 и CCR5/CXCR4 и закрепилась на поверхности клетки, другой специальный белок вируса gp41 соединяет оболочку вируса с мембраной клетки-мишени и помогает вирусу проникнуть внутрь клетки (цифра 2 на схеме).
На этом этапе остановить вирус может другая группа препаратов — ингибиторы слияния, например, энфувиртид. Препарат связывается с вирусным белком gp41 и нарушает его работу.
Следующий важный этап (на схеме обозначен цифрой 3) — обратная транскрипция. Для того чтобы клетка начала производить вирусные частицы, вирус должен встроить свою генетическую информацию в ДНК клетки-хозяина.
На этом этапе размножение вируса блокирует очень большое количество препаратов из двух классов — нуклеозидные ингибиторы обратной транскриптазы (НИОТ — ламивудин, абакавир, тенофовир) и ненуклеозидные ингибиторы обратной транскриптазы (ННИОТ — эфавиренз, рилпивирин).
Принцип действия у веществ из обеих групп похожий: молекула лекарства связывается с обратной транскриптазой вируса, нарушает ее работу и так блокирует перенос генов вируса из РНК в ДНК. Это не позволяет генам вируса встроиться в ДНК клетки-хозяина и начать производство новых вирусных частиц.
На следующем этапе инфицирования (цифра 4 на схеме) готовая вирусная ДНК проникает в ядро и встраивается в ДНК клетки-хозяина с помощью специального вирусного фермента — интегразы.
Работу этого фермента блокируют ингибиторы интегразы, например, долутегравир, не позволяя ДНК вируса встроиться в наши гены.
После того как вирусная ДНК встраивается в ДНК клетки-хозяина, клетка получает неправильную программу и начинает производить вирусные белки и РНК, необходимые для сборки новых частиц вируса (цифра 5 на схеме), используя для этого структуры, которые в норме производят собственные белки клетки. Такая перенастройка производства белка сильно нарушает работу клетки и через некоторое время вызывает ее гибель. Лекарств, которые бы влияли на этот этап размножения вируса, нет, так как здесь вирус использует собственные ферментные системы клетки-хозяина и блокирование их работы какими-то веществами навредит здоровым клеткам.
После синтеза вирусных белков клеткой-хозяином в работу вступает еще один фермент вируса — протеаза (цифра 6 на схеме). Дело в том, что белки ВИЧ синтезируются в виде длинных цепочек белков-предшественников, но они неактивные. Протеаза разрезает эти цепочки на более короткие фрагменты, которые становятся активными белками вируса: из одних собирается вирусная оболочка, другие выполняют функции ферментов (обратная транскриптаза, интеграза, протеаза, о которых мы говорили выше). Класс лекарств, нарушающих работу вирусной протеазы (ингибиторы протеазы), включает большое количество препаратов от достаточно старого лопинавира до современного дарунавира. Основной недостаток препаратов этого класса — высокая степень перекрестной устойчивости: если вирус приобретает устойчивость к одному препарату, скорее всего, на него не подействует ни один другой препарат из этого класса.
На последнем этапе (цифра 7 на схеме) вирусные частицы собираются из готовых компонентов (синтезированных клеткой вирусных белков и РНК), как конструктор, и покидают клетку-хозяина. Лекарств, которые бы тормозили эти процессы, пока не существует.
ВИЧ имеет высокую склонность к мутациям, что позволяет ему быстро приобретать устойчивость к лекарствам. Мутации изменяют форму молекул ферментов вируса. Если при этом форма изменится существенно, то фермент не сможет нормально работать и такой вирус размножаться перестанет — это вредная для вируса мутация. Однако в некоторых случаях — при полезных мутациях — форма молекулы фермента меняется не сильно, а так, что сам фермент продолжает нормально работать, но молекула лекарства уже не может с ним связаться.
Поэтому для эффективного подавления размножения ВИЧ обычно назначают три разных препарата из разных групп, влияющих на разные ферменты вируса, блокируя его воспроизводство на разных этапах. Исключением является группа ингибиторов обратной транскриптазы (НИОТ и ННИОТ) — эти лекарства связываются с разными участками молекулы вирусного фермента, поэтому могут назначаться вместе, несмотря на то, что относятся к одной группе. В условиях такой терапии вирусу очень трудно выработать устойчивость, потому что одновременно должно произойти несколько полезных мутаций в разных генах вируса, а это бывает крайне редко.
Есть несколько перспективных технологий, например, CRISPR/Cas9, которые могут позволить полностью удалить вирусную ДНК из организма человека, но пока ни одна из них не прошла все необходимые исследования для подтверждения эффективности и безопасности. Исследования продолжаются.

Ранний старт АРВТ – ключ к успеху монотерапии долутегравиром?
Обратите внимание не комментарий hiv.plus в конце текста.
В указанном рандомизированном открытом исследовании с 10%-ным пределом неинфективности (идентификатор ClinicalTrials.gov: NCT02551523) участники, начавшие КАРВТ менее чем за 180 дней после установленной первичной ВИЧ-инфекции и имевшие РНК ВИЧ в плазме
На 48 неделе наблюдалось также значительное снижение общей нагрузки ДНК ВИЧ в группе долутегравира по сравнению с исходным уровнем (P = .0004), что свидетельствует о том, что резервуар ВИЧ не пополнялся при монотерапии долутегравиром.
Во всех образцах спинномозговой жидкости РНК ВИЧ не была обнаружена выше предела количественного определения 40 копий РНК ВИЧ/мл CSF на исходном уровне (n = 23 в группе долутегравира; n = 14 в группе КАРВТ) и на 48 неделе (n = 10 в группе долутегравира; n = 2 в группе КАРВТ).
Никаких существенных изменений по сравнению с исходным уровнем не наблюдалось и в функции почек, маркерах проксимальной почечной тубулопатии или профилях липидов.
Автор: Иван Шаньгин
Комментарий hiv.plus
Исследование EARLY-SIMPLIFIED является так называемым пилотным исследованием. Число участников в группе монотерапии было очень небольшим (n=67), а группу сравнения можно назвать символической. Также небольшая продолжительность исследования.
Крайне важно обратить внимание на параметры отбора и характеристики группы исследования – в него включены были не просто люди, у которых антиретровирусная терапия была начата в первые 180 дней после начала заболевания, а лишь те, чье течение заболевания было хорошо документировано, и предположение о сверхраннем начале терапии было крайне надежным у всех участников. Фактический разброс предполагаемой даты инфицирования до даты начала комбинированной АРВТ у участников составлял всего лишь от 28 до 77 дней.
В исследовании практически не было женщин – 4% от всех участников, что также является весьма существенным ограничением. И возрастная гетерогенность оставляет желать лучшего – не было молодых участников и пожилых – возраст от 33 до 47 лет. Все участники имели оптимальный индекс массы тела. Не было ни одного участника, у которого в любой момент заболевания был документирован уровень CD4-лимфоцитов ниже 350 клеток в мкл.
Данное исследование не может и не отвечает на вопрос о применимости монотерапии. Исследование такого рода может лишь быть основанием для постановки вопроса о том, что в данном направлении, может быть, стоит продолжать работу.
Также чрезвычайно важно помнить, что существует минимум три исследования, где монотерапия долутегравиром проваливалсь.
В исследовании DOMONO монотерапия не уступала в течение 24 недель, но продолжали происходить вирусологические сбои с возникновением резистентности к долутегравиру. Выводы из данного исследования – монотерапия не применима в общем случае.
Исследование DOLAM, где монтерапия долутегравиром сравнивалась с двойной терапией (долутегравир + ламивудин), также обнаруживала вирусологические провалы с формированием перекрестной резистентности к ингибиторам интегразы ВИЧ.
Исследование MONCAY также обнаруживало со временем нарастание рисков вирусологической неудачи и формирования резистентности при монотерапии долутегравиром.
На наш взгляд, позитивный результат исследования EARLY-SIMPLIFIED заключается в том, что оно продемонстрировало скорее выгоды от раннего начала терапии, когда и в довольно экстремальных условиях монотерапии у лиц со сверхранней терапией достигался вирусологический контроль.
Из-за своих явных ограничений данное исследование никоим образом не является руководством к действию даже среди тех редких людей, которые не просто довольно точно знают дату инфицирования, но еще и начали антиретровирусную терапию буквально в первый месяц-три от даты инфицирования.

Антиретровирусная терапия (АРВТ) применяется у людей, живущих с ВИЧ, начиная с 90-х годов прошлого века. Стандартом лечения считается комбинация не менее трех действующих веществ, минимум два из которых отличаются механизмом своего действия. Но медицинская наука не стоит на месте - появляются новые классы препаратов, улучшена фармакокинетика, повышена эффективность терапии. Это позволило оптимизировать схемы лечения, облегчая и упрощая терапию.
Варианты облегчения терапии можно разделить на 3 группы:
1. Уменьшение числа принимаемых таблеток. Это возможно при применении режима лечения, когда два или три действующих вещества содержатся в одной таблетке.
2. Уменьшение частоты приема. Использование современных режимов препаратов, применяемых один раз в сутки. Кроме того, для пациентов становятся доступнее инъекционные препараты, требующие приема один раз в четыре недели.
3. Уменьшение числа таблеток за счет сокращения количества действующих веществ в схеме, без потери эффективности лечения.
Давайте разберемся, в каких случаях мы сможем использовать перечисленные варианты облегчения терапии.
Первый и второй варианты подходят каждому, если нет ограничений по конкретным препаратам (медицинских противопоказаний, ограничение по побочным эффектам, наличие мутаций резистентности). Новый режим будет таким же стандартным, но качество жизни существенно улучшится.
Уменьшение частоты до однократного приема в сутки возможно при применении лекарств с улучшенной фармакокинетикой, которая позволяет дольше сохранять эффективную концентрацию препарата в крови. Из плюсов можно отметить улучшение приверженности к лечению, снижение рисков пропуска приема АРВТ.
Третий вариант, который еще называют двойным режимом антиретровирусной терапии, подходит тем, кто уже получает успешное лечение (не менее полугода РНК ВИЧ неопределяемая, количество CD4-лимфоцитов превышает 350 клеток/мкл).
Исключение одного препарата из схемы стало возможным благодаря мощности оставшихся лекарств и их высокому барьеру для выработки мутаций резистентности. Проведены крупные клинические исследования эффективности двойных режимов АРВТ и накоплен большой опыт их практического применения.
Критерием выбора таких схем стала доказанная эффективность и безопасность двойного режима при исключении третьего препарата с его побочными эффектами.
Для облегченных режимов АРВТ с приемом один раз в сутки подходят сочетания ламивудина (3TC) с долутегравиром (DTG), либо с ламивудина с бустированным ингибитором протеазы(ИП/r). Если допустимо применение препаратов дважды в сутки, то возможно сочетание в схеме ингибиторов протеазы с ралтегравиром.
Можно ли начинать лечение сразу с двойного режима терапии?
Старт АРВТ у наивных пациентов с двойных режимов официально рекомендован пока только американскими и европейскими специалистами в области ВИЧ-инфекции, да и то с рядом уточнений:
стандартный тройной режим терапии не может быть использован или не является оптимальным для конкретного пациента;
некоторые двойные режимы не могут использоваться при вирусной нагрузке более 100, в ряде случаев более 500 тысяч копий в мл., а также при отсутствии результата теста на лекарственную устойчивость ВИЧ к препаратам;
есть определенные ограничения у пациентов с ко-инфекцией вирусного гепатита В, ;
часть схем не назначается при количестве CD4-лимфоцитов не менее 200 клеток/мкл.
На практике же облегченная терапия назначается и в других странах, включая Россию.
При применении двойных режимов следует учитывать ряд аспектов:
Насколько опасны пропуски очередного приема лекарств?
Может ли повлиять облегчение терапии на развитие лекарственной устойчивости вируса?
Разобрать все ключевые особенности облегченного режима АРВТ при ВИЧ-инфекции помогут специалисты H-Clinic.
Для правильного и безопасного приема облегченных режимов терапии ВИЧ-инфекции рекомендуется обсудить все нюансы ее применения с опытным инфекционистом.
Медицинский редактор: руководитель Университетской клиники, к.м.н., врач-инфекционист Данила Сергеевич Коннов
1. Guidelines for the use of antiretroviral agents in HIV-1-infected adults and adolescents. Developed by the panel on clinical practices for treatment of HIV infection convened by the Department of Health and Human Services (DHHS). AIDS info. August 20, 2020.
2. EACS Guidelines Version 10.1 October 2020
3. Antiretroviral Drugs for Treatment and Prevention of HIV Infection in Adults: 2020 Recommendations of the International Antiviral Society-USA Panel /JAMA, 2020, Oct 27;324(16):1651-1669. DOI: 10.1001/jama.2020.17025
4. . WHO Interim Guidelines. Updated recommendations on first-line and second-line antiretroviral regimens and post-exposure prophylaxis and recommendations on early infant diagnosis of HIV, July 2019
5. Покровский В.В., Юрин О.Г., Кравченко А.В. и соавт. Рекомендации по лечению ВИЧ-инфекции и связанных с ней заболеваний, химиопрофилактике заражения ВИЧ // Эпидемиология и инфекционные болезни. Актуальные вопросы.- 2020.-№4
6. Cohen C., Andrade-Villanueva J., Clotet B. et al. Rilpivirine versus efavirenz with two backgroundnucleoside or nucleotide reverse transcriptase inhibitors in treatment-naive adults infected with HIV-1 (THRIVE): a phase 3, randomised, non-inferiority trial/Lancet, 2011, 378.- P.229–237, DOI: 10.1016/S0140-6736(11)60983-5
7. Molina J-M., Cahn P., Grinsztejn B. et al. Rilpivirine versus efavirenz with tenofovir and emtricitabine in treatment-naive adults infected with HIV-1 (ECHO): a phase 3 randomised double-blind active-controlled trial /Lancet, 2011, 378.- P.238–246, DOI: 10.1016/S0140-6736(11)60936-7
10. Kumar P., Johnson M., Molina J. et al. Giuliano Rizzardini Switching to Doravirine/Lamivudine/Tenofovir Disoproxil Fumarate (DOR/3TC/TDF) Maintains HIV-1 Virologic Suppression Through Week 144 in the DRIVE-SHIFT Trial /J. Acquir Immune Defic Syndr, 2021, DOI: 10.1097/QAI.0000000000002642
12. Cahn P., Madero J.S., Arribas J.R. et al. Durable Efficacy of Dolutegravir Plus Lamivudine in Antiretroviral Treatment-Naive Adults With HIV-1 Infection: 96-Week Results From the GEMINI-1 and GEMINI-2 Randomized Clinical Trials /J. Acquir Immune Defic Syndr, 2020, DOI: 10.1097/QAI.0000000000002275

Отвечает наш врач-инфекционист
Каринэ Дарбинян

- Текущая антиретровирусная терапия подобрана врачом на основании имеющихся клинических рекомендаций с учётом индивидуальных особенностей пациента. Самостоятельное изменение схемы в таком случае может ухудшить как переносимость терапии, так и объективное состояние его здоровья.
- В некоторых ситуациях первичная антиретровирусная терапия была назначена в соответствии с профилем резистентности вируса к лекарствам, а значит самостоятельное изменение схемы может привести к снижению эффективности, и как следствие, прогрессированию инфекции.
- Сочетание антиретровирусных препаратов подбирается в соответствии с действующими клиническими рекомендациями на основании данных исследований об эффективности конкретных комбинаций. Не любые три произвольно выбранных антиретровирусных препарата могут быть использованы в схемах лечения ВИЧ-инфекции.
- Для каждой схемы лечения есть свои особенности: некоторые препараты необходимо принимать один раз в день, некоторые — два, какие-то натощак, а другие — с едой. Замена препарата без учёта кратности приёма и совместимости с приёмом пищи и временем суток может привести к снижению эффективности всей схемы и переносимости терапии.
Тем не менее, под руководством грамотного врача-инфекциониста смена схемы АРВТ происходит быстро, легко и безопасно.
Когда появляется потребность в коррекции схемы антиретровирусной терапии:
- Терапия потеряла эффективность.
- Пациент отмечает стойкие нежелательные явления на фоне терапии.
- Лечащий врач по результатам обследования отмечает значимые побочные эффекты терапии, например, депрессивное расстройство. В этом случае врач должен тщательно рассмотреть варианты коррекции лечения.
Медицинский редактор:
Руководитель Университетской клиники, к.м.н., врач-инфекционист
Коннов Данила Сергеевич.
Читайте также:

