Что такое нонпрогрессор при вич
Обновлено: 19.04.2024
Испытания лекарств от ВИЧ часто включает в себя аналитическое прерывание лечения, когда пациенты с ВИЧ прекращают прием антиретровирусной терапии (АРТ), чтобы ученые могли понаблюдать, как неконтролируемый вирус реагирует на исследуемые препараты.
Участие в такого рода клинических испытаниях может вызвать страх у человека с ВИЧ, который привык поддерживать неопределяемую вирусную нагрузку. Кроме того, предыдущее исследование, проведенное доктором Лау, показало, что многие люди с ВИЧ не были уверены в том, как работают эти испытания, и многие из них не были готовы к длительным периодам определяемой вирусной нагрузки.
Ученые работают над различными стратегиями излечения ВИЧ-инфекции. Некоторые методы нацелены на сокращение латентных резервуаров ВИЧ — инфицированных иммунных клеток, которые не производят новые вирионы в течение многих месяцев или лет. Другие виды терапии пытаются повысить способность иммунной системы контролировать вирус.
Существуют два типа исследований, основанных на прерывании лечения, которые используются для оценки потенциальной терапии: изучение времени до восстановления вирусной активности (TVR) и изучение контрольных точек. В исследованиях TVR после того, как участники прекращают АРТ, ученые измеряют время, необходимое, чтобы вирусная нагрузка сначала достигла обнаруживаемого уровня (50 копий/мл), а затем время, необходимое для достижения более высокого порога (часто 10 000 копий/мл), после чего участники возобновляют прием АРТ. Если тем, кто получает лечение, требуется больше времени для достижения этих пороговых значений по сравнению с контрольной группой, это указывает на то, что терапия замедляет восстановление вирусной активности. Исследования TVR часто используются для оценки методов терапии, нацеленной на резервуары, обычно они длятся всего несколько недель.
Исследования контрольных точек демонстрируют, насколько эффективно иммунная система участников контролирует ВИЧ самостоятельно. В этих гораздо более длительных исследованиях (до нескольких месяцев) исследователи позволяют вирусным нагрузкам участников достигать высоких уровней, имитируя острую фазу ВИЧ, чтобы проследить, сможет ли их иммунная система в дальнейшем снизить эту нагрузку. Порог для возобновления АРТ обычно устанавливается на высоком уровне (часто 100 000 копий/мл). Когда участники, получающие лечение, способны контролировать ВИЧ при более низких уровнях вирусной нагрузки и в течение более длительного времени, чем участники контрольной группы, это говорит о том, что терапия повышает их иммунитет против вируса.
Несмотря на то, что нет конкретных рекомендаций, определяющих, как планировать исследования с прерыванием лечения, группа ученых, занимающихся исследованием ВИЧ, встретилась в 2018 году, чтобы обсудить этические стороны и выработать методы для снижения риска. Прекращение АРТ во время этих исследований не просто подвергает участников риску длительных периодов определяемой, а в некоторых случаях и высокой вирусной нагрузки. Более высокие вирусные нагрузки также могут подвергать опасности и ВИЧ-отрицательных половых партнеров участников.
До сих пор в большинстве исследований риск снижался за счет небольшого числа участников и отсутствия контрольной группы, которая вместо лечения принимала неактивное плацебо. Включение контрольной группы важно, потому что это позволяет ученым сравнивать тех, кто принимает лекарства, с теми, кто находится на плацебо. Тем не менее научное сообщество обсуждало этичность использования контрольных групп в подобных испытаниях лекарств, потому что они подвергаются длительным периодам повышенной вирусной нагрузки в отсутствие каких-либо препаратов, даже экспериментальных.
Исследование
Доктор Лау и ее коллеги использовали данные предыдущих клинических испытаний для создания математических моделей, позволяющих оценить, как различные их параметры влияют на статистическую мощность испытания.
Статистическая мощность аналогична чувствительности. Например, тест на ВИЧ с чувствительностью 80% успешно идентифицирует вирус у 80% людей, которые на самом деле ВИЧ-положительны, но не выявит у остальных 20% ВИЧ-положительных людей. Когда клиническое испытание, оценивающее лечебную терапию, должно достигнуть статистической мощности в 80% (при условии, что терапия имеет реальную пользу для тех, кто ее принимает), в испытании будет 80-процентная вероятность обнаружить пользу и 20-процентная вероятность ее упустить.
Проще говоря, чем больше данных задействовано в испытании, тем большей статистической мощностью оно будет обладать. Такие факторы, как количество участников, число контрольных параметров, продолжительность испытания и частота анализов крови, влияют на статистическую мощность испытания.
Результаты пробного моделирования TVR
В отношении недавнего исследования TVR с участием 13 человек такая модель показала, что при мощности 80% исследование выявило бы только лечение со значительным снижением реактивации (от 70 до 80%). Чтобы исследование TVR выявило снижение реактивации на 30%, потребуется уже по 120 участников в группе терапии и в контрольной группе. Поскольку в большинстве исследований TVR задействовано малое число участников, они, вероятно, не устанавливают умеренных результатов терапии.
Может показаться нелогичным планирование исследования для выявления меньшего эффекта от лечения, когда конечной целью является поиск максимальной пользы (т. е. терапия, приводящая к 100% снижению реактивации). Тем не менее на начальных этапах поиска лекарства необходимо фиксировать даже умеренные результаты, чтобы решить, требует ли этот метод дальнейшего изучения.
Помимо рекомендации увеличить количество участников, команда предлагает использовать ретроспективные контрольные данные в дополнение к контрольным группам. Данные из предыдущих испытаний, в которых люди прерывали АРТ, могли бы повысить потенциал выявления умеренной пользы от лечения. Они смоделировали гипотетическое исследование TVR, в которое вошли 50 участников и 50 человек из контрольной группы. При мощности 80% эта конструкция может обнаруживать снижение реактивации до 43%. Добавление ретроспективных данных еще 150 участников позволило бы в том же испытании выявить снижение до 36%.
Такое моделирование также не показало практически никакого улучшения способности обнаруживать снижение реактивации при увеличении продолжительности испытаний TVR свыше пяти недель. После этого срока модель предсказала улучшение обнаружения не более чем на 1%. Точно так же они не обнаружили практически никакой пользы от проведения лабораторного мониторинга чаще, чем раз в неделю. Наблюдение за людьми два раза в неделю почти не помогло обнаружить снижение реактивации.
Ученые провели отдельный анализ для оценки максимального риска передачи ВИЧ во время исследований TVR на основе предыдущих данных. Они оценили максимальный риск передачи, предполагая, что участники занимались незащищенным сексом и что доконтактная или другие методы профилактики не использовались. Кроме того, если во время еженедельного мониторинга не сообщать пациенту показатель вирусной нагрузки сразу же, то участник, которому необходимо возобновить АРТ (если его вирусная нагрузка превысила 1000), скорее всего, отложит это до следующего еженедельного визита.
Было подсчитано, что в этом случае во время пятинедельного исследования TVR с порогом вирусной нагрузки 1000 для повторного начала АРТ максимальный риск передачи ВИЧ составил 3,6 на 1000 участников, занимающихся вагинальным сексом. При анальном сексе для вводящих партнеров максимальный риск составлял около 7 на 1000, а для принимающих партнеров — около 70 из 1000. Изменение схемы исследования, включающее экспресс-тестирование на вирусную нагрузку и возобновление АРТ в тот же день, снижает предполагаемый максимальный риск до 0,9, 1,8 и 18 на 1000 соответственно.
Результаты моделирования исследования по контрольным величинам
Исследования контрольных точек должны иметь достаточную статистическую мощность, чтобы отделять преимущества предлагаемой лечебной терапии от контроля после лечения. Используя результаты исследования CHAMP, ученые предположили, что исходный уровень контроллеров после лечения ниже 4%. Если целью исследования было определить увеличение количества контролеров до 20% (это означает, что терапия помогла людям, которые не являются естественными контроллерами, подавить вирус), их модель показала, что 24-недельное исследование со статистической мощностью 80% потребует участия 60 пациентов.
Из-за чрезвычайно высоких вирусных нагрузок в типичных исследованиях контрольных величин (до 100 000) авторы сравнили, как использование более консервативного порогового значения (1000) для возобновления АРТ повлияет на способность этих исследований обнаруживать увеличение числа контроллеров после лечения. CHAMP показало, что у 55% контроллеров после лечения первоначальные всплески вирусной нагрузки не превышали 1000 копий/мл, и в дальнейшем они сохраняли вирусную нагрузку ниже этого порога.
Используя эти данные, Лау и Кромер предположили, что использование порога в 1000 копий маскирует 45% естественных контроллеров после лечения, что может помешать обнаружить, когда терапия усиливает иммунный контроль участников над ВИЧ. Чтобы восстановить статистическую мощность, потребуется больше участников. Как и в приведенном выше примере, при мощности 80% и цели выявления 20-процентного повышение числа контроллеров после лечения свыше базового уровня 4%, более низкий порог вирусной нагрузки потребует увеличить количество участников с 60 до 120 как в лечебных, так и контрольных группах.
Как и в случае исследований TVR, ученые также оценили максимальный риск передачи ВИЧ во время определения контрольных величин, используя те же предположения, что и описанные выше (отсутствие стратегий профилактики и экспресс-тестирования на вирусную нагрузку, незащищенный секс, недельная задержка перед возобновлением АРТ). Из-за гораздо большей продолжительности испытаний и высоких пороговых значений вирусной нагрузки (для этого они сослались на исследование контрольных величин, в котором использовали данные 50 000 человек) они оценили максимальный риск передачи ВИЧ как 13 случаев на 1000 при вагинальных половых контактах, около 25 на 1000 — для вводящего партнера при анальном сексе, 214 на 1000 — крайне высокий — для принимающего партнера при анальном сексе.
Предлагаемая гибридная схема испытаний
Основываясь на собственном моделировании и оценках максимального риска передачи, ученые предлагают использовать гибридную модель для анализа прерывания лечения. В озвученной ими схеме прерывания будут начинаться с пятинедельного исследования TVR. Хотя оно, как правило, применяется, когда терапия нацелена на резервуары ВИЧ, у людей, отвечающих на терапию, направленную на усиление иммунитета, также будет наблюдаться более медленное восстановление вируса (если лечение было эффективным).
Начало испытания для оценки потенциального лечения с помощью исследования TVR подвергнет участников гораздо более коротким перерывам в лечении, что позволит исследователям определить, имела ли эта терапия достаточную эффективность, чтобы перейти к более длительному изучению заданных значений. Если медики согласятся с необходимостью дальнейшего исследования, а пациенты с вирусной нагрузкой ниже 1000 согласятся перейти к следующей фазе, они продолжат тщательное наблюдение в течение 24 недель или до тех пор, пока вирусная нагрузка участников не превысит 1000 копий/мл, после чего они возобновят АРТ.
Ученые рекомендуют провести экспресс-тестирование на вирусную нагрузку и возобновить АРТ в тот же день, чтобы свести к минимуму риск передачи инфекции. По их оценке, ограничение контрольной точки теми, кто уже демонстрирует контроль за вирусом, до вирусной нагрузки ниже 1000, снижение порога вирусной нагрузки для возобновления АРТ до 1000, ограничение продолжительности до 24 недель, а также включение тестирования по месту оказания медицинской помощи и возобновление АРТ в тот же день снижают максимальный риск передачи до 0,2 на 1000 при вагинальном сексе, до 0,35 на 1000 — для вводящего партнера при анальном сексе и до 3,1 на 1000 — для принимающего партнера при анальном сексе. И это значительное улучшение показателей по сравнению с оценкой, полученной в ходе традиционных исследований контрольных величин.
Если первоначальное исследование TVR показывает, что лечение не требует дальнейшего изучения (например, если не обнаружено позитивного эффекта), то ученые смогут избежать затрат на проведение длительного исследования контрольных величин.
Выводы
Ученые пришли к выводу, что в испытаниях лекарств недостаточно участников для обеспечения знаковой статистической мощности при умеренных результатах лечения. Поскольку чаще всего при испытаниях терапии также не используются контрольные группы, количественная оценка пользы лечения чрезвычайно сложна. Специалисты рекомендуют сотрудничать всем заинтересованным структурам для создания ретроспективной контрольной базы данных, которая позволила бы разработать схему испытаний, не полностью полагающуюся на контрольные группы плацебо. Тем не менее они отмечают, что задействование ретроспективных контрольных данных означает включение людей, которые с большей вероятностью начали АРТ во время хронической ВИЧ-инфекции, и тех, кто использует более старые схемы АРТ, которые могут действовать как искажающие факторы.
Тем не менее сокращение числа участников, получающих плацебо, снижение пороговых значений вирусной нагрузки, продолжительности испытаний и рисков передачи ВИЧ могут побудить большее число людей с ВИЧ участвовать в исследованиях с прерыванием лечения.
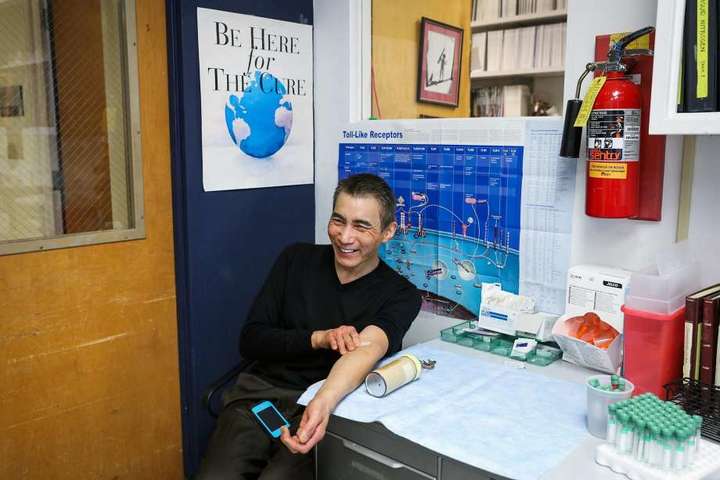
Лаки Чой. Фото: Gabrielle Lurie / The Chronicle
Жизнь как чудо
Лаки Чой – музыкант. Он играл на пианино всю жизнь. Раньше он зарабатывал музыкой, но прекратил писать собственные произведения в начале 90-х. В последний раз он создал что-то своё, когда жил в Париже, незадолго до того, как его партнёр умер от СПИДа. После этой потери он перестал творить.
"Музыка всегда была тем, что заставляло меня чувствовать себя живым", – говорит Чой.
Сейчас ему 60, он живёт в Сан-Франциско. Мужчина считает чудом то, что он жив, здоров и способен возобновить занятия музыкой. Чой – тоже ВИЧ-положительный. Он думает, что получил вирус в конце 70-х годов, когда ему было 20 с небольшим. Но кое-что отличает Чоя от многих других людей с диагнозом ВИЧ. В отличие от своих партнёров, он никогда не переносил болезни, связанные с ВИЧ, никогда не принимал АРВ-лекарства. Вирус в его крови находят лишь самые чувствительные лабораторные тесты.
Чой – один из тех, кого называют "элитный контроллер" или "нонпрогрессор". Особенности генетики позволяют его иммунитету давать отпор ВИЧ.
Но жить с вирусом на фоне эпидемии СПИДа было нелегко даже нонпрогрессорам. В течение многих лет они жили в постоянном страхе, что тоже умрут. Для некоторых из них стратегией выживания стала изоляция, а иммунитет к ВИЧ не защитил их от потерь, которые, как цунами, прокатились по их поколению.
Как и сотни других элитных контроллеров в США, Чой десятилетиями принимал участие в медицинских исследованиях, которые направлены на то, чтобы понять, как работает его иммунная система. Многие медики надеются, что это знание может привести к победе над ВИЧ. Каждый месяц Чой приезжает в один из корпусов Калифорнийского университета в Сан-Франциско (UCSF). Он сдаёт кровь, а специалисты пытаются понять, как функционирует его иммунитет.
"За свою карьеру я усвоил принцип: если хочешь понять вирус, смотри на выживших", – говорит доктор Джей Леви, который занимается случаем Чоя и других нонпрогрессоров.
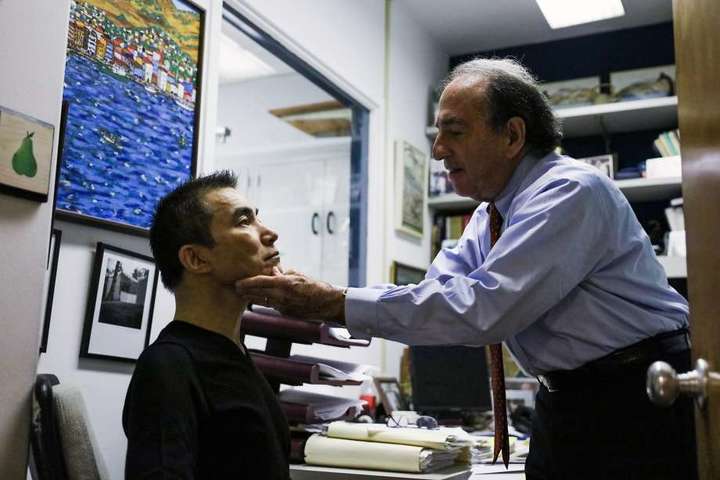
Лаки Чой на приёме у доктора Леви. Фото: Gabrielle Lurie / The Chronicle
Впервые доктор познакомился с контроллером в 1984 году. В его кабинет вошёл мужчина, который уверял, что у него ВИЧ. При этом он был здоров. За долгие годы работы Леви создал группу из таких же мужчин и женщин, выпустил десятки работ о них. Но путь к пониманию особенностей их организма и созданию лекарства оказался более сложным, чем кто-либо ожидал.
Подопытные
Учёные до сих пор пытаются точно определить, как работает иммунная система элитного контроллера. Считается, что у этих пациентов есть мутированный ген, благодаря которому их иммунитет функционирует не так, как у большинства людей. В итоге, даже если ВИЧ проникает в организм, защитные клетки убивают большую часть вируса, он находится на неопределяемом уровне, не причиняя организму вреда.
Нонпрогрессоры могут не принимать противовирусные препараты в течение долгих лет после инфицирования. Некоторые из них получили ВИЧ 30 или более лет и всё ещё здоровы. Но многие из них в зрелом возрасте начинают АРВ-терапию в качестве профилактики, чтобы предупредить развитие заболевания.
Долгие годы, до начала 2000-х, учёные использовали знания об элитных контроллерах для разработки вакцины против ВИЧ-инфекции. Когда эти попытки не увенчались успехом, многие сосредоточились на других стратегиях. Но ряд исследователей до сих пор взаимодействуют с контроллерами. Та работа, которую производит их иммунитет, слишком важна, чтобы просто её игнорировать.
"Мы пока лишь поскребли монеткой поверхность этого знания", – считает доктор Стивен Дикс, профессор UCSF, который также создал собственную группу пациентов среди элитных контроллеров. Эти добровольцы в течение многих десятилетий ежемесячно сдают кровь или образцы спинномозговой жидкости.
"Люди, которые выжили в начале эпидемии, потеряли многих своих близких и друзей, – говорит Дикс. – У них есть серьёзный мотив помогать нам докопаться до причины случившегося".
Вина выжившего
"Один из моих лучших друзей получил ВИЧ в то же время, что и я. – говорит Джордж Фокс, ещё один нонпрогрессор, которому сейчас 60. – Он начал болеть, таять на глазах. Я был в панике". В какой-то момент Джордж понял, что вирус действует на него иначе. Он не заболел и мог бы радоваться этому, но его друзья умирали. По словам Фокса, "это была палка о двух концах".
Фото: Gabrielle Lurie, The Chronicle
После того, как Фокс получил диагноз ВИЧ, врач прописал ему AZT – самый первый антиретровирусный препарат, который оказался очень токсичным. Фокс отказался принимать его. Он поставил рецепт в рамку, повесил на стену и перевозил с собой, когда переезжал с места на место в 80-х и 90-х годах. Он никогда не принимал лекарств против ВИЧ.
Фокс присоединился к группе нонпрогрессоров доктора Леви в конце 90-х годов. К тому времени его лучший друг умер от СПИДа. А самого Джорджа ничего не беспокоило, кроме молочницы во рту.
Время шло, в душе Джордже росло чувство вины. У него была карьера, дом. Он никогда не болел, пока друзья, по его собственному выражению, "умирали как мухи". Он просто слушал их истории – о клинической смерти, страшных инфекциях, изнурительных побочных эффектах – и был не в состоянии разделить их боль.
"Я чувствовал вину выжившего", – говорит Фокс.
Некоторые нонпрогрессоры, которые пережили худшие времена эпидемии, объединились в сообщества. Этих мужчин и женщин соединяло не только общее горе и ужас, но и стойкость против болезни.
Многие из них не чувствуют, что они полностью интегрированы в комьюнити ВИЧ-положительных. При этом они не идентифицируют себя с ВИЧ-отрицательными: они также сталкиваются со стигмой, которая окружает ВИЧ, но не способны разделить большую часть того, с чем борются другие ВИЧ-позитивные. Это приводит к изоляции.
"Я живу между двумя мирами, – говорит Кай Бразерс, 54-летний участник группы Леви. – Я никогда не чувствовал себя частью мира ВИЧ-положительных".

Кай Бразерс / Gabrielle Lurie, The Chronicle
Лаки Чой чувствовал себя гораздо более вовлечённым в ВИЧ+ сообщество, поскольку несколько лет он ухаживал за больными во время эпидемии 80-90-х годов. У него не было времени бояться за свое здоровье, потому что он был слишком занят, присматривая за умиравшими от СПИДа членами гей-сообщества Сан-Франциско. Он не только проводил с больными людьми их последние дни, но и утешал их семьи, которые не могли понять, что происходит с их сыновьями и братьями. Ради этого Чой бросил учёбу. Он посвятил себя уходу за больными и просвещению людей в маргинальных общинах – о том, как защитить себя от ВИЧ.
Как и многие другие выжившие, тогда он принимал решения спонтанно, основываясь на том, что всё равно скоро умрёт. Теперь, когда Чою 60, он всё равно не жалеет, что посвятил себя этому.
Но в многолетней борьбе вирус всё же побеждает. Кай Бразерс два десятка лет успешно боролся с болезнью, но пару лет назад анализы показали повышение вирусной нагрузки в крови. "Я обнаружил, что я не супергерой, который может всю жизнь побеждать болезнь", – говорит Бразерс.
На шестом десятке мужчина впервые в жизни начал пить лекарства против ВИЧ. Сегодня он совершенно здоров.
Когда-то давно одна из веток в популяции гоминид, все больше отделяясь, стала постепенно обретать морфологию и образ жизни человека нынешнего, – так сказать, разумного. Но история вирусов началась задолго до нашей. Задолго до того, как наш мозг развился к способности задавать вопросы. И задолго до того, как мы стали сначала догадываться, а потом и понимать, – от чего, собственно, болеем и умираем. Сегодня на одной планете с нами живет неисчислимое количество вирусов; по некоторым оценкам, их здесь сформировалось более ста миллионов разновидностей (представляете себе, например, сто миллионов человеческих рас?), и если каким-то чудом пересчитать все вирусы поштучно, то численность этой популяции значительно превзойдет состав всех прочих популяций, вместе взятых, включая даже бактерии и насекомых. Вирусы фантастически разнообразны во всех аспектах своего существования, особенно в размерах, форме и предпочтениях. А мы до сих пор не решили даже, можно ли их считать живыми.
Любое живое существо на Земле, – во всей биомассе от бактерий и простейших до слона и баобаба, – заражается теми или иными вирусами. Некоторые вирусы колонизируют представителей какого-то одного вида, другие не столь привередливы. К человеку абсолютное большинство из них относится нейтрально. Но все они, – внутриклеточные паразиты, которые перестраивают геном зараженной клетки на свой лад, на репликацию все новых и новых своих копий. Активно существовать и размножаться вне живой клетки вирусы не могут. Пассивное же их существование и, вообще, этот странный вирусный мир, где даже гравитация работает как-то не так, нам представить довольно сложно.
В целом, при заражении наша судьба зависит от общего состояния здоровья и актуального иммунного статуса, от инфицирующей дозы (численность попавшей в организм колонии) и поведения самого вируса. Клетки-то не просто инфицируются; какое-то время они работают как фабрика вирусов, а при разрушении мембраны неизбежно погибают, и если это происходит в массовом порядке, да в жизненно важном органе, который не восстанавливается…
Для Homo sapiens’а, который привык считать себя центром мироздания и венцом творения, Великая вирусная война как-то… оскорбительна, что ли. Действительно, в ней ведь нет ничего личного. Вообще ничего. Враг попросту не знает о том, что он – враг, что существуем такие себе высокоразвитые мы, что нам не нравится болеть и умирать. Когда на человека нападал опасный хищник-людоед (например, другой Homo sapiens), это всегда была какая-то схватка, какая-то ярость, хоть какие-то шансы. А этого врага даже не увидишь в лицо, потому что лица у него нет. Ему нечем и незачем нас ненавидеть, нечем о нас знать и думать, нечем испытывать к нам аппетит. Его и самого-то, врага этого, практически нет, настолько он мал. Наш организм для него – нечто вроде Галактики, с которой из-за разности в масштабах невозможно пребывать в каких-то личных отношениях. Мы – просто мир обитания, место и способ существования. Вот они и существуют в своем измерении, пока им существуется. Кстати говоря: когда мы своими бензопилами, заводами и фабриками, потребностями и отходами уничтожаем породившую нас природу, – мы ведь делаем это не потому, что мы плохие, ненавидим свою планету и целенаправленно торопимся довести ее до нежилого состояния. Вовсе нет. Просто вот такой у нас получается course of events, как сказал бы англичанин. Такой ход событий, курс нашего (паразитического, выходит?!) развития. И, кстати, не случайно мы в последние годы все чаще сравниваем с вирусами самих себя, – в пересчете на масштабы, конечно. Сравнив, неприятно удивляемся: а и правда, много ведь общего. Только мы, пожалуй, поагрессивней будем, подеструктивней, покатастрофичней для своей экосистемы в целом. И природа, возможно, пытается сдерживать нас с помощью мелких и мельчайших, – есть и такая теория. Именно сдерживать. Если бы от нас по-настоящему хотели избавиться, уже давно избавились бы, так что полное вымирание нам, видимо, не грозит, – во всяком случае, вымирание от инфекционных болезней. Это по отдельности мы теперь стали нежны и уязвимы, а как вид мы остаемся очень цепкими, живучими, плодовитыми и настырными. Даже теряя сотни миллионов, быстро восстанавливаемся в миллиардах. К тому же известно, что ни один паразит не заинтересован в том, чтобы уничтожить своих хозяев как вид, вывести его вчистую. Даже если этот вид опасен для всех.
А кто из них по-настоящему опасен для нас?
Вакцины уже есть, но никаких ощутимых результатов пока нет, да и вообще не очень понятно, как там у нас обстоят дела с иммунитетом к коронавирусу.
В целом, пока совсем не похоже, что пандемия идет (или пойдет в ближайшем будущем) на спад. Более вероятным представляется дальнейшее развитие.
Учитывая все вышесказанное, наверное, лучше бы нам понимать, с чем мы имеем дело.
Далее – о двенадцати самых опасных для человека вирусах (по версии экспертов ресурса Live Science).
Марбургский вирус
Вирус Эбола
Широко известный вирус, вызывающий геморрагическую лихорадку. Ее клинические проявления и пути распространения в целом подобны описанным выше; сам вирус также имеет генетическую структуру, аналогичную Марбургскому вирусу, однако представляет собой отдельный серотип (т.е. вызывает несколько отличный иммунный отклик). По состоянию на 2018 год было известно шесть видов эболавируса, каждый из которых имеет собственную специфику. Наиболее опасным является заирский штамм; эпоним Эбола – название реки в Заире (ныне Демократическая республика Конго), где этот вид впервые был идентифицирован.
Вирус бешенства
Вирус иммунодефицита человека
Заболевание, известное сегодня во всем мире как AIDS (СПИД, синдром приобретенного иммунодефицита), появилось и стало объектом исследований с начала 1980 годов, – сначала на выборках гомосексуалистов и инъекционных наркоманов, затем в других категориях населения (в частности, у пациентов, получавших переливание препаратов крови). Инфекционная этиология предполагалась с самого начала; в 1985 году возбудитель был выделен и идентифицирован как ВИЧ, вирус иммунодефицита человека. ВИЧ относится к семейству ретровирусов, отличается продолжительным инкубационным периодом и, как следует из названия, приводит к постепенному ослаблению иммунной системы. СПИД – это терминальная стадия ВИЧ-инфекции, когда организм становится абсолютно беззащитным перед любыми, в том числе условными патогенами, – как внешними, так и внутренними (например, раковыми клетками).
Современные молекулярно-генетические исследования свидетельствуют о том, что правирус иммунодефицита появился в животном мире Африки сто с небольшим лет назад, и, неоднократно мутировав, за несколько десятилетий эволюции обрел способность инфицировать и вызывать заболевание у человека. Быстрому распространению вируса сначала в африканских странах, а затем и по всему миру, способствовал ряд социально-экономических факторов. По оценкам ВОЗ, с момента идентификации ВИЧ-СПИД различные типы и подтипы вируса унесли жизни более чем 32 миллионов человек, что является наибольшими потерями от инфекционных болезней на современном этапе. До 95% новых случаев заражения приходится на беднейшие страны; более двух третей всех инфицированных проживает в Африканском регионе ВОЗ (каждый двадцать пятый взрослый там является, как минимум, носителем).
Вирус оспы
Вирус характеризуется… вернее, характеризовался, поскольку натуральная оспа теперь уже относится к побежденным болезням: естественного вируса оспы в природе не существует. Он характеризовался очень высокой контагиозностью (заразностью), вирулентностью (способностью вызывать заболевание у носителя) и летальностью, – что в совокупности делало оспу одной из опаснейших инфекционных болезней в истории человечества. Эволюция вируса Variola насчитывает десятки тысяч лет, но способность инфицировать человека, как считают современные исследователи, у вируса развилась не ранее, чем две тысячи лет назад; произошло это, видимо, на Ближнем Востоке или в Северной Африке. В начале нашей эры от эпидемий черной оспы страдала, прежде всего, Европа и Азия (Китай, Корея, Индия, Япония), где у выживших вырабатывался устойчивый иммунитет. В тех регионах, куда вирус был занесен позднее, эпидемии носили катастрофический характер: например, 90% коренного населения Америки было уничтожено не мушкетами и винчестерами, а вирусом оспы, и затем уже другими инфекциями, вирусными и бактериальными.
Оспа побеждена, теперь это лишь история, и мы очень надеемся, что никто и никогда из землян уже не будет инфицирован этим вирусом.
Тем не менее, продолжаются работы по созданию противооспенных вакцин; совсем недавно появился даже этиотропный препарат. Уместно повторить: никогда и ни в чем нельзя быть уверенным до конца (даже в высшей защите, которая была и в Ухане), если речь идет о вирусах. К сожалению, есть все основания опасаться, – особенно в нашем неспокойном мире с его терроризмом и ползучими идеями о биологическом оружии. Попади вирус оспы в беспечные, алчные или, хуже того, в недобрые руки (особенно если эти руки окажутся еще и умелыми по части генетической модификации) – и последствия будут… в общем, лучше не думать. С другой стороны, а как об этом не думать, если в 2014 году в одном из американских Национальных институтов здоровья кто-то из сотрудников в очередной раз открыл никем не охраняемый лабораторный холодильник, вдруг заинтересовался давно и невостребованно стоящей пробиркой, вынул ее (слава богу, со всеми необходимыми предосторожностями) – и вот, пожалуйста: пробирочка с черной оспой, забытая, как потом оказалось, еще в 50-е годы. А этот вирус, в отличие от многих других, очень устойчив, и за все шестьдесят лет он так и не утратил жизнеспособность.
Этот образец уничтожен. Но действительно ли он был последним?
Хантавирус
Вирус изолирован и описан Хо Вангом Ли в 1976 году. В дальнейшем было выделено множество разновидностей хантавируса, которые условно можно разделить на две крупные группы – евразийскую и американскую.
Первая группа, широко распространенная в Азии и Европе (в том числе в 61 субъекте Российской Федерации по обе стороны от Урала), при инфицировании человека вызывает ГЛПС, геморрагическую лихорадку с почечным синдромом. Это наиболее частая из всех острых природно-очаговых инфекций. Протекает с высокой температурой, кровотечениями, серьезным поражением почек и рядом тяжелых сопутствующих дисфункций в различных системах организма. Летальность выше в азиатских регионах (до 10-12%).
Все хантавирусы переносятся грызунами и, реже, рукокрылыми. Человек инфицируется при вдыхании, попадании с пищей или при прямом контакте с продуктами жизнедеятельности либо иным биоматериалом зараженного грызуна. Передача от человека к человеку зафиксирована лишь в единичных случаях в Южной Америке.
Этиотропные средства на данном этапе находятся в стадии разработки, вакцины – в стадии клинических испытаний и внедрения. Лечение на сегодняшний день всегда паллиативное, сугубо симптоматическое. Эпидемиологические данные по хантавирусным инфекциям постоянно отслеживаются и уточняются соответствующими службами.
Вирус гриппа
Но даже в те годы, когда сезонная эпидемия гриппа вызывается не самым агрессивным штаммом, она протекает тяжело у нескольких миллионов человек и уносит от 300 до 500 тысяч жизней. Это при летальности менее одного процента для гриппа А. Грипп В более смертоносен, но он реже приобретает размах эпидемий и пандемий.
Первые упоминания или описания похожих на грипп болезней, явно инфекционных и явно респираторных, встречаются еще до нашей эры, – у Гиппократа, например. Первым достоверным описанием пандемии принято считать источник ХVI века.
Клиническая картина неспецифична и, в принципе, одинакова для всех ОРВИ. Точный диагноз может быть установлен только лабораторно, с помощью серологического анализа или полимеразной цепной реакции, однако в абсолютном большинстве случаев сезонный грипп диагностируют клинически, с учетом актуальной эпидемиологической обстановки в регионе.
Заболевание разрешается в течение 7-10 дней и, как правило, не требует госпитализации. Лечение до сих пор было сугубо паллиативным и/или косвенным, иммуностимулирующим, хотя в последние годы сообщалось о создании нескольких эффективных этиотропных противогриппозных препаратов.
Основное средство профилактики и сдерживания эпидемий гриппа – вакцинация, поскольку иммунитет является стойким и достаточно надежным. Основной путь передачи инфекции, как и у всех ОРВИ, – воздушно-капельный.
Однако грипп – это все-таки вирусная инфекция, а вирусы, повторим вновь и вновь, опасны своей непредсказуемостью и своими осложнениями.
К гриппу это относится, пожалуй, в самой полной мере. Вирусы Influenzaviridae, особенно тип А, чрезвычайно изменчивы, они постоянно ищут и находят способы обходить иммунитет (в том числе созданный вакциной для прошлогодних штаммов), поэтому нередко мутации оказываются весьма опасными.
Что касается осложнений, то наиболее тяжелые из них развиваются со стороны легких, печени, сердца, периферической и центральной нервной системы. Наибольшая летальность наблюдается в самой младшей и самой старшей возрастных категориях, когда иммунная система либо еще недостаточно сформирована, либо уже ослаблена.
Вирус денге
Вирус денге может колонизировать организм приматов (включая человека) и летучих мышей, а главным фактором трансмиссии служат кровососущие комары Aedes, выступающие также переносчиками многих других инфекционных заболеваний. Поэтому в эндемичных по денге странах борьба с размножением комаров является одной из важнейших государственных задач.
Тяжелый вариант денге протекает в форме геморрагической лихорадки, чаще встречается у многократно инфицированных жителей регионов, наиболее неблагополучных в эпидемиологическом плане.
Летальность при типичной форме лихорадки денге – порядка 2-2.5%, но геморрагическая форма убивает до половины заболевших. Ежегодная заболеваемость составляет 50-500 миллионов новых случаев, до полумиллиона больных госпитализируются и до 20000 человек умирают. Столь высокие показатели обусловлены тем, что в эндемичной зоне земного шара проживает примерно 40% человечества, и в последние годы специалисты ВОЗ с тревогой говорят о том, что по мере глобального потепления это опасное заболевание неизбежно будет подниматься на север. Разработанные к настоящему времени вакцины рекомендуется применять лишь у ранее уже инфицированных и переболевших; иммунная защита вырабатывается лишь к одному типу лихорадки, тогда как к другим серотипам человек остается восприимчивым, – и это главная проблема в аспекте иммунизации. Лечение симптоматическое, этиопатогенетической терапии пока не существует.
Ротавирус
Лечение симптоматическое, основной задачей выступает регидратация и дезинтоксикация. Доступны вакцины. Этиотропных препаратов пока нет.
В эпидемиологическом плане ротавирусные инфекции являются глобальной проблемой: они широко распространены по всему миру. Заболеваемость оценивается на уровне 25 миллионов новых случаев в год, летальность составляет порядка 3% с большим разбросом, – от 600 до 900 тысяч человек ежегодно умирают, из них до полумиллиона – дети в возрасте до пяти лет. Тяжелые формы течения с летальным исходом регистрируются, в основном, в регионах со слаборазвитой медициной, однако встречаются и в развитых странах, т.е. опасность ротавирусов не следует недооценивать в любом случае.
Вирус SARS-CoV
Судя по заголовкам пунктов, статья становится всё актуальнее, не так ли?
Вирус MERS-CoV
Вспышка началась осенью 2012 году в Саудовской Аравии, затем охватила соседние страны; весной 2015 года бетакоронавирус (родовое название) был завезен в Южную Корею, где уже к осени очаг, – а это была самая серьезная вспышка за пределами Ближнего Востока, – удалось локализовать и подавить.
Бетакоронавирусный респираторный синдром характеризуется тяжелым течением, выраженной лихорадкой, кашлем, затруднениями дыхания и общей гипоксией; в случаях развития тяжелой вирусной пневмонии наблюдается прогрессирующая дыхательная и, нередко, почечная недостаточность, – что и приводит к летальным исходам.
Вирус SARS-CoV-2
Ну вот и добрались. В своих публикациях мы обещали обсудить самые наболевшие вопросы, связанные с продолжающейся в настоящее время пандемией коронавирусной болезни CoViD-19 (это официальное и единственно корректное международное наименование). Ситуацию с этим заболеванием мы отслеживаем и освещаем в новостной ленте чуть ли не с самого начала, и мы готовы говорить об этом.
Обратите внимание на редакторский комментарий к ней, датированный мартом 2020 года. Его мы переведем полностью:
Мы не знаем. В штате Лахта Клиники пока, к сожалению, нет высококвалифицированных специалистов в области молекулярной генетики. И было бы верхом безответственности занимать какую бы то ни было позицию и поддерживать какое бы то ни было мнение, не имея на то достаточной информации (вполне возможно, она и впрямь когда-нибудь всплывет) и достаточной компетентности.
Сейчас вообще не это главное.
Пора, кажется, действовать осмотрительно, умно, информированно и, главное, коллективно.
Мы сейчас на осадном положении. Мы все сейчас в одной лодке, – понимаете? – весь земной шар, все человечество.

"Мы не грязные, мы не угроза, мы не переносчики болезней. На самом деле, мы – решение проблемы. ВИЧ-положительные люди с неопределяемой вирусной нагрузкой в крови помогут не допустить роста числа новых случаев ВИЧ", – заявил доктор Рич Волицки, человек, живущий с ВИЧ, и.о. директора управления по борьбе с ВИЧ / СПИДом и инфекционными заболеваниями в Департаменте здравоохранения США.
Когда доктор Волицки произнес свою речь на заключительном пленарном заседании 2016 года на конференции по СПИДу в США, он услышал овации. Он рассказал новых результатах исследований HPTN 052 и "Партнёр" среди дискордантных пар, которые показали нулевую передачу вируса при незащищённом контакте ВИЧ-отрицательного человека и ВИЧ-положительного с неопределяемой вирусной нагрузкой в крови.
То, о чём говорили в течение многих лет, теперь доказано исследованиями. Мы можем лишь распространять эту новость и поощрять людей с ВИЧ скорее обращаться за лечением и придерживаться его. Но принцип "Н = Н" – "неопределяемый = не передающий" встречает сопротивление, причём оттуда, откуда меньше всего ждёшь.
Вот пять причин, которые доказывают, как значима эта новость.
1. Наука точна.
Исследование "Партнёр" зафиксировало 58 тыс. актов проникающего секса без презерватива между дискордантными парами. В нём участвовала тысяча пар, в которых позитивный партнер с ВИЧ имеет неопределяемую вирусную нагрузку. Среди них не было ни одной передачи вируса. Ни одной. Те же результаты получены в результате исследования HPTN 052 – таковы эмпирические данные на сегодняшний день. Как сказал доктор Волицки, "это переломный момент в истории эпидемии ВИЧ-инфекции".
Аргументы против теории "нулевого риска" в основном сводятся к тому, что ничего, на самом деле, не бывает без риска. Критики говорят об опасности снижения риска чего бы то ни было на нулевой уровень, а потом гипнотизируют вас статистикой. Достаточно сказать, что доказать нулевой риск статистически невозможно.
Вы рисковали умереть от удара тока, когда включили компьютер, чтобы прочитать эту статью. Люди, которые пьют алкоголь иногда самовоспламеняются. Но почему мы до сих пор не видим предупреждающие надписи об этом на каждой бутылке виски?
Да, есть вероятность того, что кто-то может бросить терапию и вирусная нагрузка в крови повысится, а значит появится риск передачи ВИЧ. Но мы говорим именно о том, что риск передачи нулевой при неопределяемой нагрузке. Пока вы проходите лечение, ваш партнёр в безопасности. Давайте сосредоточимся на этом факте, безо всяких "если".
2. Эксперты в области здравоохранения разделяют эту позицию (а общественники – не очень).
Крупные чиновники от медицины в США уже приняли результаты исследований и их значимость для людей, живущих с ВИЧ. При этом правозащитники и общественные организации неохотно соглашаются с этим постулатом, ссылаясь на теоретический риск инфекции. Возможно, у них вызывает беспокойство вопрос об изменении их листовок и веб-сайтов.
Кампания "Н = Н" зиждилась на энергии человека по имени Брюс Ричман. Он вошёл на сцену ВИЧ-активистов несколько лет назад, казалось бы из ниоткуда, неся знамя "неопределяемости". Ричман собрали подписи экспертов в области здравоохранения со всего мира о "консолидированном решении" по данному вопросу, в то время как каждую организацию прочив ВИЧ в США приходится чуть ли не уговаривать принять вокабуляр, который сотрёт клеймо с людей, в крови которых невозможно обнаружить вирус.
Мой обзор веб-сайтов и заявлений от крупных организаций говорит о том, что некоторые преувеличивают риск передачи вируса при нулевой нагрузке. Почему столь важное исследование сталкивается с невежеством и апатией со стороны наших собственных лидеров? Заметным исключение является работа общественников в Великобритании и Франции, которые всецело разделяют концепцию "Н = Н".
Предполагается, что те из нас, кто достиг неопределяемости могут просто так бросить принимать терапию или не видеться с врачом, который подтвердит, что лечение эффективно. Это сводит нас к не вызывающим доверие индивидам, которые не способны принимать решения, и которых нужно держать подальше от здоровых людей. Эта стигматизация приводит в бешенство.
3. Речь идет о ВИЧ. Только ВИЧ.
В этой дискуссии неизбежно всплывает вопрос о том, что содействие концепции "Н = Н" приведёт нас к росту ИППП из-за возможности не пользоваться презервативами. То же самое говорили критики ДКП, противозачаточных таблеток и любых других средств, которые якобы должны привести к неосторожному сексуальному поведению.
Мы отчаянно нуждаемся в комплексных программах сексуального здоровья, чтобы не убивать только тех крокодилов, которые ближе всего подплыли к лодке. Мы не пытаемся доказать, что неопределяемый уровень ВИЧ в крови делает вас недосягаемым для сифилиса и других инфекций.
Также заходит речь о дальнейшем дроблении нашего сообщества: между положительными и отрицательными, между теми, кто на ДКП и кто – нет, между теми, кто достиг неопределяемой вирусной нагрузки и кто не может, несмотря на все усилия. Я сочувствую этим людям, но считаю, что гораздо большее благо – снятие стигмы с тех, кто всё же добился неопределяемости и теперь может не бояться за партнёра. Все ВИЧ-инфицированные люди могут и должны отметить это событие, независимо от их собственной вирусной нагрузки.
4. Это крупная победа над криминализацией ВИЧ.
Важная работа делается для отмены или реформирования законов о криминализации ВИЧ: судебного преследования ВИЧ-положительных людей за скрытие статуса от их сексуального партнера. Теперь ответчик сможет утверждать, что никогда не ставил под угрозу своего партнера, в первую очередь, благодаря использованию презервативов или тому факту, что вирус у человека не обнаружен.
Понятие "нулевого риска" можно и нужно использовать, чтобы объяснить суду, что ВИЧ-позитивный человек не представлял угрозу для своего сексуального партнера, а значит не должен быть заключен в тюрьму за это.
5. Это меняет самовосприятие людей, живущих с ВИЧ.
Теперь я могу не беспокоиться о том, что передам ВИЧ своему партнёру. Этот факт влияет на меня так, что трудно описать. Я могу уподобить его тому дню, когда Верховный суд США признал законными гей-браки. Я и до этого знал, что сексуальная ориентация не делает меня недостойным человеком. Но в тот день я шёл по улице с гордо поднятой головой. Что-то изменилось.
За 35 лет жизни с ВИЧ я никогда не чувствовал подобного. Я это заслужил – как и миллионы других людей, живущих с ВИЧ.

Новость
иллюстрация Вячеслава Федорова
Авторы
Редактор

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
На школьных уроках биологии мы узнавали, что мутации — это изменения, дающие потомству не только новый цвет волос или глаз, но неизлечимые болезни. Но оказывается, что в реальной жизни каждый человек, помимо наследования генетического материала родителей, рождается с, примерно, 70 новыми мутациями [1]. В большинстве случаев это не является для него чем-то фатальным, а просто делает отличным от другого, даже самого близкого родственника.
Зачастую мутациями называют лишь часть всех изменений — только те, что приводят к очевидному отличию фенотипа (например болезням). Однако есть существенный процент мутаций, которые в норме присутствуют у более чем 1% популяции, но не заметны невооруженным секвенатором глазом.
Полиморфизмы встречаются повсюду в геноме. От их расположения можно ожидать разного воздействия: снипы в промоторной зоне гена могут иногда приводить к изменению уровня экспрессии этого гена, SNP в транслируемых участках генома могут несколько модифицировать строение или эффективность синтеза как РНК, так и белка, влияние SNP в сайте сплайсинга может быть более значительным, чем просто в транслируемой части. Почти у каждого гена найден целый ряд полиморфизмов, которые потенциально могут влиять на его работу в клетке.

Рисунок 1. Визуальный пример однонуклеотидных полиморфизмов в популяции. Кружок — диплоидный организм, например, человек. Соответственно, рассматривая один полиморфизм, мы имеем дело с двумя аллелями. На рисунке видно, что аллель С > A.
иллюстрация Вячеслава Федорова
Находят полиморфизмы посредством анализа результатов больших проектов по секвенированию популяций. Благодаря ним у нас есть более-менее точная статистика встречаемости огромного количества снипов в разных группах человеческих особей (рис. 1). Стоит отметить, что многие относительно замкнутые малые сообщества могут нести в себе доселе не найденные и, уж тем более, не описанные полиморфизмы, но, в целом, можно вполне смело говорить о том, что сухих данных (которые можно описывать и исследовать на предмет зависимостей) у ученых уже очень много. Доступ к этим находкам есть у каждого, кто знает, как искать (рис. 2).

Рисунок 2. Небольшой участок человеческого генома, в районе гена ACE1 (ангиотензинпревращающего фермента 1). Синяя стрелка — база данных полиморфизмов описанных в литературе (cited variations); над ней — база данных полиморфизмов с доказанным клиническим значением (clinical). Красная стрелка — база данных всех найденных снипов (live RefSNPs). Обратите внимание, полиморфизмы окрашены в разные цвета в зависимости от их типа: красные — SNV/SNP (однонуклеотидные вариации); желтые — инсерции; фиолетовые — делеции; синие — indel (инсерция+делеция).
Проявления снипов чрезвычайно разнообразны, например, доказано, что они влияют на частоту суицидального и агрессивного поведения [3], заболеваемость серповидно-клеточной анемией (но полиморфизмом, то есть вариантом нормы, такую мутацию можно назвать только для тех популяций, которые еще недавно были подвержены постоянной опасности малярии) [4], [5], склонность к развитию мужского бесплодия [6], восприимчивость к инфекциям и характер их протекания.
Полиморфизмы имеют единую кодировку (рис. 3):

Рисунок 3. Кодировка полиморфизмов. rs — reference sequence (референсный сиквенс).
иллюстрация Вячеслава Федорова
Часто можно встретить рядом с названием полиморфизма такое обозначение: rs0000 G>A. Оно призвано показать что G — мажорный аллель, а A — минорный (встречается в популяции реже). Может также встречаться такая форма: G/A, в таком случае указания на минорность нет, а порядок не имеет значения. Стоит обратить внимание на то, что обозначение G>A равнозначно обозначению C>T, и в контексте одного полиморфизма могут встречаться обе формы записи. Происходит так потому, что секвенирование может проходить как по плюс-цепи ДНК (кодирующей цепи), так и по минус-цепи (комплементарной кодирующей). Так, у одних исследователей в определенном месте генома будет встречаться A/G, а у других — T/C.
Интерфероны да интерлейкины (минутка иммунологии)
Цитокины играют важную роль в воспалительных и инфекционных процессах. Влияя на регуляцию экспрессии соответствующих генов, снипы могут влиять на протекание инфекционного процесса.
Цитокины — небольшие молекулы, которые передают сигналы между клетками. Их можно разделить на несколько групп: интерфероны, интерлейкины, хемокины, лимфокины и факторы некроза опухоли.
Интерфероны (IFN, от англ. interferon) — белки, выделяемые в ответ на попадание в организм вирусов, бактерий и некоторых химических соединений. IFN делятся на три типа. К первому типу относят IFN-α, IFN-β и IFN-ω, ко второму — IFN-γ, к третьему — IFN-λ. Нас будут интересовать IFN первого и третьего типов, так как они вырабатываются в ответ на вторжение в организм вирусов.
Когда в организм попадает вирус, его гликопротеины или, например, РНК распознаются рецепторами опознавания паттерна, к которым относятся знаменитые Toll-подобные рецепторы, после чего начинается синтез IFN. Далее зараженная клетка выпускает IFN, которые взаимодействуют со своими специфичными рецепторами на других клетках, что приводит к синтезу различных белков, таких как протеинкиназа R и олигоаденилатсинтетаза (РНКаза L), которые теми или иными способами препятствуют размножению вируса.
Интерлейкины (IL, от англ. interleukin) — довольно большая группа цитокинов. Различные IL регулируют рост, дифференцировку и подвижность клеток. Мы же рассмотрим некоторые IL, которые вырабатываются в ответ на вирусную инфекцию:
- IL-12 участвует в защите человека от внутриклеточных патогенов, таких как вирус кори и ВИЧ-1.
- IL-15секретируется фагоцитами после инфицирования вирусами (например, вирусом герпеса). Этот цитокин индуцирует пролиферацию T-клеток и NK-клеток, которые уничтожают инфицированные вирусом клетки.
- IL-28 активирует уже знакомую нам олигоаденилатсинтетазу.
Полиморфизмы и инфекционные болезни (не ковид, честно)
Вирусом гриппа ежегодно заражается около 7% взрослых людей, и до 25% детей до 5 лет [7]. Хотя большинство людей восстанавливается после инфекции в течение недели, небольшой процент все же страдает от тяжелого респираторного дистресс-синдрома или других редких осложнений.
Оказывается, некоторые снипы могут повышать вероятность возникновения осложнений течения болезни. Например, rs12252-G/G A>G интерферон-индуцируемого трансмембранного белка 3 (IFITM3) вызывает более быстрое прогрессирование инфекции и более высокую летальность [8]. Возможно, из-за полиморфизма в гене этого белка происходит альтернативный сплайсинг транскрипта, что приводит к укорачиванию и изменению мембранной локализации IFITM3. Ген белка IFITM3 содержит два экзона и может кодировать два варианта белка, которые различаются наличием 21 аминокислоты на N-конце. У значительного числа пациентов с осложнениями был минорный (то есть редко встречающийся) генотип, изменяющий акцепторный сайт сплайсинга, без которого выполнить правильный сплайсинг невозможно. Также минорный генотип уменьшал рестрикцию вируса клеточными системами in vitro [9].
Хотя данный SNP и снижает противовирусную активность по отношению к гриппу, относительно ретровирусов она повышается, что может быть объяснением распространенности этого снипа в человеческой популяции [10].
Также было выяснено, что некоторые SNP в генах, кодирующих белки легочного сурфактанта (англ. SFTPs), включая SFTPA и SFTPB, ассоциированы с тяжелым протеканием гриппа [11].
Другим, менее знаменитым вирусом, а именно вирусом Эпштейна—Барр (Epstein—Barr virus, EBV), было когда-либо заражено более 90% общемировой популяции людей [12]. Хотя обычно инфекция проходит мягко или бессимптомно, EBV способен вызывать острый инфекционный мононуклеоз и различные виды онкологических заболеваний, в частности, лимфому [12]. Снипы влияют на противовирусный иммунный ответ, а также на реактивацию EBV, посредством изменения генов цитокинов, вызывающих воспаление, а также способных контролировать EBV. Например, высокие уровни продукции IL-10 защищают от первичной и хронической инфекции EBV [13]. Так, три полиморфных сайта в промоторной зоне гена, кодирующего IL-10, влияют на уровень продукции интерлейкина. Генотип, в котором представлены все три SNP (rs1800871 A>G, rs1800872 T>G и rs1800896 G>A), связан с устойчивостью к EBV [14], [15].

иллюстрация Вячеслава Федорова
Инфекция респираторно-синцитиальным вирусом (англ. RSV) может приводить к разным клиническим исходам — от легкой простуды до тяжелого бронхиолита, пневмонии или астмы. Примерно у 1–2% инфицированных детей развивается заболевание, требующее госпитализации [19], [20]. Генетические исследования здоровых по отношению к другим болезням детей выявили SNP в генах, участвующих в иммунной защите, которые чрезмерно представлены у пациентов, госпитализированных с RSV.
Уже знакомые нам SFTPs могут, как и в случае с вирусом гриппа, влиять на инфекцию RSV напрямую, ограничивая инфицирование эпителия легких RSV и регулируя иммунный ответ на вирус. Полиморфизмы в генах SFTPA2 и SFTPD были ассоциированы с тяжелой инфекцией RSV в группах пациентов из Финляндии и США [21–23]. Несколько исследований также продемонстрировали связь между полиморфизмом стартового кодона гена рецептора витамина D (который кодирует и внутриклеточный рецептор, и фактор транскрипции, что тоже примечательно) и тяжестью вызванного RSV-инфекцией бронхиолита [24–26]. Этот полиморфизм усугубляет патогенез RSV, потому что из-за него кодируется неправильный рецептор витамина D, который не может поддерживать противовирусные цитокиновые реакции, опосредованные STAT1 (STAT1 — фактор транскрипции, который участвует в положительной регуляции генов за счет сигналов интерферонов) [27].
А завершает наш парад (но не обзор) вирус, которым инфицировано более 2% населения Земли [28], вирус, от которого, по данным Всемирной организации здравоохранения, в 2016 году погибло 399 000 человек [29], вирус, который может вызывать цирроз или рак печени. Да, как вы уже догадались, это вирус гепатита C (ВГC).
Известно, что у 10–15% больных хроническим вирусным гепатитом C (ХВГC) есть риск развития цирроза печени в течение 20–30 лет от момента инфицирования, но в то же время у значительной части больных цирроз печени не формируется на протяжении всей жизни [28]. Более того, известно, что у представителей европеоидной расы чаще наблюдается спонтанное выздоровление и устойчивый ответ на противовирусную терапию, чем у афроамериканцев [30], но реже, чем у представителей монголоидной расы [31]. Все это наталкивает на мысль, что в развитии болезни немалую роль играют генетические факторы. И действительно, было обнаружено, что пятинуклеотидная делеция в промоторе гена интерферон-индуцируемого хемоаттрактанта T-клеток (CXCL11) чаще встречается у больных ХВГC, чем у контрольной группы [32]. Эта делеция приводит к уменьшению активности промотора гена CXCL11 в присутствии реплицирующегося ВГС in vitro и ослаблению миграции T-лимфоцитов in vivo. Также был идентифицирован SNP гена IL-28B, который связан с устойчивым ответом на терапию интерфероном у европейцев [33] и японцев [34]. Этот снип располагается в 8900 п.н. от участка конца транскрипции IL-28B в регионе между генами IL-28A и IL-28B. Было показано, что аллель G, в отличие от аллеля T, ассоциирован с низким уровнем ответа на противовирусную терапию. Так, у пациентов, гомозиготных по аллелю G, спонтанное выздоровление и устойчивый ответ на терапию наблюдался в два раза реже, чем у пациентов, гомозиготных по аллелю T [35].
Рубрика ковида
Недавно ворвавшаяся в жизнь всей планеты инфекция SARS-CoV-2 сразу притянула к себе внимание биоинженеров, вирусологов, биоинформатиков и вообще всех. А пристальное внимание ученых в совокупности с возросшим финансированием дает свои плоды. Статей уже, буквально за год, по запросу coronavirus на PubMed вышло 39 300 штук. Такой объем данных трудновато даже просмотреть, но мы постарались взглянуть на этот массив с точки зрения именно полиморфизмов. В первую очередь стоит понять в каком направлении копают ученые, какие гены притягивают внимание.
Разумеется, на ум сразу приходит ген белка ACE2 (ангиотензинпревращающего фермента 2), через который вирус проникает в клетку. И действительно, есть ряд работ тем или иным методом предсказывающих или показывающих влияние вариаций ACE2 на течение болезни. Так, было показано, что упрощающие проникновение вируса в клетку гемизиготные варианты ACE2 приводят к повышенной смертности у мужчин [36], в то время как некоторые редкие полиморфизмы того же гена улучшают клиническую картину и облегчают протекание болезни.
Гемизиготность — генетическое состояние клетки или организма, при котором отсутствует одна хромосома из пары или отсутствует участок одной хромосомы из пары. Например, гены Х-хромосомы в мужском кариотипе, или линии раковых клеток, у которых отсутствуют целые участки хромосом.
Другой часто исследуемый ген — белка IFITM3 (интерферон-индуцируемого трансмембранного белка 3). Важен он тем, что в ответ на интерфероновый сигнал блокирует вход вирусов в цитоплазму, а также может инактивировать уже образующиеся в клетке вирусные частицы. Для него уже выявлены полиморфизмы, влияющие на протекание ковида. Например rs12252 A>G: в случае гомозиготного G-аллеля вероятность тяжелого протекания и летального исхода выше [37].
Вирус входит в клетку не только через ACE2, ему также нужна помощь в протеолитической активации spike-белка. На роль такой протеазы-помощницы лучше всего подходит TMPRSS2 (мембранно-связанная сериновая протеаза). В работе [38] выявлена, помимо прочих, зависимость встречаемости нескольких снипов гена TMPRSS2 и склонности к заражению.
Забавное наблюдение
Мы выделили ферменты ACE2 и TMPRSS2, как ключевые клеточные белки, нужные для проникновения SARS-CoV-2 в клетку. А теперь давайте посмотрим на РНК-профили экспрессии этих генов (рис. 5). Видите, где максимальный уровень экспрессии?
Читайте также:

