Что такое обратная транскриптаза вич
Обновлено: 18.04.2024
Обратная транскриптаза (также известная как ревертаза или РНК-зависимая ДНК-полимераза) — фермент (КФ 2.7.7.49), катализирующий синтез ДНК на матрице РНК в процессе, называемом обратной транскрипцией.
Называется так потому, что большинство процессов транскрипции в живых организмах происходит в другом направлении, а именно, с молекулы ДНК синтезируется РНК-транскрипт.
Обратная транскриптаза была открыта Говардом Теминым в Университете Висконсин-Мэдисон и независимо Дэвидом Балтимором в 1970 году в Массачусетском технологическом институте. Оба исследователя получили Нобелевскую премию в области физиологии и медицины в 1975 году совместно с Ренато Дульбекко.
Содержание
Значение для вирусов
Обратная транскрипция необходима, в частности, для осуществления жизненного цикла ретровирусов, например, вирусов иммунодефицита человека и T-клеточной лимфомы человека типов 1 и 2. После попадания вирусной РНК в клетку обратная транскриптаза, содержащаяся в вирусных частицах, синтезирует комплементарную ей ДНК, а затем на этой цепи ДНК, как на матрице, достраивает вторую цепь.
Значение для эукариот
Ретротранспозоны эукариот кодируют обратную транскриптазу, которая используется ими для встраивания в геном хозяина подобно тому, как это происходит у вирусов. Обратной транскриптазой является также теломераза.
Роль в генетической инженерии
В генетической инженерии обратную транскриптазу используют для получения кДНК — копии эукариотического гена, не содержащей интронов. Для этого из организма выделяют зрелую мРНК, кодирующую соответствующий генный продукт (белок, РНК) и проводят с ней в качестве матрицы обратную транскрипцию. Полученную кДНК можно трансформировать в клетки бактерий для получения трансгенного продукта.
См. также
Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена.
Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники.
Эта отметка установлена 14 мая 2011.
- КФ 2.7.7
- Методы биологических исследований
- Ферменты
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Обратная транскриптаза" в других словарях:
Обратная транскриптаза — (ревертаза, РНК зависимая ДНК полимераза) фермент, осуществляющий образование ДНК копии у РНК геномных вирусов. Встречается у некоторых РНК вирусов, имеющих однонитчатый негативный геном. Обеспечивает возможность интеграции РНК генома вирусов в… … Словарь микробиологии
Обратная транскриптаза РНК-зависимая ДНК-полимераза ревертаза — Обратная транскриптаза, РНК зависимая ДНК полимераза, ревертаза * зваротная транскрыптаза, РНК залежная ДНК полімераза, рэвертаза * reverse transcriptase or PTase or RNA dependent DNA polymerase ретровирусный многофункциональный фермент класса… … Генетика. Энциклопедический словарь
Транскриптаза обратная РНК-зависимая ДНК-полимераза ревертаза — Транскриптаза обратная, РНК зависимая ДНК полимераза, ревертаза * транскрыптаза зваротная, РНК залежная ДНКполімераза, рэвертаза * reverse transcriptase … Генетика. Энциклопедический словарь
транскриптаза обратная — (син. ревертаза) фермент, катализирующий обратную транскрипцию рибонуклеиновой кислоты вирусов (в т. ч. опухолевых) в участки дезоксирибонуклеиновой кислоты (гены) … Большой медицинский словарь
Транскриптаза Обратная (Reverse Transcriptase) — присутствующий главным образом в ретровирусах фермент, который катализирует синтез молекул ДНК из РНК. Наличие этого фермента способствует соединению вирусной РНК с молекулами ДНК клеток хозяина. Источник: Медицинский словарь … Медицинские термины
Вирусы могут размножаться только внутри клетки-хозяина, перестраивая ее работу так, что клетка начинает производить новые вирусные частицы. Это серьезно нарушает работу самой клетки и в большинстве случаев ведет к ее гибели. Процесс проникновения и размножения вируса в ней сложный и содержит много стадий, но специальные лекарства могут блокировать его на различных этапах.
В случае с ВИЧ это выглядит так.
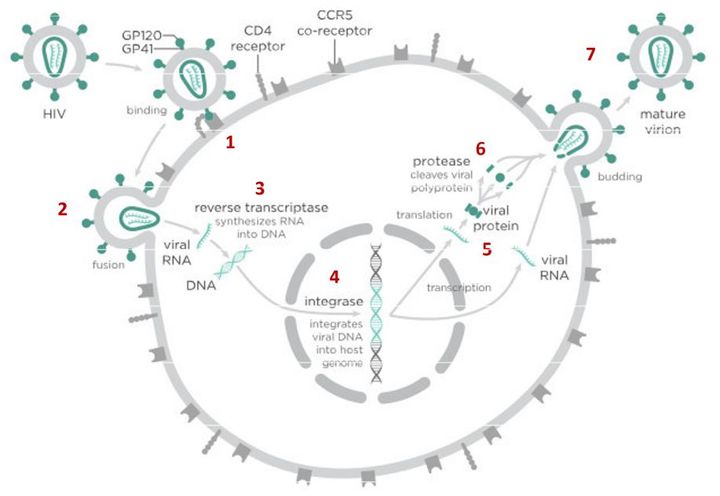
На первом этапе (цифра 1 на схеме) вирус проникает в клетку.
На этом этапе работает другой препарат против ВИЧ — маравирок. Молекула этого лекарства связывается с рецептором CCR5 и блокирует его, что не позволяет вирусу перейти к следующему этапу проникновения в клетку и останавливает заражение. Но у этого вещества есть недостаток — дело в том, что некоторые типы вируса иммунодефицита человека используют на втором этапе другой рецептор — CXCR4. Такому вирусу маравирок не помешает проникнуть в клетку.
(На этом видео можно увидеть как протекает этот и другие этапы репликации вируса в клетке)
После того как вирусная частица приклеилась к рецепторам CD4 и CCR5/CXCR4 и закрепилась на поверхности клетки, другой специальный белок вируса gp41 соединяет оболочку вируса с мембраной клетки-мишени и помогает вирусу проникнуть внутрь клетки (цифра 2 на схеме).
На этом этапе остановить вирус может другая группа препаратов — ингибиторы слияния, например, энфувиртид. Препарат связывается с вирусным белком gp41 и нарушает его работу.
Следующий важный этап (на схеме обозначен цифрой 3) — обратная транскрипция. Для того чтобы клетка начала производить вирусные частицы, вирус должен встроить свою генетическую информацию в ДНК клетки-хозяина.
На этом этапе размножение вируса блокирует очень большое количество препаратов из двух классов — нуклеозидные ингибиторы обратной транскриптазы (НИОТ — ламивудин, абакавир, тенофовир) и ненуклеозидные ингибиторы обратной транскриптазы (ННИОТ — эфавиренз, рилпивирин).
Принцип действия у веществ из обеих групп похожий: молекула лекарства связывается с обратной транскриптазой вируса, нарушает ее работу и так блокирует перенос генов вируса из РНК в ДНК. Это не позволяет генам вируса встроиться в ДНК клетки-хозяина и начать производство новых вирусных частиц.
На следующем этапе инфицирования (цифра 4 на схеме) готовая вирусная ДНК проникает в ядро и встраивается в ДНК клетки-хозяина с помощью специального вирусного фермента — интегразы.
Работу этого фермента блокируют ингибиторы интегразы, например, долутегравир, не позволяя ДНК вируса встроиться в наши гены.
После того как вирусная ДНК встраивается в ДНК клетки-хозяина, клетка получает неправильную программу и начинает производить вирусные белки и РНК, необходимые для сборки новых частиц вируса (цифра 5 на схеме), используя для этого структуры, которые в норме производят собственные белки клетки. Такая перенастройка производства белка сильно нарушает работу клетки и через некоторое время вызывает ее гибель. Лекарств, которые бы влияли на этот этап размножения вируса, нет, так как здесь вирус использует собственные ферментные системы клетки-хозяина и блокирование их работы какими-то веществами навредит здоровым клеткам.
После синтеза вирусных белков клеткой-хозяином в работу вступает еще один фермент вируса — протеаза (цифра 6 на схеме). Дело в том, что белки ВИЧ синтезируются в виде длинных цепочек белков-предшественников, но они неактивные. Протеаза разрезает эти цепочки на более короткие фрагменты, которые становятся активными белками вируса: из одних собирается вирусная оболочка, другие выполняют функции ферментов (обратная транскриптаза, интеграза, протеаза, о которых мы говорили выше). Класс лекарств, нарушающих работу вирусной протеазы (ингибиторы протеазы), включает большое количество препаратов от достаточно старого лопинавира до современного дарунавира. Основной недостаток препаратов этого класса — высокая степень перекрестной устойчивости: если вирус приобретает устойчивость к одному препарату, скорее всего, на него не подействует ни один другой препарат из этого класса.
На последнем этапе (цифра 7 на схеме) вирусные частицы собираются из готовых компонентов (синтезированных клеткой вирусных белков и РНК), как конструктор, и покидают клетку-хозяина. Лекарств, которые бы тормозили эти процессы, пока не существует.
ВИЧ имеет высокую склонность к мутациям, что позволяет ему быстро приобретать устойчивость к лекарствам. Мутации изменяют форму молекул ферментов вируса. Если при этом форма изменится существенно, то фермент не сможет нормально работать и такой вирус размножаться перестанет — это вредная для вируса мутация. Однако в некоторых случаях — при полезных мутациях — форма молекулы фермента меняется не сильно, а так, что сам фермент продолжает нормально работать, но молекула лекарства уже не может с ним связаться.
Поэтому для эффективного подавления размножения ВИЧ обычно назначают три разных препарата из разных групп, влияющих на разные ферменты вируса, блокируя его воспроизводство на разных этапах. Исключением является группа ингибиторов обратной транскриптазы (НИОТ и ННИОТ) — эти лекарства связываются с разными участками молекулы вирусного фермента, поэтому могут назначаться вместе, несмотря на то, что относятся к одной группе. В условиях такой терапии вирусу очень трудно выработать устойчивость, потому что одновременно должно произойти несколько полезных мутаций в разных генах вируса, а это бывает крайне редко.
Есть несколько перспективных технологий, например, CRISPR/Cas9, которые могут позволить полностью удалить вирусную ДНК из организма человека, но пока ни одна из них не прошла все необходимые исследования для подтверждения эффективности и безопасности. Исследования продолжаются.
Проведя тщательный анализ этого образца, группа ученых во главе с Майклом Уороби (Michael Worobey) из университета Аризоны показала, что этот мужчина был инфицирован ВИЧ — вирусом, вызывающим синдром приобретенного иммунодефицита.
При жизни ни сам мужчина, ни его лечащие врачи об этом не знали. Формально вирус будет открыт лишь 17 лет спустя.
Извлекая крошечные генетические фрагменты из образца ткани, команда Уороби практически полностью реконструировала геном ВИЧ в том виде, в котором он существовал в те годы. А сама работа ученого помогла пролить свет на возникновение того, что станет причиной одной из самых важных пандемий в истории человечества.
В погоне за образцами
Вирус иммунодефицита человека был выявлен в 1980-х, после того как таинственный новый синдром затронул жителей США, и, как казалось, тогда он появился из ниоткуда. На самом деле эпидемия зародилась за несколько десятилетий до этого, просто на совсем другом континенте. В Африке.
Теперь мы можем с уверенностью утверждать, что по мере распространения геном вируса претерпевал постоянные изменения: сравнивая накопившиеся мутации и оценивая время, за которое они произошли, ученые могут проследить историю эволюции вируса вплоть до самого момента возникновения.
по теме

Общество
Наиболее вероятное место его появления — южный Камерун. А приблизительное время — 1920-е годы. Именно там и тогда вирус от шимпанзе перешел к человеку, перед тем как вскоре перебраться в город, известный в наше время как Киншаса.
В густонаселенном и быстрорастущем регионе с множеством потенциальных реципиентов вирус и обосновался, чтобы затем распространиться по всему миру.
Очевидно, что огромное количество людей тогда было инфицировано ВИЧ еще прежде, чем кто-то узнал о его существовании. Образцы тканей некоторых из погибших сохранились до наших дней: они рутинно собирались для исследований патологоанатомами, обрабатывались химическим фиксатором, располагались на восковых подложках, изучались под микроскопом (скорее всего, безрезультатно), а затем отправлялись в хранилище.
Но поскольку вирус до своего появления на Западе не был идентифицирован, определить заранее, какой именно образец ткани, взятый в то время, может содержать его следы, невозможно. Искать следы вируса в таких условиях — все равно что искать иголку в тысяче стогов сена.
Более того, процесс обработки химическим фиксатором и условия хранения образцов, дошедших до нашего времени, были таковы, что негативно влияли на содержащиеся в них РНК — молекулы, составляющие геном ВИЧ.
Вирус ВИЧ под микроскопом. Компьютерная Модель.
Однако нет ничего странного в том, что за два десятилетия поисков ученым удалось найти лишь два образца со следами вируса, собранных в Киншасе в период до его открытия.
Дэвид Хо (David Ho) из университета Рокфеллера (Rockefeller University) нашел следы вируса в образце крови, взятой в 1959 году; Уороби обнаружил их в кусочке лимфатического узла из 1960 года.
В обоих случаях от молекул РНК в целом сохранилось около одного процента. Но даже этих крошечных кусочков оказалось достаточно, чтобы доказать: именно ВИЧ блуждал по Киншасе за десятилетия до его открытия, а также чтобы наметить основные вехи истории его эволюции.
В то же время, ввиду ненадежности фрагментарных свидетельств, Уороби хотел собрать геном полностью. Целиком.
Его коллеги Софи Грисилс и Том Уоттс (Sophie Gryseels and Tom Watts) для этого разработали более точную технологию извлечения РНК и применили ее к более чем 1600 образцам тканей из Университета Киншасы (University of Kinshasa). И один из них, как оказалось, действительно содержал следы вируса.
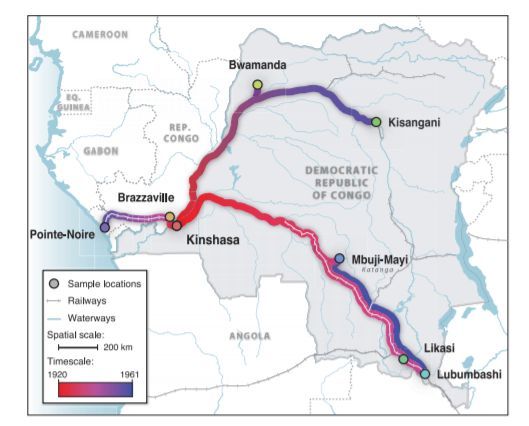
Скрытая эпидемия. Пути распространения ВИЧ в Африке до того, как вирус попал в США.
Место и время
Извлеченные образцы оказались больше всего похожи на подтип С, наиболее распространенный тип ВИЧ в Африке. Тот, что и сейчас доминирует в южной части континента.
На поверку генетический материал, попавший в руки ученых, является лишь малой частью того разнообразия, которое существовало в Киншасе в 1960-е.
А стало быть, из всех подтипов вируса лишь некоторые из тех, что в то время можно было обнаружить в городе, вырвались наружу, дабы стать общемировой проблемой.
История ВИЧ в датах
1930-е
Исследователи полагают, что приблизительно в 1930-х некая форма вируса иммунодефицита обезьян (SIV) перебралась к людям во время разделки или поедания мяса шимпанзе в Демократической Республике Конго. Этот вирус стали называть ВИЧ-1, и это самый распространенный тип вируса на сегодняшний день.
1959
Первый известный случай заболевания СПИДом выявлен при исследовании образцов плазмы крови мужчины, умершего в Демократической Республике Конго в 1959 году.
1960-е
ВИЧ-2, ареал распространения которого ограничен западной частью Африки, перешел к людям от обезьян вида дымчатый мангобей в Гвинее-Бисау в 1960-х.
Генетический анализ вируса, проведенный в 2003 году, говорит, что именно этот тип, вероятно, впервые перебрался в Соединенные Штаты примерно в 1968 году.
1970-е
На протяжении 1970-х вирус, оставаясь незамеченным, продолжает распространяться по США и остальному миру, начинается эпидемия.
1981
Высокая распространенность двух редких заболеваний — саркомы Капоши и пневмонии — отмечена среди молодых гомосексуальных мужчин в Нью-Йорке и Калифорнии в США. Это первый задокументированный случаи СПИДа. К концу года уже 121 человек умер от таинственного заболевания.
1982
Ученые центра по контролю и профилактике заболеваний (Centers for Disease Control and Prevention, CDC) в Атланте, США, предположили, что нарушение работы иммунной системы среди гей-сообщества вызвано инфекционным заболеванием. Они ввели термин Синдром приобретенного иммунодефицита (СПИД) и установили, что помимо геев в группу риска входят потребители инъекционных наркотиков, люди гаитянского происхождения и больные гемофилией. К концу 1982 года СПИД был обнаружен на пяти континентах.
1983
Эпидемия СПИДа бурно развивается в Европе: в первую очередь среди гей-сообщества, а также среди людей, имеющих тесные связи с центральной Африкой.
Начинается расследование случаев СПИДа в Руанде, Заире и других африканских странах.
1984
Используя недавно разработанные техники, в ходе нескольких исследований независимо друг от друга Люк Монтанье (Luc Montagnier) из Института Пастера в Париже (the Pasteur Institute in Paris), Франция, и Роберт Галло (Robert Gallo) из Национального института раковых заболеваний (the National Cancer Institute) в Вашингтоне, округ Колумбия, США, обнаруживают ретровирус, ответственный за развитие заболевания, известного как СПИД. Позднее он будет назван вирусом иммунодефицита человека (ВИЧ).
Случаи заболевания СПИДом все чаще начинают появляться в среде гетеросексуалов.
1985
В Атланте, США, проведена первая конференция, посвященная проблемам СПИДа.
Вслед за прошлогодним открытием вируса на рынке появляется первый метод тестирования на ВИЧ, одобренный Управлением по контролю за продуктами и лекарствами США (US Food and Drug Administration, FDA).
В США начинается тестирование крови в донорских пунктах.
1987
Азидотимидин (AZT), также известный как Зидовудин, первый противовирусный препарат, становится доступным для лечения ВИЧ после клинических испытаний. Препарат работает, блокируя действие обратной транскриптазы фермента ВИЧ, не давая вирусу размножаться в клетках. AZT замедляет развитие СПИДа, отдаляя смерть.
К 1987 году 16908 человек умерли от СПИДа в США. Всего Всемирная организация здравоохранения (ВОЗ) сообщила о 71571 случае заболевания СПИДом, из которых 47022 — в США.
По оценкам Всемирной организации здравоохранения, по всему миру носителями ВИЧ являются от 5 до 10 миллионов человек, ВОЗ запускает глобальную программу по борьбе со СПИДом.
1988
ВОЗ объявила 1 декабря всемирным днем борьбы с ВИЧ/СПИДом.
1991
Красная лента стала международным символом борьбы с ВИЧ/СПИДом.
1992
В США СПИД вышел на первое место среди причин смертности мужчин в возрасте от 24 до 44 лет.
Первые комбинированные лекарственные препараты для лечения ВИЧ появляются на рынке, после того как FDA наряду с AZT одобрило использование Zalcitabine (ddC), который также блокирует обратную транскриптазу.
Комбинированные препараты против ВИЧ оказываются более эффективными, а комплексное лечение замедляет развитие лекарственной резистентности.
1994
Использование AZT для предотвращения передачи ВИЧ от матери ребенку во время беременности рекомендовано в США. Исследование показало, что подобная терапия снижает шанс передачи вируса во время беременности до 8 %, в контрольной группе вероятность передачи составляла 25 %.
Через 12 лет после открытия вируса правительство США впервые запускает кампанию в медиа по пропаганде использования барьерных контрацептивов.
1995
ВОЗ объявила о достижении количеством зараженных миллионной отметки, всего же с начала эпидемии ВИЧ вирусом заразились более 19,5 миллиона человек.
1996
Международная инициатива по вакцинации против СПИДа (IAVI) — некоммерческая организация, базирующаяся в Нью-Йорке, — создана для ускорения поиска вакцины против ВИЧ.
90 % всех заболевших теперь проживают в развивающихся и развитых странах.
1997
Впервые благодаря появлению ВААРТ отмечено резкое падение смертности от СПИДа.
ООН объявляет, что к 2010 году 40 миллионов детей могут потерять одного или обоих родителей из-за СПИДа.
1998
Первые полномасштабные испытания вакцины против ВИЧ начинаются в США.
Две команды исследователей начинают разработку вакцин против штаммов ВИЧ, распространенных в странах Африки к югу от Сахары
В Сан-Франциско обнаружен штамм ВИЧ, устойчивый ко всем лекарственным средствам, подавляющим протеазу, которые в то время существовали на рынке. У некоторых пациентов, использующих для лечения ингибиторы протеазы, встречаются необычные побочные эффекты, такие как рост жировых отложений и проблемы с сердцем.
1999
33 миллиона человек инфицированы ВИЧ, а 14 миллионов умерли от СПИДа по всему миру.
СПИД становится одним из четырех самых массовых убийц современности.
2001
Индийская компания начинает продавать копии дорогих запатентованных лекарств против СПИДа через медицинскую благотворительную организацию в Африке. Этот шаг заставляет некоторые фармацевтические компании снижать цены.
2003
5 миллионов новых случаев СПИДа выявлены на протяжении 2003 года — самое большое количество с начала эпидемии. 3 миллиона человек умерли от СПИДа в этом же году.
2005
Около 40 миллионов человек инфицированы ВИЧ по всему миру.
Высокорезистивный штамм вируса, вызывающий быстрое развитие СПИДа, обнаружен в Нью-Йорке, США.
По оценкам ученых, сам ВИЧ возник где-то между 1896 и 1905 годом. Далеко не все вирусы так молоды. Когда ученые впервые обнаружили следы гепатита B времен Бронзового века, они подсчитали, что вирус менялся в 100 раз медленнее, чем предполагалось до этого. Открытие кардинально изменило предполагаемый период его возникновения. Даже ВИО (вирусы иммунодефицита обезьян), ближайшие родственники ВИЧ, поражающие шимпанзе, эволюционировали с разной скоростью в далеком прошлом и в новейшей истории, что делает оценку времени возникновения очень сложной.
В целом именно благодаря этому факту статистическими методами ученым удалось достаточно точно локализовать время и место начала пандемии. Установить, что с 1920-х годов именно Киншаса, ныне столица Демократической Республики Конго, стала центром первого очага эпидемии ВИЧ, а также положила начало эпидемии 1960-х годов в других частях континента.
Отсюда, из Киншасы, вирус прибыл на Гаити примерно в 1964 году. Причиной тому стало возвращение на родину жителей этого островного государства. До середины 60-х многие жители Гаити работали в только что получившем свою независимость Конго в качестве специалистов. И значительная часть гаитянских работников проживала именно в Киншасе.

Миграция из Гаити в США. Вторая половина 60-х тут наблюдается резкий рост. ВИЧ попадет в США именно в этот период.
Уже с Гаити вирус вместе с мигрантами перебрался на материк — в Соединенные Штаты Америки. Где очень быстро распространился среди гомосексуалов, воспользовавшись относительной уязвимостью перед ВИЧ именно этой группы.
Первые смерти от симптомов, крайне похожих на СПИД, будут зафиксированы здесь (преимущественно среди афроамериканских геев) уже в конце 60-х. Накануне знаменитых Стоунвольских бунтов, органично связанных с борьбой за права черного населения Америки и ставших отправной точкой эмансипации ЛГБТ-движения, завершившегося нынешней либерализаций законодательства относительной однополых браков и партнерств практически во всех западных странах.
Работа Уороби подтвердила эти и некоторые другие тезисы. Не на моделях, а на реальном генетическом материале.
Вирусы могут размножаться только внутри клетки-хозяина, перестраивая ее работу так, что клетка начинает производить новые вирусные частицы. Это серьезно нарушает работу самой клетки и в большинстве случаев ведет к ее гибели. Процесс проникновения и размножения вируса в ней сложный и содержит много стадий, а значит, специальные лекарства могут тормозить его на различных этапах.
В случае с ВИЧ это выглядит так.

по теме

Лечение
Лучшие научпоп-статьи 2018 года
После того как вирусная частица приклеилась к рецепторам CD4 и CCR5/CXCR4 и закрепилась на поверхности клетки, другой специальный белок вируса gp41 соединяет оболочку вируса с мембраной клетки-мишени и помогает вирусу проникнуть внутрь клетки (цифра 2 на схеме). На этом этапе остановить вирус может другая группа препаратов — ингибиторы слияния, например, энфувиртид. Препарат связывается с вирусным белком gp41 и нарушает его работу.

На этом этапе размножение вируса блокирует очень большое количество препаратов из двух классов — нуклеозидные ингибиторы обратной транскриптазы (НИОТ — ламивудин, абакавир, тенофовир) и ненуклеозидные ингибиторы обратной транскриптазы (ННИОТ — эфавиренз, рилпивирин). Принцип действия у веществ из обеих групп похожий: молекула лекарства связывается с обратной транскриптазой вируса, нарушает ее работу и так блокирует перенос генов вируса из РНК в ДНК. Это не позволяет генам вируса встроиться в ДНК клетки-хозяина и начать производство новых вирусных частиц.
На следующем этапе инфицирования (цифра 4 на схеме) готовая вирусная ДНК проникает в ядро и встраивается в ДНК клетки-хозяина с помощью специального вирусного фермента — интегразы. Работу этого фермента блокируют ингибиторы интегразы, например, долутегравир, не позволяя ДНК вируса встроиться в наши гены.
После того как вирусная ДНК встраивается в ДНК клетки-хозяина, клетка получает неправильную программу и начинает производить вирусные белки и РНК, необходимые для сборки новых частиц вируса (цифра 5 на схеме), используя для этого структуры, которые в норме производят собственные белки клетки. Такая перенастройка производства белка сильно нарушает работу клетки и через некоторое время вызывает ее гибель. Лекарств, которые бы влияли на этот этап размножения вируса, нет, так как здесь вирус использует собственные ферментные системы клетки-хозяина и блокирование их работы какими-то веществами навредит здоровым клеткам.
по теме

Лечение
Ошибка системы. Почему в регионах опять не хватает таблеток от ВИЧ
После синтеза вирусных белков клеткой-хозяином в работу вступает еще один фермент вируса — протеаза (цифра 6 на схеме). Дело в том, что белки ВИЧ синтезируются в виде длинных цепочек белков-предшественников, но они неактивные. Протеаза разрезает эти цепочки на более короткие фрагменты, которые становятся активными белками вируса: из одних собирается вирусная оболочка, другие выполняют функции ферментов (обратная транскриптаза, интеграза, протеаза, о которых мы говорили выше). Класс лекарств, нарушающих работу вирусной протеазы, включает большое количество препаратов от достаточно старого лопинавира до современного дарунавира. Основной недостаток препаратов этого класса — высокая степень перекрестной устойчивости: если вирус приобретает устойчивость к одному препарату, скорее всего, на него не подействует ни один другой препарат из этого класса.
На последнем этапе (цифра 7 на схеме) вирусные частицы собираются из готовых компонентов (синтезированных клеткой вирусных белков и РНК), как конструктор, и покидают клетку-хозяина. Лекарств, которые бы тормозили эти процессы, пока не существует.
ВИЧ имеет высокую склонность к мутациям, что позволяет ему быстро приобретать устойчивость к лекарствам. Мутации изменяют форму молекул ферментов вируса. Если при этом форма изменится существенно, то фермент не сможет нормально работать и такой вирус размножаться перестанет — это вредная для вируса мутация. Однако в некоторых случаях — при полезных мутациях — форма молекулы фермента меняется не сильно, а так, что сам фермент продолжает нормально работать, но молекула лекарства уже не может с ним связаться.
Поэтому для эффективного подавления размножения ВИЧ обычно назначают три разных препарата из разных групп, влияющих на разные ферменты вируса, блокируя его воспроизводство на разных этапах. Исключением является группа ингибиторов обратной транскриптазы (НИОТ и ННИОТ) — эти лекарства связываются с разными участками молекулы вирусного фермента, поэтому могут назначаться вместе, несмотря на то, что относятся к одной группе. В условиях такой терапии вирусу очень трудно выработать устойчивость, потому что одновременно должно произойти несколько полезных мутаций в разных генах вируса, а это бывает крайне редко.
Есть несколько перспективных технологий, например, CRISPR/Cas9, которые могут позволить полностью удалить вирусную ДНК из организма человека, но пока ни одна из них не прошла все необходимые исследования для подтверждения эффективности и безопасности. Исследования продолжаются.

Новость
Система CRSIPR/Cas9 удалит вирусную информацию в геноме человека, зараженного ВИЧ
Автор
Редакторы

Генеральным спонсором конкурса, согласно нашему краудфандингу, стал предприниматель Константин Синюшин, за что ему огромный человеческий респект!
CRISPR/Cas9

Рисунок 1. Система CRISPR/Cas9 как один из вариантов бактериального иммунитета. а — Внедрение чужеродной ДНК в клетку бактерии. б — Приобретение спейсера. в — Транскрипция CRISPR-локуса. г — Образование guideРНК. д — Образование активного комплекса Cas9 + guideРНК. е — Связывание чужеродной ДНК. ж — Внесение двухцепочечного разрыва в ДНК. Сокращения см. в тексте.
Но затем в 2012 году бактериальную защитную систему взяли на вооружение ученые, ведь если соединить Cas9 с определенной РНК, то можно разрезать необходимый ген. Разрезанный ген запускает в клетке систему репарации, которая в буквальном смысле пытается соединить концы с концами. При этом происходят различные мутации репарируемого гена — в основном удаления, но бывают и разные вставки. Однако если мы предоставим матрицу для репарации, ген может вернуться к правильной форме. Так можно вносить любые изменения в геном. Это означает, что мы в теории можем лечить генетические заболевания, рак и не только. Сегодня мы поговорим о том, как CRISPR/Cas9 поможет решить проблему избавления от вируса иммунодефицита человека (ВИЧ).
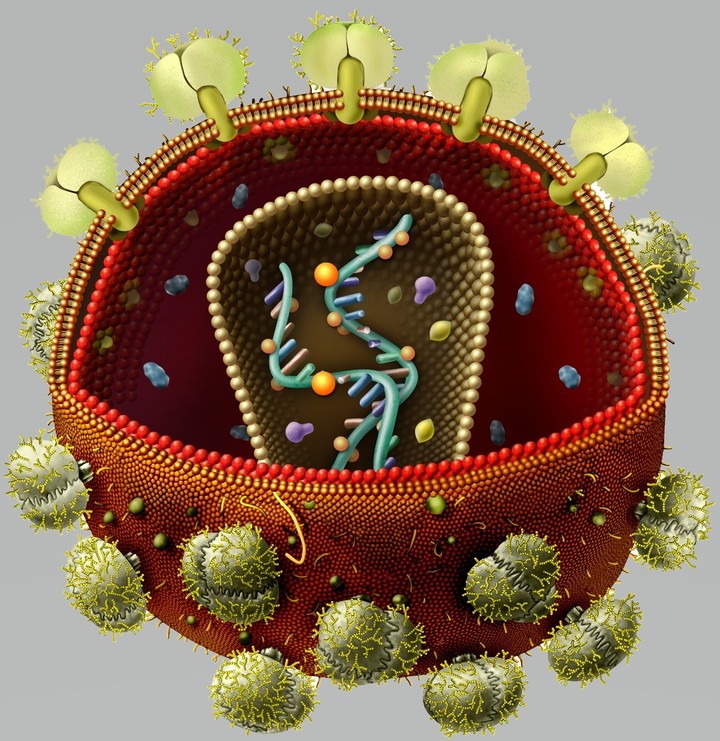
ВИЧ — возбудитель синдрома приобретенного иммунодефицита (СПИДа) — относится к роду лентивирусов семейства ретровирусов, чей геном представлен двумя копиями одноцепочечной РНК, на двух концах которой находятся длинные концевые повторы (или по-английски long terminal repeat, LTR) [7]. В самой вирусной частице содержатся еще три фермента: протеаза, обратная транскриптаза и интеграза (рис. 2). Протеаза расщепляет продукты считывания вирусных генов с образованием зрелых белков.

Рисунок 2. Строение вириона ВИЧ. Частица покрыта липидным бислоем, происходящим из клеточной мембраны организма-хозяина, и усеяна молекулами вирусных гликопротеинов.
Жизненный цикл ВИЧ довольно прост (рис. 3). Вначале вирус инфицирует клетку, причем в качестве рецептора служит молекула CD4, а корецепторами становятся рецепторы хемокинов, поэтому поражаются клетки иммунной системы: T-лимфоциты (T-хелперы), моноциты, макрофаги, а также клетки мозга (макрофаги, микроглия, астроциты), клетки лимфоидной ткани желудочно-кишечного тракта и другие. Затем одноцепочечный РНК-геном с помощью обратной транскриптазы превращается в двухцепочечную ДНК, так называемую провирусную ДНК. Наконец интеграза встраивает двухцепочечную провирусную ДНК в геном хозяина. Эта встроенная информация считывается, причем промоторами (то есть местами, привлекающими РНК-полимеразу для транскрипции) служат длинные концевые повторы — LTR. Собираются новые вирусные частицы, поражающие новые клетки. В целом весь этот процесс приводит к частым мутациям вируса, особенно вариабельны поверхностные гликопротеины, в том числе поэтому частицы ВИЧ так неуловимы для нашего иммунитета [8], [9].

Рисунок 3. Жизненный цикл ВИЧ. 1 — зрелая вирусная частица; 2 — связывание с клеткой благодаря рецепторам; 3 — слияние мембран вируса и клетки; 4 — высвобождение вирусной РНК; 5 — превращение РНК в ДНК (обратная транскрипция); 6 — интеграция в геном клетки; 7 — считывание вирусной информации; 8 — сборка и выход вирусной частицы; 9 — новая вирусная частица.
Терапия ВИЧ

Рисунок 4. Удаление провируса из генома человека приведет к невозможности размножения и распространения вируса.
Современная высокоактивная антиретровирусная терапия основывается на ингибировании обратной транскриптазы, протеазы, интегразы, слияния вируса с клеткой, что значительно осложняет жизнь вируса. Но все же ВИЧ-инфекция в настоящий момент остается неизлечимым заболеванием, так как такая терапия никак не влияет на ДНК вируса у нас в геноме: у пациентов, принимающих антиретровирусную терапию, около 10 6 клеток содержат провирус. Сверх того, у пациентов могут быть серьезные побочные эффекты или устойчивость к антиретровирусной терапии [10].

Рисунок 5. Система CRISPR/Cas9, интегрированная в клетки, может препятствовать их заражению вирусом и интеграции вируса в геном.
Предложенная система протестирована японскими учеными в 2013 году на культуре клеток человеческих T-лимфоцитов [8]. В качестве мишени они предложили использовать LTR, а в них — разные участки, необходимые для связывания факторов инициации и элонгации транскрипции. Трехкратное внесение в клетки конструкции CRISPR/Cas9 снижало считывание вирусного генома почти в 3 раза (с 97,8% до 35,5%). Дальнейший анализ показал, что почти все клетки содержали в области провируса различные мутации.
Так как LTR — это концевые повторы, то разрезание с двух концов теоретически может привести к полному вырезанию встроенного в геном вирусного куска. И действительно — почти у трети клеток (31,8%) после трехкратного внесения системы CRISPR/Cas9 этот участок полностью удалялся.
А что насчет мутаций вируса? Ведь если целевой участок изменит свою структуру, система CRISPR/Cas9 не сможет его найти и обезвредить. Понимая это, ученые выбрали именно тот участок LTR, что содержит высококонсервативные последовательности ДНК, практически одинаковые у всех подвидов ВИЧ.
Не все так просто

Рисунок 6. Повышение специфичности разрезания гена с использованием никаз, вносящих одноцепочечные разрывы.
Предложенная система изменения генов не так чудесна, как может показаться на первый взгляд, как бы я ни старалась вас в этом убедить. Есть много подводных камней, которые требуют дальнейшего исследования.
Таким образом, стремительно развивающаяся генная терапия с использованием CRISPR/Cas9 — ключ к избавлению от ВИЧ-инфекции и ассоциированных с ней заболеваний и осложнений. Однако не стоит ожидать, что такое лекарство сегодня-завтра появится на прилавках в аптеке, ведь еще о многом стоит подумать, чтобы разработать действительно эффективное и безопасное лечение.
Читайте также:

