Что такое оппортунистические микозы
Обновлено: 23.04.2024
Место Aureobasidium pullulans среди возбудителей оппортунистических инфекций человека (обзор литературы)
Журнал: Лабораторная служба. 2018;7(2): 12‑18
Aureobasidium pullulans — сапрофитный гриб, который широко распространен в окружающей среде и активно используется в различных промышленных технологиях. Как и многие сапрофитные грибы, при определенных условиях A. pullulans может вызывать оппортунистические микозы у человека. Глубокий микоз, обусловленный A. pullulans, зачастую трудно поддается лечению, стандартная терапия отсутствует. Тактика ведения таких пациентов основана на данных in vitro в экспериментах на животных, на клиническом опыте, полученном, в основном, при экспертной оценке описанных клинических случаев.
Факторы риска. Развитию микромицетов в зданиях способствуют аварийные протечки, места с наличием образования капельно-жидких конденсатов влаги, нарушенной гидроизоляцией фундаментов и стен, теплоизоляцией, вентиляцией и т. д. при реконструкции и модернизации зданий, в частности с использованием оконных конструкций из пластика, алюминия и деревоалюминия. Неправильный их подбор и некачественный монтаж приводит к появлению конденсата по периметру оконных коробок, что создает условия для развития микромицетов. Подобное явление отмечается при декорировании фасадов с применением декоративного бетона и плохой заделке швов. Вероятнее всего, на материалах, в составе которых содержатся вещества естественного происхождения, например целлюлоза, минералы строительных и отделочных смесей и т. д., может развиваться в первую очередь комплекс видов, тем или иным образом связанных в природе с этими субстратами. Конденсационная влага и капиллярное смачивание приводит к повышению влажности отделочных материалов и способствует развитию микромицетов на внутренней стороне, например обоев, штукатурки. Наличие влаги, особенно капельно-жидкой, выводит споры микромицетов из состояния анабиоза. В закрытых помещениях основной перенос спор грибов, часто адсорбированных на частицах пыли, осуществляют конвенционные потоки воздуха. Анализ мест наибольшего накопления и адсорбции пылевых частиц со спорами микромицетов показал, что это происходит в вентиляционных системах и даже в помещениях при ламинарном и кондиционированном воздухообмене. Вероятно, элементы конструкций кондиционеров так же, как и радио-, и телеаппаратуры, и компьютеров, могут служить источником концентрации спор микромицетов из-за статического заряда на деталях и направленного потока воздуха от вентиляторов [8].

Особенности роста A. pullulans. A. pullulans растет в температурном диапазоне (+)2—35 °C с оптимальным ростом при (+)25—30 °C и отличается своей фенотипической пластичностью. На морфологию колонии влияет ряд факторов, например источник углерода, возраст колонии, температура, свет и субстрат. Колонии могут быть и гомогенными, и гетерогенными, и дрожжеподобными, и с мицелиальным ростом, величина колоний варьирует от маленьких до больших размеров [6, 7]. A. pullulans созревает быстро, в течение 7 дней после инкубации при комнатной температуре. На картофельно-декстрозном агаре колонии имеют диаметр 1—3 см после инкубации при 25 °C в течение 7 дней. На агаре с солодовым экстрактом при 24 °C колонии достигают диаметра 4 см за 7 дней. Колонии меняют окраску в процессе роста: цвет варьирует от белого до кремового или бледно-розового. Позднее, вследствие образования хламидоспор колонии становятся частично коричневыми или черными, часто секторами. У некоторых штаммов обратная сторона может быть белой, светло-оранжевой или абрикосовой (рис. 1). Рис. 1. Колонии A. pullulans на агаре Сабуро, 12 сут (из архива Н.С. Багировой).
A. pullulans относится к быстро растущим видам. Молодые колонии можно наблюдать в микроскоп: влажные дрожжевые клетки (бластоконидии). По мере взросления колоний становятся видны септированные гифы (диаметром 2—16 мкм). Первичные конидии гиалиновые*, гладкие, эллипсоидные, одноклеточные, различной формы и размера. В старых культурах могут образовываться темно-бурые, толстостенные гифы. Конидиеносцы недифференцированные, расположены интеркалярно или терминально, или выглядят короткими боковыми ветвями. Эндоконидии образуются интеркалярно и высвобождаются в соседнюю пустую клетку. Гифы гиалиновые, гладкие, тонкостенные, с поперечными перегородками (рис. 2, 3). Рис. 2. Микроскопия по Граму мазков-отпечатков из очагов некроза селезенки (иммерсия, ×1000) (из архива Н.С. Багировой). Рис. 3. Мазок по Граму, чистая 12-суточная культура A. pullulans (иммерсия, ×1000) (из архива Н.С. Багировой).
Идентификация. В большинстве опубликованных биологических исследованиях описана идентификация A. pullulans, основанная на морфологии клеток или колоний, что приводит к сложностям в распознавании A. pullulans как самостоятельного возбудителя.
Причины частых ошибок в идентификации этих грибов можно объяснить их небольшими размерами, отсутствием специфических морфологических характеристик. Диагноз основывается на гистологической экспертизе клинических образцов и культуральном методе исследования. Кроме того, рекомендуется мультилокусное секвенирование для точной идентификации видов, особенно для необычных или недавно описанных патогенных микроорганизмов. Молекулярная характеристика микромицетов — это надежный метод молекулярной систематики с мультилокусными наборами данных, обширной выборкой таксона и строгими нормированными аналитическими методами [9]. Однако использование данного метода в клинической лаборатории в основном ограничивается эпидемиологическими исследованиями и выявлением необычных и редко встречающихся видов или трудно идентифицируемых штаммов. Молекулярная идентификация большинства видов основана на секвенировании рибосомных генов и сравнении с опубликованными базами данных, особенно в GenBank. Однако более 10% этих находок могут быть ошибочными [10]. Следует заметить, что в настоящее время в отношении A. pullulans отсутствует межлабораторная стандартизация методов секвенирования. Несколько международных обществ по микологии человека и животных (ISHAM), а также институт по клиническим и лабораторным стандартам США (CLSI) работают над стандартизацией метода секвенирования грибов. Молекулярная характеристика всегда должна оцениваться в свете фенотипических особенностей микроорганизмов, поскольку молекулярные диагностические методы пока недостаточно надежны для встречающихся разнородных видов микозов [6, 7, 11].
Связь A. pullulans с аллергическими реакциями. В некоторых странах нозокомиальные грибы сгруппированы в 3 класса опасности, основанные на связанном с ними риске для здоровья. A. pullulan относится к классу опасности В: грибы, продукты метаболитов которых могут вызывать аллергические реакции у обитателей, если они присутствуют в помещении в течение длительного периода времени. В настоящее время более 80 грибковых родов ассоциируются с аллергией. Наиболее часто в связи с этим сообщается о Cladosporium spp., Penicillium spp., Aspergillus spp., Alternaria spp. и Aureobasidium spp. [13]. Специфические аллергенные компоненты A. pullulans не изучены. Хроническое воздействие A. pullulan на человека через увлажнители или кондиционеры может привести к гиперчувствительности, пневмониту (иначе называемому аллергическим альвеолитом). Это состояние характеризуется острым началом: одышкой, кашлем, лихорадкой, инфильтратами в грудной клетке и острой воспалительной реакцией. Состояние также может быть хроническим и опосредованным лимфоцитами. Хроническое состояние рентгенографически характеризуется ретикулонодулярными инфильтратами в легких [14—16].
Широкое распространение разнообразных видов грибов в природе, их постоянное присутствие в ближайшем окружении и среде обитания человека обусловливают особое значение исследований о возможности присутствия и развития в микробиоте искусственных медицинских материалов и технике токсиногенных и оппортунистических форм грибов. Процессы биоповреждения и биоразрушения инициируют развитие микробных очагов потенциальных инфекций. Полимерные материалы, пораженные микробами, могут быть источниками подобных осложнений, что повышает актуальность разработки новых, биоустойчивых материалов [20]. A. pullulans имеет сродство к синтетическим материалам и хирургическим имплантированным устройствам, так как гриб был выделен из стационарных перитонеальных диализных катетеров и центральных венозных катетеров. У иммунокомпрометированных пациентов описаны тяжелые инфекции, при которых A. pullulans был выделен из крови, бронхоальвеолярного лаважа, лимфатических узлов, абсцесса селезенки или цереброспинальной жидкости. Инфекции развивались главным образом вследствие повреждения кожи или глаз, а также интратекального введения цитотоксических препаратов [11].
Современные методы лечения онкологических больных нередко основаны на применении высоких доз цитостатических препаратов, что позволяет значительно увеличить частоту достижения полной ремиссии, но при этом развивается глубокая аплазия костного мозга, которая часто осложняется присоединением инфекции, в том числе грибковой. Известно, что препараты для лечения злокачественных новообразований крови способны подавлять выработку провоспалительных цитокинов, активацию и пролиферацию Т-лимфоцитов [21—23]. Ведущая роль в защите от оппортунистических грибковых инфекций принадлежит Т-хелперам 1-го типа и провоспалительным цитокинам, которые активируют нейтрофилы и макрофаги, непосредственно отвечающие за уничтожение клеток грибов [24]. Баланс между ключевыми цитокинами, обеспечивающими противогрибковую защиту (ИФН-γ, ФНО-α, ИЛ-6, ИЛ-8), и противовоспалительными цитокинами (ИЛ-4 и ИЛ-10), определяет исход инфекционного процесса [25].
Терапия. Глубокий микоз, обусловленный A. pullulans, зачастую трудно поддается лечению. Стандартная терапия отсутствует. Тактика ведения таких пациентов основана на данных in vitro в экспериментах на животных, клиническом опыте, полученном в основном при экспертной оценке описанных клинических случаев. Нередко тактика ведения таких больных требует хирургического вмешательства и продолжительной антимикотической терапии. Комбинированная противогрибковая терапия может обеспечить лучшие результаты, чем традиционные подходы к лечению. По данным зарубежной литературы [6, 7], хорошая противогрибковая активность в отношении A. pullulans in vitro отмечается у вориконазола и итраконазола. До недавнего времени не было систематических данных о чувствительности A. pullulans к антимикотикам. В исследовании M. Javad Najafzadeh и соавт. [19] изучена чувствительность 104 штаммов A. pullulans (51 штамм из клинического материала) после идентификации на молекулярно-генетическом уровне. Амфотерицин В, итраконазол и позаконазол были признаны препаратами с наилучшей активностью против A. pullulans. Это первое всестороннее исследование активности противогрибковых препаратов в отношении большого количества клинически значимых штаммов A. pullulans. Результаты данного исследования не противоречат терапевтическим рекомендациям, опубликованным Европейским обществом клинической микробиологии и инфекционных заболеваний/Европейской конфедерацией медицинской микологии (ESCMID/ECMM) [11]. Длительная терапия при инфекциях, вызванных подобными микромицетами, обычно колеблется от нескольких недель до месяцев или дольше. Положение осложняется тем, что нет специальных диагностических тестов. Необходимы дальнейшие исследования, направленные на диагностику подобных инфекций и выработку стратегии ведения больных редкими микозами [6, 7, 11].
Заключение
Автор заявляет об отсутствии конфликта интересов.
*Гиалиновые конидии: бесцветная бесполая репродуктивная единица, сформированная любым способом, который не включает цитоплазматическое расщепление и действует как орган распространения.
Оппортунистические микозы - группа микозов, которые вызываются условнопатогенными грибами из родов Absidia, Aspergillus, Candida, Mucor, Penicillium и др. у иммунодефицитных лиц.
Среди инфекционных болезней оппортунистические микозы, которые вызываются условнопатогенными грибками, занимают особое место.
Патогенез (что происходит?) во время Оппортунистических микозов:
В отличие от большинства инфекционных болезней, где внешние этиологические факторы явно доминируют во взаимодействии над внутренними факторами, при оппортунистических микозах роль внутренних факторов (иммунодефицитные состояния различного характера и другие проявления недостаточности) при взаимодействии часто превалирует над внешними этиологическими факторами.
Условно-патогенная флора, к которой относятся возбудители оппортунистических микозов, в одиночку неспособна в просвете полостей и трубчатых структур, куда она попадает извне, быть достаточной для того, чтобы ее представителей можно было бы расценивать истинными паразитами. Чаще она пребывает в состоянии паразитоносительства, мнимого (ложного) паразитизма. Однако, когда возникают ассоциации вирусов, патогенных бактерий, грибов, зоопаразитов и прочих микроорганизмов и они совместно обитают в просвете полостей и трубчатых систем конкретного хозяина и оказывают друг на друга существенное влияние, то создаются условия их интеграции - паразитоценоза, поэтому следует учитывать, что обретение условнопатогенными грибками агрессивных свойств связано не только с угнетением защитных сил организма, но и явлениями возникающего паразитоценоза.
Каждый из участников этой интеграции (гриб, бактерия, вирус) в отдельности недостаточен для возникновения болезни, но необходим в совокупности для того, чтобы она стала достаточной и смогла стать причиной заболевания, которое является многокомпонентным. Обязательным условием достаточности для возникновения заболевания является интеграция необходимых причин, долевое участие которых может быть различно по своей значимости и времени воздействия.
Патоморфогенез оппортунистических микозов следует изучать с его начальных звеньев, когда транзиторное носительство трансформируется в начальную форму в виде микст-микоценоза и локализуется в просвете и на поверхности слизистой оболочки. В условиях нарушения неспецифической резистенции, связанной с угнетением системы нейтрофилов, значительного ослабления иммунной защиты в многоуровневых барьерах слизистой оболочки, просветочная микопатия переходит в инвазивную форму. Переход этот может носить узко локальный характер и, потому, он крайне трудно определим при гистологическом исследовании. Поэтому так часто имеет место отрицательный ответ о наличии инвазии. Он может принимать и манифестированную форму, что наблюдается при повреждении или отсутствии эпителиальной выстилки и выраженном иммунодефиците у резко ослабленных больных.
Трансформация просветочной микопатии в инвазивную форму отмечается при различного рода проявлениях иммунодефицита, связанных не только с каким-либо предшествующим заболеванием, но и обусловленных ятрогенными факторами, в том числе лечением антибиотиками, гормонами, цитостатиками. В этих условиях развиваются своеобразные терминальные инвазивные оппортунистические микозы на фоне выраженного иммунодефицита, трудно поддающиеся лечению. Иногда подобные инвазивные висцеральные формы могут развиваться, когда условнопатогенные грибки у ослабленных больных попадают в обход защитных барьеров в кровь при внутривенных вливаниях, операциях на органах кровообращения, в условиях трансплантационной хирургии.
Висцеральные инвазивные формы оппортунистических микозов, которые чаще возникают в терминальный период, по своей патогенетической сущности следует расценивать как вторую индуцированную болезнь, или болезнь конца какого-либо предшествующего страдания.
Симптомы Оппортунистических микозов:
Оппортунистические микозы вызывают сапрофитические виды, проникающие из внешней среды либо входящие в состав микробных сообществ организма человека. Патогенность возбудителей очень низкая, и они обычно не вызывают поражений у здоровых лиц (что, собственно, и отражает общее название заболеваний).
Оппортунистические микозы обычны для лиц с различными нарушениями иммунобиологической резистентности. Инфекции, вызываемые Кандидами и другими дрожжеподобными грибами, обычно развиваются как эндогенные заболевания. Плесневые грибы (аспергиллы и др.), конидии которых постоянно выделяют из воздуха, вызывают экзогенные поражения.
Как правило, большинство оппортунистических микозов протекает как моноинфекция, но при глубоких иммунодефицитах наблюдают смешанные инфекции, вызванные несколькими видами грибов.
Диагностика Оппортунистических микозов:
Дифференцированная диагностика миконосительства и различных форм поражений слизистых оболочек, выстланных многослойным плоскими цилиндрическим эпителием, различается при поражении слизистых оболочек, выстланных многослойным плоским эпителием.
Выделяют поверхностную (интраэпителиальную) и инвазивную (с нарушением целостности эпителия и базальной мембраны) формы.
Лечение Оппортунистических микозов:
Лечение всех системных оппортунистических микозов требует комплексного этиопатогенетического подхода и включает:
- общеукрепляющую витаминотерапию, направленную на активизацию иммунозащитных свойств организма (комплекс витаминов с микро- и макроэлементами, средства, стимулирующие гемопоэз - Кокарбоксилаза, Левамизол и т.д.);
- симптоматическую терапию (сердечно-сосудистые, гипотензивные, седативные препараты, при болях в суставах и мышцах - противовоспалительные нестероидные средства), в отдельных случаях применение бронхолитиков, отхаркивающих средств и гормонов по показаниям, особенно - при бронхиальной астме;
- назначение ферментных препаратов (Панкреатин, Фестал, Панзинорм форте), регуляторов кишечной микро флоры (Бактисубтил, Хилак), желчегонных средств, гепа топротекторов (Липостабил, Карсил, Эссенциале);
- назначение эуобиотиков, антиоксидантов, иммуно корректоров, вагинальных антисептиков при поражении генитальной сферы;
- специфическая этиотропная терапия заключается в назначении антимикотиков с учетом вида возбудителя, локализации поражения, характера течения и тяжести заболевания, а также веса и возраста больного.
К каким докторам следует обращаться если у Вас Оппортунистические микозы:
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Оппортунистических микозов, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору .
Актиномикоз (синонимы: лучистогрибковая болезнь; Aktinomykose - нем.; actinomycose - франц.) - хроническая болезнь, вызываемая различными видами актиномицетов. Характеризуется поражением различных органов и тканей с образованием плотных инфильтратов, которые затем нагнаиваются с появлением свищей и своеобразным поражением кожи.
Что провоцирует / Причины Актиномикоза:
Возбудители - различные виды актиномицетов, или лучистых грибов. Основными из них являются следующие: Actinomyces Israeli, Actinomyces bovis, Actinomyces albus, Ac. violaceus. Актиномицеты хорошо растут на питательных средах, образуя колонии неправильной формы, нередко с лучистыми краями. Патогенны для многих видов сельскохозяйственных и лабораторных животных. В патологическом материале встречаются в виде друз, которые представляют собой желтоватые комочки диаметром 1-2 мм. При микроскопии в центре друз обнаруживается скопление нитей мицелия, а по периферии - колбовидные вздутия. При окраске гематоксилиноозином центральная часть друзы окрашивается в синий цвет, а колбы в розовый. Встречаются друзы, у которых кайма из колбообразных клеток отсутствует. Актиномицеты чувствительны к бензилпенициллину (20 ЕД/мл), стрептомицину (20 мкг/мл), тетрациклину (20 мкг/мл), левомицетину (10 мкг/мл) и эритромицину (1,25 мкг/мл).
Эпидемиология. Актиномикоз распространен во всех странах. Им заболевают люди и сельскохозяйственные животные. Однако случаев заражения человека от больных людей или животных не описано.
Возбудители актиномикоза широко распространены в природе (сено, солома, почва и др.). Актиномицеты часто обнаруживают у здоровых людей в ротовой полости, зубном налете, лакунах миндалин, на слизистой оболочке желудочно-кишечного тракта. Имеют значение как экзогенный, так и эндогенный способы заражения.
Патогенез (что происходит?) во время Актиномикоза:
Наиболее частым является эндогенный путь инфекции. Актиномицеты широко распространены в природе, в частности на растениях, могут попадать с растениями в организм и находиться на слизистых оболочках в качестве сапрофита. Переходу актиномицетов из сапрофитического в паразитическое состояние способствуют воспалительные заболевания слизистых оболочек полости рта, респираторного и желудочно-кишечного тракта. На месте внедрения актиномицетов образуется инфекционная гранулема, которая прорастает в окружающие ткани. В грануляциях возникают абсцессы, которые, прорываясь, образуют свищи. Поражение кожи имеет вторичный характер.
В образовании нагноений играет роль и вторичная, преимущественно стафилококковая инфекция. Антигены лучистых грибов приводят к специфической сенсибилизации и аллергической перестройке организма (гиперсенсибилизация замедленного или туберкулинового типа), а также к образованию антител (комплементсвязывающие, агглютинины, преципитины и др.).
Симптомы Актиномикоза:
Длительность инкубационного периода неизвестна. Он может колебаться в широких пределах и доходить до нескольких лет (от времени инфицирования до развития манифестных форм актиномикоза). Основные клинические формы актиномикоза: актиномикоз головы, языка и шеи; торокальный актиномикоз; абдоминальный; актиномикоз мочеполовых органов; актиномикоз кожи; мицетома (мадурская стопа); актиномикоз центральной нервной системы. Актиномикоз относится к первично-хроническим инфекциям с длительным прогрессирующим течением. При разрастании инфильтрата в процесс вовлекается кожа. Вначале определяется очень плотный и почти безболезненный инфильтрат, кожа становится цианотично-багровой, появляется флуктуация, а затем развиваются длительно незаживающие свищи. В гное обнаруживают беловато-желтоватые мелкие комочки (друзы).
Шейно-челюстно-лицевая форма встречается наиболее часто. По выраженности процесса можно выделить глубокую (мышечную) форму, когда процесс локализуется в межмышечной клетчатке, подкожную и кожную формы актиномикоза. При мышечной форме процесс локализуется преимущественно в жевательных мышцах, под покрывающей их фасцией, образуя плотный инфильтрат хрящевой консистенции в области угла нижней челюсти. Лицо становится асимметричным, развивается тризм различной интенсивности. Затем в инфильтрате появляются очаги размягчения, которые самопроизвольно вскрываются, образуя свищи, отделяющие гнойную или кровянисто-гнойную жидкость, иногда с примесью желтых крупинок (друз). Синюшная окраска кожи вокруг свищей длительно сохраняется и является характерным проявлением актиномикоза. На шее образуются своеобразные изменения кожи в виде поперечно расположенных валиков. При кожной форме актиномикоза инфильтраты шаровидные или полушаровидные, локализующиеся в подкожной клетчатке. Тризма и нарушений процессов жевания не наблюдается. Кожная форма встречается редко. Актиномикозный процесс может захватывать щеки, губы, язык, миндалины, трахею, глазницы, гортань. Течение относительно благоприятное (по сравнению с другими формами).
Торакальный актиномикоз (актиномикоз органов грудной полости и грудной стенки) , или актиномикоз легких. Начало постепенное. Появляются слабость, субфебрильная температура, кашель, вначале сухой, затем со слизисто-гнойной мокротой, нередко с примесью крови (мокрота имеет запах земли и вкус меди). Затем развивается картина перибронхита. Инфильтрат распространяется от центра к периферии, захватывает плевру, грудную стенку, кожу. Возникает припухлость с чрезвычайно выраженной жгучей болезненностью при пальпации, кожа становится багрово-синюшной. Развиваются свищи, в гное обнаруживаются друзы актиномицетов. Свищи сообщаются с бронхами. Они располагаются не только на грудной клетке, но могут появиться на пояснице и даже на бедре. Течение тяжелое. Без лечения больные умирают. По частоте торокальный актиномикоз занимает второе место.
Абдоминальный актиномикоз также встречается довольно часто (занимает третье место). Первичные очаги чаще локализуются в илеоцекальной области и в области аппендикса (свыше 60%), затем идут другие отделы толстой кишки и очень редко поражается первично желудок или тонкий кишечник, пищевод.
Брюшная стенка поражается вторично. Первичный инфильтрат чаще всего локализуется в илеоцекальной области, нередко имитирует хирургические заболевания (аппендицит, непроходимость кишечника и др.). Распространяясь, инфильтрат захватывает и другие органы: печень, почки, позвоночник, может достигнуть брюшной стенки. В последнем случае возникают характерные изменения кожи, свищи, сообщающиеся с кишечником, расположенные обычно в паховой области. При актиномикозе прямой кишки инфильтраты обусловливают возникновение специфических парапроктитов, свищи вскрываются в перианальной области. Без этиотропного лечения летальность достигает 50%.
Актиномикоз половых и мочевых органов встречается редко. Как правило, это вторичные поражения при распространении инфильтрата при абдоминальном актиномикозе. Первичные актиномикозные поражения половых органов встречаются очень редко.
Актиномикоз костей и суставов встречается редко. Эта форма возникает или в результате перехода актиномикозного инфильтрата с соседних органов, или является следствием гематогенного заноса гриба. Описаны остеомиелиты костей голени, таза, позвоночника, а также поражения коленного и других суставов. Нередко процессу предшествует травма. Остеомиелиты протекают с деструкцией костей, образованием секвестров. Обращает на себя внимание, что несмотря на выраженные костные изменения, больные сохраняют способность передвигаться, при поражениях суставов функция серьезно не нарушается. При образовании свищей возникают характерные изменения кожи.
Актиномикоз кожи возникает, как правило, вторично при первичной локализации в других органах. Изменения кожи становятся заметными, когда актиномикозные инфильтраты достигают подкожной клетчатки и особенно характерны при образовании свищей.
Мицетома (мадуроматоз, мадурская стопа) - своеобразный вариант актиномикоза. Эта форма была известна давно, довольно часто встречалась в тропических странах. Заболевание начинается с появления на стопе, преимущественно на подошве, одного или нескольких плотных отграниченных узлов величиной от горошины и более, покрытых сначала неизмененной кожей, в дальнейшем над уплотнениями кожа становится красно-фиолетовой или буроватой. По соседству с первоначальными узлами появляются новые, кожа отекает, стопа увеличивается в объеме, меняет свою форму. Затем узлы размягчаются и вскрываются с образованием глубоко идущих свищей, выделяющих гнойную или серозно-гнойную (иногда кровянистую) жидкость, нередко с дурным запахом. В отделяемом заметны мелкие крупинки обычно желтоватого цвета (друзы). Узлы почти безболезненны. Процесс медленно прогрессирует, вся подошва пронизывается узлами, пальцы ноги поворачиваются кверху. Затем узлы и свищевые ходы появляются и на тыле стопы. Вся стопа превращается в деформированную и пигментированную массу, пронизанную свищами и полостями. Процесс может переходить на мышцы, сухожилия и кости. Иногда наблюдается атрофия мышц голени. Обычно процесс захватывает только одну стопу. Заболевание продолжается очень долго (10-20 лет).
Осложнения. Наслоение вторичной бактериальной инфекции.
Диагностика Актиномикоза:
В далеко зашедших случаях с образованием свищей и характерных изменений кожи диагноз затруднений не представляет. Труднее диагностировать начальные формы актиномикоза.
Некоторое значение для диагностики имеет внутрикожная проба с актинолизатом. Однако во внимание следует принимать лишь положительные и резко положительные пробы, так как слабоположительные внутрикожные пробы часто бывают у больных с заболеваниями зубов (например, при альвеолярной пиорее). Отрицательные результаты пробы не всегда позволяют исключить актиномикоз, так как у больных с тяжелыми формами они могут быть отрицательными вследствие резкого угнетения клеточного иммунитета; они всегда отрицательны у ВИЧ-инфицированных. Выделение культуры актиномицетов из мокроты, слизистой оболочки зева, носа не имеет диагностического значения, так как актиномицеты нередко обнаруживаются и у здоровых лиц. Диагностическое значение имеет РСК с актинолизатом, которая бывает положительной у 80% больных. Наибольшее диагностическое значение имеет выделение (обнаружение) актиномицетов в гное из свищей, в биоптатах пораженных тканей, в друзах, в последних иногда микроскопически обнаруживаются лишь нити мицелия. В этих случаях можно попытаться выделить культуру актиномицетов путем посева материала на среду Сабура.
Актиномикоз легких необходимо дифференцировать от новообразований легких, абсцессов, других глубоких микозов (аспергиллеза, нокардиоза, гистоплазмоза), а также от туберкулеза легких. Абдоминальный актиномикоз приходится дифференцировать от различных хирургических заболеваний (аппендицита, перитонита и пр.). Поражение костей и суставов - от гнойных заболеваний.
Диагноз человеческого актиномикоза в основном основан на выделении и идентификации причинных агентов, потому что клинические симптомы часто вводят в заблуждение и гистопатология и серология низкоспецифична и низкочувствительна. Присутствие друз, которые иногда придают гною внешний вид манной каши, должно инициировать поиск актиномицетов. Однако учитывая, что только 25% образцов актиномикотического гноя содержит эти гранулы, их отсутствие не исключает диагноз актиномикоза.
Забор и транспортировка патогенного материала.
Подходящий для бактериологического анализа актиномикоза патматериал - гной, выделения из свищей, бронхиальный секрет, грануляция и биоптаты. Во время забора следует принять предосторожности против загрязнения врожденной, относящейся к слизистой оболочке, микрофлорой. Во всех случаях, когда это возможно, гной или ткань должны быть получены чрескожной пункцией. Для диагностики торакального актиномикоза, бронхиальный секрет должен быть получен транстрахеально.
Исследование мокроты является недостоверным, поскольку она обычно содержит актиномицеты полости рта, включая патогенные разновидности. Трансторакальная чрескожная пункционная биопсия или чрескожная пункция подозрительных абдоминальных абсцессов - часто единственные средства получения удовлетворительных образцов патматериала для диагностики. Транспортировка образцов в бактериологическую лабораторию должна быть достаточно быстрой. Если длительная транспортировка неизбежна , нужно использовать специальные транспортные среды типа среды Стюарта, хотя ферментирующие актиномицеты менее восприимчивы к окислительному повреждению, чем строгие анаэробы.
Микроскопическое исследование
Когда присутствуют друзы, это позволяет быстро и сравнительно надежно поставить предварительный диагноз после осмотра при малом увеличении (д 100) актиномикотической гранулы, помещенной под покровное стекло и с внесенным в каплю 1% р-ром метиленового синего. Актиномикотические друзы проявляются как частички, подобные цветной капусте с неокрашенным центром и синей периферией, в которых лейкоциты и короткие нити, иногда с "дубинками", исходят от центра гранулы. Окрашенные по Граму мазки, полученные сдавлением гранул между двумя стеклами, показывают нитевидные, ветвящиеся, грам-положительные структуры, которые представляют патогенные актиномицеты, а также разнообразие других грам-отрицательных и грам-положительных бактерий, которые указывают на присутствие сопутствующих микроорганизмов. Наличие этих бактерий необходимо, чтобы отличить актиномикотические друзы от гранул, сформированных различными аэробными актиномицетами (Nocardia, Actinomadura, Streptomyces), которые никогда не содержат сопутствующую микрофлору. Прямая и непрямая иммунофлюоресценция для обнаружения специфических антител также может быть использована для определения разновидностей актиномицетов, находящихся в грануле, без выделения культуры.
Культуральная диагностика
Чтобы получить надежные результаты, целесообразно использовать прозрачные среды, чтобы чашки могли быть тщательно просмотрены с целью обнаружения характерных нитевидных колоний, и выращивать культуру, по крайней мере, 14 дней. Культуры могут быть исследованы каждые 2-3 дня без изменения анаэробных условий, еслис целью получения низкого кислородного потенциала используется метод Fortner (1928). Если используются анаэробные фляги или чашки, целесообразно сделать посев на две или три среды одновременно, чтобы исследовать их для определения роста актиномицетов после 3, 7 и 14 дней. Так как удаление чашек из анаэробной среды обычно останавливает дальнейший рост микроорганизмов, которым нужна длительная инкубация без изменений анаэробных условий.
Предварительные результаты культурального исследования получают через 2-3 дня, когда под микроскопом можно увидеть характерные паукообразные микроколонии A. israelii, A. gerencseriae или P. propionicum. Подтверждение предварительных микроскопических или ранних культуральных диагнозов однозначной идентификацией патогенной разновидности актиномицетов может занять 14 дней и более. Это необходимо, чтобы надежно выявить различия между ферментирующими актиномицетами и морфологически схожими контаминантами, полученные со слизистых оболочек больного, а также схожими аэробными актиномицетами родов Nocardia, Actinomadura и Streptomyces. Детальный бактериологический анализ сопутствующей микрофлоры также может быть полезен для выбора соответствующей терапии антибиотиками.
Молекулярные методы, типа генетических исследований или полимеразной цепной реакций (ПЦР), в настоящее время только разрабатываются и в будущем возможно смогут позволить осуществлять более быструю диагностику актиномикоза.
Серологическая диагностика
Актиномикотическая инфекция не обязательно стимулируют гуморальный иммунный ответ, который можно обнаружить имеющимися лабораторными методами. Однако ни один из из использованных методов при большом разнообразии использованных антигенов не обеспечил удовлетворительных результатов из-за проблем с чувствительностью и специфичностью (Holmberg, Nord и Wadstrмm 1975, Holmberg 1981, Persson и Holmberg 1985).
Лечение Актиномикоза:
Лучшие результаты дает сочетание этиотропной терапии (антибиотики) и иммунотерапии (актинолизат). При шейно-челюстно-лицевой форме назначают внутрь феноксиметилпенициллин по 2 г/сут и при длительности курса не менее 6 нед. Можно также назначать тетрациклин в больших дозах (по 0,75 г 4 раза в день в течение 4 нед или по 3 г в сутки лишь в первые 10 дней, а затем по 0,5 г 4 раза в сутки в течение последующих 18 дней). Эритромицин назначают по 0,3 г 4 раза в сутки в течение 6 нед. При абдоминальных формах и при актиномикозе легких назначают большие дозы бензилпенициллина (10 000 000 ЕД/сут и более) внутривенно в течение 1 - 1,5 мес с последующим переходом на фенокси-метилпенициллин в суточной дозе 2-5 г в течение 2-5 мес. При наслоении вторичной инфекции (стафилококки, анаэробная микрофлора) назначают длительные курсы диклоксациллина или антибиотики тетрациклиновой группы, при анаэробной инфекции - метронидазол. Для иммунотерапии актинолизат можно вводить подкожно или внутрикож-но, а также внутримышечно. Под кожу и внутримышечно вводят по 3 мл актинолизата 2 раза в неделю. На курс - 20-30 инъекций, длительность курса 3 мес. При абсцессе, эмпиеме проводят хирургическое лечение (вскрытие и дренирование). При обширных повреждениях легочной ткани иногда прибегают к лобэктомии. Из антибиотиков наиболее эффективными являются тетрациклины, затем идут феноксиметилпенициллин и менее эффективен эритромицин. Резистентных к этим антибиотикам штаммов актиномицетов не встречалось.
Прогноз. Без этиотропного лечения прогноз серьезный. При абдоминальном актиномикозе умирало 50% больных, при торакальном погибали все больные. Относительно легче протекал шейно-челюстно-лицевой актиномикоз. Все это обусловливает необходимость ранней диагностики и начала терапии до развития тяжелых анатомических повреждений. Учитывая возможность рецидивов, реконвалесценты должны находиться под длительным наблюдением (6-12 мес).
Профилактика Актиномикоза:
Гигиена полости рта, своевременное лечение зубов, воспалительных изменений миндалин и слизистой оболочки полости рта. Специфическая профилактика не разработана. Мероприятия в очаге не проводят.
К каким докторам следует обращаться если у Вас Актиномикоз :
Обязательные доктора:
- Дерматолог – для исключения патологии кожи.
- Стоматолог – для исключения патологии слизистой полости рта.
- Отоларинголог – для исключения патологии миндалин.
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Актиномикоза, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору .
Оппортунистические микозы. Кандидоз. Возбудитель кандидоза.
Оппортунистические микозы вызывают сапрофитические виды, проникающие из внешней среды либо входящие в состав микробных сообществ организма человека. Патогенность возбудителей очень низкая, и они обычно не вызывают поражений у здоровых лиц (что, собственно, и отражает общее название заболеваний). Оппортунистические микозы обычны для лиц с различными нарушениями иммунобиологической резистентности. Инфекции, вызываемые Кандидами и другими дрожже подобны ми грибами, обычно развиваются как эндогенные заболевания. Плесневые грибы (аспергиллы и др.), конидии которых постоянно выделяют из воздуха, вызывают экзогенные поражения.
Как правило, большинство оппортунистических микозов протекает как моноинфекция, но при глубоких иммунодефицитах наблюдают смешанные инфекции, вызванные несколькими видами грибов.
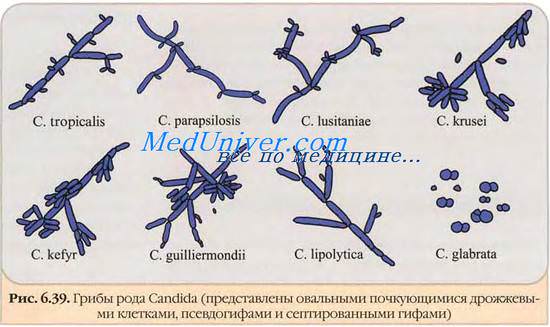
Кандидоз. Возбудитель кандидоза.
Кандидоз — антропонозный микоз, характеризующийся поражением слизистых оболочек и кожи. Возможны тяжёлые висцеральные формы, чаще с вовлечением лёгких и органов пищеварения. Кандидоз обычно возникает эндогенно как следствие дисметаболических расстройств и дисфункций иммунной системы.
Возбудители кандидоза — дрожжеподобные грибы рода Candida. Кандиды не относят к истинным диморфным грибам, так как в тканях можно выявлять как дрожжевые клетки, так и гифы. Переход в мицелиальную фазу можно наблюдать при культивировании при более низкой температуре (22-25 С) или при истощении питательной среды. In vivo переход дрожжевой фазы в мицелиальную (плесневую) можно наблюдать при прорастании в ткани организма. Дрожжевая фаза представлена овальными или круглыми клетками-бластоспорами (4-8 мкм), размножающимися многополюсным почкованием. Клеточная стенка содержит 5-7 слоев.
Оптимальная температура для роста кандид составляет 25—28 С. Мицелиальная фаза кандидоза представлена цепочками удлинённых клеток с трёхслойной клеточной стенкой, образующими псевдомицелий. На нём беспорядочно располагаются дрожжеподобные бластоспоры (рис. 35, см. цветную вклейку). Некоторые виды, включая С. albicans, формируют терминальные хламидиоспоры.
Поражения у человека вызывают С. albicans (более 90% поражений), С. tropicalis, С. krusei, С. lusitaniae, С. parapsilosis, С. kefyr, С. guilliermondii и др. В начале XX в. кандидозы наблюдали сравнительно редко, но заболеваемость значительно возросла с началом применения антибиотиков и растёт в настоящее время. На сегодняшний день кандиды — наиболее распространённые возбудители оппортунистических микозов.
С. albicans — нормальный комменсал полости рта, ЖКТ, влагалища и иногда кожи. Любые нарушения резистентности организма либо изменения нормального микробного ценоза могут приводить к развитию заболевания. Возможность передачи возбудителя при бытовых контактах не определена, однако первичная колонизация детей кандидами происходит при прохождении через родовые пути матери или при кормлении грудью. Мочеполовой кандидоз передаётся половым путём.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Оппортунистические инфекции – это большая группа инфекционных заболеваний, которые развиваются у пациентов с различными типами иммунодефицитов и нехарактерны для людей с нормальным иммунным статусом. Патологии поражают любую систему органов и вызывают соответствующую симптоматику. К общим клиническим проявлениям относят длительный субфебрилитет, лимфаденопатию, астенический синдром. Диагностика оппортунистических инфекций включает серологические, молекулярно-генетические, бактериологические и другие методы детекции патогенных возбудителей. Программы лечения сочетают длительную этиотропную терапию с методами иммунокоррекции.
МКБ-10


Общие сведения
Проблема оппортунистических инфекций (ОПИ) становится все более актуальной, что вызвано ростом числа ВИЧ-инфицированных людей, разработкой эффективных, однако агрессивных методов лечения онкопатологии. При этом многие люди являются бессимптомными носителями возбудителей ОПИ: 60% инфицированы цитомегаловирусом, 90% – герпесвирусами 1 и 2 типов, около 30% – токсоплазмой. Учитывая клинический полиморфизм и отсутствие специфических симптомов, диагностика и лечение оппортунистических болезней представляет серьезную мультидисциплинарную проблему.

Причины
Для манифестации оппортунистических инфекций необходимо заражение патогенным микроорганизмом: вирусом, бактерией, грибком или простейшим. Известно более 20 типичных возбудителей ОПИ, в современной инфектологии этот перечень постоянно дополняется. Болезнь возникает при активации латентного очага, реже выступает следствием текущего заражения. Первостепенную важность играет нарушение иммунного статуса вследствие следующих патологий:
- ВИЧ-инфекция. Самая частая причина, поскольку на определенном этапе снижения числа CD4-клеток ОПИ развиваются у каждого больного. Инфекционные болезни используются для диагностики заражения ВИЧ и определения стадии заболевания, поэтому в данном контексте они называются СПИД-ассоциируемыми или СПИД-индикаторными патологиями.
- Злокачественные новообразования. Патофизиология любого опухолевого процесса предполагает угнетение собственной иммунной системы пациента и снижение ее ответа на чужеродные агенты. При этом уменьшается число Т-клеток, угнетаются процессы фагоцитоза. Проблема наиболее выражена при гемобластозах – лейкозах и лимфомах.
- Хроническая соматическая патология. Угнетение активности клеточного и гуморального иммунитета происходит при эндокринных заболеваниях (сахарный диабет, гипотиреоз), почечной недостаточности, тяжелых воспалительных патологиях ЖКТ.
- Ятрогенные факторы. Применение цитостатиков и других видов иммуносупрессоров является важным предиктором развития оппортунистических инфекций. Подобная ситуация наблюдается в группе пациентов после лучевой терапии, трансплантации органов и костного мозга.
- Первичные иммунодефициты. В эту группу относят все виды иммунной недостаточности, которые имеют генетический характер или возникают внутриутробно под влиянием тератогенов. Они манифестируют в раннем детском возрасте, проявляются затяжными оппортунистическими болезнями, которые с трудом подаются терапии.
Патогенез
Хотя возбудители оппортунистических инфекций таксономически неоднородны, в развитии заболеваний большую роль имеют общие особенности их патогенности и вирулентности. К свойствам микроорганизмов, вызывающих ОПИ, относят возможность длительного и даже пожизненного персистирования в организме человека, внутриклеточное паразитирование, склонность к поражению клеток моноцитарно-макрофагальной системы.
Инфекции активизируются при иммунодефицитах любой этиологии и склонны к хроническому течению с периодическими обострениями, поражением жизненно важных органов. Для оппортунистических болезней характерна лимфогенная и гематогенная диссеминация микроорганизмов, образование эктопических очагов. Собственный иммунитет пациента не способен оказать должное сопротивление инфекционному агенту, лекарственные средства не всегда эффективны.
Сложность и опасность оппортунистических инфекций заключается еще и в том, что они способны подавлять естественный иммунитет. В последние годы говорят о возможности пожизненной иммуносупрессии при персистировании герпесвирусов. Таким образом, формируется порочный круг, когда иммунодефицит провоцирует активацию возбудителей ОПИ, которые усугубляют явления иммунной недостаточности и потенциируют дальнейшие полиорганные нарушения.

Классификация
Единой систематизации оппортунистических инфекций на сегодня не существует. Условно возбудителей объединяют в 3 группы: патогены, которые поражают лиц с нарушениями иммунитета и здоровых людей; микробы, встречающиеся только при иммунодефицитах; вакцинные штаммы микроорганизмов. Общепринятой является классификация ОПИ согласно типу возбудителя:
Симптомы оппортунистических инфекций
В инфектологии выделяют общую группу клинических признаков, которая встречается при любом варианте ОПИ. Наиболее типичным симптомом признан длительный субфебрилитет, которые возникает без видимой причины и беспокоит пациента больше 1 месяца. Нередко повышение температуры возникает после перенесенного ОРВИ или кишечной инфекции, которые выступают пусковым фактором активации оппортунистического заболевания.
Вторым настораживающим симптомом считается лимфаденопатия – увеличение лимфатических улов. Чаще всего в процесс вовлекается лимфоидная ткань шейно-подчелюстной, подмышечной и паховой зоны. Лимфоузлы достигают диаметра около 1 см, имеют плотноэластическую консистенцию, не спаяны с окружающими тканями и безболезненны при ощупывании.
Третью группу общей симптоматики оппортунистических инфекций составляет астенический синдром. Он включает слабость, повышенную утомляемость, снижение переносимости умственных и физических нагрузок. Зачастую пациенты жалуются на ночную потливость, головокружения и головные боли, нарушения сна. При длительном существовании таких признаков наблюдается когнитивная дисфункция, эмоциональная подавленность, стойкое снижение работоспособности.
Пациента с иммуносупрессией должен насторожить кашель и одышка – типичные признаки туберкулеза и пневмоцистной пневмонии (ПЦП), снижение остроты зрения – возможное проявление цитомегаловирусного ретинита, длительно сохраняющаяся диарея – признак криптоспоридиоза, микроспоридиоза. Жжение и сухость полости рта в комбинации с эрозиями и белыми налетами на слизистых указывают на орофарингеальный кандидоз.
Оппортунистические болезни не имеют четко выраженного тропизма. Один и тот же вид возбудителя может вызывать миокардит, плеврит, артрит, менингит и другие нозологические формы. Зачастую они имитируют симптомы хронических соматических заболеваний, с которыми пациенты длительно и безрезультатно посещают врачей разных специальностей. Исключение составляет пневмоцистоз, который в основном поражает легкие с развитием ПЦП.
Осложнения
Оппортунистические инфекции – тяжелые и потенциально смертельные заболевания. Среди пациентов с терминальными стадиями ВИЧ-инфекции ОПИ составляют 90% в структуре летальности, оставшиеся 10% приходятся на саркому Капоши, лимфомы и прочие неинфекционные последствия СПИДа. Смертность при церебральном токсоплазмозе составляет около 33%, при криптококковом менингите – 20-30%, при пневмоцистной пневмонии – 10-20%.
Особую тревогу вызывает сочетание нескольких видов оппортунистических заболеваний у одного пациента. Микробные ассоциации более характерны для позднего периода и хронического течения основной патологии, вызвавшей иммунодефицит. Сочетанное инфицирование типично для иммунокомпрометированных пациентов, пребывающих на стационарном лечении: у 40-50% больных в послеоперационном периоде, у 70-80% при перитонитах и плевритах.
Распространение оппортунистических инфекций негативно сказывается на репродуктивном здоровье населения. Они обуславливают многие случаи самопроизвольного прерывания беременности, эмбриопатий и фетопатий, задержки внутриутробного развития. Дети, рожденные от матерей с ОПИ, находятся в группе риска развития заболеваний новорожденных, перинатальных энцефалопатий.

Диагностика
Обследование пациентов проводится мультидисциплинарной командой врачей, в которую входят врач-инфекционист, иммунолог, онколог и другие узкопрофильные специалисты. Большое клиническое значение имеет выяснения времени и условий появления симптоматики, характера течения заболевания, наличия факторов риска иммунодефицитных состояний. Для подтверждения оппортунистических инфекций проводятся следующие методы диагностики:
Лечение оппортунистических инфекций
В процессе лечения практикующие инфекционисты сталкиваются с такими нюансами, как множественная лекарственная устойчивость патогенов, гетерогенность популяции возбудителей, низкая активность естественных иммунных факторов. Основу терапии составляет прием этиотропных противомикробных препаратов: антибиотиков, антимикотиков, противопротозойных и противовирусных. Лечение ОПИ имеет ряд особенностей:
- в основном назначаются комбинации из 2-3 препаратов для повышения их эффективности;
- продолжительность противомикробной терапии повышается в 1,5-2 раза и более в сравнении с лечением инфекционных болезней у иммунокомпетентных лиц;
- при подборе терапии ориентируются не только на клиническую картину болезни, но и на текущий иммунный статус пациента;
- при вирусных инфекциях обязательно назначаются этиотропные препараты, тогда как у людей без иммуносупрессии противовирусные средства используют только по показаниям.
Для успешного лечения ОПИ требуется максимально возможное восстановление иммунной функции. В группе пациентов с ВИЧ-инфекцией назначаются протоколы антиретровирусной терапии (ВААРТ), чтобы повысить число CD4-клеток и улучшить отдаленные прогнозы. При ведении онкологических больных используются персональные схемы иммуномодуляторов, экспериментальные направления иммунотерапии и регенеративной медицины с применением стволовых клеток.
Прогноз и профилактика
Течение любой инфекции на фоне иммуносупрессии является сложным и непредсказуемым, однако усовершенствованные протоколы лечения позволяют достичь стойкой ремиссии или даже полного излечения. К прогностически неблагоприятным факторам относят пожилой и старческий возраст, неправильно подобранную терапию, невозможность проведения иммунокоррекции основного заболевания.
При иммунодефицитах показана первичная медикаментозная профилактика оппортунистических инфекций. Применяют сульфаниламиды, макролиды‑азалиды, противогрибковые средства. При положительной пробе Манту или недавнем контакте с больным туберкулезом назначается химиопрофилактика сроком на 6 месяцев. Также пациентам рекомендовано строго соблюдать противоэпидемические меры, в периоде резкой иммуносупрессии необходимо пребывание в стерильных боксах.
3. Клинические особенности сочетанных оппортунистических инфекций (обзор)/ В.В. Шкарин, Н.В. Саперкин// Медицинский альманах. – 2017. – №4.
4. Оппортунистические инфекции: проблемы и перспективы/ Под общ. ред. проф. Ю.В. Редькина, О.А. Мирошника, В.В. Лобова. – 2002.
Читайте также:

