Что такое пироплазмоз у людей
Обновлено: 22.04.2024
Бабезиоз (бабезиеллез) – острое инфекционное заболевание животных и человека, характеризующееся общей интоксикацией организма, лихорадкой и развитием анемии. Бабезиоз относится к группе трансмиссивных паразитарных зоонозных инфекций. Впервые недуг был диагностирован в 1957 г. в Югославии.
Патогенез бабезиоза
Возбудителями бабезиоза у человека могут быть три вида бабезий (тип – простейшие, класс – споровики): Babesia divergens и Babesia rodhaini – в Европе, Babesia micron – в Америке. У животных возбудителем заболевания также могут быть В. bovis и В. bigemina.
Переносчики инфекции – аргасовые клещи и пастбищный клещ Ixodes ricinus. В их организме бабезии сохраняются пожизненно и могут передаваться потомству. Передача бабезиоза возможна и путем гемотрансфузий (переваливание крови) от инфицированных лиц. Также описаны случаи заражения детей внутриутробно.
К группе риска развития данной инфекционной болезни относятся работники сельского хозяйства, звероводческих ферм и собачьих питомников, а также пастухи и туристы. На сегодняшний день в мировой литературе описано только порядка 100 случаев возникновения бабезиоза у человека, большинство из них закончились летальным исходом. Острые формы болезни развивались у людей с серьезными нарушениями иммунной системы, в том числе после спленэктомии (операции по удалению селезенки) и у ВИЧ-инфицированных. У людей с полноценно функционирующей иммунной системой заболевание отличается бессимптомным течением, паразитемия достигает максимум 2%.
Итак, риск заражения бабезиозом выше:
При сниженном иммунитете;
У людей с удаленной селезенкой;
При наличии любого аутоиммунного заболевания;
У ВИЧ-инфицированных, больных СПИДом;
У пожилых людей;
У пациентов с хроническими болезнями и очагами инфекции;
У людей, которые не так давно перенесли тяжелое заболевание.
В этих случаях бабезиоз протекает в крайне тяжелой форме и чаще всего заканчивается смертью.
Признаки бабезиоза у человека
Продолжительность инкубационного периода бабезиоза после укуса клеща составляет 10-15 дней, при заражении через кровь – 6-12 суток.
Как было сказано выше, симптомы бабезиоза появляются только в случае поражения более 3-5% эритроцитов.
Легкое течение болезни характеризуется гриппоподобным состоянием: повышение температуры тела, общее ослабление организма, учащенное дыхание, озноб, потоотделение. Больные жалуются на сниженный аппетит, боли в мышцах, лабильное настроение, головные боли. У них падает гемоглобин, развивается небольшая анемия. Главное отличие бабезиоза от простуды и ОРВИ – отсутствие положительного эффекта от противовирусных препаратов.
Для тяжелого течения бабезиоза характерно острое начало: внезапное повышение температуры до 41 градуса, которая держится до 8 дней, после чего также резко спадает. Наблюдается острый гемолиз эритроцитов, что сопровождается желтушностью кожных покровов. Интенсивность желтухи зависит от степени лизиса красных кровяных телец. Пациенты жалуются на выраженный озноб, тошноту, рвоту, общетоксические симптомы, головные боли, снижение аппетита, боли в животе и мышцах, светобоязнь, нарушение сердечной деятельности.
Примерно через 7 дней после появления клинических признаков бабезиоза в моче появляется гемоглобин, развивается олигурия, появляются симптомы почечной недостаточности. Печень и селезенка увеличивают до огромных размеров. В крови отмечается резкое уменьшение количества эритроцитов, развивается выраженная анемия.
В 50% случаев, если человеку не оказать медицинскую помощь, наступает летальный исход из-за уремии, присоединения сепсиса, развития пневмонии и других осложнений.
Диагностика бабезиоза
Клиническая диагностика бабезиоза затруднительна по причине недостаточного количества наблюдений за больными (ввиду редкости заболевания) и неспецифичности симптомов. А потому любой больной, у которого в течение длительного периода времени держится температура, увеличилась печень, а антибактериальная терапия при этом не дает результатов, должен быть обследован на все инфекционные заболевания, в том числе на бабезиоз.
Большое значение имеет учет эпидемиологических данных больного – зафиксированные случаи укусов клещей, пребывание в эндемичной местности. Важно и установление особенностей иммунного статуса больного.
Очень эффективным является ксенодиагностика, когда кровь пациента вводят спленэктомированным лабораторным хомякам. Через 2-4 недели проводят анализ их крови на наличие в ней бабезий.
Самый результативный, но довольно дорогой способ диагностики бабезиоза – определение ДНК паразита методом ПЦР (полимеразной цепной реакции).
Лечение бабезиоза у человека
С учетом того, что бабезиоз – заболевание малоизученное, подход к его лечению индивидуальный.
Легкая форма заболевания, как правило, проходит сама, поэтому медикаментозной терапии не требует.
Основа успешного лечения среднетяжелых и тяжелых форм бабезиоза – раннее назначение антипаразитарных препаратов.
Практикуются следующие схемы медикаментозного лечения бабезиоза:
Комбинация Хинина и Клиндамицина – эффективный метод, однако дает много побочных эффектов: шум в ушах, выраженные расстройства в работе ЖКТ;
Сочетание Котримоксазола и Пентамидина Диизоцианата – схема, которая дает положительные результаты уже на третьи сутки после начала лечения;
Одновременное назначение Атовакона и Азитромицина. Для понижения температуры, с целью коррекции гипоксии и дезинтоксикации назначают симптоматическое лечение.
Для устранения анемии прописывают препараты железа.
При острой почечной недостаточности проводят процедуры гемодиализа.
Падение гемоглобина ниже 70 г/л, эритроцитов до 1,2 млрд/мкл, гематокрита – 20% являются показаниями к переливанию крови или эритроцитарной массы.
Бабезиоз (пироплазмоз, бабезиеллёз, babesiosis) - острое инфекционное заболевание человека и животных, характеризующееся интоксикацией, лихорадкой, развитием анемии и тяжелым прогрессирующим течением. Бабезиоз относится к трансмиссивным паразитарным зоонозным инфекциям. Заболевание у человека было впервые диагностировано в Югославии в 1957 году.
Болезни протекают с проявлениями лихорадки, анемии, желтухи, гемоглобинурии. Наибольшее ветеринарное значение имеют бабезиозы мелкого и крупного рогатого скота, а также собак. Возможно заболевание человека. Распространены на всех континентах, кроме Антарктики, в пределах ареалов переносчиков - нескольких видов пастбищных клещей. В России - в основном на северо-западе и юге Европейской части и в степных районах юга Сибири.
Из-за недостаточной изученности и различия мнений исследователей, часто бабезиоз отождествляют с пироплазмозом, что не вполне корректно из-за различий в этиологии возбудителей, а также клинической картины заболеваний. По Международной классификации болезней МКБ-10 бабезиоз человека имеет код B60.0.
Что провоцирует / Причины Бабезиоза:
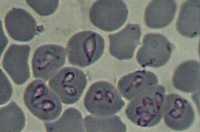
Возбудитель бабезиоза относится к типу простейших, классу споровиков, семейству Babesiidae. Заболевание человека вызывают три вида бабезий: Babesia divergens, rodhaini - в Европе и Babesia micron в Америке. Бабезиоз животных вызывается также В. bovis и В. bigemina. Бабезии располагаются внутри пораженных эритроцитов в центре или по периферии клеток. При окраске по Граму имеют вид тонких колец диаметром 2-3 мкм или образований грушевидной формы диаметром 4-5 мкм.
В мировой литературе к настоящему времени описано всего около 100 случаев бабезиоза, большинство из которых закончилось летально. Манифестные формы заболевания развивались у лиц с резкими нарушениями иммунной системы, в частности после спленэктомии. Считается вероятной манифестация бабезиоза у ВИЧ-инфицированных. У людей с нормально функционирующей иммунной системой заболевание протекает бессимптомно, несмотря на наличие паразитемии, достигающей 1-2%.
Заболевание встречается в Европе (Скандинавские страны, Франция, ФРГ, Югославия, Польша) и в США (восточное побережье). Хозяином являются мыши-полевки и другие грызуны, собаки, кошки и крупный рогатый скот. Бабезиоз животных открыт в 1888 году В. Бабешем. Ежегодно только в Европе регистрируются десятки тысяч случаев заболевания домашних животных. Переносчик - широко распространенный пастбищный клещ Ixodes ricinus и аргасовые клещи. Возбудитель сохраняется в организме клещей пожизненно и может передаваться трансовариально. Заболевают туристы, сельхозяйственные рабочие, пастухи в период активности клещей (весенне-летний и летне-осенний сезоны). Возможна передача инфекции путем гемотрансфузий от инфицированных лиц, у которых имеется бессимптомная паразитемия.
Патогенез (что происходит?) во время Бабезиоза:
Патогенез бабезиоза изучен недостаточно.
Передаётся бабезиоз через укусы клещей почти всех родов семейства Ixodidae, наиболее известны как передатчики клещи родов Dermacentor, Rhipicephalus, Hyalomma. Передача происходит через слюну во время питания клеща.
Естественным резервуаром возбудителей в природе служат больные бабезиозом животные. Промежуточные резервуары - мелкие грызуны.
Переболевшие животные в течение 2- 3 лет невосприимчивы к повторному острому заражению. Во многих эндемичных районах заражено большинство или всё поголовье скота.
Симптомы Бабезиоза:
Продолжительность инкубационного периода при заражении Babesia divergens через клещей 10–15 суток, через кровь - 6–12 суток, при заражении овец Babesia ovis соответственно 8–12 и 5–7 суток. У больных животных резко повышается температура тела (до 40–41°C), нарушается работа сердца, учащается дыхание. Общее состояние угнетённое, запоры чередуются с поносами. Животные быстро худеют. Удои коров снижаются в 4–5 раз. Молоко становится жёлтым, иногда красноватым, горьким на вкус. На 2-3–й день болезни появляется кровавая моча. У овец часто наступает прерывание беременности. Продолжительность острого периода болезни 4–8 суток.
Летальность у крупного рогатого скота 40% и более, у овец и коз - до 80% от числа заболевших острой формой.
Бабезиоз у человека развивается в основном на фоне пониженного иммунного статуса (пожилые или перенёсшие тяжёлые операции, больные СПИДом). Случаи заболевания начали фиксировать лишь во второй половине 20–ого века, описано несколько десятков случаев заболевания. Высока вероятность недостаточного уровня диагностики этого заболевания у человека, для его повышения проводится значительная работа во многих странах. У человека с нормальной иммунной системой протекает бессимптомно, несмотря на высокую степень паразитемии (1–2%).
Осложнения. Бабезиоз закономерно осложняется острой почечной недостаточностью, острой почечно-печеночной и полиорганной недостаточностью. Присоединяющиеся неспецифические пневмонии ухудшают прогноз.
Диагностика Бабезиоза:
Клиническая диагностика затруднительна. Длительная лихорадка в сочетании с анемией, гепатомегалией при отсутствии эффекта от лечения с применением антибактериальных средств является основанием для лабораторных исследований на ба-безиоз. Особенно важен учет эпидемиологических данных (укусы клещей, пребывание в эндемичной местности) и выявление нарушений иммунного статуса у больного. Диагноз подтверждается паразитологиче-ски обнаружением возбудителя в мазке и толстой капле крови, а также в реакции непрямой иммунофлюоресценции. Диагностический титр при однократном исследовании не менее 1:256. Применяют также реакцию связывания комплемента.
При невысокой паразитемии иногда используют биологический метод, при котором кровь больного вводят спленэктомированным золотистым хомячкам. Спустя 2-4 нед у животных развивается заболевание и бабезий легко выявляются в мазке крови.
Дифференциальная диагностика проводится с тропической малярией, сепсисом, заболеваниями крови, ВИЧ-инфекцией, ГЛПС.
Лечение Бабезиоза:
Хороший лечебный эффект дают пироплазмил, беренил, гемоспоридин, акаприн, ихтарган, альбаргин, тиарген, наганин и др. Больным животным предоставляют полный покой (их нельзя перегонять), обеспечивают зелёными и сочными кормами.
Для тяжёлых форм бабезиоза у человека рекомендованы комбинации клиндамицина и хинина или азитромицина и атоваквона. В тяжёлых случаях необходимо переливание крови.
Прогноз. Без этиотропного лечения заболевание нередко (50-80% случаев) заканчивается летальным исходом. При своевременном начале антипаразитарной терапии прогноз благоприятный.
Профилактика Бабезиоза:
Специфическая профилактика не разработана.Уничтожение клещей и грызунов на пастбищах, обработка животных акарицидами. Для человека - применение противоклещевых препаратов.
К каким докторам следует обращаться если у Вас Бабезиоз:
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Бабезиоза, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору .
Пироплазмоз – трансмиссивное протозойное заболевание человека и животных, вызванное внутриклеточными простейшими рода Babesia, паразитирующими в эритроцитах. Заболевание развивается у лиц со сниженным иммунным ответом. Течение пироплазмоза сопровождается лихорадкой, ознобом, головными и мышечными болями, артралгией, гепатомегалией, анемией. Диагноз пироплазмоза подтверждается обнаружением паразита в мазке и толстой капле крови, а также методами РИФ, ИФА. Терапевтический эффект в отношении возбудителя пироплазмоза оказывает комбинированное назначение клиндамицина и хинина, азитромицина и атоваквона.
Общие сведения
Пироплазмоз (бабезиоз, бабезиеллез) - паразитарная зоонозная инфекция, протекающая с лихорадочным, анемическим и желтушным синдромами. Как инфекционное заболевание, пироплазмоз представляет актуальную проблему для ветеринарии, поскольку, главным образом, поражает мелкий и крупный рогатый скот, собак и других животных. Бабезиозы человека регистрируются относительно редко (в мире известно несколько сотен случаев). Впервые пироплазмоз человека был диагностирован в 1957 году в Югославии. С тех пор случаи заболевания человека были выявлены в странах Азии, Африки, Европы, Америки. На территории России природные очаги пироплазмоза располагаются в северо-западных и южных областях Европейской части и в степной зоне юга Сибири.

Причины пироплазмоза
Возбудители пироплазмоза принадлежат к типу простейших, семейству Babesiidae, роду Babesia. По своим морфо-физиологическим свойствам бабезии напоминают возбудителей малярии: они также паразитируют в эритроцитах, а внешне имеют сходство с плазмодиями. В эритроците бабезии располагаются по периферии или в центре; имеют различную (грушевидную, кольцевидную, овальную, точковидную, амебовидную, ланцетовидную) форму, диаметр от 2-3 до 4-5 мкм. Пироплазмоз человека могут вызывать 3 вида возбудителя: Babesia divergens и Babesia rodhaini в Европе, Babesia microti – на американском континенте.
Возбудители пироплазмоза паразитируют в организме диких и домашних животных (грызунов, собак, кошек, мелкого и крупного рогатого скота), а человеку передаются трансмиссивным путем, через укусы инфицированных иксодовых и аргасовых клещей. В организме клещей бабезии сохраняются пожизненно и даже передаются трансовариально потомству. Кроме этого, не исключается возможное заражение человека при переливании крови от лиц с бессимптомной паразитемией. Повышенному риску заражения пироплазмозом подвергаются пастухи, сельскохозяйственные рабочие, туристы в период сезонной активности клещей (с мая по сентябрь). Иногда отмечается микстинфицирование бабезиями и спирохетами рода Borrelia - возбудителями болезни Лайма, передаваемыми теми же видами клещей.
Жизненный цикл развития бабезий протекает в организме клещей-переносчиков и позвоночных. В организме клеща паразиты покидают эритроциты позвоночного хозяина и претерпевают сложный и множественный цикл деления в просвете и эпителиальных клетках кишечника, гемолимфе, различных органах клеща. Процесс развития бабезий до инвазионной стадии (одноядерных спорозоитов) происходит в слюнных железах клеща и стимулируется кровососанием. Попав в кровь человека или животных возбудители пироплазмоза проникают в красные кровяные клетки, где размножаются путем бинарного деления или почкования. Увеличивая свою численность, паразиты разрушают эритроциты хозяина, затем проникают в новые эритроциты, повторяя цикл деления.
Клинические проявления пироплазмоза развиваются при поражении бабезиями 3-5% эритроцитов. Вместе с разрушенными эритроцитами в кровяное русло выделяются продукты жизнедеятельности паразитов и белковые субстанции, вызывающие выраженную общетоксическую и пирогенную реакцию. Нарастают анемия, тканевая гипоксия, нарушения микроциркуляции, главным образом в почечных капиллярах, где оседают свободный гемоглобин и оболочки эритроцитов. Поражение 10-15% эритроцитов приводит летальному исходу от острой почечной недостаточности.
Симптомы пироплазмоза
У лиц с нормальным иммунитетом пироплазмоз протекает в виде бессимптомного носительства, несмотря на паразитемию 1-2%. Тяжелое манифестное течение в основном отмечается у лиц со сниженными иммунными реакциями: пожилых людей, пациентов, перенесших спленэктомию, ВИЧ-инфицированных и т. д.
Инкубационный период при заражении пироплазмозом длится 1-3 недели (в редких случаях – несколько месяцев). При легкой клинической форме пироплазмоза отмечаются гриппоподобные симптомы: лихорадка, слабость, разбитость, ломота в теле. При тяжелом течении инфекции развивается острая лихорадка с температурой 40-41°С и потрясающими ознобами, сильными головными и мышечными болями, артралгией. На фоне высокой температуры возникают тошнота, рвота, боли в эпигастрии, чередование запоров и диареи, гепатоспленомегалия, желтуха, снижение массы тела. С 6-7-го дня заболевания нарастают гемоглобинемия, гемоглобинурия, олигоанурия и острая почечная недостаточность. Особо тяжелое течение имеет пироплазмоз, вызванный B.divergens: даже при своевременно начатом специфическом лечении смертность достигает 50%. Гибель больных пироплазмозом обычно связана с уремией, почечно-печеночной недостаточностью или присоединением бактериальных инфекций (пневмонии, сепсиса).
Хронический пироплазмоз протекает с периодическими лихорадочными реакциями, нарушением аппетита, слабостью, снижением внимания, утомляемостью, подавленностью, что может ошибочно расцениваться, как ипохондрия или депрессия.
Диагностика и лечение пироплазмоза
Поскольку случаи пироплазмоза редки в клинической практике, заболевание приниматься за геморрагическую лихорадку с почечным синдромом, малярию, сепсис, болезни крови, проявления СПИДа и др. Для постановки клинического диагноза важно учитывать эпидемиологические сведения (нахождение в эндемичных районах, факт укусов клещей), а также сочетание патогномоничных симптомов (длительной лихорадки, анемии, гепатомегалии).
Лабораторное подтверждение пироплазмоза основано на микроскопии толстой капли или мазка крови при окрашивании их по Романовскому-Гимзе: при этом ядро бабезий окрашивается в красный цвет, а цитоплазма – в голубой. С помощью серологических тестов (НРИФ, ИФА) диагностические титры антител обнаруживаются спустя 3-8 недель от начала заболевания. При хроническом пироплазмозе наиболее показательно выявление ДНК бабезий при помощи ПЦР. Биологический метод диагностики пироплазмоза – введение крови больного спленэктомированным хомячкам с последующим выделением возбудителя эффективен, но длителен (занимает от 2-х до 4-х недель).
Легкие, доброкачественно протекающие формы пироплазмоза не нуждаются в специфической терапии. При тяжелом течении рекомендуется назначение клиндамицина совместно с хинином, либо азитромицина и атоваквона, либо комбинации пентамидина, диизоцианата, сульфаметоксазола и триметоприма. При анемии показаны препараты железа, проведение гемотрансфузии; при высокой лихорадке – дезинтоксикационная терапия и антипиретики. В случае развития ОПН осуществляется гемодиализ.
Без лечения тяжелые формы пироплазмоза практически всегда заканчиваются гибелью пациента. При своевременной антипаразитарной терапии шансы на выздоровление высокие. Иммунопрофилактика пироплазмоза не разработана. Неспецифические меры сводятся к борьбе с переносчиками инфекции, защите от клещей, срочному удалению присосавшихся клещей.
Гранулоцитарный анаплазмоз – это инфекционное заболевание с трансмиссивным путем передачи. Основными симптомами являются длительная лихорадка с выраженными общеинтоксикационными проявлениями. Гораздо реже наблюдаются нарушения работы желудочно-кишечного тракта, кашель, миалгии и кожные высыпания. Диагностика анаплазмоза осуществляется методами ПЦР и темнопольной микроскопии окрашенных мазков крови для выявления возбудителя, с помощью ИФА определяют антитела. Лечение включает этиотропные антибактериальные препараты, патогенетические, симптоматические средства.
МКБ-10

Общие сведения
Гранулоцитарный анаплазмоз человека является болезнью, передаваемой клещами. Анаплазмы были открыты английским ветеринаром Тейлером в 1910 году, заболевание впервые описано врачом Бэккеном в 1991 году (США). Инфекция распространена в Великобритании, Швеции, США, Канаде. В России эндемичными зонами считаются Приморье, Алтайский и Хабаровский край, Новосибирская область. Чаще поражаются лица старше 45 лет мужского пола, жители сельских районов, пригородов. Сезонность болезни – летне-осенняя с пиками в июне, июле и ноябре, имеет связь с активностью переносчиков.

Причины
Возбудитель заболевания – бактерия Anaplasma, виды А. phagocytophilum, A. marginale. Источником и резервуаром инфекции служат белоногие мыши, косули, лесные крысы, крупный рогатый скот. Переносчиками гранулоцитарного анаплазмоза являются иксодовые клещи, преимущественно видов I. scapularis, I. pacificus, I. ricinus, I. persulcatus. Инфицированность переносчиков на территории России, по разным данным, составляет 6-19%.
Основные факторы риска – пожилой возраст, прием иммунодепрессантов, сахарный диабет, коллагенозы, ВИЧ-инфекция, симптомы лекарственного, онкогенного иммунного дефицита. Интерес для современной клинической инфектологии представляет изучаемая возможность связи тяжелого течения гранулоцитарного анаплазмоза с мутациями генов, специфически влияющих на экзоцитоз цитотоксических эффекторных молекул при активации макрофагов.
Патогенез
После присасывания переносчика возбудитель со слюной попадает в толщу кожи. Анаплазмы способны проникать в зрелые нейтрофилы. Внутри цитозоля формируются колонии (морулы). Инфицированные лейкоциты активируют секрецию хемокинов, привлекающих к размножению лимфоциты и макрофаги. Эти иммунные клетки в дальнейшем продуцируют провоспалительные гамма-интерфероны, чем усиливают воспалительный компонент реакции организма.
С током крови анаплазмы переносятся в селезенку, печень, лимфатические узлы и костный мозг, где за счет индуцированных хемокинов, являющихся сильными ингибиторами пролиферации стволовых клеток, нарушают кроветворение. Моноциты и естественные Т-киллеры, ответственные за регуляцию активированных макрофагов, становятся дисфункциональными, что приводит к выраженным воспалительным повреждениям в тканях за счет усиления секреции ИФН-γ, ИЛ-12, ИЛ-1β и ИЛ-10.
Симптомы гранулоцитарного анаплазмоза
Инкубационный период составляет 14 дней, может укорачиваться до 3 суток или удлиняться до 3 недель. Начало гранулоцитарного анаплазмоза острое, с симптомами общей интоксикации: слабостью, утомляемостью, умеренными головными болями. Лихорадка характеризуется длительностью, потрясающими ознобами, достигает 38,5° C и более. Могут возникать тошнота, дискомфорт в животе, чувство давления и распирания в правом подреберье, рвота и расстройства стула.
Часть пациентов предъявляет жалобы на мышечные и суставные боли, сухой кашель (19%), першение в горле, заложенность носа. Гораздо реже возникают такие опасные симптомы, как нарушения сознания, галлюцинации, бред, параличи, светобоязнь, десневая и носовая кровоточивость, появление крови в моче и кале, чувство нехватки воздуха, обмороки при резком вставании. При появлении этих признаков необходима срочная консультация врача.
Осложнения
Осложнения гранулоцитарного анаплазмоза считаются редкими состояниями, больше характерными для пациентов с отягощенным преморбидным фоном. Наиболее часто встречаются симптомы токсического шока, сепсис, острая дыхательная недостаточность, пневмония (1%), миокардит, рабдомиолиз и неврологические нарушения (около 1%) – демиелинизирующие полиневриты, менингоэнцефалиты.
Описаны случаи таких осложнений гранулоцитарного анаплазмоза, как аритмии, респираторный дистресс-синдром взрослых, кишечные и желудочные кровотечения, гемофагоцитарный лимфогистиоцитоз. На фоне ослабленного иммунитета в присутствии анаплазм возможна манифестация симптомов легочного аспергиллеза, диссеминированного кандидоза, криптококкоза, некротизирующего герпетического фарингита.
Диагностика
Верификация диагноза и назначение лечения осуществляются инфекционистом. Другие медицинские специалисты привлекаются по показаниям. Важен тщательный сбор эпидемиологического анамнеза с уточнением нахождения в эндемичном регионе, факта и длительности присасывания клеща, приема профилактических препаратов. Опорными клинико-лабораторными и инструментальные признаками гранулоцитарного анаплазмоза человека являются:
- Физикальные данные. При объективном исследовании выявляется лимфаденопатия, гиперемия зева, иногда единичные хрипы в легких во время аускультации, урчание, диффузная болезненность живота, умеренная гепатомегалия, реже спленомегалия. Сыпь на теле встречается менее чем в 10% случаев, пятнисто-папулезная. Обязательно исследуются менингеальные симптомы.
- Лабораторные исследования. В общеклиническом анализе крови – лейкопения, нейтропения, лимфопения, тромбоцитопения, анемия, ускорение СОЭ, в тяжелых случаях панцитопения. Повышается активность АЛТ, АСТ, мочевины, СРБ, ЛДГ, креатинина. В общем анализе мочи – протеинурия, эритроцитурия. В ликворограмме – лимфоцитарный плеоцитоз, увеличение содержания белка.
- Выявление инфекционных агентов. Темнопольная микроскопия тонких мазков крови позволяет обнаружить морулы (вакуоли с анаплазмами) на первой неделе заболевания; метод малоинформативен. Назначение ПЦР рекомендуется до начала этиотропного лечения. ИФА становится диагностически значимым, начиная со второй недели болезни, выполняется двукратно с интервалом 2-3 недели.
- Инструментальные методы. При проведении рентгенографии грудной клетки визуализируются увеличенные лимфоузлы корней легких, инфильтраты, усиление легочного рисунка. Во время ультразвукового исследования определяются симптомы увеличения печени и селезенки. На ЭКГ отмечаются преходящие нарушения проводимости миокарда, брадикардия.
Дифференциальная диагностика проводится с моноцитарным эрлихиозом человека и пироплазмозом (нужна лабораторная верификация). При ку-лихорадке наблюдается поражение респираторного тракта, для лептоспироза характерна желтуха, боли в мышцах, геморрагический компонент, клиника пятнистой лихорадки Скалистых гор включает обильную сыпь с геморрагическим компонентом, вовлечение ЦНС. Иксодовый клещевой боррелиоз проявляется эритемой, поражением опорно-двигательного аппарата.
Лечение гранулоцитарного анаплазмоза
Эмпирическая терапия назначается лихорадящим пациентам, по факту присасывания клеща более чем на 4-24 часа без приема химиопрофилактики. При наличии симптомов гранулоцитарного анаплазмоза лечение проводится в амбулаторных условиях при легком и среднетяжелом течении инфекции, отсутствии отягощенного преморбидного фона. Госпитализация требуется в 30% случаев заболевания, чаще – беременным женщинам, детям младшего возраста. Постельный режим соблюдают до 2-3 суток без лихорадки.
Осложненное течение болезни в 3% случаев является показанием для пребывания в палате интенсивной терапии, иногда искусственной вентиляции легких. Диетические рекомендации включают щадящее витаминизированное питание, исключение животных жиров, сахара, пряностей, маринадов, алкоголя и кофе. При отсутствии противопоказаний рекомендуется прием увеличенного количества кипяченой воды, оральных полиионных растворов.
Консервативная терапия
Стандарты медикаментозного ведения гранулоцитарного анаплазмоза не разработаны. Средняя продолжительность терапии составляет около 6-14 дней. У пациентов без осложнений нормализация температуры тела отмечается примерно через четверо суток, лабораторные показатели обычно стабилизируется в течение недели. Чаще всего лечение инфекционной патологии осуществляется следующими препаратами:
- Этиотропные. Анаплазмы чувствительны к тетрациклину, доксициклину, рифампицину, хлорамфениколу. Последний должен использоваться с осторожностью из-за риска дополнительного угнетения кроветворения, считается малоэффективным. Клиническое улучшение оценивается через 48 часов антибактериальной монотерапии; необходимо помнить о коинфекции с другими клещевыми болезнями.
- Патогенетические. Дезинтоксикация проводится инфузионными методами с помощью глюкозо-солевых, сукцинат-содержащих растворов, хлосоля, ацесоля. Для снижения температуры тела, обезболивания и купирования симптомов воспаления назначаются НПВС; ацетилсалициловая кислота и аналоги применяются с осторожностью. Иногда требуется переливание тромбоцитов, эритроцитарной массы.
- Симптоматические. При катаральных проявлениях рекомендовано местное противовоспалительное лечение, противокашлевые лекарства. Для купирования симптомов диспепсии пациенты получают ферменты, спазмолитики, противорвотные, сорбирующие средства. Поражение нервной системы может потребовать назначения глюкокортикостероидов, антихолинэстеразных препаратов, липоевой кислоты.
Лица с ВИЧ-инфекцией могут переносить гранулоцитарный анаплазмоз как в бессимптомной, так и в генерализованной форме, чаще в виде пневмонии, ДВС-синдрома либо симптомов манифестации оппортунистических инфекций. При подозрении на данную клещевую нозологию необходимо незамедлительно начать прием этиотропных препаратов в течение 2-х и более недель. Детям до 8 лет и беременным препараты тетрациклинов противопоказаны.
Прогноз и профилактика
Прогноз благоприятный для случаев своевременного выявления симптомов и лечения. Продолжительность лихорадочного периода может составлять более 3 недель. Летальность при гранулоцитарном анаплазмозе достигает 0,2-1%; предикторами являются преклонный возраст, высокий уровень креатинина, АСТ, ЛДГ, симптомы различных нарушений сознания, системного воспалительного ответа.
Специфических вакцинных препаратов для профилактики инфекции не существует. Неспецифические меры – акарицидная обработка полей, парков, сельских районов, пригородных поселений и кладбищ, соответствующая экипировка для нахождения в эндемичных зонах. Необходимо использовать репелленты, своевременно обращаться за медицинской помощью в случае присасывания клеща, получать своевременную полноценную антибактериальную профилактику.
1. Анаплазмозы и эрлихиозы человека – новая проблема инфекционной патологии в России: пособие для врачей/ Рудаков Н.В., Шпынов С.Н., Оберт А.С. - 2006.
3. Гранулоцитарный анаплазмоз человека/ Волосач О. С.// Журнал Гродненского государственного медицинского университета - 2015 - № 2.
4. Pro-inflammatory immune responses are associated with clinical signs and symptoms of human anaplasmosis/ Anna M. Schotthoefer, Steven J. Schrodi, Jennifer K. Meece, Thomas R. Fritsche,Sanjay K. Shukla// PLoS One – 2017 -№12.

Этиология бабезиоза
В США Babesia microti наиболее распространенная причина бабезиоза у людей. Грызуны – основной естественный носитель, а клещи оленя семейства иксодовых – обычные переносчики. Личинка клеща заражается, питаясь на инфицированном грызуне, затем преобразовывается в нимфу, которая передает паразита другому животному или человеку. Взрослый клещ обычно питается на олене, но также может передать паразита людям. Babesia проникает в эритроциты, созревает, а затем размножается бесполым путем. Зараженные эритроциты в конечном счете разрываются и выпускают оорганизмы, которые поражают другие эритроциты; таким образом, Babesia может также передаваться при переливании крови, возможно, при пересадке органов. Тест для скрининга доноров крови и органов на Babesia microti стали применять в США с 2018 года. В настоящее время он используется в штатах на северо-востоке США с самыми высокими показателями инфицирования. Врожденная инфекция также может встречаться, но очень редко.

Иксодовые клещи, зараженные Babesia, иногда также коинфицированы Borrelia burgdorferi (которая вызывает болезнь Лайма Болезнь Лайма Болезнь Лайма – передаваемая клещами инфекция, вызываемая видом spirochete Borrelia. Ранние признаки включают сыпь в виде мигрирующей эритемы, которая может сопровождаться спустя несколько недель-месяцев. Прочитайте дополнительные сведения ), Anaplasma phagocytophilum (которая вызывает гранулоцитарный анаплазмоз человека [ГАЧ]) или Borrelia miyamotoi (которая вызывает ГАЧ-подобное заболевание) или вирус Повассан (флавивирус, который вызывает энцефалит Энцефалит Энцефалит характеризуется воспалительным процессом в веществе головного мозга вследствие прямого воздействия вирусного агента. При остром диссеминированном энцефаломиелите воспалительный процесс. Прочитайте дополнительные сведения ). Таким образом, от укуса клеща пациенты заражаются более чем одной инфекцией.
Читайте также:

