Что такое посев на хеликобактер
Обновлено: 24.04.2024
В статье представлены результаты бактериологического тестирования 48 штаммов Helicobacter pylori (H. pylori), выделенных от пациентов в Санкт-Петербурге. Антибиотикорезистентность штаммов H. pylori оценивали методом серийных разведений. Среди анализируемы
Resistance of Helicobacter pylori to antimicrobial preparations by the results of bacteriologic testing
The article describes the results of bacteriologic testing of 48 Helicobacter pylori (H. pylori) strains taken from the patients in Saint-Petersburg. Antibiotic resistance of H. pylori strains was evaluated by serial breeding method. Among the analysed isolates, 42,5% were resistant to metronidazole, 27,1% — to levofloxacin, 25% — to clarithromycin, 6,3% — to amoxicillin. All the tested strains were sensitive to tetracycline.
Эрадикация H. pylori у инфицированных пациентов, страдающих хроническим гастритом, язвенной болезнью, функциональной диспепсией и другими H. pylori-ассоциированными заболеваниями, является основной стратегией предотвращения развития некардиального рака желудка [1]. В любой клинической ситуации, при которой врач сомневается в необходимости диагностировать инфекцию H. pylori и провести уничтожение микроорганизма, дополнительным и крайне актуальным аргументом в пользу этих мероприятий должен стать профилактический эффект эрадикации относительно возникновения рака желудка, особенно у пациентов с отягощенным наследственным анамнезом [2].
Целью данной работы было получение данных о состоянии первичной антибиотикорезистентности штаммов H. pylori, выделенных от пациентов в Санкт-Петербурге.
Материал и методы исследования
Исследование по протоколу SHELF проводилось в Санкт-Петербурге с мая 2013 по июнь 2014 года. Одобрение было получено в центральном и локальном научном этическом комитете в соответствии с принципами Хельсинкской декларации. В исследовании использовались гастробиоптаты пациентов, соответствующих следующим критериям.
Критерии исключения:
1) пациенты, ранее получавшие антимикробную терапию для эрадикации H. pylori;
2) пациенты, получавшие антибиотики из группы макролидов в течение одного года, предшествовавшего данному исследованию;
3) пациенты, участвующие в любых других клинических исследованиях;
4) пациенты, получавшие ингибиторы протонного насоса и препараты висмута в течение двух недель, предшествовавших данному исследованию;
5) больные, принимающие антибактериальную терапию на момент забора материала.
Критерии включения:
1) мужчины и женщины в возрасте от 18 до 65 лет;
2) пациенты с инфекцией H. pylori, подтвержденной быстрым уреазным тестом гастробиоптата, полученного при проведении эзофагогастродуоденоскопии (ЭГДС);
3) решение врача в рамках рутинной клинической практики и диагноза пациента провести ЭГДС с забором биоптата.
В качестве основы питательной среды для выделения и культивирования H. pylori использовался колумбийский агар. Каждый образец биопсии высевался параллельно на две чашки Петри с агаром, содержащим антибиотики в следующих концентрациях: ванкомицин в концентрации 6 мкг/мл, триметоприм, в концентрации 2 мкг/мл (растворяли в спирте) и амфотерицин В (или налидиксовую кислоту) в концентрации 2–10 мкг/мл.
Инкубация посевов осуществлялась в микроаэрофильных условиях при содержании кислорода около 5%. Для этих целей использовались анаэростаты системы GasPac100 c газогенерирующими пакетами типа GasPak (BBL CampyPak Plus Microaerophilic System envelopes with Palladium Catalyst).
На кровяной питательной среде на 5–7 сутки H. pylori формировал мелкие, круглые, гладкие, прозрачные, влажные колонии диаметром около 1 мм. Колонии H. pylori, полученные в результате первичного посева биопсийного материала, использовали для приготовления мазков, окраски их по Граму и постановки уреазного теста.
Решение вопроса о принадлежности выделенной культуры к роду Helicobacter выносили на основании характерной морфологии выделенных колоний, а также набора тестов: морфологии культуры в мазке, окрашенном по Граму, и наличии характерных биохимических свойств (способности к продукции уреазы). Типичные клетки H. pylori при микроскопии имели вид тонких изогнутых нежно-розовых палочек.
Антибиотикорезистентность выделенных штаммов H. pylori изучали, используя метод серийных разведений, который основан на регистрации ингибиции роста микроорганизма на питательном агаре, содержащем определенные концентрации антибиотика. Определяли чувствительность штаммов H. pylori к кларитромицину, амоксициллину, левофлоксацину, метронидазолу и тетрациклину. Рабочие концентрации исследуемых антибактериальных препаратах в агаре были следующими:
- амоксициллин — 0,25; 0,12; 0,06 мкг/мл;
- кларитромицин — 1,0; 0,5; 0,25; 0,12 мкг/мл;
- левофлоксацин — 2,0; 1,0; 0,5 мкг/мл;
- метронидазол — 16; 8; 4 мкг/мл;
- тетрациклин — 2,0; 1,0; 0,5 мкг/мл.
Среды и растворы антибактериальных препаратов готовили непосредственно перед использованием.
На чашки Петри с ростом H. pylori добавляли по 1–2 мл стерильного физиологического раствора и снимали бактериальную массу. Инокулюм наносили бактериологической петлей на поверхность чашки Петри с селективной кровяной средой с определенной концентрацией антибиотика, равномерно распределяя по поверхности. Затем чашки Петри помещали в анаэростат и инкубировали при температуре 37 °С в течение 3–5 суток. После окончания инкубации отмечали чашку с концентрацией антибактериального препарата, вызывающей полное подавление роста микробов. Контроль чистоты роста культуры оценивали по посеву на чашку Петри с селективной кровяной средой без добавления антибиотиков.
Данный метод позволил подразделить штаммы H. pylori на чувствительные и устойчивые [9]. Критерии распределения штаммов по степени чувствительности приведены в табл. 1.
На каждого пациента, гастробиоптат которого использовался в исследовании, заполнялась индивидуальная регистрационная карта (ИРК), которая дублировалась в базе данных Microsoft Access Database и содержала демографические, анамнестические данные, результаты проведенных исследований.
Статистический анализ
Статистический анализ выполнялся с помощью программного пакета IBM® SPSS® Statistics, версия 21.0.
Демографические и анамнестические показатели анализировались с помощью методов описательной статистики. Для дихотомических показателей резистентности были представлены 95% доверительные интервалы для долей резистентности к тому или иному антибиотику. Подобный статистический анализ проводился в отношении выявления наличия H. pylori и выявления резистентности к антибиотикам.
Результаты исследования
В исследовании использовались гастробиоптаты 109 пациентов в возрасте от 18 до 64 лет. Возраст, пол и диагноз пациентов представлены в табл. 2.
У пациентов были диагностированы различные заболевания, ассоциированные с H. pylori. Наиболее частой нозологией являлся хронический гастрит — 78,9% (n = 86). Язвенная болезнь двенадцатиперстной кишки (ДПК) диагностирована у 20,2% (n = 22), а язвенная болезнь желудка — у 0,9% (n = 1).
Инфицирование H. pylori было подтверждено у всех пациентов уреазным тестом. Бактериологическим методом микроорганизм выделен лишь у 56 пациентов, что составило 51,4% (95% ДИ: 42,0%, 60,8%). Такой процент отражает технические трудности, связанные с транспортировкой и культивированием микроаэрофильного микроорганизма.
Чувствительность H. pylori к антимикробным препаратам удалось определить у 48 выделенных штаммов. Из-за скудного роста культуры в 8 случаях оценить антибиотикограмму было невозможно.
Таким образом, в анализ резистентности были включены 48 штаммов хеликобактера, выделенных от 48 пациентов. Среди анализируемых изолятов H. pylori штаммов, 17 (42,5%) были резистентны к метронидазолу, 13 (27,1%) — к левофлоксацину, 12 (25%) — к кларитромицину. Кроме того, было выявлено 3 (6,3%) штамма, устойчивых к амоксициллину. Все тестируемые штаммы были чувствительны к тетрациклину. В случаях выявления резистентности к трем и более группам антимикробных препаратов, штамм хеликобактера относили к полирезистентным. В ходе исследования 5 (11,1%) микроорганизмов были полирезистентными (табл. 3).
Двойная резистентность к кларитромицину и метронидазолу обнаружена у 2 (4,4%) изолятов, метронидазолу и левофлоксацину — у 4 (8,3%) микроорганизмов. Все штаммы, резистентные к амоксициллину, были устойчивы к кларитромицину.
Частота встречаемости резистентных штаммов отличалась среди мужчин и женщин, однако данный факт сложно интерпретировать из-за малой выборки (табл. 4).
При анализе частоты резистентности к кларитромицину выявлены различия по нозологиям. Так, у 14 пациентов, страдающих язвенной болезнью, было 5 (35,7%) случаев выделения штаммов H. pylori, резистентных к кларитромицину. В то же время у 34 больных, у которых был диагностирован только хронический гастрит, частота выделения резистентных штаммов к кларитромицину была ниже — 7 (20,6%). Однако этот факт сложно интерпретировать из-за ограниченного числа наблюдений.
Согласно Маастрихтским рекомендациям IV пересмотра, уровень резистентности H. pylori к кларитромицину в популяции является определяющим фактором при выборе схемы эрадикации [10]. Подобно другим патогенам, хеликобактер имеет региональные особенности резистентности. Резистентность напрямую коррелирует с частотой назначения антимикробных препаратов и утвержденными протоколами выбора антибиотиков [11]. Невозможно экстраполировать данные о резистентности, выявленные в одной стране, на другую, в силу значительных региональных различий чувствительности микроорганизмов. Так, резистентность к кларитромицину в Нидерландах составляет всего 5,6%, тогда как резистентность H. pylori к данному антибиотику в Австрии достигает 35,4% [11]. Уровень устойчивости к метронидазолу в Пекине составил 63,9%, а на Юго-Восточном побережье Китая — 95,4% [16, 17]. Для анализа антибиотикорезистентности H. pylori в мире нами были отобраны наиболее масштабные исследования, проводимые с 2000 по 2013 год. Проанализировано 13 исследований, из которых 3 европейских, 5 азиатских, 2 африканских и 3 американских. Более подробно уровень резистентности к антибиотикам H. pylori в различных странах приведен в табл. 5.
При анализе результатов исследований по антибиотикорезистентности H. pylori на территории России обращает на себя внимание рост уровня резистентности H. pylori к кларитромицину. Так, в 1996 г. в г. Москве не было выявлено резистентных штаммов к кларитромицину. Уже в 1999 г. уровень резистентности H. pylori к кларитромицину составил 17,1%, в 2000 г. 16,6%, в 2001 г. 13,8%, а в 2005 г. уже 19,3% [24, 25]. При интерпретации показателей резистентности важно учитывать методику определения чувствительности. Так, при использовании только генотипического метода полимеразной цепной реакции (ПЦР) возможны сложности в интерпретации результатов. Примером могут служить данные, полученные в Санкт-Петербурге — 39–40% резистентных штаммов по данным ПЦР [26, 27]. В то же время резистентность к кларитромицину при оценке дискодиффузионным методом, который тоже имеет определенные ограничения, составила всего 7,7% [28].
Наибольшую информативность представляют данные о резистентности, полученные методом серийных разведений. На основании тестирования 133 штаммов методом серийных разведений сделан вывод о низкой резистентности в Смоленске в 2010 г. [29]. В нашем исследовании, при использовании сходной технологии тестирования, резистентность составила 25%, что еще раз иллюстрирует межрегиональные различия чувствительности микроорганизмов.
Фенотипический метод определения чувствительности к антибиотикам рекомендован Институтом по клиническим и лабораторным стандартам (CLSI), EUCAST, а также Маастрихтским соглашением IV пересмотра в качестве основного метода определения чувствительности H. pylori к кларитромицину [38]. Культуральный метод является высокоспецифичным тестом, однако характеризуется низкой чувствительностью [39]. Определение чувствительности H. pylori к антибиотикам в нашей стране сопряжено с рядом трудностей. Успех бактериологического выделения H. pylori во многом связан с правильностью отбора биопсийных образцов и соблюдением условий транспортировки материала в лабораторию. Хеликобактер является труднокультивируемым микроорганизмом, что требует не только навыков работы с его чистой культурой, но и четкого соблюдения методики разведения рабочих концентраций исследуемых антибактериальных препаратов. Учитывая объективные сложности, описанные выше, становится понятным отсутствие широко представленных данных об истинном состоянии антибиотикорезистентности в различных регионах нашей страны. Большинство исследователей в своих суждениях об антибиотикорезистентности H. pylori опираются на метод ПЦР как единственную доступную альтернативу бактериологическому методу, который позволяет определить генетические мутации H. pylori и прогнозировать фенотипическую резистентность [7].
Такая стратегия была использована нами для лечения пациентов, гастробиоптаты которых использовались в данном исследовании. Применение стандартной тройной терапии с двойной дозой ингибиторов протонного насоса, усиленной препаратом висмута трикалия дицитрата, привело к уничтожению H. pylori у 93,2% пациентов, несмотря на выявленную высокую резистентность к кларитромицину [44].
Выводы и рекомендации
На основании проведенного бактериологического исследования антибиотикорезистентности штаммов H. pylori можно сделать следующие выводы и рекомендации:
Полученные данные о резистентности H. pylori в Санкт-Петербурге делают актуальным использование всех возможностей для повышения эффективности стандартного подхода: двойные дозы ингибиторов протонного насоса, увеличение длительности с 7 до 10–14 дней, добавление препаратов висмута и пробиотиков, поиск новых стратегий эрадикации.
Литература
За остальным списком литературы ? обращайтесь в редакцию.
В. И. Симаненков* , 1 , доктор медицинских наук, профессор
Н. В. Захарова*, доктор медицинских наук, профессор
А. Б. Жебрун**, доктор медицинских наук, профессор, член-корреспондент РАН
А. В. Сварваль**, кандидат медицинских наук
И. В. Савилова*
Р. С. Ферман**
* ГБОУ ВПО СЗГМУ им. И. И. Мечникова, Санкт-Петербург
** НИИ ЭиМ им. Пастера, Санкт-Петербург
Наличие симптомов инфекционно-воспалительных заболеваний; Подбор антибактериальной терапии; Оценка эффективности антибактериальной терапии.
Наименование метода
Тип биоматериала/Тип пробирки/Цвет крышки
Преаналитические требования
Подготовка к исследованию:
Биоптаты (3 точки), полученный при эндоскопическом исследовании, помещают в стерильную пробирку (контейнер) с физиологическим раствором В случае если предполагаемое время от взятия материала до доставки в микробиологическую лабораторию не превышает 6 ч, используется стерильная плотно закрывающаяся пробирка с 5-15 мл физиологического раствора. Если доставка образцов будет осуществляться в течение 6–48 ч, в качестве транспортной среды используется Рortagerm pylori (BioMeriеux, Франция).
Условия хранения и транспортировки:
Хранение и транспортировка образцов осуществляется при температуре +4°С в защищенном от света месте.
Стабильность аналитов
Клиническая информация о тесте
Более чем половина людей инфицирована H.pylori. чаще всего инфекция протекает бессимптомно или неспецифическим дискомфортом верхней части живота. Только для 10% инфицированных приходятся осложнения (гастродуоденальная язвенная болезнь, атрофия слизистой оболочки желудка, желудочно-кишечные злокачественные новообразования). Почти у всех пациентов с язвенной болезнью двенадцатиперстной кишки обнаруживается инфекция H.pylori. Бактериологическое исследование заключается в посеве исследуемого материала на питательные среды с целью выявления и идентификации чистой культуры возбудителя и его чувствительности к расширенному спектру антибиотиков.
Интерпретация результатов
Интерпретация проводится врачом с учетом клинических проявлений. Положительный результат: - выделение представителей патогенной флоры свидетельствует об этиологическом факторе выделенного возбудителя в клинической картине. При положительном результате осуществляется постановка чувствительности к антибактериальным препаратам. R-возбудитель резистентен (устойчив) к антибактериальному препарату, S-возбудитель чувствителен к антибактериальному препарату, I- возбудитель умеренно устойчив к антибактериальному препарату. Выявление условно-патогенной флоры и ее значимость в развитии заболевания зависит от количества выделенного возбудителя для данной локализации. Отрицательный результат: - отсутствие патогенной флоры - норма; - присутствие условно- патогенной флоры в количестве, не превышающем диагностического значения - норма для данной локализации.
Для диагностики хеликобактерной инфекции. Для определения показаний к назначению антихеликобактерной терапии и оценки ее эффективности.
Наименование метода
Тип биоматериала/Тип пробирки/Цвет крышки
Преаналитические требования
Подготовка к исследованию:
До сбора кала предварительно помочиться в унитаз. Далее путем естественной дефекации подкладное судно собирают испражнения. Затем кал берется ложечкой в стерильный контейнер с завинчивающейся крышкой в количестве 1–3 г (1 ложка). Материал брать из участков, где обнаруживается слизь и/или кровь. Завинтить емкость крышкой и доставить кал медсестре. Написать на этикетке емкости данные пациента: Ф.И.О., дату и время сбора материала. Исследование проводится 2–3-кратно с интервалом не менее 14 дней/ Сбор материла стерильным ректальным зондом-тампоном транспортной системы Кери-Блер: вводят кончик стерильного зонда-тампона на 2,5—3,0 см за анальный сфинктер. Осторожно вращая тампон вокруг оси, собирают материал с крипт ануса и так же осторожно извлекают тампон. Примечание: следует иметь в виду, что ректальные мазки для получения необходимой информации – материал существенно худший по сравнению с пробой фекалий, даже в случае наличия трудности сбора материала у маленьких детей и стариков.
Условия хранения и транспортировки:
При Т= +18°С. +20°С – 1-2 часа (комнатная температура) При Т= +4°С. +8°С – 4 часа (холодильник)
Примечание:
материал для исследования берут до начала антибактериальной терапии или в интервалах между курсами лечения, но не менее двух недель после ее окончания.
Стабильность аналитов
в транспортной системе Эймса: при температуре +2°С. +8°С - стабилен 72 часа, при температуре +20°С. +25°С - стабилен 24 часа, замораживать запрещено; в контейнере: при температуре +2°С. +8°С - стабилен 8 часов, при температуре +20°С. +25°С - стабилен 2 часа, замораживать запрещено
Клиническая информация о тесте
Helicobacter pylori антиген – один из показателей инфицирования бактерией Helicobacter pylori, способствующей образованию пептических (вызванных действием пищеварительных соков) язв в желудке или двенадцатиперстной кишке. Определение антигена бактерии в кале является высокочувствительным и специфичным методом диагностики хеликобактериоза.
Интерпретация результатов
Положительный результат Инфицирование Helicobacter pylori (соответственно, высокий риск развития язвенной болезни, гастрита, дуоденита или уже имеющееся заболевание, повышенный риск развития рака желудка). Отрицательный результат Инфицирования Helicobacter pylori нет.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Хеликобактериоз: причины появления, симптомы, диагностика и способы лечения.
Определение
Хеликобактериоз – инфекционное заболевание, поражающее пилорический отдел желудка, или привратник, и двенадцатиперстную кишку. Его возбудителем является уникальная патогенная микроаэрофильная грамотрицательная бактерия хеликобактер пилори (H. pylori). Свое название бактерия получила за счет отдела желудка, в котором она обитает – пилорического.
В результате микроорганизм еще сильнее колонизирует слизистую оболочку, формирует ее повышенную восприимчивость к соляной кислоте и провоцирует воспаление, приводящее к развитию язвенных дефектов.
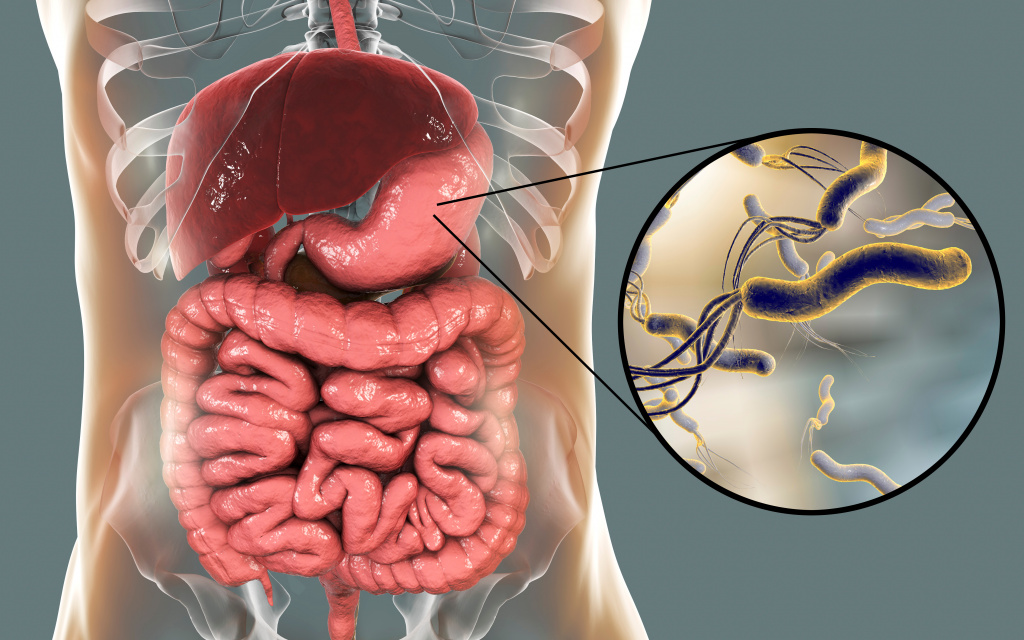
Хеликобактер пилори – спиралевидная бактерия длиной 3,5 и шириной 0,5 микрон. Она имеет жгутики, с помощью которых свободно перемещается по стенке желудка либо надежно на ней закрепляется. Бактерия H. pylori очень изменчива, ее штаммы (разновидности) отличаются друг от друга способностью прикрепляться к слизистой оболочке желудка, вызывать воспалительный процесс и обладают разной степенью патогенности.

Хеликобактер пилори, колонизирующая слизистую оболочку желудка, — частая причина ее воспалительных изменений, она признана этиологическим фактором гастрита, а сам гастрит — инфекционным заболеванием. В зависимости от состояния защитных факторов желудка возникший инфекционный процесс может протекать латентно или с выраженной клинической симптоматикой воспаления. Согласно современным представлениям, H. pylori вызывает хронический гастрит у всех зараженных лиц. Это может привести к язвенной болезни, атрофическому гастриту, аденокарциноме желудка или низкодифференцируемой лимфоме желудка. H. pylori относится к канцерогенам первого порядка.
Результаты многочисленных исследований дают основание предполагать возможную патогенетическую или опосредованную роль инфекции H. pylori в развитии и/или течении заболеваний, не относящихся к пищеварению: кардио-, цереброваскулярных, аутоиммунных заболеваний, заболеваний крови, кожи, нервной системы и многих других.
Патоген отличается относительной устойчивостью к окружающей среде: при кипячении хеликобактерии гибнут практически мгновенно, при обработке дезинфицирующими составами — в течение нескольких минут.
Причины появления хеликобактериоза
Заразиться бактерией можно при контакте с загрязненной водой или продуктами питания. Инфицирование возможно во время проведения эндоскопии и при использовании других плохо стерилизованных медицинских инструментов, которые имели прямой контакт со слизистой желудка пациента.
Бытовой способ передачи (например, через поцелуи, личные вещи и проч.) также возможен, о чем свидетельствует выделение бактерии из слюны и зубного налета.
Распространенность инфекции варьируется в зависимости от географического региона, возраста пациента, его этнической принадлежности и социально-экономического статуса. По данным Департамента здравоохранения г. Москвы (2019), распространенность этой инфекции в Москве составляет 60,7–88%, в Санкт-Петербурге - 63,6%, в Восточной Сибири достигает 90%.
Классификация заболеваний
Заболевания, связанные с H. pylori:
- гастрит,
- дуоденит,
- гастродуоденит,
- эзофагит,
- язвенная болезнь желудка,
- язвенная болезнь двенадцатиперстной кишки,
- железодефицитная анемия неясного генеза,
- рак желудка,
- рак двенадцатиперстной кишки.
Основной жалобой, с которой больные с признаками Helicobacter-инфекции обращаются к врачу, являются желудочные боли. Локализация симптома может меняться и переходить в область расположения двенадцатиперстной кишки.
Боли бывают острыми, ноющими, тупыми, возникают в верхних отделах живота слева и по центру в околопупочной области. Дискомфорт может возникать при длительном голодании, натощак или через определенное время после приема пищи.
Симптоматика хеликобактериоза зависит от клинической формы заболевания и может включать:
- чувство тяжести в животе после еды;
- нарушение аппетита, связанное с внезапными приступами тошноты (если слизистая желудка сильно травмирована);
- беспричинная рвота на фоне нормальной температуры тела;
- изжога (жгучие ощущения в пищеводе и даже гортани) и отрыжка с неприятным кислым или горьким привкусом;
- хронические запоры (отсутствие дефекации в течение трех суток и более);
- разжижение каловых масс, появление пенистой или водянистой консистенции;
- кишечные спазмы и вздутие живота.
- снижение аппетита до полного его отсутствия;
- тошнота может сменяться рвотой со сгустками крови;
- резкое снижение массы тела, не являющееся нормой;
- сухость во рту и привкус металла;
- появление белого налета на языке;
- неприятный запах изо рта при отсутствии кариеса;
- заеды в уголках рта;
- кровоточивость десен.
Диагностика хеликобактериоза
Долгое время хеликобактериоз может никак себя не проявлять, при этом провоцируя развитие язвы, аденокарциномы или мальтомы желудка. В особой зоне риска люди, чьи родственники имеют эти заболевания в анамнезе.
Диагностика может быть инвазивной (эндоскопия с последующей биопсией желудочных тканей) и неинвазивной (лабораторные исследования).
Согласно международным рекомендациям, методами выбора для диагностики бактерии и оценки эффективности лечения H. pylori служат дыхательный̆ тест с мочевиной, меченной 13С и определение специфических антигенов H. pylori в кале иммунохроматографическим методом.
Синонимы: Дыхательный тест с 13С-меченной мочевиной. 13 UBT; 13C-UBT. Краткая характеристика 13С-уреазного дыхательного теста Дыхательный тест в текущей модификации предназначен для лиц старше 12 лет. 13С-уреазный дыхательный тест относится к неинвазивным безопасным методам исследования.
Читайте также:

