Что такое раковые кори
Обновлено: 13.05.2024
Предлагаем Вашему вниманию краткий, но очень подробный обзор перитонеального канцероматоза.
Филиалы и отделения, где лечат перитонеальный канцероматоз
Национальный центр лечения больных канцероматозом
Руководитель Центра к.м.н. Владимир Михайлович Хомяков – 8 495 150 11 22
Введение
Перитонеальный канцероматоз (опухоль брюшины) - одно из самых грозных вариантов прогрессирования целого ряда онкологических заболеваний. Канцероматоз является формой метастазирования, при которой опухолевые клетки распространяются по внутренней выстилке анатомической полости (брюшной или плевральной) и формируют на ней мелкие узелки, так называемые диссеминаты. Ее возникновение в большинстве случаев подразумевает IV стадию заболевания, и сопряжено с неблагоприятным прогнозом для пациента. Лечение пациентов с перитонеальным канцероматозом является одной из самых сложных задач в онкологии. Наиболее часто он развивается при злокачественных новообразованиях желудочно-кишечного тракта, дыхательной системы и женских репродуктивных органов. При каких опухолях может развиваться перитонеальный канцероматоз? При раке желудка, раке легкого, раке толстой и тонкой кишки, раке яичников, муцинозных опухолях червеобразного отростка. мезотелиоме брюшины или плевры, раке поджелудочной железы, саркоме брюшной полости (саркоматоз).
Согласно данным статистики, перитонеальный канцероматоз встречается у 20-35% пациентов с онкопатологией: в 40% случаев данное осложнение формируется при опухолях желудочно-кишечного тракта, в 30% - при раке яичников (причем на момент верификации диагноза рака яичников у подавляющего большинства пациенток уже имеет место поражение брюшины). Перитонеальный канцероматоз (опухоль брюшины) является неблагоприятным прогностическим фактором; данная форма прогрессирующего опухолевого поражения практически не поддается хирургическому лечению, а применение только системной химиотерапии улучшает состояние лишь на некоторое время.
Причины возникновения перитонеального канцероматоза
Перитонеальный канцероматоз является вторичным опухолевым поражением, результатом прогрессирования рака различной локализации. Наиболее часто поражение брюшины осложняется раком желудка, тонкого кишечника, поджелудочной железы, злокачественными опухолями яичников, матки, маточных труб, печеночноклеточным раком, реже - первичными опухолями брюшины (перитонеальная мезотелиома). В ряде случаев первичный очаг остается неустановленным.
Развитие перитонеального канцероматоза является поэтапным процессом. Первый этап – распространение опухолевых клеток из первичного очага поражения. Это связано с нарушением межклеточного взаимодействия и приобретением клетками опухоли подвижности. При этом эпителиальные клетки меняют фенотип на мезенхимальный, происходит деградация межклеточного матрикса. Распространение опухолевых клеток может происходить в ходе оперативного вмешательства. Их механическое отделение возможно при повреждении лимфатических или кровеносных сосудов. Попавшие в брюшную полость клетки опухоли мигрируют под действием силы тяжести, сокращений внутренних органов, имплантируются в местах повышенной резорбции: большом сальнике, в области слепой кишки, дугласовых карманах.
На втором этапе опухолевые клетки взаимодействуют с мезотелием брюшины. Механизмы адгезии определяются природой клеток, особенностями морфологии брюшины, а также наличием участков ее повреждения. Далее клетки закрепляются в мезотелии, происходит их горизонтальное распространение по поверхности перитонеума, а затем инвазивный рост – прорастание в базальную мембрану, соединительную ткань. Следующим этапом является стимуляция неоангиогенеза – обязательного фактора развития опухоли. Морфопатогенетические механизмы формирования канцероматоза брюшины еще недостаточно изучены, в связи с чем отсутствуют радикальные методы лечения.
Частота развития канцероматоза брюшины зависит не только от первичной локализации опухоли, но и от ее размеров, глубины инвазии, гистотипа, степени дифференцировки (недифференцированный рак желудка осложняется поражением брюшины в 60% случаев, ограниченный – в 15%).
Классификация перитонельного канцероматоза
Единая классификация данного заболевания отсутствует, поскольку характеристики первичных опухолей, приводящих к поражению брюшины, весьма разнообразны. Наиболее распространена классификация перитонеального канцероматоза брюшины в зависимости от числа, локализации метастазов, которая предусматривает три степени:
Р1 – локальное поражение брюшины
Р2 – несколько областей канцероматоза, разделенных здоровыми участками брюшины
Р3 – многочисленные очаги поражения
Также используется метод определения индекса канцероматоза брюшины: суммируются баллы измерения максимальных очагов поражения (0-3 балла) в каждой из 13 наиболее вероятных областей поражения брюшины.
Симптомы перитонеального канцероматоза
Перитонеальный канцероматоз брюшины является вторичным поражением, поэтому его клиническая картина во многом определяется проявлениями первичной опухоли. Характерным признаком является обильный выпот в брюшную полость – формирование асцита. Зачастую асцитический синдром, развивающийся вследствие обструкции лимфатического дренажа, является единственным признаком заболевания, и пациенты могут поступать в отделение гастроэнтерологии или терапии для диагностики причин асцита. Состояние больных тяжелое, характерна значительная потеря веса. Неспецифическими признаками являются тошнота, рвота, выраженная слабость, утомляемость. При наличии крупных метастазов возможно их прощупывание через брюшную стенку.
Диагностика перитонеального канцероматоза
Перитонельный канцероматоз имеет неспецифическую клиническую картину, однако консультация гастроэнтеролога или онколога позволяет предположить данное заболевание на основании симптомов и физикальных данных. Лабораторные анализы не выявляют специфических изменений: определяется лейкоцитоз, ускорение СОЭ. Диагностическая программа обязательно должна включать УЗИ органов брюшной полости и малого таза, позволяющее обнаружить распространенное поражение, а также МСКТ брюшной полости с контрастированием. Обязательно проводится цитологическое исследование асцитической жидкости, полученной при лапароцентезе, которое дает возможность впервые установить или подтвердить диагноз, а также определить гистогенез клеток опухоли.
Информативным методом диагностики перитонеального канцероматоза является лапароскопия с осмотром перитонеума, дугласова пространства, диафрагмы, сопровождающаяся биопсией. Высокой специфичностью обладает обратнотранскриптазная полимеразная цепная реакция (ОТ-ПЦР), которая позволяет определить источник диссеминации даже при малом количестве опухолевых клеток.
Сложности диагностики возникают при наличии перитонеального канцероматоза без выявленного первичного очага. Данная форма заболевания, встречающаяся в 3-5 % случаев, проявляется клинически только при уже сформировавшемся поражении брюшины. При этом первичный очаг может иметь настолько малые размеры, что его прижизненное обнаружение невозможно.
В качестве дополнительных методов может использоваться определение онкомаркеров (кислой фосфатазы, раково-эмбрионального антигена, альфа-фетопротеина, бета-субъединицы ХГЧ). Такая диагностика не обладает высокой специфичностью, но применяется для оценки прогноза, раннего выявления диссеминации, рецидивов, а также для контроля эффективности лечения.
Лечение перитонеального канцероматоза
Хирургическое лечение канцероматоза включает удаление первичной опухоли с регионарными метастазами и отсевами по брюшине. Циторедуктивная операция выполняется в объеме перитонэктомии, может сочетаться с удалением матки и придатков, сигмовидной кишки, желчного пузыря. После проведения операции оценивается индекс полноты циторедукции: СС-0: после проведения хирургического лечения очаги поражения визуально не определяются; СС-1: имеются неудаленные очаги диаметром до 2,5 мм; СС-2: очаги диаметром 2,5 мм – 2,5 см; СС-3: очаги поражения более 2,5 см в диаметре. Однако даже при определении индекса СС-0 нельзя полностью исключить возможность диссеминации, поэтому обязательно проводится химиотерапия.
Эффективные подходы к лечению, как правило, подразумевают проведение комбинированной терапии, например, сочетания хирургического вмешательства и системной химиотерапии. Одним из наиболее эффективных методов является локальная химиотерапия. Идея локальной химиотерапии состоит в том, чтобы обеспечить доставку лекарственного препарата непосредственно к опухолевым клеткам, находящимся на внутренней выстилке анатомической полости. Из-за крайне низкой проницаемости этой области для лекарственных препаратов, например, при внутривенном их введении или приеме в виде таблеток, доставка препаратов в виде аэрозоля под давлением углекислого газа даёт накопление препарата в опухоли в значительно больших концентрациях.
Методы лечения перитонеального канцероматоза
Длительное время канцероматоз брюшины и плевры считали терминальной стадией болезни, не подлежащей специальному лечению. Разработка методик непосредственного воздействия на брюшину и плевру позволила улучшить прогноз при этом состоянии. МНИОИ им. П.А. Герцена обладает уникальными возможностями лечения больных с канцероматозом, имея в арсенале весь комплекс новейших методов терапии.
Гипертермическая интраоперационная внутрибрюшная (внутриплевральная) химиотерапия (HITEC).
Это методика, при которой во время операции в брюшную или плевральную полость вводится подогретый до 42,5С, высококонцентрированный раствор химиотерапевтических препаратов, что обеспечивает их воздействие непосредственно на раковые клетки в брюшной (плевральной) полости при минимальном воздействии на другие органы. Сеанс проводится в течение часа, что позволяет разрушить опухолевые клетки, оставшиеся после так называемой циторедуктивной операции.
Внутрибрюшная (внутриплевральная) аэрозольная химиотерапия под давлением (PIРAC)
Это новейший инновационный метод лечения перитонеального канцероматоза, который обеспечивает доставку лекарственного препарата непосредственно к опухолевым клеткам, находящимся на внутренней выстилке анатомической полости. Метод совсем недавно появился в России. Процедуру проводят посредством лапароскопии (торакоскопии). В брюшной или плевральной полости под давлением углекислого газа распыляют аэрозоль химиопрепаратов и оставляют в течение 30 мин. При таком способе введения химиопрепаратов их воздействие на опухоль многократно возрастает при полном отсутствии системной токсичности. Ноу-хау МНИОИ имени П.А. Герцена в этом методе лечения стала разработка собственной специальной форсунки, которая формирует поток мелкодисперсного аэрозоля с размером капель от 1 до 40 мкм. Изделие выполнено из специализированных материалов и не уступает по качеству импортному аналогу, а по ряду технических характеристик его превосходит.
Что такое корь? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, инфекциониста со стажем в 14 лет.
Над статьей доктора Александрова Павла Андреевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Корь (Measles) — острое инфекционное заболевание, вызываемое вирусом кори, который поражает эпителий верхних дыхательных путей и кожные покровы. Клинически характеризуется выраженным синдромом общей инфекционной интоксикации, патогномоничной энантемой, макуло-папулёзной сыпью, конъюнктивитом и синдромом поражения респираторного тракта (дыхательных путей).
Этиология
вид — возбудитель кори (Polinosa morbillarum)
Синдромально заболевание было описано в 1890 году доктором Бельским (Псков), в 1895 году детским доктором Филатовым и в 1898 году доктором Копликом (США).
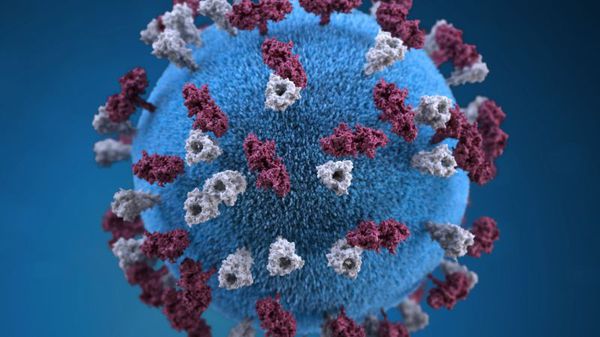
Оболочка вируса имеет 3 слоя: белковую мембрану, липидный слой и наружные гликопротеидные комплексы, образующие своеобразные выступы. Штаммы вирусов идентичны в антигенном отношении, обладают комплементсвязывающими, гемагглютинирующими, гемолизирующими свойствами и симпластообразующей активностью. СД-46 является рецептором у человека к вирусу кори.
Вирус неустойчив во внешней среде – чувствителен к ультрафиолету, в каплях слюны погибает за 30 минут, при высыхании и действии дезинфицирующих средств — мгновенно. Хорошо переносит пониженные температуры. Вирус можно выделить из различных сред организма (кровь, моча, кал, смывы со слизистых ротоглотки, конъюнктив, цереброспинальной жидкости). [2] [5]
Эпидемиология
Антропоноз. Источник заболевания – исключительно заражённый человек, также с атипичной формой заболевания кори. Инфицированный заразен с последних 2-х дней инкубации и до 4-го дня с момента появления высыпаний включительно — с 5 дня заразность пропадает.
Передача заболевания
Механизм передачи: воздушно-капельный (путь аэрозольный), редко трансплацентарный (при заболевании женщины в конце беременности). Теоретически возможно заражение от недавно привитых (но на практике такое случается чрезвычайно редко).
Существует весенне-зимняя сезонность. После перенесённой инфекции, полного курса вакцинации развивается стойкий пожизненный иммунитет.
Корь — одна из основных причин смерти среди детей раннего возраста.
В 2015 году в глобальных масштабах произошло 134 200 случаев смерти от кори. [1] [3]
Кто подвергается риску
Заразиться корью может любой человек, не имеющий иммунитета — тот, кто не был вакцинирован или тот, у кого не выработался иммунитет после вакцинации.
Самому высокому риску заболевания корью и развития осложнений, включая смертельный исход, подвергаются невакцинированные дети раннего возраста. Корь — одна из основных причин смерти среди них.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы кори
Инкубационный период
Инкубационный период при типичной форме — от 9 до 11 суток (в некоторых случая до 13).
Симптомы кори у взрослых
Начало заболевания подострое (т.е. основной синдром появляется на 2-3 сутки от начала заболевания), однако при должной подготовке врача (выявлении патогномоничной энантемы — сыпи на слизистых оболочках) можно определить острое начало (в течении первых суток). Во взрослом возрасте из-за особенностей иммунной системы эти критерии могут не соблюдаться.
- синдром выраженной общей инфекционной интоксикации;
- синдром патогномоничной энантемы (пятна Бельского-Филатова-Коплика);
- синдром макуло-папулёзной экзантемы;
- синдром конъюнктивита (выраженный);
- синдром поражения респираторного тракта (фарингит, трахеобронхит);
- синдром генерализованной лимфаденопатии (ГЛАП);
- гепатолиенальный синдром.
Описана так называемая ранняя диагностика кори, включающая:
- затруднение носового дыхания;
- покраснение правого века;
- субфебрилитет (лихорадка постоянного типа).
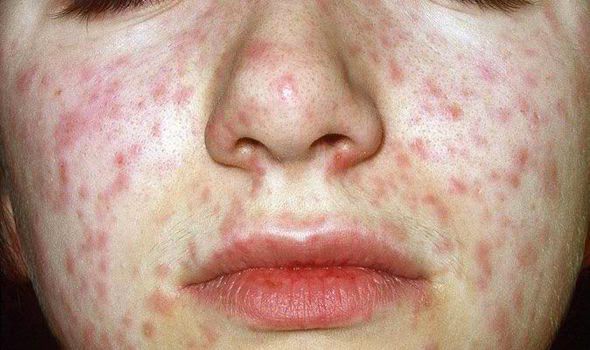
Объективно: можно отметить возникновение макуло-папулёзной сыпи, появляющейся в типичных случаях на 3-4 день болезни, с выраженной этапностью (лицо, шея; после туловище, руки, бёдра; затем олени и стопы, а на лице в этот момент бледнеет). Высыпания представляют собой папулы, окруженные красным пятном, предрасположенные к слиянию (но при наличии чистых участков), иногда появляются петехии. Спустя 3-4 дня сыпь становятся бледной и оставляет после себя бурые пятна и отрубевидное шелушение. Увеличиваются и приобретают чувствительность периферические лимфоузлы (затылочные, заднешейные и подмышечные). Ярко выражен конъюнктивит (конъюнктивы масштабно гиперемированы, отёчны, быстро присоединяется гнойное отделяемое). Характерным является вид больного: одутловатое лицо, красные (как у кролика) глаза, отёчность носа и век, сухие потрескавшиеся губы. При аускультации в лёгких прослушиваются сухие хрипы. Выражена тахикардия, снижение артериального давления. Увеличиваются размеры печени и селезёнки (генерализация инфекции).
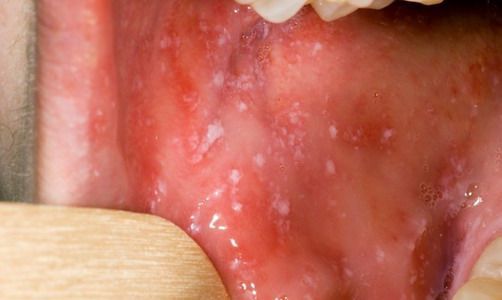
При фарингоскопии в ротоглотке визуализируется гиперемия мягкого нёба, на слизистой поверхности щёк в начале заболевания пятна Бельского — Филатова — Коплика (мелкие белесоватые пятнышки с узкой красноватой каёмкой), которые пропадают при появлении экзантемы. Иногда появляется пятнистая энантема на слизистой мягкого нёба.
Описана митигированная корь (у людей, получивших специфический противокоревой иммуноглобулин в период инкубации), характеризующаяся удлинением инкубационного периода до 21 дня, лёгким течением.
При абортивной форме заболевания характерно типичное начало, но спустя 1-2 суток клинические проявления исчезают.
Существует понятие — реакция на прививку (при первичном введении живой противокоревой вакцины), характеризующееся повышением температуры тела, катаральными явлениями (воспалениями) со стороны верхних дыхательных путей, скудной малозаметной сыпью (чаще развивается у детей и лиц с иммунодефицитом).
У больных с наличием тяжелого иммунодефицита – СПИДа (ВИЧ, онкологические больные, лица, получающие системные цитостатики после трансплантации органов) — течение заболевания крайне тяжёлое (летальность до 80%). [4] [5]
Какие виды колоректального рака бывают?
Колоректальный рак (КРР) включает в себя несколько видов. Первый и самый распространенный — это рак ободочной кишки (аденокарцинома толстой кишки). Вторым по частоте является рак прямой кишки (аденокарцинома прямой кишки). И третий вид — это рак анального канала, как правило он плоскоклеточный. Значительно реже встречаются другие злокачественные опухоли прямой ободочной кишки: гастроинтестинальная стромальная опухоль, нейроэндокринный рак или карциноид — более доброкачественный вариант нейроэндокринной опухоли. И совсем редко встречаются меланомы прямой кишки и анального канала.
На каком месте по заболеваемости находится колоректальный рак?
Если брать все виды рака, которые относят к КРР, то на третьем месте в мире. Но в развитых странах процент пациентов с КРР немного больше. Скорее всего, это связано с увеличенной продолжительностью жизни и особенностями питания.
Считается, что если в популяции употребляют больше мясных продуктов и меньше растительной пищи, то вероятность возникновения колоректального рака увеличивается.

Какие виды КРР более распространены среди женщин, а какие среди мужчин?
Достоверно известно, что любым видом КРР чаще болеют женщины. Это принято связывать с тем, что женщины живут дольше, а колоректальный рак, как и большинство других видов рака, — это болезнь пожилых людей. Раньше считалось, что рак анального канала тоже чаще встречается у женщин. В 1975 году в США на 100 тыс человек им болело меньше 1% женщин и около 0,7% мужчин. А к 2007 году этот уровень увеличился в 1,7 и 3 раза соответственно. Достоверно установлена причина этого вида рака — он вызывается вирусом папилломы человека (ВПЧ) и передается между партнерами, практикующими анальный секс. Поэтому сейчас много мужчин нетрадиционной сексуальной ориентации страдают от рака анального канала, но, конечно, в зону риска входят и женщины. Если проводить массовую вакцинацию от онкогенных штаммов ВПЧ, то сложившуюся ситуацию можно было бы улучшить. Причем это работает не только при вышеуказанном заболевании, но и для других видов плоскоклеточного рака: рака шейки матки и некоторых видов опухолей головы и шеи.
Как можно понять, что у тебя повышенный риск развития колоректального рака? С какого возраста следует начинать профилактические обследования?
В США, где скрининг развит наиболее сильно, принято выделять группы среднего, повышенного и высокого риска.
Группа среднего риска — это большинство из нас: здоровые люди, у которых нет близких родственников, которые бы болели КРР, раком желудка, раком тела матки или раком молочной железы. У них отсутствуют наследственные синдромы и хронические воспалительные заболевания кишечника, а именно неспецифический язвенный колит или синдром раздраженной кишки. В этой группе скрининговые обследования нужно проводить с 55 лет.
Группа повышенного риска — это пациенты, у которых кровные родственники (родители или бабушки\дедушки) болели указанными выше видами рака. У таких людей повышен риск возникновения злокачественного новообразования, в том числе и КРР. Представителям этой группы следует начинать обследования раньше, в США советуют это делать с 45 лет.
И, наконец, есть группа высокого риска. В нее входят пациенты с доказанными наследственными синдромами: диффузным семейным полипозом, синдромом Пейтца–Егерса или синдромом Линча. Для таких людей характерно раннее возникновение полипов в кишечнике и затем развитие из них злокачественной опухоли. Также сюда относят пациентов, более 10 лет страдающих неспецифическим язвенным колитом или болезнью Крона. Этой группе нужно начинать скрининговую программу намного раньше. Например, наличие родственников с диффузным семейным полипозом сдвигает эту границу аж к 20 годам. А при синдроме Линча у пациента в 100% случаев разовьется колоректальный рак, если он до него доживет. Если у таких людей находят опухоль кишечника, то удаляют всю толстую и прямую кишку, понимая, что рано или поздно у них разовьется рак и в оставшейся части.
Первая стадия скрининга для всех групп риска — это иммунохимический анализ кала на скрытую кровь. Тест бывает количественный и качественный, но лучше выбирать количественный, он точнее. Если тест показывает наличие крови в кале, то тогда следует выполнить фиброколоноскопию, чтобы посмотреть все толстую и прямую кишку.
Какие программы скрининга действуют сейчас в России?
В России, к сожалению, вообще нет скрининговых программ, если мы говорим о популяционном скрининге. У нас есть только некоторые элементы. Например, в Санкт-Петербурге несколько лет назад проводилась программа по скринингу рака молочной железы. Женщин обследовали, поводили маммографию, специально оснащали кабинеты маммологов и прочее. Но такие программы должны финансироваться отдельно, а у нас все пытаются включить в программу диспансеризации, не совсем понимая, что диспансеризация и онкологический скрининг — разные вещи.
Всего в мире известны три опухолевые локализации, в отношении которых популяционный скрининг доказано эффективен: КРР, рак молочной железы и рак шейки матки. Все остальные вопросы, связанные со скринингом, например, рака легкого или рака предстательной железы, пока только изучаются, очевидных доказательств эффективности сегодня нет. А внедрение скрининговой программы по КРР в США помогло снизить смертность примерно на 10%, это жизнь 13,5 тысяч человек ежегодно.
Но что очень важно для популяционного скрининга, так это хороший охват групп населения. Если он меньше 50%, то затраты на скрининг превышают пользу. В такие программы должны вовлекаться не только онкологи, эпидемиологи и другие врачи, но также СМИ, медиаперсоны да и общество в целом. Это большая комплексная работа, которой сейчас нет в России.
Какие профилактические действия помогут снизить риск КРР?
Безусловно, первое, что можно сделать — отказаться от курения. Также нужно стараться употреблять больше клетчатки и меньше переработанного красного мяса. Если есть проблемы с функционированием кишечника (синдром раздраженной кишки, нарушения стула) — это нужно обязательно лечить. И, наконец, нужно понимать, что если вам стукнуло пятьдесят лет, то необходимо на всякий случай сдать кал на скрытую кровь и сделать колоноскопию. Любые жалобы: изменение стула, наличие крови — должны быть поводом для посещения врача. Нельзя махать рукой на такие обстоятельства, думая, что у тебя просто геморрой. Нужно обратиться к специалисту, который назначит правильное обследование и лечение. Для любого грамотного проктолога наличие крови в стуле — это повод назначить фиброколоноскопию.

На какие моменты нужно обратить внимание, когда тебе назначают колоноскопию?
Как и при любой другой инвазивной манипуляции, чем чаще врач ее выполняет, тем больше у него в этом опыта. Достаточно банальная истина, но нужно обращаться в учреждение с хорошим потоком пациентов. Во-вторых, нужно идти туда, где процедуру вам сделают на качественном оборудовании. И, желательно, где вам обеспечат обезболивание.
К сожалению, у нас есть проблема с отсутствием контроля качества колоноскопии. Хотя вполне объективные критерии ее выполнения существуют. К этим проблемам на западе относятся очень серьезно. Гипотетически можно делать колоноскопию всем людям, например, в городе Санкт-Петербурге. Потратить на это огромные деньги. Но если сделать ее всем и некачественно, то ценность такой процедуры теряется. Если врач пропустит 15% полипов у 15% больных, то ценность этого скрининга будет нулевая. Именно поэтому за рубежом есть четкие объективные критерии оценки качества выполненной процедуры. А у нас их пока нет.
А каковы эти критерии качества?
Самое понятное для неспециалистов — колоноскопия не должна продолжаться меньше 15 минут. Если доктор говорит, что очень быстро засунул колоноскоп, моментально осмотрел всю кишку и он молодец, то это не так.
Значит он смотрел невнимательно. А полипы бывают маленькие, например, полсантиметра-сантиметр. Если врач эти полипы пропустил, а в следующий раз человек собрался сделать колоноскопию, скажем, через 10 лет, то за это время из полипа может развиться рак.
Кстати, критерии качества хирургического вмешательства при КРР тоже важный вопрос. Ведь что такое онкологическая операция? Это операция, качество которой мы не можем определить сегодня, завтра или послезавтра. В отличии от какого-нибудь геморроя, при онкологическом заболевании у пациента, зачастую нет жалоб. Он лег на стол и чувствовал себя хорошо; встал и чувствует то же самое. Но как выполнена эта операция, мы не знаем. Мы можем это определить только через год, когда человек придет, сделает компьютерную томограмму и там действительно будет все хорошо, без признаков рецидива болезни. Но если он придет, а эти признаки будут, то поздно что-то говорить доктору. Время уже упущено.
Нужно ли выполнять биопсию при колоноскопии?
Современная колоноскопическая техника позволяет отличить обычный доброкачественный полип от чего-то более серьезного. Но нужно понимать, что любой полип больше полусантиметра должен быть удален. Маленькие можно удалять амбулаторно, прямо во время процедуры. Но вот для крупных полипов или полипов с подозрением на злокачественный рост нужно выполнить биопсию. И если он большой, но доброкачественный, то удаляют его в стационаре — обычно это занимает не больше двух дней. А если мы получаем при изучении биопсии злокачественный результат, то тогда уже нужно проходить полное обследование, определять клиническую стадию заболевания. И в зависимости от стадии уже определяется тактика лечения: начиная от эндоскопического удаления во время колоноскопии и заканчивая применением всех методов лечения.
Расскажите, пожалуйста, поподробнее про методы лечения.
В идеале мы должны находить онкологические заболевания, в частности колоректальный рак, на таких стадиях, чтобы было достаточно небольшого вмешательства. Если бы мы всем пациентам диагностировали КРР на первой стадии, то можно было бы ограничиться эндоскопическими вмешательством во время колоноскопии. И это было бы здорово. И более того, это был бы окончательный метод лечения, который приводил бы к выздоровлению у большинства больных в 99% случаев. Но, к сожалению, пока мы далеки от этого.
Есть пациенты с опухолями побольше, но все равно вполне операбельными. В этих случаях достаточно только хирургического вмешательства, которое также приведет к полному излечению большинства больных. Не потребуется больше ничего, кроме наблюдения у онколога.
Когда пациент попадает в руки онкологов уже на третьей стадии, ему требуется использование нескольких методов лечения. Принципиально в онкологии их существует три: хирургическое лечение, лекарственное (химиотерапевтическое) лечение и лучевое воздействие на опухоль. Если мы говорим про рак прямой кишки, то на третьей стадии пациент обязательно должен получить все три составляющие. Причем начинать лечение нужно, как правило, с химиолучевой терапии, а затем уже проводить хирургическое вмешательство. В этом случае мы увеличиваем безрецидивную выживаемость на 10-15%, если сравнивать с только хирургическим лечением.

Фото из архива Ильи Черниковского
Если говорить про рак ободочной кишки, то он, как правило, не подвергается лучевому воздействию. Очень сложно облучить опухоль, которая расположена в брюшной полости. Пациент дышит, двигается, кишечник перистальтирует и нецелевые органы могут попасть под лучевое воздействие. На третьей стадии этого вида КРР уже определенно используется химиотерапия, но как профилактическое лечение после хирургического вмешательства. Она позволяет увеличить выживаемость таких пациентов примерно на 5-10%, что несомненно важно.
Ну и наконец, самая печальная группа больных, которые обращаются к онкологам на 4 стадии заболевания с метастазами в отдаленные органы. Чтобы совсем не наводить пессимизм, можно сказать, что за последние 20 лет удалось добиться довольно существенных прорывов в лечении таких больных.
Во-вторых, появились новые таргетные препараты, которые дают очень хороший эффект. На фоне этих препаратов, при выполнении операции на печени, некоторые пациенты получили существенное 30-40% повышение выживаемости. Это большой прорыв.
Вышесказанное еще раз доказывает, что заниматься пациентами с КРР должны в стационарах, где работают все группы специалистов. Помимо просто хирурга, который может удалить опухоль, нужны еще грамотные химиотерапевты и радиологи, специалисты по хирургическому лечению печени и т.д. Если пациент может получить все это в одном стационаре, у него появляется шанс жить гораздо дольше.
Расскажите еще, пожалуйста, о влиянии локализации рака на выживаемость.
Есть данные, что при расположении первичной опухоли в левой половине ободочной кишки (то есть, в нисходящей ободочной, сигмовидной и прямой кишке) выживаемость существенно выше, чем при локализации рака в правой половине (слепой или восходящей ободочной кишке). Но пока этот вопрос на стадии изучения, и уже появляются альтернативные точки зрения.
Как правило, опухоли с левой стороны ободочной кишки диагностируются раньше. Это связано с тем, что, во-первых, в левой половине ободочной кишки опухоль часто вызывает стеноз — из-за него возникают нарушения дефекации и кровь в стуле, следовательно, пациенты раньше обращаются к врачу. Во-вторых, когда выполняют колоноскопическое исследование, иногда не могут пройти колоноскопом дальше определенного места. До левой половины добраться проще, далеко не все эндоскописты доходят до слепой кишки и тщательно рассматривают правую половину.
А это пока никто не учитывал в исследованиях. Есть мнение, что это все связано не с биологией опухоли, а лишь с такими факторами. Я сейчас ссылаюсь на нашего самого известного онкогенетика, профессора Имянитова Евгения Наумовича. Он считает, что глобальных генетических различий между правой и левой половиной опухоли нет.
Какие советы вы могли бы дать пациентам?
Первое: вы не должны бояться обследований.
В развитых странах, если отделение выполняет менее пятидесяти операций в год, связанных с КРР, то его перепрофилируют. В Санкт-Петербурге совершенный разброс в этом плане. Пациенты обращаются в разные учреждения и оперируются не в профильных центрах. И дело даже не в том, что там плохие доктора, просто это не их работа. Так же, как если я начну оперировать грыжи. Да, я умею это делать, но это не моя задача. А у нас все, кому не лень, хватаются оперировать рак.
А потом министр здравоохранения приезжает и удивляется, что в Санкт-Петербурге плохая онкологическая статистика. А это все из-за того, что в Петербурге зачастую не следуют порядку оказания помощи онкологическим больным. У нас примерно половина пациентов оперируется не в профильных учреждениях на сегодняшний день. А отвечают за результаты онкологи.
Мы боремся с этим уже давно и продолжим это делать, чтобы закрепить эту простую истину: онкологические больные должны лечиться у онкологов. Это очень важно.
И третий пункт, люди мало что знают о своих правах. У нас в городе пациент, которому поставили диагноз рак, имеет право сделать все обследования, которые необходимы для определения тактики, бесплатно и в рамках одного учреждения. Что сегодня происходит с такими больными? Им ставят диагноз и начинают гонять: в одно место — сделать КТ, в другое — выполнить платно МРТ, а потом только берут на операцию в непрофильное учреждение. А после оказывается, что ему нужно делать химиотерапию. А еще желательно, перед тем как назначить лекарства, провести иммуногистохимическое и молекулярно-генетическое консультирование для более прецизионного лечения. И все это платно.
Июль — месяц осведомленности о саркомах мягких тканей и раке костей. Почему эти опухоли часто обнаруживают поздно, каких ошибок можно избежать и как химиотерапия и ЗD-печать повлияли на лечение и качество жизни пациентов?
Пока мы не знаем конкретные причины возникновения сарком
Какие три главных факта нам нужно сегодня знать о злокачественных опухолях мягких тканей и костей?
Это очень редкие опухоли — всего 1% от всех онкозаболеваний, но очень сложные и коварные.
Например, саркомы мягких тканей появляются из соединительных тканей, которые могут быть везде, в любой точке организма — от головы до пяток. Их более 150 подтипов* и каждая группа опухолей диагностируется и лечится по-разному. У них крайне разнообразная и сложная для интерпретации морфологическая картина, поставить точный диагноз – настоящий вызов даже для опытного патоморфолога. Генетически они тоже разные — отличается и прогноз заболевания.
И третий главный факт — это опухоли, которые, к сожалению, часто поражают людей молодого возраста и деток.

Григорий Владимирович Зиновьев
Есть ли факторы, которые провоцируют эти заболевания, и можем ли мы на них повлиять?
Многие пациенты говорят, что саркома у них возникла после травмы, и раньше в литературе встречалась такая теория. Но в настоящее время нет достоверных данных о взаимосвязи травмы и появлении сарком костей и мягких тканей. Есть довольно красноречивый факт: после Второй мировой войны, да и вообще любых войн, у нас была бы эпидемия сарком, но всплеска заболеваемости не было.
Как правило, травмы становятся триггером, спусковым механизмом, провоцирующим рост опухоли. Но именно в том случае, если саркома была. То есть если опухоль должна появиться — она появится, что бы ты с этим не делал, к сожалению.
Мы знаем, что саркомы связаны с определенными генетическими особенностями. Например, если человек родился с синдромом Ли-Фраумени, семейным аденоматозным полипозом (FAP), нейрофиброматозом или ретинобластомой в анамнезе — одна патология тянет за собой другую, изменения в одном из ключевых генов нередко приводят к возникновению сарком.
И мы должны быть очень внимательны к этой группе пациентов, понимая, что риск возникновения различных видов сарком велик — зачастую уже в детстве. Нередко требуется дополнительное генетическое тестирование, как пациентов, так и их потомства — некоторые синдромы наследуемые.
Но эти генетические патологии редкие. В большинстве случаев саркомы возникают не на фоне какого-то синдрома, а просто возникают, и пока мы не знаем конкретные причины. Из-за того, что это очень коварная болезнь, она может развиваться и у меня сейчас, но я об этом просто не знаю.
Если появилось новообразование — это повод обратиться к врачу и обследовать
То есть способов профилактики нет?
К сожалению, нет. Для сарком тканей и кости толком нет ни профилактики, ни скрининга.
Хороший опыт есть у наших британских коллег. Врачам первичного звена, терапевтам, выдавали брелоки с мячиками для гольфа на цепочке. Это было напоминанием — если вы обнаружили у пациента под мышечной фасцией растущее новообразование размером не меньше мячика для гольфа — это прямое показание к выполнению исследования, хотя бы ультразвукового.
Ровно так же мы можем использовать такое правило: если у нас появилось новообразование — это как минимум повод обратиться к специалисту и обследовать. Особенно если оно растет.
Да, в большинстве случаев те новообразования, которые мы можем обнаружить у себя под кожей, оказываются доброкачественными — липомы, фибромы. Но среди них могут оказаться и саркомы, поэтому нужно быть очень внимательным прежде всего врачам.
Конечно. Надо быть уверенным, что вы прогреваете, физиотерапевтируете или разминаете у массажиста. Это как раз те сценарии, с которыми приходят ко мне пациенты. Масса людей использовали бытовые методы или подвергались неадекватному лечению, антилечению фактически.
Но опять-таки — это редкая опухоль. На каждую саркому приходится не меньше 100 доброкачественных новообразований. И когда врач в день видит 100 липом, подозревать в 101-ой липосаркому — довольно сложно. У каждого человека, если нас просканировать, можно обнаружить доброкачественные образования чего бы то ни было — печени, костей, мягких тканей, кожи.
Григорий Зиновьев на операции
Более того — есть еще одна проблема. Одно дело, когда мы говорим о конечностях. А что у нас в забрюшинном пространстве, вдоль позвоночника, что в средостении?
Гадкое коварство саркомы, особенно ретроперитонеальных локализаций (в забрюшинном пространстве), в том, что они растут совершенно бессимптомно. После 50 лет у мужчин обычно увеличивается живот — ну, растет и растет, наверное, диету нарушает, пьет пиво. У человека с ожирением обнаружить растущую опухоль тоже сложно. И когда возникают уже боли и функциональный дефицит, человек обращается за помощью, ему делают УЗИ как первый способ диагностики и выявляют злокачественное новообразование. Это я говорю о мягких тканях.
С костями все еще сложнее. Пока не появится боль или припухлость — мы никогда не будем подозревать, что в кости есть саркома. Одно утешает — это редкая опухоль, иначе можно сойти с ума, если думать, что у каждого в кости может быть по саркоме.
Можем ли мы в таком случае сказать, что периодически человеку стоит делать УЗИ всех органов, даже если ничего не беспокоит?
Естественно, стоит делать УЗИ, и это входит в плановую диспансеризацию, профилактический скрининг. Мы же понимаем, что рак желудка не дремлет, и нужно регулярно проводить гастроскопию. Каждая женщина знает, что с определенной периодичностью необходимо посещать гинеколога. И так далее.
Раз в год человек делает УЗИ живота, смотрит печень-почки-малый таз — и в этот момент врачи случайно находят какое-то изменение мягких тканей забрюшинного пространства или опухоль кости. Но не поиск сарком — причина для УЗИ, причина для УЗИ — плановое обследование.
Другой пример: человек шел по улице, упал и сломал шейку бедренной кости. Выполнили рентген и обнаружили, что причина этого — опухоль кости, а не просто травма, которой часто и не было вовсе. На этом этапе тоже масса ошибок!
Недавно на конференции я выступал с докладом по патологическим переломам — травматологи не всегда могут правильно оценить ситуацию, распознать, что это не травматический перелом, а патологический, что там — именно опухоль, а не простой перелом.
Поэтому не нужно устанавливать пластины и спицы — сначала следует выполнить стабилизацию, затем биопсию, понять, с чем мы имеем дело, а потом — правильные, большие и красивые операции. Но главное — назначить необходимую системную терапию.
Редкая, коварная, сложная опухоль.
Произошла эволюция терапии сарком — доля ампутаций стремительно уменьшается
Насколько хорошо медицина сегодня умеет вылечивать такие заболевания?
В онкологии мы пользуемся критерием 5-летней выживаемости, и огульно для всех сарком мягких тканей и костей сказать невозможно.
Если сильно-сильно обобщать, хотя это уже некорректно, и мы будем использовать данные регистров США, то при локализованном процессе — если опухоль расположена только в кости — пятилетняя выживаемость составляет порядка 80%. При региональном распространении, с поражением смежных структур или лимфоузлов — порядка 50-60%. Если человек обращается к нам с отдаленными метастазами, то прогноз уже гораздо хуже — меньше 20 пациентов из ста будут живы по истечению пяти лет.
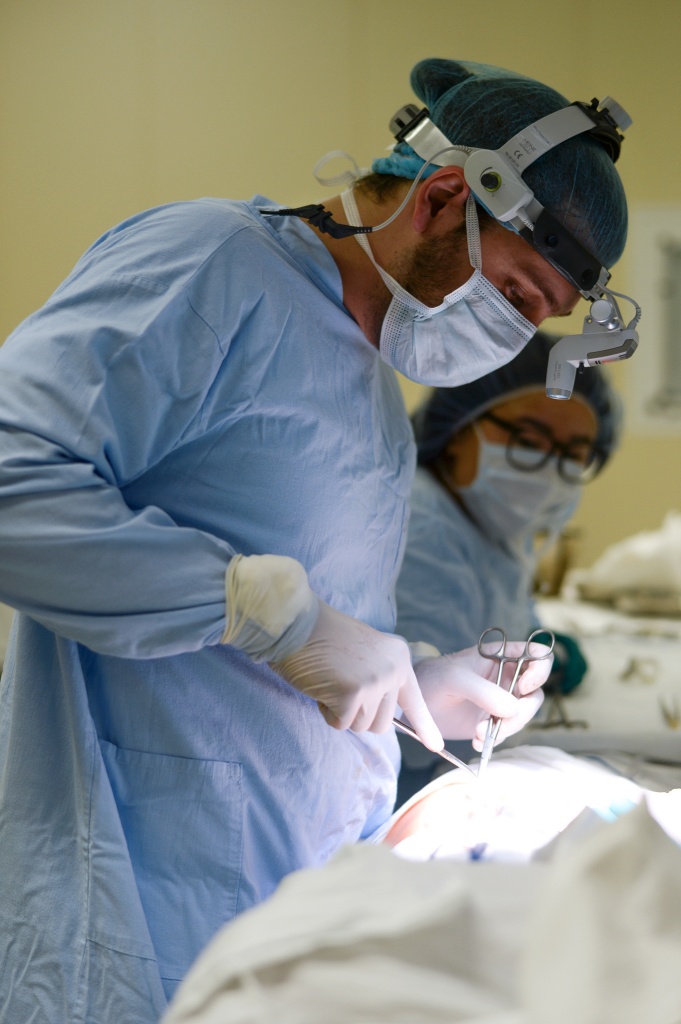
Григорий Зиновьев на операции
Кроме того, лечение со временем улучшается, и эти цифры основаны на данных пациентов, которым был поставлен диагноз и которые получали терапию не менее пяти лет назад. Но опять-таки — это огульно, без разбора.
Все зависит от биологии опухоли, от того, как она отреагирует на системную терапию.
Например, фиброматоз десмоидного типа никогда не метастазирует, но рецидивирует бесконечно — как ты его не удаляй, описаны рецидивы даже после ампутаций. Сейчас даже в отношении этой опухоли принят такой консенсус — лучше всего при любой возможности избежать операции, динамически наблюдать. В общем, все меняется в зависимости от морфологического подтипа.
Например, при высокодифференцированной хондросаркоме в случае успешного хирургического лечения у нас будут прекрасные результаты — практически 100% опухоль-специфическая выживаемость, так как опухоль удалена радикально, и у нее низкая степень злокачественности. А есть опухоли, у которых по определению, в связи с ее биологией прогноз хуже.
Что вы обычно говорите пациенту, который первый раз пришел к вам на прием?
Лечение этих опухолей должно быть комплексным, и это действительно очень тяжелый и серьезный процесс. Например, при саркоме Юинга лечебная программа может длиться целый год. И самый важный момент — правильно поставить диагноз. В нашей стране совсем немного патологов, которые специализируются на этих заболеваниях.
Я горжусь тем, что в моем учреждении каждый диагноз саркомы обсуждает мультидисциплинарная команда. Все мы — хирурги, патологи, химиотерапевты, радиологи и рентгендиагносты — собираемся за микроскопом, смотрим и обсуждаем все материалы, совместно принимаем решение.
Есть ли сейчас какие-то технологии, методы, которые улучшают результаты лечения и качество жизни ваших пациентов?
Есть — произошла долгая эволюция терапии сарком. Она началась в 1960-х годах, когда саркома считалась только хирургической патологией — и способом лечения была лишь ампутация.
Но стало очевидно, что опухоль все равно метастазирует, что саркомы — это системные заболевания, кроме некоторых подтипов с хорошим биологическим потенциалом. В 1970-х появилась химиотерапия, которая становилась все более эффективной для ряда опухолей. Но не для всех, к сожалению.
Не отставала и хирургия. Открылись новые возможности для конечность-сохраняющих операций, и доля ампутаций начала стремительно уменьшаться. Сейчас это, скорее, исключение.
Теперь благодаря модульным и индивидуальным эндопротезам мы можем заместить костный дефект. При необходимости протезируем и сосуды. Серьезный вклад внесла и 3D-печать.

Ключевая проблема — мало эффективных химио- и иммунотерапевтических препаратов для лечения сарком, и исследования в этом направлении идут очень медленно.
Потому что это очень разнообразная, но при этом редкая патология — всего 1% от всех опухолей человека, при том какое есть множество морфологических подтипов. Намного выгоднее проводить разработку новых препаратов при более распространенных и хорошо изученных заболеваниях, например, при раке молочной железы. Для сравнения — в 2018 году в США саркомой мягких тканей (все подтипы) заболели около 13 000 человек, а раком молочных желез — больше 260 000.
Трагично, кода при системном лечении опухоль не уходит… Тяжелых историй хватает. Ряд опухолей ведет себя очень агрессивно, и наши возможности ограничены.
Телемедицина — это исключительная возможность для нашей страны
Вы следите за судьбами пациентов после выписки?
Когда завершается лечебная программа, пациент чаще всего наблюдается у нас. Особенно это важно, если по месту жительства у него нет возможности адекватного контроля за заболеванием или установленной конструкцией.
Прекрасно, что у нас теперь есть телемедицина, и я очень активно использую эту технологию и призываю к этому коллег и пациентов. Для нашей необъятной страны это исключительная возможность!
Где бы пациент ни жил, его врач в онкологическом учреждении формирует пакет документов и исследований, отправляет нам в головное учреждение, мы пытаемся разобраться в ситуации и при необходимости госпитализируем к себе.

Эту историю можно назвать позитивной?
Рано. Позитивной она будет, когда мы завершим комбинированное лечение, пройдет время — не случится рецидив или не появятся метастазы. Но у меня много позитивных историй.
То есть в случае успешного лечения жизнь человека может быть обычной?
Конечно. Даже в случае утраты конечности человек может жить полноценной жизнью, заниматься спортом, кататься на лыжах и велосипеде. Истории многих сильных духом пациентов заставляют задуматься и заряжают оптимизмом.
Какой вопрос в медицине вас сейчас особенно интересует?
Меня очень волнует поиск новых препаратов для лечения больных моей профильной патологией. Пока исследований мало, эффективность химиотерапии не всегда высока. Я очень жду появления новых эффективных препаратов и сам участвую в разработке новых подходов в комплексном лечении.
Но есть еще много нюансов, которые зачастую ставят врачей и пациентов в тупик, — материальное снабжение, квоты… Это дорогое лечение, и надеюсь, что для такой страны, как наша, это не будет становиться серьезным препятствием.
В отношении хирургии и лечебного процесса у нашей команды есть большие возможности, так как НМИЦ онкологии имени Н.Н. Петрова — референтный центр по лечению сарком. Остается и дальше интенсивно развиваться.
* Fletcher CDM, Bridge JA, Hogendoorn P, Mertens F. World Health Organization Classification of Tumours. Pathology and Genetics of Tumours of Soft Tissue and Bone, Fourth Edition. IARC, Lyon, 2013.
Фотографии из личного архива Григория Зиновьева
Не всегда онкологические заболевания удается диагностировать на ранних стадиях. Одна из причин — несвоевременное обращение за помощью: часто люди не знают о признаках, которые могут указывать на рак.
Перечисляем основные симптомы, которые должны насторожить. В большинстве случаев они вызваны другими заболеваниями. Если какие-то из симптомов сохраняются долгое время или прогрессируют, обратитесь к врачу.
Общие симптомы рака
Ночное потоотделение могут вызвать различные инфекции или прием некоторых лекарств. Еще этот симптом часто встречается у женщин во время менопаузы. Однако обильное потоотделение ночью также может быть признаком онкологического заболевания.
Резкая потеря веса без объяснимых причин — сигнал, который может указывать на различные заболевания. В случае с онкологическими заболеваниями этот симптом чаще всего встречается при раке поджелудочной железы, желудка, пищевода или легких.
Обращайте внимание на шишки или отеки, возникшие по непонятным причинам. Если они появились после ушиба, удара и долгое время не проходят, также необходимо проконсультироваться с врачом.
Боль — это защитный сигнал организма, который говорит о том, что в организме что-то не так. Боль может быть ранним симптомом некоторых онкологических заболеваний, например рака костей или яичек. Головные боли, которые со временем учащаются или усиливаются входят в список возможных симптомов опухолей головного мозга. Боль в спине может быть признаком рака толстой, прямой кишки или яичников.
Если боль вызвана онкологическим заболеванием, чаще всего это означает, что опухоль распространилась на другие ткани и органы. В процессе роста она может давить на расположенные рядом нервы, кости или органы. Кроме того, раковые клетки могут выделять химические вещества, которые вызывают боль. Также боль провоцирует реакция организма на эти вещества.
Сильная и прогрессирующая усталость, которая не проходит после сна и отдыха, может указывать как на распространение опухоли, так и быть симптомом ранних стадий некоторых видов рака, например лейкемии.
Локальные симптомы рака
Кожа обычно быстро восстанавливается — мелкие повреждения заживают около недели. Если небольшие раны и язвы не проходят в течение долгого времени, даже если они при этом не болят, необходимо проконсультироваться с врачом.
Обратитесь к врачу, если заметили необычную родинку: она поменяла цвет, форму, болит, кровоточит. Заметить появление новых родинок или изменения существующих бывает сложно. Людям с повышенным риском развития меланомы рекомендуют составлять карту родинок.
Незаживающая язва во рту может быть симптомом рака полости рта. На это следует обратить особое внимание людям, которые курят, жуют табак и часто употребляют алкоголь.
Белые пятна во рту или на языке могут быть лейкоплакией — заболеванием, которое поражает полость рта и язык. Это состояние также чаще всего возникает из-за употребления табака, в том числе курительного, жевательного и загубного. Без лечения лейкоплакия может перерасти в рак ротовой полости.
Язвы на половых органах могут быть признаком инфекции или ранней стадии рака вульвы и полового члена.
Любые кровотечения или кровянистые выделения, за исключением менструации — это всегда признак какого-то нарушения в организме, о котором нужно сообщить врачу. Кашель с кровью может сигнализировать о раке легких, рвота с кровью — о раке пищевода или раке желудка. При колоректальном раке кровь может выделяться со стулом. Рак шейки матки или яичников может вызывать вагинальные кровотечения или необычные выделения из влагалища, рак молочной железы — кровянистые выделения из соска.
- Изменения в области молочной железы, ареолы и соска
Шишка или уплотнение в груди могут быть симптомами как ранней, так и поздней стадий рака. При их обнаружении обязательно следует посетить врача. Некоторые виды рака молочной железы могут вызвать покраснение или уплотнение в области груди. В редких случаях кожа на соске может стать чешуйчатой и шелушиться, покрыться корками, напоминающими экзему, которые вызывают зуд. У мужчин рак молочной железы встречается очень редко, но им также необходимо обращаться к врачу при необычных изменениях груди.
Трудности с глотанием пищи, изжога, расстройство желудка, потеря аппетита на протяжении длительного времени могут быть признаками рака пищевода или желудка.
- Изменения в работе кишечника или мочевого пузыря
Сбои в работе кишечника (длительный запор, диарея или чувство неполного опорожнения) могут быть симптомами рака толстой кишки. Боль при мочеиспускании, кровь в моче или изменение частоты мочеиспускания (слишком часто или редко) могут быть связаны с раком мочевого пузыря или простаты.
Часто кашель и охриплость встречаются при простуде. Однако нужно насторожиться, если они держатся дольше нескольких недель или усиливаются: кашель может быть признаком рака легких, а охриплость — рака гортани.
Головная боль, судороги, изменения зрения, слуха, проблемы с речью и координацией могут сигнализировать об опухоли головного мозга.
Научный редактор: Екатерина Коробейникова, онколог-химиотерапевт, выпускница Высшей школы онкологии
Читайте также:

