Что такое реактивация или поздний период первичной инфекции
Обновлено: 19.04.2024
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Цитомегаловирус: причины появления, симптомы, диагностика и способы лечения.
Определение
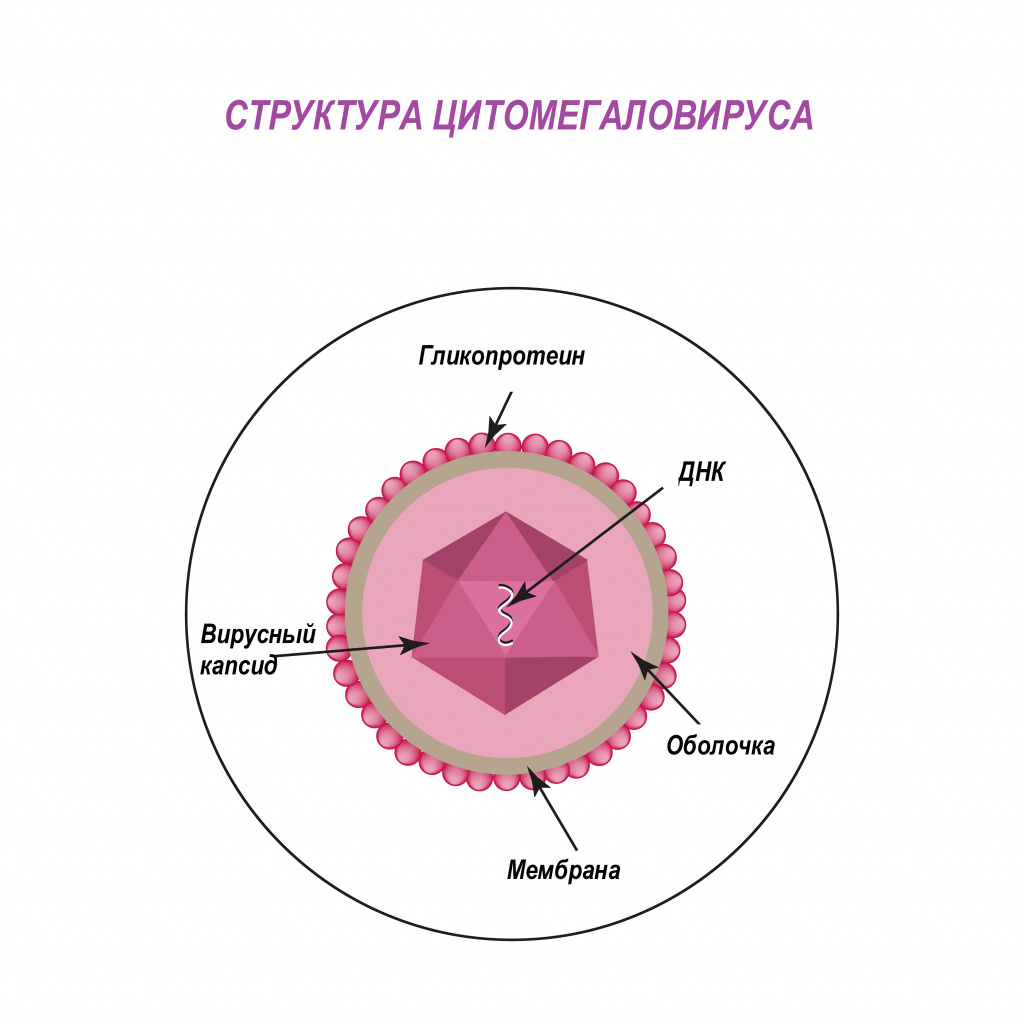
Цитомегаловирус (ЦМВ, или цитомегаловирусная болезнь) – хроническое инфекционное заболевание вирусной этиологии, характеризующееся многообразием клинических форм и проявлений - от бессимптомного течения до тяжелого поражения внутренних органов и центральной нервной системы. Возбудитель ЦМВ – представитель семейства герпесвирусов (вирус герпеса человека 5-го типа).
Попадая в клетки организма, цитомегаловирус способен оставаться в них пожизненно. У лиц с нормально функционирующей иммунной системой в подавляющем большинстве случаев инфекция протекает по типу вирусоносительства. При угнетении иммунитета вирус активизируется, вызывая клинические симптомы болезни.
По различным данным доля носителей цитомегаловируса в России составляет порядка 73-90% - то есть именно у такого количества людей выявляются антитела к ЦМВ.
Причины появления цитомегаловирусной болезни
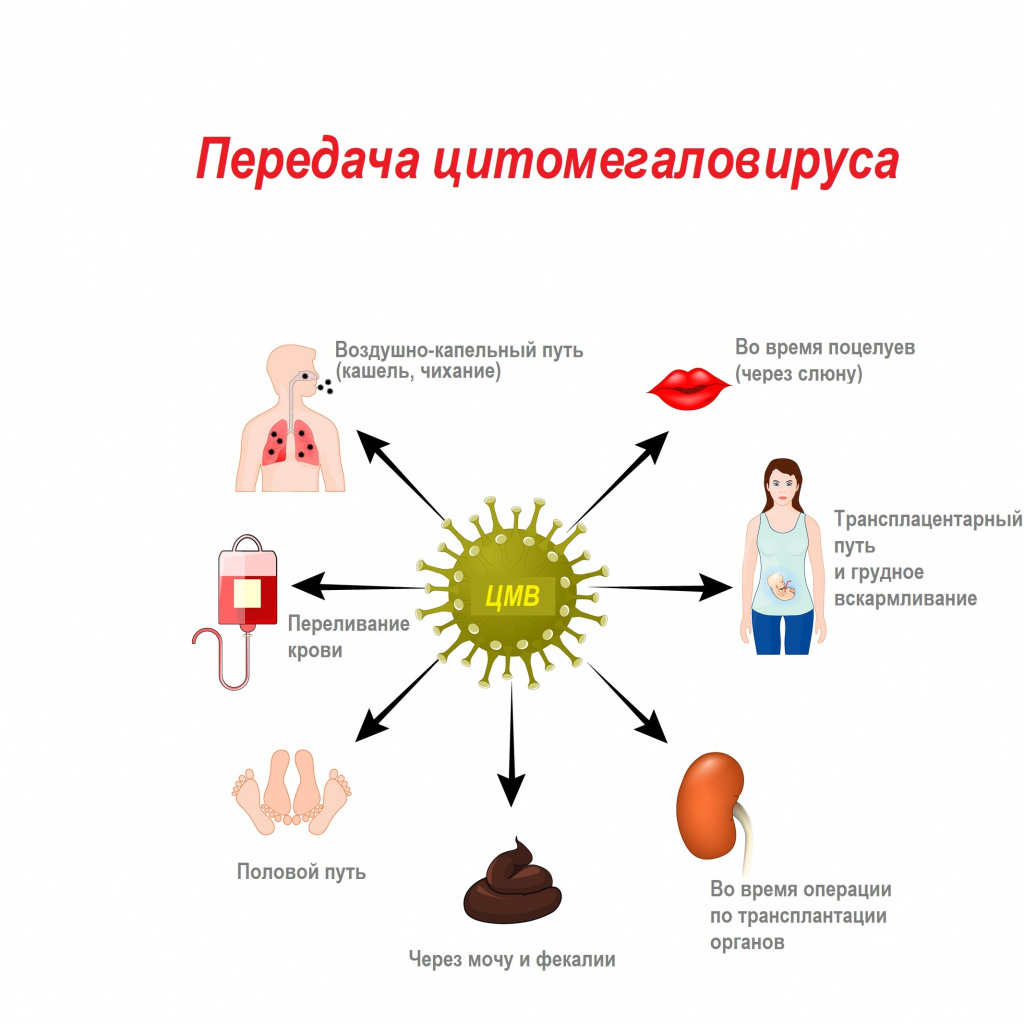
Цитомегаловирус передается через биологические жидкости: слюну, мочу, кровь, вагинальный секрет, слезы, сперму, фекалии, грудное молоко.
Из-за лабильности возбудителя и низкой концентрации вируса в выделениях для передачи инфекции необходим длительный, частый и тесный контакт с носителем.
Механизмы передачи вируса — воздушно-капельный (аэрозольный путь), контактный (контактно-бытовой и половой), гемоконтактный (парентеральный, а также при пересадке органов), вертикальный (от матери к плоду), фекально-оральный (алиментарный — через грудное молоко).
Заражение плода реализуется за счет трансплацентарной передачи от матери к плоду, которая возможна в течение всей беременности. Наибольшую опасность для плода представляет первичная инфекция на ранних сроках беременности, поскольку часто вызывает формирование врожденных пороков развития.
Особое свойство ЦМВ — способность вызывать депрессию практически всех звеньев иммунитета, резко угнетать продукцию интерферонов, в первую очередь ИНФ-α. При острой инфекции вирус поражает преимущественно эпителиальные клетки легких, печени, кишечника, почек, мочевого пузыря, молочных и слюнных желез, генитального тракта. Цитомегаловирус может инфицировать нервные клетки, клетки гладкой мускулатуры, костного мозга.
Классификация заболевания
По характеру инфицирования:
- врожденное (внутриутробное),
- постнатальное (приобретенное).
- латентная инфекция,
- персистирующая инфекция,
- активная (низкой, средней, высокой степени тяжести) инфекция.
- острая инфекция,
- реактивация вируса,
- реинфекция.
Инкубационный период цитомегаловирусной болезни составляет от 15 дней до трех месяцев (при манифестной, выраженной форме заболевания). Однако чаще первичное инфицирование протекает или бессимптомно, или по типу легкой формы ОРЗ – у пациента наблюдаются незначительная слабость, лихорадка (температура 37,1-38,0°С), дискомфорт в мышцах, першение в горле, иногда насморк, увеличение шейных лимфатических узлов, болезненность слюнных желез, головная боль, отсутствие аппетита.
У беременных острая первичная инфекция протекает, как правило, бессимптомно (25–50%) или с неспецифическими проявлениями (с лихорадкой, астенией и головной болью).
В редких случаях развиваются гепато- и спленомегалия, гепатит с минимальной степенью активности цитолитического синдрома, дерматиты, васкулиты, интерстициальный пневмонический процесс, тромбоцитоз или тромбоцитопения, лимфоцитоз.
У больных с иммунодефицитом цитомегаловирусная инфекция протекает тяжело - вирус быстро распространяется по организму и вызывает серьезные осложнения.
Диагностика цитомегаловируса
Диагностические мероприятия начинаются со сбора жалоб и анамнеза, в том числе акушерско-гинекологического анамнеза матери.
Затем врач проводит объективное обследование (физикальное, неврологическое и антропометрическое).
Лабораторные исследования - общие и специфические:
-
общий анализ крови;
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий анализ, лейкоформула, СОЭ См. также: Общий анализ – см. тест № 5, Лейкоцит.
Синонимы: Анализ крови на антитела к цитомегаловирусу; АТ-ЦМВ-IgМ; цитомегаловирусная инфекция; ЦМВ-инфекция; специфические иммуноглобулины класса М к цитомегаловирусу. Cytomegalovirus; CMV Antibody; IgM; CMV infection; CMV-specific IgM. Краткое описание исследования Anti-CMV.
Синонимы: Анализ крови на антитела к цитомегаловирусу; АТ-ЦМВ-IgG; Цитомегаловирусная инфекция; ЦМВ-инфекция; Специфические иммуноглобулины класса G к цитомегаловирусу. Cytomegalovirus; CMV Antibody, IgG; CMV infection; CMV-specific IgG. Краткое описание исследования Anti-CMV-IgG .
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирусная инфекция входит в группу репродуктивно значимых инфекций, обозначаемых как TORCH-комплекс (название образовано начальными буквами в латинских наименованиях - Toxoplasma, Rubella, Cytomegalovirus, Herpes); первичное инфицирование данными возбудителями, либо обострение .
К каким врачам обращаться
С первичными жалобами пациенты обращаются к врачу-терапевту или врачу общей практики (семейному врачу), детей ведет врач-педиатр . Могут потребоваться консультации инфекциониста - для верификации диагноза, стоматолога - при поражениях слизистой оболочки рта, кардиолога - при наличии врожденного порока сердца, нейрохирурга - при пороках центральной нервной системы, невропатолога - для оценки неврологической патологии, гематолога - при выраженных гематологических изменениях и геморрагическом синдроме, окулиста - для исследования глазного дна, отоларинголога - для исследования слухового аппарата.
Лечение цитомегаловирусной болезни
Субклинические формы ЦМВ-инфекции и латентное носительство крайне распространены, поэтому в большинстве случаев не требуют специфической терапии даже при выявлении антител. Их лечение направлено на усиление защитных сил организма при помощи иммуномодуляторов и профилактику факторов риска, которые приводят к обострению заболевания.
Для терапии клинически активных форм инфекции применяют:
- комплекс патогенетической (противовирусной) терапии, который разрабатывается профильными специалистами и включает препараты прямого противовирусного действия для минимизации риска осложнений, сокращения времени течения заболевания, а также профилактики рецидивов;
- иммунотерапию – антицитомегаловирусный иммуноглобулин назначают преимущественно детям при манифестных формах заболевания и беременным;
- дезинтоксикационную терапию, которая направлена на купирование синдрома интоксикации;
- метаболическую терапию - для восстановления обмена веществ в организме;
- симптоматическую терапию - для купирования воспалительных и токсических проявлений заболевания.
Проблема клинически выраженной инфекции актуальна для лиц, имеющих иммуносупрессию иной природы, в частности, онкогематологических пациентов, больных лучевой болезнью, лиц, длительно принимающих кортикостероидную, туберкулостатическую терапию, а также перенесших ожоговую травму.
Острое течение ЦМВ может привести к развитию гепатита с повышением уровня аминотрансфераз и атипичным лимфоцитозом.
Ученые предполагают роль цитомегаловируса как одного из кофакторов в развитии системных васкулитов, хронических диссеминированных заболеваний легких (в частности, фиброзирующего альвеолита), криоглобулинемии, опухолевых процессов (аденокарциномы предстательной железы, аденокарциномы толстой кишки, рака шейки матки), атеросклероза, кардиомиопатии, детского церебрального паралича, эпилепсии, синдрома Гийена-Барре, синдрома хронической усталости, аутизма.
Первичное инфицирование цитомагаловирусом у беременных женщин существенно повышает риск преждевременных родов, самопроизвольного выкидыша, многоводия, замершей беременности, внутриутробного инфицирования и даже гибели плода. Врожденная ЦМВ-инфекция может стать триггерным фактором развития тяжелых генерализованных форм и инвалидизирующих исходов заболевания, таких как потеря слуха, зрения, умственная отсталость, микроцефалия, судорожный синдром и пр. Такие пожизненные проблемы со здоровьем развиваются примерно у каждого пятого ребенка с врожденной цитомегаловирусной инфекцией.
Профилактика цитомегаловирусной болезни
Женщинам, планирующим беременность, необходимо пройти обследование на наличие ЦМВ. При обнаружении вируса важно получить консультацию врача-иммунолога.
Профилактика или превентивное лечение (активный мониторинг пациентов по уровню вирусной нагрузки и назначение противовирусных препаратов пациентам с признаками инфекции) являются эффективными способами предотвращения развития цитомегаловирусной инфекции после трансплантации органов.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
От 10 % до 30 % всех пациентов с Covid-19 страдают от симптомов, которые появляются через несколько недель и даже месяцев после заражения. К ним относятся в том числе молодые, ранее здоровые люди, у которых заболевание Covid-19 проходило без осложнений. Симптомы могут включать когнитивные нарушения, утомляемость, одышку, учащенное сердцебиение и непереносимость физических и умственных нагрузок.
Чиновники здравоохранения по всему миру пытаются выяснить, что вызывает такие долгосрочные симптомы. Национальные институты здравоохранения США представили крупную инициативу по изучению постковидного синдрома при финансовой поддержке в размере 1,15 миллиарда долларов. Тем не менее ученые по-прежнему очень мало знают о причинах этого состояния, а методов лечения предлагают еще меньше.
Некоторые пациенты с постковидным синдромом и правозащитные организации призывают врачей проводить исследования на реактивированные вирусы. По их словам, при существующем небольшом количестве вариантов лечения постковидного синдрома имеет смысл посмотреть, могут ли противовирусные препараты от герпеса облегчить симптомы. Некоторые врачи говорят, что это стоит дополнительных анализов и дальнейшего изучения. Другие утверждают, что анализы трудно интерпретировать и что даже если латентный вирус реактивируется, неясно, вызывает ли он постковидный синдром.
Авторы исследовании, опубликованного в июне медицинском журнале Pathogens, предположили, что существует связь между реактивацией Эпштейна-Барра и постковидным синдромом. Исследователи обнаружили, что в группе из 30 пациентов с постковидным синдромом примерно у 67 % были положительные тесты на реактивацию ВЭБ. Исследователи проверили реактивацию на основе количества антител, которые, по их словам, связаны с активной или реактивированной инфекцией ВЭБ.
Врачи не проводят тесты на реактивированные вирусы у пациентов с постковидным синдромом на регулярной основе. Лабораторные тесты, покрываемые страховкой и доступные для большинства пациентов, не так точны, как те, которые используют исследователи для тестирования вирусной ДНК, поэтому они вряд ли покажут столько реактиваций, говорит Сьюзен Левин, доктор в центре, изучающем синдром хронической усталости при школе общественного здравоохранения Колумбийского университета и в Корнелльском центре лечения заболеваний нейроиммунной системы.
Доктор Левин лечит около 200 пациентов с постковидным синдромом и проверяет их на реактивированные вирусы, но часто использует дополнительные тесты для подтверждения. Она утверждает, что около 80 % пациентов имеют подтверждение реактивации ВЭБ и небольшой процент также получает положительный результат для реактивированного случая ВПГ-6.
По словам врача, трудно определить, насколько реактивация вирусов способствует развитию постковидного синдрома у пациентов, но она считает, что это играет важную роль.

Доктор Хенрих уверен, что то, что скрытые вирусы реактивируются вирусом Covid-19, неудивительно. По его словам, вопрос в том, вызывает ли эта реактивация постковидный синдром.
По словам Хенриха, реактивированные вирусы у пациентов с ослабленным иммунитетом могут вызывать симптомы и заболевания, которые поддаются лечению. Но у многих людей могут быть временные, но обнаруживаемые уровни вируса герпеса человека, не вызывающие симптомов. Роль ВЭБ при миалгическом энцефаломиелите / синдроме хронической усталости (МЭ / СХУ) является предметом продолжающихся дискуссий в медицинском сообществе.
В чем трудности диагностики ЦМВ? Каков механизм заражения ЦМВИ? В последние годы отмечена тенденция к увеличению среди беременных частоты вирусных инфекций и возросла их способность, при определенных условиях, к эпидемическому распространению.
В чем трудности диагностики ЦМВ?
Каков механизм заражения ЦМВИ?
В последние годы отмечена тенденция к увеличению среди беременных частоты вирусных инфекций и возросла их способность, при определенных условиях, к эпидемическому распространению.
Особое значение приобретает проблема цитомегаловирусной инфекции (ЦМВИ) при беременности, вследствие того что цитомегаловирус (ЦМВ) может явиться причиной акушерской патологии, эмбрио- и фетопатий, внутриутробной и перинатальной инфекции [1].
Наличие латентных форм ЦМВИ с атипичным течением, инаппарантными проявлениями и поражением тканей органов представляет большие трудности для своевременного распознавания инфекции и является причиной диагностических ошибок.
Среди родившихся живыми 0,2-2,2% детей внутриутробно инфицированы цитомегаловирусом. Внутриутробная ЦМВИ, вне зависимости от формы заболевания, может представлять опасность вследствие поражения ЦНС и привести к возникновению психомоторных нарушений, умственной отсталости детей даже через несколько лет после родов [2].
Беременным принадлежит значительный процент в эпидемиологии ЦМВИ, которая обнаруживается у них в два раза чаще, чем краснуха.
ЦМВИ может способствовать развитию осложнений во время беременности, родов и в послеродовом периоде. Акушерская патология наиболее часто проявляется в виде спонтанных выкидышей, мертворождений, рождения нежизнеспособных детей [3, 4, 11].
Проблема изучения цитомегаловирусной инфекции и ее влияния на течение и исход беременности, разработка основ комплексной профилактики и лечения крайне актуальны и особенно важны для практического здравоохранения.
Цитомегаловирус является крупным ДНК-геном со сравнительно низкой вирулентностью и особой способностью к резкому подавлению клеточного иммунитета.
Воздействия экзо- и эндогенных факторов приводят к снижению иммунитета и, соответственно, к активации хронической цитомегаловирусной инфекции.
Источниками инфекции могут являться носители ЦМВ, их биологические жидкости и выделения: кровь, моча, слезы, слюна, грудное молоко, спинномозговая жидкость, амниотическая жидкость, вагинальное отделяемое, слизь из носоглотки, сперма, фекалии и др.
Особый тропизм ЦМВ проявляет к слюнным железам. Отсюда реальная возможность передачи ЦМВ от матери к ребенку при поцелуях. Имеется прямая корреляционная зависимость между инфицированием цитомегаловирусом и сексуальной активностью партнеров.
С учетом возраста и интимности контактов между людьми выявляются две волны атаки ЦМВИ: первая достигается к трехлетнему возрасту, вторая — к периоду половой зрелости.
В большинстве случаев имеет место бессимптомное вирусоносительство или субклиническая, инаппарантная, хроническая инфекция, которая вне иммунодепрессии не вызывает никаких субъективных нарушений или объективных клинических проявлений. Длительной (нередко пожизненной) латенции способствует внутриклеточное сохранение ЦМВ в лимфоцитах, где он надежно защищен от действия специфических антител и интерферона.
Морфологические изменения проявляются в виде комплексов из цитомегалических клеток (ЦМК) и интерстициальной лимфогистиоцитарной инфильтрации [3].
Цитомегалические изменения наиболее часто наблюдаются в слюнных железах, легких, почках и головном мозге.
Описаны локальные цитомегалические повреждения глаз (хореоретиниты), кишечника (колиты), кожи (дерматиты), надпочечников, легких, почек, головного мозга [3].
Вопрос о влиянии срока беременности на передачу инфекции от матери к плоду остается открытым. Считается, что наибольшую угрозу для плода представляет развитие цитомегаловирусной инфекции в первой половине беременности.
Реактивация латентной инфекции ведет к передаче вируса от матери к плоду в 0,15%–0,36% случаев [5].
Возможно несколько путей передачи инфекции от матери к плоду:
- трансплацентарный;
- через инфицированные выделения в родовом канале;
- кормление инфицированным материнским молоком.
Трансплацентарная передача ЦМВИ наиболее часто приводит к инфицированию плода [7].
Цитомегаловирус от матери может проникать через плаценту в любом сроке беременности и вызывать поражение плода.
Цитомегаловирусная инфекция у беременных может быть первичной или рецидивирующей. Первичное материнское заражение ЦМВ, возникшее во время беременности, лучше всего диагностируется при изучении сероконверсии антител к ЦМВ. Присутствие антител IgG и IgM можно считать свидетельством первичной материнской инфекции. Рецидивирующая ЦМВ-инфекция во время беременности включает в себя как реактивацию собственного штамма ЦМВ, так и возможную реинфекцию новым штаммом вируса [9].
В большинстве случаев, в популяциях с высоким превалированием антител к ЦМВ, развитие ЦМВИ во время беременности скорее происходит в результате реинфицирования.
Врожденная ЦМВИ возникает либо после первичной инфекции, либо в результате обострения хронической. Более тяжелые последствия наблюдаются в период беременности при первичной инфекции.
При беременности в условиях иммунодефицита возникает неспецифическая депрессия иммунной системы. При ЦМВИ больше всего страдает клеточный иммунитет. Именно характер сдвигов в системе клеточного иммунитета во многом определяет течение и исход цитомегалии.
В ответ на внедрение вируса происходит выработка антител. При цитомегалии комплиментсвязывающие антитела сохраняются на протяжении всей жизни, что позволяет установить случаи имевшего в прошлом заболевания. Очевидно, что специфические антитела важны при защите против цитомегаловируса.
Антитела класса IgG свидетельствуют о том, что женщина ранее встречалась с инфекцией. Беременные имеют более интенсивную и длительную реакцию IgG. Высокие показатели титров антител свидетельствуют об активизации хронического процесса.
Отсутствие IgG в пуповинной сыворотке или сыворотке крови новорожденного исключает врожденную ЦМВИ, в то время как их присутствие может означать пассивный перенос от матери к плоду.
Значительно более высокий уровень IgG у новорожденного, чем у матери, может свидетельствовать о врожденной инфекции.
При исследовании в первые шесть месяцев жизни ребенка врожденная ЦМВИ исключается, если уровень IgG будет постепенно снижаться. Наличие IgМ в сыворотке крови характеризует первичную инфекцию. Антитела IgМ сохраняются в крови от 12 до 18 недель от начала первичной инфекции.
Антитела класса IgM через плаценту не переходят, их синтез осуществляется плодом и новорожденным в ответ на антигенное раздражение.
Механизм передачи ЦМВ предполагает тесный контакт между беременной (родильницей) и плодом (новорожденным). После беременности и родов ЦМВ можно найти почти во всех жидкостях тела, особенно в цервико-вагинальных выделениях и в грудном молоке, что может явиться источником пери- и постнатальной передачи ЦМВ от матери к новорожденному.
Передача инфекции может произойти с кровью при гемотрансфузиях и парентеральных манипуляциях, а также через поврежденную кожу и мацерированные слизистые. Установлено, что интранатальная или ранняя постнатальная передача ЦМВИ происходит в 10 раз чаще, чем трансплацентарная.
В послеродовом периоде эпидемиологическая опасность для новорожденного сохраняется в случаях нарушения женщиной гигиенических норм, а также вследствие передачи вируса с грудным молоком (20% серопозитивных матерей имеют ЦМВ в грудном молоке и 30% из них могут выделять вирус в молоко в течение года после родов) [8].
Перинатальные и постнатальные проявления ЦМВИ у детей почти всегда протекают в легкой форме и асимптоматично.
Многообразие вариантов течения ЦМВИ у беременных связано в большинстве случаев с бессимптомной латенцией и полиморфизмом клинических проявлений заболевания.
Варианты течения ЦМВИ и широкий спектр их проявлений обусловлены сложностью взаимоотношений между ЦМВ и клеткой хозяина.
Нередко клинические симптомы проявляются в виде субфебрильной температуры, ринофарингита, кашля, развития мононуклеозоподобного синдрома.
Диапазон клинических вариантов варьирует от слабо выраженного сиалоаденита и благоприятно текущего мононуклеозоподобного заболевания (лимфоцитоз, атипичные мононуклеары) до тяжелых поражений печени, легких и мозга.
У беременных симптоматическая ЦМВИ обычно проявляется в форме синдрома мононуклеоза, что подтверждается наличием лимфоцитоза, присутствием антител ЦМВ IgG и IgM в сыворотке и культуры ЦМВ в крови, моче, слюне, цервикальных выделениях.
Мононуклеозоподобный синдром характеризуется продолжительной лихорадкой, ознобами, быстрой утомляемостью, болями в мышцах, головными болями, встречается чаще у молодых людей [6].
У беременной женщины наиболее часто происходит обострение хронической ЦМВИ, которая, как правило, не имеет явных клинических проявлений. Однако у данной категории женщин в анамнезе нередко имеются указания на привычное невынашивание или неразвивающуюся беременность, мертворождения, рождение нежизнеспособных детей, а также детей-инвалидов с врожденными пороками развития [11].
Инфицирование возможно в любом триместре, тем не менее наиболее тяжелые последствия возникают при первичной инфекции, возникшей у матери в течение первых 20 недель беременности. Вместе с тем даже при развитии первичной ЦМВИ во время беременности 90-95% женщин имеют шанс родить здорового ребенка [12].
Внутриутробная цитомегаловирусная инфекция может приводить к рождению детей с тяжелыми неврологическими расстройствами, поражениями зрительного и слухового нервов.
Степень поражения плода зависит от срока инфицирования. Заражение на ранних сроках беременности чаще ведет к гибели плода и самопроизвольным выкидышам.
Дети с ЦМВИ (положительным IgM) от серопозитивных матерей имеют более низкий вес и рост при рождении, чем дети серонегативных матерей.
ЦМВ может инфицировать плаценту, плод, амниотическую жидкость. Вирусная культура и характерные цитомегалические клетки могут быть выявлены у плодов от женщин с активной первичной ЦМВИ. Однако наличие признаков или симптомов ЦМВ у плода не всегда является предвестником серьезного заболевания при рождении и в постнатальном периоде.
При выявлении симптомов болезни в течение первых трех недель жизни ребенка ЦМВИ может рассматриваться как врожденная, возникновение заболевания в более поздние сроки чаще характеризует приобретенную форму ЦМВИ (постнатальное инфицирование).
Врожденная ЦМВИ характеризуется, как правило, генерализованным поражением органов плода и целым комплексом клинических симптомов.
Для приобретенной формы ЦМВИ характерно латентное течение, преимущественно с локальным поражением слюнных желез.
У новорожденных, инфицированных внутриутробно, в 90% случаев не бывает симптомов при рождении, у 5-17% их них развиваются осложнения в более позднем периоде [6].
Развитие симптоматики у новорожденного с ЦМВИ коррелируется с симптомами, присутствующими при рождении.
Остальные дети с врожденной ЦМВИ совершенно асимптоматичны и выглядят при рождении здоровыми.
Клинические формы ЦМВИ могут иметь острое или хроническое течение.
По степени тяжести заболевания ЦМВИ выявляют:
- легкую (в том числе стертые и субклинические формы инфекции), при которой поражения внутренних органов незначительны и не сопровождаются функциональными нарушениями (компенсация);
- среднетяжелую, при которой имеется поражение внутренних органов, сопровождаемое функциональными нарушениями различной степени (субкомпенсация);
- тяжелую, при которой резко выражена интоксикация и поражение внутренних органов сопровождается тяжелыми функциональными нарушениями (декомпенсация);
При тяжелом течении врожденной ЦМВИ смерть ребенка чаще наступает в первые дни и недели жизни; при легком — болезнь принимает волнообразное течение.
Следует отметить, что дети с врожденной или перинатальной активной цитомегалией чрезвычайно предрасположены к развитию бактериальных суперинфекций, что обусловлено в первую очередь иммунной недостаточностью.
Симптомы врожденной ЦМВИ включают признаки замедления внутриутробного развития, внутриутробную гипотрофию, конъюгационную желтуху, гепатоспленомегалию, интерстициальную пневмонию, нарушения мозгового кровообращения. Осложнения со стороны ЦНС также очень часты и проявляются у новорожденных повышенной сонливостью, плохим сосательным рефлексом, макро- и микроцефалией, гидроцефалией, порэнцефалией, хориоретинитом, сенсоневральной глухотой [4, 11].
Врожденная ЦМВИ может также иметь необычные проявления, такие как вентрикуломегалия, перивентрикулит или образование кист, гемолитическая анемия, петехии, геморрагическая пурпура, тромбоцитопения, хронический гепатит и асцит [3, 8].
Однако, несмотря на очень большое количество симптомов и осложнений, ассоциируемых с врожденной ЦМВИ, трудно предсказать физическое и интеллектуальное развитие ребенка, основываясь на симптомах, присутствующих при рождении.
Каждое из перечисленных клинических проявлений ЦМВИ заслуживает отдельного рассмотрения.
Гепатомегалия вместе со спленомегалией и петехиями является самым убедительным подтверждением болезни у детей с врожденной ЦМВИ. Обычно присутствуют явления гепатита с нарушениями функции печени (желтуха, гипербилирубинемия).
Функция печени, как правило, нормализуются в первые недели жизни.
Спленомегалия нередко может явиться единственным показателем врожденной ЦМВИ при рождении.
Петехии обычно носят преходящий характер и наблюдаются в течение двух-трех суток после рождения. При врожденной ЦМВИ чаще встречается комбинация петехий с гепатоспленомегалией и тромбоцитопенией.
При исследовании крови выявляется картина гипохромной анемии, эритробластоз, тромбоцитопения.
Врожденная ЦМВИ приводит к ухудшению зрения у 20% детей. Чаще всего наблюдается хориоретинит (односторонний или двусторонний), который может привести к слепоте. Однако врожденная ЦМВИ обычно не вызывает микроофтальмию или катаркту.
Микроцефалия может быть частично причиной замедленного развития новорожденного и сочетаться с внутричерепными кальцификатами, которые локализуются в перивентрикулярной структуре и ликворе.
Компьютерная томография является наиболее чувствительным методом для их определения. Ультразвук и рентгенография черепа относятся к менее чувствительным методам.
Многие дети с микроцефалией и внутричерепными кальцификатами имеют неврологические проявления.
У 10% детей с асимптоматичными проявлениями инфекции могут наблюдаться осложнения, даже в возрасте пяти–семи лет, чаще в виде сенсорной потери слуха, неврологических расстройств или умственного отставания. Половина детей с врожденной ЦМВИ имеют сочетанную потерю слуха. Глухота носит двухсторонний сенсоневральный характер. Нередко также диагностируются врожденные сердечно-сосудистые, гастроинтестинальные, мышечно-скелетные аномалии развития органов [7].
Таким образом, для беременных с цитомегаловирусной инфекцией должен быть предусмотрен комплекс диагностических, профилактических и лечебных мероприятий, направленных на уменьшение случаев возникновения врожденной цитомегаловирусной инфекции, что должно быть обязательным условием создания эффективной системы профилактики и охраны здоровья матери и ребенка.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Вирус Эпштейна–Барр: причины появления, симптомы, диагностика и способы лечения.
Вирус Эпштейна–Барр может инфицировать различные типы клеток, включая B-клетки иммунной системы (разновидность лейкоцитов – белых кровяных телец) и эпителиальные клетки слизистых оболочек.
ВЭБ является представителем ДНК-содержащих вирусов из семейства Herpesviridae (герпесвирусы), подсемейства гамма-герпесвирусов и рода лимфокриптовирусов. В процессе репликации (самокопирования) вируса экспрессируется свыше 70 различных вирусспецифических белков. В настоящее время выделены группы иммуногенных белков, определение антител к которым дает возможность дифференцировать стадию инфекции (ЕА – ранний антиген, ЕВNА-1 — ядерный антиген, VCA — капсидный антиген, LMP — латентный мембранный белок).
Другой способ заражения – контактно-бытовой (вирус передается через зубные щетки, столовые приборы, полотенца и т.д.). ВЭБ также может распространяться через кровь и сперму.
ВЭБ размножается в В-лимфоцитах и эпителиальных клетках, в связи с чем характерно многообразие клинических проявлений данной патологии. Важной отличительной чертой вируса является то, что он не тормозит и не нарушает размножение В-лимфоцитов, а, наоборот, стимулирует его. В этом заключается особенность возбудителя - он размножается в клетках иммунной системы, заставляя их клонировать свою, вирусную, ДНК.
Хронический воспалительный процесс, вызванный ВЭБ, приводит к структурным и метаболическим нарушениям пораженных тканей, что является причиной возникновения разнообразной соматической патологии.
Классификация вируса Эпштейна-Барр
Единой классификации вирусной инфекции Эпштейна-Барр (ВИЭБ) не существует, к использованию в практической медицине предлагается следующая:
- по времени инфицирования – врожденная и приобретенная;
- по форме заболевания – типичная (инфекционный мононуклеоз) и атипичная: стертая, асимптомная, с поражением внутренних органов;
- по тяжести течения – легкая, средней степени и тяжелая;
- по продолжительности течения – острая, затяжная, хроническая;
- по фазе активности – активная и неактивная;
- смешанная инфекция – чаще всего наблюдается в сочетании с цитомегаловирусом.
- Инфекционный мононуклеоз (железистая лихорадка, болезнь Филатова) – распространенное инфекционное заболевание, основными проявлениями которого является подъем температуры до высоких значений, увеличение лимфатических узлов, воспаление слизистой оболочки глотки, увеличение печени и селезенки. ВЭБ в данном случае проникает через эпителий слизистых оболочек верхних дыхательных путей.
- Лимфогранулематоз (болезнь Ходжкина) и некоторые виды неходжкинских лимфом – группа заболеваний, объединенных злокачественной моноклональной пролиферацией лимфоидных клеток в лимфоузлах, костном мозге, селезенке, печени и желудочно-кишечном тракте.
- Синдром хронической усталости – состояние, характеризующееся длительным чувством усталости, которое не проходит после продолжительного отдыха.
- Синдром Алисы в стране чудес – состояние, клиническим проявлением которого является нарушение ощущения своего тела и отдельных его частей. Человек ощущает себя или части своего тела очень большими или очень маленькими по сравнению с действительностью.
- Гепатит, спровоцированный ВЭБ, часто является осложнением инфекционного мононуклеоза. Появляется слабость, тошнота, желтушность кожи и слизистых, увеличивается печень.
- Герпетическая инфекция в виде генитального или лабиального (на губах) поражения. Также возможен стоматит, вызванный ВЭБ. При активации инфекции появляется чувство жжения и боль, а затем множество маленьких пузырьков.
- Посттрансплантационная лимфопролиферативная болезнь – вторичное злокачественное заболевание, развивающееся после трансплантации гемопоэтических стволовых клеток (метод лечения, применяемый при онкологии, заболеваниях крови и др.), ассоциированное с ВЭБ-инфекцией.
- Рассеянный склероз – хроническое аутоиммунное заболевание, при котором поражается миелиновая оболочка нервных волокон головного и спинного мозга. Характеризуется большим количеством симптомов и зависит от уровня поражения: часто снижается мышечная сила, угасают рефлексы, появляются параличи (обездвиженность) различных локализаций.
- Волосатая лейкоплакия – на слизистой оболочке языка по бокам, на спинке либо на его нижней части появляются белые участки с шероховатой поверхностью. Они безболезненны и не причиняют существенного дискомфорта. Основная опасность заключается в возможности озлокачествления измененных клеток слизистой.
- Назофарингеальная карцинома – злокачественное образование глотки. Среди его симптомов часто встречаются заложенность носа, потеря слуха, частые отиты, появление крови в слюне, кровянистые выделения из носа, увеличение лимфоузлов, головные боли.
- Аутоиммунный тиреоидит – хроническое заболевание щитовидной железы, при котором в организме образуются антитела к тканям щитовидной железы. При данном заболевании возможно появление зоба (увеличение щитовидной железы), развитие симптомов гипотиреоза: отеки, повышенная утомляемость, сонливость, запоры, сухость кожи, выпадение волос.
Лабораторное обследование включает:
-
вирус Эпштейна–Барр, определение ДНК в крови (Epstein Barr virus, DNA);
От него не скроешься. Рано или поздно с ним встречается каждый человек. Надо ли его бояться? А может, инфекция совсем безобидна? Паниковать не стоит, но и легкомысленное отношение – ошибка.
— Елена Геннадьевна, что такое вирус Эпштейна-Барр?
— Среди герпес-вирусов насчитывают 8 типов, вызывающих патологии у вида Homo sapiens, то есть у людей. Вирус Эпштейна-Барр – герпес-вирус IV типа. После заражения вирусом Эпштейна-Барр инфекция остаётся в организме навсегда и никогда его не покидает.
Вирус Эпштейна-Барр – один из самых распространённых герпес-вирусов у людей. Восприимчивость к нему человека высока. Многие дети инфицируются до достижения годовалого возраста, а к 40-50 годам инфекция есть в организме практически у каждого.
— Как происходит заражение вирусом Эпштейна-Барр?
Вирус Эпштейна-Барр проникает в организм через верхние дыхательные пути, и уже оттуда распространяется в лимфоидную ткань, вызывая поражения лимфоузлов, миндалин, селезёнки и печени.
При размножении в организме вирус Эпштейна-Барр воздействует на иммунную систему. Механизм воздействия сложен, но в конечном результате за счёт поражения В-лимфоцитов и угнетения Т-клеточного иммунитета происходит подавление выработки интерферона – белка, отвечающего за противовирусную защиту организма.
В современном мире у детей отмечается всплеск заболеваемости, особенно в городах. Наиболее высока вероятность заразиться в местах скопления людей.
— А бессимптомный носитель может быть опасен?
— Чаще всего источником инфекции становится человек в острой стадии болезни. Но передача от бессимптомного носителя не исключена.
— Какую болезнь вызывает вирус Эпштейна-Барр?
— Классическое проявление – инфекционный мононуклеоз. Для него характерны общие интоксикационные симптомы: высокая температура тела, сонливость, вялость, головные боли, боль в горле, увеличение лимфоузлов (или лимфопролиферативный синдром).
Лимфопролиферативный синдром сочетает:
- Поражение рото-, носоглотки: острый фарингит с гипертрофией (увеличением) лимфоидной ткани носоглотки, острые аденоидит и тонзиллит. Это проявляется затруднённым носовым дыханием, храпом во сне.
- Поражение периферических лимфатических узлов (часто поражаются переднешейные, подчелюстные и заднешейные).
Выраженное увеличение шейных лимфоузлов может сопровождаться одутловатостью лица, пастозностью век. - Увеличение печени и селезёнки.
Читайте материалы по теме:
Знать, что ребёнок инфицирован, важно и по другой причине. Вирус Эпштейна-Барр может изменить реакцию на некоторые антибиотики, спровоцировать токсикоаллергическую реакцию. Поэтому следует обязательно своевременно выявлять вирус и сообщать о нём лечащим врачам, они будут подбирать антибиотики с учётом этого факта.
Тяжёлые последствия возникают, если первичное заражение происходит у женщины в период беременности. Вирус Эпштейна-Барр преодолевает плацентарный барьер, это грозит гибелью плода или значительными дефектами развития.
— Есть мнение, что вирус Эпштейна-Барр вызывает гепатит и даже лимфому. Это правда?
— Герпетические вирусы кровотоком разносятся по всему организму, поражают все группы лимфатических узлов. И печень, и селезёнка при остром течении мононуклеоза увеличены. При этом течение болезни обычно благоприятное, здоровье печени полностью восстанавливается.
Утверждать, что вирус Эпштейна-Барр непременно приводит к лимфоме, нельзя. Обнаружить вирус недостаточно: если инфицировано практически всё население планеты, естественно, анализы обнаружат наличие вируса в организме, но ведь лимфомой заболевает далеко не каждый. Конечно, хроническое подавление иммунной системы может приводить к разным нарушениям, в том числе к онкологическим заболеваниям. Но достоверной связи нет. А скомпенсировать иммунные нарушения современная медицина в силах.
Паниковать точно не стоит. Но и надеяться на самостоятельное излечение не надо. Когда ребёнок постоянно болеет, родители зачастую впадают в отчаяние. И хотя избавиться от герпес-вирусов навсегда невозможно, вполне можно облегчить состояние и в разы уменьшить частоту заболеваний. Лечиться можно и нужно.
Подробнее о гепатитах читайте в наших статьях:
— Какими методами можно проверить, присутствует ли в организме вирус Эпштейна-Барр? Какие анализы его выявляют?
Метод ИФА точнее, он в любом случае покажет и наличие инфекции, и выраженность инфекционного процесса. Выводы в данном случае делают по присутствию в крови специфических иммуноглобулинов (антител) к вирусу. Например, если обнаружены иммуноглобулины класса М (IgM), можно говорить об острой фазе инфекции (первичном заражении либо реактивации вируса, когда-то попавшего в организм). Если найдена определённая фракция иммуноглобулина класса G (IgG), это свидетельствует, что организм в прошлом уже сталкивался с инфекцией. Поэтому для определения диагностического метода нужна консультация врача.
— Какими методами лечения вируса Эпштейна-Барр располагает современная медицина?
— Это сложная задача. Если для герпес-вирусов I и II типа (вирусов простого герпеса) есть специфические противовирусные средства, то для вируса Эпштейна-Барр и цитомегаловируса специфической терапии пока не разработали. При лёгком течении болезнь может пройти сама, но при тяжёлом течении с поражением костного мозга медицинская помощь необходима. Лечение направлено на стимуляцию иммунитета, применяются интерфероны. Схему лечения выбирают, исходя из множества факторов, определять её должен только врач.
После излечения вирус продолжает жить в организме. Периодически могут возникать обострения: из-за переохлаждения, длительного пребывания под солнцем, стресса и т. д. Проявления инфекции – всегда повод идти к врачу.
Беседовала Дарья Ушкова
Редакция рекомендует:
Для справки:
Королёва Елена Геннадьевна
Читайте также:

