Что такое рефрактерная инфекция
Обновлено: 22.04.2024
Клостридиальный псевдомембранозный колит (С. difficile-ассоциированный колит)
Патофизиология: гибель нормальных бактерий толстой кишки, вызвванная антибиотиками (от нескольких дней до 10 недель после приема антибиотиков), приводит к колонизации токсинпродуцирующим С. difficile (орально-фекальный путь заражения). Высвобождение токсинов А и В приводит к гибели слизистой и воспалению. В основе различных степеней проявления заболевания лежат: 1) иммунные факторы хозяина и 2) вирулентные факторы микроорганизмов.
Антибиотики, связанные с клостридиальным колитом: любые антибиотики (за некоторым исключением, например, ванкомицин); частота возникновения колита в значительной степени является отражением повсеместного использования соответствующих лекарственных препаратов: пенициллинов, цефалоспоринов, фторхинолонов, клиндамицина и даже метронидазола (несмотря на то, что последний применяется для лечения при С. difficile).
Лечение: от консервативного (легкие и среднетяжелые формы) до колэктомии (тяжелые и жизнеугрожающие формы), которая может спасти больному жизнь.
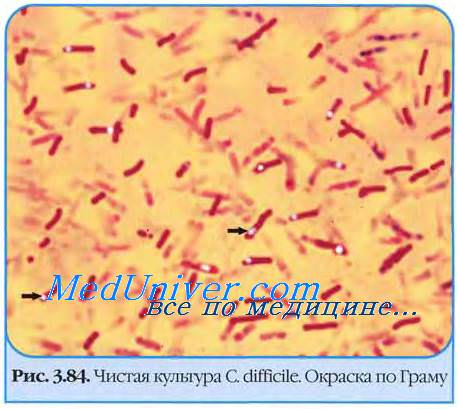
Возбудитель псевдомембранозного колита - Clostridium difficile
б) Симптомы псевдомембранозного колита:
- Осложнения: дилатация толстой кишки (вначале картина как при синдроме Огилви) => токсический мегаколон, перфорация, сепсис, олигурия, полиорганная недостаточность, смерть.
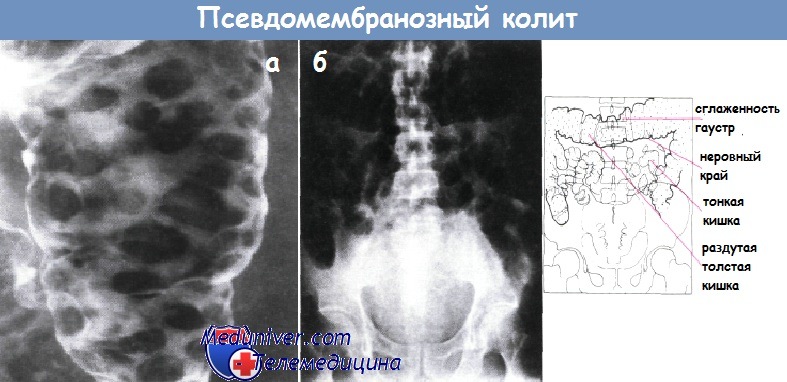
а - Колит, вызванный Clostridium difficile: приподнятый рентгенопрозрачный налет в нисходящей ободочной кишке. Клизма с барием, двойное контрастирование
б - Обзорная рентгенография брюшной полости при псевдомембранозном колите
в) Дифференциальный диагноз клостридиального колита:
• Антибиотико-ассоциированная диарея, несвязанная с С. difficile (80%): неспецифическая диарея, другие патогенные микроорганизмы (Staphylococcus, Clostridium perfringens, Candida albicans и др.).
• Диарея, неассоциированная с антибиотиками: например, секреторная, связанная с пищей, лекарствами (например, НПВП, прокинетиками), нейроэндокринные опухоли и т.д.
• Дисфункция толстой кишки после перенесенной инфекции С. difficile, может длиться в течение недель и месяцев после элиминации С. difficile.
• ВЗК: обострение язвенного колита с суперинфекцией С. difficile.
• Инфекционный колит: Shigella, энтерогеморрагическая Е. coli, Salmonella, Campylobacter и т.д.
• Ишемический колит.
• Дивертикулез.
г) Патоморфология псевдомембраного колита
Микробиология Clostridium difficile:
• С. difficile повсеместно распространенный грамположительный анаэроб, образующий устойчивые к нагреванию споры, способные сохраняться в окружающей среде месяцы и годы => отличие патогенных штаммов от непатогенных состоит в способности продуцировать токсины, вызывающие диарею и колит.
• Инфицирование происходит при проглатывании спор, которые могут выжить в кислой среде желудка и развиться в вегетативные формы в толстой кишке.
• Наличие С. difficile обычно для окружающей среды больниц/учреждений длительного ухода:
- Пол, туалеты, подкладные судна, постельные принадлежности, швабры, весы, мебель.
- Повышение риска в присутствии больного с диареей, недавно получавшего лечение по поводу инфекции С. difficile.
- Медицинский персонал, выступающий переносчиком через руки, галстуки, кольца, стетоскопы.
• Токсины:
- Токсин А (энтеротоксин с массой 308 кДа): секреция жидкости, повреждение слизистой и воспаление.
- Токсин В (цитотоксин с массой от 250 до 270 кДа): в тканевых культурах в 1000 раз более цитотоксичен по сравнению с токсином А, однако не энтеротоксичен у животных. Вызывает распад филаментного актина => разрушение микрофиламентного цитоскелета => округление и смерть клеток.
д) Обследование при псевдомембранозном колите
Необходимый минимальный стандарт:
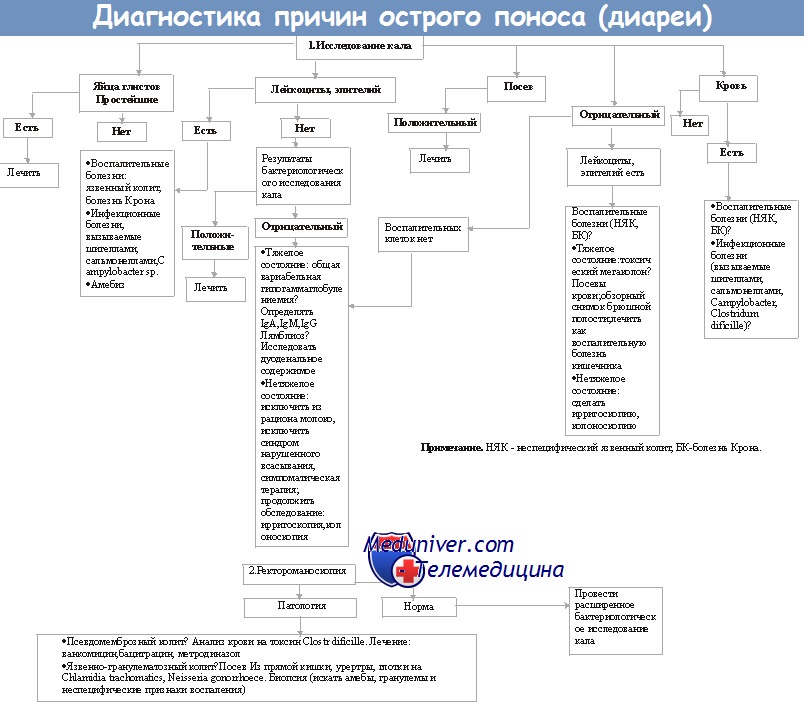
1. Диарея. Анализ кала на токсины С. difficile А и В (посев С. difficile не показан!).
- Цитотоксиновый копрологический тест: чувствительность - 95%, специфичность - 99%, результат - в течение 2-3 дней.
- ELISA (Enzyme Linked Immuno Sorbent Assay - фермент-связанный иммуносорбентный тест) для определения токсина: чувствительность - 70-90%, специфичность - 99%, результат - в течение 4-6 часов.
- ПЦР (полимеразная цепная реакция) на токсин В: чувствительность - 96%, специфичность - 100%, результат - в течение нескольких часов.
ж) Лечение без операции псевдомембраного колита
1. Амбулаторно или в стационаре при легких симптомах:
• Отмена антибиотиков, вызвавших колит.
• Коррекция процесса, лежащего в основе заболевания.
• Уход за перианальной кожей: барьерный крем.
• Монотерапия одним из нижеперечисленных антибиотиков, по крайней мере, в течение 10 дней:
- Метронидазол 3x250-500 мг внутрь (дешевый метод).
- Ванкомицин 4х 125-250 мг внутрь (дорогой метод).
- Рифаксимин 3 х 200 мг внутрь.
2. Стационар при выраженных сопутствующих заболеваниях/ПИТ:
• Отмена антибиотиков, вызвавших колит.
• Лечение текущего заболевания.
• Уход за перианальной кожей: барьерный крем.
• Комбинация двух из нижеперечисленных антибиотиков, по крайней мере, в течение 10 дней:
- Метронидазол 3x500 мг внутрь (дешевый метод).
- Ванкомицин 4х 125-250 мг внутрь (дорогой метод).
- Рифаксимин 3x200 мг внутрь.
• Рефрактерный/рецидивный колит: комбинация ванкомицина и рифаксимина в течение 10 дней, затем ударная доза.
3. Альтернативы:
• Связывающие вещества: холестирамин 3-4x4 г внутрь (также связывает и пероральные антибиотики!), колестипол.
• Другие антибиотики: бацитратцин
• Антидиарейные препараты: следует назначать с осторожностью, противопоказаны до тех пор, пока инфекция неконтролируема.
• Стероиды?
• Пробиотики: например, Saccharomyces boulardii (непатогенные дрожжевые грибки, за исключением больных с центральным венозным доступом в палатах интенсивной терапии), Lactobacillus GG (в целом непатогенны, но могут вызывать бактериемию/абсцессы печени).
• Клизмы с калом или введение кала через колоноскоп от здорового донора (например, супруга): эффективное восстановление флоры толстой кишки.
Ванкомицин применяемый для лечения псевдомембранозного колита
и) Операция при псевдомембранозном колите
Показания:
• Фульминантное течение.
• Токсическая дилатация.
• Перфорация толстой кишки.
• Неэффективность лекарственной терапии, рефрактерное течение или ухудшение. Признаком ухудшения (помимо основных) является нарушение функции других органов и систем (дыхательной, нервной, кровообращения): применение вазопрессоров, стероидов, лейкоцитоз > 20000.
Хирургический подход. Колэктомия с концевой илеостомой у всех без исключения больных.
л) Наблюдение и дальнейшее лечение:
• Экстренная хирургия: планирование последующей операции, т.е. восстановление непрерывности кишечника в плановом порядке, после полного восстановления физического состояния и питания.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Активные вещества: один флакон содержит Цефоперазон натрия (эквивалентный цефоперазону) 250 мг, 500 мг, 1000 мг и Сульбактам натрия (эквивалентный сульбактаму) 250 мг, 500 мг, 1000 мг.
Описание
Фармакотерапевтическая группа
Антибиотик - цефалоспорин + ингибитор бета-лактамаз
Код АТХ
Фармакодинамика:
Цефалоспорин III поколения в комбинации с ингибитором бета-лактамаз. Цефоперазон - полусинтетический цефалоспориновый антибиотик широкого спектра действия предназначенный только для парентерального применения. Действует на чувствительные микроорганизмы во время их активного размножения путем угнетения биосинтеза мукопептида клеточной стенки.
Сульбактам - производное пенициллановой кислоты. Является необратимым ингибитором бета-лактамаз. Сульбактам не обладает клинически значимой антибактериальной активностью (исключение составляют Nеissеriacеae и Acinеtobactеr).
Способность сульбактама предупреждать разрушение пенициллинов и цефалоспоринов устойчивыми микроорганизмами была подтверждена в исследованиях с использованием резистентных штаммов в отношении которых сульбактам обладал выраженным синергизмом с пенициллинами и цефалоспоринами. Сульбактам связывается с некоторыми пенициллинсвязывающими белками поэтому цефоперазон + сульбактам часто оказывает более выраженное действие на чувствительные штаммы чем один цефоперазон. Цефоперазон + сульбактам активен в отношении всех микроорганизмов чувствительных к цефонеразону. Кроме того обладает синергизмом в отношении следующих микроорганизмов: Haemophilus influenzae Bacteroides spp. Staphylococcus spp. Acinetobacter сalcoaceticus Enterobacter aerogenes Escherichia coli Proteus mirabilis Klebsiella pneumoniae Morganella morganii Citrobacier freundii Enterobacter cloacae Citrobacter diversus.
Активен in viiro в отношении широкого спектра микроорганизмов:
гримположительные бактерии - Staphylococcus aureus (и т.ч. штаммы образующие и не образующие пенициллиназы). Staphylococcus epidermidis Streptococcus pneumoniae. Streptococcus pyogenes (бета-гемолитический штамм группы A). Streptococcus agalactiae (бета-гемолитический штамм группы В) большинство штаммов бета-гемолитических Streptococcus spp. Enterococcus faecalis:
грамотрицательные бактерии - Escherichia coli. Klebsiella spp.. Enterobacter spp. Ciirobacier spp. Haemophilus influenzae Proteus mirabilis. Morganella morganii Providencia rettgeri. Providencia spp. Sеrratia spp. (включая Serratia marcescens). Salmonella spp.. Shigella spp.. Pseudomonas aeruginosa. Acinetobacter calcoaceticus. Neisseria gonorrhoeae. Neisseria meningitidis: Bordetella pertussis. Yersinia enterocolitica;
анаэробныебактерии - Bacteroides fragilis. Fusobacterium spp.. Peptococcus spp.. Peptostreptococcus spp.. Veillonella spp. Clostridium spp.. Eubacter spp.. Lactobacillus spp.
Фармакокинетика:
Максимальная концентрация (Cmax) сульбактама и цефоперазона после внутривенного (в/в) введения Бакперазона в дозе 2 г (1 г сульбактама 1 г цефоперазона) достигается в течение 5 мин и составляет в среднем 1302 и 2368 мкг/мл соответственно. Это отражает более высокий объем распределения ( Vd) сульбактама (от 80 до 27.6 л) по сравнению с таковым цефоперазона (от 10.2 до 11.3 л).
Как сульбактам так и цефоперазон хорошо распределяются в различных тканях и жидкостях организма включая желчь желчный пузырь кожу аппендикс фаллопиевы трубы яичники матку.
Примерно 84 % дозы сульбактама и 25 % дозы цефоперазона выводятся почками. Оставшаяся часть цефоперазона выводится в основном с желчью. Период полувыведения (Т1/2) сульбактама составляет в среднем около 1 ч. Т1/2 цефоперазона - 1.7 ч.
У больных с различной степенью нарушения функции почек выявлена высокая корреляция между общим клиренсом сульбактама из организма и расчетным клиренсом креатинина (КК). У больных с терминальной почечной недостаточностью выявлено значительное удлинение Т1/2 сульбактама (в среднем 6.9 и 9.7 ч в различных исследованиях). Гемодиализ вызывал значительные изменения Т1/2 общего клиренса из организма и Vd сульбактама. В то же время существенных изменений фармакокинетики цефоперазона у больных с почечной недостаточностью не выявлено. Т1/2 цефоперазона несколько уменьшается во время гемодиализа.
Фармакокинетика цефоперазона сульбактама изучалась у пожилых людей с почечной недостаточностью и нарушениями функции печени. По сравнению со здоровыми добровольцами выявлено увеличение длительности Т1/2- снижение клиренса и повышение Vd как сульбактама так и цефоперазона. Фармакокинетика сульбактама коррелировала со степенью нарушения функции почек а фармакокинетика цефоперазона - со степенью нарушения функции печени.
Так как цефоперазон активно выводится с желчью то Т1/2 цефоперазона обычно удлиняется а выведение почками увеличивается у больных с заболеваниями печени и/или обструкцией желчных путей. Даже при тяжелом нарушении функции печени в желчи достигается терапевтическая концентрация цефоперазона аТ1/2 увеличивается всего в 2-4 раза. В исследованиях у детей не было выявлено существенных изменений фармакокинетических параметров компонентов цефоперазоп + сульбактам по сравнению с таковыми у взрослых. Средний Т1/2 сульбактама у детей составлял от 0.91 до 1.42 ч цефоперазона - от 1.44 до 1.88 ч.
Показания:
Противопоказания:
С осторожностью:
Беременность и лактация:
Применение препарата в период беременности возможно только в том случае когда предполагаемая польза для матери превышает потенциальный риск для плода. При необходимости назначения препарата в период лактации следует прекратить грудное вскармливание.
Способ применения и дозы:
Взрослым - по 1-2 г препарата каждые 12 ч. При тяжелых инфекциях суточная доза цефоперазона + сульбактама может быть увеличена до 8 г при соотношении компонентов 1:1 (т.е. 4 г цефоперазона). Больным получающим цефоперазон + сульбактам в соотношении 1:1 может потребоваться дополнительное введение цефоперазона. Дозу следует делить на равные части и вводить каждые 12 ч.
У больных с КК 15-30 мл/мин максимальная доза сульбактама составляет I г каждые 12 ч (максимальная суточная доза сульбактама 2 г) а у больных с КК менее 15 мл/мин максимальная доза сульбактама составляет 500 мг каждые 12 ч (максимальная суточная доза сульбактама I г). При тяжелых инфекциях может потребоваться дополнительное введение цефоперазона.
Фармакокинетика сульбактама значительно изменяется при гемодиализе несколько снижается период полувыведения цефоперазона из сыворотки поэтому введение препарата следует проводить после диализа.
Если регулярное мониторирование сывороточной концентрации цефоперазона не проводится то максимальная суточная доза не должна превышать 2 г.
цефоперазон + сульбактам (мг/кг/сут)
Дозу следует делить на равные части и вводить каждые 6-12 ч.
При серьезных или рефрактерных инфекциях эти дозировки могут быть увеличены до 160 мг/кг/сут для соотношения компонентов 1:1. Суточную дозу делят на 2-4 равные части. При необходимости введения более 80 мг/кг/сут рассчитанных по активности цефоперазона увеличение дозы достигается за счет дополнительного введения цефоперазона.
П рименение у новорожденных
У новорожденных в течение первой недели жизни препарат следует вводить каждые 12 ч. Максимальная суточная доза сульбактама у детей не должна превышать 80 мг/кг/сут. Способ приготовлении растворов дли парентерального применения
Эквивалентная доза цефоперазон+ сульбактам г
Объём растворителя мл
Максимальная конечная концентрация мг/мл
Для растворения используют стерильную воду для инъекций (см. таблицу). В случае введения препарата в концентрации превышающей 250 мг/мл рекомендуется приготовление раствора с использованием лидокаина. Разведение проводят в 2 этапа - во флакон содержащий 0.5 г препарата добавляют 0.65 мл стерильной воды для инъекций (во флакон содержащий 1 г препарата - 1.3 мл; во флакон содержащий 2 г - 2.6 мл) взбалтывают до полного растворения а затем прибавляют 02 мл 2 % раствора лидокаина гидрохлорида (во флакон содержащий 1 г препарата - 0.4 мл; во флакон содержащий 2 г - 0.8 мл). Конечный раствор будет содержать в 1 мл 05 % раствора лидокаина гидрохлорида около 250 мг цефоперазона и около 250 мг сульбактама.
В нутривенное введение:
Для в/в введения содержимое флакона растворяют в адекватном объеме (см. таблицу) 5% раствора декстрозы 0.9% раствора NaCL 5% раствором декстрозы в 0.225% растворе NaCI 5% раствором декстрозы в 0.9% растворе NaCl или стерильной воды для инъекций и вводят в течение 3 мин.
Для в/в инфузионного введения растворяют как было указано выше затем разводят до 20-100 мл тем же растворителем и вводят в течение 15-60 мин:
Приготовление раствора с использованием лактата Рингера.
Так как лактат Рингера не пригоден для первоначального разведения раствор готовят в два этапа: сначала используют стерильную волу для инъекций (см. таблицу) а затем полученный раствор разводят раствором лактата Рингера до концентрации сульбактама 5 мг/мл. Инфузию проводят в течение 15-60 мин.
Побочные эффекты:
Со стороны ceрдечно-сосудистойсистемы: артериальная гипотензия
Со стороны желудочно-кишечного тракта: диарея тошнота рвота псевдомембранозный колит.
Аллергические реакции: макулопапулезная сыпь крапивница зуд синдром Стивенса- Джонсона анафилактический шок.
Система кроветворения: кровотечения (дефицит витамина К) снижение числа нейтрофилов. При длительном лечении развивается обратимая нейтропения снижение уровня гемоглобина и гематокрита преходящая эозинофилия тромбоцитопения лейкопения гипопротромбинемия.
Местные реакции: иногда после в/м инъекции наблюдается преходящая боль и жжение в месте инъекции. При в/в введении препарата может развиться флебит в месте введения. Лабораторные показатели: гиперкреатининемия преходящее повышение "печеночных" трансаминаз щелочной фосфатазы и билирубина в сыворотке крови гематурия ложно- положительная проба Кумбса. При использовании раствора Бенедикта или Фединга может наблюдаться ложпоположительная реакция на глюкозу в моче.
Прочие: головная боль лихорадка озноб васкулит.
Передозировка:
Сведения об острой токсичности цефоперазона и сульбактама ограничены. Симптомы: неврологические нарушения включая судороги.
Взаимодействие:
Особые указания:
У больных получавших бета-лактамные антибиотики в т.ч. цефалоспорины описаны случаи развития серьезных реакций повышенной чувствительности (анафилактических) которые иногда приводили к смерти. Риск развития таких реакций выше у тех пациентов у которых в анамнезе наблюдались реакции повышенной чувствительности па различные аллергены. При возникновении аллергической реакции необходимо отменить препарат и назначить адекватную терапию. При анафилактических реакциях необходимо неотложное введение эпинефрина в/в вводят глюкокортикостероиды и обеспечивают проходимость дыхательных путей включая интубацию по показаниям назначают кислород. При тяжелых заболеваниях печени и желчевыводяших путей и особенно сочетающихся с нарушением выводящей функции почек необходима коррекция режима дозирования препарата. У пациентов с печеночной или почечной недостаточностью необходимо постоянное мониторирование сывороточной концентрации цефоперазона и коррекция его дозы в случае необходимости.
При лечении цефоперазоном в редких случаях развивался дефицит витамина К. Причиной его вероятно является подавление нормальной микрофлоры кишечника которая синтезирует этот витамин. К группе риска можно отнести пациентов получающих неполноценное питание пациентов с мальабсорбцией (например при муковисцидозе) и длительно находящихся на в/в искусственном питании. В таких случаях а также у больных получающих антикоагулянты необходимо контролировать протромбиновое время и при наличии показании назначать витамин К.
При длительной терапии рекомендуется периодически контролировать показатели функции внутренних органов включая почки печень и систему кроветворения.
Влияние на способность управлять трансп. ср. и мех.:
способности к управлению транспортными средствами и механизмами в период применения препарата маловероятно.
Форма выпуска/дозировка:
Порошок для приготовления раствора для внутривенного и внутримышечного введения 250 мг+ 250 мг; 05 г + 05 г; 10 г + 10 г.
Упаковка:
По 500 мг 1 г или 2 г активного вещества в стеклянный бесцветный флакон укупоренный серой бутил каучуковой пробкой обкатанный алюминиевым колпачком с дополнительной упаковкой в виде пластмассового колпачка; по 1 флакону вместе с инструкцией по применению в пачку из картона или 50 флаконов (для стационаров) вместе с инструкцией по применению помещают в коробку из картона.
Условия хранения:
Срок годности:
Приготовленный раствор для иньекций годен к применению в течение 24 часов при температуре не выше 25°С.
Условия отпуска
Производитель
Джепак Интернейшенл, B-13, Chand Society, Juhu Church Road, Juhu, Mumbai 400 049, India, Индия
Владелец регистрационного удостоверения/организация, принимающая претензии потребителей:
Бакперазон - цена, наличие в аптеках
Указана цена, по которой можно купить Бакперазон в Москве. Точную цену в Вашем городе Вы получите после перехода в службу онлайн заказа лекарств:
Под лихорадкой неясного генеза (ЛНГ) понимаются клинические случаи, характеризующиеся стойким (более 3 недель) повышение температуры тела выше 38°С, которое является главным или даже единственным симптомом, при этом причины заболевания остаются неясными, несмотря на интенсивное обследование (обычными и дополнительными лабораторными методиками). Лихорадки неясного генеза могут быть обусловлены инфекционно-воспалительными процессами, онкологическими заболеваниями, болезнями обмена веществ, наследственной патологией, системными болезнями соединительной ткани. Диагностическая задача состоит в выявлении причины повышения температуры тела и установлении точного диагноза. С этой целью проводят расширенное и всестороннее обследование пациента.
МКБ-10

Общие сведения
Под лихорадкой неясного генеза (ЛНГ) понимаются клинические случаи, характеризующиеся стойким (более 3 недель) повышение температуры тела выше 38°С, которое является главным или даже единственным симптомом, при этом причины заболевания остаются неясными, несмотря на интенсивное обследование (обычными и дополнительными лабораторными методиками).
Терморегуляция организма осуществляется рефлекторно и является показателем общего состояния здоровья. Возникновение лихорадки (> 37,2°С при подмышечном измерении и > 37,8 °С при оральном и ректальном) связано с ответной, защитно-адаптационной реакцией организма на болезнь. Лихорадка - один из самых ранних симптомов многих (не только инфекционных) заболеваний, когда еще не наблюдается других клинических проявлений болезни. Это служит причиной трудностей в диагностики данного состояния. Для установления причин лихорадки неясного генеза требуется более обширное диагностическое обследование. Начало лечения, в т. ч. пробного, до установления истинных причин ЛНГ назначается строго индивидуально и определяется конкретным клиническим случаем.

Причины и механизм развития лихорадки
Лихорадка продолжительностью менее 1 недели, как правило, сопровождает различные инфекции. Лихорадка, длящаяся более 1 недели, обусловлена, скорее всего, каким - либо серьезным заболеванием. В 90 % случаев лихорадка вызвана различными инфекциями, злокачественными новообразованиями и системными поражениями соединительной ткани. Причиной лихорадки неясного генеза может быть атипичная форма обычного заболевания, в ряде случаев причина повышения температуры так и остается невыясненной.
В основе лихорадки неясного генеза могут лежать следующие состояния:
- заболевания инфекционно-воспалительного характера (генерализованные, локальные) – 30 - 50% от всех случаев (эндокардит, пиелонефрит, остеомиелит, абсцессы, туберкулез, вирусные и паразитарные инфекции и др.);
- онкологические заболевания - 20 – 30% (лимфома, миксома, гипернефрома, лейкемия, метастазированый рак легких, желудка и др.);
- системные воспаления соединительной ткани – 10 -20% (аллергический васкулит, ревматизм, ревматоидный артрит, болезнь Крона, системная красная волчанка и др.);
- прочие заболевания - 10 – 20% (наследственные заболевания и болезни обмена веществ, психогенные и периодические лихорадки);
- недиагностируемые заболевания, сопровождающиеся лихорадкой – примерно 10% (злокачественные образования, а также случаи, когда лихорадка проходит спонтанно или после применения жаропонижающих или антибактериальных средств).
Механизм повышения температуры тела при заболеваниях, сопровождающихся лихорадкой, следующий: экзогенные пирогены (бактериальной и небактериальной природы) воздействуют на центр терморегуляции в гипоталамусе посредством эндогенного (лейкоцитарного, вторичного) пирогена – низкомолекулярного белка, вырабатываемого в организме. Эндогенный пироген оказывает влияние на термочувствительные нейроны гипоталамуса, приводя к резкому повышению теплопродукции в мышцах, что проявляется ознобом и снижением теплоотдачи за счет сужения сосудов кожи. Также экспериментально доказано, что различные опухоли (лимфопролиферативные опухоли, опухоли печени, почек) могут сами вырабатывать эндогенный пироген. Нарушения терморегуляции иногда могут наблюдаться при повреждениях ЦНС: кровоизлияниях, гипоталамическом синдроме, органических поражениях головного мозга.
Классификация лихорадки неясного генеза
Выделяют несколько вариантов течения лихорадки неясного генеза:
- классический (известные ранее и новые заболевания (болезнь Лайма, синдром хронической усталости);
- нозокомиальный (лихорадка появляется у больных, поступивших в стационар и получающих интенсивную терапию, спустя 2 и более суток после госпитализации);
- нейтропенический (количество нейтрофилов < 500 на 1 мкл или их снижение прогнозируется через 1-2 дня при бактериальных инфекциях, кандидозе, герпесе).
- ВИЧ-ассоциированный (ВИЧ-инфекция в сочетании с токсоплазмозом, цитомегаловирусом, гистоплазмозом, микобактериозом, криптококкозом).
По уровню повышения различают температуру тела:
- субфебрильную (от 37 до 37,9 °С),
- фебрильную (от 38 до 38,9 °С),
- пиретическую (высокую, от 39 до 40,9 °С),
- гиперпиретическую (чрезмерную, от 41°С и выше).
По длительности лихорадка может быть:
- острой - до 15 дней,
- подострой - 16-45 дней,
- хронической – более 45 дней.
По характеру изменений температурной кривой во времени различают лихорадки:
- постоянную - в течение нескольких суток наблюдается высокая (~ 39°С) температура тела с суточными колебаниями в пределах 1°С (сыпной тиф, крупозная пневмония, и др.);
- послабляющую – в течение суток температура колеблется от 1 до 2°С, но не достигает нормальных показателей (при гнойных заболеваниях);
- перемежающуюся – с чередованием периодов (1-3 дня) нормальной и очень высокой температуры тела (малярия);
- гектическую – наблюдаются значительные (более 3°С) суточные или с промежутками в несколько часов изменения температуры с резкими перепадами (септические состояния);
- возвратную - период повышения температуры (до 39-40°С) сменяется периодом субфебрильной или нормальной температуры (возвратный тиф);
- волнообразную – проявляющуюся в постепенном (изо дня в день) повышении и аналогичном постепенном понижении температуры (лимфогранулематоз, бруцеллез);
- неправильную – не отмечается закономерности суточных колебаний температуры (ревматизм, пневмония, грипп, онкологические заболевания);
- извращенную – утренние показания температуры выше вечерних (туберкулез, вирусные инфекции, сепсис).
Симптомы лихорадки неясного генеза
Основной (иногда единственный) клинический симптом лихорадки неясного генеза – подъем температуры тела. В течение долгого времени лихорадка может протекать малосимптомно или сопровождаться ознобами, повышенной потливостью, сердечными болями, удушьем.
Диагностика лихорадки неясного генеза
Необходимо точно соблюдать следующие критерии в постановке диагноза лихорадки неясного генеза:
- температура тела у пациента 38°С и выше;
- лихорадка (или периодические подъемы температуры) наблюдаются 3 недели и более;
- не определен диагноз после проведенных обследований общепринятыми методами.
Пациенты с лихорадкой являются сложными для постановки диагноза. Диагностика причин лихорадки включает в себя:
- общий анализ крови и мочи, коагулограмму;
- биохимический анализ крови (сахар, АЛТ, АСТ, СРБ, сиаловые кислоты, общий белок и белковые фракции);
- аспириновый тест;
- трехчасовую термометрию;
- реакцию Манту;
- рентгенографию легких (выявление туберкулеза, саркоидоза, лимфомы, лимфогрануломатоза);
- ЭКГ;
- Эхокардиографию (исключение миксомы, эндокардита);
- УЗИ брюшной полости и почек;
- МРТ или КТ головного мозга;
- консультация гинеколога, невролога, ЛОР-врача.
Для выявления истинных причин лихорадки одновременно с общепринятыми лабораторными анализами применяются дополнительные исследования. С этой целью назначаются:
- микробиологическое исследование мочи, крови, мазка из носоглотки (позволяет выявить возбудителя инфекции), анализ крови на внутриутробные инфекции;
- выделение вирусной культуры из секретов организма, ее ДНК, титров вирусных антител (позволяет диагностировать цитомегаловирус, токсоплазмоз, герпес, вирус Эпштейн-Барра);
- выявление антител к ВИЧ (метод энзим – сцепленного иммуносорбентного комплекса, тест Вестерн – блот);
- исследование под микроскопом толстого мазка крови (для исключения малярии);
- исследование крови на антинуклеарный фактор, LE-клетки (для исключения системной красной волчанки);
- проведение пункции костного мозга (для исключения лейкоза, лимфомы);
- компьютерная томография органов брюшной полости (исключение опухолевых процессов в почках и малом тазу);
- сцинтиграфия скелета (выявление метастазов) и денситометрия (определение плотности костной ткани) при остеомиелите, злокачественных образованиях;
- исследование желудочно–кишечного тракта методом лучевой диагностики, эндоскопии и биопсии (при воспалительных процессах, опухолях в кишечнике);
- проведение серологических реакций, в том числе реакции непрямой гемагглютинации с кишечной группой (при сальмонеллезе, бруцеллезе, болезни Лайма, тифе);
- сбор данных об аллергических реакциях на лекарственные препараты (при подозрении на лекарственную болезнь);
- изучение семейного анамнеза в плане наличия наследственных заболеваний (например, семейной средиземноморской лихорадки).
Для постановки верного диагноза лихорадки могут быть повторно проведены сбор анамнеза, лабораторные исследования, которые на первом этапе могли быть ошибочными или неправильно оцененными.
Лечение лихорадки неясного генеза
В том случае, если состояние пациента с лихорадкой стабильное, в большинстве случаев следует воздержаться от лечения. Иногда обсуждается вопрос о проведении пробного лечения пациенту с лихорадкой (туберкулостатическими препаратами при подозрении на туберкулез, гепарином при подозрении на тромбофлебит глубоких вен, легочную эмболию; антибиотиками, закрепляющимися в костной ткани, при подозрении на остеомиелит). Назначение глюкокортикоидных гормонов в качестве пробного лечения оправдано в том случае, когда эффект от их применения может помочь в диагностике (при подозрении на подострый тиреодит, болезнь Стилла, ревматическую полимиалгию).
Крайне важно при лечении пациентов с лихорадкой иметь информацию о возможном ранее приеме лекарственных препаратов. Реакция на прием медикаментов в 3-5% случаев может проявляться повышением температуры тела, причем быть единственным или главным клиническим симптомом повышенной чувствительности к лекарствам. Лекарственная лихорадка может появиться не сразу, а через некоторый промежуток времени после приема препарата, и ничем не отличаться от лихорадок другого генеза. Если есть подозрение на лекарственную лихорадку, требуется отмена данного препарата и наблюдение за пациентом. При исчезновении лихорадки в течение нескольких дней причина считается выясненной, а при сохранении повышенной температуры тела (в течении 1 недели после отмены медикамента) лекарственная природа лихорадки не подтверждается.
Существуют различные группы препаратов, способных вызвать лекарственную лихорадку:
- противомикробные препараты (большинство антибиотиков: пенициллины, тетрациклины, цефалоспорины, нитрофураны и др., сульфаниламиды);
- противовоспалительные средства (ибупрофен, ацетилсалициловая к-та);
- лекарственные средства, применяемые при заболеваниях ЖКТ (циметидин, метоклопрамид, слабительные, в состав которых входит фенолфталеин);
- сердечно-сосудистые лекарственные препараты (гепарин, альфа-метилдопа, гидралазин, хинидин, каптоприл, прокаинамид, гидрохлортиазид);
- препараты, действующие на ЦНС (фенобарбитал, карбамазепин, галоперидол, хлорпромазин тиоридазин);
- цитостатические препараты (блеомицин, прокарбазин, аспарагиназа);
- другие лекарственные препараты (антигистаминные, йодистые, аллопуринол, левамизол, амфотерицин В).
1. Лихорадка неясного генеза: учебно-методическое пособие/ Низов А.А., Асфандиярова Н.С., Колдынская Э.И. – 2015.

18 мая 2021 г. ACG опубликовала руководство по профилактике, диагностике и лечению инфекции Clostridioides difficile.
1) Не рекомендуется применение пробиотиков для профилактики инфекции Clostridioides difficile у пациентов, получающих антибиотики (первичная профилактика).
2) Не рекомендуется применение пробиотиков для профилактики рецидива инфекции Clostridioides difficile (вторичная профилактика).
3) Алгоритм тестирования инфекции Clostridioides difficile должен включать оба вида тестирования: и высокочувствительный метод, и высокоспецифичный метод, чтобы иметь возможность различить колонизацию от активной инфекции.
4) Рекомендуется применение перорального ванкомицина 125 мг 4 раза в день в течение 10-ти дней для лечения изначального эпизода нетяжелой инфекции Clostridioides difficile.
5) Рекомендуется применение пер-орального фидаксомицина 200 мг 2 раза в день в течение 10-ти дней для лечения изначального эпизода нетяжелой инфекции Clostridioides difficile.
6) Пероральный метронидазол по 500 мг 3 раза в день в течение 10-ти дней может быть рассмотрен для лечения изначального эпизода нетяжелой инфекции Clostridioides difficile у пациентов низкого риска.
7) Как изначальная терапия тяжелой инфекции Clostridioides difficile рекомендуется ванкомицин 125 мг 4 раза в день в течение 10-ти дней.
8) Как изначальная терапия тяжелой инфекции Clostridioides difficile рекомендуется фидаксомицин 200 мг 2 раза в день в течение 10-ти дней.
10) Пациентам с паралитической кишечной непроходимостью добавление клизм с ванкомицином (500 мг каждые 6 часов) может оказать пользу.
11) Предлагается рассмотреть трансплантацию фекальной микробиоты у пациентов с тяжелой и фульминантной инфекцией Clostridioides difficile, рефрактерной к антибиотикотерапии, особенно когда пациенты являются плохими кандидатами на операцию.
12) Рекомендуется постепенное снижение/пульс-дозы ванкомицина у пациентов с первым рецидивом после изначального курса фидаксомицина, ванкомицина или метронидазола.
13) Рекомендуется применение фидаксомицина у пациентов с первым рецидивом после изначального курса ванкомицина или метронидазола.
14) У пациентов со вторым или более рецидивом инфекции Clostridioides difficile рекомендуется трансплантация фекальной микробиоты для предупреждения последующих рецидивов.
15) Рекомендуется выполнение трансплантации фекальной микробиоты через колоноскопию, либо капсулами, для лечения рецидивной инфекции Clostridioides difficile. Предлагается введение микробиоты через клизму, если другие методы не доступны.
16) Предлагается выполнение повторной трансплантации фекальной микробиоты у пациентов, у которых развивается рецидив инфекции Clostridioides difficile в течение 8ми недель после изначальной трансплантации фекальной микробиоты.
17) У пациентов с рецидивной инфекцией Clostridioides difficile: которые не являются кандидатами на трансплантацию фекальной микробиоты; у которых произошел рецидив после трансплантации фекальной микробиоты; которым требуется непрерывные или частые курсы антибиотиков - то таким пациентам может применяться супрессивный пероральный ванкомицин для предупреждения последующих рецидивов.
18) Профилактика пероральным ванкомицином может быть рассмотрена во время последующего системного применения антибиотиков у пациентов с анамнезом инфекции Clostridioides difficile, у которых имеется высокий риск рецидива, чтобы предотвратить последующие рецидивы.
19) Предлагается рассмотреть применение безлотоксумаба для предотвращения рецидива инфекции Clostridioides difficile у пациентов с высоким риском рецидива.
20) Не рекомендуется прекращать антисекреторную терапию у пациентов с инфекцией Clostridioides difficile, в том случае, если данная терапия имеет надлежащее показание для применения.
21) Рекомендуется выполнение тестирования на инфекцию Clostridioides difficile у пациентов с воспалительным заболеванием кишечника, поступающих с острым обострением с диареей.
22) Предлагается применение перорального ванкомицина 125 мг 4 раза в день в течение как минимум 14-ти дней у пациентов с воспалительным заболеванием кишечника и инфекцией Clostridioides difficile.
23) Необходимо рассмотреть трансплантацию фекальной микробиоты при рецидивной инфекции Clostridioides difficile у пациентов с воспалительным заболеванием кишечника.
- Только пациенты с симптомами, предполагающими активную инфекцию Clostridioides difficile должны быть тестированы (3 или более неоформленных стула в течение 24-х часов).
- Рекомендуются следующие критерии, которые являются прогностическими по плохим исходам, для классифицирования тяжелой инфекции Clostridioides difficile в момент установления диагноза: лейкоциты ≥15 тысяч клеток/мм(3), либо сывороточный креатинин более 1,5 мг/дЛ.
- Фульминантная инфекция определяется, когда пациент соответствует критериям тяжелой активной инфекции Clostridioides difficile, плюс наличие гипотензии, либо шока, либо паралитической кишечной непроходимости, либо мегаколон.
По оперативным вмешательствам и по особым популяциям пациентов (беременные, кормящие грудью и др.) смотрите документ.
Подробнее смотрите в прикрепленном файле.
Посмотреть другие обзоры
Автор обзора
Автор обзоров мировой медицинской периодики на портале MedElement - врач общей практики, хирург Талант Иманалиевич Кадыров.
Закончил Киргизский Государственный медицинский институт (красный диплом), в совершенстве владеет английским языком. Имеет опыт работы хирургом в Чуйской областной больнице; в настоящий момент ведет частную практику.
Регулярное повышение квалификации: курсы Advanced Cardiac Life Support, International Trauma Life Support, Family Practice Review and Update Course (Англия, США, Канада).
Что такое псевдомембранозный колит? Причины возникновения, диагностику и методы лечения разберем в статье доктора Аверина Александра Анатольевича, гастроэнтеролога со стажем в 15 лет.
Над статьей доктора Аверина Александра Анатольевича работали литературный редактор Вера Васина , научный редактор Роман Васильев и шеф-редактор Маргарита Тихонова

Определение болезни. Причины заболевания
Псевдомембранозный колит (Pseudomembranous colitis) — это острое воспалительное заболевание толстого кишечника, вызываемое токсигенными штаммами бактерии Clostridium difficile [1] . Микроб вырабатывает токсины А и В, повреждающие кишечную стенку, и белок, угнетающий перистальтику кишечника. В результате возникает диарея, боль в животе, появляется слизь и иногда примесь крови в кале.
Характерным признаком заболевания являются фиброзные наложения на слизистой оболочке толстой кишки [27] [28] .

Псевдомембранозный колит (ПМК) чаще всего развивается после лечения антибиотиками. Его ещё называют Clostridium difficile-ассоциированным псевдомембранозным колитом, антибиотик-ассоциированным псевдомембранозным и клостридиозным колитом.
Эпидемиология
Заболеваемость ПМК лучше всего отслеживается в США и странах западной Европы [2] . В России статистический учёт заражения C. diff не ведётся. Согласно систематическому обзору за 2011 год, каждый 5-й случай из всех антибиотик-ассоциированных диарей (ААД) и каждый 2–3 случай внутрибольничной ААД в странах Европы и Северной Америки вызваны C. diff [3] .
В стационарах США среди внутрибольничных инфекций C. diff занимает первое место (12,1 % от общего количества), опережая K. pneumoniae (9, 7 %) и E. coli (9,3 %) [4] . В 2011 г. было зафиксировано более 450 тыс. случаев C. difficile-ассоциированной болезни и более 29 тыс. смертей от неё [29] .
В европейских странах заболеваемость C. diff составляет около 7 случаев на 10000 койко-дней, т. е. при средней госпитализации 10 дней, 7 случаев из 1000 госпитализаций заканчиваются ПМК. В 20 европейских странах это значение колеблется от 0,7 до 28,7 на 10000 койко-дней [5] .
В России в 2011 году было продано 295 млн упаковок антибиотиков, в 2019 — 379 млн [8] [26] . Антибактериальных препаратов потребляется всё больше, их продажа из аптек не контролируется, поэтому проблемы ААД и ПМК актуальны и в нашей стране.
В клиниках Санкт-Петербурга у пациентов с ААД тест на токсины C. diff был положительным в 47,7 % случаев [6] .
Смертность от ПМК колеблется от 9,3 до 22 % и зависит от возраста пациента, смерть чаще наступает при тяжёлом течении заболевания [7] [26] .
В настоящее время увеличилась внутри- и внебольничная заболеваемость C. difficile-ассоциированной болезнью, расширились группы риска, стали чаще встречаться рецидивы и тяжёлые формы, в том числе вызванные более патогенным штаммом BI/NAP1/027, возросла смертность [27] .
Причины псевдомембранозного колита
Основная причина болезни — это приём антибиотиков. ПМК могут вызывать любые антибактериальные препараты, но наиболее часто к нему приводит применение Клиндамицина, хинолонов, цефалоспоринов 2-го и 3-го поколения, карбапенемов. Реже ПМК развивается после приёма макролидов, пенициллина, Тетрациклина, Тигециклина.
К факторам риска, помимо приёма антибиотиков, относятся:
- возраст старше 65 лет;
- терапия ингибиторами протонной помпы и Н2-гистаминоблокаторами — препаратами, снижающими секрецию соляной кислоты в желудке;
- лечение в стационаре, особенно в отделениях реанимации, — каждые 7 дней госпитализации увеличивают риск ПМК на 8 % [1][9][10] ;
- наличие дополнительной патологии, в том числе воспалительных заболеваний кишечника, ВИЧ, сахарного диабета[31][32][33] ;
- хирургические вмешательства на органах ЖКТ;
- энтеральное питание, в том числе через назогастральный зонд;
- приём иммуносупрессивных препаратов (глюкокортикостероидов, Такролимуса) и противоопухолевых средств [31] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы псевдомембранозного колита
Наиболее частые симптомы лёгкого или умеренного псевдомембранозного колита:
- водянистая диарея (жидкие испражнения, похожие на кашицу) от трёх раз в сутки на протяжении двух и более дней в сочетании с болью в животе;
- лёгкие спазмы в животе, часто сопровождающиеся с позывами на стул, но не всегда приводящие к дефекации;
- примеси слизи, крови или гноя в испражнениях;
- температура тела 38,5 °С и более;
- тошнота или потеря аппетита.
При тяжёлом течении псевдомембранозного колита возникает водянистая диарея с кровью, уровень альбумина снижается менее 30 г/л, что сочетается с одним из следующих симптомов: высоким уровнем лейкоцитов в клиническом анализе крови (> 15×10 9 /л) и/или болезненностью при ощупывании живота. На фоне длительной диареи организм теряет много жидкости, что приводит к обезвоживанию и проявляется тёмно-жёлтой мочой, чувством жажды, усталости, головокружением, спутанностью сознания и заторможенностью [1] [9] .
При рецидиве болезни симптомы появляются повторно менее чем через 8 недель после окончания терапии.
Проявления псевдомембранозного колита схожи с симптомами других инфекций, поражающих толстый кишечник. Но в отличие от них признаки ПМК могут быть слабо выражены и, как правило, наблюдаются долго: от одной недели до нескольких месяцев. Также встречаются случаи, когда человек является носителем возбудителя ПМК — C. diff, но симптомы полностью отсутствуют.
Патогенез псевдомембранозного колита
В основе патогенеза ПМК лежит чрезмерное размножение бактерий C. diff на фоне уменьшения или гибели нормальной микробиоты толстого кишечника. C. diff вырабатывает токсины А и В, которые вызывают воспаление в кишечной стенке. На течение заболевания влияет состояние иммунной системы пациента и патогенные свойства бактерий, такие как вирулентность, наличие токсинов А и В.
Основной путь передачи инфекции — фекально-оральный. Бактерии попадают в организм с загрязнённых поверхностей, например с дверных ручек, смесителей, ручек смыва сливного бачка, мебели или медицинского инвентаря. Также переносить инфекцию может персонал больницы и заражённые пациенты.
Бактерии C.diff образуют споры, которые устойчивы к действию антибиотиков и могут длительно сохраняться в желудочно-кишечном тракте человека, заражая окружающих и вызывая рецидивы заболевания у самого пациента [12] .
Для некоторых людей C.diff — это часть нормальной микрофлоры ЖКТ, но в таком случае численность бактерий контролируется за счёт других микроорганизмов и работы иммунной системы.
Основные поражающие факторы C.diff — это выделяемые ею токсины [1] . Токсин А (энтеротоксин, белковая молекула с массой 308 кДа) влияет на секрецию жидкости, приводит к повреждению слизистой оболочки кишечника (мембран клеток) и вызывает воспалительный ответ со стороны иммунной системы.

Токсин В (цитотоксин, белковая молекула с массой от 250 до 270 кДа) в 1000 раз более цитотоксичен по сравнению с токсином А. Он вызывает распад филаментного актина — белка, поддерживающего целостность клеток. В результате клетки слизистой разрушаются и гибнут. Токсин В опасен для человека, но не приводит к воспалению и повреждению слизистой оболочки кишечника у животных.
Под действием токсинов в кишечной стенке развивается специфическое воспаление с характерными изменениями на поверхности слизистой. Она становится отёчной, разрыхляется, приобретает ярко-красный цвет, на ней исчезает сосудистый рисунок. При контакте эндоскопа со слизистой капельки крови не появляются. Наблюдается множество желтовато-белых бляшек диаметром 3–5 мм, которые плотно фиксированы к слизистой оболочке. При взятии биопсии они отрываются с трудом, торцом эндоскопа не снимаются. Преобладает два типа воспалительных реакций: диффузно-катаральное воспаление слизистой и очаги фибриноидного некроза — бело-жёлтые бляшки, или псевдомембраны, поэтому такой тип колита называется псевдомембранозным.
![Бляшки при ПМК [35]](https://probolezny.ru/media/bolezny/psevdomembranoznyy-kolit/blyashki-pri-pmk-35_s.jpg)
В биоптатах, полученных из воспалительно-изменённых участков слизистой, выявляют скопление иммунных клеток крови и слизистой, расширение капилляров и некроз клеток покровного эпителия [1] .
В биоптатах, взятых из бляшек, присутствует фибрин, обрывки некротизированного покровного эпителия, слизь, лейкоциты, плазматические клетки и колонии бактерий.
Чтобы определить патогенность клостридий, нужно выявить их токсины. Посев биоптатов на питательные среды удовлетворительных результатов не даёт. Метод в данном случае затратен и неинформативен, поэтому токсины C. diff определяют в кале.
Воспалительный процесс, как правило, захватывает несколько отделов толстого кишечника, но чаще поражена его прямая и сигмовидная часть, реже вовлекается вся толстая кишка. Протяжённость её поражения связана с тяжестью течения заболевания: чем больше толстого кишечника вовлечено в воспалительный процесс, тем тяжелее протекает колит и ярче симптомы.
Продолжительное воспаление в кишечной стенке приводит к следующим нарушениям:
- не всасывается жидкость, из-за чего развивается обезвоживание;
- потери крови из образующихся эрозий и язв приводят к анемии;
- кишечная стенка становится проницаемой для токсинов возбудителя и продуктов его жизнедеятельности, находящихся в просвете кишки, из-за чего нарастает общая интоксикация.
При тяжёлом течении прекращается перистальтика толстого кишечника, развивается токсический мегаколон и возникает полиорганная недостаточность, из-за чего пациент может погибнуть.
Классификация и стадии развития псевдомембранозного колита
ПМК входит в группу антибиотик-ассоциированных диарей. В Международной классификации болезней (МКБ-10) псевдомембранозный колит кодируется как АО 4.7 — Энтероколит, вызванный Clostridium difficile.
В зависимости от тяжести течения болезни и клинической картины выделяют следующие формы:
- ПМК лёгкой или умеренной тяжести. Проявляется диареей — неоформленным жидким, кашицеобразным стулом три или более раз в сутки и болью в животе.
- ПМК тяжёлого течения. Сопровождается водянистой диареей с кровью и изменениями в анализах. В биохимическом анализе крови отмечается низкий уровень альбумина (меньше 30 г/л), который сочетается с одним из следующих признаков: высоким уровнем лейкоцитов в клиническом анализе крови (> 15×10 9 /л) в клиническом анализе крови и/или болезненностью при ощупывании живота.
- Осложнённые формы ПМК. Протекают с водянистой диареей с кровью и одним из следующих симптомов: снижение артериального давления, температура тела ≥ 38,5 °C, отсутствие перистальтики тонкого кишечника, помрачение или угнетение сознания. В клиническом анализе крови лейкоциты повышены > 25×10 9 /л или снижены < 2×10 9 /л, возникает органная и почечная недостаточность, требуется искусственная вентиляция лёгких.
- Рецидивирующее течение ПМК. Заболевание развивается повторно менее чем через 8 недель после окончания терапии [1][14] .
Данная классификация используется для выбора схемы лечения.
Осложнения псевдомембранозного колита
Наиболее частые осложнения псевдомембранозного колита:
- Обезвоживание и электролитные нарушения — из-за сильной и длительной диареи нарушается ритм сердца, снижается артериальное давление и мышечный тонус. Чаще эти осложнения развиваются при недостаточном восполнении потерянной жидкости и солей.
- Почечная недостаточность — при стремительном обезвоживании нарушается работа почек, из-за чего снижается частота мочеиспусканий, появляются отёки, по анализам крови видно, что растёт содержание азотистых шлаков.
- Токсический мегаколон — расширение толстой кишки, редкое осложнение с плохим прогнозом. На фоне диареи частота стула резко урежается до одного раза в сутки, в дальнейшем дефекация прекращается полностью. Это происходит из-за замедления и полного прекращения перистальтики толстого кишечника. Из-за распирания толстого кишечника газами и содержимым нарастает вздутие живота, усиливается боль в нём. Интоксикация и электролитные нарушения приводят к резкому ухудшению самочувствия и выраженной слабости. В дальнейшем стенка кишки разрывается, содержимое изливается в брюшную полость (перфорация кишечника) и начинается перитонит. Как правило, это осложнение наблюдается у ослабленных пациентов, находящихся в отделении реанимации и хирургии.
- Перфорация кишечной стенки — образуется сквозное отверстие в кишечной стенке с излитием содержимого кишечника в брюшную полость и развитием перитонита.
- Полиорганная недостаточность — может привести к гибели пациента [1][15] .
Диагностика псевдомембранозного колита
Тесты на C. diff показаны при длительной диарее с болью в животе и/или примесью крови в стуле, возникшей спустя 3–60 суток после выписки из стационара и/или после приёма антибиотиков [1] .
Чтобы выявить токсигенные штаммы C. diff, токсины A и B определяют в кале [16] .
Для этого используют следующие методы:
- Цитотоксиновый копрологический тест. Чувствительность — 95 %, специфичность — 99 %, результат — в течение 2–3 дней.
- ELISA (Enzyme Linked Immuno Sorbent Assay) — фермент-связанный иммуносорбентный тест для определения токсинов. Чувствительность — 70–90 %, специфичность — 99 %, результат — через 4–6 часов.
- ПЦР (полимеразная цепная реакция) на токсин В. Чувствительность — 96 %, специфичность — 100 %, результат — в течение нескольких часов.
Чувствительность теста — это доля положительных результатов среди больных людей, т. е. вероятность правильно определить инфекцию у заболевших, отсутствие ложноотрицательных результатов. Специфичность — доля отрицательных результатов среди здоровых людей, т. е. отсутствие ложноположительных результатов.
Посев кала на C.diff не проводится, так как этим методом не удаётся определить токсигенные штаммы.
С помощью дополнительных методов можно оценить тяжесть состояния пациента и своевременно выявить осложнения.
К дополнительным обследованиям относятся:
- ректороманоскопия или сигмоидоскопия — позволяют обнаружить типичные изменения стенки кишки (множественные желтоватые бляшки 2–10 мм в диаметре, плотно фиксированные на поверхности слизистой оболочки);
- колоноскопия — помимо типичных изменений кишечной стенки, определяется распространённость процесса и поражение толстого кишечника выше сигмовидной кишки [17] ;
- обзорная рентгенография органов брюшной полости — используется, чтобы выявить признаки пареза кишечника и токсического расширения кишки;
- анализ крови — показывает уровень лейкоцитов (при ПМК повышен до 10–50 × 10 9 ), уровень креатинина (выше нормы) и альбумина (ниже нормы).
Гистологическое исследование биоптатов не является необходимым при C. difficile-ассоциированной болезни, но может быть крайне важным для дифференциальной диагностики.
Лечение псевдомембранозного колита
Методы лечения псевдомембранозного колита в российских и зарубежных клинических рекомендациях совпадают [1] [18] . При лёгком и среднетяжёлом течении его проводят в амбулаторных условиях (дома), при тяжёлом и/или осложнённом — в стационаре.
Для лечения ПМК назначаются антибиотики:
Антибиотики подавляют развитие C. diff. Бактерия чувствительна только к трём перечисленным антибактериальным препаратам.
При развитии осложнений ПМК могут применяться следующие методы:
- При токсическом мегаколоне показана колэктомия — удаление толстой кишки.
- Для лечения рецидивирующего ПМК в качестве экспериментального метода рассматривается трансплантация кишечной микробиоты (fecal microbiota transplantation, FMT) [23][24][25] . Кишечную микробиоту берут от здорового донора и при помощи назоинтестинального зонда, клизмы или колоноскопии переносят пациенту в кишечник. В России такое лечение считается экспериментальным. Проводится в научных клинических учреждениях, например в Федеральном научно-клиническом центре ФМБА России.

В качестве вспомогательных и симптоматических препаратов используются:
- Сорбенты (Диоктаэдрический смектит) — эффективно удаляет токсины C. diff, снижая их действие на кишечную стенку, улучшает качество стула.
- Пробиотики (Lactobacillus rhamnosus, Bifidobacterium longum, Bifidobacterium bifidum, Bifidobacterium infantis не менее 1×10 9 КОЕ/г) — подавляют активность C. diff. Данные об их эффективности пока противоречивы [22] .
- Препараты на основе дрожжей Saccharomyces cerevisiae (boulardii) — эффективны как вспомогательные и профилактические средства.
Прогноз. Профилактика
При лёгком или среднетяжёлом течении ПМК и хорошей реакции на стандартную терапию прогноз благоприятный, при тяжёлом и осложнённом — неблагоприятный. При рецидивирующем течении прогноз сомнительный, так как не разработаны эффективные схемы лечения.
Профилактика псевдомембранозного колита
Для профилактики развития ПМК следует:
- чаще мыть руки и соблюдать правила личной гигиены;
- рационально принимать антибиотики — строго по назначению врача с соблюдением всех указаний;
- изолировать пациентов с инфекцией C. diff в отдельные палаты, соблюдать меры санитарного режима;
- тщательно обрабатывать все поверхности хлорсодержащими или другими дезинфицирующими средствами, активными против спор C. diff;
- сокращать сроки госпитализации пациентов старше 65 лет [16] .
Чтобы предотвратить рецидив C. difficile-ассоциированной болезни, после завершения лечения Метронидазолом или Ванкомицином назначаются пробиотики курсом не менее трёх месяцев. Серьёзных побочных эффектов от них не выявлено [34] .
Читайте также:

