Что такое ретровирус и их заболевания
Обновлено: 18.04.2024
Онкогенные РНК-геномные вирусы. Онкогенные ретровирусы. Свойства онкогенных рнк-вирусов.
Онкогенные РНК-геномные вирусы представлены ретровирусами, включёнными в подсемейство онковирусов. Онкогенные ретровирусы широко распространены в природе: они найдены как у различных позвоночных (птиц, человека), так и у беспозвоночных и способны вызвать развитие опухолей у своего хозяина.
Их онкогенный потенциал обусловлен наличием обратной транскриптазы (РНК-зависимой ДНК-полимеразы), обеспечивающей образование из вирусной РНК ДНК-геномного провируса.
Первоначально под контролем обратной транскриптазы в цитоплазме клетки происходит превращение вирусного РНК-генома в неинтегрированную линейную ДНК. В ходе этого процесса происходит дупликация последовательностей РНК, после чего ДНК принимает кольцевую, замкнутую форму.
Затем вирусная ДНК интегрируется в клеточный геном. Встраивание определяет повторяющиеся LTR- [от англ. [ong terminal repeat, длинные концевые повторы] последовательности, имеющиеся на концах провируса.
За счёт инвертированных комплементарных повторов на концах LTR-последовательности проявляют свойства транспозонов и вставочных элементов. После интеграции в хромосомы клетки вирусная ДНК становится матрицей для синтеза вирусного РНК-генома и вирусной иРНК.
Вирус, захвативший клеточный протоонкоген, становится опс+-вирусом, и его легко обнаружить по трансформирующему эффекту на инфицированные клетки, которые начинают бурно размножаться.
Онкогенные ретровирусы вызывают развитие опухолей трёх групп: солидных опухолей (сарком и раков), острых лейкозов (лимфом, миелобластом) и хронического лимфоидного лейкоза.
На основании морфологических и антигенных различий онкогенные ретровирусы разделены на пять типов: А, В, С, D и Т-лимфотропные вирусы.
Наибольшее количество онкогенных вирусов относят к типу С (вызывают лимфоретикулярные новообразования). По своему онкогенному потенциалу все известные онкогенные ретровирусы разделяют на две разграниченные группы:
Высокоактивные опухолеродные вирусы, индуцирующие неопластические заболевания с коротким инкубационным периодом (например, вирус саркомы Рауса).
Вирусы с умеренной активностью, вызывающие развитие неоплазий после длительного латентного периода (например, HTLV).
За редким исключением все вирусы первой группы — двухкомпонентны и состоят из вируса-помощника и дефектного вируса, ответственного за патогенность (см. также главу 5h\B отличие от ДНК-содержащих вирусов, большинство ретровирусов относительно безвредно для клетки-хозяина. Для большинства ретровирусов характерна высокая специфичность по отношению к чувствительным клеткам, и лишь некоторые из них могут инфицировать клетки разных видов животных.
По характеру распространения среди хозяев выделяют экзогенные и эндогенные ретровирусы.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
В 80-х гг. было установлено, что целый ряд заболеваний - от инфекционной эритемы и острого артрита у здоровых в остальном людей до апластических кризов и хронической анемии у ослабленных больных - обусловлены парвовирусной инфекцией. У беременных она может привести к внутриутробной инфекции, водянке плода и его гибели.
Многие тяжелые проявления парвовирусной инфекции связаны с размножением парвовируса в клетках эритроидного ростка костного мозга и их разрушением.
Что провоцирует / Причины Парвовирусной инфекции:
К семейству парвовирусов относится несколько видоспецифических вирусов животных.
Для человека патогенен только парвовирус В19, названный номером образца сыворотки человека, из которой он был впервые выделен. Это мелкий вирус диаметром 20-25 нм без внешней оболочки. Икосаэдрический капсид из двух структурных белков окружает одну плюс- или минус-цепь ДНК. Парвовирус В19 высокоустойчив: он сохраняет жизнеспособность при 16-часовом нагревании при 60°С. В культурах клеток, обычно применяющихся в лабораторной практике, он не размножается и инфекции у лабораторных животных не вызывает. Культивировать его удается в клетках-предшественниках эритроцитов, полученных из костного мозга человека, крови, пуповины или печени плода.
Парвовирусные заболевания встречаются в любое время года, но наиболее распространенное из них - инфекционная эритема - чаще дает вспышки в школах зимой и весной. При таких вспышках заболевает 20-60% детей и еще у многих инфекция протекает бессимптомно.
По данным массовых серологических исследований, антитела к парвовирусу В19 имеют около половины взрослых. Процент серопозитивных лиц быстро повышается с 5 до 18 лет и продолжает возрастать в дальнейшем, что указывает на заражение также и взрослых. Больные заразны в фазе виремии, когда вирус обнаруживают в мазках из зева, секрете дыхательных путей и сыворотке.
Очень заразны больные с апластическими кризами: описана вспышка инфекционной эритемы среди медицинских сестер, в которой несомненным источником инфекции был такой больной. Больные инфекционной эритемой значительно менее заразны.
Механизм передачи инфекции в естественных условиях неясен. По-видимому, она передается воздушно-капельным путем или при непосредственном контакте. Возможно также заражение при инфузии препаратов факторов свертывания, даже обработанных паром и сухим нагреванием.
Патогенез (что происходит?) во время Парвовирусной инфекции:
Благодаря исследованиям на добровольцах известно, что парвовирусная инфекция имеет две фазы.
Первая фаза совпадает с виремией, развивающейся примерно через 6 сут после интраназального введения вируса восприимчивым (серонегативным) лицам. Виремия продолжается около 1 нед; в первые 2-3 сут наблюдаются общие симптомы (головная боль, недомогание, миалгия, озноб, лихорадка, зуд), ретикулоцитопения. В этот период вирус выделяется с секретами дыхательных путей. Через несколько дней происходит незначительное снижение уровня гемоглобина, сохраняющееся в течение 7-10 сут. Исследование костного мозга в этот период выявляет значительное обеднение эритроидного ростка. Иногда бывают легкие лимфопения, нейтропения и тромбоцитопения.
Вторая фаза заболевания наступает через 17-18 сут после заражения. К этому времени виремия прекращается, появляются специфические IgM-антитела. Зги антитела через несколько месяцев исчезают. На несколько дней позже IgM появляются IgG-антитела, которые сохраняются неопределенно долго. В этой фазе вирус из секрета носоглотки исчезает, количество ретикулоцитов в крови нормализуется, в течение 2-3 сут наблюдается пятнисто-папулезная сыпь, на 1-2 сут дольше - артралгия или артрит.
Упомянутые выше исследования показали, что у здоровых людей парвовирусная инфекция быстро проходит без лечения. Ее клинические проявления - инфекционная эритема и артрит - почти несомненно обусловлены образованием иммунных комплексов. В пользу этого предположения свидетельствует развитие инфекционной эритемы у больных с хронической виремией при введении им нормальных иммуноглобулинов.
У больных с хронической гемолитической анемией или иммунодефицитом парвовирусная инфекция часто протекает тяжело, сопровождаясь обширным разрушением эритроидного ростка костного мозга. В то время как здоровые люди легко переносят прекращение эритропоэза на 7-10 сут, при гемолитической анемии, когда компенсация достигается за счет усиленного эритропоэза, разрушение клеток-предшественников эритроцитов обычно приводит к тяжелому апластическому кризу. У больных с иммунодефицитом виремия не прекращается, развивается тяжелая хроническая анемия вследствие постоянного заражения вирусом клеток эритроидного ростка.
Водянка плода при внутриутробной инфекции объясняется его потребностью в значительно более напряженном, чем у взрослых, эритропоэзе в сочетании с незрелостью иммунной системы.
Парвовирус В19 избирательно прикрепляется к мембранному рецептору эритроцитов - антигену Р, чем и объясняется тропность этого вируса к клеткам-предшественникам эритроцитов, особенно к эритробластам и нормобластам. У немногочисленных лиц, не имеющих антигена Р, парвовирус В19 инфекции не вызывает.
Симптомы Парвовирусной инфекции:
Инфекционная эритема (пятая болезнь) - это самое частое проявление парвовирусной инфекции; она встречается в основном у детей и известна также под названием "пятая болезнь", данным ей в конце XIX века как одной из шести детских инфекций, сопровождающихся сыпью.
Протекает заболевание легко. Яркая пятнистая сыпь появляется на щеках ("нашлепанные" щеки). Иногда высыпаниям предшествует субфебрильная температура. Сыпь обычно пятнисто-папулезная и имеет сетчатый, кружевной вид; она быстро распространяется на конечности. Иногда сыпь кореподобная, везикулярная, геморрагическая или сопровождается зудом. Обычно она проходит примерно через неделю, но на протяжении последующих недель могут появляться преходяшие высыпания, особенно при волнении, физической нагрузке, пребывании на солнце, купании, изменении окружающей температуры.
Острая артралгия и артрит - редкие у детей, но частые у взрослых проявления парвовирусной инфекции. Сыпь у взрослых, наоборот, нередко отсутствует или нетипичная - без характерной эритемы на лице. В большинстве случаев артрит симметрично поражает периферические суставы (коленные, суставы кисти и запястья) и обычно проходит через 3 нед, не оставляя деструктивных изменений. Однако у некоторых больных он держится несколько месяцев, в редких случаях - несколько лет. Неизвестно, обусловлен ли затяжной артрит хронической инфекцией или аутоиммунными реакциями. Описаны единичные случаи, в которых предполагается (но не доказана) связь парвовирусной инфекции с идиопатической тромбопитопенической пурпурой, гемофагоцитарным синдромом, панцитопенией, артритом, подобным поражению суставов при лаймской болезни, с рецидивирующей парестезией, фибромиалгией, СКВ, системными васкулитами (в том числе узелковым периартериитом, гранулематозом Вегенера, болезнью Кавасаки).
Парвовирусная инфекция - причина большинства внезапных апластических кризов при почти всех хронических гемолитических анемиях, в том числе серповидноклеточной анемии, ферментопатиях, наследственном микросфероцитозе, талассемиях, пароксизмальной ночной гемоглобинурии, аутоиммунной гемолитической анемии. Кроме того, парвовирусная инфекция может вызвать апластический криз у больных с острой кровопотерей.
Кризы сопровождаются тяжелой анемией с бледностью, слабостью, сонливостью. Часто за неcколько дней до криза отмечаются общие симптомы. Глубокая ретикулоцитопения держится 7-10 сут. Клетки эритроидного ростка в костном мозге отсутствуют, хотя клеток гранулоцитарно-моноцитарного ростка достаточно. Уровень гемоглобина может упасть до угрожающего жизни предела, требующего неотложного переливания крови.
В отличие от инфекционной эритемы и артрита апластический криз сопровождается виремией, и такие больные заразны.
У больных с иммунодефицитом, вероятно, из-за неспособности вырабатывать в достаточном количестве IgG-антитела, парвовирус В19 не элиминуеруется из организма. Развивается хроническая инфекция с разрушением клеток-предшественников эритроцитов в костном мозге и анемией, требующей регулярных переливаний крови. Такая анемия описана при ВИЧ-инфекции, врожденных иммунодефицитах, поддерживающей химиотерапии острого лимфобластного лейкоза, у реципиентов костного мозга.
Хроническая парвовирусная инфекция может быть причиной идиопатической аплазии эритроидного ростка. Анемия, обусловленная этой инфекцией, иногда бывает единственным проявлением нераспознанного иммунодефицита. Анемия может протекать волнообразно; ее удается излечить или добиться улучшения с помощью нормальных иммуноглобулинов. Спектр иммунодефицитов, при которых наблюдается хроническая анемия, вызванная парвовирусом В19, и распространенность подобного сочетания пока не изучены.
В большинстве случаев парвовирусная инфекция у беременных не приводит к инфицированию плода и вредного воздействия на него не оказывает. Однако почти у 10% беременных, перенесших парвовирусную инфекцию, плод погибает от неиммунной водянки. Смерть плода наступает от тяжелой анемии и сердечной недостатости. Вирус обнаруживают в тканях плода, особенно в эритробластах и нормобластах. Беременным, которые могут заразиться парвовирусом В19, необходимо периодически определять титр IgM и уровень альфа-фетопротеина и проводить повторные УЗИ, чтобы своевременно выявить водянку плода. В некоторых случаях плод переносит водянку и рождается здоровым или, реже, - с врожденной анемией и гипогаммаглобулинемией, не поддающейся лечению нормальными иммуноглобулинами.
Диагностика Парвовирусной инфекции:
Парвовирусную инфекцию обычно подтверждают измерением титров специфических IgM и IgG с помощью готовых наборов для ИФА. Иногда выделяют вирус из сыворотки или тканей или выявляют в них вирусные антигены и ДНК. Об острой инфекции свидетельсвуют характерная клиническая картина и высокий титр IgM или выделение самого вируса, о давно перенесенной - высокий титр IgG.
При инфекционной эритеме и остром артрите вирус из сыворотки обычно не удается выделить, но титр IgM высокий. При апластических кризах параллельно с высоким титром IgM в сыворотке определяют большое количество вируса или eго ДНК. В костном мозге обнаруживают характерные гигантские эритробласты и гипоплазию эритроидного ростка. У больных с иммунодефицитом антитела часто не удается определить но в сыворотке обнаруживают вирус или его ДНК.
Диагноз внутриутробной инфекции подтверждает водянка плода при наличии в околоплодных водах или крови плода вирусной ДНК в сочетании с высоким титром специфических IgM у беременной.
Лечение Парвовирусной инфекции:
Инфекционная эритема и артрит в большинстве случаев лечения не требуют. При тяжелом, в частности затяжном, артрите используют НПВС. При апластическом кризе обычно требуются переливания эритроцитарной массы. При анемии у больных с иммунодефицитом применяют нормальный иммуноглобулин для в/в введения, содержащий антитела к парвовирусу В19. С его помощью удается добиться излечение или хотя бы подавления парвовирусной инфекции.
Профилактика Парвовирусной инфекции:
При контакте с парвовирусной инфекцией профилактическое применение этого препарата показано больным с иммунодефицитом и хронической гемолитической анемией и беременным, однако действенность такой иммунопрофилактики, проведенной непосредственно перед или сразу после заражения, не установлена.
Чтобы уменьшить вероятность заражения, лицам группы риска следует мыть руки перед едой и после контакта с больными.
Больные с апластическим кризом и хронической инфекцией, вызванной парвовирусом В19, в отличие от больных инфекционной эритемой и артритом представляют собой источник больничной инфекции. Их госпитализируют в отдельные палаты и соблюдают контактную и респираторную изоляцию.
Вакцина против парвовируса В19 пока не создана, но исследуется возможность ее получения с помощью зараженной рекомбинантным бакуловирусом линии клеток насекомых, которая экспрессирует белки капсида парвовируса В19, не вызывающие заболевание, но обладающие иммуногенными свойствами.
К каким докторам следует обращаться если у Вас Парвовирусная инфекция:
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Парвовирусной инфекции, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору .
Ретровирусы. Семейство ретровирусов. Виды ретровирусов.
Ретровирусы содержат две идентичные молекулы геномной РНК и РНК-зависимую ДНК-полимеразу (обратную транскриптазу, ревертазу). Ретровирусы выделены от множества видов животных и проявляют разнообразный спектр патогенного потенциала. Семейство включает вирусы 7 родов: альфа-, бета-, гамма-, дельта-, эпсилонретровирусы, лентивирусы и спумавирусы. Семейство включает вирусы, патогенные для человека и многих видов животных.
Большинство ретровирусов обладают выраженным тропизмом к клеткам лимфОретикулярной и гемопоэтической системы. Ретровирусы у специфических для них видов животных встречаются повсеместно. В борьбе с ретровирусными инфекциями основной мерой является предотвращение передачи вируса.
Вирионы ретровирусов представляют собой округлые оболочечные частицы диаметром 80—100 нм, обладающие уникальной трехслойной структурой. Центральная часть вириона представлена нуклеопротеиновым комплексом, который включает около 30 молекул ревертазы и имеет спиральную симметрию. Эта структура окружена икосаэдрическим капсидом диаметром около 60 нм, покрытым оболочкой, происходящей из мембраны клетки, от которой отходят гликопротеиновые пепломеры. Лентивирусы имеют на поверхности примерно 72 шишкоподобных пепломера длиной около 10 нм с яйцевидным концевым уплотнением.
Ретровирусы имеют диплоидный геном, представляющий инвертированный димер из двух молекул линейной позитивной полярности, оцРНК; каждая молекула содержит 7-11 тн и имеет полиА последовательность на З'-конце и КЭП-структуру на 5'-конце. Детальная организация геномов разных ретровирусов широко варьирует.
Геном ретровирусов уникален в следующих отношениях:
1) является единственным диплоидным;
2) вирусная РНК синтезируется и изменяется с помощью механизма, изменяющего клеточную мРНК;
3) это единственный геном, связанный со специфическим переносом функции РНК целиком к первичной репликации;
4) это единственная оц(+)РНК, которая не является мРНК вскоре после инфекции;
5) это единственный геном, кодирующий обратную транскриптазу, которая сама по себе уникальна.
Среди многих своих функций обратная транскриптаза служит в качестве РНК-зависимой ДНК полимеразы, а ДНК-зависимая ДНК полимераза, интеграза и РНКаза, каждая в меру своей определенной функции, представляют различную часть белковой молекулы. Геном недефектных ретровирусов содержит три разных гена, каждый из которых кодирует два и более белка. Gag ген кодирует вирионные коровью белки, pol ген кодирует обратную транскриптазу, a env ген кодирует вирионные пепломерные белки. Геном кодирует также несколько определенных вирионных компонентов.
Геном быстро трансформирующих ретровирусов содержит четвертый ген — вирусный онкоген (v-onc). Присутствие онкогена обычно связано с делецией в другом месте генома, обычно в env гене, так что большинство v-onc содержащих вирусов не способны синтезировать полностью оболочку и поэтому являются дефектными по репликации. Они всегда находят связь с недефектными вирусами, которые реплицируются полностью и функционируют в качестве помощников. Вирус саркомы Рауса является исключением. Его геном содержит вирусный онкоген v-src и также полные gag, pol и env гены, и поэтому является репликативнокомпетентным.
Vpu, vpr и vpx найдены в лентивирусах приматов. Vpu способствует созреванию вирусных гликопротеинов и освобождению вирионов почкованием; Vpr -слабый активатор транскрипции; Vpx, по-видимому, способствует репликации в Т-лимфоцитах и макрофагах.
При продуктивной инфекции вирионы формируются и освобождаются почкованием через плазматическую мембрану. Некоторые ретровирусы вызывают образование опухолей.
Спумавирусы являются необычными ретровирусами во многих отношениях. Они выделены от человека, обезьян, КРС, кошек, морских львов и хомяков. Они представляют проблему, когда контаминируют клеточные культуры, но их связь с заболеваниями неизвестна. Существует мнение, что пенящие вирусы ближе стоят к ДНК гепаднавирусам.
Эндогенный ретровирус свиней (PERV) найден у всех исследованных пород свиней. Известны три субгруппы этого вируса: А, В и С. Все свиньи содержат множественные провирусы (около 50) в своем геноме. PERVлатентно инфицирует многие культуры клеток свиньи и, реже, человека. Патогенность этого вируса не установлена.
Онковирусы, в отличие от лентивирусов, реплицируются в делящихся клетках. В составе ретровирусов обнаружено 11-13 белков. Часть из них локализована в сердцевине, а главный внутренний белок Р27 - Р30 - в мембране, окружающей РНК. В составе липопротеиновой оболочки 2-5 гликопротеинов, из которых более крупный образует головку шипика и является главным компонентом оболочки, а более мелкие белки образуют отросток, погруженный в билипидный слой. Различные белки ответственны за групповую и типовую специфичность. Подгрупповые и типоспецифические антигены связаны с наружными гликопротеинами и выявляются в РН, РСК, ИФ и РИД. Группоспецифические антигены связаны с белками сердцевины. Их обнаруживают в РСК, ИФ и РИД. Главный внутренний белок Р27 - РЗО - основной группоспецифический антиген, общий для всех ретровирусов птиц или млекопитающих, относящихся к одной группе.
Согласно предложенной ранее номенклатуре структурные белки ретровирусов обозначали следующим образом: МА - матриксный, СА - капсидный, NC -белок нуклеокапсида, SU - поверхностный, ТМ - трансмембранный, PR- протеаза, RT - ревертаза, IN - белок интеграции.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
РНК-вирусы как причина развития рака - вирусный канцерогенез
Открытие вирусов, вызывающих злокачественные опухоли у животных, произошло еще на рубеже XIX и XX веков. В 1910 г. Пейтон Рауш обнаружил, что бесклеточный фильтрат из тканей птичьей саркомы может вызывать развитие аналогичной саркомы у цыплят. Примерно в это же время была доказана вирусная природа птичьего миелобластоза. Позднее было обнаружено, что часто проходит весьма значительный латентный период между инфицированием вирусом и развитием рака.
Тем не менее вплоть до 1960-х годов не существовало четких доказательств того, что инкорпорация вирусной ДНК в геном клетки является необходимым условием развития злокачественной трансформации, как не было и случаев выделения вирусной ДНК из раковых клеток.
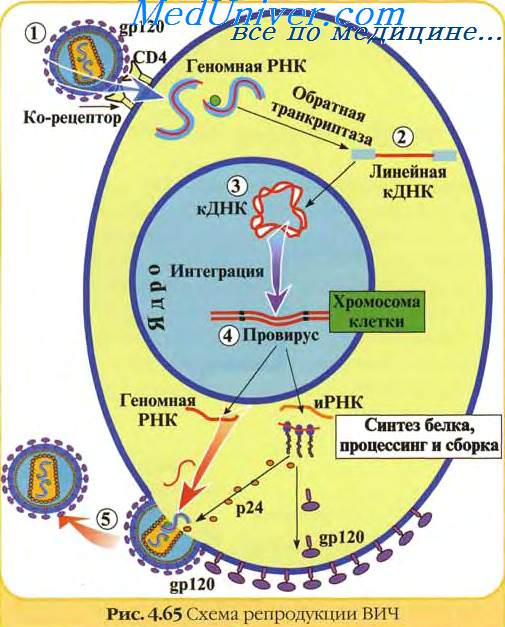
РНК-содержащие вирусы вызывают развитие целого ряда различных опухолей у животных, при этом наиболее распространена индукция этими вирусами лимфом, лейкемий и сарком. Типичная структура таких вирусов - это две идентичные цепочки молекул РНК в сочетании с ферментом обратная транскриптаза, одетых в гликопротеиновую оболочку. При инфицировании вирусом его обратная транскриптаза заставляет клетки синтезировать ДНК, комплементарную вирусной РНК.
Эта ДНК затем встраивается в клеточные хромосомы, и на ее основе клетка уже сама начинает синтез новых вирусных белков, вирусных обратных транскриптаз и элементов гликопротеиновой оболочки. Из-за механизма их действия этот тип вирусов получил название ретровирусы. Все они имеют весьма схожий внешний вид на электронных микрофотографиях и являются самыми маленькими из известных вирусов.
Некоторые из ретровирусов (например, вирусы птичьего лейкоза, кошачьей и мышиной лейкемии) содержат в себе только три гена и обладают очень длительным инкубационным периодом с момента заражения до возникновения опухоли. Другие вирусы (например, вирус саркомы Рауса (ВСР)) вызывают очень быструю злокачественную трансформацию и могут быть выделены из культуры опухолевых клеток.
Показано, что вирус ВСР содержит особый ген (v-src), способный вызывать трансформацию фибробластов in vitro. Этот ген кодирует наработку протеинкиназы, которая фосфорилирует тирозин. К сожалению, действие этой протеинкиназы запускает целый каскад различных метаболических процессов, и очень сложно оценить, какой именно из них ведет к злокачественной трансформации.
В настоящее время известно, что и нормальные, и злокачественные клетки содержат в своем генотипе участки ДНК, сходные или идентичные ряду последовательностей онкогенных РНК-содержащих вирусов. Такие участки получили название клеточных прото-онкогенов (чтобы отличать их от вирусных онкогенов). Постулируется, что активация этих участков, возникающая в результате канцерогенного воздействия, запускает целую цепочку событий, ведущую в итоге к злокачественной трансформации клетки. Считается также, что ретровирусы инкорпорировали эти клеточные участки в свой геном в процессе эволюции.
В настоящее время мы лучше понимаем механизмы действия продуктов вирусной активации. Примером такого продукта является протеинкиназа, активируемая геном sre, а также целый ряд других вирус-индуцированных канцерогенов. Это и рецепторы к эпидермальному фактору роста, продуцируемые геном v-erb, и тромбоцитарный фактор роста (ТФР), кодируемый фрагментами гена v-sis, и целый ряд связывающихся с ядром клетки белков, продукцию которых вызывает вирус птичьей лейкемии.
Как нормальные, так и раковые клетки содержат в себе участки последовательностей ДНК, гомологичные РНК онкогенных вирусов. Если происходит экспрессия или активация под действием канцерогенов этих клеточных онкогенов, это ведет к злокачественной трансформации клеток.
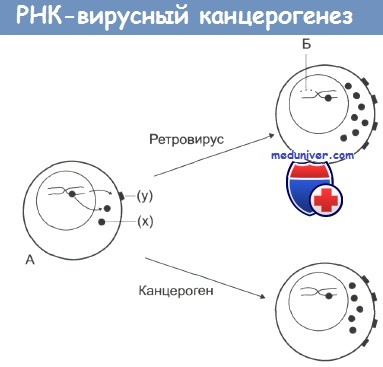
Онкогенная и злокачественная трансформация.
На стадии А нормальная клетка, которая характеризуется низкой протоонкогенной активностью, продуцирует фактор роста (х) или белки дифференцировки или рецепторы (у).
Канцерогены повышают активность протоонкогенов, что дает начало неопластической трансформации.
По другому механизму: при заражении ретровирусом происходит внедрение в ДНК клетки вирусных промоторов или онкогенов (Б), что также ведет к увеличению онкогенной активности и последующей злокачественной трансформации.
Первым ретровирусом, для которого была однозначно доказана связь со злокачественными новообразованиями, был вирус Т-клеточной лейкемии человека (ВТКЛ-1), выделенный из клеток хронической кожной Т-лимфомы. Этот вирус довольно широко распространен, может передаваться половым путем, через кровь, особенно в среде наркоманов, и от беременной женщины к плоду. Первоначально эндемический ареал циркуляции данного вируса был в основном представлен тропическими странами, однако в настоящее время в США серопозитивная реакция на вирус обнаруживается у каждого из 4000 человек населения. Кроме Т-клеточной лейкемии вирус вызывает тропический спастический паралич.
После 20 лет наблюдения за серопозитивными пациентами оценено, что риск развития последнего заболевания составляет около 5%. Один из вирусных генов, а именно tax-ген, вызывает увеличение продукции клеточного интерлейкина-2 (ИЛ-2) и его рецепторов, что является основным фактором, стимулирующим деление Т-клеток.
Ретровирусы могут вызывать опухолевые заболевания не напрямую, а опосредованно, как это было показано для вируса иммунодефицита человека (ВИЧ-1), вызывающего развитие СПИДа. Случаи развития рака у ВИЧ-инфицированных рассмотрены в одном из обзоров. Отмечается, что у ВИЧ-инфицированных наиболее часто развиваются три типа опухолей: мгновенная или высокозлокачественная В-клеточная лимфома; саркома Капоши (СК, которую вызывает другой вирус — герпесвирус ГСК, или герпесвирус 8); карцинома шейки матки.
До разработки эффективных методов терапии ВИЧ-инфицированных более 40% из них заболевали тем или иным видом рака. Тем не менее связь этого вируса с развитием онкологических заболеваний скорее всего косвенная и опосредована развитием общей хронической иммунодепрессии организма, которая и позволяет другим канцерогенным вирусам вызывать рак. В-клеточные лимфомы также характеризуются довольно сложным патогенезом. Хотя В-клетки не поражаются вирусом ВИЧ-1, они могут быть мишенью для других типов вирусов, например для вируса Эпштейна-Барра (ВЭБ). Рак шейки матки у женщин также развивается на основе вторичной вирусной инфекции — вируса папилломы человека (ВПЧ), на фоне общей иммунодепрессии, вызванной ВИЧ-1. По причине общего снижения иммунных реакций организма все эти опухоли развиваются особенно быстро и агрессивно.
Показано, что РНК-содержащий вирус гепатита С значительно увеличивает риск заболевания гепатоклеточной карциномой. У больных, инфицированных этим вирусом, риск развития раковой опухоли возрастает в 100 раз, но механизмы его канцерогенного действия в настоящее время почти не изучены. Если больной заражен еще и вирусом гепатита В, риск развития рака печени возрастает многократно. На земном шаре одним или обоими из этих вирусов заражено около миллиарда человек.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021

Уже много лет между эволюционистами и креационистами продолжается спор о том, как же все-таки произошел человек — путем эволюции или божественного сотворения? К счастью, древние вирусы на протяжении миллионов лет ведут летопись эволюции и записывают ее в нашу ДНК.
После расшифровки нуклеотидной последовательности ДНК многих животных, в том числе и человека, стало возможным узнать, где именно в геноме находятся эти остатки древних вирусов. И взору ученых предстала строгая упорядоченность расположения эндогенных ретровирусов — выяснилось, что все они находятся в геномах в строго определенных местах. Некоторые из них характерны лишь для человека или для кошки и не встречаются у других животных. Другие же ретровирусы можно обнаружить в одном и том же месте, к примеру, в геномах гориллы, шимпанзе, орангутанга и человека.
Почти половина генома

У разных ретротранспозонов (транспозон — мобильный элемент ДНК) процесс обратной транскрипции имеет свои особенности.
У ретротранспозонов с длинными концевыми повторами (LTR-ретропозоны) обратная транскрипция происходит не в ядре, а в цитоплазме. Так как по своему строению и механизму перемещения LTR-ретропозоны имеют большое сходство с вирусами, данный класс подвижных элементов называют ретровирусоподобными. Их содержание в геноме человека — около 8% всей последовательности нуклеотидов.
Ко второму классу ретротранспозонов, без длинных концевых повторов (non-LTR), относятся элементы LINE (Long Interspersed Elements — длинные перемежающиеся элементы) и SINE (Short Interspersed Elements — короткие перемежающиеся элементы). Перемещение и встраивание ДНК-копии этих элементов происходит не в цитоплазме, а в ядре. Элементы LINE — самые многочисленные из подвижных структур человека: они занимают в ДНК пятую часть (около 20%) от всей последовательности нуклеотидов. И они же единственные из мобильных генов человека, сохранившие до сих пор свою самостоятельную способность к перемещению.
Одомашненные вирусы
Транскрипция — это перенос генетической информации с ДНК на рибонуклеиновую кислоту (РНК), при котором ДНК используется в качестве отправной точки, матрицы. Транскрипцию можно наблюдать всякий раз, когда осуществляется синтез новых белков. До открытия американцами обратной транскрипции считалось, что движение в направлении от РНК к ДНК невозможно. Но, как оказалось, этот генетический метод активно используется в живой природе, в том числе и такими опасными ее представителями, как вирусы (среди которых и самый опасный для человека — ВИЧ).
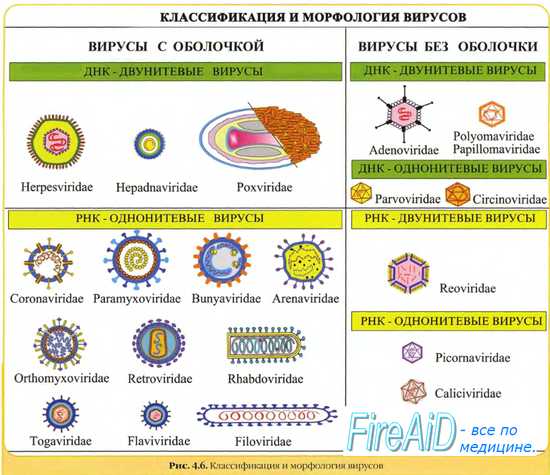
Жизненный цикл ретровируса

Вирус прикрепляется к строго определенным клеткам хозяина благодаря образованию связей белков капсида и рецепторов на поверхности клетки. После проникновения в клетку собственные ферменты или ферменты клетки хозяина разбирают капсид. Вирусная РНК высвобождается и подвергается обратной транскрипции: обратная транскриптаза формирует по матрице РНК цепочки ДНК, а интеграза инициирует проникновение провирусной ДНК в ядро и включение ее в геном хозяина. В ядре происходит процесс репликации (повторной сборки) вирусной РНК, который уже стал неотъемлемой функцией генома хозяина. В хозяйской цитоплазме вирусная РНК обзаводится капсидом. Отпочковываясь от клетки, обновленный вирус прихватывает с собой часть мембраны хозяина, используя ее в качестве собственной оболочки.
Устройство вириона

РНК ретровируса располагается в белковой оболочке под названием капсид. Наружная липидная оболочка покрыта ворсинками длиной 8−10 нм. Вирион имеет форму икосаэдра (двадцатигранника) и диаметр 80−100 нм.
Двигатель прогресса
Еще в конце 1980-х годов можно было встретить утверждение о том, что ретровирусы не способны вызывать эпидемический процесс. И отсюда — бесплодные попытки ученых создать вакцину против ВИЧ. Ретровирусы и сегодня не утратили своей способности вызвать большую пандемию. Однако ретровирусы, по мнению ученых, могут быть полезными. Предполагается, и не без оснований, что они сослужили нам хорошую службу в процессе эволюции, передав человеку и другим живым организмам свои структурные элементы, ставшие впоследствии нашими генами.

Как мы строим супервирус
Сегодня уже точно известен целый ряд важных генов, берущих свое начало от ретроэлементов. Прежде всего это некоторые гены, участвующие во внутриутробном развитии плода. Несколько лет назад появились данные, что ретровирусы могли сыграть весомую роль в эволюции плацентарных животных. Появление у древних организмов плаценты — важный этап их эволюционного развития в сторону усложнения. Плацента позволила предкам человека продлить внутриутробное развитие. Именно с этим сегодня связывают кардинальные изменения у млекопитающих, живших около 60 млн лет назад, — увеличение размеров мозга и постепенное развитие умственных способностей.
Основной целью российских биологов был поиск ретровирусов hsERV, которые осуществляют функции энхансеров (усилителей). Энхансеры — это нуклеотидная последовательность с регуляторными функциями, которая обычно находится вблизи (или внутри) генов и повышает их экспрессию. Из всех обнаруженных на сегодня hsERV лишь шесть копий находились в районах обычного расположения энхансеров. Изучив эти шесть ретровирусов, исследователи смогли выявить один hsERV, расположенный вблизи важного гена PRODH.
Ген PRODH кодирует фермент пролиндегидрогеназу, связанный с синтезом глутамата, одного из нейромедиаторов, стимулирующего передачу сигналов возбуждения в нервной системе. У шимпанзе аналогичный ген во всех местах его расположения (в гиппокампе, префронтальной коре и хвостатом ядре) не имеет рядом с собой участка ДНК с эндогенными ретровирусами и менее активен по сравнению с человеческим. Есть основания полагать, что внедрение ретровируса вблизи этого гена сыграло весомую роль в развитии умственных способностей человека.
Хозяева Земли
По мнению Супотницкого, именно ретровирусы (и ретроэлементы) — настоящие хозяева Земли. Они возникли раньше нас в процессе эволюции, принимали активное участие в создании сложных организмов и вполне способны ради большего разнообразия видов сгубить все человечество.
Автор выражает большую благодарность
д. б. н. А. А. Буздину (Институт биоорганической химии РАН)
за помощь при написании статьи.
Читайте также:

