Что такое ревматоидная интоксикация
Обновлено: 19.04.2024
Серонегативный ревматоидный артрит начинается и протекает не совсем так, так типичный, серопозитивный артрит. К этому прибавляются трудности диагностики и лечения заболевания.
Статистика заболеваемости
Это хроническое системное воспалительное заболевание соединительной ткани аутоиммунной природы с преимущественным поражением и деформацией суставов и внутренних органов. Серонегативные формы артрита характеризуются тем, что в отличие от серопозитивной формы в крови и суставной жидкости больных не выявляется ревматоидный фактор (РФ) – антитела к иммуноглобулину G, трансформирующегося в чужеродный для организма белок – антиген. Код болезни по МКБ - 10 M06.0.
Серонегативным ревматоидным артритом (СНРА) болеет пятая часть от всех больных РА. Распространенность болезни не более 1%. Чаще болеют женщины.
Как развивается заболевание
Основной причиной развития серонегативного ревматоидного артрита является генетический фактор – семейная предрасположенность к заболеванию.
Поэтому, если кто-то из близких родственников страдает этой суставной патологией, нужно беречься, избегать воздействия различных факторов, способных запустить аутоиммунный процесс.
К таким факторам относятся:
Хондропротекторы что это как выбрать, насколько они эффективны
Боль в суставах в состоянии покоя
Серонегативный ревматоидный артрит начинается с того, что под воздействием перечисленных факторов в организме запускается аутоиммунный процесс, в основе которого лежит дисбаланс между цитокинами, поддерживающими и подавляющими воспаление. Цитокинами называются информационные молекулы, регулирующие физиологические процессы в клетках. Воспалительные цитокины преобладают, что является основой дисбаланса иммунной системы и длительного воспалительного процесса, развивающегося в соединительной ткани.
В первую очередь поражается соединительная ткань суставной полости: воспаляется и разрастается синовиальная оболочка, страдает хрящевая и костная ткань, нарушается суставная функция.
Соединительная ткань есть и во внутренних органах, поэтому они также могут пострадать. При длительно протекающем патологическом процессе нарушается белковый обмен и во внутренних органах откладываются белково – полисахаридные комплексы – амилоид. Амилоидоз – тяжелое осложнение, вызывающее повреждение функции внутренних органов – сердца, печени, почек, легких.
Симптомы
Симптомы и течение серонегативного ревматоидного артрита отличаются от типичных проявлений серопозитивного РА. Основным проявлением последнего является постепенное поражение мелких суставчиков кистей рук и стоп ног. Серонегативный артрит проявляется по-другому.
Течение серонегативного ревматоидного артрита
Первые признаки
Начало болезни, как правило, не постепенное, а острое. Внезапно появляется лихорадка. Температура может быть, как субфебрильной, так и очень высокой, с перепадами и появлением проливного пота в течение дня. Нарушается общее состояние: появляются слабость, недомогание, головная боль, головокружение характерны для начальной стадии заболевания.
Скованности движений при серонегативном артрите почти никогда не наблюдается, но болевой синдром выражен достаточно сильно. Появляется отечность и болезненность в области одного крупного сустава. Чаще всего это колени, локти или голеностопы. В начале заболевания характерно отсутствие мелких суставных поражений кисти и стопы – это является редким клиническим симптомом при данной форме болезни.
В лимфатических узлах при серонегативном артрите происходят следующие изменения: они становятся плотными, безболезненными.
Иногда с самого начала появляются признаки поражения внутренних органов. При поражении сердца – это одышка, сердцебиение.
Явные симптомы
Постепенно лихорадка сменяется нормальной или субфебрильной температурой. Через полгода воспалительный процесс при серонегативном артрите становится симметричным за счет появления воспаления в еще нескольких суставах. Еще через некоторое время процесс распространяется дальше, может присоединиться воспаление в мелких суставах пальцев кисти и стопы – развиваются признаки полиартрита. Кисти и пальцы рук принимают характерную форму.
Боли в суставах нарастают, быстро развиваются деструктивные изменения, появляются выраженные признаки анкилоза (сращения хрящей и костей), нарушения функция конечности. Достаточно часто при серонегативном ревматоидном артрите поражается тазобедренный сустав. Эрозии суставных поверхностей незначительны, но происходит быстрое разрастание соединительной ткани, закрытие суставной щели и формирование анкилоза.
Системные проявления при серонегативном РА также не заставляют себя ждать: появляются признаки поражения сердца (эндокардиты), легких (плевриты), почек (нефриты), кишечника. Увеличиваются печень и селезенка. При назначении своевременного лечения можно добиться в течении данной патологии длительной ремиссии и подавить прогрессирование заболевания. Если этого не сделать, болезнь будет прогрессировать.
Самые опасные симптомы серонегативного артрита
Наиболее опасными признаками являются:
- лихорадка в течение длительного времени;
- множественные поражения крупных и мелких суставов;
- появление сильной одышки в покое.
Осложнения
Если больному человеку вовремя не было назначено комплексное лечение, течение заболевания может осложниться:
- некрозом головки бедренной кости, что приведет к инвалидности;
- тяжелым поражением сердечно-легочной системы;
- амилоидозом, при котором страдают функции внутренних органов.
Чтобы снизить риск развития тяжелых осложнений при серонегативном артрите, нужно придерживаться всех рекомендаций врача.
Стадии болезни
Выделяют 4 стадии развития серонегативного ревматоидного артрита:
- Начальная. В течение первых полутора-двух месяцев развиваются признаки интоксикации и начального поражения одного крупного сустава.
- Ранняя. Это первые 12 месяцев болезни. Суставные дегенеративные изменения прогрессируют, поражения становятся симметричными. Проявляются признаки системных поражений.
- Прогрессирующая. Развивается от года до двух лет. На пораженных участках нарастают необратимые нарушения, присоединяется поражение мелких суставчиков кисти и стопы.
- Запущенная. После двух лет. За счет анкилоза нарушается суставная функция, конечность становится неподвижной.
Стадии серонегативного ревматоидного артрита
Диагностика
Диагноз ставится на основании характерных симптомов и подтверждается данным дополнительного обследования, позволяющих выявить патологический процесс на ранней стадии.
- Лабораторные исследования:
- общий анализ крови – выявляются признаки воспаления – ускоренная СОЭ, увеличение содержания лейкоцитов;признаки анемии;
- биохимический анализ – выявляется дисбаланс сывороточных белков: снижается количество альфа- и повышается количество гаммаглобулинов; в крови обнаруживается С-реактивный белок (СРБ) – признак воспалительного процесса;
- иммунологические анализы являются маркером, позволяющим отличить серонегативный и серопозитивный виды РА:
- ревматоидный фактор (антитела к IgG) не выявляется или его титры незначительны; наличие ревматоидного фактора говорит о серопозитивном РА;
- антитела к циклическому цитрулинсодержащему пептиду (анти-ЦЦП, АЦЦП) могут быть положительными и тогда это подтверждает диагноз серонегативного артрита; цитрулин – продукт обмена, в норме полностью выводящийся из организма; при РА выделяются ферменты, встраивающие цитрулин в тканевые белки и превращающие его в чужеродный белок – антиген; на этот антиген иммунная система вырабатывает антитела.
- Инструментальная диагностика:
- рентген суставов;
- УЗИ;
- МРТ или КТ – наиболее информативные методы диагностики;
- при необходимости – артроскопия – эндоскопическое исследование пораженного сустава.
Хруст в суставах - когда стоит беспокоиться
Внутрисуставные инъекции гиалуроновой кислоты
Лечебные мероприятия
Существует ли вероятность, что серонегативный ревматоидный артрит можно вылечить? Полностью вылечить невозможно, но при лечении серонегативных форм РА, как и при лечении любого другого хронического заболевания, стараются добиться длительной ремиссии. Чем она продолжительнее, тем выше качество жизни больного.
Современные лечебные технологии позволяют добиваться неограниченно долгой ремиссии. Но пациент всегда должен помнить, что рецидив возможен и придерживаться рекомендаций врача по предупреждению обострений.
Лечение серонегативного ревматоидного артрита должно быть комплексным и включить:
- соблюдение двигательного режима, занятия ЛФК;
- правильное рациональное питание;
- медикаментозную терапию;
- очищение крови;
- средства народной медицины, назначенные врачом;
- физиотерапевтические процедуры;
- ортопедическая коррекция;
- хирургическая операция.

Лечение серонегативного ревматоидного артрита
Режим, ЛФК, диета
Серонегативный ревматоидный артрит требует осознанного отношения к режиму дня и двигательной активности. Ограничение движений необходимо только во время обострений серонегативного артрита. Как только состояние больного улучшается, ему назначаются комплексы лечебной физкультуры (ЛФК) с постепенно нарастающей нагрузкой. Если этого не сделать, будет нарушаться кровообращение, снизится подвижность конечности, возрастет риск развития анкилоза, мышцы утратят свою силу и уменьшатся в объеме.
Кроме ЛФК во время ремиссии рекомендовано больше ходить пешком, плавать, кататься на велосипеде. Противопоказаны травматичные движения – прыжки, футбол и т.д.
Важно правильно питаться, в рационе должно быть достаточное количество белков, жиров, углеводов, витаминов и минералов. Пищу следует обогащать кальцием и витамином D (творог, сыр, кефир, рыбий жир) – это необходимо для предупреждение остеопороза.
Лекарственная терапия и средства народной медицины
Медикаментозное лечение серонегативного ревматоидного артрита начинается с применения противовоспалительных препаратов для устранения воспаления и связанной с ним боли. Больным назначают лекарственные средства из группы нестероидных противовоспалительных средств (НПВС). Это Диклофенак, Индометацин, Ибупрофен, Нимесулид, Мелоксикам и др. Их назначают внутрь или в виде наружных средств – гелей, мазей, кремов.
При тяжелом течении болезни назначают глюкокортикостероидные гормоны (ГКС) – Гидрокортизон, Бетаметазон, Дексаметазон и др. Их принимают внутрь, вводят в виде инъекций или непосредственно в суставную полость. Также их можно применять наружно в виде мазей и кремов. ГКС отлично снимают признаки воспаления, но имеют серьезные побочные действия, поэтому их назначают только по показаниям и короткими курсами на несколько дней.
Следующая группа препаратов – иммуносупрессоры – средства, подавляющие чрезмерную активность иммунитета – Метотрексат, Сульфасалазин, Циклофосфамид, Циклоспорин, Лефлуномид. Серонегативный ревматоидный артрит часто не реагирует на применение того или иного препарата, лечить его труднее, чем серопозитивный. Поэтому врачи часто используют комбинированную базисную терапию, применяя сразу несколько лекарственных препаратов, наблюдая за состояние больного и лабораторными показателями.
Самыми современными лекарствами для подавления активности серонегативного артрита считаются биологические агенты. Препараты этой группы относятся к биологически активным веществам (антитела, цитокины), воздействующим непосредственно на поломанные звенья иммунитета. К таким препаратам относятся Ритуксимаб, Тоцилизумаб, Абатацепт. Это эффективная, но достаточно дорогостоящая терапия, способная перевести лечение на более высокий уровень.
Для усиления эффекта медикаментозной терапии серонегативного артрита прием индивидуально подобранных лекарственных средств сочетают со средствами народной медицины. Это также может снизить большую лекарственную нагрузку на организм пациента.
Очищение крови
При тяжелой интоксикации и распространенном процессе можно использовать такие процедуры, как гемосорбция и плазмаферез, осищающие кровь от токсических веществ.
Физиотерапевтические процедуры
Физиолечение присоединяют на всех этапах лечения серонегативного ревматоидного артрита. Электрофорез с НПВК и ГКС помогает устранить воспаление и боль, магнито- и лазеротерапию можно использовать для подавления деструктивных процессов в тканях. Курсы физиолечения ускоряют процесс выздоровления и снижают риск развития осложнений.
Ортопедическая коррекция
Больного серонегативным артритом учат держать пораженную конечность в физиологически правильном положении для снижения риска деформации. Для этого используют специальные приспособления для выравнивания конечности - ортезы. Их носят по несколько часов в день, снимая во время выполнения физических упражнений. Ортезы помогают вылечить суставные дисфункции при разных формах ревматоидного артрита.
Хирургические операции
Методы лечения серонегативного ревматоидного артрита
Применяется редко, только если диагностируют функциональную суставную несостоятельность. Проводятся операции эндопротезирования или резекции части суставной капсулы. Операция помогает вылечить больного даже при тяжелых поражениях.
Подход к лечению заболевания в нашей клинике
- лекарственная терапия – назначается комплекс высокоэффективных лекарств, применяются новейшие схемы и методики;
- лекарственные травы – используются, как научные подходы к применению фитотерапии, так и народные средства для снижения нагрузки от медикаментов;
- физиотерапия – умелое сочетание медикаментозной терапии с физиопроцедурами дает быстрый и стойкий положительный эффект;
- лечебное движение – специально подобранные упражнения ЛФК, кинезитерапии улучшают кровообращение, тренируют мышцы; лечебный массаж закрепляет этот эффект; – передовая методика активизации восстановительных процессов при помощи собственных тромбоцитов пациента, обработанных по специальной методике;
- рефлексотерапия (РТ – акупунктура, прижигание полынными сигаретами, точечный массаж)– воздействие различными способами на активные точки на поверхности тела человека, рефлекторно связанные с различными органами и тканями; проверенные веками высокая эффективность методов РТ позволяет полностью избавить пациента от рецидивов болезни даже без применения лекарств; – метод рефлексотерапии, при котором в акупунктурные точки вводятся современные эффективные лекарства.
Специалистам нашей клиники удается быстро добиться ремиссии серонегативного артрита и поддерживать ее на протяжении длительного времени. Пациенты, которые выполняют все рекомендации врача и регулярно проводят противорецидивное лечение, забывают о своем заболевании и ведут обычный образ жизни.
Профилактика обострений

Профилактика обострений
Серонегативный ревматоидный артрит серьезное заболевание, требующее постоянного соблюдения рекомендаций врача. Чтобы предупредить рецидив, нужно:
- больше двигаться, заниматься обязательными упражнениями ЛФК, но избегать тяжелых физических нагрузок, вести здоровый образ жизни;
- избегать переохлаждений, если это необходимо, сменить место проживания, профессию;
- исключить все вредные привычки;
- правильно питаться;
- поддерживать здоровье своего тела, лечиться от сопутствующие заболевания;
- выполнять все назначенные врачом процедуры.
- Насонов ЕЛ, Каратеев ДЕ, Балабанова РМ. Ревматоидный артрит. В кн.: Ревматология. Национальное руководство. Под ред. Е.Л. Насонова, В.А. Насоновой. Москва: ГЭОТАР-Медиа; 2008.С. 290–331
- Насонов ЕЛ, редактор. Генно-инженерные биологические препараты в лечении ревматоидного артрита. Москва: ИМА-ПРЕСС; 2013.
- Emery P, Breedveld FC, Dougados M, Kalden JR, Schiff MH, Smolen JS. Early referral recommendation for newly diagnosed rheumatoid arthritis: evidence based development of a clinical guide. Ann Rheum Dis 2002;61:4 290-297 doi:10.1136/ard.61.4.290
- Schett G, Emery P, Tanaka Y, et al. Tapering biologic and conventional DMARD therapy in rheumatoid arthritis: current evidence and future directions. Ann Rheum Dis 2016l0:1-10. Doi.10.1136/annrheumdis-2016-209201.
Суставы, Боли, Лечение без операции
Дата публикации: 09.04.2020
Дата обновления: 12.11.2020
Что такое аутоиммунный тиреоидит? Причины возникновения, диагностику и методы лечения разберем в статье доктора Сивова А. А., эндокринолога со стажем в 13 лет.
Над статьей доктора Сивова А. А. работали литературный редактор Елена Бережная , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Хронический аутоиммунный (лимфоматозный) тиреоидит (ХАИТ) — хроническое заболевание щитовидной железы аутоиммунного происхождения, было описано Х. Хасимото в 1912 г. Заболевание чаще наблюдается у женщин и наиболее часто диагностируется среди известных патологий щитовидной железы. Аутоиммунный тиреоидит выявляется у одной из 10-30 взрослых женщин. [1]
Рассматриваемое заболевание аутоиммунной природы, и для него обязательно присутствие антител. Впервые опубликовали данные об обнаружении антител к ткани щитовидной железы в сыворотке у пациентов с аутоиммунным тиреоидитом в 1956 году. Впоследствии выяснилось, что аутоиммунный тиреоидит подразумевает наличие антител к тиреоглобулину, второму коллоидному антигену и тиреопероксидазе (микросомальному антигену).
Провоцирующие факторы
Сегодня принято считать, что апоптоз, то есть программируемая гибель фолликулярных клеток щитовидной железы — одна из главных причин аутоиммунного тиреоидита и других патологий щитовидной железы. [2] Предполагается, что запуску апоптоза способствуют вирусы и генетические нарушения.
Чем опасен тиреоидит во время беременности
Аутоиммунный тиреоидит у женщины никак не отражается на возможности забеременеть и родить здорового ребёнка при условии, что у пациентки нормальный уровень гормонов — тиреотропный гормон (ТТГ) до 2,5 мЕд/л, в том числе в первом триместре беременности.
При гормональном нарушении возможны следующие осложнения:
-
;
- выкидыш;
- преждевременные роды;
- проблемы со сном;
- поздний токсикоз; ;
- кровотечения после родов;
- гипоксия плода;
- неонатальный тиреотоксикоз.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
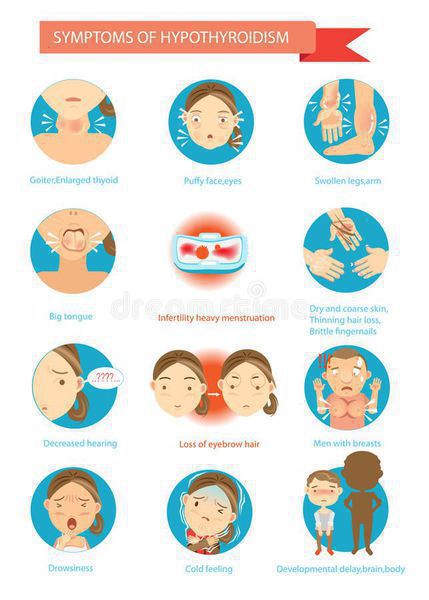
Симптомы аутоиммунного тиреоидита
Изначально, на протяжении некоторого времени, больные не высказывают никаких жалоб. Постепенно с течением времени регистрируют медленное развитие клинической картины снижения функции щитовидной железы, вместе с тем в части ситуаций будет отмечаться прогрессирующее уменьшение размеров железы или же наоборот ее увеличение. [3]
Клинические проявления при хроническом аутоиммунном тиреоидите начинают появляться с нарушением функции щитовидной железы, но в части ситуаций симптомов может и не быть. Все симптомы аутоиммунного тиреоидита щитовидной железы неспецифические, т. е. могут быть при многообразных заболеваниях. Но несмотря на это, все же обозначим клинические проявления, имея которые следует обратиться к эндокринологу для обследования.

Патогенез аутоиммунного тиреоидита
Эндогенный (внутренний) критерий наследования аутоиммунных заболеваний взаимосвязан с клонами Т-лимфоцитов.
- Чтобы произошло развитие хронического заболевания с учетом имеющейся наследственной предрасположенности, нужно влияние экзогенных факторов (вирусных и любых других инфекций, фармпрепаратов), которые способствуют активации Т-лимфоцитов, те впоследствии активируют В-лимфоциты, запуская цепную реакцию.
- Далее Т-клетки, кооперируясь с антитиреоидными антителами, воздействуют на эпителиальные клетки фолликулов, содействуя их деструкции, вследствие чего снижается численность правильно функционирующих структурных единиц щитовидной железы. [1][4]
Количество антитиреоидных антител при этом заболевании непосредственно отражает выраженность аутоиммунного процесса и иногда имеет склонность уменьшаться по мере увеличения продолжительности заболевания. Только присутствия антитиреоидных антител недостаточно, чтобы травмировать структурные элементы щитовидной железы.
Для реализации токсических свойств имеющимся антителам необходимо вступить во взаимодействие с Т-лимфоцитами, которые чувствительны к антигенам щитовидной железы при ХАИТ, чего не бывает при наличии обычного зоба или если патология щитовидной железы не выявлена.
В норме все клетки имеют иммунологическую нечувствительность к другим клеткам собственного организма, которая приобретается во время внутриутробного развития (еще до рождения), во время взаимодействия зрелых лимфоцитов со своими антигенами. Любые нарушения в данном взаимодействии и синтез особых клонов Т-лимфоцитов, которые вступают во взаимодействие со своими же антигенами, и могут стать той причиной, которая приводит к нарушению иммунологической нечувствительности и впоследствии привести к формированию любых аутоиммунных патологий, включая и ХАИТ.
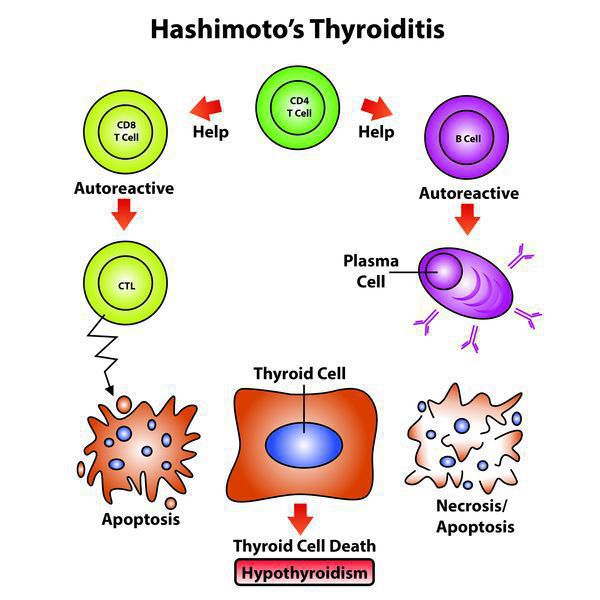
Классификация и стадии развития аутоиммунного тиреоидита
Формы ХАИТ с учетом объема железы и данных клиники:
- Гипертрофическая (тиреоидит Хасимото). Наиболее распространена. Щитовидная железа отличается плотностью, увеличена до II или III степени. Функция железы чаще не изменена, однако в большинстве ситуаций регистрируют тиреотоксикоз или гипотиреоз. Встречается у 15-20% больных.
- Атрофическая. Щитовидная железа в норме или незначительно увеличена, а на момент осмотра может быть даже уменьшена. Функционально — гипотиреоз. Встречается у 80-85% пациентов.
Еще одна классификация аутоиммунного тиреоидита щитовидной железы: [2]
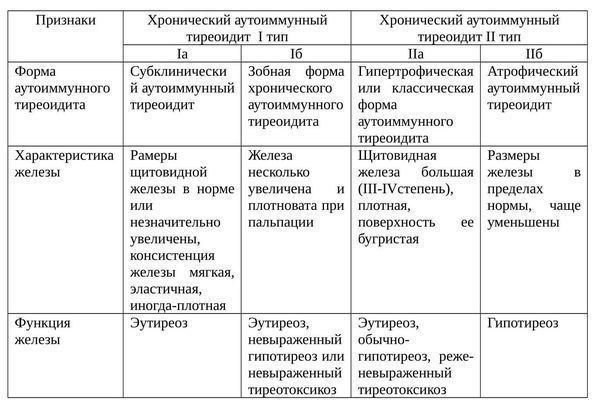
Фазы ХАИТ с учетом клинической картины заболевания:
- Эутиреоидная. Бессимптомное продолжительное (иногда пожизненное) течение, без изменений в функции щитовидной железы.
- Субклиническая. Если заболевание прогрессирует, то поскольку происходит деструкция клеток щитовидной железы и уменьшается уровень тиреоидных гормонов, повышается синтез тиреотропного гормона (ТТГ), который в свою очередь чрезмерно стимулирует щитовидную железу, благодаря чему организм поддерживает на нормальном уровне секрецию Т4.
- Фаза тиреотоксикоза. Поскольку заболевание продолжает развиваться, в кровь высвобождаются имеющиеся тиреоидные гормоны и формируется тиреотоксикоз. Не считая этого, в кровь попадают разрушенные части внутренних структур фолликулярных клеток, в результате образуются антитела к клеткам щитовидной железы. Когда при прогрессирующей деструкции щитовидной железы концентрация гормонопродуцирующих клеток снижается ниже допустимого предела, концентрация в крови Т4 стремительно уменьшается, развивается стадия явного гипотиреоза.
- Фаза гипотиреоза. Продолжается приблизительно в течение года, чаще всего после этого происходит восстановление функции щитовидной железы. Иногда гипотиреоидная фаза продолжается всю жизнь.
ХАИТ преимущественно протекает только с одной фазой заболевания. [5]
Осложнения аутоиммунного тиреоидита
ХАИТ — условно безопасное заболевание, не приводящее к осложнениям только при условии сохранения необходимой концентрации гормонов в крови, т. е. эутиреоидного состояния. И, соответственно, тогда никаких осложнений не развивается. Но при наступлении гипотиреоза могут наблюдаться осложнения. При отсутствии лечения гипотиреоза могут возникать осложнения: нарушение репродуктивной функции, выраженное снижение памяти, вплоть до слабоумия, анемия, но самое грозное и тяжелое осложнение гипотиреоза — гипотиреоидная или мексидематозная кома — возникает при резкой недостаточности гормонов щитовидной железы. [5] [6]
Диагностика аутоиммунного тиреоидита
Диагностика ХАИТ состоит из нескольких пунктов. Для определения данного заболевания у больного необходим минимум один большой критерий, если таких критериев не обнаружено, то диагноз лишь вероятен. [1]
Большие диагностические критерии:
- первичный гипотиреоз (причем возможен как манифестный, так и устойчивый субклинический);
- присутствие антител к ткани щитовидной железы;
- ультразвуковые критерии аутоиммунной патологии.
Пальпация щитовидной железы
Какие анализы нужны, чтобы определить АИТ
Для установления аутоиммунного тиреоидита необходимо сдать кровь на тиреотропный гормон ( ТТГ), тироксин свободный (Т4 свободный) и антитела к тиреопероксидазе (ТПО). Если антитела к ТПО повышены, но ТТГ в пределах нормы, то диагноз АИТ носит вероятный характер.
Нужно заметить, что при обнаружении у больного гипотиреоза манифестного или стабильного субклинического, диагностирование аутоиммунного тиреоидита важно для установления причины уменьшения функции железы, но несмотря на это постановка диагноза никак не меняет терапевтических методов. Лечение заключается в употреблении заместительной гормональной терапии препаратами тиреоидных гормонов.
Использование пункционной биопсии щитовидной железы не показано для установления хронического аутоиммунного тиреоидита. Ее необходимо проводить, только если имеются узлы щитовидной железы, более 1 см в диаметре.
Важно отметить, что нет надобности контролировать в течение болезни количество имеющихся антител к щитовидной железе, потому что данная процедура не имеет диагностической роли для анализа прогрессирования аутоиммунного тиреоидита. [7]
Лечение аутоиммунного тиреоидита
Терапия аутоиммунного тиреоидита щитовидной железы неспецифическая. При формировании фазы тиреотоксикоза достаточно применения симптоматической терапии. При формировании гипотиреоза главным вариантом медикаментозной терапии является назначение тиреоидных гормонов. Сейчас в аптечной сети РФ возможно приобрести только таблетки Левотироксина натрия (L-тироксин и Эутирокс). Применение таблетированных препаратов тиреоидных гормонов нивелирует клинику гипотиреоза и при гипертрофической форме аутоиммунного тиреоидита вызывает уменьшение объема щитовидной железы до допустимых значений.
В случае обнаружения у пациента манифестного гипотиреоза (повышение уровня тиреотропного гормона и снижение концентрации Т4 свободного) необходимо использование в лечении левотироксина натрия в средней дозе 1,6 – 1,8 мкг/кг массы тела пациента. Показателем правильности назначенного лечения будет являться уверенное удержание в пределах референсных значений тиреотропного гормона в крови больного.
Когда у больного диагностирован субклинический гипотиреоз (увеличена концентрация ТТГ в совокупности с неизмененной концентрацией Т4 свободного), необходимо:
- Спустя 3–6 месяцев вторично провести гормональное обследование для доказательства наличия изменения функции щитовидной железы;
- Когда в течение беременности у пациентки обнаружено увеличение уровня тиреотропного гормона, даже при сохраненной концентрации Т4 свободного, назначить левотироксин натрия в полной расчетной заместительной дозе сразу же;
- Лечение левотироксином натрия нужно при постоянном субклиническом гипотиреозе (увеличение концентрации тиреотропного гормона в крови свыше 10 мЕд/л, и еще в ситуациях не менее двукратного определения концентрации тиреотропного гормона между 5 – 10 мЕд/л), но если этим больным более 55 лет и у них имеются сердечно-сосудистые патологии, лечение левотироксином натрия назначается только при отличной переносимости лекарства и при отсутствии сведений о декомпенсации данных болезней на фоне приема тироксина;
- Показатель достаточности лечения субклинического гипотиреоза представляет собой стабильное удержание уровня ТТГ в пределах референсных значений в крови.
Если у женщин перед планированием беременности, выявлены антитела к ткани щитовидной железы и/или ультразвуковые признаки аутоиммунного тиреоидита, нужно определить гормональную функцию щитовидной железы (концентрацию тиреотропного гормона и концентрацию Т4 свободного) и обязательно определять уровень гормонов в каждом триместре беременности. [8]
Если поставлен диагноз аутоиммунный тиреоидит, но не выявляются изменения в работе щитовидной железы, применение препаратов левотироксина натрия не показано. [9] Оно возможно иногда в исключительных ситуациях внушительного увеличения объема щитовидной железы, спровоцированного аутоиммунным тиреоидитом, при этом решение принимается по каждому пациенту индивидуально. [10]
Физиологическое количество калия йодита (приблизительно 200 мкг/сутки) не могут спровоцировать формирование гипотиреоза и не осуществляют негативного воздействия на функцию щитовидной железы при ранее развившемся гипотиреозе, вызванном аутоиммунным тиреоидитом.
Питание при аутоиммунном тиреоидите
Продуктов, которые влияют на течение аутоиммунного тиреоидита, не существует. Глютен или лактоза не имеют отношения к гипотиреозу на фоне АИТ. Поэтому рекомендации по питанию для людей с аутоиммунным тиреоидитом такие же, как и для всех остальных: разнообразное сбалансированное питание с достаточным употреблением воды.
Существуют ли народные способы лечения
Аутоиммунный тиреоидит лечат только медицинскими препаратами, которые назначает эндокринолог. Отсутствие адекватной терапии может грозить опасными осложнениями: нарушением репродуктивной функции, выраженным снижением памяти (вплоть до слабоумия), анемией и комой, которая возникает при резкой недостаточности гормонов щитовидной железы.
Прогноз. Профилактика
Хронический аутоиммунный тиреоидит прогрессирует обычно крайне медленно, с развитием гипотиреоидного состояния спустя несколько лет. В отдельных ситуациях состояние и трудоспособность сохраняются в течение 15-18 лет, даже с учетом непродолжительных обострений. В фазе обострения тиреоидита регистрируются симптомы невыраженного либо гипотиреоза, либо тиреотоксикоза.
Сегодня методов профилактики хронического аутоиммунного тиреоидита не найдено.
Р. М. Балабанова, профессор, доктор медицинских наук, руководитель отдела изучения и коррекции аутоиммунных нарушений ГУ Института ревматологии РАМН
Е. В. Шекшина, кандидат медицинских наук, младший научный сотрудник
Хроническое системное иммуноопосредованное воспалительное заболевание с преимущественным поражением периферических (синовиальных) суставов по типу симметричного эрозивнодеструктивного полиартрита, сопровождающегося пролиферацией синовиоцитов и ангиогенезом (что сближает его с онкологическими заболеваниями), называют РЕВМАТОИДНЫМ АРТРИТОМ (РА).
Распространенность РА среди взрослого населения различных климато-географичеcких зон – в среднем 0,6–1,3%. Ежегодная заболеваемость за последние годы сохраняется на высоком уровне – 0,02%. Для РА характерен половой диморфизм: женщины болеют в 3–4 раза чаще, чем мужчины. Во время беременности нередко развивается ремиссия. У женщин пик заболеваемости РА приходится на 35–55 лет, у мужчин – на 40–60 лет.
Этиология и патогенез заболевания
До настоящего времени причина возникновения РА не уточнена. В его развитии равнозначна роль как генетических, так и внешнесредовых факторов, среди которых предполагается участие инфекции, иммунизации, питания, переливания крови, курения, УФО-облучения и др.
О генетической предрасположенности к заболеванию свидетельствует его высокая агрегация в семьях больных РА. Заболеваемость им в раннем возрастезначительно чаще встречается в семьях, где были родственники с РА. Роль генетической предрасположенности к этому заболеванию подтверждена и его более высокой частотой среди монозиготных близнецов (12–32%) по сравнению с дизиготными (3,5–9%).
Из эндогенных факторов в развитии РА определенную роль играют половые гормоны, что подтверждается большой частотой заболевания среди женщин, а также положительным влиянием беременности на течение РА и его обострением после родоразрешения или ее прерывания. У женщин, больных РА, выявлен дефицит андрогенов – тестостерона и дегидроэпиандростерона, у мужчин также низок уровень тестостерона.
Участие половых гормонов в развитии РА подтверждает влияние экзогенных эстрогенов (оральных контрацептивов), снижающих риск развития РА.
Среди внешнесредовых факторов возникновения этого заболевания в первую очередь предполагается роль инфекции. Классических эпидемиологических доказательств инфекционной этиологии РА нет, но это не исключает ее участия в генетически предрасположенном организме, о чем свидетельствуют результаты исследований на животных.
Специфический (инфекционный) триггер РА не установлен, но есть много претендентов: микоплазма, парвовирус В19, цитомегаловирус (ЦМВ), вирус простого герпеса 6-го типа, Эпстайна – Барр вирус (ЭБВ). Один из механизмов развития так называемых аутоиммунных заболеваний, к которым относится и РА, – “молекулярная мимикрия”. Микробы и вирусы могут содержать белковые структуры (аминокислотные последовательности), сходные с белками хозяина. Иммунный ответ на патоген с целью его элиминации может “изменить направление”, в результате чего возникает перекрестная реакция с собственными антигенами, структурно схожими с чужеродными.
В сыворотке больных РА содержатся в повышенных титрах антитела к латентному или репликативному антигену ЭБВ. Тлимфоциты периферической крови больных РА не способны контролировать ЭБВ-позитивные В-лимфобластоподобные линии, и это объясняет частоту ЭБВ-инфицированных периферических В-лимфоцитов при РА в сравнении с контролем. Длительная экспозиция одного или нескольких вирусов, что нередко имеет место при РА, может играть триггерную роль в инициации иммунного воспаления, так как антигены вируса не только перекрестно реагируют с антигенами хозяина, но и выполняют адъювантный эффект.
Патогенез
ЭФ РА(?) > Трансформация IgG в АутоАГ > IgM,A,G-ревматоидные факторы + АутоАГ = ЦИК > синовиальная ткань > повышение активности медиаторов воспаления, проницаемости микрососудов, хемотаксис лейкоцитов, фагоцитоз ЦИК > повреждение лизосом лейкоцитов и макрофагов > высвобождение лизосомальных ферментов > повреждение клеточных структур > образование новых АутоАГ > цепная реакция
Неизвестный этиологический фактор ревматоидного артрита вызывает первичную иммунную реакцию в виде образования антител в виде IgG. По неизвестной причине они трансформируются и превращаются в аутоантигены, которые в условиях иммунодефицита по Тсупрессорам инициируют выработку В-лимфоцитами антител групп Ig M, A, G (ревматоидные факторы). Они образуют с аутоантигеном циркулирующие иммунные комплексы (ЦИК), оседающие главным образом в синовиальной оболочке суставов и вызывающие повышение активности медиаторов воспаления, нарушение микроциркуляции, активацию хемотаксиса лейкоцитов.
В процессе фагоцитоза повреждаются лизосомы нейтрофилов и макрофагов, высвобождаются лизосомальные ферменты, повреждающие клеточные структуры. Образуются новые аутоантигены, новые аутоантитела, и патологический процесс приобретает характер цепной реакции. На какое-то время она может затихать, но затем вновь возобновляется под влиянием специфических и неспецифических факторов.
Исход воспалительного процесса характеризуется редукцией, а затем и прекращением миграции клеток в воспаленную ткань с последующим повышением апоптоза клеток и восстановлением тканей. Постоянная активация моноцитов и макрофагов приводит к неспособности их блокировать эти процессы, что способствует переходу острого воспаления в хроническое.
Важную роль в патогенезе РА играют простагландины.
Другой механизм, участвующий в воспалении и деструкции хряща, – усиление новообразования сосудов. Этот ангиогенез в синовии связывают с действием провоспалительных цитокинов, который приводит к усилению проникновения воспалительных клеток в ткани сустава, что обеспечивает поступление питательных веществ, необходимых для нормального функционирования воспалительных и пролиферирующих клеток. Важная роль отводится нейтрофилам, увеличение количества которых в синовиальной жидкости приводит к гиперпродукции хемоаттрактантов. Дегрануляция нейтрофилов сопровождается высвобождением протеиназ, реактивных форм кислорода, продуктов метаболизма арахидоновой кислоты.
Процессы, происходящие в синовии при РА, напоминают локальное злокачественное новообразование. Масса вновь образованных клеток и соединительной ткани во много раз превышает массу нормальной синовиальной оболочки. Образующийся при РА паннус обладает способностью к инвазии и деструкции хряща, субхондральной кости и связочного аппарата. Синовиоциты больных РА обладают фенотипическими свойствами трансформированных опухолевых клеток. В синовиальной жидкости и тканях обнаружено увеличение уровня факторов роста – тромбоцитарного и фибробластного. Сходство ревматоидного синовита и локализованного злокачественного новообразования проявляется и на молекулярном уровне. Ряд цитокинов обладает способностью вызвать длительно сохраняющиеся фенотипические изменения клеток.
Патологический процесс при РА в первую очередь развивается в суставах и околосуставных тканях и имеет свои особенности в зависимости от стадии заболевания.
Синовит выявляется рано, даже в клинически неизмененном суставе. Нарушения в синовиальной мембране обусловлены иммунологическими процессами. В начальных стадиях процесса строма скудно инфильтрирована лимфоцитами, плазматическими клетками, лаброцитами (тучными клетками) и макрофагами. Т-лимфоциты имеют морфологические и иммунологические характеристики антигензависимых клеток. В-лимфоциты как предшественники плазматических клеток и сами плазматические клетки синтезируют иммуноглобулины in situ.
На ранней стадии имеет место пролиферация кроющих синовиоцитов типа В, имеющих морфологическое сходство с фибробластами. Клетки формируют несколько слоев с очаговым “частоколом”. Встречаются капилляриты и продуктивные васкулиты. На этой стадии выявляется преобладание экссудативных и альтернативных процессов в синовиальной мембране – отек, полнокровие и очаги фибриноидных изменений.
Для развернутой стадии характерна картина хронического пролиферативного процесса. При этом отмечаются выраженная гиперплазия и гипертрофия ворсинок. Становится более очевидной пролиферация кроющих синовиоцитов с формированием нескольких слоев и наличием гигантских клеток.
В морфогенезе ревматоидного синовита важное место занимает поражение сосудов микроциркуляторного русла – васкулиты и ангиоматоз. В стенках сосудов выявляются отложения иммуноглобулинов. На этой стадии в синовиальной мембране могут формироваться ревматоидные узелки, а в случае присоединения амилоидоза – амилоидные массы.
Особенность позднего периода – выраженный ангиоматоз, сочетающийся с продуктивными васкулитами и тромбозами. Волнообразное течение болезни находит отражение и в морфологии синовиальной мембраны.
Под ней в перихондральной ее части формируется синовиальный паннус – сосудистая и фиброзная ткань. В процессе развития он врастает в хрящ, разрушая его.
Специфический морфологический признак при РА – ревматоидный узелок. Его можно увидеть в различных органах и тканях, но наиболее частая локализация – кожа и синовиальная мембрана. Узелок представлен очагом фибриноидного некроза, окруженного палисадообразно расположенными макрофагами, лимфоцитами и плазматическими клетками. Нередко в нем видны гигантские многоядерные клетки. С помощью моноклональных антител удалось подтвердить участие иммунопатологических реакций в развитии ревматоидных узелков.
Особое место в прогрессировании ревматоидного процесса занимают васкулиты, которые выявляютсяво всех органах, но не имеют специфических морфологических признаков. Исследование сосудов кожи у больных РА с признаками кожного васкулита показало, что изменения микроциркуляторного русла носят генерализованный характер.
При этом заболевании обнаруживают продуктивные, деструктивные и деструктивно-продуктивные васкулиты. Сосуды поражены генерализованно и полиморфно – от умеренной пролиферации эндотелия и инфильтрации наружной оболочки до некроза средней оболочки стенки сосуда. Преобладают поражения сосудов мелкого калибра – кожи, скелетной мускулатуры, внутренних органов. Наиболее типичны продуктивные васкулиты и тромбоваскулиты, реже встречается панваскулит типа узелкового полиартериита с очаговым или тотальным некрозом средней оболочки.
Изменения в сосудах крупного и среднего калибра могут быть обусловлены поражением vasa vasorum и развивающейся в связи с этим ишемией сосудистой стенки. Иногда наблюдается картина аортита с последующим склерозом и расширением устья аорты.
Поражение серозных оболочек проявляется чаще всего сухим плевритом с незначительным фибринозным выпотом, что ведет к образованию спаек. В легочной ткани процесс развивается по типу хронической межуточной пневмонии, очагового или диффузного пневмосклероза с образованием ревматоидных узелков.
Поражение почек обусловлено гломерулонефритом (мембранозным или мембранозно-пролиферативным), нефроангиосклерозом, хроническим интерстициальным нефритом, ангиитом. Часто нефропатия обусловлена отложением амилоидных масс. В латентной стадии амилоид обнаруживают периваскулярно в ткани пирамид и некоторых артериолах клубочков, в нефротической стадии в большинстве клубочков, стенках сосудов, пирамидах отложения амилоида массивные.
В желудочно-кишечном тракте выявляют признаки гастрита, энтерита, колита, которые достаточно часто обусловлены иммунокомплексным процессом, что подтверждается обнаружением в подслизистой основе иммуноглобулинов, фибрина. Наиболее тяжелые изменения желудочно-кишечного тракта связаны с отложением амилоидных масс в слизистой оболочке, стенке сосудов с развитием лимфоидно-плазмоцитарной инфильтрации, атрофией слизистой оболочки и подслизистой основы.
В биоптатах печени отмечают изменения в портальной соединительной ткани с продуктивными васкулитами, лимфоидно-гистиоцитарной или плазмоцитарной инфильтрацией, склеротические изменения, а также дистрофию, некроз гепатоцитов. При амилоидном поражении отложения амилоида наблюдают в ретикулярной строме долек печени по ходу внутридольковых капилляров, в стенке сосудов. Амилоид нередко замещает большую часть паренхимы.
В селезенке выявляют гиперплазию и плазматизацию лимфоидной ткани, пролиферацию эндотелия синусов, отложения белковых преципитатов.
При РА поражаются различные отделы нервной системы и ее элементы (сосуды, соединительная ткань, нервные волокна). Периферическая система в основном поражена за счет vasa nervorum. В соединительной ткани нервной системы выявляют фибриноидные изменения, лимфоидные и плазмоклеточные инфильтраты, а также отложения амилоида, микронекрозы.
Клиническая картина РА
Суставной синдром – ведущий в клинической картине РА. Начало заболевания чаще всего подострое (55–70%), как правило, спровоцированное перенесенной острой инфекцией или обострением хронической, охлаждением, травмой, стрессовой ситуацией.
Развитию артрита за несколько недель или месяцев предшествует продромальный период, признаки которого – усталость, похудание, периодически возникающая боль в суставах (часто на изменение атмосферного давления), снижение аппетита, повышенная потливость, субфебрильная температура, небольшая анемия, увеличение СОЭ.
По данным В. А. Насоновой и М. Г. Астапенко (1989), в продромальном периоде у 32% больных развивается утренняя скованность, особенно в суставах конечностей, которая при активном движении проходит. Среди причин возникновения этого симптома – нарушение нормального ритма выработки гормонов надпочечниками со смещением на более поздний период суток, а также аккумуляция цитокинов в отечной жидкости воспаленных суставов во время сна.
В начальном периоде РА у 1/3 больных отмечают артралгии, усиливающиеся при движении, у 2/3 – симметричный артрит мелких суставов кистей и стоп. Боль и скованность наибольшие в утренние часы, постепенно убывающие к вечеру. Интенсивность и длительность этих проявлений коррелирует с прогрессивностью болезни, сохраняясь при выраженной активности до обеда, а у отдельных больных проходит только к вечеру.
У 8–15% страдающих РА заболевание начинается остро в течение нескольких дней. При этом пациент может указать время и движение, спровоцировавшее боль. Артралгии могут сопровождаться такой же резкой болью в мышцах, длительной утренней скованностью, лихорадкой, что приводит больного к обездвиженности.
В 15–20% случаев РА начинается незаметно с медленным прогрессированием артрита без повышения температуры тела, ограничения движений.
Поражение суставов в ранней стадии РА может быть нестойким и самопроизвольно исчезать на несколько месяцев и даже лет. Стойкий полиартрит с прогрессированием воспалительного процесса отмечен у 70% больных. Первыми, как правило, при РА вовлекаются вторые-третьи пястно-фаланговые, проксимальные межфаланговые и суставы запястья, реже – плюсне-фаланговые. Затем по частоте поражения следуют коленные, локтевые, голеностопные. Позднее вовлечение крупных суставов некоторые авторы объясняют более высоким соотношением поверхности синовиальной мембраны к суставному хрящу. По нашим данным, у 87% заболевших все началось с поражения мелких суставов кистей, у 9,7% – крупных (коленные, плечевые). Стойкий прогрессирующий полиартрит имел место у 43%, у 57% больных он носил волнообразное течение с периодами ремиссии. У 20,4% пациентов развился ишемический некроз головок бедренных костей.
Некоторые суставы в дебюте болезни остаются интактными (“суставы исключения”) – дистальные межфаланговые, первый пястнофаланговый сустав большого пальца кисти, проксимальный межфаланговый мизинца.
Ранняя фаза РА характеризуется преобладанием экссудативных явлений симметрично пораженных суставов кистей с наличием выпота, определяемого по симптому флюктуации, воспалительному отеку периартикулярных тканей, резкой болезненности при пальпации, положительному симптому сжатиякисти.
Над мелкими суставами может быть слегка гиперемирована кожа, а над крупными – повышенная температура. Вследствие воспаления суставных тканей и рефлекторного спазма мышц резко ограничивается движение в пораженных суставах, что ведет к развитию мышечной атрофии. Артрит сопровождается воспалительным поражением влагалищ сухожилий, чаще разгибателей, реже – сгибателей кисти и стопы.
У 15–20% заболевших в первый год болезни может произойти спонтанное затухание симптомов артрита и развиться ремиссия болезни. Но у большей части больных процесс принимает прогрессирующий характер с переходом в экссудативно-пролиферативную фазу.
Наряду с общими симптомами (слабость, астения, похудание, ухудшение сна, аппетита, субфебрильная температура) прогрессирует суставной синдром. Преобладание пролиферативных процессов в суставных тканях приводит к их утолщению, стойкой плотной или пружинящей припухлости периартикулярных тканей, что вызывает изменение конфигурации суставов, в первую очередь мелких – кистей и стоп, запястья, лучезапястных, коленных, локтевых. Плечевые, тазобедренные суставы поражаются при РА редко, еще реже вовлекаются суставы позвоночника.
Классификация РА
Первая была предложена А. И. Нестеровым в 1961 году, после чего неоднократно уточнялась в связи с появлением новых данных о клинике и вариантах течения РА. Последний был одобрен на I Всероссийском конгрессе ревматологов в 2003 году.
Выделено 2 клинико-иммунологических варианта: серопозитивный и серонегативный РА. Полиартрит как основное проявление этого заболевания включает в себя оба варианта. Внесуставные проявления в основном отнесены к серопозитивному варианту и представлены лишь там, где ревматоидная принадлежность не вызывает сомнений. Сюда же отнесена особая форма РА – синдром Фелти. Серонегативный вариант РА имеет свои клинико-лабораторные особенности, к нему отнесен и синдром Стилла взрослых.
Характеризуя активность заболевания, выделяют 4 степени: 0 – ремиссия, 1 – низкая, 2 – средняя, 3 – высокая. Определение активности базируется на наиболее лабильных клинических и лабораторных признаках:
- выраженность боли по визуальной аналоговой шкале (ВАШ), где ее отсутствие приравнивается к нулевой отметке, а максимальное значение – к 10 см
- длительность утренней скованности в минутах
- показатели СОЭ и СРБ
Определение СРБ в нашей стране не стандартизировано, поэтому мы взяли за исходное значение норму, а далее – ее 2–3- и более кратное превышение.
Зарубежными ревматологами предложено для оценки активности РА применять DAS (счет активности болезни).
По МКБ Х принята такая классификация РА: Воспалительные полиартропатии
Приведен литературный обзор патогенетических механизмов синдрома эндогенной интоксикации (ЭИ) и его особенностей при ревматоидном артрите (РА). Выраженная местная гипоксия и ацидоз, способствующий сохранению и хронизации воспалительного процесса в синовиальной среде пораженных суставов при РА, накопление недоокисленных продуктов обмена могут способствовать усугублению синдрома ЭИ.
Ключевые слова: синдром эндогенной интоксикации, ревматоидный артрит, система компонентов комплемента, циркулирующие иммунные комплексы.
Синдром эндогенной интоксикации (ЭИ) относится к числу наиболее распространенных в клинической практике и наблюдается при самых различных, этиологически и патогенетически нетождественных состояниях [15, 41, 56, 66].
ЭИ является непременным и определяющим звеном шока любой этиологии [55, 66], септического процесса [65], ожоговой [33] и травматической болезни [7, 29, 64], в том числе закрытой черепно-мозговой [15] и операционной [11] травмы; уремии [16, 35, 50, 58]; онкологических процессов [34]. Описан ряд хирургических заболеваний, сопровождающихся развитием ЭИ: панкреонекроз и острый панкреатит [42, 43], перитонит [27] и др.
Клинике, патогенезу и лечению ЭИ посвящено в последние годы большое количество публикаций, в том числе обзорного характера [21, 27, 41, 48]. Согласно сложившемуся представлению, под ЭИ понимают отравление организма промежуточными и конечными продуктами обмена веществ, вследствие накопления их выше физиологической нормы в связи с активацией катаболических процессов при снижении эндогенной детоксикации. Несмотря на многообразие веществ эндогенной природы, обладающих токсическими свойствами, и точек приложения их повреждающего действия, клинические проявления симптомокомплекса ЭИ малоспецифичны и характеризуются общей слабостью, чувством разбитости, нарушениями сна и аппетита, мышечными и головными болями и т.д. [18, 27, 54]. Клиническими проявлениями синдрома являются также температурные реакции (может быть как гипер- так и гипотермия), гипервентиляция легких, тахикардия, энцефалопатия, лейкоцитоз или лейкопения, коагулопатии (синдром диссеминированного внутрисосудистого свертывания).
В последние годы в иностранной литературе достаточно широкое распространение получила оригинальная концепция сущности синдрома ЭИ: возникновение системного (генерализованного) воспаления (systemic inflammatory response syndrome - SIRS) [48, 49], к которому могут привести такие различные патологические процессы, как тканевая деструкция и выраженная гипоксия тканей, хроническое отравление; в частности, приводятся сведения о развитии синдрома при отравлении салицилатами и т.д.
Механизмы возникновения ЭИ различного генеза однотипны: среди источников интоксикации основное внимание уделяется очагам воспалительной деструкции, ишемизированным тканям, зонам естественной вегетации микрофлоры в организме. Приводим стадии развития синдрома ЭИ по В.В. Чаленко, Ф.Х. Кутушеву (1990). В начале процесса токсины и метаболиты поступают в кровь, лимфу, интерстициальную жидкость и распространяются из патологического очага (воспаление, травмированные ткани, опухоли и т.д.). Если защитные системы организма в состоянии обезвредить эти вещества, клинической симптоматики может и не возникнуть, xoтя при любом патологическом состоянии, возможно, существует скрытый или транзиторный эндотоксикоз - так называемая нулевая стадия (I). При декомпенсации защитных и регуляторных систем - выделительной, детоксикационной (микросомального окисления, конъюгации), моно-нуклеарно-макрофагальной, начинается накопление эндогенных токсинов в opганизме - стадия накопления продуктов первичного аффекта (II).
Включение, напряжение и последующая декомпенсация регуляторных и защитных систем (регуляции агрегатного состояния крови, калликреин-кининовой, иммунокомпетентной, перекисного окисления) ведут к накоплению этих продуктов в токсически высоких концентрациях и появлению продуктов их извращенного функционирования (аутоантител, комплексов фибриногена и гепарина с тромбогенными белками, свободных радикалов, нестабильных гидроперекисей). Развивается стадия декомпенсации регуляторных систем и ауто-агрессии (III). Одновременно токсические продукты I-III стадий проникают в неизмененные клетки, вызывая нарушения внутриклеточного обмена, повреждение биологических мембран и цитолиз, что ведет к появлению аутоантигенов, нарушению распределения и диссеминации цитолокализованных веществ и появлению патологических метаболитов - стадия нарушенного метаболизма (IV). Затем грубые нарушения регуляции и обменных процессов ведут к нарушению внутренней среды организма, ломке барьеров, всасыванию неизмененных или малоизмененных продуктов кишечника, что приводит к финальной стадии дезинтеграции организма как биологического целого (V).
Как следует из перечисленных механизмов развития ЭИ, они основаны на многочисленных "порочных кругах", являются аутокаталитическими и обусловливают развитие клинических проявлений эндотоксикоза у больных. Схема компонентов синдрома ЭИ (эндотоксинов), составленная в соответствии с описанием В.В. Чаленко, Ф.Х. Кутушева (1990), приведена на рис.
Рис. Схема компонентов эндогенной интоксикации.
Ряд авторов [8, 21] выделяют три компонента ЭИ: микробиологический, биохимический и иммунологический. Среди патологических биохимических процессов большое внимание уделяется активации протеолиза с нарушением общего ферментативного гомеостаза организма, причем отмечается прямая корреляция уровня протеолитической активности крови с такими интегральными маркерами синдрома ЭИ как лейкоцитарный индекс интоксикации, циркулирующие иммунные комплексы, молекулы средней массы, большинство авторов считает универсальным маркером ЭИ именно молекулы средней массы. Важным патофизиологическим механизмом развития эндотоксикоза является и активация процессов перекисного окисления липидов, инициируемых свободными кислородными радикалами.
При ЭИ наблюдаются выраженные изменения иммунного статуса, проявляющиеся, как правило, иммунодепрессией [10, 32].
Ключевую роль в развитии синдрома играют активированные нейтрофилы [53, 63] и медиаторы различных типов. Прежде всего это дериваты активированных полиморфноядерных лейкоцитов, цитокины [51], обладающие повреждающим действием на ткани; затем компоненты комплемента. В последние годы большое значение придается молекулам адгезии, в частности, селектинам [62], играющим важную роль в развитии воспалительных реакций. Молекулы адгезии, такие как CD11b на полиморфноядерных лейкоцитах, под влиянием фактоpa некроза опухоли-а, интерлейкина и других медиаторов подвергаются разрегулированию [60], способствуя "прилипанию" циркулирующих полиморфноядерных лейкоцитов и моноцитов к эндотелию сосудов.
Стимуляция цитокиновой системы является общим путем развития многих патологических состояний: сепсиса, геморрагий, ишемии-реперфузии, травмы мягких тканей и т.д., приводящих к активации макрофагов и гиперпродукции провоспалительных цитокинов. Вторичные компоненты и эффекторные молекулы могут вызывать клиническое проявление синдрома ЭИ [56].
Определяющим патогенетическим механизмом ЭИ различного генеза (Fry, цит. по Н.П. Макаровой, И.Н. Коничевой, 1995) является генерализованное нарушение микроциркуляции, провоцируемое каскадным высвобождением биологически активных продуктов из активированных клеточных элементов, в частности, макрофагов; преобладание вследствие различных причин катаболических процессов; нарушение транспорта и утилизации кислорода тканями, приводящее к накоплению недоокисленных продуктов обмена, в том числе маркера анаэробного метаболизма - лактата.
Bone R.S. (1995; 1996) на первое место ставит генерализованное поражение эндотелия и нарушение регуляции системы гемостаза с преимущественной активацией коагуляционных механизмов и специфическим и неспецифическим угнетением системы естественных антикоагулянтов и системы фибринолиза.
Для объективной оценки наличия ЭИ существуют различные неспецифические лабораторные методы, позволяющие с той или иной степенью точности и достоверности судить о выраженности синдрома.
В хирургической практике (травматическая болезнь, перитонит, панкреонекроз и т.д.) при изучении степени ЭИ использовали определение количества лейкоцитов и лейкоцитарной формулы, а также функциональной активности с помощью НСТ-теста [3]; цитоморфологический метод, позволяющий оценить уровень деструктивных изменений лейкоцитов [11]; из иммунологических методов - определение иммуноглобулинов, циркулирующих иммуннокомплексов [3, 15, 21]. Из биохимических методов широко используется определение продуктов перекисного окисления липидов, в основном, малонового диальдегида [4, 6, 22]; в том числе у больных онкологического профиля [18, 25], а также у больных деформирующим остеоартрозом [47]. Повсеместно распространено определение уровня молекул средней массы, являющихся общепризнанным биохимическим маркером ЭИ при различных патологических состояниях [28, 38, 39].
Учитывая вышесказанное, следует подчеркнуть неспецифичность синдрома ЭИ, возникающего при столь различных по этиологии, патогенезу, клиническим проявлениям и тяжести заболеваниях. Сложность заключается в том, что хорошо известная классическая триада клинических симптомов выраженной ЭИ (тахикардия, тахипное и гипертермия) не всегда встречается при легких и среднетяжелых состояниях, в частности, при заболеваниях суставов.
Согласно современным представлениям, "ревматоидный артрит - хроническое системное воспалительное заболевание соединительной ткани с прогрессирующим поражением преимущественно периферических (синовиальных) суставов по типу симметричного прогрессирующего эрозивно-деструктивного полиартрита" [26]. Принимая во внимание хорошо известные патогенетические особенности ревматоидного воспалительно-деструктивного процесса, приводимые в ряде руководств [26, 37] (нарушение микроциркуляции, тканевая гипоксия с накоплением недоокисленных продуктов обмена, а также токсинов, исходящих из ишемизированных тканей пораженных суставов; неконтролируемая активация протеолиза с угнетением его естественных ингибиторов; высвобождение биологически активных веществ из активированных клеточных элементов; поражение эндотелия, явные и скрытые коагулопатии; выраженные иммунные нарушения; глубокие метаболические сдвиги, в частности, активация свободнорадикальных реакций и процессов липопероксидацин с последующими необратимыми повреждениями клеточных и митохондриальных мембран и т.д.), можно предположить накопление эндогенных токсинов в биологических средах организма с развитием синдрома ЭИ и у больных ревматоидным артритом.
Понятие ЭИ практически не применяется в ревматологии, хотя хорошо известен комплекс неспецифических, так называемых, "общих" во многом субъективных симптомов, а именно: слабость, быстрая утомляемость, снижение работоспособности, головная боль, нарушение сна, плохой аппетит, похудание, потливость, эмоциональная лабильность, как проявление нейротоксикоза, общая температурная реакция и т.д. [26, 37], являющихся клиническими проявлениями ЭИ. Важную роль в патогенезе РА играет циркуляторная гипоксия; характерно увеличение частоты пульса, а также изменение ряда параметров, характеризующих механическую работу сердца. С другой стороны, тахикардия, как известно, является одним из классических симптомов ЭИ.
Кроме того, в лечении больных РА в последние годы достаточно широко и успешно используются различные методы детоксикации, в том числе гемосорбция и плазмаферез, что само по себе подразумевает наличие интоксикации у данного контингента больных.
Наиболее близкими к механизмам развития ЭИ при РА являются, очевидно, процессы, обусловленные наличием опухолевого роста [18, 23, 52, 61]. Учитывая сведения об однотипности нарушений метаболизма клеток в далеко зашедшей стадии РА и при опухолевых процессах [52], принимая во внимание мнение о нарушении процессов перекисного окисления липидов как важного механизма ЭИ при новообразованиях [18, 25], а также признавая значимость свободнорадикальных процессов в развитии РА с накоплением токсичных интер-медиатов, в частности малонового диальдегида [12, 61], можно предположить, что именно активация процессов перекисного окисления липидов, наряду с другими механизмами, играет существенную роль в развитии эндотоксикоза при РА.
Одним из основных эндогенных медиаторов воспаления и, вероятно, одним из наиболее универсальных агентов, участвующих в реализации синдрома ЭИ, является фактор некроза опухоли, продуцируемый макрофагами и эндотелиальными клетками [55, 60]. Из известных биологических эффектов фактора некроза опухоли в развитии ЭИ при РА вероятнее всего действуют следующие: пирогенный, активации гуморальных систем организма (кининовой, комплемента, гемостаза), активации фагоцитоза, агрегации тромбоцитов, непосредственное воздействие на печень, скелетные мышцы и нарушение метаболизма клеток на уровне митохондрий [21]. Фактор некроза опухоли оказывает непосредственное и опосредованное (через активированные гуморальные системы) воздействие на микроциркуляторное русло, участвует в дезинтеграции системы гемостаза и нарушении сосудистого тонуса, повреждает миофибриллы кардиомиоцитов, вызывая первичную миокардиальную депрессию (Bone R.S., 1991, цит. по Н.П. Макаровой, И.Н. Коничевой, 1995).
Одно из первых мест в перечне эндогенных медиаторов синдрома ЭИ занимают также интерлейкины: интерлейкин-1, -6, -8 - продукты активированных мононуклеарных фагоцитов и эндотелиальных клеток и интерлейкин-2,-4 - из активированных Т-лимфоцитов. Биологические эффекты интерлейкинов: пирогенный, воздействие на полиморфноядерные лейкоциты, мобилизация маргинального пула нейтрофилов, стимуляция продукции нейтрофилов костным мозгом, участие в активации системы гемостаза, непосредственное повреждающее действие на эндотелий, дезинтеграция миофибрилл кардиомиоцитов, стимуляция синтеза белков острой фазы (CRP, гаптоглобина, церулоплазмина), угнетение синтеза альбуминов, трансферрина, иммунологические эффекты (стимуляция синтеза иммуноглобулинов, модуляция активности Т-хелперов и Т-супрессоров) обусловливают развитие и клинические проявления синдрома.
Одним из наиболее активных компонентов, участвующих в реализации воспалительного ответа, является система комплемента. Имеются данные о возможности ее непосредственной активации эндотоксинами, причем С3а и С5а включаются в перечень медиаторов ЭИ [49]. Описывается способность компонентов комплемента стимулировать дегрануляцию тучных клеток с высвобождением гистамина и повышением сосудистой проницаемости. Возможно и прямое повреждающее действие активированных компонентов комплемента на эндотелий и опосредованное, в качестве хемоаттрактантов полиморфноядерных лейкоцитов. Последние через свободные кислородные радикалы и протеолитические энзимы разрушают эндотелий сосудов микроциркуляторного русла с последующим осаждением фибрина и агрегатов форменных элементов. К повреждению эндотелия, нарушению проницаемости, отеку, нарушению транспорта и утилизации кислорода в тканях приводит и выделение клеточных протеаз и цитотоксинов, высвобождающихся в процессе неконтролируемого системного иммунного ответа.
У больных PA, очевидно, "работают" следующие патогенетические механизмы развития синдрома эндогенной интоксикации (по классификации В.В. Чаленко, Ф.Х. Кутушева, 1990): накопление иммунологически чужеродных продуктов деградации соединительнотканных компонентов суставов (продукты неограниченного протеолиза и гидролиза гликопротеинов); накопление в патологических концентрациях ферментов свертывающей, фибринолитической, калликреиновой систем, антител, циркулирующих иммунных комплексов, медиаторов воспаления, биогенных аминов, продуктов перекисного окисления липидов); нарушение распределения и диссеминации органо- и цитолокализованных веществ (в том числе лизосомальных ферментов).
Из трех общеизвестных компонентов ЭИ [8, 21] у больных РА имеются два - биохимический и иммунологический (неконтролируемая активация протеолиза с нарушением общего ферментативного гомеостаза организма, грубые иммунологические нарушения с накоплением продуктов расщепления пластического материала).
При РА вовлечение в патологический процесс микроциркуляторного русла приводит к возникновению гипоксии [37], что вызывает деполимеризацию основного вещества соединительной ткани, усугубляя тем самым тяжесть патологического процесса. Системные расстройства микроциркуляции и тканевая гипоксия, взаимно усиливая друг друга, создают порочный круг, поддерживающий течение воспалительного процесса. Гипоксия, преобладание гликолиза, накопление недоокисленных продуктов обмена, лактата, снижение рН [2] в очаге поражения, с одной стороны, стимулируют биосинтетическую активность фибробластов [57], а с другой стороны - способствуют увеличению проницаемости лизосомальных мембран и выходу из клеток лизосомальных энзимов, участвующих в деградации основного вещества и других соединительнотканных структур [45].
Выраженная местная гипоксия и ацидоз, способствующий сохранению и хронизации воспалительного процесса в синовиальной среде пораженных суставов при РА [2], накопление недоокисленных продуктов обмена могут способствовать усугублению синдрома ЭИ.
Из многочисленных определений синдрома ЭИ наиболее общим и достаточно удачно отражающим его сущность при патологии суставов, является, по нашему мнению, следующее: ЭИ - это состояние, обусловленное деструктивными процессами, в результате которых в жидкостях и тканях организма накапливаются в нефизиологических концентрациях промежуточные и конечные продукты нормального обмена веществ, а также продукты нарушенного метаболизма соединительной ткани и компоненты деградации ее нормальных структур, оказывающие токсическое влияние и вызывающие дисфункцию различных органов и систем [19, 20, 31].
Нами при сравнительном клинико-лабораторном анализе обнаружено наличие выраженной ЭИ у больных РА с помощью объективных биохимических (молекулы средней массы, малоновый диальдегид) и иммунологических (циркулирующие иммунные комплексы, иммуноглобулины) тестов; степень эндотоксикоза зависела от общей активности и распространенности воспалительного процесса [1, 14].
Таким образом, характерные особенности развития воспалительно-деструктивного процесса у больных РА, как и у больных с другими тканевыми деструкциями, создают патогенетические предпосылки для возникновения синдрома ЭИ, что подтверждает хорошо известная клиническая симптоматика и полученные в последние годы лабораторные данные.
ЛИТЕРАТУРА.
Summary
Review of literature on the pathogenic mechanisms of endogenous intoxication (EI) syndrome and its peculiaritces in rheumatoid arthritis (RA) was done. Severe local hypoxia and acidosis, promoting chronicity of inflammatory process in synovial medium of the affected joints in RA, accumulating of underoxidized metabolic products could aggravate EI syndrome.
Key words: syndrome of endogenous intoxication, rheumatoid arthritis, system of compliment components, circulatins immunic complexes.
Читайте также:

