Что такое токсико септический шок
Обновлено: 19.04.2024
Синдром токсического шока — тяжёлый патологический синдром, развивающийся при инфицировании штаммами стафилококка, продуцентами TSST-1 (токсин-1 синдрома токсического шока), реже — энтеротоксинов В и С, а также стрептококком группы А.
Патоморфология. Субэпидермальное сагиттальное расслоение кожи. Минимальная воспалительная реакция в тканях. Снижение числа лимфоцитов в лимфатических узлах. Изъязвления слизистой оболочки влагалища и шейки матки.
Клиническая картина. Повышение температуры тела (38,8 °С и выше), рвота, диарея, эритема и скарлатиноподобная сыпь, чаще на ладонях и подошвах (с последующей десквамацией через 1–2 нед), артериальная гипотензия, развитие менингизма, острого респираторного дистресс-синдрома и шока. Возможны периорбитальные отёки, конъюнктивиты.
Методы исследования • Микробиологическое исследование •• Выделение культуры Staphylococcus aureus из влагалища или хирургической раны (>90%) •• Назальное или перинеальное выделение Staphylococcus aureus •• Выделение Staphylococcus aureus из крови (непостоянно) • ОАК •• Нейтрофилёз с увеличением количества палочкоядерных форм •• Лимфопения •• Нормоцитарная, нормохромная анемия •• Тромбоцитопения •• Коагулопатия • Биохимический анализ крови •• Гипоальбуминемия •• Дисбаланс электролитов •• Гипокальциемия •• Гипомагниемия •• Гипофосфатемия •• Увеличение содержания АЛТ и АСТ •• Увеличение концентрации азота мочевины крови •• Увеличение содержания сывороточного креатинина •• Увеличение содержания кальцитонина •• Увеличение количества сывороточного билирубина •• Изменение осадка мочи.
Специальные исследования • Отсутствие сывороточных АТ к TSST-1, SEA, SEB или SEC • Определение TSST-1 или SEA-SEC в изоляте Staphylococcus aureus.
Дифференциальная диагностика • Скарлатина • Лекарственная реакция • Пятнистая лихорадка скалистых гор • Лептоспироз • Болезнь Кавасаки • Менингококкемия.
ЛЕЧЕНИЕ
Тактика ведения • Режим — стационарный, интенсивная терапия; до нормализации температуры тела и АД необходимо постоянное наблюдение за больным • Удаление тампонов из влагалища • Восстановление водного баланса • Лекарственная терапия • При необходимости — ИВЛ • Лечение хронических очагов инфекций.
Лекарственная терапия • Внутривенная инфузия допамина 400–800 мг/сут длительностью от 2–3 ч до 1–4 дней • ГК в/в • Антибиотики •• Оксациллин 2–4 г/сут каждые 6 ч •• При аллергии на оксациллин — клиндамицин 0,6–2,4 мг/сут в 4 приёма •• Ванкомицин по 500 мг каждые 6 ч • Иммуноглобулин 0,4 мг/кг в/в каждые 6 ч.
Осложнения • ОПН • Респираторный дистресс-синдром взрослых • Алопеция • ДВС • Атаксия, токсическая энцефалопатия • Нарушения памяти • Кардиомиопатия.
Течение и прогноз. Смертность — 3–9%. Рецидивы — 10–15% случаев.
Возрастные особенности. Дети и подростки. Иногда наблюдают как осложнение ветряной оспы.
Профилактика. Исключение использования тампонов длительного действия во время менструации, особенно с высокой адсорбирующей способностью. Следует рекомендовать частую смену тампонов в течение дня. Применение гигиенических прокладок на ночь. Своевременное лечение инфицированных ран.
МКБ-10 • A41.9 Септицемия неуточнённая
Примечание. Синдром стрептококкового токсического шока, или токсический стрептококковый синдром, может быть клинически не отличим от стафилококкового токсического шока.
Код вставки на сайт
Синдром токсического шока — тяжёлый патологический синдром, развивающийся при инфицировании штаммами стафилококка, продуцентами TSST-1 (токсин-1 синдрома токсического шока), реже — энтеротоксинов В и С, а также стрептококком группы А.
Патоморфология. Субэпидермальное сагиттальное расслоение кожи. Минимальная воспалительная реакция в тканях. Снижение числа лимфоцитов в лимфатических узлах. Изъязвления слизистой оболочки влагалища и шейки матки.
Клиническая картина. Повышение температуры тела (38,8 °С и выше), рвота, диарея, эритема и скарлатиноподобная сыпь, чаще на ладонях и подошвах (с последующей десквамацией через 1–2 нед), артериальная гипотензия, развитие менингизма, острого респираторного дистресс-синдрома и шока. Возможны периорбитальные отёки, конъюнктивиты.
Методы исследования • Микробиологическое исследование •• Выделение культуры Staphylococcus aureus из влагалища или хирургической раны (>90%) •• Назальное или перинеальное выделение Staphylococcus aureus •• Выделение Staphylococcus aureus из крови (непостоянно) • ОАК •• Нейтрофилёз с увеличением количества палочкоядерных форм •• Лимфопения •• Нормоцитарная, нормохромная анемия •• Тромбоцитопения •• Коагулопатия • Биохимический анализ крови •• Гипоальбуминемия •• Дисбаланс электролитов •• Гипокальциемия •• Гипомагниемия •• Гипофосфатемия •• Увеличение содержания АЛТ и АСТ •• Увеличение концентрации азота мочевины крови •• Увеличение содержания сывороточного креатинина •• Увеличение содержания кальцитонина •• Увеличение количества сывороточного билирубина •• Изменение осадка мочи.
Специальные исследования • Отсутствие сывороточных АТ к TSST-1, SEA, SEB или SEC • Определение TSST-1 или SEA-SEC в изоляте Staphylococcus aureus.
Дифференциальная диагностика • Скарлатина • Лекарственная реакция • Пятнистая лихорадка скалистых гор • Лептоспироз • Болезнь Кавасаки • Менингококкемия.
ЛЕЧЕНИЕ
Тактика ведения • Режим — стационарный, интенсивная терапия; до нормализации температуры тела и АД необходимо постоянное наблюдение за больным • Удаление тампонов из влагалища • Восстановление водного баланса • Лекарственная терапия • При необходимости — ИВЛ • Лечение хронических очагов инфекций.
Лекарственная терапия • Внутривенная инфузия допамина 400–800 мг/сут длительностью от 2–3 ч до 1–4 дней • ГК в/в • Антибиотики •• Оксациллин 2–4 г/сут каждые 6 ч •• При аллергии на оксациллин — клиндамицин 0,6–2,4 мг/сут в 4 приёма •• Ванкомицин по 500 мг каждые 6 ч • Иммуноглобулин 0,4 мг/кг в/в каждые 6 ч.
Осложнения • ОПН • Респираторный дистресс-синдром взрослых • Алопеция • ДВС • Атаксия, токсическая энцефалопатия • Нарушения памяти • Кардиомиопатия.
Течение и прогноз. Смертность — 3–9%. Рецидивы — 10–15% случаев.
Возрастные особенности. Дети и подростки. Иногда наблюдают как осложнение ветряной оспы.
Профилактика. Исключение использования тампонов длительного действия во время менструации, особенно с высокой адсорбирующей способностью. Следует рекомендовать частую смену тампонов в течение дня. Применение гигиенических прокладок на ночь. Своевременное лечение инфицированных ран.
МКБ-10 • A41.9 Септицемия неуточнённая
Примечание. Синдром стрептококкового токсического шока, или токсический стрептококковый синдром, может быть клинически не отличим от стафилококкового токсического шока.
Септический шок — это системная патологическая реакция на тяжелую инфекцию. Ее характеризуют лихорадка, тахикардия, тахипноэ, лейкоцитоз при идентификации очага первичной инфекции. При этом микробиологическое исследование крови нередко выявляет бактериемию. У части пациентов с синдромом сепсиса бактериемии не выявляют. Когда составляющими синдрома сепсиса становятся артериальная гипотензия и множественная системная недостаточность, то констатируют развитие септического шока.
Причины и патогенез развития септического шока:
Частота сепсиса и септического шока неуклонно возрастает с тридцатых годов прошлого века и, по-видимому, будет продолжать возрастать.
Тому причинами являются:
1. Все более широкое использование для интенсивной терапии инвазивных устройств, то есть внутрисосудистых катетеров и др.
2. Распространенное применение цитотоксических и иммуносупрессивных средств (при злокачественных заболеваниях и трансплантациях), которые вызывают приобретенный иммунодефицит.
3. Рост продолжительности жизни больных сахарным диабетом и злокачественными опухолями, у которых высок уровень предрасположенности к сепсису.
Бактериальная инфекция — это наиболее частая, причина септического шока. При сепсисе первичные очаги инфекции чаще локализованы в легких, органах живота, брюшине, а также в мочевыводящих путях. Бактериемию выявляют у 40-60% больных в состоянии септического шока. У 10-30% больных в состоянии септического шока невозможно выделить культуру бактерий, действие которых вызывает септический шок. Можно предположить, что септический шок без бактериемии — это результат патологической иммунной реакции в ответ на стимуляцию антигенами бактериального происхождения. По-видимому, данная реакция сохраняется после элиминации из организма патогенных бактерий действием антибиотиков и других элементов терапии, то есть происходит ее эндогенизация.
В основе эндогенизации сепсиса могут лежать многочисленные, усиливающие друг друга и реализуемые через выброс и действие цитокинов, взаимодействия клеток и молекул систем врожденного иммунитета и, соответственно, иммуно-компетентных клеток.
Сепсис, системная воспалительная реакция и септический шок — это следствия избыточной реакции на стимуляцию бактериальными антигенами клеток, осуществляющих реакции врожденного иммунитета. Избыточная реакция клеток систем врожденного иммунитета и вторичная по отношению к ней реакция Т-лимфоцитов и В-клеток вызывают гиперцитокинемию. Гиперцитокинемия — это патологический рост содержания в крови агентов ауто- паракриннои регуляции клеток, осуществляющих реакции врожденного иммунитета и приобретенные иммунные реакции.
При гиперцитокинемии в сыворотке крови аномально возрастает содержание первичных провоспалительных цитокинов, фактора некроза опухолей-альфа и интерлейкина-1. В результате гиперцитокинемии и системной трансформации нейтрофилов, эндотелиальных клеток, мононуклеарных фагоцитов и тучных клеток в клеточные эффекторы воспаления во многих органах и тканях возникает лишенный защитного значения воспалительный процесс. Воспаление сопровождается альтерацией структурно-функциональных элементов органов-эффекторов.
Критический дефицит эффекторов обуславливает множественную системную недостаточность.
Симптомы и признаки септического шока:
О развитии системной воспалительной реакции говорит наличие двух или более следующих признаков:
• Температура тела более высокая, чем 38 о С, или на уровне ниже 36 о С.
• Частота дыханий выше 20/минуту. Дыхательный алкалоз при напряжении углекислого газа в артериальной крови ниже 32 мм рт. ст.
• Тахикардия при частоте сердечных сокращений большей 90/минуту.
• Нейтрофилия при росте содержания полиморфноядерных лейкоцитов в крови до уровня выше 12х10 9 /л, или нейтропения при содержании нейтрофилов в крови на уровне ниже 4х10 9/ л.
• Сдвиг лейкоцитарной формулы, при котором палочкоядерные нейтрофилы составляют более 10% общего числа полиморфноядерных лейкоцитов.
О сепсисе свидетельствуют два или более признаков системной воспалительной реакции при подтвержденном данными бактериологических и других исследований наличии патогенных микроорганизмов во внутренней среде.
Течение септического шока
При септическом шоке гиперцитокинемия повышает активность синтетазы оксида азота в эндотелиальных и других клетках. В результате снижается сопротивление резистивных сосудов и венул. Снижение тонуса данных микрососудов уменьшает общее периферическое сосудистое сопротивление. Часть клеток организма при септическом шоке страдает от ишемии, обусловленной расстройствами периферического кровообращения. Расстройства периферического кровообращения при сепсисе и септическом шоке — это следствия системной активации эндотелиоцитов, полиморфоядерных нейтрофилов и мононуклеарных фагоцитов.
Воспаление данного генеза имеет сугубо патологический характер, происходит во всех органах и тканях. Критическое падение числа структурно-функциональных элементов большинства органов-эффекторов составляет основное звено патогенеза так называемой множественной системной недостаточности.
Согласно традиционным и верным представлениям, сепсис и системную воспалительную реакцию вызывает патогенное действие грамотрицательных микроорганизмов.
В возникновении системной патологической реакции на инвазию во внутреннюю среду и кровь грамотрицательных микроорганизмов определяющую роль играют:
• Эндотоксин (липид А, липополисахарид, ЛПС). Этот термостабильный липополисахарид составляет наружное покрытие грамотрицательных бактерий. Эндотоксин, воздействуя на нейтрофилы, вызывает высвобождение полиморфноядерными лейкоцитами эндогенных пирогенов.
• ЛПС-связывающий белок (ЛПССБ), следы которого определяют в плазме в физиологических условиях. Данный протеин образует с эндотоксином молекулярный комплекс, циркулирующий с кровью.
• Рецептор клеточной поверхности мононуклеарных фагоцитов и эндотелиальных клеток. Его специфическим элементом является молекулярный комплекс, состоящий из ЛПС и ЛПССБ (ЛПС-ЛПССБ).
В настоящее время растет частота сепсиса, обусловленного инвазией во внутреннюю среду грамположительных бактерий. Индуцирование сепсиса грамположительными бактериями обычно не связано с высвобождением ими эндотоксина. Известно, что предшественники пептидогликана и другие компоненты стенок грамположительных бактерий вызывают высвобождение клетками систем иммунитета фактора некроза опухолей-альфа и интерлейкина-1. Пептидогликан и другие компоненты стенок грамположительных бактерий активируют систему комплемента по альтернативному пути. Активация системы комплемента на уровне всего организма вызывает системное патогенное воспаление и вносит свой вклад в эндотоксикоз при сепсисе и системной воспалительной реакции.
Ранее считалось, что септический шок всегда вызывается эндотоксином (липополисахаридом бактериального происхождения), который высвобождается грамотрицательными бактериями. Теперь общепризнанным является тот факт, что менее чем в 50% случаев септический шок вызывается грамположительными возбудителями.
Расстройства периферического кровообращения при септическом шоке, адгезия активированных полиморфоядерных лейкоцитов к активированным эндотелиоцитам — все это ведет к выходу нейтрофилов в интерстиций и воспалительной альтерации клеток и тканей. Одновременно эндотоксин, фактор некроза опухолей-альфа, а также интерлейкин-1 повышают образование и высвобождение эндотелиальными клетками тканевого фактора свертывания. В результате активируются механизмы внешнего гемостаза, что вызывает отложение фибрина и диссеминированное внутрисосудистое свертывание.
Артериальная гипотензия при септическом шоке в основном представляет собой следствие снижения общего периферического сосудистого сопротивления. Гиперцитокинемия и рост концентрации в крови оксида азота при септическом шоке обуславливает расширение артериол. При этом посредством тахикардии компенсаторно растет минутный объем кровообращения. Артериальная гипотензия при септическом шоке возникает, несмотря на компенсаторный рост минутного объема кровообращения. Общее легочное сосудистое сопротивление при септическом шоке растет, что можно отчасти связать с адгезией активированных нейтрофилов к активированным эндотелиоцитам легочных микрососудов.
Выделяют следующие основные звенья патогенеза расстройств периферического кровообращения при септическом шоке:
1)рост проницаемости стенки микрососудов;
2) рост сопротивления микрососудов, который усиливается клеточной адгезией в их просвете;
3) низкая реакция микрососудов на вазодилатирующие влияния;
4) артериоло-венулярное шунтирование;
5) падение текучести крови.
Гиповолемия — это один из факторов артериальной гипотензии при септическом шоке.
Выделяют следующие причины гиповолемии (падения преднагрузки сердца) у больных в состоянии септического шока:
1) дилатация емкостных сосудов;
2) потеря жидкой части плазмы крови в интерстиций из-за патологического роста проницаемости капилляров.
Можно считать, что у большинства больных в состоянии септического шока падение потребления кислорода организмом преимущественно обусловлено первичными нарушениями тканевого дыхания. При септическом шоке умеренный лактатный ацидоз развивается при нормальном напряжении кислорода в смешанной венозной крови.
Лактатный ацидоз при септическом шоке считают следствием снижения активности пируватдегидрогеназы и вторичной аккумуляции лактата, а не падения тока крови на периферии.
Расстройства периферического кровообращения при сепсисе носят системный характер и развиваются при артериальной нормотензии, которую поддерживает рост минутного объема кровообращения. Системные нарушения микроциркуляции проявляют себя снижением рН в слизистой оболочке желудка и падением насыщения кислородом гемоглобина крови в печеночных венах. Гипоэргоз клеток кишечного барьера, действие иммуносупрессивных звеньев патогенеза септического шока — все это снижает защитный потенциал кишечной стенки, что служит еще одной из причин эндотоксемии при септическом шоке.
Диагноз септического шока
- Септический шок - сепсис (синдром системной воспалительной реакции плюс бактериемия) в сочетании со снижением АД сист. менее 90 мм рт. ст. при отсутствии видимых причин для артериальной гипотензии (дегидратация, кровотечение). Наличие признаков гипоперфузии тканей несмотря на проведение инфузионной терапии. Перфузионные нарушения включают ацидоз, олигурию, острые нарушения сознания. У пациентов, получающих инотропные препараты, перфузионные нарушения могут сохраняться при отсутствии артериальной гипотензии.
- Рефрактерный септический шок - септический шок, продолжающийся более одного часа, рефрактерный к инфузионной терапии.
Лечение септического шока:
1. Инфузионная терапия
- Катетеризация двух вен.
- 300-500 мл раствора кристаллоидов в/в в виде болюса, затем 500 мл раствора кристаллоидов в/в капельно в течение 15 минут. Оценить венозную гипертензию и наличие сердечной декомпенсации.
- При наличии сердечной недостаточности целесообразна катетеризация a. pulmonalis катетером Swan-Ganz для оценки волемического статуса: оптимальное PCWP = 12 мм рт. ст. при отсутствии ОИМ и 14-18 мм рт. ст. при наличии ОИМ;
- если после инфузионного болюса величина PCWP превысит 22 мм рт. ст., то следует предположить прогрессирование сердечной недостаточности и прекратить активную инфузию кристаллоидов.
- Если, несмотря на высокие значения давления заполнения левого желудочка, артериальная гипотензия сохраняется - допамин 1-3-5 и более мкг/кг/мин, добутамин 5- 20 мкг/кг/мин.
- Бикарбонат натрия в расчетной дозе с целью коррекции метаболического ацидоза.
2. Терапия гипоксемии/РДСВ - оксигенотерапия, ИВЛ с использование PEEP.
3. Терапия сниженной контрактильной способности миокарда - строфантин К 0,5 мг 1-2 раза в сутки в/в в 10-20 мл 5- 20 %-ного раствора глюкозы или физиологического раствора; дигоксин 0,25 мг 3 раза в сутки per os в течение 7- 10 суток, затем 0,25-0,125 мг в сутки; добутамин 5- 20 мкг/кг/мин в/в.
6. Эмпирическая антибиотикотерапия (учитывается локализация источника септического процесса и предполагаемый спектр возможных микроорганизмов).
7. Хирургическое дренирование очагов инфекции.
8. Препараты, эффективность которых не подтверждена:
Септический шок является осложнением многих заболеваний, связанных с инфекцией, особенно хирургических. В нашей практике септический шок встречается при лечении больных с диабетической флегмоной, гангреной. Иногда сепсис развивается у пациентов с нагноением сосудистых протезов.
Наиболее тяжелым течением сепсис отличается при развитии госпитальной инфекции, когда процесс развивается, как осложнение после проведенных операций. Для предупреждения подобного осложнения применяются меры асептики и антисептики, профилактическое назначение антибиотиков.
Синдром токсического шока — тяжелое острое полиорганное поражение, вызванное экзотоксинами золотистого стафилококка или пиогенного стрептококка. Проявляется внезапным повышением температуры до 38,9°С и более, падением артериального давления, эритематозными кожными высыпаниями с последующим шелушением, профузным поносом, рвотой, признаками поражения разных органов и систем. Диагноз СТШ устанавливают на основе клинической картины, данных физикального обследования, лабораторных, в том числе бактериологических, анализов. Лечение предусматривает санацию бактериального очага, назначение антибиотиков, инфузионной и симптоматической терапии.
МКБ-10
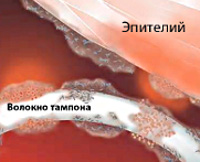
Общие сведения
Синдром токсического шока (СТШ) впервые диагностирован в 1978 г. у семи детей со стафилококковой инфекцией. Специалисты в области гинекологии столкнулись с ним двумя годами позже, отметив связь развития синдрома у молодых женщин с использованием суперадсорбирующих гигиенических тампонов во время месячных. Абсолютное большинство пациенток — женщины в возрасте 17-30 лет. Приблизительно у половины из них развитие синдрома связано с менструацией. В четверти случаев неменструального СТШ заболевание возникает в послеродовом периоде у носительниц Staphylococcus aureus, в 75% — в результате других причин (кожного и подкожного инфицирования, перенесенных операций с тампонированием и пр.).

Причины СТШ
Синдром токсического шока вызывают экзотоксин-продуцирующие микроорганизмы, оказывающие системное воздействие на разные органы и ткани, — золотистый стафилококк (Staphylococcus aureus) и пиогенный β-гемолитический стрептококк группы А (Streptococcus pyogenes). В большинстве случаев заболевание возникает не в момент первичного заражения бактериями, а на фоне носительства инфекционных возбудителей при воздействии следующих предрасполагающих факторов:
- Использование тампонов. Вероятность развития СТШ возрастает при пользовании гигиеническими средствами с повышенными адсорбирующими свойствами и нарушении рекомендуемой частоты их замены.
- Использование интравагинальных контрацептивов. Наличие во влагалище диафрагм, губок, колпачков создает благоприятные условия для размножения микроорганизмов.
- Нарушение целостности слизистых оболочек. При травмах половых органов, наличии в матке остатков плацентарной ткани, плодных оболочек, крови после родов и гинекологических операций возникают оптимальные условия для бактериального обсеменения и проникновения микроорганизмов или их токсинов в кровь.
Неменструальный синдром токсического шока может осложнять хирургические процедуры, при которых применяется перевязочный материал, накапливающий кровь (операции на полости носа с использованием турунд, тампонирование ран и др.), и травматические повреждения кожи. Сочетание указанных факторов с вирусными заболеваниями (ветрянкой, гриппом), приемом иммуносупрессивных препаратов повышает риск развития токсемии и бактериемии.
Патогенез
Ключевую роль в развитии синдрома токсического шока играют механические и химические воздействия, которые способствуют размножению бактерий и влияют на проницаемость тканей. Пусковым моментом служит проникновение в кровь значительных количеств специфических токсинов (TSST) и их взаимодействие с Т-лимфоцитами. В результате массивно высвобождаются цитокины, вызывающие полиорганную токсическую реакцию. Расширяются сосуды и повышается проницаемость их стенки, что приводит к перемещению плазмы крови и сывороточных протеинов во внесосудистое пространство. При этом наблюдается резкое падение давления, возникают отеки, нарушается коагуляция, повышается температура. Под влиянием опосредованных иммунных реакций и прямого действия токсинов поражаются кожа, паренхима печени, легких и других органов.
Симптомы СТШ
У менструирующих женщин, использующих тампоны, признаки СТШ появляются на 3—5-й день менструации. При синдроме токсического шока, осложнившем роды или гинекологические операции, патология проявляется в первые 2 дня послеродового или послеоперационного периода. Как правило, заболевание возникает остро. В редких случаях наблюдается продром в виде общего недомогания, тошноты, головной и мышечных болей. Первым признаком СТШ становится сильный озноб с повышением температуры до 39—40°С, после чего в течение 1—4 суток разворачивается полная клиническая картина.
Практически у всех пациенток возникают мышечная слабость и диффузные боли в мышцах, особенно в мускулатуре проксимальных отделов конечностей, брюшного пресса и спины. Часто беспокоят боли в суставах. Более чем 90% заболевших отмечают упорную рвоту и профузный водянистый понос, скудное количество мочи. Возникают першение в горле, парестезии, головная боль, светобоязнь, головокружение и обмороки на фоне падения АД. В ряде случаев беспокоит кашель, болезненные ощущения при глотании. В острой стадии, длящейся от 24 до 48 часов, пациентка выглядит заторможенной и дезориентированной.
Специфическое проявление синдрома — кожные высыпания в виде диффузного покраснения, которое напоминает солнечный ожог и начинает постепенно бледнеть на протяжении первых 3 дней. В последующем возникает грубое шелушение кожи, особенно заметное на подошвах и ладонях. У некоторых женщин покраснение носит характер пятен различных размеров, к которым присоединяются мелкие узелковые высыпания или точечные петехиальные кровоизлияния. Почти у четверти заболевших на 5—10-е сутки возникает сильный зуд на фоне пятнисто-узелковой сыпи. Практически у 100% пациенток к концу 1—2-ой недели наблюдается неглубокое генерализованное чешуйчатое отслаивание кожного эпителия с более выраженным пластинчатым шелушением ладоней, подошв, пальцев рук и ног. Половина пациенток, перенесших СТШ, к концу 2—3-го месяца отмечает выпадение волос и схождение ногтей.
Почти в 3/4 случаев выявляются гиперемия конъюнктивы, покраснение задней стенки глотки и слизистой рта, малиново-красный цвет языка. Каждую третью менструирующую женщину с СТШ беспокоят болезненность и отечность в области больших и малых половых губ. При тяжелом течении синдрома возникают признаки токсического поражения печени, почек, дыхательной системы с преходящей желтушностью кожи, болью в животе, пояснице, правом подреберье, помутнением мочи, одышкой и т. п.
Кроме клинически выраженного синдрома токсического шока, существует его стертая форма (при первичном проявлении или повторном эпизоде): у пациентки повышается температура, возникает озноб, умеренные мышечные боли, тошнота, рвота, понос, першение в горле. Однако артериальное давление не снижается, и патологическое состояние разрешается без лечения.
Осложнения
При тяжелом течении синдрома наблюдается токсический шок, приводящий к нарушению микроциркуляции и усугубляющий поражение паренхиматозных органов. Возникает дыхательная недостаточность с одышкой и ухудшением оксигенации крови, ДВС-синдром с тромбоэмболией и обильными кровотечениями, нарушается сердечный ритм, в результате острого тубулярного некроза отказывают почки. У пациенток со стрептококковым СТШ более чем в 50% случаев развиваются бактриемия и некротизирующий фасциит. В отдаленном периоде возможна временная потеря ногтей и волос, неврологические нарушения (парестезии, расстройства памяти, повышенная утомляемость).
Диагностика
С учетом полиорганного характера заболевания для постановки диагноза необходимо оценивать как локальные изменения со стороны женских органов, так и признаки нарушения других систем. В комплексное обследование включены:
- Осмотр гинеколога. Выявляются отечность и гиперемия половых органов, в некоторых случаях — скудные выделения гнойного характера из цервикального канала. Пальпаторно может определяться болезненность в области придатков.
- Физикальное обследование. В 100% случаев наблюдается повышение температуры более 38,9°С и падение систолического давления ниже 90 мм рт.ст. (обычно с ортостатическим снижением на 15 мм рт.ст.).
- Общеклинические анализы. Для ОАК характерны лейкоцитоз с высоким нейтрофилезом, сдвиг лейкоцитарной формулы влево, тромбоцитопения, анемия, повышение СОЭ. В общем анализе мочи определяется аномальный мочевой осадок с выщелоченными эритроцитами и стерильной пиурией.
- Биохимический анализ крови. При нарушенной функции печени повышаются уровень билирубина и активность трансфераз (выявляется почти у половины заболевших), при почечной недостаточности возникает азотемия, креатининемия, при поражении мышц — повышенное содержание КФК. В коагулограмме увеличивается протромбиновое время и частичное тромбопластиновое время, определяются продукты деградации фибрина. Анализ крови на электролиты выявляет метаболический ацидоз, снижение уровня кальция, фосфора, натрия, калия.
- Методы определения возбудителя. Для выявления инфекционного агента используют бакпосев мазка из половых органов с антибиотикограммой и посев крови (показан при подозрении на стрептококковый СТШ). Серологические исследования позволяют провести оценку показателей иммунной системы, исключить инфекционные заболевания со сходной клинической картиной.
- Инструментальная диагностика. ЭКГ позволяет своевременно выявить нарушения сердечного ритма. Флюорография или рентгенография ОГК рекомендованы для оценки состояния легких.
Синдром ТШ дифференцируют от сепсиса и инфекционных заболеваний (кори, скарлатины, лептоспироза, гепатита В, пятнистой лихорадки Скалистых гор, брюшного тифа, менингококцемии, вирусных экзантем). Пациентку консультируют анестезиолог-реаниматолог, инфекционист, кардиолог, хирург, уролог, дерматолог, пульмонолог, невропатолог.
Лечение синдрома токсического шока
При выборе схемы лечения синдрома токсического шока важно предусмотреть воздействие на факторы, вызвавшие заболевание, и мероприятия для стабилизации функций пораженных систем. Пациентке показаны:
- Санация бактериального очага. В первую очередь удаляют тампон, диафрагму, колпачок (при их наличии) и промывают влагалище стерильным раствором. При выявлении бактериально обсемененных ран возможно иссечение тканей с участками некроза.
- Антибиотикотерапия. Выбор препарата основан на результатах определения чувствительности к противомикробным средствам. До получения таких данных назначается эмпирическая терапия с учетом вероятного возбудителя и его возможной антибиотикорезистентности. Курс составляет до 10 дней.
- Инфузионная терапия. Ключевой элемент лечения — восстановление внутрисосудистого объема жидкости и стабилизация показателей гемодинамики. В зависимости от характера нарушений пациентке вливают кристаллоидные растворы, электролиты, свежезамороженную плазму крови, тромбоцитарную массу и т. п.
- Вазопрессорные средства. Если коррекция объема внутрисосудистой жидкости не позволяет нормализовать АД, вводят препараты с прессорным эффектом.
При выраженной органной недостаточности пациентке могут назначаться гемодиализ (при острой почечной недостаточности), искусственная вентиляция легких с положительным давлением на выдохе (при респираторном дистресс-синдроме). Ряд авторов отмечают более быстрое выздоровление при назначении кортикостероидов и иммуноглобулинов.
Прогноз и профилактика
В большинстве случаев благодаря достижениям современной гинекологии, своевременной диагностике и лечению пациентки со стафилококковым СТШ выздоравливают за 1—2 недели, при этом смертность на современном этапе составляет 2,6%. Температура и АД нормализуются в течение 2-х суток с момента госпитализации, а лабораторные показатели — на 7—14-ый день. Уровень эритроцитов восстанавливается через 4—6 недель. При стрептококковом токсическом шоке смертность до сих пор остается высокой и достигает 50%. Для профилактики СТШ важно соблюдать рекомендации по использованию тампонов и протоколы обследования перед родами и гинекологическими операциями для своевременного выявления возбудителей.
Септический шок – это тяжелое патологическое состояние, возникающее при массивном поступлении в кровь бактериальных эндотоксинов. Сопровождается тканевой гипоперфузией, критическим снижением артериального давления и симптомами полиорганной недостаточности. Диагноз ставится на основании общей клинической картины, сочетающей в себе признаки поражения легких, сердечно-сосудистой системы (ССС), печени и почек, централизации кровообращения. Лечение: массивная антибиотикотерапия, инфузия коллоидных и кристаллоидных растворов, поддержание деятельности ССС за счёт введения вазопрессоров, коррекция респираторных нарушений путем ИВЛ.
МКБ-10
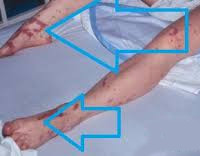
Общие сведения
Септический шок (СШ) также называют инфекционно-токсическим (ИТШ). Как самостоятельная нозологическая единица патология впервые была описана в XIX веке, однако полноценное изучение с разработкой специфических противошоковых мер началось не более 25 лет назад. Может возникать при любом инфекционном процессе. Наиболее часто встречается у пациентов хирургических отделений, при менингококковой септицемии, брюшном тифе, сальмонеллезе и чуме. Распространен в странах, где диагностируется наибольшее количество бактериальных и паразитарных заболеваний (Африка, Афганистан, Индонезия). Ежегодно от ИТШ погибает более 500 тысяч человек по всему миру.

Причины
В абсолютном большинстве случаев патология развивается на фоне ослабления иммунных реакций. Это происходит у пациентов, страдающих хроническими тяжелыми заболеваниями, а также у людей пожилого возраста. В силу физиологических особенностей сепсис чаще диагностируется у мужчин. Список самых распространенных заболеваний, при которых могут возникать явления ИТШ, включает в себя:
- Очаги гнойной инфекции. Признаки системной воспалительной реакции и связанных с ней нарушений в работе внутренних органов отмечаются при наличии объемных абсцессов или флегмоны мягких тканей. Риск генерализованного токсического ответа повышается при длительном течении болезни, отсутствии адекватной антибактериальной терапии и возрасте пациента старше 60 лет.
- Длительное пребывание в ОРИТ. Госпитализация в отделение реанимации и интенсивной терапии всегда сопряжена с риском возникновения сепсиса и инфекционного шока. Это обусловлено постоянным контактом с резистентной к антибактериальным препаратам микрофлорой, ослаблением защитных сил организма в результате тяжёлой болезни, наличием множественных ворот инфекции: катетеров, желудочных зондов, дренажных трубок.
- Раны. Нарушения целостности кожных покровов, в том числе возникшие во время операции, существенно повышают риски инфицирования высококонтагиозной флорой. ИТШ начинается у больных с загрязненными ранами, не получивших своевременной помощи. Травматизация тканей в ходе оперативного вмешательства становится причиной генерализованной инфекции только при несоблюдении правил асептики и антисептики. В большинстве случаев септический шок возникает у пациентов, перенесших манипуляции на желудке и поджелудочной железе. Еще одна распространенная причина – разлитой перитонит.
- Приём иммунодепрессантов. Лекарственные средства, угнетающие иммунитет (меркаптопурин, кризанол), используются для подавления реакции отторжения после трансплантации органов. В меньшей степени уровень собственной защиты снижается при употреблении химиотерапевтических средств – цитостатиков, предназначенных для лечения онкологических заболеваний (доксорубицина, фторурацила).
- СПИД.ВИЧ-инфекция в стадии СПИДа приводит к развитию нетипичного сепсиса, спровоцированного не бактериальный культурой, а грибком рода Candida. Клинические проявления болезни характеризуется малой степенью выраженности. Отсутствие адекватного иммунного ответа позволяет патогенной флоре свободно размножаться.
Возбудитель сепсиса – грамположительные (стрептококки, стафилококки, энтерококки) и грамотрицательные (Enterobacter cloacae, Clostridium pneumoniae) бактерии. Во многих случаях культуры нечувствительны к антибиотикам, что затрудняет лечение пациентов. Септический шок вирусного происхождения в настоящее время вызывает споры специалистов. Одни представители научного мира утверждают, что вирусы неспособны стать причиной патологии, другие – что внеклеточная форма жизни может спровоцировать системную воспалительную реакцию, являющуюся патогенетической основой ИТШ.
Патогенез
В основе симптомов лежит неконтролируемое распространение медиаторов воспаления из патологического очага. При этом происходит активация макрофагов, лимфоцитов и нейтрофилов. Возникает синдром системного воспалительного ответа. На фоне этого снижается периферический сосудистый тонус, объем циркулирующей крови падает за счет повышения проницаемости сосудов и застоя жидкости в микроциркуляторном русле. Дальнейшие изменения обусловлены резким уменьшением перфузии. Недостаточное кровоснабжение становится причиной гипоксии, ишемии внутренних органов и нарушения их функции. Наиболее чувствителен головной мозг. Кроме того, ухудшается функциональная активность легких, почек и печени.
Помимо СВР в формировании септического шока важную роль играет эндогенная интоксикация. В связи со снижением работоспособности экскреторных систем в крови накапливаются продукты нормального обмена веществ: креатинин, мочевина, лактат, гуанин и пируват. Во внутренних средах повышается концентрация промежуточных результатов окисления липидов (скатол, альдегиды, кетоны) и бактериальных эндотоксинов. Всё это вызывает тяжелые изменения гомеостаза, расстройства кислотно-щелочного баланса, нарушения в работе рецепторных систем.
Классификация
Симптомы септического шока
90% случаев СШ сопровождается дыхательной недостаточностью различной степени тяжести. Пациенты с декомпенсированным и терминальным течением болезни нуждаются в аппаратной респираторной поддержке. Печень и селезенка увеличены, уплотнены, их функция нарушена. Может отмечаться атония кишечника, метеоризм, стул с примесью слизи, крови и гноя. На поздних стадиях возникают симптомы диссеминированного внутрисосудистого свертывания: петехиальная сыпь, внутреннее и наружное кровотечения.
Осложнения
Септический шок приводит к ряду тяжелых осложнений. Наиболее распространённым из них считается полиорганная недостаточность, при которой нарушается функция двух и более систем. В первую очередь страдает ЦНС, легкие, почки и сердце. Несколько реже встречается поражение печени, кишечника и селезенки. Летальность среди пациентов с ПОН достигает 60%. Часть из них погибает на 3-5 сутки после выведения из критического состояния. Это обусловлено органическими изменениями во внутренних структурах.
Еще одним распространенным последствием ИТШ являются кровотечения. При формировании внутримозговых гематом у пациента развивается клиника острого геморрагического инсульта. Скопление экстравазата в других органах может приводить к их сдавлению. Уменьшение объема крови в сосудистом русле потенцирует более значимое снижение артериального давления. ДВС на фоне инфекционно-токсического шока становится причиной гибели пациента в 40-45% случаев. Вторичное поражение органов, спровоцированное микротромбозами, возникающими на начальном этапе формирования коагулопатии, отмечается практически у 100% больных.
Диагностика
- Осмотр и физикальное исследование. Реализуется непосредственно лечащим врачом. Специалист обнаруживает характерные клинические признаки шокового состояния. Для этого проводится тонометрия, визуальная оценка цвета кожных покровов, особенностей дыхательных движений, подсчет пульса и ЧДД, аускультация сердца и легких. При подозрении на наличие осложнений необходима оценка неврологического статуса на предмет симптоматики кровоизлияния в мозг.
- Аппаратное исследование. Имеет вспомогательное значение. Пациенту показан контроль состояния с использованием анестезиологического монитора. На экран устройства выводится информация о величине артериального давления, частоте сердечных сокращений, степени насыщения крови кислородом (при легочной недостаточности SpO2<90%) и коронарном ритме. На фоне нарушений дыхания и токсического поражения миокарда может отмечаться тахикардия, аритмия и блокады внутрисердечной проводимости.
- Лабораторное исследование. Позволяет выявить имеющиеся нарушения гомеостаза, сбои в работе внутренних органов. У пациентов с шоком септического происхождения обнаруживается повышенный уровень креатинина (> 0,177 ммоль/л), билирубина (>34,2 мкмоль/л), лактата (>2 ммоль/л). О нарушении коагуляции свидетельствует тромбоцитопения (
Лечение септического шока
Пациентам показана интенсивная терапия. Лечение проводят в отделениях ОРИТ с использованием методов аппаратной и медикаментозной поддержки. Лечащий врач – реаниматолог. Может потребоваться консультация инфекциониста, кардиолога, гастроэнтеролога и других специалистов. Требуется перевод больного на искусственную вентиляцию лёгких, круглосуточное наблюдение среднего медицинского персонала, парентеральное кормление. Смеси и продукты, предназначенные для введения в желудок, не используются. Все методы воздействия условно делятся на патогенетические и симптоматические:
- Патогенетическое лечение. При подозрении на наличие сепсиса больному назначают антибиотики. Схема должна включать в себя 2-3 препарата различных групп, обладающих широким спектром действия. Подбор медикамента на начальном этапе проводят эмпирическим путем, в соответствии с предполагаемой чувствительностью возбудителя. Одновременно с этим производят забор крови на стерильность и восприимчивость к антибиотикам. Результат анализа готовится в течение 10 дней. Если к этому времени подобрать эффективную лекарственную схему не удалось, следует использовать данные исследования.
- Симптоматическое лечение. Подбирается с учетом имеющейся клинической картины. Обычно больные получают массивную инфузионную терапию, глюкокортикостероиды, инотропные средства, антиагреганты или гемостатики (в зависимости от состояния свертывающей системы крови). При тяжелом течении болезни используют препараты крови: свежезамороженную плазму, альбумин, иммуноглобулины. Если пациент находится в сознании, показано введение анальгетических и седативных лекарств.
Прогноз и профилактика
Септический шок имеет неблагоприятный прогноз для жизни. При субкомпенсированном течении погибает около 40% больных. Декомпенсированная и терминальная разновидности оканчиваются гибелью 60% пациентов. При отсутствии своевременной медицинской помощи смертность достигает 95-100%. Часть больных умирает через несколько дней после устранения патологического состояния. Профилактика ИТШ заключается в своевременном купировании очагов инфекции, грамотном подборе антибиотикотерапии у хирургических больных, соблюдении антисептических требований в отделениях, занимающихся инвазивным манипуляциями, поддержке адекватного иммунного статуса у представителей ВИЧ-инфицированной прослойки населения.
2. Тактика ведения пациентов с сепсисом и септическим шоком в многопрофильном стационаре/ Сапичева Ю.Ю., Лихванцев В.В. – 2015.
Cептический шок возможен при перитоните, инфекциях мочевыводящих и жёлчных путей, пневмонии, панкреонекрозе, септических родах и аборте. Чаще всего септический шок возникает в результате действия грамотрицательных бактерий (Е. coli, Klebsiella, Proteus), но патогенными могут быть и другие агенты (грамположительные бактерии, вирусы, грибки, простейшие).
Патогенез • Изменения сосудистого русла имеют различную направленность (в зависимости от вида микроорганизмов, обусловивших септический шок) •• Грамположительная флора выделяет экзотоксины, вызывающие протеолиз и последующее образование плазмокининов. В рбзультате действия последних развиваются паралич сосудов и артериальная гипотензия по изоволемическому типу •• Грамотрицательная флора содержит эндотоксин, поступающий в кровь при разрушении бактерий. Стимулируя мозговой слой надпочечников, он приводит к выделению катехоламинов и последующему сужению сосудов • Нарушения сократительной функции миокарда при септическом шоке наступают на поздних сроках, в результате длительной коронарной недостаточности. Кроме прямого влияния токсинов на миокард, имеет значение сгущение крови, особенно значительное при перитоните и панкреонекрозе • Дыхательная недостаточность при септическом шоке обусловлена: •• синдромом шокового лёгкого, зависящего от нарушения микроциркуляции •• ухудшением сократимости дыхательных мышц •• несоответствием между функцией лёгких и возросшими требованиями к вентиляции (тахипноэ создаёт компенсаторный дыхательный алкалоз в ответ на избыточное образование органических кислот и угольной кислоты; гипервентиляция также связана с лихорадкой и прямым действием токсинов бактерий на дыхательный центр) • Печёночная недостаточность бывает обусловлена бактериемией, эндотоксемией, а также гипоперфузией и гипоксией органа. Истощаются фиксированные макрофаги (купферовские клетки), возникает портальная гипертензия • Нарушения реологии крови. С одной стороны, поражение печени приводит к уменьшению образования протромбина и повышению фибринолитической активности крови. С другой стороны, уровень фибриногена в крови остаётся высоким, а уровень эндогенного гепарина снижается. Поэтому гиперкоагуляция сохраняется и создаются условия для возникновения ДВС • Почечная недостаточность при септическом шоке возникает в результате гиперкоагуляции. Быстро развиваются необратимые изменения, вплоть до массивного тубулярного некроза • Повреждения поджелудочной железы имеют ишемическое происхождение. Вначале происходит активация секреторной функции с выбросом в кровоток протеолитических ферментов. На поздних сроках возможен асептический панкреонекроз. Дисфункция поджелудочной железы вызывает: •• гипергликемию •• избыточное образование кининов (протеазы поджелудочной железы трансформируют неактивные кининогены в активные кинины), кинины вызывают повышение проницаемости сосудистой стенки и снижают АД •• геморрагический гастроэнтероколит (в результате повышенной секреции протеаз в просвет кишечника и застоя крови в брыжейке) • Возникает вторичный иммунодефицит.
Клинические проявления
• Симптомы инфекции: гипертермия, ознобы, бактериемия, изменения белой и красной крови.
• Нервно-психические расстройства: возбуждение, судороги, сопор, кома.
• Сердечно-сосудистые расстройства: артериальная гипотензия, нарушения ритма, ишемия миокарда. Нарушения микроциркуляции: •• при гипердинамическом синдроме кожные покровы тёплые, сухие, гиперемированные •• при гиподинамическом синдроме — холодная, влажная, мраморная с цианозом кожа.
• Дыхательные расстройства: тахипноэ, гипоксемия, низкий артериовенозный градиент рО2.
• Нарушения функций паренхиматозных органов: •• олигурия (менее 600–700 мл/сут), гиперазотемия, гиперкреатининемия •• желтуха, повышение активности трансаминаз •• диастазурия, гиперамилаземия, гипергликемия.
• Тромбогеморрагический синдром, в т.ч. желудочно-кишечные кровотечения.
• Лабораторные данные: коагулопатия, нарушения КЩР (респираторный алкалоз, метаболический ацидоз), нарушение водно-электролитного баланса, диспротеинемия.
Лечение • Хирургическое лечение очагов инфекции • Коррекция расстройств гемодинамики • Обеспечение адекватной лёгочной вентиляции и газообмена: масочная ингаляция 100% кислорода, если при этом р a О2 не превышает 60–70 мм рт.ст. — ИВЛ • Восполнение потерь жидкости, парентеральное питание, коррекция КЩР и электролитных нарушений •• Суточный объём инфузии определяют дефицитом ОЦК •• Инфузии альбумина и протеина — при шоковом лёгком •• Белковые и аминокислотные инфузии (обеспечение не менее 4000 ккал) •• Жировые эмульсии не показаны из-за опасности блокады ретикулоэндотелиальной системы • Коррекция метаболических нарушений • При олигурии на фоне достаточного ОЦК — фуросемид (по 100–200 мг в/м или в/в дробно через каждые 4 ч) в сочетании с осмотическими диуретиками (маннитол 1 г/кг в/в капельно) • Лечение пареза кишечника •• Стимуляция моторики кишечника (гипертонические клизмы, диадинамические токи Бернара) •• Неостигмина метилсульфат (1 мл 0,05% р-ра п/к 2 р/сут), дистигмина бромид (1 мл 0,05% р-ра в/м 1 р/сут) • Антистафилококковый иммуноглобулин в/м через день до 4 доз, антистафилококковая плазма в/в, иммуноглобулин человеческий нормальный (IgG+IgA+IgM), иммуноглобулин человеческий нормальный, моноклональные АТ • Антибиотикотерапия •• Препараты выбора — пенициллины, аминогликозиды, цефалоспорины, карбапенемы, производные фторхинолона в больших дозах (например, гентамицин — до 240–400 мг/сут, цефалоспорины — до 12 г/сут) •• Для профилактики суперинфекции противогрибковые препараты (нистатин 500 000 ЕД 3–4 р/сут, леворин 500 000 ЕД 2–4 р/сут), амфотерицин В, флуконазол, бифидобактерии бифидум, бифиформ.
Синонимы • Токсико-инфекционный шок • Эндотоксиновый xe "Шок:эндотоксиновый" шок • Бактериемический шок • Инфекционно-токсический xe "Шок:инфекционно-токсический" шок
МКБ-10 • A48.3 Синдром xe "Синдром:токсического шока" токсического шока
Код вставки на сайт
Cептический шок возможен при перитоните, инфекциях мочевыводящих и жёлчных путей, пневмонии, панкреонекрозе, септических родах и аборте. Чаще всего септический шок возникает в результате действия грамотрицательных бактерий (Е. coli, Klebsiella, Proteus), но патогенными могут быть и другие агенты (грамположительные бактерии, вирусы, грибки, простейшие).
Патогенез • Изменения сосудистого русла имеют различную направленность (в зависимости от вида микроорганизмов, обусловивших септический шок) •• Грамположительная флора выделяет экзотоксины, вызывающие протеолиз и последующее образование плазмокининов. В рбзультате действия последних развиваются паралич сосудов и артериальная гипотензия по изоволемическому типу •• Грамотрицательная флора содержит эндотоксин, поступающий в кровь при разрушении бактерий. Стимулируя мозговой слой надпочечников, он приводит к выделению катехоламинов и последующему сужению сосудов • Нарушения сократительной функции миокарда при септическом шоке наступают на поздних сроках, в результате длительной коронарной недостаточности. Кроме прямого влияния токсинов на миокард, имеет значение сгущение крови, особенно значительное при перитоните и панкреонекрозе • Дыхательная недостаточность при септическом шоке обусловлена: •• синдромом шокового лёгкого, зависящего от нарушения микроциркуляции •• ухудшением сократимости дыхательных мышц •• несоответствием между функцией лёгких и возросшими требованиями к вентиляции (тахипноэ создаёт компенсаторный дыхательный алкалоз в ответ на избыточное образование органических кислот и угольной кислоты; гипервентиляция также связана с лихорадкой и прямым действием токсинов бактерий на дыхательный центр) • Печёночная недостаточность бывает обусловлена бактериемией, эндотоксемией, а также гипоперфузией и гипоксией органа. Истощаются фиксированные макрофаги (купферовские клетки), возникает портальная гипертензия • Нарушения реологии крови. С одной стороны, поражение печени приводит к уменьшению образования протромбина и повышению фибринолитической активности крови. С другой стороны, уровень фибриногена в крови остаётся высоким, а уровень эндогенного гепарина снижается. Поэтому гиперкоагуляция сохраняется и создаются условия для возникновения ДВС • Почечная недостаточность при септическом шоке возникает в результате гиперкоагуляции. Быстро развиваются необратимые изменения, вплоть до массивного тубулярного некроза • Повреждения поджелудочной железы имеют ишемическое происхождение. Вначале происходит активация секреторной функции с выбросом в кровоток протеолитических ферментов. На поздних сроках возможен асептический панкреонекроз. Дисфункция поджелудочной железы вызывает: •• гипергликемию •• избыточное образование кининов (протеазы поджелудочной железы трансформируют неактивные кининогены в активные кинины), кинины вызывают повышение проницаемости сосудистой стенки и снижают АД •• геморрагический гастроэнтероколит (в результате повышенной секреции протеаз в просвет кишечника и застоя крови в брыжейке) • Возникает вторичный иммунодефицит.
Клинические проявления
• Симптомы инфекции: гипертермия, ознобы, бактериемия, изменения белой и красной крови.
• Нервно-психические расстройства: возбуждение, судороги, сопор, кома.
• Сердечно-сосудистые расстройства: артериальная гипотензия, нарушения ритма, ишемия миокарда. Нарушения микроциркуляции: •• при гипердинамическом синдроме кожные покровы тёплые, сухие, гиперемированные •• при гиподинамическом синдроме — холодная, влажная, мраморная с цианозом кожа.
• Дыхательные расстройства: тахипноэ, гипоксемия, низкий артериовенозный градиент рО2.
• Нарушения функций паренхиматозных органов: •• олигурия (менее 600–700 мл/сут), гиперазотемия, гиперкреатининемия •• желтуха, повышение активности трансаминаз •• диастазурия, гиперамилаземия, гипергликемия.
• Тромбогеморрагический синдром, в т.ч. желудочно-кишечные кровотечения.
• Лабораторные данные: коагулопатия, нарушения КЩР (респираторный алкалоз, метаболический ацидоз), нарушение водно-электролитного баланса, диспротеинемия.
Лечение • Хирургическое лечение очагов инфекции • Коррекция расстройств гемодинамики • Обеспечение адекватной лёгочной вентиляции и газообмена: масочная ингаляция 100% кислорода, если при этом р a О2 не превышает 60–70 мм рт.ст. — ИВЛ • Восполнение потерь жидкости, парентеральное питание, коррекция КЩР и электролитных нарушений •• Суточный объём инфузии определяют дефицитом ОЦК •• Инфузии альбумина и протеина — при шоковом лёгком •• Белковые и аминокислотные инфузии (обеспечение не менее 4000 ккал) •• Жировые эмульсии не показаны из-за опасности блокады ретикулоэндотелиальной системы • Коррекция метаболических нарушений • При олигурии на фоне достаточного ОЦК — фуросемид (по 100–200 мг в/м или в/в дробно через каждые 4 ч) в сочетании с осмотическими диуретиками (маннитол 1 г/кг в/в капельно) • Лечение пареза кишечника •• Стимуляция моторики кишечника (гипертонические клизмы, диадинамические токи Бернара) •• Неостигмина метилсульфат (1 мл 0,05% р-ра п/к 2 р/сут), дистигмина бромид (1 мл 0,05% р-ра в/м 1 р/сут) • Антистафилококковый иммуноглобулин в/м через день до 4 доз, антистафилококковая плазма в/в, иммуноглобулин человеческий нормальный (IgG+IgA+IgM), иммуноглобулин человеческий нормальный, моноклональные АТ • Антибиотикотерапия •• Препараты выбора — пенициллины, аминогликозиды, цефалоспорины, карбапенемы, производные фторхинолона в больших дозах (например, гентамицин — до 240–400 мг/сут, цефалоспорины — до 12 г/сут) •• Для профилактики суперинфекции противогрибковые препараты (нистатин 500 000 ЕД 3–4 р/сут, леворин 500 000 ЕД 2–4 р/сут), амфотерицин В, флуконазол, бифидобактерии бифидум, бифиформ.
Синонимы • Токсико-инфекционный шок • Эндотоксиновый xe "Шок:эндотоксиновый" шок • Бактериемический шок • Инфекционно-токсический xe "Шок:инфекционно-токсический" шок
МКБ-10 • A48.3 Синдром xe "Синдром:токсического шока" токсического шока
Читайте также:

