Что такое токсокароз унцинариоз анкилостомоз
Обновлено: 24.04.2024
Токсокароз — паразитарное заболевание, вызываемое миграцией личинок аскарид животных семейства псовых (T. canis ). Характеризуется длительным рецидивирующим течением и полиорганными поражениями иммунологической природы. Возбудителями токсокароза могут бы
Токсокароз — паразитарное заболевание, вызываемое миграцией личинок аскарид животных семейства псовых (T. canis ). Характеризуется длительным рецидивирующим течением и полиорганными поражениями иммунологической природы. Возбудителями токсокароза могут быть также личинки других аскарид — кошки (T. mystax), коровы, буйвола, (T. vitulorum). Однако роль этих возбудителей в патологии человека практически не изучена
Половозрелые формы T. canis — крупные раздельнополые черви длиной 4 — 18 см локализуются в желудке и тонком кишечнике животных (собак). Интенсивность инвазии у собак может быть очень высокой, особенно у молодых животных. Средняя продолжительность жизни половозрелых особей составляет 4 месяца, максимальная — 6 месяцев. Самка паразита за сутки откладывает более 200 тыс. яиц. В 1 г фекалий может содержаться 10 000—15 000 яиц, так что в почву попадают миллионы яиц, обусловливая тем самым высокий риск заражения токсокарозом.
 |
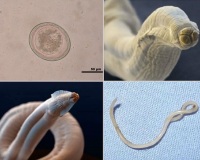
Яйца токсокар округлой формы, крупнее яиц аскариды (65—75 мкм). Наружная оболочка яйца толстая, плотная, мелкобугристая. Внутри яйца располагается темный бластомер.
Цикл развития возбудителя следующий. Выделившиеся яйца токсокар попадают в почву, где, в зависимости от влажности и температуры почвы, созревают за 5—36 суток, становясь инвазионными. Инвазионность яиц сохраняется в почве длительное время, в компосте — несколько лет.
Жизненный цикл токсокары сложный. Выделяют основной цикл и два варианта вспомогательных. Основной цикл происходит по схеме: окончательный хозяин (псовые) — почва — окончательный хозяин (псовые). Передача инвазии осуществляется геооральным путем. Вспомогательный цикл (вариант 1) идет трансплацентарно, в этом случае паразит в личиночной стадии переходит от беременной самки к плоду, в организме которого совершает полную миграцию, достигая в кишечнике щенка половозрелой стадии. Инвазированный щенок становится функционально полноценным окончательным хозяином, источником инвазии.
Вспомогательный цикл (вариант 2) осуществляется по цепи: окончательный хозяин (псовые) — почва — паратенический хозяин. Паратеническим (резервуарным) хозяином могут быть грызуны, свиньи, овцы, птицы, земляные черви. Человек также выступает в роли паратенического хозяина, но не включается в цикл передачи инвазии, являясь для паразита биологическим тупиком. Дальнейшее развитие возбудителя происходит при условии, что паратенический хозяин будет съеден собакой или другим окончательным хозяином. Механизм передачи инвазии при этом варианте — геооральный — ксенотрофный.
В зависимости от возраста хозяина реализуются разные пути миграции личинок токсокар. У молодых животных (щенков до 5 недель) почти все личинки совершают полную миграцию с достижением половозрелых форм в кишечнике и выделением яиц во внешнюю среду. В организме взрослых животных большая часть личинок мигрирует в соматические ткани, где сохраняет жизнеспособность несколько лет. В период беременности и лактации у беременных сук возобновляется миграция личинок. Мигрирующие личинки через плаценту попадают в организм плода. Личинки остаются в печени пренатально инвазированных щенков до рождения, а после рождения личинки из печени мигрируют в легкие, трахею, глотку, пищевод и попадают в желудочно-кишечный тракт, где через 3—4 недели достигают половозрелой стадии и начинают выделять во внешнюю среду яйца. Кормящие суки могут передавать щенкам инвазию также через молоко.
У человека цикл развития возбудителя, его миграция осуществляется следующим образом. Из яиц токсокар, попавших в рот, затем в желудок и тонкий кишечник выходят личинки, которые через слизистую оболочку проникают в кровеносные сосуды и через систему воротной вены мигрируют в печень, где часть из них оседает, инцистируется или окружается воспалительными инфильтратами, образуя гранулемы. Часть личинок по системе печеночных вен проходит фильтр печени, попадает в правое сердце и через легочную артерию — в капиллярную сеть легких. В легких часть личинок также задерживается, а часть, пройдя фильтр легких, по большому кругу кровообращения заносится в различные органы, оседая в них. Личинки токсокар могут локализоваться в различных органах и тканях — почках, мышцах, щитовидной железе, головном мозге и др. В тканях личинки сохраняют жизнеспособность многие годы и периодически, под влиянием различных факторов, возобновляют миграцию, обусловливая рецидивы заболевания.
- Географическое распространение и эпидемиология
Токсокароз — широко распространенная инвазия, она регистрируется во многих странах. Показатели пораженности плотоядных являются высокими во всех странах мира. Средняя пораженность собак кишечным токсокарозом, обследованных на различных континентах, составляет свыше 15%, но в некоторых регионах у части животных достигает 93%. По данным сероэпидемиологических исследований, от 2 до 14% обследованных практически здоровых лиц в различных очагах токсокароза имеют положительные иммунологические реакции на токсокароз. Распространенность инвазии в различных регионах точно неизвестна, поскольку токсокароз не подлежит обязательной регистрации. Совершенно очевидно, что токсокароз имеет широкую геграфию распространения, и число больных значительно выше официально регистрируемых.
| Токсокароз широко распространен и регистрируется во многих странах. Средняя пораженность кишечным токсокарозом собак, обследованных на различных континентах, составляет свыше 15%, но в некоторых регионах достигает 93%. По данным сероэпидемиологических исследований, от 2 до 14% обследованных практически здоровых лиц в различных очагах токсокароза имеют положительные иммунологические реакции на токсокароз |
- Патогенез и патологическая анатомия
Патогенез токсокароза сложный и определяется комплексом механизмов в системе паразит — хозяин. В период миграции личинки травмируют кровеносные сосуды и ткани, вызывая геморрагии, некроз, воспалительные изменения. Ведущая роль принадлежит иммунологическим реакциям организма в ответ на инвазию. Экскреторно-секреторные антигены личинок оказывают сенсибилизирующее действие с развитием реакций немедленного и замедленного типов. При разрушении личинок в организм человека попадают соматические антигены личинок. Аллергические реакции проявляются отеками, кожной эритемой, увеличением резистентности дыхательных путей к вдыхаемому воздуху, что клинически выражается развитием приступов удушья. В аллергических реакциях принимают участие тучные клетки, базофилы, нейтрофилы, но основную роль играют эозинофилы. Пролиферация эозинофилов регулируется Т-лимфоцитами при участии медиаторов воспалительных реакций, выделяемых сенсибилизированными лимфоцитами, нейтрофилами, базофилами. Образующиеся иммунные комплексы привлекают в очаг поражения эозинофилы. Вокруг личинок токсокар кумулируются сенсибилизированные Т-лимфоциты, привлекаются макрофаги и другие клетки — формируется паразитарная гранулома.
Патоморфологическим субстратом токсокароза является выраженное в различной степени гранулематозное поражение тканей. При интенсивной инвазии развиваются тяжелые гранулематозные поражения многих органов и систем, которые при повторных заражениях могут стать хроническими. При токсокарозе находят многочисленные гранулемы в печени, легких, поджелудочной железе, миокарде, лимфатических узлах, головном мозге и других органах.
Наиболее характерным лабораторным показателем является повышенное содержание эозинофилов в периферической крови. Относительный уровень эозинофилии может колебаться в широких пределах, достигая в ряде случаев 70 — 80% и более. Повышается содержание лейкоцитов (от 20х109 до 30х109 на 1 л). При исследовании пунктата костного мозга выявляется гиперплазия зрелых эозинофилов. У детей нередко отмечается умеренная анемия. Некоторые исследователи отмечают прямую корреляцию между тяжестью клинических проявлений инвазии и уровнем эозинофилии и гиперлейкоцитоза периферической крови. Характерным лабораторным признаком является также ускорение СОЭ, гипергаммаглобулинемия. В случаях поражения печени наблюдается повышение билирубина, гиперферментемия.
В хронической стадии болезни острые клинические и лабораторные признаки затухают. Наиболее стабильным лабораторным показателем остается гиперэозинофилия периферической крови.
Выделяют субклиническое, легкое, среднетяжелое и тяжелое течение токсокароза. Возможна так называемая бессимптомная эозинофилия крови, когда явные клинические проявления инвазии отсутствуют, но наряду с гиперэозинофилией выявляются антитела к антигенам T.canis.
Одной из наиболее серьезных проблем, связанных с токсокарозом, является его взаимосвязь с бронхиальной астмой. При сероэпидемиологических исследованиях установлено, что у больных бронхиальной астмой нередко обнаруживаются антитела к антигенам T.canis классов Ig G и Ig E. В зависимости от остроты паразитарного процесса, его длительности и длительности клинических проявлений бронхиальной астмы преобладает тот или другой класс иммуноглобулинов. Имеются клинические наблюдения, свидетельствующие об улучшении течения бронхиальной астмы или выздоровлении после ликвидации токсокарозной инвазии.
Паразитологический диагноз устанавливается редко и только по наличию в тканях характерных гранулем и личинок и их идентификации при исследовании биопсийного и секционного материала. Это возможно при пункционной биопсии печени, легких, оперативном вмешательстве. Обычно диагноз токсокароза устанавливается на основании данных эпидемиологического анамнеза, клинической симптоматики и гематологических проявлений. Используют также иммунологические реакции, позволяющие выявлять антитела к антигенам токсокар. Обычно применяют ИФА с секреторно-экскреторным антигеном личинок токсокар второго возраста. В настоящее время в России выпускается коммерческий диагностикум. Диагностическим титром считают титр антител 1:400 и выше (в ИФА). Титр антител 1:400 свидетельствует об инвазированности, но не болезни. Титр антител 1:800 и выше свидетельствует о заболевании токсокарозом. Практика показывает, что прямая корреляция между уровнем антител и тяжестью клинических проявлений токсокароза существует не всегда. Не всегда имеется и корреляция между уровнем антител и гиперэозинофилии крови.
При постановке диагноза и определении показаний к специфической терапии следует учитывать, что токсокароз протекает циклически с рецидивами и ремиссиями, в связи с чем возможны значительные колебания клинических, гематологических и иммунологических показателей у одного и того же больного.
М. И. Алексеева и соавт. (1984) разработали алгоритм диагностики токсокароза, основанный на оценках в баллах значимости клинических симптомов и сопоставлении клинико-эпидемиологических и лабораторных показателей. Этот метод может быть перспективен при проведении массовых обследований населения.
Дифференциальный диагноз проводят с миграционной стадией других гельминтозов (аскаридоз, описторхоз), стронгилоидозом, эозинофильной гранулемой, лимфогранулематозом, эозинофильным васкулитом, метастазирующей аденомой поджелудочной железы, гипернефромой и другими заболеваниями, сопровождающимися повышенным содержанием эозинофилов в периферической крови. Следует иметь в виду, что у больных с системными лимфопролиферативными заболеваниями и серьезными нарушениями в системе иммунитета иммунологические реакции могут быть ложно положительными. В этих случаях необходим тщательный анализ клинической картины заболевания.
| При интенсивной инвазии развиваются тяжелые гранулематозные поражения многих органов и систем, которые при повторных заражениях могут стать хроническими |
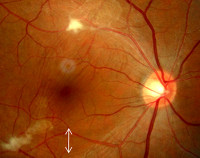
Глазной токсокароз. Патогенез этой формы токсокароза до конца не ясен. Существует гипотеза об избирательном поражении глаз у лиц с инвазией низкой интенсивности, при которой не развивается достаточно выраженная иммунная реакция организма из-за слабого антигенного воздействия небольшого числа поступивших в организм личинок токсокар.
Эта форма токсокароза чаще наблюдается у детей и подростков, хотя описаны случаи заболевания и у взрослых.
Для токсокароза характерно одностороннее поражение глаз. Патологический процесс развивается в сетчатке, поражается хрусталик, иногда параорбитальная клетчатка. В тканях глаза формируется воспалительная реакция гранулематозного характера. Патологический процесс часто принимают за ретинобластому, проводят энуклеацию глаза. При морфологическом исследовании обнаруживают эозинофильные гранулемы, иногда — личинки токсокар.
Клинически поражение глаз протекает как хронический эндофтальмит, хориоретинит, иридоциклит, кератит, папиллит. Глазной токсокароз — одна из частых причин потери зрения.
Диагностика глазного токсокароза сложна. Количество эозинофилов обычно нормальное или незначительно повышено. Специфические антитела не выявляются или выявляются в низких титрах.
Разработано недостаточно. Применяют противонематодозные препараты — тиабендазол (минтезол), мебендазол (вермокс), медамин, диэтилкарбамазин. Эти препараты эффективны в отношении мигрирующих личинок и недостаточно эффективны в отношении тканевых форм, находящихся в гранулемах внутренних органов.
Минтезол (тиабендазол) назначают в дозах 25—50 мг/кг массы тела в сутки в три приема в течение 5—10 дней. Побочные явления возникают часто и проявляются тошнотой, головной болью, болями в животе, чувством отвращения к препарату (в настоящее время препарат в аптечную сеть России не поступает).
Вермокс (мебендазол) назначают по 200 —300 мг в сутки в течение 1—4 недель. Побочные реакции обычно не наблюдаются.
 |
Медамин применяют в дозе 10 мг/кг массы тела в сутки повторными циклами по 10 — 14 дней.
Диэтилкарбамазин назначают в дозах 2 — 6 мг/кг массы тела в сутки в течение 2 — 4 недель. (В настоящее время препарат в России не производится, не закупается за рубежом. — Прим. ред.)
Альбендазол назначают в дозе 10 мг/кг массы тела в сутки в два приема (утро — вечер) в течение 7 — 14 дней. В процессе лечения необходим контроль анализа крови (возможность развития агранулоцитоза) и уровня аминотрансфераз (гепатотоксическое действие препарата). Небольшое повышение уровня аминотрансфераз не является показанием к отмене препарата. В случае нарастающей гиперферментемии и угрозы развития токсического гепатита требуется отмена препарата.
Критерии эффективности лечения: улучшение общего состояния, постепенная регрессия клинических симптомов, снижение уровня эозинофилии и титров специфических антител. Следует отметить, что клинический эффект лечения опережает положительную динамику гематологических и иммунологических изменений. При рецидивах клинической симптоматики, стойкой эозинофилии и положительных иммунологических реакциях проводят повторные курсы лечения.
Прогноз для жизни благоприятный, однако при массивной инвазии и тяжелых полиорганных поражениях, особенно у лиц с нарушениями иммунитета, возможен летальный исход.
Включает соблюдение личной гигиены, обучение детей санитарным навыкам.
Важным профилактическим мероприятием является своевременное обследование и дегельминтизация собак. Наиболее эффективно преимагинальное лечение щенков в возрасте 4 — 5 недель, а также беременных сук. Для лечения собак используют противонематодозные препараты. Необходимо ограничение численности безнадзорных собак, оборудование специальных площадок для выгула собак.
Следует улучшить санитарно-просветительскую работу среди населения, давать информацию о возможных источниках инвазии и путях ее передачи. Особого внимания требуют лица, по роду деятельности имеющие контакты с источниками инвазии (ветеринарные работники, собаководы, землекопы и другие).
Токсокароз – это хроническое инфекционное заболевание, вызываемое личинками круглого червя токсокары. Для инвазии характерна лихорадка, рецидивирующие высыпания и увеличение размеров печени. Патология сопровождается поражением глазных яблок и внутренних органов: сердца, головного мозга, легких. Диагностика заключается в обнаружении специфических антител к возбудителю. Лечение этиотропное (антигельминтные препараты), также применяются средства симптоматической терапии, в некоторых случаях производятся хирургические вмешательства.
МКБ-10
B83.0 Висцеральная форма заболеваний, вызываемых миграцией личинок гельминтов [висцеральная Larva migrans]
Общие сведения

Причины токсокароза
Возбудитель – круглый червь Toxocara, наиболее часто встречаются инвазии видами Т. сanis (собачий) и T. сati (кошачий). Основной цикл развития паразита не включает в себя человеческий организм, поэтому люди оказываются случайными хозяевами гельминта, который в подобных условиях неспособен достигать половозрелой формы. Источником инфекции является больное животное (чаще собака), больной человек эпидемиологически не опасен. Считается, что доля зараженных токсокарозом среди взрослых собак варьирует от 15 до 50%, щенков – до 80%.
Больные животные выделяют яйца гельминтов с фекалиями, сами паразиты в половозрелой форме находятся у постоянного хозяина в пищеварительном тракте. Наиболее опасными считаются дворы, детские площадки, парки, поскольку контаминация земли яйцами паразита встречается в 10-40% почвенных проб. Инфицирование людей происходит контактным и пищевым путем – при поглаживании, играх со зверями, особенно бродячими, употреблении в пищу немытых ягод, фруктов и овощей. Отмечено, что тараканы могут поглощать яйца токсокар с последующим выделением до 25% потенциально жизнеспособных особей, что играет важную роль в распространении инфекции в быту.
Патогенез
После попадания яиц токсокары в тонкий кишечник человека (преимущественно двенадцатиперстную кишку) высвобождаются личинки, проникающие в системный кровоток через слизистую оболочку. Сначала токсокары заносятся в печень и правую половину сердца, затем в легочную артерию и левый желудочек, откуда выходят в большой круг кровообращения. Распространяясь по организму, личинки оседают в различных органах и тканях, вызывая геморрагические и некротические изменения, образование воспалительных очагов в виде гранулем, в центре которых находится некротизированная ткань и личинка, вокруг – воспалительный инфильтрат.
При попадании в кровеносное русло продуктов жизнедеятельности возникают аллергические реакции. Часть личинок гибнет, оставшиеся гельминты выделяют особую маскирующую субстанцию, которая позволяет им персистировать в организме до 10 лет, периодически мигрируя по кровеносной системе и поражая новые ткани. Характерной особенностью токсокар является формирование гранулем в поджелудочной железе, головном мозге, печени, легких, миокарде и мезентериальных лимфатических узлах. Патогенез поражения глаз до конца не изучен, имеются гипотезы о низкой активности инвазии и малой выраженности иммунного ответа.
Патогенез эпилепсии при токсокарозе окончательно не ясен. Предполагается, что поражение головного мозга может привести к формированию волокнистых рубцов после острого воспаления или хронических гранулем. Другая теория объясняет появление эпилептических припадков при повреждении нейронов усиленным образованием провоспалительных цитокинов из-за повышения проницаемости гематоэнцефалического барьера, вызываемого паразитами, а также аутоантителами к нейрональным элементам, которые нередко обнаруживаются у больных токсокарозом.
Классификация
Классификация токсокароза у человека основывается на глубине инвазии в организм человека. Гельминтоз практически всегда протекает с минимальной либо неспецифической клиникой (субклинически), бессимптомная форма встречается в 13% случаев заболевания, органные поражения более характерны для детей. Выделяют следующие виды токсокароза:
- Глазной.Типичен для детей старше 8 лет, подростков и молодых взрослых. Поражение зрительного аппарата обычно одностороннее, протекает в виде хронического эндофтальмита, увеита, абсцессов стекловидного тела, папиллитов, кератитов и косоглазия. При длительном течении возможна слепота.
- Висцеральный.Протекает остро или хронически с вовлечением дыхательной системы, сердца, кожи, лимфатических узлов, селезенки, печени, суставов и мышц. Часто наблюдается диарея, тошнота и рвота. Описаны поражения головного мозга: рецидивирующие головные боли, менингоэнцефалит, эпилептические припадки.
Симптомы токсокароза
Инкубационный период определить сложно, считается, что он может занимать несколько лет. При остром начале наблюдается лихорадка до 38,5°C и выше, поражения дыхательной системы – от заложенности носа, сухого кашля и першения в горле до тяжелой одышки и астматического статуса. На коже появляется зудящая сыпь в виде волдырей и пятен, при подкожном расположении личинок видны приподнятые над поверхностью прямые или извилистые красновато-коричневые ходы. У детей нередко выявляются увеличенные плотноэластические безболезненные лимфоузлы. Пациенты с токсокарозом часто предъявляют жалобы на боли в животе, тошноту, иногда – рвоту и срывы стула.
Осложнения
Наиболее частые осложнения висцерального токсокароза – бронхиальная астма, хронический бронхит и эпилепсия, глазного – отслойка сетчатки и односторонняя слепота. Подкожное расположение личинок токсокар приводит к присоединению вторичной бактериальной инфекции, образованию инфильтраов, абсцессов и флегмон, поражение легких – к тяжелым пневмониям смешанной этиологии с нарастающей дыхательной недостаточностью. Массивная инвазия гельминтов, полиорганное поражение могут стать причиной летального исхода. У беременных женщин токсокароз часто выявляется невынашивание, задержка внутриутробного развития плода.
Диагностика
Диагноз токсокароза подтверждается врачом-инфекционистом. Для исключения сочетания висцерального и глазного гельминтоза обязательным является осмотр офтальмолога, по показаниям назначаются консультации других специалистов. Диагностические методы, необходимые для верификации токсокарозного поражения, включают следующие методики:
Дифференциальную диагностику проводят с аскаридозом, при котором нередко наблюдаются кишечная непроходимость, острая обструкционная дыхательная недостаточность. Необходимо исключить описторхоз и стронгилоидоз, которые протекают с желтухой, болями в правом подреберье и срывами стула. Глазную форму токсокароза дифференцируют от ретинобластомы, проявляющейся лейкокорией, косоглазием, слезотечением, светобоязнью, вторичной глаукомой. Кожные проявления могут быть следствием укусов насекомых, воздействия аллергенов.
Лечение токсокароза
Показанием для стационарного лечения являются висцеральные формы болезни. Постельный режим назначается только при наличии лихорадки и рекомендуется до 2-4 дней устойчивого отсутствия высоких цифр температуры тела. Специальной диеты нет, однако, учитывая некоторые побочные эффекты применяемых препаратов, рекомендуется воздержаться от приема жирной, жареной пищи, алкоголя, специй, маринадов, сладостей. Важно соблюдение питьевого режима, исключение контакта с возможными пищевыми и бытовыми аллергенами. Недопустимо самовольное прекращение начатого медикаментозного лечения.
- Антигельминтная терапия. Высокоэффективными антигельминтными средствами для разрушения мигрирующих личинок считаются албендазол, мебендазол, диэтилкарбамазин, которые применяются в таблетированных формах. В отношении токсокар, находящихся в гранулемах, данные препараты не обладают выраженным нейтрализующим эффектом.
- Хирургические методы лечения применяются при глазном токсокарозе и включают в себя микрохирургическое удаление гранулем, лазерную коагуляцию для расщепления личинок в средах глаза и коррекции отслойки сетчатки.
- Симптоматическая терапия проводится по показаниям. Включает жаропонижающие (парацетамол, целекоксиб), дезинтоксикационные (хлосоль, глюкозо-солевые растворы), десенсибилизирующие (глюконат, хлорид кальция), антигистаминные (хлорапирамин, дезлоратадин), отхаркивающие (ацетилцистеин, мукалтин), ферментативные (панкреатин) и другие средства.
Прогноз и профилактика
Прогноз при неосложненных формах благоприятный, летальных случаев не описано. Длительность приема лекарственных средств может составлять до 3-4 недель и более, иногда требуются несколько курсов с перерывами в 2-4 месяца. Критериями эффективности считаются исчезновение клиники, снижение уровня антител и эозинофилии крови. Описаны случаи диссеминированного токсокароза среди ВИЧ-инфицированных лиц в стадии СПИДа, а также пациентов, длительно принимающих системные глюкокортикостероиды или проходящих лучевую терапию по поводу онкологических болезней.
Профилактические вакцины на основе ДНК показали положительный эффект в экспериментах на мышах, исследования в настоящее время продолжаются. Рекомендуется осуществлять контроль за популяцией бродячих животных, проводить выгул собак на специально отведенных территориях. Важными мерами неспецифической борьбы с заболеваемостью являются отучение детей от поедания земли, привитие навыков личной гигиены после игр на улице, песочнице, общения с животными; тщательное мытье ягод, зелени, овощей и фруктов перед едой; назначение антигельминтных препаратов беременным собакам, новорожденным щенкам.
2. Токсокароз. Клиника. Диагностика. Лечение. Профилактика. Информационно¬методическое пособие. – 2004.
4. Токсокароз у детей/ Глазунова Л.В., Артамонов Р.Г., Бекташянц Е.Г., Куйбышева Е.В., Шиц О.Л., Кирнус Н.И., Иванова Е.Ю. // Лечебное дело. – 2008.
Анкилостомидоз – глистная инвазия, вызываемая паразитированием в кишечнике человека круглых червей (анкилостом или некаторов), принадлежащих к семейству Ancylostomatidae. Клинически анкилостомидоз проявляется папуло-везикулярной сыпью, кашлем, одышкой, нарушением аппетита, тошнотой, болями в животе, диареей, железодефицитной анемией. Диагноз анкилостомидоза подтверждается при выявлении яиц гельминтов в фекалиях и дуоденальном содержимом. Лечение анкилостомидоза заключается в проведении дегельминтизации и коррекции анемии с последующим трехкратным контрольным исследованием кала.
МКБ-10
Общие сведения
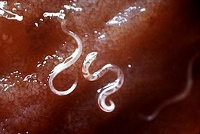
Анкилостомидоз - гельминтозы (анкилостомоз и некатороз), вызываемые паразитическими круглыми червями – анкилостомидами. Анкилостомоз и некатороз объединены в одну группу на основании биологического сходства возбудителей, их частого совместного паразитирования в организме, а также схожести клинических и эпидемиологических признаков инвазии. Оба гельминтоза на ранних стадиях протекают с аллергическим поражением кожи и респираторного тракта, а на поздних – с нарушением функции ЖКТ и развитием железодефицитной анемии. Анкилостомидозы – распространенные паразитарные заболевания, которыми поражены 25% мирового населения, главным образом в регионах с низким уровнем санитарной культуры. По частоте заражения анкилостомидозы уступают лишь энтеробиозу и аскаридозу.

Причины и пути заражения анкилостомидозом
Возбудители анкилостомоза (анкилостома - Ancylostoma duodenale) и некатороза (некатор - Necator amencanus) принадлежат к единому семейству Ancylostomatidae. Их объединяет общность морфологии, циклов развития и действия, оказываемого на организм хозяина. Оба вида гельминтов принадлежат к классу круглых червей (нематод) и по характеру развития относятся к геогельминтам.
Яйца анкилостомид имеют одинаковое строение: овальную форму, гладкую бесцветную оболочку, размеры 66х38 мкм. Каждое яйцо содержит 4-8 бластомера. Жизненный цикл возбудителей анкилостомидоза начинается с попадания яиц гельминтов с фекалиями во внешнюю среду. Развитие личинок происходит в почве при температуре 14-40° С и влажности выше 80%. После двух линек, примерно через 7-10 дней личинки анкилостомид становятся инвазионными.
Заражение человека анкилостомидозом может происходить по двум механизмам - фекально-оральному и перкутанному (чрескожному); водным, пищевым либо контактным путями. В первом случае личинки попадают в организм хозяина через рот при употреблении обсемененной воды, овощей или фруктов. Перкутанный путь заражения предполагает активное проникновение инвазионных личинок сквозь кожу при контакте человека с загрязненной почвой (во время ходьбы босиком, лежания на земле, выполнения земляных и сельскохозяйственных работ). Внедрившись через кожный барьер, личинки попадают в кровеносное русло, затем мигрируют в правые отделы сердца и легкие, откуда по дыхательным путям проникают в глотку и вторично заглатываются. Оказавшись в тонком кишечнике, через 5-6 недель личинки превращаются в половозрелых гельминтов, способных самостоятельно откладывать яйца. При пероральном заражении анкилостомидозом миграционная стадия отсутствует - личинки сразу оказываются в тонком кишечнике. Жизненный цикл анкилостом составляет 7-8 лет, некаторов - до 15 лет. К группам риска, подверженным заражению анкилостомидозом относятся сельскохозяйственные работники, шахтеры, дачники, дети.
Симптомы анкилостомидоза
В течении анкилостомидоза выделяют 3 фазы: инвазионную, миграционную и кишечную. Первая фаза связана с внедрением личинок через кожу в организм человека, что сопровождается клиникой дерматита или крапивницы - появлением сыпи (эритематозной, папулезной, везикулезной), локального отека, жжения и зуда кожи, сохраняющихся в течение 10-12 дней.
Во время второй фазы анкилостомидоза (миграции личинок по организму хозяина) происходит сенсибилизация организма продуктами их жизнедеятельности с развитием аллергических реакций. Кроме этого, травмирование капилляров легочных альвеол и тканей дыхательных путей клинически проявляется очаговыми пневмониями, плевритами, бронхитами, трахеитами, ларингитами. Больные анкилостомидозом жалуются на кашель, одышку, охриплость голоса, субфебрилитет.
В третью (кишечную) фазу анкилостомидоз переходит через 30-60 дней после инвазии. Данная стадия имеет длительное, хроническое течение и связана с паразитированием анкилостомид в тонком кишечнике, где они с помощью зубцов прикрепляются к слизистой оболочке, травмируя ее. В месте фиксации паразита образуются эрозии и язвы, которые могут длительно кровоточить, приводя к развитию железодефицитной анемии. Кроме этого, будучи гематофагами по способу питания, каждая особь некатора потребляет в сутки 0,03-0,05 мл крови, анкилостомы - 0,16-0,34 мл, что также способствует хронической кровопотере. Кишечная фаза анкилостомидоза протекает с явлениями дуоденита - нарушением аппетита, извращением вкуса, тошнотой, рвотой, болями в эпигастральной области, диареей или запором.
При длительном течении анкилостомидоза или массивной инвазии у детей может наблюдаться снижение массы тела, задержка в умственном и физическом развитии. Взрослые пациенты могут страдать раздражительностью, нарушением сна, повышенной утомляемостью; у женщин нередко отмечается нарушение менструального цикла. Развитие анемии сопровождается слабостью, головокружением, тахикардией, шумом в ушах.
Диагностика и лечение анкилостомидоза
В различные фазы анкилостомидоза пациент может обращаться за медицинской помощью к отоларингологу, пульмонологу, гастроэнтерологу или терапевту. При диагностике анкилостомидоза учитываются клинические и эпидемиологические данные. В периферической крови отмечается гипохромная железодефицитная анемия, увеличение СОЭ, эозинофилия, гипоальбуминемия. При исследовании общего анализа мокроты обнаруживается большое количество эозинофилов. В фазу миграции на рентгенограммах легких могут выявляться воспалительные эозинофильные инфильтраты; на ЭКГ – признаки миокардиодистрофии. Данные рентгенографии пассажа бария указывают на гипотонию кишечника, нарушение моторики с явлениями застоя каловых масс.
Решающими для подтверждения анкилостомидоза являются результаты анализа кала на яйца гельминтов или исследования содержимого 12-перстной кишки, получаемого при дуоденальном зондировании. Кроме этого, используются серологические методы диагностики (реакции гемагглютинации и латекс-агглютинации). Поскольку яйца анкилостомид имеют одинаковое строение, идентификация гельминтов (анкилостом и некаторов) возможна лишь после проведения дегельминтизации и отхождения с калом взрослых особей. Анкилостомидоз требует проведения дифференциальной диагностики с другими гельминтозами, а также анемиями другой этиологии.
Этиотропная терапия анкилостомидоза проводится противогельминтными препаратами, назначаемыми врачом инфекционистом (паразитологом). Для проведения дегельминтизации используются следующие лекарственные средства: пирантел, бефения гидроксинафтоат, левамизол, мебендазол. Через 3-4 недели после антигельминтной терапии проводится контроль эффективности лечения – 3-хкратное исследование кала с интервалом в 1 месяц. Симптоматическое и патогенетическое лечение анкилостомидоза предполагает назначение препаратов железа, витамина B12, фолиевой кислоты, антигистаминных средств и др.
Прогноз и профилактика анкилостомидоза
В большинстве случаев при своевременной диагностике и лечении анкилостомидозы завершаются полным выздоровлением. Последующая диспансеризация пациентов, перенесших анкилостомоз, осуществляется ежегодно в течение 4 лет; перенесших некатороз – в течение 7 лет. Тяжелые осложнения и летальные формы анкилостомидоза развиваются при запущенном течении заболевания.
Профилактические мероприятия заключаются в соблюдении норм личной гигиены - мытье рук после посещения туалета, защите кожных покровов при контакте с землей, тщательной обработке фруктов и овощей, кипячении воды перед употреблением и т. д. Важное значение имеет санитарная обработка участков почвы и объектов внешней среды, предположительно загрязненных личинками анкилостомид. Группы повышенного риска по заболеваемости анкилостомидозом должны проходить ежегодное медицинское обследование.
Токсокароз у детей — это тканевой гельминтоз, который вызван паразитами рода Toxocara. Заболевание имеет полиморфную клиническую картину. Типичные признаки висцеральной формы: легочной синдром, субфебрильная лихорадка, нарушения пищеварения. При глазном токсокарозе возникают отек и гиперемия век, болезненность, экзофтальм. Диагностика гельминтоза включает серологические и гистологические анализы, методы визуализации (рентгенография грудной клетки, УЗИ органов живота, ЭКГ, ЭхоКГ). Лечение проводится этиотропными противопаразитарными препаратами, гормонами и антигистаминными средствами, пробиотиками и ферментами.
МКБ-10
Общие сведения
Токсокароз — самое распространенное на территории России паразитарное заболевание, интенсивный показатель которого составляет 380 случаев на 100 тыс. населения. Наиболее подвержены дети дошкольного возраста. Среди возрастной группы до 4 лет половых различий заболеваемости не выявлено, в категории 5-14 лет паразиты чаще поражают мальчиков, а среди подростков 14-18 лет больше заражаются девочки. Несмотря на высокую частоту встречаемости, диагностика и лечение токсокароза затруднены, что связано с полиморфностью клинической картины.

Причины
Основной фактор риска инфицирования токсокарами — несоблюдение детьми санитарно-гигиенических норм, поэтому чаще всего болезнь поражает дошкольников, которые играют в песочнице, а потом берут все грязными руками. В группу риска относят семьи, у которых есть домашние животные, жители пригородов и сельской местности. Высокий риск заражения токсокарозом и другими гельминтозами у детей, которые страдают геофагией — патологической тягой к поеданию земли и песка.
Патогенез
Инкубационный период составляет несколько дней, но не исключено латентное течение гельминтоза. Передача инфекции ребенку происходит преимущественно 3 путями: контактно-бытовым — при играх с домашними или бродячими животными, алиментарным — при поедании овощей, зелени, которые загрязнены землей с цистами токсокар, водным — при употреблении зараженной некипяченой воды. Редкий путь инфицирования — гео-оральный, который наблюдается у детей с геофагией.
Жизненный цикл возбудителя достаточно сложен, он проходит в организме животных и частично в почве. В ЖКТ человека поступают зрелые цисты, из которых образуются личинки токсокар. Через стенку кишечника они проникают в кровоток: сначала по венозной системе достигают правых отделов сердца, затем попадают в легочные сосуды, оттуда — в левую половину сердца и далее разносятся по всем внутренним органам.
Личинки могут длительное время сохраняться в тканях в латентном состоянии, а их активация происходит при снижении иммунитета. Паразиты выделяют антигены, которые провоцируют аллергические реакции немедленного и замедленного типов, образование эозинофильных гранулем. Специфические для токсокароза тканевые элементы в центре имеют зону некроза, вокруг нее расположены эозинофилы, фагоциты и лимфоидные клетки.
Классификация
В литературе по детским инфекционным болезням существует несколько вариантов систематизации токсокароза:
- по течению: типичные и атипичные (стертые, бессимптомные) варианты;
- по локализации поражения: висцеральная и глазная формы;
- по тяжести: легкое, среднетяжелое и тяжелое течение.
По длительности токсокароз у детей бывает острым (до 3 месяцев) и хроническим, который подразделяется на непрерывный и рецидивирующий вариант.
Симптомы токсокароза у детей
Висцеральная форма
Клинические признаки гельминтоза зависят от объема поглощенных цист токсокары, степени распространения личинок по организму и уровня иммунной защиты. У детей чаще встречается висцеральная форма, которая ассоциирована с одновременным проникновением большого количества гельминтов в организм. Вначале токсокароз проявляется неспецифическими признаками: повышением температуры до субфебрильных цифр, небольшим ознобом, слабостью, вялостью.
У 65% детей первично выявляются симптомы поражения легких. Пациенты жалуются на кашель, который усиливается по ночам, одышку при физических нагрузках. Возможны катаральные явления в виде насморка и заложенности носа, отхаркивания слизистой мокроты при кашле. Хронический вариант токсокароза иногда протекает под маской рецидивирующих бронхитов или персистирующей бронхиальной астмы, классическое лечение которых не дает должного эффекта.
Помимо легочного синдрома, при гельминтозе наблюдается увеличение и болезненность нескольких групп лимфатических узлов. У ребенка возможна асимметрия живота и тяжесть в правом подреберье, вызванные увеличением размеров печени. Типичным проявлением считается рецидивирующая лихорадка неясного генеза. На коже ребенка образуются зудящие волдыри, на ладонях и ступнях формируются безболезненные узелки.
Глазная форма
Глазная форма токсокароза начинается с умеренной отечности и покраснения верхнего века, которые сохраняются не более 5 дней. Симптомы повторяются на протяжении полугода с промежутками от нескольких дней до 2-3 недель. Постепенно отек становится более выраженным, заметен экзофтальм, ребенок жалуется на боли при движениях глазом. Поражение при токсокарозе чаще одностороннее.
Осложнения
Если лечение гельминтоза не проводится вовремя, происходят паразитарные и аутоиммунные повреждения внутренних органов. Зачастую у ребенка формируется тяжелая персистирующая бронхиальная астма, которая сопровождается бронхообструктивным синдромом и дыхательной недостаточностью. Нарушения вентиляции и снижение местного иммунитета — предрасполагающие факторы развития у зараженных детей затяжных пневмоний, легочных абсцессов.
Поражение органов ЖКТ проявляется панкреатитом, гепатитом, синдромом мальабсорбции и мальдигестии. Также встречаются осложнения со стороны ЦНС (парезы, параличи, нарушения чувствительности), опорно-двигательного аппарата (синовиты, артриты). При токсокарозе возможен летальный исход, если личинки паразита мигрируют в миокард и жизненно важные центры головного мозга. Смерть наступает от острой сердечной недостаточности, остановки дыхания.
Диагностика
Обследованием ребенка занимается педиатр, который при подозрении на заражение гельминтами дает направление на консультацию детского инфекциониста. При физикальном исследовании органов дыхания обращают внимание на хрипы и ослабленное дыхание, при пальпации живота врач обнаруживает гепатомегалию, при внешнем осмотре выявляется аллергическая сыпь. В план диагностики включаются:
- Рентгенография ОГК. Обзорную рентгенограмму в двух проекциях делают для исследования степени поражения легочной ткани. На снимках заметны множественные очаги инфильтрации, усиление бронхиального рисунка, могут быть признаки эмфиземы. Для детальной диагностики проводится спирометрия (школьникам), тест на бронхиальную обструкцию.
- Биопсия. Обнаружение личинок токсокары в биоптатах — наиболее достоверный способ диагностики паразитарного процесса. Детям наиболее часто делают чрескожную пункционную биопсию печени. Если на кожных покровах есть характерные узелки, их биоптаты также используют для гистологической верификации диагноза.
- Дополнительные инструментальные методы. Для оценки состояния гепатобилиарной системы, поджелудочной железы и кишечника ребенка назначается УЗИ брюшной полости. При перебоях в работе сердца показана ЭКГ и эхокардиография. При затруднениях в диагностике выполняют КТ легких, брюшных органов.
- Серологические реакции. ИФА обладает высокой чувствительностью (93,7%) и специфичностью (89,3%) при висцеральной форме токсокароза. При титре антител 1:200 или 1:400 говорят о бессимптомном носительстве, а значение 1:800 и выше указывает на активный процесс, лечение которого нужно начинать незамедлительно.
- Общеклинические анализы. В гемограмме детей с токсокарозом обнаруживают эозинофилию, лейкоцитоз, повышение СОЭ. При биохимическом исследовании крови определяют гипергаммаглобулинемию, возрастание IgE, в печеночных пробах — синдром цитолиза. Обязательно исследуют кал на яйца глист, чтобы исключить другие гельминтозы.
Лечение токсокароза у детей
Этиотропное лечение проводится противогельминтными препаратами группы бензимидазолов. Они назначаются короткими курсами в возрастных дозировках. Спустя 3 месяца выполняется иммунологический контроль терапии и при негативной динамике подбирается новый курс противопаразитарных средств. Патогенетическое и симптоматическое лечение гельминтоза предполагает прием препаратов следующих групп:
- Кортикостероиды. Рекомендованы для купирования аллергических и аутоиммунных реакций при тяжелых формах токсокароза. Уменьшают активность воспалительного процесса, предотвращают системные осложнения.
- Антигистаминные средства. Используются при кожных аллергических проявлениях — зудящих дерматозах, отеке Квинке. Быстро устраняют субъективный дискомфорт, уменьшают отечность и покраснение кожи ребенка.
- Пробиотики. Применяются для нормализации пищеварительной функции, восстановления микробиоты кишечника. При мальбасорбции обычно терапия дополняется пищеварительными ферментами. Детям, страдающим диарейным синдромом, показаны энтеросорбенты.
Прогноз и профилактика
В большинстве случаев противопаразитарное лечение эффективно уничтожает личинок гельминтов и предупреждает необратимые поражения внутренних органов. Иногда токсокароз протекает в бессимптомной форме, что коррелирует с хорошей активностью иммунной системы. Неблагоприятный прогноз устанавливают при массивной инвазии, наличии у ребенка первичного или вторичного иммунодефицита.
В отношении больного и его окружения противоэпидемические меры и изоляция не проводятся. Профилактика токсокароза предполагает обучение ребенка правилам личной гигиены, тщательное мытье овощей и зелени, использование бутилированной или кипяченой водопроводной воды. Важную роль отводят лечению бездомных животных, организации приютов, что уменьшает количество естественных резервуаров инфекции.
1. Особенности течения токсокароза у детей/ Т.В. Сорокман, И.И. Перкас// Актуальная инфектология. — 2018.
4. Токсокароз у детей/ Л.В. Глазунова, Р.Г. Артамонов, Е.Г. Бекташянц, Е.В. Куйбышева// Лечебное дело. — 2008.
Читайте также:

