Что такое убиквитарные инфекции
Обновлено: 15.04.2024
Лечение при инфекции Helicobacter pylori (Hp) можно считать детально разработанным: по комбинации лекарственных средств, их дозам и продолжительности курса оно стандартизировано. В России эта терапия утверждена в соответствующих стандартах медицинской помощи и Формулярной системе. Национальные рекомендации многих европейских стран и отечественные стандарты по диагностике и лечению при Нр основаны на алгоритмах, разработанных под эгидой Европейской группы по изучению этой инфекции. Поскольку первые конференции по выработке данного консенсуса прошли в Маастрихте, рекомендации носят название Маастрихтских (конференции проходили в 1996, 2000 и 2005 гг.).
Схемы эрадикационной терапии строго регламентированы, кажется, что такое лечение не должно вызывать вопросов. Однако выполнение любого стандарта на практике не всегда сопровождается стопроцентной эффективностью. Большинство наиболее острых вопросов касаются выбора схемы лечения после неудачи первой (а иногда второй и третьей) попытки.
Решающее значение имеет, безусловно, терапия первой линии, которая должна быть нацелена на достижение эрадикации Hр у максимального числа больных. В качестве терапии первой линии Маастрихтские рекомендации III предлагают следующие трехкомпонентные схемы лечения (табл. 1): ингибитор протонной помпы в стандартной дозировке 2 раза в день+кларитромицин – 500 мг 2 раза в день+амоксициллин – 1000 мг 2 раза в день или метронидазол – 400 или 500 мг 2 раза в день. Минимальная продолжительность тройной терапии – 7 дней, однако оказалось, что для данной схемы более эффективен 14-дневный курс лечения (на 12%; 95% доверительный интервал – ДИ: 7–17%) [12]. Тем не менее 7-дневная тройная терапия может быть признана приемлемой, если местные исследования показывают, что она высокоэффективна. Рекомендуется одинаковая терапия первой линии для всех стран, хотя в разных странах могут быть одобрены разные дозы лекарственных средств [17].
Таблица 1. Схемы стандартной тройной терапии при Нр
| 1-й компонент | 2-й компонент | 3-й компонент |
| Ингибитор протонной помпы: лансопразол – 30 мг 2 раза в день или омепразол – 20 мг 2 раза в день или пантопразол – 40 мг 2 раза в день или рабепразол – 20 мг 2 раза в день или эзомепразол – 20 мг 2 раза в день | Кларитромицин – 500 мг 2 раза в день | Амоксициллин – 1000 мг 2 раза в день или Метронидазол – 400 или 500 мг 2 раза в день |
Четырехкомпонентная схема лечения включает в себя ингибитор протонной помпы в стандартной дозе 2 раза в день+висмута субсалицилат/трикалия дицитрат – 120 мг 4 раза в день+метронидазол – 500 мг 3 раза в день+тетрациклин – 500 мг 4 раза в день (табл. 2). В Маастрихтских рекомендациях II за четырехкомпонентной схемой была закреплена позиция терапии второй линии [16]. Одно из новых положений Маастрихтских рекомендаций III – возможность применения такой схемы в определенных клинических ситуациях, как терапии первой линии (альтернативная терапия первой линии) [17].
Таблица 2. Схемы четырехкомпонентной эрадикационной терапии при Нр
| 1-й компонент | 2-й компонент | 3-й компонент | 4-й компонент |
| Ингибитор протонной помпы: лансопразол – 30 мг 2 раза в день или омепразол – 20 мг 2 раза в день или пантопразол – 40 мг 2 раза в день или рабепразол – 20 мг 2 раза в день или эзомепразол – 20 мг 2 раза в день | Висмута субсалицилат/ субцитрат – 120 мг 4 раза в день | Метронидазол – 500 мг 3 раза в день | Тетрациклин – 500 мг 4 раза в день |
Принципиальное значение имеет чувствительность Hp к кларитромицину и метронидазолу. Количество резистентных штаммов Hp к кларитромицину, по данным мультицентрового европейского исследования, в среднем составляет 9,9% (95% ДИ: 8,3–11,7). Выявлены существенные различия этого показателя: в странах Северной Европы частота резистентности к кларитромицину низкая (4,2%; 95% ДИ: 0–10,8%); в Центральной и Восточной Европе она выше (9,3%; 95% ДИ: 0–22%) и самая высокая – на юге Европы (18%; 95% ДИ: 2,1–34,8%) (рис. 1) [13]. Риск возникновения резистентности к кларитромицину связан с частотой назначения макролидов в данной группе населения. В связи с тем что в ряде европейских стран в педиатрической практике широко назначали макролиды по поводу, например, респираторных заболеваний, частота резистентности штаммов Hp к кларитромицину у детей весьма высока, что делает проблемой выбор тактики эрадикационной терапии.
Рис. 1. Распространенность штаммов Hp, резистентных к макролидам, в европейских странах (по Glupczynski Y. и соавт., 2000)
Ответственна за резистентность к кларитромицину мутация гена 23S rDNA, которая ведет к нарушению пространственной конфигурации рибосомы. Признано, что она способствует развитию перекрестной резистентности к макролидным антибиотикам; вместе с тем не ясно, все ли макролиды, разными путями проникающие в слизистую оболочку желудка, могут приводить к селекции резистентных штаммов in vivo.
Различны и данные о влиянии резистентности к кларитромицину на исходы эрадикационной терапии. Максимальный из описанных эффектов следующий: 87,8% эрадикации Hp при наличии чувствительных штаммов, 18,3% – при наличии резистентных штаммов [18].
Количество штаммов Hp, резистентных к метронидазолу, в Европе и США колеблется от 20 до 40%. Известно, что в развивающихся странах число метронидазолрезистентных штаммов выше. Наибольшее значение для селекции резистентных штаммов имеет применение метронидазола в популяции. Механизм формирования резистентности к метронидазолу до конца не ясен: подозревают изменения гена rdxA, но точные мутации не известны [18].
Наблюдение (1996–2001) за динамикой резистентности к производным нитроимидазола (метронидазол), макролидам (кларитромицин) и β-лактамам (амоксициллин) у штаммов Hp, выделенных в Москве, показало, что она отличается от таковой в Европе (рис. 2). Так, во взрослой популяции уровень первичной резистентности Hp к метронидазолу уже в 1996 г. превысил среднеевропейский показатель (25,5%) и составил 36,1%. На протяжении 1996–1999 гг. отмечалось увеличение числа первично резистентных штаммов Hp к метронидазолу, а затем оно не выявлялось [2].
Рис. 2. Динамика резистентности (в %) к метронидазолу, кларитромицину и амоксициллину у штаммов Hp, выделенных от взрослых в Москве в 1996–2001 гг. (Кудрявцева Л., 2004)
В отличие от данных, полученных в Европе в 1996 г., где во взрослой популяции уровень первичной резистентности Hp к макролидам (кларитромицин) составлял 7,6%, в Москве в то время штаммов Hp, резистентных к этому антибиотику, выявлено не было. Относительный прирост количества штаммов Hp, первично резистентных к кларитромицину, среди взрослой популяции за 1-й год наблюдения составил 8%, за 2-й – 6,4%, за 3-й – 2,7%. В 2000 г. уровень резистентности Hp к кларитромицину несколько снизился: если в 1999 г. он составлял 17,1%, то в 2000 г. – 16,6%. В 2001 г. наметилась явная тенденция к снижению этого показателя (13,8%).
В 1996 г. в Москве было выделено 3 штамма Hp, резистентных к амоксициллину; в дальнейшем такие находки не повторялись, и эти данные можно считать единственными в РФ и уникальными [2].
Таблица 3. Частота антибиотикорезистентности Hp в разных городах России в 2001 г. (Кудрявцева Л. и соавт., 2004)
% резистентных штаммов
Терапия первой линии – стандартная тройная – не утратила актуальности для России. От точного соблюдения этого стандарта врачом и пациентом зависит успех эрадикации Нр. Чем выше ее показатель, тем меньше вероятность повторного лечения. Наиболее обоснованным способом повышения эффективности стандартной тройной терапии следует признать увеличение ее продолжительности до 14 дней [7, 11, 12].
Как надо планировать терапию второй линии при неудаче применения первой линии? Следует избегать назначения антибиотиков, которые пациент уже получал. Это – один из основополагающих (но не общепризнанных) постулатов, на которых строится такое планирование [7]. С точки зрения экспертов – авторов Маастрихтских рекомендаций III, наиболее правильным выбором в данной ситуации является квадротерапия с препаратом висмута [17]. К такому же выводу пришли и авторы Американских рекомендаций по диагностике и лечению Hp [7]. При анализе нескольких десятков клинических исследований с применением квадротерапии в качестве терапии второй линии средний показатель эрадикации микроорганизма составил 76% (60–100%) [15]. Данная схема доступна, относительно дешева и эффективна. К ее недостаткам относят большое число таблеток и капсул, которые приходится принимать ежедневно (до 18 штук в сутки), четырехкратный режим дозирования и сравнительно часто развивающиеся нежелательные явления [7].
В некоторых странах препараты висмута недоступны, и в качестве схем второй линии Маастрихтские рекомендации III предлагают варианты тройной терапии: ингибитор протонной помпы и амоксициллин, а в качестве антибактериального агента фигурируют тетрациклин или метронидазол [17]. В России нет систематизированного опыта использования таких схем, хотя имеются данные о весьма низкой эффективности 7-дневной тройной терапии: ингибитор протонной помпы+амоксициллин+метронидазол [1].
Как терапию третьей линии Маастрихтские рекомендации III позиционируют тройную терапию с представителем рифамицинов – рифабутином – и хинолонов – левофлоксацином.
В группе больных с неудавшимся курсом стандартной тройной терапии 12-дневное лечение ингибитором протонной помпы в сочетании с амоксициллином и рифабутином (150 мг) привело к эрадикации Hp в 91% случаев, причем доказанная резистентность к метронидазолу и кларитромицину не сказалась на результате [5]. Привлекательная сторона применения рифабутина – очень малая вероятность формирования резистентности к нему Hp (описана лишь в единичных случаях). Механизм формирования резистентности (перекрестной ко всем рифамицинам) – это точечная мутация rpoB-гена [18]. Маастрихтские рекомендации III настаивают на осторожном назначении этого антибиотика, так как его широкое применение может привести к селекции резистентных штаммов Mycobacteria.
Удобной в применении и достаточно эффективной кажется тройная терапия с левофлоксацином: ингибитор протонной помпы в стандартной дозе дважды в сутки в сочетании с амоксициллином (2000 мг/сут) и левофлоксацином (500 мг/сут). В качестве терапии второй линии после неудачной стандартной тройной терапии эта схема дает высокий результат [8]. Но с применением левофлоксацина связана проблема формирования резистентности к хинолонам вследствие целого ряда мутаций гена gyrA. В недавно опубликованном французском исследовании, в котором изучали большое число штаммов Hp, резистентность выявлена у 17,2% из них [6]. В работе итальянских авторов (с гораздо меньшим числом изученных штаммов) резистентность к левофлоксацину установлена в 30,3% случаев; показатель успешной эрадикации чувствительного к данному антибиотику микроорганизма – 75% против 33,3% при наличии резистентности [19].
В последних рекомендациях экспертов и обзорах по данной проблеме очень пристальное внимание уделяется новой схеме эрадикации Hp – последовательной терапии [7, 10, 11, 14]. Курс последовательной терапии занимает 10 дней: на первые 5 дней назначают ингибитор протонной помпы в стандартной дозе дважды в сутки в сочетании с амоксициллином (2000 мг/сут); затем в течение еще 5 дней – ингибитор протонной помпы в стандартной дозе дважды в сутки в сочетании с кларитромицином (1000 мг/сут) и тинидазолом (1000 мг/сут). В итальянском исследовании [21] при последовательной терапии эрадикация Hp (intention-to-treat) составила 91 против 78% в группе сравнения (10-дневная стандартная тройная терапия). В группе пациентов, инфицированных штаммами, резистентными к кларитромицину, этот показатель достиг 89 против 29%.
Для исключения неудачи в эрадикации Hp стандартную тройную терапию следует назначать в полном объеме по дозам и при возможности – на 14 дней. Выбор схем лечения в случае неудачи терапии первой линии достаточно широк и позволяет учесть индивидуальные особенности пациента.
Классификация инфекций головного мозга (ЦНС)
а) Классификация. Инфекционные заболевания можно разделить на врожденные/неонатальные и приобретенные. Эти категории, в свою очередь, могут быть подразделены на подгруппы на основании этиологии, например, бактериальные, вирусные, грибковые, паразитические заболевания и риккетсиозы.
Инфекционные болезни могут манифестировать в различных формах в зависимости от остроты процесса. Для некоторых заболеваний, например герпеса и энцефалита, характерно острое и молниеносное течение. Другие протекают в подострой или хронической форме (например, подострый склеротический панэнцефалит (ПСПЭ) и энцефалит Расмуссена).
б) Врожденные/неонатальные инфекционные заболевания:
1. Терминология. Врожденные инфекции головного мозга часто группируют вместе и просто именуют TORCH-инфекциями (сокращение от первых букв англоязычных терминов токсоплазмоза, краснухи, цитомегаловирусной и герпетической инфекций). При включении в эту группу сифилиса ее называютTORCH(S) или (S)TORCH.
Среди других врожденных инфекций выделяют синдром приобретенного иммунодефицита человека (СПИД) и лимфоцитарный хориоменингит (ЛХМ). Примерно 40% беременностей у ВИЧ-лоложительных матерей протекают с вертикальной передачей вируса плоду, но эта цифра значительно снижается при ВААРТ матерей и родоразрешении методом кесарева сечения.
2. Этиология. Большинство врожденных инфекционных заболеваний передается плоду трансплацентарным путем за исключением вируса герпеса, который передается ребенку во время родов. Большинство из них, за исключением двух (токсоплазмоза и сифилиса), имеют вирусную природу. Все они встречаются относительно редко за возможным исключением цитомегаловирусной инфекции (ЦМВИ) и герпетического энцефалита.
3. Патология. Трансплацентарная передача различных патогенов проявляется в виде ряда признаков, которые зависят как от инфекционного агента, так и времени инфицирования. Если инфицирование происходит на ранних этапах эмбрионального развития (например, в первом триместре), то наблюдается тенденция к невынашиванию или формированию врожденных пороков развития.
У выживших младенцев наблюдаются такие пороки развития, как нарушение миграции клеток и шизэнцефалия. При инфицировании на более поздних сроках преобладают энцефалокластические проявления. Встречается микроцефалия с явной деструкцией мозговой ткани и распространенной энцефаломаляцией. Для ЦМВИ, токсоплазмоза, ВИЧ-инфекции и врожденной краснухи характерны дистрофические паренхиматозные кальцификаты.

(а) Полученный при аутопсии макропрепарат головного мозга пациента, погибшего от острого бактериального менингита, крупный план: обратите внимание на вязкий гнойный экссудат, который заполняет борозды. Наблюдается отечность и диффузное набухание нижележащих извилин. Мягкая мозговая оболочка воспалена и гиперемирована, хорошо выражены кортикальные сосуды.
(б) При аутопсии определяются множественные пиогенные абсцессы. Разрыв крупного абсцесса, расположенного в глубоком белом веществе головного мозга, в полость желудочков привел к развитию вентрикулита.
в) Приобретенные инфекционные/воспалительные заболевания:
1. Бактериальные инфекции. Бактериальные патогены, которые часто приводят к развитию менингита, включают в себя Streptococcus pneumoniae, Neisseria meningitidis, Haemophilus influenzae, Listeria monocytogenes, Streptococcus В и E. coli.
- Менингит. Гнойный экссудат преимущественно в базальных цистернах является частым патологическим признаком менингита вне зависимости от специфического инфекционного агента. Экссудат может заполнять цистерны и субарахноидальные пространства. Контрастирование мягкой мозговой оболочки и субарахноидального пространства является наиболее частой находкой при диагностической визуализации. Часто развиваются такие осложнения, как гидроцефалия, эмпиема и васкулит с наличием или отсутствием инфаркта ткани головного мозга.
- Абсцесс. Абсцессы проходят четыре общие стадии развития: ранний и поздний церебрит и ранняя и поздняя инкапсуляция. На стадии раннего церебрита присутствует еще не локализованный очаг инфекции. Формируется неинкапсулированное объемное образование, состоящее из воспалительных клеток, отека, очагов некроза и петехиальных кровоизлияний. На стадии позднего церебрита очаги инфекции сливаются. Наблюдается центральный некроз со слабо очерченным ободком из воспалительных клеток, грануляционной ткани и фибробластов. За стадией позднего церебрита следует стадия ранней инкапсуляции.
2. Вирусные инфекции:
- Острые вирусные инфекции. Герпетический энцефалит (ГЭ) является наиболее частым неэпидемическим вирусным энцефалитом. Более 95% из них вызваны ВПГ-1 (оральный вирус герпеса). В настоящее время большинство эпидемических вирусных энцефалитов вызваны вирусом лихорадки западного Нила.
- Подострая и хроническая вирусная инфекция. Для многих вирусов характерен длительный инкубационный период и прогрессирование симптомов на протяжении нескольких месяцев или даже лет. Примером служит подострый склерозирующий панэнцефалит (ПСПЭ). Другим примером является прогрессирующая мультифокальная лейкоэнцефалопатия (ПМЛ), которая наблюдается при инфицировании вирусом JC (убиквитарный полиомавирус).

(а) Макропрепарат голов -ного мозга, полученный при аутопсии: определяются классические признаки острого герпетического энцефалита. Обратите внимание на склонность данной инфекции поражать лимбическую систему, что в данном случае представлено зонами геморрагического некроза в лобной доле и субфронтальной коре.
(б) Макропрепарат головного мозга, полученный при аутопсии: острый геморрагический некротический энцефалит, предположительно вирусной этиологии. Для многих неэпидемических вирусных энцефалитов характерна склонность к поражению базальных ганглиев, таламуса, среднего мозга и моста.
3. Другие инфекционные заболевания:
- Парабиозы. Нейроцистицеркоз (НЦЦ) стал самой распространенной паразитарной инфекцией ЦНС и самой частой причиной эпилепсии во всем мире. Несмотря на то, что большинство паразитов редко вызывают поражение головного мозга, оно рано или поздно возникает у большинства пациентов, инфицированных НЦЦ.
- Грибковые заболевания. Грибы распространены повсеместно и эндемичны для любой области земного шара. Большинство из них, например Aspergillus, инфицируют человека нечасто, в основном при вдыхании или при колотых ранениях. При возникновении грибкового заболевания у иммунокомпетентных лиц легкие поражаются чаще, чем головной мозг. Микозы ЦНС и диссеминированные системные микозы обычно развиваются у иммунокомпрометированных лиц. ВИЧ/СПИД и иммуносупрессивная терапия являются факторами, значительно увеличивающими предрасположенность пациента к оппортунистическим заболеваниям.
- Риккетсиозы, такие как пятнистая лихорадка Скалистых гор и Средиземноморская пятнистая лихорадка, обычно проявляются кожными высыпаниями. Инфицирование ЦНС встречается нечасто. Если же оно происходит, то для риккетсий характерна выраженная тропность к периваскулярным пространствам и возникновение инфарктоподобных поражений в базальных ганглиях.
- Спирохетозы. Спирохеты относятся к грамотрицательному типу бактерий. Среди этой группы патогенов сифилис и болезнь Лайма, вызываемые бактериями Treponema pallidum и Borrelia burgdorferi соответственно, встречаются наиболее часто. В США болезнь Лайма является наиболее частой трансмиссивной (клещевой) инфекцией. Нейроборрелиоз Лайма - вторичное поражение нервной системы на фоне системной инфекции, вызванной Borrelia burgdorferi.

(а) Макропрепарат голов -ною мозга, полученный при аутопсии: наблюдается туберкулезный менингит (ТБМ). ТБМ обычно характеризуется появлением вязких гноеподобных экссудатов, которые склонны располагаться в базальных цистернах. Визуализационная и патологоанатомическая картины при менингите в целом схожи вне зависимости от этиологии процесса.
(б) Макропрепарат головного мозга, полученный при аутопсии: определяются две нейроцистицеркозные кисты, расположенные в поверхностных бороздах. Нейроцистицеркозные кисты церебральной локализации наиболее часто расположены в субарахноидальных пространствах.
Инфекции кожи и мягких тканей: причины, диагностика, лечение, профилактика
Бактериальные инфекции кожи. Передача кожных инфекций осуществляется посредством контактного механизма. Заболевания быстро распространяются в местах скопления людей и в условиях антисанитарии. Возбудителями кожных инфекций могут быть многие микроорганизмы. Наиболее распространены Staphylococcus aureus и Streptococcus pyogenes.
Бактерии возбудители инфекций кожи и мягких тканей:
- S. aureus: импетиго, фурункулёз, невскрывающийся фурункул, токсический эпидермальный некролиз, острая паронихия
- S. pyogenes: целлюлит, рожа, импетиго
- С. diphtheriae: дифтерия (кожная форма)
- М. tuberculosis: волчанка обыкновенная
- М. marinum: хронические язвенные поражения кожи
- М. ulcerans: деструктивные язвы (язва Бурули)
- С. minutissimum: эритразма
- Pseudomonas aeruginosa: колонизация ожогов
- Erysipelothrix rhusiopathiae: эризипелоид
При целлюлите, вызванном S. pyogenes, S. aureus, Pasteurella multocida, реже вибрионами, обитающими в морской воде, и грамотрицательными бациллами, происходит поражение всех слоев кожи. Микроорганизмы проникают в организм человека через повреждённые участки кожи, раны и места укусов насекомых. Эмпирическое лечение флуклоксациллином необходимо начинать до получения результатов бактериологического исследования. В тяжёлых случаях применяют внутривенные антибактериальные препараты (бензилпенициллин и флуклоксациллин).
Некротизирующий фасцит — быстро прогрессирующая инфекция, поражающая также кожу и подкожную клетчатку. Заболевание развивается в результате микст-инфекции, вызванной аэробными и анаэробными микроорганизмами, а также вследствие моноинфекции S. pyogenes. Болезнь быстро прогрессирует и может привести к смерти пациента за очень короткое время. Большую роль в лечении играет успешное иссечение инфицированных некротических тканей, проводимое на фоне лечения бензилпенициллином, цефалоспоринами третьего поколения и метронидазолом.
Эритразма — поверхностная инфекция, возникающая на сгибательных поверхностях конечностей и вызываемая Corynebacterium minutissimum. Очаги поражения флюоресцируют в ультрафиолетовом свете. Возбудитель может быть выделен при посеве. Для лечения применяют эритромицин или тетрациклин.
Рожа — стрептококковая инфекция, поражающая органические участки кожи на лице или голенях. При обследовании отмечают обычно повышение количества лейкоцитов в периферической крови. Для лечения назначают приём внутрь амоксициллина и флуклоксациллина; в тяжёлых случаях может потребоваться внутривенное введение антибиотиков.
Эризипелоид — зоонозная инфекция, вызываемая Erysipelothrix rhusiopathiae. Местный очаг (обычно пальцы рук) характеризуется развитием эритемы красно-фиолетового цвета. В группу риска входят мясники (поражаются пальцы рук при работе с инфицированным мясом, чаше свиньи) и рыбаки. В большинстве случаев заболевание разрешается самостоятельно, но применение внутрь пенициллина или тетрациклина позволяет ускорить процесс выздоровления, назначение антибиотиков обязательно при развитии вторичной бактериемии.
Ожоги могут стать причиной инфекции, вызванной Pseudomonas aeruginosa, S. aureus, S. pyogenes и иногда бактериями кишечной группы. Возможно заражение антибиоти-коустойчивыми формами микроорганизмов. Бактериальное поражение может привести к отторжению пересаженной кожи и вторичной бактериемии.
Паронихия. Паронихия, или воспаление околоногтевой ткани, — распространённое заболевание, возникающее вследствие бактериальной инвазии (например, S. aureus) в местах повреждения кутикулы. При этом возникают боль, отёчность с последующим формированием небольшого абсцесса. Абсцесс дренируют и назначают антибактериальную терапию (флуклоксациллин и др.).
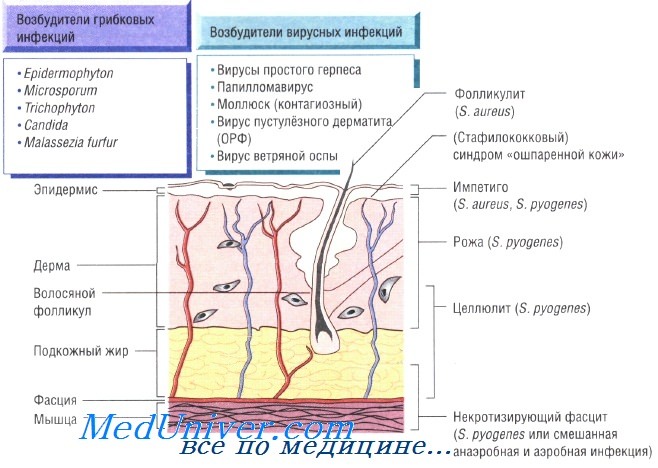
Причины инфекций кожи
Кожные проявления системных инфекций
На коже могут отражаться проявления системных инфекций. Ярким примером может служить петехиальная сыпь при менингококковой септицемии — несомненный признак тяжёлого сепсиса. У пациентов с синегнойной септицемией на коже возникают гангренозные очаги (гангренозная эктима). Менее выражены кожные изменения при эндокардите (кровоизлияния у оснований ногтей). При стафилококковой септицемии возникают участки инфаркта кожи, а при некоторых вирусных заболеваниях высыпания на коже становятся частью характерной клинической картины (ветрянка и корь).
Для вируса простого герпеса кожные покровы — первичный очаг инфекции. Некоторые штаммы Staphylococcus aureus и бета-гемолитических стрептококков вызывают системные заболевания, обусловленные действием токсинов и сопровождающиеся различными кожными изменениями: при синдроме токсического шока — генерализованная и сыпь на ладонях, при скарлатине — сыпь с бледностью носогубного треугольника, а при синдроме ошпаренной кожи у новорождённых — сильное шелушение.
Бородавки как инфекция кожи
Папилломавирус человека поражает клетки кожи и усиливает их репликацию, в результате чего формируется бородавка (папиллома). Существуют папулёзные, пятнистые и мозаичные виды папиллом, а также подошвенная (роговая) бородавка. Заболевание передаётся при непосредственном контакте с больным, а также через предметы общего пользования особенно при повышенной влажности (при совместном купании в бассейне).
Передача генитальных бородавок (остроконечных кондилом) осуществляется половым путём. Диагноз устанавливают на основании клинических признаков. Для определения вируса остроконечных кондилом применяют реакцию иммунофлюоресценции и полимеразную цепную реакцию.
Папилломавирусы вызывают злокачественные новообразования шейки матки (тип 16 и 18) и гортани (тип 6 и 11). В настоящее время существуют вакцины против виусов типа 16 и 18, которые формируют продолжительный иммунитет.
Папилломы со временем самостоятельно исчезают, не оставляя рубцов (за исключением случаев у людей со сниженным иммунитетом). Очень часто для самолечения применяют местные кератолитические вещества (салициловая кислота). При генитальных бородавках используют подофил щитовидный*. В качестве альтернативы применяют криотерапию, ускоряющую исчезновение папиллом. Прижигание в настоящее время не рекомендуют для частого использования у одного пациента.
Некоторые штаммы поксвирусов поражают кожный покров и вызывают возникновение характерных симптомов (например, контагиозный моллюск и контагиозный пустулёзный дерматит).
Дерматофитозы - грибковые инфекции кожи
Клинические признаки дерматофитозов. При дерматофитии (стригущем лишае) возникают бляшки, сопровождаемые зудом и покраснением. Со временем их диаметр увеличивается, а в центре образуется бледное пятно. При хроническом поражении ногтей наблюдают обесцвечивание и истончение ногтей, а при заболеваниях кожи головы — облысение и рубцевание. В основе названия заболевания лежит место заражения, например дерматофития головы (tinea capitis — стригущий лишай), дерматофития туловища (tinea corporis).
Лабораторная диагностика грибковых инфекций кожи. При инфекции кожного покрова отмечают свечение поражённых участков в ультрафиолетовом свете.
В лабораторию доставляют сухие соскобы с поражённых участков кожи, образцы ногтей и волос. При нагревании в растворе натрия гидроксида они обесцвечиваются, и во время микроскопии становятся видны гифы грибов. Дерматофиты растут на декстрозосодержащем агаре Сабурада при температуре 30 °С в течение четырёх недель.
В основе идентификации лежат морфологические свойства колоний, особенности микроскопической картины (окраска лактофеноловым синим), биохимическое исследование, а также секвенирование 18S рибосомальной РНК гена.
Лечение грибковых инфекций кожи. При дерматофитозах применяют местные препараты группы имидазола (миконазол, клотримазол, тиоконазол или аморолфин). При некоторых формах инфекции назначают тербинафин (внутрь) в течение нескольких недель.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Для эффективного лечения хронических инфекционнных заболеваний предлагаются инновационные подходы, включающие: диагностику - оценку аутоиммунитета, комплексную терапию, направленную на элиминацию возбудителей, восстановление иммунитета, в том числе иммуни
For effective treatment of chronic infectious diseases some innovative approaches were suggested that include: diagnostic, autoimmunity assessment, complex therapy targeted to eliminate the agents, immunity restoration including intestine immunity and further rehabilitation.
Нерешенные проблемы патогенеза, лечения хронических заболеваний встают все острее. В настоящее время показано, что при большинстве хронических заболеваний, ранее считавшихся неинфекционными, выявляются латентные или активные бактериально-вирусные процессы [1, 2].
Хронические инфекционные заболевания, как правило, являются сочетанными (микст-инфекции). Вcе чаще они трудно поддаются лечению, носят рецидивирующий характер, в ряде случаев отмечается их непрерывное течение.
Многократно проводимая антибактериальная терапия оказывается не всегда эффективной, часто имеет место иммуносупрессивное, выраженнное побочное действие антибиотиков. То есть иммуносупрессивная терапия при хронических инфекционных процессах и хронических заболеваниях патогенетически не всегда обоснована. Есть ли альтернатива?
При проведении вакцинации также могут отмечаться побочные эффекты, в том числе выраженные. Введение вакцин в ряде случаев вызывает развитие слабого специфического иммунного ответа, или, наоборот, выявляется гиперреактивность, при этом могут активироваться очаги хронической инфекции, нарушаться механизмы иммунорегуляции, приводящие к развитию аутоиммунных процессов [3].
К решению данных вопросов можно подойти с позиций современных знаний в области иммунофизиологии и иммунопатологии [1–3, 5–7].
Все болезни являются инфекционными, если не доказано другого [1]
Колонизация микроорганизмами слизистых начинается еще внутриутробно (во время беременности, от матери). После рождения микроорганизмы поступают во внутреннюю среду через дыхательные пути, пищеварительный тракт с пищей, по мере взросления этот процесс ассимиляции увеличивается.
Факторами, усиливающими поступление микроорганизмов, являются вредные привычки (например, курение), поездки в различные страны, заболевания желудочно-кишечного тракта.
Один из механизмов воздействия генов микроорганизмов на геном человека следующий. Гены микроорганизмов участвуют в активации ключевого ядерного фактора транскрипции NF-каппа-би, который запускает продукцию ряда белков, поддерживающих воспалительные процессы (ферменты, медиаторы, цитокины).
T. Marshall в своих исследованиях показал, что при аутоиммунных заболеваниях в клетках различных органов, в крови выявляются геномы вируса Эпштейна–Барр, цитомегаловируса, вируса гепатита С, Chlamydia trachomatis, грибов.
То есть геном микроорганизмов (в настоящее время обнаружено более 1 миллиона генов микроорганизмов по сравнению с 25 тысячами генов человека) при большинстве хронических заболеваний выявляется во многих клетках организма.
Феномен антигенной молекулярной мимикрии
При частых обострениях хронических инфекционных процессов, определенном генотипе (особенности HLA-системы), нарушениях в регуляции иммунного ответа может возникнуть аутоиммуный процесс.
Комплексная оценка аутоиммунитета — инновационный подход к диагностике при хронических заболеваниях
В настоящее время хорошо известно, что все основные события, связанные с воспалительными процессами, развиваются в органах, т. е. местно. Изменения в периферической крови указывают на системность, распространенность, наличие выраженной активности воспалительного процесса.
В течение 20 последних лет активно развивается инновационный подход к диагностике различных заболеваний: появился иммунологический метод, позволяющий оценивать наличие и степень выраженности воспалительного процесса в основных органах и системах [5, 6].
Новые подходы к лечению хронических инфекционных процессов
В клетках человека, в лимфоцитах присутствует ядерный рецептор (VDR-рецептор), который участвует в синтезе Toll-подобных рецепторов, распознающих общие детерминанты многих микроорганизмов. Этот механизм участвует в подавлении активности различных патогенов (бактерий, вирусов).
При хронических инфекционных процессах VDR-рецептор заблокирован, инактивирован микроорганизмами.
В настоящее время обнаружено [1], что препарат олмесартана медоксомил (Кардосал) обладает высокой противовоспалительной активностью при различных заболеваниях, в том числе аутоиммунных, он способен восстанавливать активность VDR-рецептора. При этом прием данного препарата должен осуществляться длительно, практически постоянно. Этот препарат относится к группе сартанов (антагонисты рецепторов ангиотензина II) (Диован, Лозап и др.), которые применяются для лечения артериальной гипертензии.
Противовоспалительным эффектом, основанным на новом механизме действия, обладают экстракты босвеллиевой кислоты (из ладанного дерева), экстракты семян сибирской кедровой сосны. При применении данных препаратов происходит блокада активности ядерного фактора NF-каппа-би [4], при этом подавляется синтез провоспалительных цитокинов и др. (интерлейкина-1, фактор некроза опухолей альфа, бета, ряда металлопротеиназ).
В комплексную терапию включается специфическое лечение активной, преобладающей в данный момент бактериально-вирусной инфекции с последующей длительной реабилитацией, которая может осуществляться в течение нескольких месяцев. При этом показали свою высокую эффективность препараты — Глицирам 2 табл. 3 раза в день, производные бетулина — Суперантитокс 50 мг 1 раз в день, экстракты из босвеллиевой кислоты 10 мг 1 раз в день.
В комплексном лечении и реабилитации пациентов с хроническими инфекционными (воспалительными) процессами нами обязательно применяется коррекция состояния кишечника (важнейшего органа иммунитета) и органов желудочно-кишечного тракта, билиарной системы. В частности, пробиотики рекомендуется применять длительно: 2 и более месяцев.
Немного фактов: более 60% всех иммунокомпетентных клеток находится в кишечнике, площадь которого в 10 раз больше площади кожных покровов и составляет более 300 м 2 , кишечник имеет большую метаболическую активность, чем печень, он синтезирует три четверти всех нейротрансмиттеров, в кишечнике находится клеток в 10 раз больше, чем во всем остальном организме.
Состояние иммунитета кишечника ослабляется наличием дисбиоза (синдрома избыточного бактериального роста, повышенной проницаемости, пищевой непереносимости).
Нарушенное состояние кишечника невозможно восстановить без нормализации работы вышележащих органов — желудка, печени, желчного пузыря, поджелудочной железы. Поэтому в комплексную терапию хронических инфекционных заболеваний входит лечение патологий желудочно-кишечного тракта (ЖКТ).
Вакцинация. Спорные вопросы. Предлагаемые решения
Известные иммунологи (академик РАН Черешнев В. А., Shoenfeld Y., 2012) указывают, что введение комплексных вакцин не всегда согласовывается с основными законами функционирования иммунитета: силы, конкуренции антигенов, интервалов, суммации раздражений.
При использовании вакцин описана еще одна достаточно новая проблема — синдром ASIA [3]. Адъюванты, используемые в вакцинах для усиления действия антигенов, могут вызывать у лиц с особенностями генотипа (HLA) повышенную предрасположенность к развитию аутоиммунных процессов. Подобный эффект могут оказывать латекс, силикон.
В наших работах [8, 9] убедительно показано, что у детей с увеличенной вилочковой железой, регистрируемой в момент вакцинации, или имевших гиперплазию тимуса в анамнезе у 60% не вырабатывался защитный титр антител к дифтерийному компоненту вакцин АКДС и АДС (независимо от фирмы-производителя вакцин и лабораторий, в которых контролировался уровень антител). После проведения иммунотропной терапии содержание специфических антител достигало защитного уровня.
В связи с этим мы рекомендуем перед вакцинациями, прежде всего у детей первых месяцев и первых лет жизни, определять величину тимуса (по УЗИ).
Можно ли избежать осложнений при проведении вакцинаций?
Заключение
Рекомендуется перед проведением первой вакцинации детям первых месяцев жизни проводить УЗИ тимуса (диагностика тимомегалии или гипоплазии тимуса) для определения дальнейшей тактики ведения ребенка.
Литература
А. В. Симонова*, доктор медицинских наук, профессор
Л. Г. Кузьменко**, доктор медицинских наук, профессор
И. С. Лебедева*
И. Д. Баранова*, кандидат медицинских наук
В. В. Арзямова**, кандидат медицинских наук

Бруцеллёз - зоонозное инфекционно-аллергическое заболевание, склонное к хронизации, протекающее с преимущественным поражением опорно-двигательного аппарата, сердечно-сосудистой, нервной и половой систем.
Заболеть бруцеллезом достаточно сложно. Несмотря на то, что заболевание это инфекционное, заразиться от больного бруцеллезом человека практически невозможно.
Бруцеллы обладают высокой инвазивностью и могут проникать через неповреждённые слизистые покровы; их относят к внутриклеточным паразитам, но они могут также находиться вне клетки. Бруцеллы достаточно устойчивы во внешней среде. В воде сохраняются свыше 2 мес, в сыром мясе - 3 мес, в засоленном - до 30 дней, в брынзе - 2 мес, в шерсти - до 4 мес. Бруцеллы погибают при нагревании до 60 °С через 30 мин, при кипячении - моментально. Чувствительны к действию многих дезинфицирующих средств - 2% раствор карболовой кислоты, 3% раствор креолина и лизола, 0,2-1% раствор хлорной извести и хлорамина убивают их в течение нескольких минут.


Естественная восприимчивость людей высокая. Постинфекционный иммунитет длится обычно 6-9 мес. Повторные заболевания наблюдают в 2-7% случаев.
Основные эпидемиологические признаки. Бруцеллёз - убиквитарная инфекция; очаги болезни выявлены на всех континентах. При этом для неё характерен выраженный профессиональный характер заболеваемости: она наиболее распространена в сельской местности среди работников животноводства. Заболеваемость людей тесно связана с эпизоотиями среди крупного рогатого скота, овец и коз. Значительное место в отдельных случаях занимает возможность миграции бруцелл от биологически адаптированного хозяина к другим животным. Миграции способствуют чаще всего совместное содержание или совместный выпас разных видов животных. Наибольшую опасность представляют миграции В. melitensis на крупный рогатый скот. Заболевают в основном люди, работающие с животными: чабаны, пастухи, доярки, ветеринарные и зоотехнические работники, сотрудники бактериологических лабораторий, рабочие мясокомбинатов, боен, шерстеперерабатывающих фабрик. Заражение может произойти при переработке мясного сырья, кожи, шерсти животных, больных бруцеллёзом. В таких случаях проникновение бруцелл в организм человека происходит через кожные покровы, слизистые оболочки глаза, носа, ротовой полости. При лабораторном обследовании животноводов выявляется 1,5-2% лиц, имеющих антитела к возбудителям бруцеллёза. Распространённость бруцеллёза не одинакова по регионам, его регистрируют в основном в животноводческих районах. Эпизоотии и высокий уровень заболеваемости бруцеллёзом сохраняется в странах СНГ, главным образом в Казахстане и среднеазиатских странах, из которых возможно поступление в Украине инфицированного сырья. Максимальное число заболеваний бруцеллёзом козье-овечьего типа приходится на весенне-летний период. При заражении бруцеллёзом от крупного рогатого скота сезонность выражена слабее, что объясняется длительным периодом лактации и заражением в основном через молоко и молочные продукты.
Начинается бруцеллез у человека, как обычное простудное заболевание. В первые дни больных беспокоят:
- лихорадка
- жар
- скачки температуры тела
- боль в суставах
- ощущение растяжения мышц
- утомляемость
- потливость
- увеличение лимфатических узлов
ВАЖНО: Для острого течения бруцеллеза характерны перепады настроения у больного. Необъяснимое нервное состояние при заражении бруцеллезом говорит о том, что бактерии воздействуют на нервную систему.
Эпидемиологический надзор основан на результатах оценки эпизоотической и эпидемической обстановки. В связи с этим в организации и проведении противобруцеллёзных мероприятий важную роль играют своевременный обмен информацией и совместная деятельность ветеринарной и санитарно-эпидемиологической служб по выявлению заболеваний среди животных и людей и оценке факторов риска их возникновения.
Профилактика и борьба с бруцеллёзом основаны на проведении комплекса ветеринарно-санитарных и медико-санитарных мероприятий, направленных на снижение и ликвидацию заболеваемости бруцеллёзом сельскохозяйственных животных. Поголовье животных в неблагополучных зонах необходимо систематически обследовать на бруцеллёз с помощью серологических и аллергологических тестов для своевременного выявления и ликвидации больных животных. В качестве вспомогательной меры в эндемичных по бруцеллёзу регионах проводят активную иммунопрофилактику бруцеллёза животных введением живой вакцины. Прививкам подлежат также постоянные и временные работники животноводства, а также работники мясокомбинатов. Большое значение имеют обезвреживание сырья и продуктов животноводства, кипячение и пастеризация молока и молочных продуктов, другие мероприятия. Особого внимания требуют помещения, где содержится скот. После вывоза навоза или удаления абортированных плодов и последа помещение следует обеззаразить 20% раствором хлорной извести, 2% раствором формальдегида или 5% раствором мыльно-креозоловой смеси. К работе по уходу за животными не допускают подростков, беременных и лиц, страдающих хроническими заболеваниями. Все лица, допущенные к работе с животными, должны быть обеспечены спецодеждой, также необходимо умение пользоваться дезинфицирующими средствами. Большое значение имеет неукоснительное соблюдение правил личной гигиены. При этом проводят систематическое профилактическое обследование персонала, занятого работой с животными (не реже 1 раза в год). Важную роль играет разъяснительная работа об опасности употребления в пищу сырого молока и невыдержанных сыров и брынзы, использования шерсти животных из неблагополучных по бруцеллёзу хозяйств.
Читайте также:

