Что такое заболевание коровье бешенство у человека
Обновлено: 25.04.2024
Коровье бешенство — это неврологическое заболевание, приводящее к ухудшению головного и спинного мозга.
Признаки
В организм человека от животного попадает зараженный прион, что приводит к поражениям головного мозга. Такие прионы нарушают действия всего организма и разрушают его.
Существуют две формы заболевания коровье бешенство:
У человека признаками заболевания являются: поражения мозга, депрессия, проблемы со сном, потеря памяти.
Симптомы
Коровье бешенство проявляется у людей такими симптомами, как: головокружения, депрессия, раздражительность, частичная потеря памяти, эпилепсия, паралич, страх, галлюцинации.
Диагностика
В качестве диагностики используют инструментальные методы. Необходимо изучить все симптомы больного. Собрать необходимые анализы, в качестве материала используют спинномозговую жидкость. Также проводят биопсию головного мозга.
Способы заражения
Заразиться данным заболеванием не так уж и легко. Но если это все-таки случилось, то болезнь становится очень опасной и смертельной.
Вакцинации от коровьего бешенства к сожалению, еще не придумали.
Заразиться коровьим бешенством можно из-за переливания зараженной крови в организм, также через плохо обработанные медицинские инструменты, пересадку зараженных прионов и употребления зараженного мяса.
Наиболее достоверный способ заражения коровьим бешенством является употребление в пищу мяса диких животных. Также подхватить инфекцию возможно из молока различных животных.
Профилактика
Профилактика — это единственный способ избежать заболевания. В качестве мер предосторожности от заражения необходимо: отказаться от мяса, привезенного из-за рубежа, проверять всех иностранных животных, завезенных в страну, приобретать корма с наличием сертификата, проводить лабораторные исследования.
Лечение
В данный момент лекарства от коровьего бешенства не найдено. На прионы не действует ни одна группа препаратов. Возможно только немного продлить жизнь человека с помощью таких групп препаратов, как противосудорожные и противоэпилептические.
На данный момент коровье бешенство у людей неизлечимо и в 100% случаев приводит к летальному исходу, но ученые постоянно ищут способы лечения.
Все представленные на сайте материалы предназначены исключительно для образовательных целей и не предназначены для медицинских консультаций, диагностики или лечения. Администрация сайта, редакторы и авторы статей не несут ответственности за любые последствия и убытки, которые могут возникнуть при использовании материалов сайта.
Болезнь Крейтцфельдта-Якоба — редко встречающееся дегенеративное заболевание головного мозга, связанное с накоплением в нейронах патологического белка приона. Клинически болезнь Крейтцфельдта-Якоба проявляется слабоумием, пирамидными и экстрапирамидными нарушениями, миоклониями, симптомами поражения мозжечка и нарушением зрения. Диагноз болезни Крейтцфельдта-Якоба основывается на совокупности клинических симптомов, данных ЭЭГ, анализа цереброспинальной жидкости, МРТ и ПЭТ головного мозга, а также морфологического исследования образца тканей мозга, полученного в результате биопсии или посмертно. Эффективное лечение болезни Крейтцфельдта-Якоба пока не найдено. Заболевание имеет 100% летальный исход.
МКБ-10
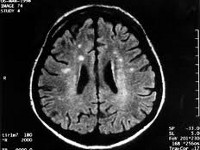
Общие сведения

Причины
Установлено, что болезнь Крейтцфельдта-Якоба имеет инфекционный характер. Заражение может произойти при пересадке зараженных прионами тканей, через нейрохирургический инструмент и препараты крови, при введении некоторых гормональных препаратов (человеческого гонадотропина для лечения бесплодия и соматотропина для терапии гипопитуитаризма). Болезнь Крейтцфельдта-Якоба новой формы может развиваться после употребления в пищу мяса заболевших животных (коровы) или носителей инфекции (овец и коз).
В результате ряда исследований стало известно, что болезнь Крейтцфельдта-Якоба связана с проникновением в организм инфекционного белка — приона. В норме в клетках головного мозга человека содержится здоровый прион, имеющий несколько другое строение. Инфекционный прион, попадая в организм человека не разрушается, а с током крови поступает в головной мозг и откладывается на поверхности нейронов. Его взаимодействие с нормальными прионами мозговой клетки приводит к тому, что они изменяют свою структуру, постепенно трансформируясь в патогенную, подобную инфекционному приону, форму. Патогенные прионы образуют бляшки и приводят к гибели нейрона.
Болезнь Крейтцфельдта-Якоба имеет достаточно длительный инкубационный период, связанный с временем, необходимым для проникновения инфекционных прионов в мозговую ткань и патогенной трансформации здоровых прионов. Длительность инкубационного периода напрямую зависит от способа заражения. При инфицировании тканей головного мозга зараженным хирургическим инструментом болезнь Крейтцфельдта-Якоба развивается через 15-20 месяцев. При инфицировании через имплантированные в околомозговые структуры ткани (например, твердую мозговую оболочку, роговицу глаза) инкубационный период может длиться до 5,5 лет. При внутримышечном введении инфицированных лекарственных препаратов (например, гонадотропина, соматотропина, содержащих бычий тромбин гемостатиков) болезнь Крейтцфельдта-Якоба начинает проявляться спустя 12,5 лет.
Отмечаются также наследственные формы болезни Крейтцфельдта-Якоба, связанные с генетическими нарушениями, приводящими к образованию патологических прионов.
Классификация
Практическая неврология классифицирует болезнь Крейтцфельдта-Якоба с учетом ее клинической формы. В соответствии с этим выделяют: подострую спонгиоформную энцефалопатию, отличающуюся быстрым течением и диффузным поражением мозговой коры; классическую (дискинетическую) форму, представляющую собой сочетание пирамидных и экстрапирамидных симптомов со слабоумием (деменцией); промежуточную форму болезни Крейтцфельдта — Якоба, характеризующуюся преобладанием мозжечковых и подкорковых расстройств; амиотрофическую форму, двигательные и речевые расстройства при которой напоминают клинику бокового амиотрофического склероза.
Симптомы болезни Крейтцфельдта-Якоба
В большинстве случаев болезнь Крейтцфельдта-Якоба характеризуется постепенным развитием, однако возможно подострое или острое начало. Примерно в 30% случаев болезнь Крейтцфельдта-Якоба начинается с продромальных симптомов: раздражительности, рассеянности, головных болей, нарушений сна, головокружения, ухудшения памяти, снижения зрения, безынициативности, снижения либидо, изменения поведенческих реакций. Возможно эпизодическое возникновение эйфории и/или беспричинного страха, отрывистые бредовые или галлюцинаторные переживания. Из неврологических нарушений в продромальном периоде наблюдаются: шаткость во время ходьбы, парестезии, расстройство высших функций коры головного мозга (алексия, акалькулия и пр.). Описаны несколько случаев, когда болезнь Крейтцфельдта-Якоба дебютировала с появления корковой слепоты.
В стадии развернутых клинических проявлений болезнь Крейтцфельдта-Якоба характеризуется прогрессирующим спастическим параличем (параплегией или гемиплегией), атаксией, эпилептическими припадками. Возникают экстрапирамидные нарушения: мышечная ригидность, атетоз, тремор. Практически у всех больных наблюдаются миоклонии — быстрые неритмичные сокращения отдельных мышц. Чаще всего отмечается миоклонус губы и века. Наблюдаются вторично генерализованные миоклонические приступы. Появляется и нарастает ярко выраженная деменция, сопровождающаяся нарушениями речи вплоть до ее полного распада. Новый вариант болезни Крейтцфельдта-Якоба отличается преобладанием психиатрической симптоматики и расстройств чувствительности. В 100% случаев он сопровождается мозжечковыми нарушениями, в то время как при спорадической болезни Крейтцфельдта-Якоба расстройства функции мозжечка наблюдаются лишь в 40% случаев.
В терминальной стадии болезнь Крейтцфельдта-Якоба характеризуется глубокой деменцией. Пациенты не контактны, находятся в состоянии прострации, утрачен контроль над функцией тазовых органов. Наблюдаются гиперкинезы, выраженные мышечные атрофии, нарушения глотания, пролежни. Возможна гипертермия и эпилептические приступы. Смерть наступает в коматозном состоянии на фоне децеребрационной ригидности и выраженной кахексии.
Диагностика
Клиническая диагностика заболевания основана на сочетании прогрессирующей в течение 2-х лет деменции, пирамидных и экстрапирамидных расстройств, миоклоний, мозжечковых расстройств и нарушений зрения. Для уточнения диагноза невролог назначает инструментальные методы обследования: электроэнцефалографию (ЭЭГ), ПЭТ и МРТ головного мозга, люмбальную пункцию. В сомнительных случаях для установления диагноза болезнь Крейтцфельдта-Якоба производят стереотаксическую биопсию головного мозга.
На ЭЭГ на фоне сниженной биоэлектрической активности у большинства больных наблюдаются периодические или псевдопериодические острые волны. Отмечается билатеральная, фокальная или генерализованная миоклоническая активность, которая в начальной стадии определяется у половины больных, а в терминальной стадии выявляется в 100% случаев спорадической болезни Крейтцфельдта-Якоба. Новый вариант заболевания часто протекает без существенных изменений ЭЭГ-паттерна.
Люмбальная пункция в обязательном порядке проводится пациентам с подозрением на болезнь Крейтцфельдта-Якоба. Она позволяет оценить давление ликвора и произвести исследование цереброспинальной жидкости. Отсутствие патологических изменений ликвора позволяет дифференцировать болезнь Крейтцфельдта-Якоба от многих других заболеваний ЦНС.
Наиболее достоверным методом диагностики является морфологическое исследование образцов мозговой ткани, которые могут быть получены прижизненно путем биопсии или при аутопсии после смерти пациента. Применение иммуноцитохимического метода позволяет обнаружить в исследуемом материале отложения патологического белка — приона.
Дифференциальная диагностика
Дифференциальную диагностику болезни Крейтцфельдта-Якоба необходимо проводить с лобно-височной деменцией, герпевирусным энцефалитом, болезнью Альцгеймера, мультиинфарктной деменцией (слабоумием, развивающимся после повторных ишемических и геморрагических инсультов), хроническим менингитом, арахноидитом, нормотензивной гидроцефалией, энцефалопатией Хашимото, сопровождающей некоторые случаи аутоиммунного тиреоидита, и др.
Лечение болезни Крейтцфельдта-Якоба
В современной медицине подходы к лечению болезни Крейтцфельдта-Якоба находятся в стадии активной разработки. Общепринятые противовирусные препараты, а также пассивная иммунизация и вакцинация людей и животных выявились неэффективными. Отмечено, что блокирующее действие на синтез патологических прионов в инфицированных нейронах оказывает Брефелдин А, а блокаторы кальциевых каналов продлевают жизнь инфицированных клеток. Обычно пациенты, имеющие болезнь Крейтцфельдта-Якоба, получают симптоматическое лечение. Оно направлено на купирование миоклонических приступов и экстрапирамидных нарушений, в связи с чем применяются антиэпилептические и противопаркинсонические лекарственные средства.
Прогноз болезни Крейтцфельдта-Якоба
Болезнь Крейтцфельдта-Якоба является фатальным заболеванием. Продолжительность жизни большинства больных не превышает 1 год с момента начала клинических проявлений; а средняя длительность составляет 8 месяцев. Лишь 5-10% заболевших живут в течение 2 и более лет. Наследственная болезнь Крейтцфельдта-Якоба в среднем длится около 26 месяцев.
Бешенство – инфекционный зооноз вирусной этиологии, характеризующийся преимущественным тяжелым поражением центральной нервной системы, угрожающими летальным исходом. Человек заражается бешенством при укусе животных. Распространяясь по нервным волокнам, вирус бешенства вначале повышает их возбудимость, а затем вызывает развитие параличей. Проникая в ткани спинного и головного мозга вирус вызывает грубые нарушения в работе ЦНС, клинически проявляющиеся различными фобиями, приступами агрессивного возбуждения, галлюцинаторным синдромом. Бешенство до сих пор остается неизлечимым заболеванием. По этой причине трудно переоценить значение профилактической антирабической вакцинации, проводимой пациенту в случае укуса животного.
МКБ-10
Общие сведения
Бешенство – инфекционный зооноз вирусной этиологии, характеризующийся преимущественным тяжелым поражением центральной нервной системы, угрожающими летальным исходом. Человек заражается бешенством при укусе животных.
Характеристика возбудителя
Бешенство вызывает РНК-содержащий рабдовирус, имеющий пулевидную форму и обладающий двумя специфическими антигенами: растворимый AgS и поверхностный AgV&. В процессе репликации вирус способствует возникновению в нейронах специфических включений – эозинофильных телец Бабеша-Негри. Вирус бешенства довольно устойчив к охлаждению и замораживанию, но легко инактивируется при кипячении, воздействии ультрафиолетового излучения, а также дезинфекции различными химическими реагентами (лизол, хлорамин, карбоновая кислота, сулема и др.).
Люди обладают ограниченной естественной восприимчивостью к бешенству, вероятность развития инфекции в случае заражения зависит от локализации укуса и глубины повреждения и колеблется в пределах от 23% случаев при укусах конечностей (проксимальных отделов) до 90% в случае укуса в лицо и шею. В трети случаев заражение происходит при укусе диких животный, в остальных случаях виновниками поражения человека бешенством являются домашние животные и скот. В случае своевременного обращения за медицинской помощью и проведения профилактических мероприятий в полней мере бешенство у инфицированных лиц не развивается.
Патогенез бешенства
Вирус бешенства проникает в организм через поврежденную кожу и распространяется по волокнам нервных клеток, к которым имеет выраженную тропность. Кроме того, возможно распространение вируса по организму с током крови и лимфы. Основную роль в патогенезе заболевания играет способность вируса связывать рецепторы ацетилхолина нервных клеток и повышать рефлекторную возбудимость, а в последующем - вызывать параличи. Проникновение вируса в клетки головного и спинного мозга приводят к грубым органическим и функциональным нарушениям работы ЦНС. У больных развиваются кровоизлияния и отек головного мозга, некроз и дегенерация его ткани.
В патологический процесс вовлекаются клетки коры полушарий, мозжечка, зрительного бугра и подбугорной области, а также ядра черепно-мозговых нервов. Внутри нейронов головного мозга при микроскопии отмечаются эозинофильные образования (тельца Бабеша-Негри). Патологическое перерождение клеток ведет к функциональным расстройствам органов и систем ввиду нарушения иннервации. Из центральной нервной системы вирус распространяется в другие органы и ткани (легкие, почки, печень и железы внутренней секреции и др.). Попадание его в слюнные железы ведет к выделению возбудителя со слюной.
Симптомы бешенства
Инкубационный период бешенство может составлять от пары недель при локализации укуса на лице или шее до нескольких месяцев (1-3) при внедрении возбудителя в области конечностей. В редких случаях инкубационный период затягивался до года.
Бешенство протекает с последовательной сменой трех периодов. В начальном периоде (депрессии) отмечается постепенное изменение поведение больного. В редких случаях депрессии предшествует общее недомогание, субфебрилитет, боль в области ворот инфекции (как правило, уже зажившей к началу заболевания раны). Иногда (крайне редко) место внедрения возбудителя вновь воспаляется. Обычно в этом периоде клиника ограничивается проявлениями со стороны центральной нервной системы (головные боли, расстройства сна, потеря аппетита) и психики (апатия, подавленность, раздражительность, угнетенность и приступы страха). Иногда больные могут ощущать дискомфорт в груди (стеснение), страдать расстройством пищеварения (обычно запорами).
Разгар заболевания (стадия возбуждения) наступает на 2-3 день после появления первых признаков депрессии, характеризуется развитием различных фобий: боязни воды, воздуха, звуков и света. Гидрофобия – боязнь воды – мешает больным пить. Характерное поведение – при протягивании стакана с водой, больной с радостью его берет, но попытка выпить жидкость вызывает приступ парализующего страха, приостановку дыхания и больной бросает стакан. Однако не всегда бешенство сопровождается гидрофобией, что может затруднять диагностику. При прогрессировании заболевания больные страдают от сильной жажды, но ввиду сформировавшегося рефлекса даже вид и шум воды вызывают спазмы дыхательных мышц.
Аэрофобия характеризуется приступами удушья в связи с движением воздуха, при акустофобии и фотофобии такая реакция наблюдается на шум и яркий свет. Приступы удушья кратковременны (несколько секунд), их сопровождают спазмы и судороги мимической мускулатуры, зрачки расширены, больные возбуждены, испытывают панический ужас, кричат, откидывают голову назад. Наблюдается дрожание рук. Дыхание во время пароксизмов прерывистое, свистящее, вдохи – шумные. В дыхании задействована мускулатура плечевого пояса. В этом периоде больные пребывают в агрессивном возбужденном состоянии, много кричат, склонны к бессистемной агрессивной активности (мечутся, могут ударить или укусить). Характерна гиперсаливация.
С прогрессированием заболевания приступы возбуждения становятся все чаще. Отмечается потеря веса, избыточное потоотделение, возникают галлюцинации (слуховые, зрительные и обонятельные). Продолжительность периода возбуждения составляет 2-3 дня, реже удлиняется до 6 суток.
Терминальная стадия болезни – паралитическая. В тот период больные становятся апатичны, их движения ограничены, чувствительность снижена. Ввиду стихания фобических пароксизмов возникает ложное впечатление, что больному стало лучше, однако в это время быстро поднимается температура тела, развивается тахикардия и артериальная гипотензия, возникают параличи конечностей, а в дальнейшем и черепно-мозговых нервов. Поражение дыхательного и сосудодвигательного центра вызывает остановку сердечной деятельности и дыхания и смерть. Паралитический период может длиться от одного до трех дней.
Диагностика бешенства
Есть способы выделения вируса бешенства из ликвора и слюны, кроме того, существует возможность диагностики с помощью реакции флюоресцирующих антител на биоптатах дермы, отпечатках роговицы. Но ввиду трудоемкости и экономической нецелесообразности эти методики не применяются в широкой клинической практике.
В основном диагностику осуществляют на основании клинической картины и данных эпидемиологического анамнеза. К диагностическим методикам, имеющим прижизненный характер, также относят биопробу на лабораторных животных (новорожденных мышах). При заражении их выделенным из слюны, ликвора или слезной жидкости вирусом, мыши погибают через 6-7 дней. Гистологический анализ ткани головного мозга умершего больного позволяет окончательно подтвердить диагноз в случае выявления в клетках телец Бабеша-Негри.
Лечение бешенства
В настоящее время бешенство является неизлечимым заболеванием, терапевтические мероприятия носят паллиативный характер и направлены на облегчение состояния пациента. Больные госпитализируются в затемненную шумоизолированную палату, им назначают симптоматические средства: снотворные и противосудорожные препараты, обезболивающие, транквилизаторы. Питание и регидратационные мероприятия осуществляют парентерально.
Сейчас идет активное опробование новых схем лечения с помощью специфических иммуноглобулинов, иммуномодуляторов, гипотермии головного мозга и методик интенсивной терапии. Однако до сих пор бешенство является смертельным заболеванием: летальный исход наступает в 100% случаев развития клинической симптоматики.
Профилактика бешенства
Профилактика бешенства в первую очередь направлена на снижение заболеваемости среди животных и ограничение вероятности укуса бродячими и дикими животными человека. Домашние животные в обязательном порядке подвергаются плановой вакцинации от бешенства, декретированные категории граждан (работники ветеринарных служб, собаколовы, охотники и т.д.) проходят иммунизацию антирабической вакциной (троекратное внутримышечное введение). Спустя год производится ревакцинация и в дальнейшем в случае сохранения высокого риска заражения, рекомендовано повторение иммунизации каждые три года.
В случае укуса животного обязательно производится комплекс мер, направленных на предотвращение бешенства: рана промывается медицинским спиртом, обрабатывается антисептиками, накладывается асептическая повязка, после чего следует немедленно обратиться в травматологический пункт (либо к хирургу или фельдшеру ФАП). В кратчайшие сроки проводится курс профилактической антирабической вакцинации (сухой инактивированной вакциной) и пассивной иммунизации (антирабический иммуноглобулин). Схема профилактических инъекций зависит от локализации укуса, глубины раны и степени загрязнения слюной.
В разгар пандемии коронавируса европейцы не раз и не два поругают китайцев: мол, если бы те не ели всякую экзотику, то опасный вирус не перепрыгнул бы к нам от летучих мышей. А затем скажут: мы, европейцы, не такие. На право считаться самой высокой цивилизацией мира могли бы претендовать британцы, если бы не одно но. Знаете ли вы, почему граждане Туманного Альбиона, родившиеся и жившие в UK до 1996 года, не могут быть донорами крови в Европе?
Как известно, Британия — родина капитализма. Сначала жители королевства начали строить паровые машины, потом стали машинами ткать одежду. Скорость производства выросла, стоимость продукта упала. В том же духе и остатки сельского хозяйства во второй половине ХХ века перевели на промышленную основу: максимум дохода, минимум непродуктивных отходов.
В тех самых шахтах, из которых первые, пока стационарные паровые машины выкачивали воду, канареек использовали для определения метана — газа без запаха и цвета. Канарейки умирали первыми, давая возможность шахтерам убежать. В конце XX века роль канареек стали играть коты. И сначала один кот, потом второй погибли от непонятной болезни — поначалу они ходили заплетающимися ногами, кружились на месте и наконец умирали.
Подобная болезнь нервной системы — почесуха овец (когда овцы начинали расчесывать себе бока до крови) — известна у этих парных млекопитающих еще с середины XVIII века, но в 1990-х у котов она была обнаружена впервые. Поскольку было известно, что почесуха овец людям не передается, Министерство сельского хозяйства Великобритании рекомендовало не обращать на нее внимания, и британская говядина считалась абсолютно безопасной.
Отметим, что у людей похожее заболевание — болезнь Крейтцфельдта — Якоба — наблюдалось и раньше. Известно, что оно поражает людей в возрасте старше 50 и является генетическим. Другое подобное заболевание, куру, обнаружили у аборигенов Новой Гвинеи, у тех был обычай есть мозг умерших родственников. Итак, спонтанную природу болезни Крейтцфельдта — Якоба никто не отрицал, но каков же механизм ее передачи?
Как обычно, после появления первых случаев заболевания его развитие проецировали в бесконечность, но с 2005 года наметился явный тренд к падению числа случаев, которых никогда не было слишком много — десятки.
Проблема побольше вызвана тем, что прион передается не только через мясо, но и через клетки крови [3]. Именно поэтому британцам запрещено сдавать кровь в Европе, есть ограничения и в самой Британии. Каннибализма среди британцев не замечено, но поскольку люди с еще не диагностированным заболеванием сдавали кровь, потенциально они могут появиться у любого, кому в 1980–1990-е переливали кровь в Британии. Исследования удаленных аппендиксов показали, что один из 2000 британцев имеет в своих организмах накопления прионной формы PrP [4].
И наконец, появляются данные о том, что нейродегенеративные заболевания, болезнь Альцгеймера и Паркинсона, в которых наблюдаются похожие на прионы скопления белка, также заразны [5].
Получается, что там, где дело касается безопасной еды, британцы оказались ничем не лучше китайцев, хотя их подвела не традиция, а наоборот, технический прогресс. И, увы, никто не может поручиться, что новые заболевания, связанные со стремлением человека расширить свое меню нашими меньшими собратьями, не появятся и в России.
Литература
1. Creutzfeldt-Jakob Disease Fact Sheet (National Institute of Neurological Disorders and Stroke).
2. Abigail B. Diack, Mark W. Head, Sandra McCutcheon, Aileen Boyle, Richard Knight, et. al.. (2014). Variant CJD // Prion. 8, 286–295.
3. Alexander H. Peden, Mark W. Head, L. Ritchie Diane, E Bell Jeanne, W Ironside James. (2004). Preclinical vCJD after blood transfusion in a PRNP codon 129 heterozygous patient // The Lancet. 364, 527–529.
4. Abigail B. Diack, Robert G. Will, Jean C. Manson. (2017). Public health risks from subclinical variant CJD // PLoS Pathog. 13, e1006642.
5. Alison Abbott. (2016) The red-hot debate about transmissible Alzheimer’s // Nature. News feature.
6. Joseph R. Berger, Erick Weisman, Beverly Weisman (1997) Creutzfeldt-Jakob Disease and eating squirrel brains // The Lancet. 350, 907, 9078, P642.
7. Richard F. Marsh, Anthony E. Kincaid, Richard A. Bessen, Jason C. Bartz (2016) Interspecies Transmission of Chronic Wasting Disease Prions to Squirrel Monkeys (Saimiri sciureus) // Journal of Virology. 79 (21), 13794–13796.
Возбудитель бешенства (Rabies virus) относится к семейству рабдовирусов (Rhabdoviridae), содержащих одноцепочечную линейную молекулу РНК, роду Lyssavirus. По форме он напоминает пулю длиной около 180 и диаметром 75 нм. В настоящее время известно семь генотипов.

Вирус бешенства под просвечивающим электронным микроскопом (увеличение в 36 700 крат). На компьютерном изображении красным цветом показана белковая оболочка вируса — капсид, а желтым — дополнительная липопротеиновая оболочка
Коварный вирус
Вирус бешенства обладает тропностью (сродством) к нервной ткани, так же как вирусы гриппа — к эпителию дыхательных путей. Он проникает в периферические нервы и со скоростью примерно 3 мм/ч движется в центральные отделы нервной системы. Затем нейрогенным путем он распространяется и на другие органы, в основном — на слюнные железы.
Вероятность заболевания зависит от места и тяжести укусов: при укусах бешеными животными в лицо и шею бешенство развивается в среднем в 90% случаев, в кисти рук — в 63%, а в бедра и в руки выше локтя — лишь в 23% случаев.
Источники заражения
Основными дикими животными — источниками заражения — являются волки, лисицы, шакалы, енотовидные собаки, барсуки, скунсы, летучие мыши. Среди домашних опасны кошки и собаки, причем именно на последних приходится максимум подтвержденных случаев передачи бешенства человеку. Большинство больных зверей погибает в течение 7–10 дней, единственное описанное исключение — желтый, он же лисицевидный мангуст Cynictis penicillata, способный носить в себе вирус без развития клинической картины инфекции в течение нескольких лет.
Наиболее характерный и достоверный признак наличия вируса в организме человека или животного — обнаружение так называемых телец Негри, специфических включений в цитоплазме нейронов диаметром около 10 нм. Впрочем, у 20% пациентов тельца Негри найти не удается, так что их отсутствие не исключает диагноз бешенства.
Первый, но чрезвычайно важный шаг к борьбе с бешенством сделал гениальный французский химик и микробиолог Луи Пастер. Разработку вакцины против этого заболевания он начал в 1880 году, после того как ему пришлось наблюдать агонию пятилетней девочки, укушенной бешеной собакой.
Кролики и собаки
Хотя впервые бешенство было описано еще в I веке до н.э. римлянином Корнелием Цельсом, спустя почти 2000 лет об этой болезни было известно ничтожно мало. Лишь в 1903 году, спустя восемь лет после смерти Пастера, французский врач Пьер Ремленже установил, что бешенство вызывается субмикроскопической формой жизни — фильтрующимся вирусом.
Как размножаются вирусы

Вирусы и бактерии
С бактериальными инфекциями врачи борются довольно успешно. С вирусами не все так просто.
Изменчивый враг
Вирусы растений
40 уколов в живот
Затем настала очередь людей. Но где найти добровольцев? Доведенный до отчаяния, Пастер был готов пожертвовать собой ради науки, но, к счастью, вмешался Его Величество Случай.
6 июля 1885 года на пороге парижской лаборатории Пастера появилась заплаканная женщина, державшая за руку девятилетнего сына — Йозефа Майстера. За три дня до этого мальчика покусала бешеная собака, нанеся ему 14 открытых ран. Последствия были вполне предсказуемы: в то время уже было известно, что смерть в таких случаях практически неминуема. Однако отец мальчика был наслышан о работах Пастера и настоял на том, чтобы привезти ребенка из Эльзаса в Париж. После серьезных колебаний Пастер ввел маленькому пациенту экспериментальный препарат, и Йозеф стал первым в истории человеком, спасенным от бешенства.
Из лабораторного дневника Луи Пастера, 1885 год

Но его поддержали простые люди. По подписке за полтора года жители многих стран мира собрали 2,5 млн франков, на которые был создан Институт Пастера, официально открытый 14 ноября 1888 года. На его территории находится музей и усыпальница исследователя, спасшего человечество от смертельно опасной инфекции. Дата смерти Пастера, 28 сентября, выбрана Всемирной организацией здравоохранения (ВОЗ) для проведения ежегодного Всемирного дня борьбы против бешенства.
Долгое время вакцину вводили под кожу передней брюшной стенки, причем для проведения полного курса требовалось до 40 инъекций. Современный иммунопрепарат вводится внутримышечно, в плечо, достаточно шести визитов в травмпункт.
Чудо Милуоки
В течение XX века ситуация с бешенством была однозначной: если пострадавшего не прививали вовремя или он вообще не получал вакцину, дело заканчивалось трагически. По подсчетам ВОЗ, ежегодно в мире после нападения бешеных животных погибает 50–55 тысяч человек, 95% из них приходится на Африку и Азию.
О возможности полноценного лечения инфекции заговорили лишь в XXI веке. Связано это было со случаем американки Джины Гис, которая впервые в истории медицины не получала вакцину, но выжила после появления симптомов бешенства. 12 сентября 2004 года 15-летняя Джина поймала летучую мышь, которая укусила ее за палец. Родители не стали обращаться к врачу, посчитав рану пустяковой, но спустя 37 дней у девочки развилась клиническая картина инфекции: подъем температуры до 39°С, тремор, двоение в глазах, затруднение речи — все признаки поражения центральной нервной системы. Джину направили в детский госпиталь Висконсина, и в лаборатории Центра по контролю и предотвращению заболеваний (Centers for Disease Control and Prevention, CDC) в Атланте подтвердили бешенство.
Через месяц анализы подтвердили: в организме девочки нет вируса. Мало того, мозговые функции были нарушены минимально — она закончила школу, а спустя год получила водительские права. В настоящее время Джина окончила колледж и намерена продолжать обучение в университете. Неудивительно, что своей будущей профессией она видит биологию или ветеринарию, а специализироваться планирует именно в области бешенства.
При проведении эпидемиологических расследований оказалось, что пациентов, которых удалось вылечить с помощью Милуокского протокола, кусали летучие мыши. Именно этот факт позволил некоторым ученым предположить, что на самом деле методика лечения тут ни при чем, а дело именно в этих млекопитающих, а точнее в том, что они заражены другим штаммом вируса, менее опасным для человека.
Загадка летучей мыши
В 2012 году это предположение получило первые подтверждения. В American Journal of Tropical Medicine and Hygiene появилась статья группы экспертов CDC, американских военных вирусологов и эпидемиологов министерства здравоохранения Перу. Результаты их исследования произвели эффект разорвавшейся бомбы: в перуанских джунглях удалось обнаружить людей, у которых в крови есть антитела к вирусу бешенства. Этим людям никогда не вводили никаких вакцин, более того, они даже не помнят, чтобы болели чем-нибудь серьезным. А это означает, что бешенство смертельно не на 100%!
В процессе опроса жителей 63 из 92 человек сообщили ученым об укусах летучих мышей. У этих людей, а также у местных летучих вампиров были взяты пробы крови. Результаты анализов оказались неожиданными: в семи пробах обнаружили антитела, нейтрализующие вирус бешенства.
Наличие антител можно было бы объяснить введением антирабической (лат. rabies — бешенство) вакцины, но, как выяснилось, такую вакцину получал только один из семи человек. Остальные переболели бешенством не только без смертельного исхода, но даже без каких-либо серьезных симптомов. В двух перуанских деревеньках обнаружилось больше выживших после этой инфекции, чем описано во всей медицинской литературе! Неудивительно, что группа Гилберт два года перепроверяла полученные данные, прежде чем решилась их опубликовать.
Но ни в коем случае — это подчеркивают все специалисты, включая авторов исследования — нельзя отказываться от введения антирабической вакцины при укусах диких животных. Во-первых, действительно может оказаться, что в летучих мышах живет другая разновидность вируса, более слабая, и везение перуанских крестьян не распространяется на штаммы, передающиеся с укусами собак или енотов. Во-вторых, результаты и выводы данного исследования могут оказаться ошибочными, так что лишний раз подвергаться риску нет никакого смысла.
Читайте также:

