Что такое золотистый стафилококк и астма
Обновлено: 26.04.2024
Стафилококки, из которых золотистый стафилококк относится к наиболее важным патогенным агентам для человека, представляют собой стойкие грамположительные бактерии, обитающие на кожных покровах. При нарушении целостности кожных покровов или слизистых оболочек во время операции или в результате травмы стафилококки могут попадать в подлежащие ткани и размножаться в них, что сопровождается образованием типично локализованных поверхностных абсцессов. Несмотря на то что эти кожные инфекции обычно не несут в себе опасности и разрешаются спонтанно, размножающиеся микроорганизмы могут проникать в лимфатическую и кровеносную системы, обусловливая потенциально опасные осложнения, связанные со стафилококковой бактериемией.
К этим осложнениям относятся септический шок, который может быть неотличим от шока при инфицироваиии грамотрицательными бактериями, а также тяжело протекающие метастатические очаги фактически в любом органе, в том числе эндокардиты, артриты, остеомиелит, пневмонии и абсцессы. Определенные штаммы золотистого стафилококка продуцируют токсины, которые могут быть причиной кожных высыпаний или вызывают дисфункцию многих систем, например при синдроме токсического шока.
Коагулазоотрицательные стафилококки, в частности эпидермальный, относятся к возбудителям внутрибольничных инфекций, особенно инфицированию подвержены сосудистые катетеры и протезы. Частой причиной инфекции мочевых путей служат сапрофитные штаммы.
Этиология и микробиология
Патогенные стафилококки отличают от непатогенных микрококков по их способности к анаэробной ферментации глюкозы и чувствительности к лизостафинэндопептидазе. Золотистый стафилококк, наиболее важный из представителей этого рода патогенный агент для человека, получил свое название из-за золотистого цвета колоний, вырастающих в аэробных условиях на твердой питательной среде, в связи с выработкой каротиноидов. Все штаммы стафилококков, продуцирующие коагулазу, называют золотистыми.
В отличие от коагулазоотрицательных стафилококков золотистый стафилококк ферментирует маннитол, продуцируют ДНКазy и проявляют высокую чувствительность к лизостафину. При культивировании на кровяном агаре он проявляет обычно гемолитические свойства. Доступные коммерческие тест-системы основаны на использовании специфических антител, связанных с частичками или бусинками латекса; с их помощью можно отличить золотистый стафилококк от коагулазоотрицательного по агглютинации частиц. Штаммы золотистого стафилококка обычно проявляют более высокую биохимическую активность (продуцирование коагулазы, токсинов, гемолизинов), чем коагулазоотрицательные. стафилококки.
В настоящее время известны 12 и предполагается существование еще двух штаммов коагулазоотрицательных стафилококков, из которых эпидермальный и сапрофитный имеют наибольшее клиническое значение. Последний может быть идентифицирован по устойчивости к новобиоцилину и налидиксовой кислоте, хотя это относится только к выделенным из мочи.
Различия штаммов золотистого и эпидермального стафилококков имеют значение при идентификации общего источника во время эпидемии при внутрибольничиых вспышках стафилококковой инфекции. Штаммы золотистого стафилококка могут быть идентифицированы по чувствительности к антибиотикам, лизису под воздействием стафилококкового бактериофага (фаготипирование) и выявлению плазмид внутри микроорганизма.
Из этих трех методов наименее точен метод определения чувствительности к антибиотикам, а наиболее точен метод выявления плазмид. Попытки дифференцировать штаммы эпидермального стафилококка методом только биотипирования, определения чувствительности к антибиотикам или серотипирования в целом не сопровождаются удовлетворительными результатами. Только 20-40% его больничных культур могут быть типированы с помощью стандартного метода фаготипирования. Плазмидный анализ наиболее надежен в отношении дифференцирования штаммов.
Эпидемиология
Коагулазоотрицательные стафилококки - это часть обычной флоры кожных покровов, слизистых оболочек и нижнего отдела кишечника; из них чаще всего выделяют эпидермальный стафилококк. Золотистый стафилококк временно заселяет передние отделы носовых ходов у 70-90% лиц и может выделяться в течение относительно продолжительного периода у 20-30% из них. Носительство в носовых ходах часто сопровождается вторичной колонизацией кожи. Независимая колонизация области промежности регистрируется у 5-20% лиц, а во влагалище он выявляется у 10% менструирующих женщин. Более высок уровень носительства золотистого стафилококка у персонала больниц (в том числе у врачей и медицинских сестер), стационарных больных и у больных, при лечении которых требуются частые проколы кожи, например при инсулинзависимом диабете, почечной недостаточности, когда необходим гемодиализ, и при аллергии (частые инъекции с целью десенсибилизации).
Среди больных наркоманией также увеличен процент носителей золотистого стафилококка. Как полагают, нарушение целостности кожных барьеров способствует его колонизации.
Сапрофитный стафилококк отличается от эпидермального повышенной способностью к адгезии к эпителиальным клеткам мочевых путей. Примерно у 5% здоровых мужчин и женщин относительно невелико количество этого микроорганизма в уретре или периуретральной области.
Несмотря на то что стафилококки могут выживать в окружающей среде в течение продолжительного периода, а некоторые штаммы распространяются воздушно-капельным путем, передача от человека к человеку через загрязненные руки служит наиболее важным путем передачи инфекции. Госпитализированные больные с острой стафилококковой инфекцией или с интенсивной колонизацией, особенно на коже (хирургические раны, ожоги, язвы от пролежней) представляют собой важнейший источник для возникновения внутрибольничных инфекций.
Они выделяют огромное количество микроорганизмов и при уходе за ними происходит загрязнение рук персонала больницы. Нарушения правил асептики и пренебрежение мытьем рук способствуют передаче микроорганизмов от одного лица другому. Как золотистый, так и эпидермальный стафилококк может стать причиной эндемичной инфекции в палате для больных с обширными поражениями кожи, особенно при множественной лекарственной устойчивости микроорганизмов в результате интенсивного лечения противобактериальными препаратами (ожоговые отделения, отделения интенсивной терапии, отделения по пересадке костного мозга). Практически здоровые лица из числа обслуживающего персонала, носителей возбудителей в носовых ходах, могут служить источником вспышки внутрибольничных инфекций. При тщательном обследовании обнаруживают, что в период усиленной передачи стафилококков у большей части носителей кожная инфекция активизируется.
Если исключена инфекция мочевых путей, то наиболее частой причиной внутрибольничных вспышек в США служат золотистый и эпидермальный стафилококки. Они чаще выделяются в качестве возбудителей как первичной, так и вторичной бактериемии, а также при кожных и хирургических раневых инфекциях.
Патогенез
Стафилококковые инфекции обычно развиваются в результате сочетания таких факторов, как вирулентность бактерий и снижение защитных сил организма. К важным факторам вирулентности стафилококков относятся их способность к выживанию при неблагоприятных условиях, компоненты клеточной стенки, продукция ферментов и токсинов, содействующих проникновению в ткани, способности к внутриклеточной персистенции в определенных фагоцитах и приобретению резистентности к противобактериальным препаратам. К важным защитным функциям организма человека относят целостность слизисто-кожного барьера, достаточное количество функционально активных нейтрофилов и удаление чужеродных тел или омертвевших тканей.
Факторы вирулентности микроорганизма.
К компонентам оболочки золотистого стафилококка относятся большой пептидогликановый комплекс, придающий ей прочность и способствующий выживанию в неблагоприятных условиях осмотического давления, уникальная тейхоевая кислота, связанная с пептидогликаном, и протеин А, существующий как в связанной с пептидогликаном форме на большей части поверхности клетки, так и в свободной, растворимой, форме.
Как пептидогликан, так и тейхоевая кислота может активировать превращение комплемента по альтернативному пути. Наряду с опсонизацией микроорганизмов для их поглощения фагоцитами активация комплемента может также играть определенную роль в патогенезе шока и диссеминированного внутрисосудистого свертывания.
Протеин А связывается с Fc-фрагментом определенных классов IgG и с Fc-рецептором фагоцитов и может служить блокирующим фактором, предотвращающим поглощение микроорганизмов нейтрофилами. Специфические рецепторы для ламинина, основного гликопротеина базальной мембраны сосудов, могут способствовать реализации возможности широкого распространения золотистого стафилококка. Некоторые штаммы эпидермального стафилококка могут быть покрыты антифагоцитарной капсулой, для переваривания которой требуются специфические антитела.
Клеточная стенка определенных штаммов этого стафилококка может активировать комплемент; при этой инфекции развиваются шок и диссеминированное внутрисосудистое свертывание, хотя. и реже, чем при инфекции, вызываемой золотистым стафилококком. Способность эпидермального стафилококка прилипать к канюлям, введенным в сосуд, и сосудистым протезам можно объяснить его склонностью инфицировать чужеродные тела; природа лигандов неизвестна.
Рисунок 1. Зачастую у больных астмой снижены виды на будущее, хотя некоторые склонны недооценивать тяжесть симптомов своего заболевания Какова дифференциальная диагностика между бронхиальной астмой и ХОЗЛ? С чем связаны возможны
 |
| Рисунок 1. Зачастую у больных астмой снижены виды на будущее, хотя некоторые склонны недооценивать тяжесть симптомов своего заболевания |
Какова дифференциальная диагностика между бронхиальной астмой и ХОЗЛ?
С чем связаны возможные ошибки в диагностике?
Какова основная роль b-агонистов в терапии бронхиальной астмы?
Как назначаются кортикостероиды?
Несмотря на возросшую компетентность врачей и доступность эффективных методов лечения, смертность от бронхиальной астмы остается высокой. Предотвратить многие смертельные исходы и даже избежать большинства случаев госпитализации можно было бы при проведении правильного лечения.
Необходимо помнить, что ведение больных астмой — процесс сложный и длительный.
Недооценка степени несостоятельности дыхания. Тяжесть состояния пациента и степень несостоятельности его дыхательной системы можно не распознать, если пренебречь тщательным выяснением всех проявлений болезни и построением диаграммы измерений максимальной скорости потока (МСП) выдыхаемого воздуха.
Зачастую у больных астмой снижены виды на будущее, хотя некоторые и склонны недооценивать серьезность симптомов своего заболевания. Чтобы выявить такую недооценку, нужно подробно расспросить пациента, бывает ли у него кашель или хриплое дыхание ночью или при физической нагрузке.
Если пациентам не удается достичь наилучшей возможной функции легких, то для коррекции этого состояния необходимо для начала вычислить нормальную МСП выдыхаемого воздуха для данного пациента, пользуясь диаграммой, прилагаемой к пикфлуометру.
Если измеренная МСП более чем на 20% меньше вычисленной, стоит провести исследование обратимости этого состояния, что делается путем сопоставления МСП или жизненной емкости легких (ЖЕЛ) до и после лечения.
Необходимая терапия может состоять всего лишь в однократном приеме бронходилятатора, но если это не увеличивает МСП на 20%, то есть до вычисленного уровня, могут понадобиться более серьезные меры, например трехнедельный курс системных кортикостероидов (30 мг преднизолона в день для взрослых). Таким образом выясняется наилучший достижимый уровень МСП, на который ориентируются в последующем лечении.
Иногда пациенты сообщают об уменьшении одышки, но при этом значения МСП не изменяются. В таких случаях необходимо провести измерение ЖЕЛ с помощью спирометра, которое может подтвердить улучшение, не определяемое по МСП (рис. 2). Спирометрами в настоящее время укомплектованы все врачебные приемные.
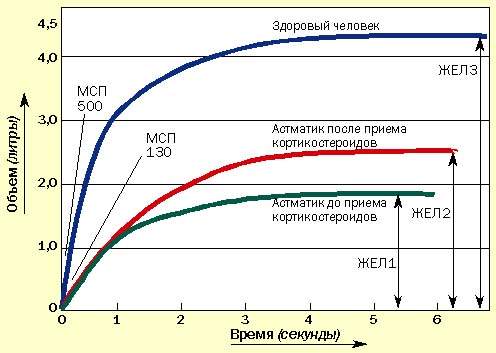 |
| Рисунок 2. Изменение ЖЕЛ под влиянием курса кортикостероидов. МСП может не измениться, но увеличение ЖЕЛ свидетельствует об улучшении состояния |
Бронхиальная астма, замаскированная под хроническое обструктивное заболевание легких (ХОЗЛ). Страдающие одышкой пациенты, которым поставлен диагноз ХОЗЛ или эмфизема, могут иметь скрытый бронхоспастический элемент, обусловленный бронхиальной астмой.
Таким пациентам необходимо провести исследование обратимости процесса, как описано выше. Любое улучшение функции легких можно поддержать, проводя адекватное лечение бронхиальной астмы. При отсутствии улучшения легочной функции назначение кортикостероидов ничем не оправдано, а только приводит к нежелательным побочным эффектам, таким как остеопороз.
Что должен помнить врач, наблюдающий больных с бронхиальной астмой
- Сказал ли я, что нужно применять спейсер при ингалировании кортикостероидов?
- Проверил ли я навыки ингаляции?
- Осмотрел ли я всех пациентов, недавно перенесших тяжелые приступы или госпитализацию?
- Все ли пациенты с повторными назначениями регулярно приходят на прием?
- Все ли я сделал, чтобы исключить астму у пациентов с ХОЗЛ?
- Проводятся ли регулярные проверки для достижения единообразного подхода к ведению астматиков?
Постоянный прием b-агонистов короткого действия. Показано, что лечение астмы постоянным приемом b-агонистов увеличивает гиперреактивность легких и утяжеляет бронхиальную астму [1]. Если пациент использует b-агонисты скорее регулярно, чем случайно, их применение должно сопровождаться назначением ингаляционных кортикостероидов или, если кортикостероиды уже применяются, увеличением их дозы до достаточной, чтобы контролировать астму. Таким образом, b-агонисты оставляют на случаи одышки и хрипов.
Последние методические указания по лечению бронхиальной астмы в Британии рекомендуют начинать с высокой дозы ингаляционных или системных кортикостероидов для достижения быстрого контроля, затем постепенно снижать дозу до минимальной, обеспечивающей нормальное самочувствие пациента и оптимальные значения МСП или ЖЕЛ на фоне минимального применения бронходилятатора (рис. 3). Быстрое облегчение состояния, достигаемое при применении кортикостероидов, улучшает настроение пациента и увеличивает его доверие к лечению.
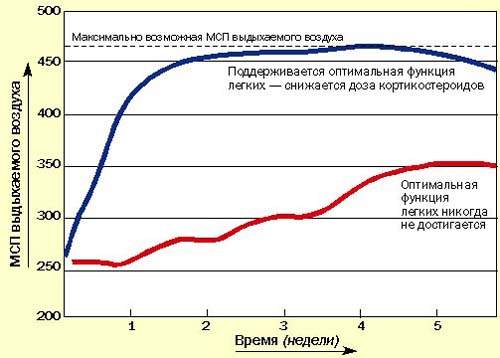 |
| Рисунок 3. Рекомендуется начинать с высоких доз кортикостероидов, а затем постепенно снижать дозу до минимальной (оптимальные значения МСП или ЖЕЛ) |
Последние данные свидетельствуют о том, что назначать кортикостероиды нужно как можно раньше всем астматикам, и не только для контролирования симптомов, но и для предотвращения прогрессирующих структурных повреждений легких, обусловленных хроническим воспалением [2,3]. Это означает, что кортикостероиды следует предпочесть b-агонистам, как только диагноз подтверждается МСП-диаграммой. b-агонисты остаются препаратами резерва на крайний случай.
Возможность альтернативного лечения. Хотя ингалируемые кортикостероиды должны быть краеугольным камнем в лечении астмы, в случаях, трудно поддающихся лечению, можно использовать и некоторые другие препараты. Доказано, что противовоспалительным эффектом обладают теофиллины в достаточно небольших дозах, но надо учитывать в каждом индивидуальном случае их возможное взаимодействие с другими препаратами.
Пожилым пациентам целесообразно назначать ипратропиум. Иногда оказываются эффективными недокромил и кромогликат.
Бронходилятаторы длительного действия, такие как сальметерол, могут облегчать состояние, особенно ночью, блокируя бронхоконстрикторные механизмы. Однако необходимо, чтобы все вышеперечисленные препараты сопровождались применением адекватных доз кортикостероидов.
Техника ингаляции. Нужно добиться, чтобы у пациентов выработались правильные навыки обращения с ингалятором. Врач должен помочь подобрать тот тип ингалятора, который наиболее удобен пациенту, и проверить его работоспособность. Для этого в кабинете врача должен быть полный набор ингаляторов.
Спейсеры. Применяемые вместе с аэрозольными ингаляторами, спейсеры облегчают проникновение препарата в легкие и снижают как накопление его в глотке, так и системное всасывание за счет проглатывания.
Спейсеры помогают координировать выброс препарата со вдохом. Это особенно важно при ингалировании кортикостероидов. Так как кортикостероиды применяются только дважды в день, громоздкий спейсер можно хранить дома.
Спейсеры обеспечивают лучшее накопление препарата в легких, чем распылители. Необходимо правильно их применять: встряхнуть ингалятор, чтобы лекарство смешалось с носителем, и однократно впрыснуть смесь с последующим скорейшим вдохом [4].
Триггерные факторы. Нераспознанные триггерные факторы могут быть и дома, и на работе, и на отдыхе, то есть практически в любом месте. Выявить источник поможет анамнез. Например, при профессиональной бронхиальной астме состояние улучшается во время отпуска и в выходные дни. Отсутствие раздражителя уменьшает или устраняет проявления болезни и снижает необходимость в лекарствах.
Проблемой, которую часто не принимают во внимание, может быть пассивное курение. Такие препараты, как b-блокаторы и нестероидные противовоспалительные средства (НПВС), также могут вызывать астму.
Использование распылителей (небулайзеров) без фоновой кортикостероидной терапии. При лечении острого астматического приступа без назначения пероральных кортикостероидов все еще используют распылители, которые обеспечивают проникновение более высокой дозы b-агонистов. Это действительно снимает бронхоспазм, но поскольку высокая доза b-агонистов не воздействует на сопутствующий воспалительный процесс, необходимо сразу же дать больному кортикостероиды внутрь, чтобы предотвратить нарастание приступа; эффект бронходилятаторов снижается по мере увеличения отека слизистой.
Если тяжесть приступа такова, что требуется небулайзер, необходимо назначить системные кортикостероиды. Даже при умеренном приступе бронходилятаторы сами по себе приносят лишь временное облегчение и есть опасность повторения приступа — возможно, глубокой ночью!
Несвоевременное назначение оральных кортикостероидов. Если не проводить противовоспалительной терапии, у больных нарастает отек слизистой, что приводит к повторению приступов. Такие пациенты часто нуждаются в госпитализации и назначении высоких доз кортикостероидов в течение нескольких дней, прежде чем у них наступит стабилизация состояния.
Пациенты, подверженные быстроразвивающимся приступам, нуждаются в как можно более раннем назначении кортикостероидов и бронходилятаторов. Они должны уметь распознавать ухудшение состояния, всегда иметь под рукой кортикостероиды и знать, как их использовать. Не следует заставлять этих пациентов дожидаться прихода к ним врача (рис. 4).
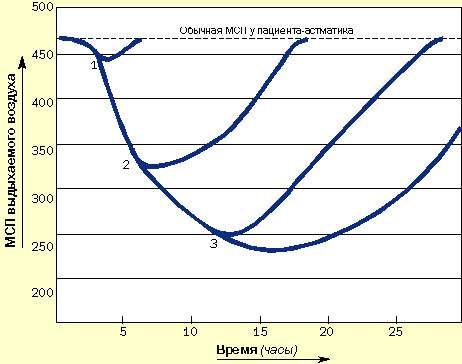 |
| Рисунок 4. Зависимость развития острых приступов от времени назначения кортикостероидов и как результат применения длительных курсов системной кортикостероидной терапии. (1) Кортикостероиды назначены сразу после возникновения приступа: выздоровление наступает быстро. (2) Кортикостероиды назначены через 6 часов: выздоровление замедлено. (3) Кортикостероиды назначены позже чем через 12 часов: приступ тяжелый и длительный, выздоровление наступает медленно |
Пациенты с постепенным развитием приступов могут подождать и посмотреть, помогает ли увеличенная доза ингаляционных кортикостероидов в сочетании с бронходилятаторами.
Неадекватный курс системных кортикостероидов. Иногда назначенные кортикостероиды отменяют до полного купирования приступа, что ведет к сохранению гиперреактивности бронхов и очередному приступу.
Подобная цепь событий может привести пациента к ложному заключению, что у него бронхиальная астма, трудно поддающаяся лечению.
Прекращение наблюдения за пациентом после острого приступа или госпитализации. Трудности возникают при отмене системного кортикостероида и назначении ингаляционного. В этот переходный период необходимо тщательное наблюдение; по достижении стабилизации состояния дозу ингалируемого кортикостероида постепенно снижают до минимально необходимой, чтобы заболевание никак себя не проявляло и функция легких была оптимальной.
Целью последующего лечения становится поддержание наивысшей МСП, достигнутой в больнице после курса системных кортикостероидов.
Консультация, проведенная через некоторое время после выписки, дает хорошую возможность проверить план ведения пациента, выяснить, что не так, и внести соответствующие поправки.
Кашель и хрипы с гнойной мокротой иногда принимают за легочную инфекцию. Однако мокрота больных астмой содержит гораздо больше эозинофилов, чем полиморфных клеток и бактерий. В пожилом возрасте левожелудочковая недостаточность и сердечная астма должны наводить на мысль о предшествующей бронхиальной астме. Будьте осторожны с b-блокаторами!
Внезапная одышка может быть обусловлена пневмотораксом или легочной эмболией. Хрипы встречаются при туберкулезе легких, бронхиальной карциноме или инородном теле и могут быть четко локализованы. Следовательно, у любого пациента с астмой, развившейся во взрослом возрасте, необходимо провести рентгенологическое исследование органов грудной клетки.
После установления диагноза основная цель врача — освободить пациента от проявлений болезни и оптимизировать функцию легких, а также установить контроль за болезнью. Для этого специально обученный медперсонал должен обучать больных и проверять правильность выполнения ими всех назначений.
Конечно, в некоторых случаях это может оказаться затруднительным, однако план предписанных действий способно усвоить абсолютное большинство больных.
Все пациенты должны:
- уметь распознать начало приступа
- знать, как применять высокие дозы b-агонистов;
- самостоятельно начать прием преднизолона внутрь;
- знать, когда звонить врачу или отправляться в больницу;
- все страдающие от приступов, должны быть обеспечены кортикостероидами.
Литература
1. Sears M. R., Taylor D. R. et al. Regular inhaled b-agonist treatment in bronchial asthma. Lancet 1990;336:1491–1396.
2. Tari Haahtela et al. Comparinson of terbutaline with budesonide in newly detected asthma. N Engl J Med 1991;325:388–392.
3. Redingon A. K., Howarth P. H. Airway remodelling in asthma. Thorax 1997;52:310–312.
4. O'Callaghan C., Barry P. Spacer devices in the treatment of asthma. BMJ 1997;314:1061–1062.
Спирометрия при хронической бронхиальной астме
Бочкообразная грудная клетка при хронической бронхиальной астме возникает из-за задержки воздуха в периферических отделах легких, что приводит к постоянному поддержанию грудной клетки в состоянии вдоха. Задержанный воздух не выдыхается и бесполезно занимает большую часть легких (остаточный объем). Это снижает объем воздуха (жизненную емкость легких), входящего в легкое.
Воздух задерживается из-за хронического воспаления, вызывающего отек слизистой периферических бронхиол. При лечении кортикостероидами отек спадает и воздух высвобождается. Это доказывается увеличением ЖЕЛ, определенной спирометрически. МСП может не изменяться (см. рис. 2.)
Проблема воспалительных заболеваний околоносовых пазух на сегодняшний день крайне актуальна. Заболеваемость риносинуситом за последние 10 лет увеличилась в 2 раза, а удельный вес госпитализированных по этому поводу возрастает ежегодно

Проблема воспалительных заболеваний околоносовых пазух на сегодняшний день крайне актуальна. Заболеваемость риносинуситом за последние 10 лет увеличилась в 2 раза, а удельный вес госпитализированных по этому поводу возрастает ежегодно на 1,5–2%. Наибольшее число больных приходится на возраст от 18 до 55 лет.
В структуре синусита 56–73% приходится на долю поражения верхнечелюстной пазухи в связи с ее наибольшими размерами, высоким расположением естественного соустья и близким контактом с корнями зубов. В последнее время отмечается ежегодный прирост заболеваемости на 1,5–2%.
Известно, что верхние и нижние отделы дыхательных путей имеют тесные анатомо-физиологические связи. Следует отметить участие рецепторного аппарата слизистой оболочки полости носа в регуляции работы легких посредством ринобронхиального рефлекса.
Таким образом, проблема воспалительных заболеваний околоносовых пазух выходит далеко за рамки оториноларингологии и тесно связана с бронхолегочной патологией, аллергизацией организма и изменениями в местном и гуморальном иммунитете.
Риносинусит — воспаление слизистой оболочки носа и околоносовых пазух, практически всегда вызывающийся застоем секрета, нарушением аэрации пазух и, как следствие, инфицированием. Острые риносинуситы обычно имеют вирусную (более чем в 80% случаев возбудителем являются риновирусы) или бактериальную этиологию, хронические — бактериальную, реже грибковую.
Важным моментом в развитии синусита и особенно его хронизации являются аномалии строения внутриносовых структур и решетчатого лабиринта. Полипы, отечная слизистая оболочка, искривленная перегородка носа и другие патологические изменения нарушают проходимость естественных отверстий околоносовых пазух, приводят к стагнации секрета и снижению парциального давления кислорода в околоносовых пазухах. Дополнительное соустье верхнечелюстной пазухи также предрасполагает к развитию синусита, наличие двух и более отверстий создает условия для заброса инфицированной слизи из полости носа обратно в верхнечелюстную пазуху.
Следует подчеркнуть, что вирусное инфицирование является лишь первой фазой заболевания; в этот период продлевается время контакта патогенных бактерий с клетками и становится возможным вторичное бактериальное инфицирование.
Возбудителями инфекционного синусита могут быть как патогенные, так и условно-патогенные микроорганизмы.
Среди возбудителей синусита наиболее значимыми в настоящее время являются Streptococcus (Str.) pneumoniae, Haemophilus (H.) influenzae, реже встречается Moraxella catarrhalis.
Известно, что серьезные внутричерепные и орбитальные осложнения при остром синусите обычно являются результатом инфицирования Str. pneumoniae и H. Influenzae.
В процентном соотношении при остром синусите в 44,9% выделяется Str. pneumoniae, в 17,3% — H. influenzae, в 10,2% — анаэробы, в 7,1% — ассоциации аэробов (Str. pneumoniae и H. influenzae). Считается, что Staphylococcus (S.) aureus обусловливает наиболее тяжелые случаи госпитального (нозокомиального) синусита.
При хронических синуситах микробная флора отличается большим разнообразием: различные стрептококки — 21%, гемофильная палочка — 16%, синегнойная палочка — 15%, золотистый стафилококк и моракселла — по 10%; Prevotella — 31%, анаэробные стрептококки — 22%, Fusobacterium — 15% и др.
Антибиотики для местного воздействия. В настоящее время существует только один антибиотик для местного воздействия на слизистую оболочку — фузафунгин (Биопарокс), выпускаемый в форме дозированного аэрозоля. Благодаря очень малому размеру аэрозольных частиц фузафунгин способен проникать в околоносовые пазухи. Спектр его антимикробной активности распространяется на микроорганизмы, которые чаще всего являются возбудителями инфекций верхних дыхательных путей. Кроме того, за время его применения не отмечено появления новых резистентных к нему штаммов бактерий. Помимо антибактериальных свойств, фузафунгин обладает собственным противовоспалительным действием. Он усиливает фагоцитоз макрофагов и ингибирует образование медиаторов воспаления.
Препараты для местного воздействия особенно эффективны в лечении синусита в случаях хорошей проходимости естественных соустьев пазух. Кроме того, целесообразно использование местных препаратов после операций в полости носа и на околоносовых пазухах.
Системная антибиотикотерапия. Эмпирическая антибактериальная терапия — наиболее рациональная стратегия этиотропной терапии в период возникновения острых гнойных или обострения хронических гайморитов на начальном этапе их лечения.
Отмечаются рост устойчивости к макролидам, а также крайне высокая резистентность к ко-тримоксазолу и тетрациклинам (более 50%), очень низкая активность в отношении ранних фторхинолонов. Приведенные данные позволяют избежать ошибок при выборе конкретного препарата, например назначения сульфаниламидов, линкомицина, доксициклина, ципрофлоксацина и других антибактериальных средств, которые часто рекомендуются врачами поликлиник.
В отношении H. influenzae практически не отмечено резистентности к ингибиторозащищенным пенициллинам, цефалоспоринам II–IV поколений, фторхинолонам.
Спектр значимых возбудителей и характер резистентности в отношении антибактериальных препаратов в настоящее время таковы, что для терапии гнойных синуситов на современном этапе используют β-лактамы, фторхинолоны и макролиды.
Достаточно высокой эффективностью при лечении синуситов обладают цефалоспорины. Пероральный цефалоспорин 3-й генерации Супракс (цефиксим) хорошо зарекомендовал себя как препарат с удобным режимом дозирования (1 раз в сутки), высоким уровнем антибактериальной активности, оптимальной фармакокинетикой в ЛОР-органах, позволяющей сохранять высокие концентрации действующего вещества в слизистой околоносовых пазух. Карбоцистеин — единственный препарат среди отхаркивающих средств, обладающий одновременно мукорегулирующим и муколитическим эффектами. Препарат нормализует количественное соотношение кислых и нейтральных сиаломуцинов бронхиального секрета, что восстанавливает вязкость и эластичность слизи (эффект достигается за счет сиаловой трансферразы, вырабатываемой бокаловидными железами слизистой оболочки).
На фоне применения препарата восстанавливается секреция иммуноглобулина A, улучшается мукоцилиарный транспорт, происходит регенерация структур слизистой оболочки. Действие препарата распространяется на слизистую оболочку всех отделов дыхательного тракта.
Одновременное назначение карбоцистеина и антибиотиков потенцирует лечебную эффективность последних при воспалительных процессах в области как верхнего, так и нижнего отделов дыхательного тракта. Кроме того, карбоцистеин повышает эффективность глюкокортикостероидной терапии, усиливает бронхолитический эффект теофиллина. Активность карбоцистеина ослабляют противокашлевые и атропиноподобные средства.
Для подтверждения тезиса о возможности консервативной терапии синуситов нами проведено обследование и лечение 65 больных гайморитом (диагноз устанавливался на основании жалоб, анамнестических данных, результатов оториноларингологического осмотра, лабораторного и инструментального обследования).
Следует отметить, что данная группа была сформирована из больных, отказавшихся от пункционного метода лечения.
Распределение больных по полу было приблизительно одинаковым: 39 женщин (60%) и 26 мужчин (40%) в возрасте от 18 до 63 лет (39 ± 10,82 года), 67% больных находились в трудоспособном возрасте (20–50 лет).
У 45 (69,2%) больных данной группы диагностирован острый гайморит: у 22 — двусторонний, у 23 — односторонний процесс. У 20 (30,8%) больных отмечалось обострение хронического гайморита: у 16 — двусторонний, у 4 — односторонний процесс.
На неэффективность предшествующей амбулаторной антибиотикотерапии указывали 26 (40%) больных: 6 больных принимали азитромицин по схеме 500, 250, 250 мг в течение 3 сут, 7 больных — ко-тримоксазол (Бисептол 480) по 2 таблетки 2 раза в сутки в течение 7–9 дней, 2 пациента — ампиокс по 500 мг 4 раза в сутки в течение 5–7 дней, 3 пациента — амоксициллин/клавуланат по 375 мг 3 раза в сутки в течение 7–10 дней, 3 пациента — ципрофлоксацин по 250 мг 2 раза в сутки в течение 5 дней, 2 пациента — пефлоксацин по 400 мг 2 раза в сутки в течение 5 дней, 3 пациента — цефазолин внутримышечно по 500 мг 2 раза в сутки в течение 7–9 дней.
На неэффективность предшествующего пункционного лечения указывали 18 (28,1%) больных. У 60 (92,3%) больных после проведенного микробиологического исследования была выявлена патогенная микрофлора.
Микробные ассоциации отмечены у 20 (30,7%) больных. Максимальное число возбудителей, выделенных у одного больного, равнялось трем (табл. 1).
Рентгенологическое исследование околоносовых пазух в носолобной и носоподбородочной проекциях было проведено 24 больным, компьютерная томография — 21 больному.
При проведении сахаринового теста для оценки транспортной функции мерцательного эпителия, у подавляющего числа больных (56–86%) выявлено увеличение времени появления сладкого привкуса во рту (> 13 мин), что косвенно свидетельствует о снижении мукоциллиарного клиренса.
Пульмонологическое (до лечения) и аллергологическое (после лечения) обследования проведены 22 больным с сопутствующим аллергическим риносинуситом (в 8 случаях сочетанным с бронхиальной астмой, в 4 — с аллергией к пыльцевым аллергенам, а в 2 — с непереносимостью Аспирина и Новокаина), 9 больным с сопутствующим полипозным риносинуситом (в 4 случаях сочетанным с бронхиальной астмой и аллергией к бытовым аллергенам), а также 3 больным только с бронхиальной астмой и 5 больным с подозрением на бронхиальную астму.
Все больные получили консультацию пульмонолога. Скрытая бронхоконстрикция выявлена у 10 больных, у 5 человек были обнаружены хронический катаральный бронхит и эмфизема легких, у 4 — диффузный пневмосклероз. У 9 пациентов была диагностирована инфекционно-зависимая бронхиальная астма с атопическими реакциями, немного реже встречалась инфекционно-зависимая бронхиальная астма без атопических реакций (7 человек). Диагноз атопической бронхиальной астмы был поставлен только 4 больным. По степени тяжести бронхиальной астмы все больные были распределены следующим образом: средняя степень тяжести диагностирована у 8, легкая степень — у 9, тяжелая степень — у 3 больных. Минимальная продолжительность бронхиальной астмы составила 4 года, максимальная — 25 лет. Длительность аллергического и полипозного риносинусита колебалась от 4 до 25 лет. Десяти больным ранее по поводу бронхиальной астмы проводилось системное лечение глюкокортикостероидами. У 5 больных бронхиальная астма была выявлена впервые.
Схема эмпирической антибактериальной терапии представлена на рис. 1.
У 7 из 65 больных на 3-и сутки после начала лечения отсутствовала положительная динамика субъективных и объективных симптомов гайморита. Этим больным дополнительно назначен курс пункционного лечения до получения результатов микробиологического исследования ввиду опасности развития внутричерепных осложнений. Четырем из них после получения данных бактериологического исследования была произведена коррекция схемы лечения в соответствии с антибиотикограммой. У 2 больных был выделен золотистый стафилококк, резистентный к большинству антибиотиков, назначен ципрофлоксацин по 500 мг 2 раза в сутки в течение 5 дней. У 2 больных выявлен также резистентный к большинству антибиотиков эпидермальный стафилококк, антибиотиком второго ряда стал левофлоксацин, назначавшийся по 500 мг 1 раз в сутки в течение 5 дней. У 3 оставшихся больных возбудители не были идентифицированы — им назначен антибактериальный препарат второго ряда моксифлоксацин: 500 мг/сут в течение 5 дней. В результате проведенного лечения у всех больных отмечена нормализация картины периферической крови (р < 0,01). Динамика субъективных и объективных симптомов гайморита представлена на рис. 2, 3.
Повторное бактериологическое исследование проводилось на 10-е сутки от начала лечения, а повторная диагностика методом полимеразной цепной реакции — на 30-е сутки после лечения.
Получены следующие результаты микробиологического исследования после лечения:
- эрадикация - у 28 больных;
- предположительная эрадикация (отсутствие патологического отделяемого) - у 37;
- персистирование - не отмечено ни в одном из случаев.
При сравнении показателей риноманометрии, проведенной всем больным до начала лечения и после его окончания, у большинства — 45 (69,2%) человек — отмечено их улучшение (р < 0,01).
Таким образом, на фоне проводимого лечения с 3-го дня установлена устойчивая тенденция (р = 0,055) к снижению, а к 5-м суткам — значительное уменьшение субъективной и объективной симптоматики гайморита, к 10-м суткам определялись бактериологическая санация носового секрета (в отношении атипичных возбудителей — к 30-м суткам) и статистически достоверное улучшение функции мерцательного эпителия (р < 0,01). Положительная динамика патологических изменений в пазухах, по данным ультразвукового исследования, начиналась с 3-х суток. К 30-м суткам у большинства больных результаты рентгенологического и ультразвукового исследований соответствовали норме (рис. 4). Данные изменения были статистически достоверны (р < 0,05).
Повторное пульмонологическое обследование проведено всем 20 больным, страдающим бронхиальной астмой, и 10 больным с выявленной бронхоконстрикцией. Отмечены улучшение показателей функции внешнего дыхания по сравнению с исходными данными у 21 больного и отсутствие изменений у 9 (табл. 2).
Клинический пример. Больная К., 44 года (история болезни № 28385/04) поступила в клинику с жалобами на выделения гнойного характера из обеих половин носа, умеренную заложенность носа с обеих сторон, периодическую головную боль, нарастающую к вечеру, гипосмию.
Длительность заболевания составляла 7 дней, в течение которых больная закапывала сосудосуживающие капли в нос. Обратилась в клинику в связи с отсутствием улучшения состояния.
Слизистая оболочка полости носа гиперемирована, средние и нижние носовые раковины сильно увеличены в объеме за счет отека, средний носовой ход значительно сужен, в общем носовом ходе — большое количество слизисто-гнойного отделяемого.
При обследовании в общем анализе крови отклонений от нормы не выявлено. При эндоскопии полости носа видимых патологических изменений в области остиомеатального комплекса не установлено. При бактериологическом исследовании выявлен рост Str. pneumoniae 107.
Больная консультирована пульмонологом. Показатели функции внешнего дыхания до начала лечения: ОФС1 — 76,2; МОС50 — 46,8. Заключение оториноларинголога: острый двусторонний гнойный гайморит. Аллергический риносинусит. Заключение пульмонолога: скрытая бронхоконстрикция.
Больная принимала цефиксим (Супракс) по 400 мг 1 раз в день в течение 10 дней, Кларготил по 10 мг в день и мометазон в дозе 200 мкг в каждую половину носа 2 раза в день течение 30 дней.
Через 2 дня после начала лечения головная боль прекратилась, периоды затрудненного носового дыхания сократились, появились обильные выделения из носа слизисто-гнойного характера. Через 5 дней выделения приобрели слизистый характер, значительно уменьшились отек и гиперемия слизистой оболочки, восстановилось обоняние.
Слизистая оболочка полости носа розовая, влажная, носовые раковины не увеличены, носовые ходы свободны.
При повторном бактериологическом исследовании роста микрофлоры выявлено не было. Сахариновое время для правой и левой половин носа уменьшилось соответственно до 17 и 15 мин. Показатели функции внешнего дыхания после проведенного лечения улучшились: ОФВ1 — до 86,5; МОС50 — до 58,4.
Спустя 30 дней больная жалоб не предъявляла, а риноскопическая картина полностью нормализовалась.
Многие практикующие врачи крайне скептически относятся к попыткам беспункционного лечения гайморита, называя в качестве главного аргумента неизбежную хронизацию процесса при использовании только системной антибактериальной терапии. Ошибочная постановка знака равенства между пункцией и антибактериальной терапией нередко приводит к нежелательным последствиям. В случае консервативного, неинвазивного лечения пункции — как дренирующему мероприятию — должен быть найден альтернативный метод эвакуации патологического секрета из пазухи, начиная с медикаментозных средств и заканчивая щадящими инструментальными пособиями. А индивидуальный подход к каждому конкретному больному с учетом частой сопутствующей патологии со стороны нижних дыхательных путей позволит в значительной мере оптимизировать результаты лечения и избежать частых обострений и рецидивов как со стороны верхнего, так и нижнего отделов дыхательной системы.
А. Ю. Овчинников, доктор медицинских наук
С. И. Овчаренко, доктор медицинских наук, профессор
И. Г. Колбанова, кандидат медицинских наук
ММА им. И. М. Сеченова, Москва
Бронхиальная астма - это аллергическое заболевание, в клинической картине которого центральное место занимают приступы удушья экспираторного типа, вызванные бронхоспазмом, гиперсекрецией и отеком слизистой оболочки бронхов.
Причины бронхиальной астмы, аллергены
Этиология. Бронхиальную астму могут вызвать аллергены инфекционного и неинфекционного происхождения. Первые места по количеству положительных кожных и провокационных ингаляционных проб занимают золотистый стафилококк, Neisseria caiarralis u Clebsiella, белый стафилококк, Escherichia coli и др., т. е. условно-патогенные и сапрофитные микроорганизмы. Обнаружение общих антигенных детерминант между антигенами из Neisseria perflava, Clebsiella, золотистым стафилококком и легочной тканью человека может указывать и на аутоимунный механизм бронхиальной астмы. Патогенный гемолитический стрептококк и гемолитический стафилококк не играют существенной роли в этиологии и патогенезе бронхиальной астмы.
К неинфекционным относятся бытовые аллергены (домашняя пыль и перо). Очень активным компонентом аллергена из домашней пыли являются клещи рода Dermatophagoides pteronissimus. "Экологическим гнездом" дерматофагоидных клещей являются постельные принадлежности, подушки, матрацы, одеяла. Максимальным периодом размножения клеща являются октябрь - ноябрь и март - апрель, что совпадает и с обострением атопической астмы.
Далее идут аллергены из книжной и библиотечной пыли, пыльцы деревьев, трав и сорняков, из шерсти и перхоти животных и человека; из насекомых и других членистоногих ("воздушный планктон"), особенно дафнии - пресноводного рачка, который в высушенном порошкообразном виде употребляется для корма аквариумных рыб.
Пищевые аллергены - хлебные злаки, рыба, молоко, яйцо и другие имеют этиологическое значение при бронхиальной астме преимущественно у детей, а у взрослых при поллинозах.
Аллергенами могут быть грибы патогенные (Trichophyton, Epidermophyton, Candida, Microsporon) и непатогенные (Cladosporon, Alternaria, Aspergillus, Penicillium и др.).
Лекарственные вещества (большинство антибиотиков и их продуцентов, панкреатин, витамин В1 препараты пиразолонового ряда и др.), как правило, вызывают профессиональную бронхиальную астму.
Из продуктов химического производства следует отметить неорганические соединения ртути, кобальта, никеля, мышьяка, хрома, платины, бериллия, персульфата натрия и аммония; органические гетероциклические (винилкарбазон-винилпиридин) и циклические (ароматические нитро-, азо- и аминосоединения), хлорированные нафталаны, а также альдегиды и терпины. Ряд веществ, применяемых при производстве полимерных материалов (изоционаты, фталиевая кислота, диметилформальдегид и др.); пестициды-хлор-, фосфор-, ртуть-органические соединения, карбонаты, цианомиды и фториды, органические фосфорсодержащие инсектициды. Из этого числа химических аллергенов к возникновению бронхиальной астмы чаще всего приводит сенсибилизация тремя веществами: формалином, фталиевым ангидридом и изоционатами. Последние широко применяются в производстве пенопластов, полиуретановых лаков, искусственных волокон, различных клеев и др.
Основную этиологическую роль при бронхиальной астме играют условно-патогенные и сапрофитные микроорганизмы, бытовые и пыльцевые аллергены. "Химическая" и лекарственная бронхиальная астма носит преимущественно профессиональный характер, однако вещества из этих групп даже в минимальных количествах могут вызывать обострение заболевания, возбудителем которого являются основные аллергены.
Ред. Ф. Koмapoвa
"Что такое бронхиальная астма, причины бронхиальной астмы, аллергены" - Аллергические заболевания
Анализ на золотистый стафилококк — посев биологического материала на питательные среды для идентификации бактерии и её количества. В норме ответ должен быть отрицательный. Клинические проявления стафилококковой инфекции неспецифичны, поэтому анализ на стафилококк позволяет исключить другие заболевания со сходными симптомами, определиться с тактикой лечения. Для исследования используют разный биологический материал: отделяемое из урогенитального тракта, зева, носа, раневой поверхности, мочу, кал, кровь, грудное молоко.
Поликлиника Отрадное предлагает широкий спектр лабораторных анализов для выявления золотистого стафилококка.
Все исследования проводят на современных автоматических анализаторах, что обеспечивает высокое качество, достоверность и быстроту получения результатов.
Наши врачи

Опыт работы: 12 лет.
Записаться на приём
%20200%D1%85200.jpg)
Врач высшей категории
Опыт работы: 22 года.
Записаться на приём

Опыт работы: 15 лет.
Записаться на приём

Опыт работы: 19 лет
Записаться на приём

Опыт работы: 21 год
Записаться на приём

Врач высшей категории
Опыт работы: 22 года
Записаться на приём

Врач высшей категории
Опыт работы: 21 год.
Записаться на приём

Опыт работы: 9 лет.
Записаться на приём

Врач высшей категории
Опыт работы: 38 лет.
Записаться на приём

Опыт работы: 35 лет.
Записаться на приём

Врач высшей категории, кандидат медицинских наук
Опыт работы: 31 год.
Записаться на приём

Врач первой категории
Опыт работы: 22 года.
Записаться на приём
Что такое золотистый стафилококк
Золотистый стафилококк — грамположительная бактерия из рода Стафилококков. Около 40% населения — носители этой бактерии. При неблагоприятных условиях инфекция активизируется, выделяет токсины, которые нарушают жизнедеятельность клеток, снижают защитные свойства иммунной системы.
К активизации стафилококковой инфекции предрасполагает местное и общее переохлаждение, регулярные стрессовые ситуации, алкогольная интоксикация, курение, хронический недосып, употребление просроченных молочных и кисломолочных продуктов.
Золотистый стафилококк вызывает широкий спектр заболеваний, начиная с аллергических реакций, кожных инфекций до смертельно-опасных состояний: менингита, остеомиелита, пневмонии, эндокардита. Сложность заключается в том, что стафилококк выживает в самых неблагоприятных условиях, устойчив к действию многих антибактериальных препаратов, высокой температуры. Это одна из самых частых бактерий, которой заражаются после посещения медицинских учреждений, операций.
Справка! Свое название золотистый стафилококк получил благодаря внешнему виду: в отличие от большей части бактерий, которые бесцветны под микроскопом, он имеет желтый цвет из-за наличия пигмента каротиноида.
В группу риска заражения золотистым стафилококком входят:
- беременные и кормящие,
- лица преклонного возраста,
- новорожденные,
- сотрудники медицинских учреждений,
- лица с ослабленным иммунитетом,
- пациенты с сахарным диабетом, онкологическими заболеваниями, ВИЧ-инфекциями.
Основные пути передачи — воздушно-капельный, контактный, гемоконтактный (с кровью).
Типы анализов на выявление стафилококка
Попадая в организм бактерия начинает размножаться, что проявляется клиническими симптомами, которые, в зависимости от места колонизации стафилококка, могут быть похожи на другие заболевания. Для того, чтобы свести диагноз к единственной вероятной болезни, в комплексное обследование включают анализ на золотистый стафилококк.
Исследование востребовано в гастроэнтерологии, педиатрии, отоларингологии, гинекологии, урологии, эндокринологии, дерматологии, кардиологии, акушерстве, нефрологии, ревматологии, хирургии. При небольшом содержании бактерии в биологическом материале (до 10³) фармакотерапию не назначают.
Посев мазка из зева и носоглотки
Исследование микрофлоры слизистой оболочки рото- и носоглотки даёт возможность выявить и идентифицировать стафилококковую инфекцию, её количество, определить чувствительность к антибактериальным препаратам.
Анализ проводят при наличии:
- хронического тонзиллита,
- дифтерии,
- скарлатины,
- при подозрении на ревматизм,
- частых ОРВИ.
Бакпосев назначают при жалобах на постоянный насморк и заложенность носа, беспричинную непроходящую боль в горле, субфебрильную температуру.
Сбор биоматериал преимущественно проводят в утреннее время натощак. Перед сдачей анализа нельзя чистить зубы, есть и пить. За 24–36 часов не используют противовирусные или антибактериальные препараты.
Микроскопическое исследование мазка из влагалища
При микроскопическом исследовании отделяемого из урогенитального тракта определяют состояние микрофлоры, наличие воспалительных процессов, бактерий и их количество, антибиотикорезистентность.
Анализ на золотистый стафилококк в гинекологии назначают при плановых гинекологических осмотрах, в период беременности, при подозрении на инфекционные заболевания мочеполовой системы.
Исследование требует специальной подготовки пациента:
- За 2–3 дня прекратить применение вагинальных свечей.
- За 36 часов ограничить половой контакт, спринцевания.
- Накануне анализа разрешается только туалет наружных половых органов.
- Минимум за два часа не рекомендовано мочиться.
Наиболее информативно исследование на 5–7 день после менструального цикла. Во время менструации соскоб не берут.
Биохимический анализ крови на золотистый стафилококк
Кровь берут в утреннее время натощак до 11.00. Чтобы результаты исследования были информативными, необходимо соблюдать несколько правил:
- Не есть 8–10 часов.
- За два дня отказаться от алкоголя.
- Накануне ограничить жирную пищу, чай, кофе, кондитерские изделия.
- Избегать эмоционального, физического переутомления.
- За полчаса до процедуры не курить.
Если вы принимаете какие-либо препараты, об этом необходимо сообщить врачу.
Анализ мочи и кала
Исследование кала на стафилококк наиболее востребовано в педиатрии, гастроэнтерологии и эндокринологии. Анализ показан для подтверждения заболеваний органов пищеварительной системы, оценки функций печени и поджелудочной железы, при различных заболеваниях кожи, частых ОРВИ, аллергии.
Материал для исследования — кал после самостоятельной дефекации, при этом важно, чтобы в него не попала урина. Собирают в стерильный, герметично закрывающийся контейнер, и в течение суток перенаправляют в лабораторию. Собранный биоматериал хранят в холоде при температуре +4–8°С.
Важно! Перед сбором материала за три дня не используют ректальные суппозитории, слабительные средства и другие препараты, которые влияют на работу ЖКТ.
Анализ мочи — универсальное исследование при первичной диагностики инфекций, заболеваний пищеварительной, дыхательной, сердечно-сосудистой системы
Подготовка и сбор мочи:
- За 2 дня отменить прием мочегонных препаратов.
- За день исключить алкоголь, соль, продукты, которые окрашивают мочу.
- За 24 часа избегать физических нагрузок, стресса.
- Мочу собирать утром. После пробуждения тщательно обмыть наружные половые органы без гигиенической косметики, насухо вытереть. Первую порцию слить. Для исследования использовать среднюю порцию мочи
Женщины не производят сбор мочи во время менструального цикла и спустя 1–2 дня. Противопоказан анализ в течение нескольких дней после оперативных вмешательств на мочевом пузыре.
Где сдать анализ на золотистый стафилококк
Читайте также:

