Что за инфекция может быть в голове у новорожденного
Обновлено: 18.04.2024
Острый бактериальный менингит у новорожденного и детей: причины, клиника, диагностика
Каждый год более 1,2 миллиона людей заболевают острым бактериальным менингитом, причем более чем 170 тысяч случаев имеют летальный исход, большинство из которых приходится на детский возраст (ВОЗ, 1998,2008). Несмотря на новые антибиотики и лечение, смертность за последние 20 лет по существу осталась неизменной. Среди выживших, примерно у половины имеются неврологические или другие осложнения после заболевания. Несколько факторов способствует этой неутешительной ситуации: отсроченная постановка диагноза из-за неспецифического характера симптомов, появление устойчивых штаммов болезнетворных микроорганизмов, слабость иммунологической защиты новорожденных детей, и отсутствие возможности предотвратить ущерб от воспалительного ответа хозяина посредством добавочных нейропротекторных или противовоспалительных механизмов.
а) Эпидемиология. Относительная заболеваемость острым бактериальным менингитом изменяется соответственно возрасту, социальным условиям жизни, географическому местоположению и политике иммунизации. В развитых странах за прошлое десятилетие эпидемиология острого бактериального менингита претерпела разительную перемену, и уровень заболеваемости снизился приблизительно до 4-5 случаев на 100000 населения, тогда как во многих развивающихся странах он остается высоким в пределах 40-50 случаев на 100000.
Вакцинация вызвала радикальное изменение в относительной частоте трех основных патогенных микроорганизмов — Haemophilus influenzae, Neisseria meningitidis и Streptococcus pneumoniae. H. influenzae тип В (HiB) был наиболее распространенным возбудителем детского бактериального менингита в Великобритании, с показателями заболеваемости в пределах 21-44 на 100000 среди детей до пяти лет, с пиковым возрастом 6-7 месяцев и коэффициентами смертности 2,4-4,3% (Вооу и Мохon, 1993; Вооу et al., 1993; Anderson et al., 1995; Heath и Me Vernon, 2002). После введения в начале 1990-х во многих странах комбинированной белково-полисахаридной вакцины против HiB, число случаев гемофильного менингита снизилось более чем на 90% (Schuchat et al., 1997), и S. pneumoniae и N. meningitides стали самыми обычными болезнетворными микроорганизмами.
В настоящее время в Европе уровень распространенности пневмококкового менингита составляет примерно 0,5 на 100000 населения; связанная с ним смертность 25%, но может достигать 45% среди очень молодых. Более чем у 30% выживших остаются постоянные неврологические осложнения (Lexau et al., 2005). Эта картина существенно хуже в развивающихся странах. Существует сезонное изменение с пиком в зимние месяцы. Дети младшего возраста наиболее подвержены риску, и 60% случаев приходится на возраст до двух лет. Комбинированная семивалентная белково-полисахаридная пневмококковая вакцина стала доступной в 2000 г. и была включена в британский национальный календарь прививок с 2006 г.
В тех странах, где эта вакцина включена в программу иммунизации, наблюдалось разительное снижение уровня инвазивной пневмококковой болезни, с сохранением N. meningitidis в качестве основного патогенного микроорганизма. Уровень заболеваемости N. meningitidis составляет около 1-3 на 100000 населения в Европе с самими обычными серотипами группы В и С. Вакцинация доступна, но пока еще только для групп А, С, Y и W135. C комбинированной полисахаридно-белковой вакциной против группы С. Она была включена в протокол иммунизации во многих развитых странах после введения в Великобритании в 1999 г. В Северной Америке недавно запущена 4-валентная вакцина для других групп (А, С, Y и W135) (Расе и Pollard, 2007).
Еще одной проблемой эпидемиологии стало появление резистентных к лекарственным средствам штаммов патогенных микроорганизмов, среди которых серьезную опасность представляет резистентный к пенициллину пневмококк (ПРП), встречающийся благодаря мутациям в одном или нескольких пенициллин-связывающих белках. Появление ПРП непосредственно связано распространением антибактериальных средств, и в определенных странах проблема больше, чем в других. В настоящее время в Великобритании менее 3% пневмококков являются ПРП, а в Испании, США и Южной Африке показатели выше. Резистентность пневмококков проверяется лабораторным анализом минимальной концентрации ингибитора (Minimum Inhibitory Concentration, MIC), и может быстро определяться с помощью специальных тестов с ПЦР для определения гена связывающего белка пенициллина 2b (ПРП2b). Устойчивость к пенициллину и хлорамфениколу при менингококковой инфекции также увеличивается, но к счастью, остается редкой.
б) Патофизиология и иммунология. Эффективная инвазия инфекции в ЦНС включает 4 стадии: в первой происходит, адгезия и колонизация патогенных микроорганизмов, часто из комменсалов носоглотки; вторая представляет собой инвазию в слизистую оболочку с последующим размножением и бактериемией; третья состоит в проникновении в подпаутинное пространство с преодолением ГЭБ, с пока еще не установленным механизмом; и наконец, размножение патогенов в подпаутинном пространстве, вызывающее воспалительный ответ хозяина.
• Адгезия и колонизация. Точные механизмы, посредством которых бактерии прикрепляются и проникают в слизистую оболочку, все еще неясны. Вовлекаются многочисленные поверхностные белки микроорганизмов (например, холиновые связывающие белки, сиаловая кислота и нейраминидаза на S. pneumoniae и К1-полисахарид на Е. coli) (Koedel et al„ 2002) и специфические рецепторы хозяина (например, pIgR). В случае менингококка пили прикрепляется к рецепторам CD46 и 66 клеток слизистой оболочки.
• Инвазия и размножение. Поверхностные белки (например, Psp А и С) и капсула пневмококков помогают сопротивляться фагоцитозу и разрушению комплиментом, для того, чтобы преодолеть защиту хозяина и выжить в пределах кровотока.
• Внедрение в ЦНС. Для проникновения патогенов в ЦНС должны быть нарушены ГЭБ и барьер между кровью и спинномозговой жидкостью (СМЖ). В этот процесс вовлечены различные гликоконъюгаты и рецепторы (например, фактор активации тромбоцитов). Было продемонстрировано, что количество бактерий в заражающем материале крови важно для возникновения менингита у экспериментальных животных, и это может также иметь место у людей (Moxon et al., 1974).
• Размножение. В СМЖ, в области ослабленной защиты хозяина, выживание и размножение патогенов наиболее вероятны. Тем не менее, их присутствие стимулирует перемещение лейкоцитов в СМЖ посредством многошагового процесса, включающего в себя различные адгезивные молекулы и лиганды (например, селектины и интегрины) с миграцией по градиенту хемотаксиса. При разрушении болезнетворных микроорганизмов запускается воспалительный каскад, который приводит к вторичному повреждению ткани. Стимуляция происходит через клеточую стенку (например, LPS у грамотрицательных микроорганизмов, таких как N. meningitidis и Н. influenzae и пептидогликаны у грамположительных микроорганизмов, таких как S. pneumoniae) (Tuomanen et al., 1985), прямо от пневмолизина (Friedland et al., 1995), и непосредственно через бактериальную ДНК (Deng et al., 2001). Через несколько часов запускаются провоспалительные цитокины, включая ФНО-α (TNFα) (Bazzoni и Beutler, 1996) и интерлейкины 1β, 6 и 8.
Они ускоряют каскад других цитокинов, хемокинов, протеолитических ферментов и реактивных кислородных радикалов и промежуточных форм азота из макрофагов, нейтрофилов и тромбоцитов. В экспериментах на крысах назначение дексаметазона и антиоксидантов показало частичное уменьшение эффекта (Auer et al, 2000). Гиперемия сосудов и повышение проницаемости кровеносных сосудов приводит к цитотоксическому и вазогенному отеку ткани мозга и увеличенному внутричерепному давлению (ВЧД), что в дальнейшем снижает церебральное перфузионное давление (ЦПД), увеличивая риск вклинения и необратимого повреждения головного мозга. Объем СМЖ увеличивается в течение первых двух или трех дней болезни (Ashwal et al., 1992), и уровни эндотоксинов (Mertsola, 1991) и других цитокинов (Arditi et al., 1989) коррелируют с тяжестью расстройств (Dulkerian et al., 1995). Частым осложнением является васкулит, приводящий к инфаркту в 2-19% случаев. Уровень мозгового кровообращения снижен на 30-70% у 30% пациентов (Ashwal et al., 1992), но авторегуляция кровообращения в основном сохранена (Ashwal et al., 1990).
Отек (цитотоксический, вазогенный и межуточный) встречается часто, как изолированно, так и с острой обструктивной гидроцефалией, обусловленной гнойным экссудатом в полостях, и может вызывать внутричерепную гипертензию и вторичное выбухание мозговой ткани. Это в свою очередь может еще больше препятствовать мозговому кровообращению (Minns et al., 1989), запуская порочный круг. Также происходит повреждение нейронов путем апоптоза, особенно в зубчатой извилине гиппокампа. Это имеет особое значение, поскольку есть доказательства, что это повреждение — причина связанных с менингитом трудностей в обучении (Loeffler et al., 2001). В экспериментах на животных гиппокампальное повреждение существенно уменьшалось в результате блокады активации каспазы-3 или управления специфическими каспаза-3-ингибиторами (Braun et al., 1999). Появление менингеального выпота может привести к хронической гидроцефалии, особенно у детей младшего возраста.
Гидроцефалия также может быть результатом стеноза сильвиева водопровода, который может возникнуть вследствие вентрикулита. Последний чрезвычайно распространен среди новорожденных и был выявлен в 92% патологоанатомических исследований (Berman и Banker, 1966), но также присутствует и у детей старшего возраста в более низкой пропорции (приблизительно 10%).

г) Клинические проявления и диагностика. Важность ранней постановки диагноза очевидна. Тем не менее, поздняя диагностика остается частой, потому что менингит относительно редко распознается в общей практике в сравнении с частыми, главным образом, вирусными, заболеваниями, сопровождающимися лихорадкой. Часто менингиту в течение нескольких дней предшествует лихорадка, поэтому невозможно определить его фактическое начало; в результате 33-40% пациентов до постановки диагноза получали антибиотики (Kaplan et al., 1986). Характер начала заболевания имеет важное прогностическое значение: прогрессирующее начало, сливающееся с предыдущими проявлениями болезни, часто прогнозирует благоприятный исход, в то время как молниеносное начало неблагоприятно (Radetsky, 1992, Kilpi et al., 1993). Лихорадка, тошнота, головная боль, сопровождающаяся рвотой, вялость и некоторое расстройство сознания (чаще умеренное оцепенение, чем кома) указывают на диагноз (Gururaj et al., 1973). Ригидность мышц шеи, а иногда также мышц спины, и симптом Кернига требуют выполнения люмбальной пункции.
На очень ранних стадиях единственными симптомами могут быть раздражительность и перемены настроения в сочетании с лихорадкой. Генерализованные припадки встречаются у 30-40% детей с острым бактериальным менингитом, особенно среди детей младше четырех лет. В одном исследовании 328 детей с первичными припадками на фоне лихорадки и без менингеальных знаков, менингит был диагностирован только у четырех детей по данным люмбальной пункции (1,2%), все они были в возрасте до 18 месяцев (Rutter и Smales, 1977). И хотя люмбальная пункция не должна быть рутинным методом исследования среди детей в возрасте до 18 месяцев, у которых могут отсутствовать менингеальные симптомы при лихорадочных припадках, она обязательна в случаях, когда ребенок не возвращается в абсолютно нормальное состояние вскоре после эпизодов припадков. Аналогично, люмбальная пункция проводится и детям до одного года при наличии малейших сомнений. Менингит у новорожденных может сопровождаться фебрилитетом или гипотермией и проявляться в виде затруднений при кормлении и дыхании. Ригидность мышц шеи и изменения родничка нетипичны. Люмбальная пункция обычно выполняется при любых септических проявлениях у нездоровых новорожденных.
Наличие пятнисто-папуллезной сыпи может служить ранним симптомом менингококкового сепсиса или проявлением вирусного заболевания. Петехии и пурпура говорят в пользу менингококковой инфекции, хотя также периодически встречаются при наличии вторичного сепсиса при гемофильной (тип В), пневмококковой инфекции или при некоторых вирусных заболеваниях (например, ECHO 9). Очаговая неврологическая симптоматика, такая как паралич черепных нервов или гемипарез обычно развивается поздно в ходе течения бактериального менингита, или раньше в качестве осложнения повышенного ВЧД (особенно параличи VI пары черепных нервов). Отек сосочка зрительного нерва редко заметен на ранних этапах; в сущности, наличие отека сосочка зрительного нерва должно вызывать подозрение о наличии очагового внутричерепного процесса, такого как абсцесс мозга или массивное повреждение, и является показанием к нейровизуализации до проведения люмбальной пункции.
При всех возможных рисках люмбальной пункции при менингитах на фоне повышенного ВЧД (Klein et al., 1986), отказ от выполнения пункции на раннем этапе заболевания значительно осложнит уход за больным ребенком. Диагноз на основе СМЖ, как было показано, изменил тактику ведения в 72% случаев с отсрочкой люмбальной пункции до тех пор, пока назначение антибиотиков повышало уровень стерильной СМЖ с 3% до 44%. Вероятность отека мозговой ткани, с предполагаемым риском смерти оценивается на уровне 4,3% (Rennick et al., 1993) и 6% (Wright et al., 1993; Lambert,1994). Люмбальная пункция, как предполагается, вызывает опущение мозгового конуса спинного мозга, хотя данных для определения явления как причины или следствия нет, а отеки мозговой ткани могут возникать и спонтанно.
Применение КТ для обнаружения отека или повышенного ВЧД чрезвычайно ограничено (Pike et al., 1990, Heyderman et al., 1992), и не способно предсказать риск опущения конуса. Данные полученные при компьютерной томографии заставили изменить тактику ведения пациентов в 5% случаев, при этом спинальная пункция откладывалась в среднем на 2,5 часа (Gopal et al., 1999). Кроме того, нормальные данные КТ не означают безопасное выполнение пункции, и в 36% случаев опущения, КТ было в пределах нормального. Используя строгий отбор пациентов, количество проведенных КТ можно значительно уменьшить (Hasbun et al., 2001). Mellor (1992) советовал откладывать спинномозговую пункцию по крайней мере на 30 минут после припадков, так как известно, что они вызывают транзиторное повышение ВЧД, и назначение маннитола перед проведением люмбальной пункции показано в сомнительных случаях, что обеспечивало эффективное снижение уровня ВЧД и повышение ЦПД и скорости кровотока (Goh и Minns, 1993). Другим противопоказанием к проведению спинальной пункции является необходимость срочного лечения шока (Lambert, 1994).
Это касаетс, прежде всего, менингококковой инфекции, диагностируемой по культуре крови. Таким образом, целесообразно отложить спинномозговую пункцию в случаях тяжелого угнетения сознания, когда ребенок находится в состоянии шока и когда имеется расширение зрачков, офтальмопарез или отек диска зрительного нерва.

е) Лабораторная диагностика:
Количество клеток в СМЖ при бактериальном менингите обычно колеблется между 1000 и 10000/мм 3 , и первоначально преобладают полиморфноядерные лейкоциты, но уровень более пяти одноядерных клеток считается ненормальным, а в 10% случаев отмечается преобладание лимфоцитов на ранних этапах. В норме нейтрофилы отсутствуют, но в цитоцентрифугированных образцах может быть обнаружен случайный единичный нейтрофил. После пункции возможно соотношение нейтрофилов и эритроцитов равное 1:700, если в периферической крови количество клеток красной крови и белых кровяных телец в пределах нормы.
Микроорганизмы можно обнаружить в мазках как внутриклеточно, так и внеклеточно. Окраска по Граму положительная в 25% случаев, в зависимости от концентрации патогенов в СМЖ (Onorato et al., 1980). Использование акридинового оранжевого, флюорохрома, окрашивающего нуклеиновые кислоты некоторых является исключение других возможно поддающихся лечению причин. Тщательные клинические, неврологические и лабораторные методы обследования определяются для каждого конкретного случая.

2. Другие лабораторные процедуры. Культура крови положительна в 80-90% случаев нелеченного менингита. Иногда культура крови может быть положительна, в то время как культура СМЖ отрицательная и, таким образом, информативна для терапии. Посевы из носа и зева не являются специфичными и чувствительными. Культура мочи и мазки из поражений кожи, окрашенные по Граму, дают возможность непосредственной идентификации патогенов.
Бактериологическое исследование жидкости из среднего уха, полученной при аспирации, в случаях сопутствующего среднего отита может выявить тот же микроорганизм, что и в ликворе, но это явление непостоянно, и даже при выявлении бактерии в обеих жидкостях нередко возможны разные штаммы.
Проводится подсчет форменных элементов крови с анализом воспалительного ответа. Обычно имеет место подъем лейкоцитов и повышенный уровень С-реактивного белка (Hansson et al., 1993).
3. Нейровизуализация. Визуализация на ранних этапах может быть нормальной, или показывать менингеальное повышение с контрастом, но его главным образом применяют для исключения другой патологии ЦНС и для диагностики осложнений (Klein et al., 1986) (см. ниже). Riordan et al., (1993) перечисляют следующие показания к КТ: длительное угнетение сознания, длительные частичные или поздние припадки, очаговые неврологические отклонения, увеличение окружности головы, подтверждение продолжающейся инфекции, и рецидивирующие симптомы и признаки. МРТ имеет дополнительные преимущества повышенной чувствительности, но не всегда доступно.
Врожденные инфекции у плода и новорожденного ребенка: виды, возбудители, клиника, диагностика
Передача врождённых и перинатальных инфекций плоду происходит через плаценту (внутриутробные инфекции), во время родов или при контакте с физиологическими жидкостями матери. Длительное разрушение плодных оболочек также способствует развитию внутриутробных заболеваний. Кроме того, заражение может произойти и после рождения (при контакте с матерью и другими людьми).
Врожденная краснуха
Первый признак врождённой краснухи — желтуха, как следствие развития гепатита. Часто возникает гемолиз и тромбоцитопеническая пурпура, а также слабовыраженные клинические проявления менингоэнцефалита. У некоторых новорождённых обнаруживают признаки метафизарной дисплазии. Инфицированные дети при рождении обычно имеют сниженную массу тела и отстают в физическом развитии.
В тяжёлых случаях болезнь обычно заканчивается летальным исходом. Наиболее грозные осложнения — незаращение артериального протока, катаракта, глухота, ретинопатия.
Тест на антитела к краснухе (IgM), которые можно обнаружить в крови детей до 3-го мес жизни, даёт положительный результат. При заболевании матери в I триместре вероятность развития патологии у ребёнка составляет 60%, поэтому некоторые женщины предпочитают прерывать беременность. В дальнейшем риск заметно снижается (2% после 20-й нед), в связи с чем выбор между рождением ребенка с вероятными нарушениями в развитии и прерыванием беременности необходимо делать крайне осторожно.
Цитомегаловирус у плода и новорожденного
Инфекция проявляется примерно в 1% случаев, при этом тяжёлая форма заболевания развивается только у 1% инфицированных. Наиболее высокий риск заражения плода отмечают на сроке гестации, соответствующем I триместру беременности. Симптомы заболевания у новорождённых — сниженная масса тела, гепатомегалия, спленомегалия, тромбоцитопения, продолжительная желтуха, повышенная возбудимость, судорожный синдром, аномальный мышечный тонус и двигательные расстройства.
Наиболее частые осложнения — микроцефалия, нейросенсорная глухота. Нередко обнаруживают кальцификацию головного мозга, гемиплегию (паралич мышц одной стороны тела), замедление психомоторных реакций, хориоретинит и миопатию. Диагностика основана на обнаружении антител к цитомегаловирусу (IgM) или определении экскреции вируса в течение первых двадцати дней жизни.
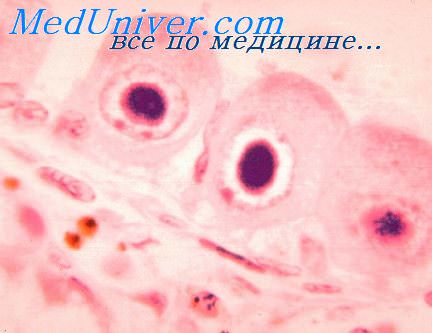
Возбудитель ЦМВ инфекции
Врожденная инфекция вируса простого герпеса
Первичная инфекция, вызванная вирусом простого герпеса, сопровождается виремией. При этом может произойти трансплацентарное заражение плода. При врождённом инфицировании дети рождаются с тяжёлыми отклонениями (пневмония, менингоэнцефалит, гепатоспленомегалия, цитопения), но лишь у некоторых из них присутствуют герпетические очаги на коже и слизистых оболочках. Лечение ацикловиром позволяет снизить смертность с 80—90% до 10—15%.
Терапию следует начинать до получения результатов лабораторного анализа. Первичная инфекция также возникает при заражении от матери, страдающей генитальным герпесом. При этом в первые дни жизни ребёнка возникают очаги на коже, конъюнктиве, слизистой оболочке рта и половых органов, а в 50% случаев наблюдают генерализованное течение инфекции. Лечение: внутривенное введение ацикловира.
Ветряная оспа плода
Инфицирование плода ветряной оспой возникает при заражении беременной в I—II триместре беременности, при этом вероятность передачи инфекции плоду составляет 3%. Заболевание характеризуется развитием рубцовой контрактуры в области лимбических структур головного мозга, микроцефалии или офтальмомикрии. Непривитые беременные в течение десяти дней после возможного заражения (контакта) должны пройти профилактический курс введения иммуноглобулина (содержащим антитела к вирусу ветряной оспы).
Ветряная оспа новорождённых возникает при заболевании матери в течение одной недели до родов. Смертность составляет 40%, поэтому в первые 48 ч жизни ребёнку необходимо ввести специфический иммуноглобулин. При ухудшении состояния следует незамедлительно начать лечение ацикловиром. Применение нормального иммуноглобулина человека не защищает новорождённого от заражения. В некоторых странах применяется вакцина.
Врожденный листериоз
Трансплацентарная передача Listeria monocytogenes происходит при заражении матери инфекцией, протекающей бессимптомно. Заболевание матери на ранних стадиях беременности обычно приводит к смерти плода, а на более поздних — к преждевременным родам. Инфекцию новорождённых обычно осложняет бактериемия, гепатоспленомегалия, менингоэнцефалит, тромбоцитопения и пневмония. При интранатальном заражении инфекция развивается в течение первых двух недель жизни ребенка и сопровождается менингитом и бактериемией.
Для выделения возбудителя на анализ отбирают кровь, спинномозговую жидкость, плацентарную ткань и послеродовую жидкость из матки. Инфицированную мать и ребёнка помещают в отдельную палату, так как они могут стать причиной вспышки заболевания в родильном отделении. Препарат выбора — ампициллин (иногда в комплексе с гентамицином); длительность лечения 2—6 нед.
Врожденный сифилис
Благодаря эффективным пренатальным исследованиям случаи врождённого сифилиса в настоящее время достаточно редки. У заражённых детей обнаруживают лихорадку, а также симптомы, свойственные вторичному сифилису, сыпь, кондиломы и трещины на слизистых оболочках. При развитии остеохондритов возникает выраженный болевой синдром. Очень часто отмечают постоянный насморк (сопение, гнусавость).
Для подтверждения диагноза применяют темнопольную микроскопию образцов поражённой кожи и слизистых оболочек. Специфические IgM или другие антитела персистируют в организме свыше 6 мес после перенесённой инфекции. Поздние симптомы (глухота, атрофия зрительного нерва, паретический нейросифилис) наблюдают в возрасте 12—20 лет. Нередко возникают бугристые образования на лобных костях, хронический большеберцовый периостит, перфорация передних зубов, деформация первых постоянных коренных зубов и высокий изгиб нёба. Препарат выбора — пенициллин.
Врожденный токсоплазмоз
Вероятность врождённого токсоплазмоза варьирует в разных регионах. Например, в Великобритании его регистрируют достаточно редко, а во Франции — часто. При заражении беременной трансплацентарную передачу инфекции плоду наблюдают в каждом третьем случае. Наиболее высок риск развития патологии плода (мертворождение, смерть после рождения, кальцификация головного мозга, церебральный паралич и эпилепсия) при заражении женщины в I и II триместре беременности.
Хориоретинит может возникать только спустя некоторое время после рождения и быть единственным симптомом болезни. Токсоплазмоз у матери подтверждают при обнаружении специфических антител (IgM) или сероконверсии. IgM также обнаруживают у инфицированных новорождённых. Применение спирамицина позволяет снизить риск трансплацентарного заражения, но не влияет на исход заболевания у новорождённых.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Инфекции, повреждения головного мозга у недоношенных новорожденных. Особенности
У недоношенных младенцев имеется более высокий риск инфекционных осложнений, поскольку IgG в основном переносится через плаценту в последнем триместре, a IgA и IgM вообще не переносятся. Кроме того, инфекция внутри или вокруг шейки матки часто является причиной преждевременных родов и может вызвать инфицирование сразу после рождения.
Большинство инфекционных осложнений у недоношенных младенцев развиваются через несколько дней после рождения и являются нозокомиальными (внутрибольничными); они часто связаны с установленными катетерами или ИВЛ.
Инфекции у недоношенных младенцев являются основной причиной смерти и способствуют развитию бронхопульмональной (бронхолёгочной) дисплазии (БПД) — хронического заболевания лёгких, повреждению белого вещества головного мозга и последующей инвалидности.

Повреждения головного мозга у недоношенных
Кровоизлияния в головной мозг происходят в 25% случаев у младенцев с ОНВР и легко распознаются при ультразвуковом сканировании черепа. В типичных случаях они происходят в зародышевом матриксе выше хвостатого ядра, которое содержит тонкую сеть кровеносных сосудов. Большинство кровоизлияний происходит в первые 72 ч жизни.
Они наиболее типичны вследствие перинатальной асфиксии и у младенцев с тяжёлым РДС. Пневмоторакс является значительным фактором риска. Небольшие кровоизлияния, ограниченные зародышевым матриксом, не увеличивают риск церебрального паралича. Кровоизлияние может происходить в желудочках; обширные внутрижелудочковые кровоизлияния обусловливают 25-30% риск церебрального паралича.
Наиболее тяжёлым кровоизлиянием является односторонний геморрагический инфаркт с вовлечением паренхимы мозга; это часто приводит к гемиплегии.
Обширное внутрижелудочковое кровоизлияние может привести к нарушению оттока и реабсорбции спинномозговой жидкости (СМЖ), приводя к тому, что СМЖ накапливается под давлением. Эта дилатация может разрешаться спонтанно или прогрессировать до гидроцефалии, которая может вызывать расхождение швов, быстрое увеличение окружности головы и напряжённость переднего родничка.
Иногда требуется вентрикулоперитонеальное шунтирование, однако первоначальное облегчение симптомов можно обеспечить удалением СМЖ с помощью люмбарной или желудочковой пункции. Около половины младенцев с прогрессирующей постгеморрагической дилатацией желудочков страдают церебральным параличом, также имеется более высокий процент паренхиматозных инфарктов.
При наличии двусторонних множественных кист, так называемой ПВЛ, существует 80-90% риск спастической диплегии при заднем расположении. Внутрижелудочковое кровоизлияние и ПВЛ могут происходить при отсутствии патологических клинических проявлений.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Внутриутробные инфекции – группа заболеваний плода и новорожденного, развивающихся вследствие заражения в дородовом периоде или в родах. Внутриутробные инфекции могут приводить к гибели плода, самопроизвольному аборту, задержке внутриутробного развития, преждевременным родам, формированию врожденных пороков, поражению внутренних органов и ЦНС. Методы диагностики внутриутробных инфекций включают микроскопические, культуральные, иммуноферментные, молекулярно-биологические исследования. Лечение внутриутробных инфекций проводится с использованием иммуноглобулинов, иммуномодуляторов, противовирусных, антибактериальных препаратов.

Общие сведения
Внутриутробные инфекции – патологические процессы и заболевания, обусловленные антенатальным и интранатальным инфицированием плода. Истинная распространенность внутриутробных инфекций не установлена, однако, согласно обобщенным данным, с врожденными инфекциями рождается не менее 10% новорожденных. Актуальность проблемы внутриутробных инфекций в педиатрии обусловлена высокими репродуктивными потерями, ранней неонатальной заболеваемостью, приводящей к инвалидизации и постнатальной гибели детей. Вопросы профилактики внутриутробных инфекций лежат в плоскости рассмотрения акушерства и гинекологии, неонатологии, педиатрии.

Причины внутриутробных инфекций
Внутриутробные инфекции развиваются в результате инфицирования плода в дородовом периоде или непосредственно во время родов. Обычно источником внутриутробной инфекции для ребенка выступает мать, т. е. имеет место вертикальный механизм передачи, который в антенатальном периоде реализуется трансплацентарным или восходящим (через инфицированные околоплодные воды) путями, а в интранатальном - аспирационным или контактным путями.
Реже происходит ятрогенное инфицирование плода в период беременности при проведении женщине инвазивной пренатальной диагностики (амниоцентеза, кордоцентеза, биопсии ворсин хориона), введении плоду препаратов крови через сосуды пуповины (плазмы, эритроцитарной массы, иммуноглобулинов) и т. д.
В антенатальном периоде инфицирование плода обычно связано с вирусными агентами (вирусами краснухи, герпеса, цитомегалии, гепатита В и С, Коксаки, ВИЧ) и внутриклеточными возбудителями (токсоплазмоза, микоплазмоза).
В интранатальном периоде чаще происходит микробная контаминация, характер и степень которой зависит от микробного пейзажа родовых путей матери. Среди бактериальных агентов наиболее распространены энтеробактерии, стрептококки группы В, гонококки, синегнойная палочки, протей, клебсиелла и др. Плацентарный барьер непроницаем для большинства бактерий и простейших, однако при повреждении плаценты и развитии фетоплацентарной недостаточности, может произойти антенатальное микробное инфицирование (например, возбудителем сифилиса). Кроме этого, не исключается и интранатальное вирусное заражение.
Факторами возникновения внутриутробных инфекций служат отягощенный акушерско-гинекологический анамнез матери (неспецифические кольпиты, эндоцервициты, ЗППП, сальпингофориты), неблагополучное течение беременности (угроза прерывания, гестозы, преждевременная отслойка плаценты) и инфекционная заболеваемость беременной. Риск развития манифестной формы внутриутробной инфекции существенно выше у недоношенных детей и в том случае, когда женщина инфицируется первично во время беременности.
Известно, что тяжесть проявлений инфекционного процесса у беременной и у плода может не совпадать. Бессимптомное или малосимптомное течение инфекции и у матери может вызвать тяжелые поражения плода, вплоть до его гибели. Это связано с повышенным тропизмом вирусных и микробных возбудителей к эмбриональным тканям, преимущественно ЦНС, сердца, органа зрения.
Классификация
Этиологическая структура внутриутробных инфекций предполагает их деление на:
- вирусные (вирусный гепатит, герпес, краснуха, ОРВИ, цитомегалия, эпидемический паротит, энтеровирусная инфекция)
- бактериальные (туберкулез, сифилис, листериоз, сепсис)
- паразитарные и грибковые (микоплазмоз, токсоплазмоз, хламидиоз, кандидоз и др.)
Для обозначения группы наиболее распространенных внутриутробных инфекций используется аббревиатура TORCH-синдром, объединяющий токсоплазмоз (toxoplasmosis), краснуху (rubella), цитомегалию (cytomegalovirus), герпес (herpes simplex). Буквой О (other) обозначаются другие инфекции, в числе которых - вирусные гепатиты, ВИЧ-инфекция, ветряная оспа, листериоз, микоплазмоз, сифилис, хламидиоз и др.).
Симптомы внутриутробных инфекций
Наличие внутриутробной инфекции у новорожденного может быть заподозрено уже во время родов. В пользу внутриутробного инфицирования может свидетельствовать излитие мутных околоплодных вод, загрязненных меконием и имеющих неприятный запах, состояние плаценты (полнокровие, микротробозы, микронекрозы). Дети с внутриутробной инфекцией часто рождаются в состоянии асфиксии, с пренатальной гипотрофией, увеличенной печенью, пороками развития или стигмами дисэмбриогенеза, микроцефалией, гидроцефалией. С первых дней жизни у них отмечается желтуха, элементы пиодермии, розеолезных или везикулезных высыпаний на коже, лихорадка, судорожный синдром, респиратрные и кардиоваскулярные расстройства.
Ранний неонатальный период при внутриутробных инфекциях нередко отягощается интерстициальной пневмонией, омфалитом, миокардитом или кардитом, анемией, кератоконъюнктивитом, хориоретинитом, геморрагическим синдромом и др. При инструментальном обследовании у новорожденных могут обнаруживаться врожденная катаракта, глаукома, врожденные пороки сердца, кисты и кальцификаты мозга.
В перинатальном периоде у ребенка отмечаются частые и обильные срыгивания, мышечная гипотония, синдром угнетения ЦНС, серый цвет кожных покровов. В поздние сроки при длительном инкубационном периоде внутриутробной инфекции возможно развитие поздних менингитов, энцефалитов, остеомиелита.
Рассмотрим проявления основных внутриутробных инфекций, составляющих TORCH-синдром.
Врождённый токсоплазмоз
Внутриутробное инфицирование одноклеточным протозойным паразитом Toxoplasma Gondii приводит к тяжелым поражениям плода – задержке развития, врожденным порокам развития мозга, глаз, сердца, скелета.
После рождения в остром периоде внутриутробная инфекция проявляется лихорадкой, желтухой, отечным синдромом, экзантемой, геморрагиями, диареей, судорогами, гепатоспленомегалией, миокардитом, нефритом, пневмонией. При подостром течении доминирую признаки менингита или энцефалита. При хронической персистенции развивается гидроцефалия с микроцефалией, иридоциклит, косоглазие, атрофия зрительных нервов. Иногда встречаются моносимптомные и латентные формы внутриутробной инфекции.
К числу поздних осложнений врожденного токсоплазмоза относятся олигофрения, эпилепсия, слепота.
Врождённая краснуха
Внутриутробная инфекция возникает из-за заболевания краснухой при беременности. Вероятность и последствия инфицирования плода зависят от гестационного срока: в первые 8 недель риск достигает 80%; последствиями внутриутробной инфекции могут служить самопроизвольное прерывание беременности, эмбрио- и фетопатии. Во II триместре риск внутриутробного инфицирования составляет 10-20%, в III – 3-8%.
Дети с внутриутробной инфекцией обычно рождаются недоношенными или с низкой массой тела. Для периода новорожденности характерна геморрагическая сыпь, длительная желтуха.
Классические проявления врожденной краснухи представлены триадой Грега: поражением глаз (микрофтальмией, катарактой, глаукомой, хориоретинитом), ВПС (открытым артериальным протоком, ДМПП, ДМЖП, стенозом легочной артерии), поражением слухового нерва (сенсоневральной глухотой). В случае развития внутриутробной инфекции во второй половине беременности у ребенка обычно имеется ретинопатия и глухота.
Кроме основных проявлений врожденной краснухи, у ребенка могут выявляться и другие аномалии: микроцефалия, гидроцефалия, расщелины нёба, гепатит, гепатоспленомегалия, пороки развития мочеполовой системы и скелета. В дальнейшем внутриутробная инфекция напоминает о себе отставанием ребенка в физическом развитии, ЗПР или умственной отсталостью.
Врождённая цитомегалия
Внутриутробное заражение цитомегаловирусной инфекцией может приводить к локальному или генерализованному поражению многих органов, иммунодефициту, гнойно-септическим осложнениям. Врожденные дефекты развития обычно включают микроцефалию, микрогирию, микрофтальмию, ретинопатию, катаракту, ВПС и др. Неонатальный период врожденной цитомегалии осложняется желтухой, геморрагическим синдромом, двусторонней пневмонией, интерстициальным нефритом, анемией.
К отдаленным последствиям внутриутробной инфекции относятся слепота, нейросенсорная глухота, энцефалопатия, цирроз печени, пневмосклероз.
Врождённая герпетическая инфекция
Внутриутробная герпес-инфекция может протекать в генерализованной (50%), неврологической (20%), слизисто-кожной форме (20%).
Генерализованная внутриутробная врожденная герпетическая инфекция протекает с выраженным токсикозом, респираторным дистресс-синдромом, гепатомегалией, желтухой, пневмонией, тромбоцитопенией, геморрагическим синдромом. Неврологическая форма врожденного герпеса клинически проявляется энцефалитом и менингоэнцефалитом. Внутриутробная герпес-инфекция с развитием кожного синдрома сопровождается появлением везикулярной сыпи на кожных покровах и слизистых оболочках, в т. ч. внутренних органов. При наслоении бактериальной инфекции развивается сепсис новорожденных.
Внутриутробная герпес-инфекция у ребенка может приводить к формированию пороков развития - микроцефалии, ретинопатии, гипоплазии конечностей (кортикальной карликовости). В числе поздних осложнений врожденного герпеса - энцефалопатия, глухота, слепота, задержка психомоторного развития.
Диагностика
В настоящее время актуальной задачей является пренатальная диагностика внутриутробных инфекций. С этой целью на ранних сроках беременности проводится микроскопия мазка, бактериологический посев из влагалища на флору, ПЦР-исследование соскоба, обследование на TORCH-комплекс. Беременным из группы высокого риска по развитию внутриутробной инфекции показана инвазивная пренатальная диагностика (аспирация ворсин хориона, амниоцентез с исследованием амниотической жидкости, кордоцентез с исследованием пуповинной крови).
Возможно выявление эхографических маркеров внутриутробных инфекций с помощью акушерского УЗИ. К косвенным эхографическим признакам внутриутробного инфицирования относятся маловодие или многоводие; наличие гиперэхогенной взвеси в околоплодных водах или амниотических тяжей; гипоплазия ворсин хориона, плацентит; преждевременное старение плаценты; отечный синдром плода (асцит, перикардит, плеврит), гепатоспленомегалия, кальцификаты и пороки развития внутренних органов и др. В процессе допплерографического исследования кровотока выявляются нарушения плодово-плацентарного кровотока. Кардиотокография обнаруживает признаки гипоксии плода.
После рождения ребенка с целью достоверной верификации этиологии внутриутробной инфекции используются микробиологические (вирусологические, бактериологические), молекулярно-биологические (ДНК-гибридизация, ПЦР), серологические (ИФА) методики обследования. Важное диагностическое значение имеет гистологическое исследование плаценты.
По показаниям новорожденные с внутриутробными инфекциями в первые сутки жизни должны быть осмотрены детским неврологом, детским кардиологом, детским офтальмологом и др. специалистами. Целесообразно провести ЭхоКГ, нейросонографию, офтальмоскопию, исследование слуха методом вызванной отоакустической эмиссии.
Лечение внутриутробных инфекций
Общие принципы лечения внутриутробных инфекций предполагают проведение иммунотерапии, противовирусной, антибактериальной и посиндромной терапии.
Иммунотерапия включает применение поливалентных и специфических иммуноглобулинов, иммуномодуляторов (интерферонов). Противовирусная терапия направленного действия осуществляется, главным образом, ацикловиром. Для противомикробной терапии бактериальных внутриутробных инфекций используются антибиотики широкого спектра действия (цефалоспорины, аминогликозиды, карбапенемы), при микоплазменной и хламидийной инфекциях – макролиды.
Посиндромная терапия внутриутробных инфекций направлена на купирование отдельных проявлений перинатального поражения ЦНС, геморрагического синдрома, гепатита, миокардита, пневмонии и т. д.
Прогноз и профилактика
При генерализованных формах внутриутробных инфекций летальность в неонатальном периоде достигает 80%. При локальных формах возникают серьезные поражения внутренних органов (кардиомиопатии, ХОБЛ, интерстициальный нефрит, хронический гепатит, цирроз и т. д.). Практически во всех случаях внутриутробные инфекции приводят к поражению ЦНС.
Профилактика внутриутробных инфекций заключается в проведении предгравидарной подготовки, лечении ЗППП до наступления беременности, исключении контактов беременной с инфекционными больными, коррекции программы ведения беременности у женщин групп риска. Женщины, ранее не болевшие краснухой и не получавшие прививки против краснухи, должны быть вакцинированы не позднее, чем за 3 месяца до предполагаемой беременности. В ряде случаев внутриутробные инфекции могут являться основанием для искусственного прерывания беременности.
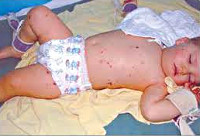
Менингит у детей – инфекционно-воспалительный процесс, затрагивающий мозговые оболочки. Течение менингита у детей сопровождается общеинфекционным (гипертермией), общемозговым (головной болью, рвотой, судорогами, нарушением сознания) и менингеальным синдромом (ригидностью затылочных мышц, общей гиперестезией, менингеальной позой, положительными симптомами Кернига, Лессажа, Брудзинского, выбуханием большого родничка). Диагностика менингита у детей требует проведения люмбальной пункции, исследования ликвора и крови. Основными принципами лечения менингита у детей являются: госпитализация ребенка, постельный режим, проведение антибактериальной/противовирусной, дезинтоксикационной, дегидратационной терапии.
Общие сведения
Менингит у детей – нейроинфекция, вызывающая преимущественное поражение мягкой мозговой оболочки головного и спинного мозга; протекающая с развитием общеинфекционных, общемозговых, менингеальных симптомов и воспалительных изменений в цереброспинальной жидкости. В структуре педиатрии и детской инфекционной патологии менингитам уделяется повышенное внимание, что объясняется частым органическим поражением ЦНС, высокой летальностью от данной патологии, тяжелыми медико-социальными последствиями. Уровень заболеваемости менингитом среди детей до 14 лет составляет 10 случаев на 100 тысяч населения; при этом около 80% заболевших составляют дети до 5 лет. Риск летальности при менингите зависит от возраста детей: чем младше ребенок, тем выше вероятность трагического исхода.

Причины менингита у детей
Менингиты у детей могут вызываться самыми различными возбудителями: бактериями, вирусами, грибами, простейшими. Наиболее многочисленная группа возбудителей менингита у детей представлена бактериями: менингококком, пневмококком, гемофильной палочкой серогруппы b, стафилококком, энтеробактериями, микобактериями туберкулеза. Вирусные менингиты у детей чаще всего ассоциированы с вирусами ECHO, Коксаки, эпидемического паротита, ветряной оспы, кори, краснухи, полиомиелита, клещевого энцефалита, Эбштейна-Барр, герпеса, энтеровирусами, аденовирусами и др. Менингиты у детей, вызываемые грибами, риккетсиями, спирохетами, токсоплазмой, малярийным плазмодием, гельминтами и другими патогенами, относятся к числу редко встречаемых форм.
Потенциальным источником инфекции служит больной человек или бактерионоситель; инфицирование может происходить воздушно-капельным, контактно-бытовым, алиментарным, водным, трансмиссивным, вертикальным, гематогенным, лимфогенным, периневральным путями.
Развитию менингита у новорожденных детей способствует неблагоприятное течение беременности и родов, гипоксия плода, недоношенность, внутриутробные инфекции. У детей раннего возраста факторами риска развития менингита служат гнойные заболевания различной локализации (отиты, мастоидиты, синуситы, фарингиты, тонзиллиты, гастроэнтероколиты, фурункулы лица и шеи, остеомиелит, эндокардит), ОРВИ, инфекционные заболевания детского возраста, кишечные инфекции, черепно-мозговые травмы. Предрасположенность к менингиту детей первых лет жизни объясняется незрелостью иммунной системы и повышенной проницаемостью гематоэнцефалического барьера. Фоном для развития патологического процесса в оболочках мозга могут служить гипотрофия, дефекты ухода за ребенком, переохлаждение, смена климатических условий, стресс, чрезмерные физические нагрузки.
Для вспышек менингита у детей характерна сезонность (пик заболеваемости приходится на зимне-весенний период) и цикличность (подъем заболеваемости отмечается каждые 10-15 лет).
Патогенез менингита у детей
При первичных менингитах у детей входными воротами для инфекции чаще всего служат слизистые оболочки респираторного или желудочно-кишечного тракта. Проникновение возбудителя в полость черепа и мозговые оболочки происходит гематогенным, сегментарно-васкулярным или контактным путями. Выраженная токсемия и нарастание уровня биологически активных веществ создают условия для повышения проницаемости сосудистых мембран, гематоэнцефалического барьера, проникновения микроорганизмов и их токсинов в ЦНС с развитием серозного, серозно-гнойного или гнойного воспаления мозговых оболочек.
Скопление воспалительного экссудата вызывает раздражение сосудистых сплетений желудочков головного мозга, что сопровождается увеличением продукции цереброспинальной жидкости и увеличением внутричерепного давления. Именно с развитием гипертензионно-гидроцефального синдрома связаны основные клинические проявления менингита у детей. Следствием расширения ликворных пространств и сдавления тканей мозга служит ухудшение перфузии, развитие гипоксии, выход жидкости из сосудистого русла и возникновение отека головного мозга.
При правильном лечении менингита у детей в фазу обратного развития происходит резорбция воспалительного экссудата, нормализация ликворопродукции и внутричерепного давления. В случае нерационального лечения менингита у детей может произойти организация гнойного экссудата и формирование фиброза, следствием чего будет являться нарушение ликвородинамики с развитием гидроцефалии.
Классификация
Первичные менингиты у детей возникают без предшествующего локального воспалительного процесса или инфекции; вторичные менингиты у детей развиваются на фоне основного заболевания и выступают его осложнением.
С учетом глубины поражения в структуре менингитов у детей различают: панменингит – воспаление всех мозговых оболочек; пахименингит – преимущественное воспаление твердой мозговой оболочки; лептоменингит – сочетанное воспаление паутинной и мягкой мозговых оболочек. Отдельно выделяют арахноидит - изолированное поражение паутинной оболочки, имеющее свои клинические особенности.
По выраженности интоксикационного и общемозгового синдрома, а также воспалительных изменений в спинно-мозговой жидкости, различают легкую, среднюю и тяжелую форму менингита у детей. Течение нейроинфекции может быть молниеносным, острым, подострым и хроническим.
В этиологическом отношении, в соответствии с принадлежностью возбудителей, менингиты у детей делятся на вирусные, бактериальные, грибковые, риккетсиозные, спирохетозные, гельминтные, протозойные и смешанные. В зависимости от характера ликвора, менингиты у детей могут быть серозными, геморрагическими и гнойными. В структуре патологии в педиатрии преобладают серозные вирусные и бактериальные (менингококковый, гемофильный, пневмококковый) менингиты у детей.
Симптомы менингита у детей
Независимо от этиологической принадлежности, течение менингита у детей сопровождается общеинфекционными, общемозговыми, менингеальными симптомами, а также типичными воспалительными изменениями ликвора.
Общеинфекционная симптоматика при менингите у детей характеризуется резким повышением температуры, ознобами, тахипноэ и тахикардией, отказом ребенка от еды и питья. Может отмечаться бледность или гиперемия кожных покровов, геморрагическая сыпь на коже, связанная с бактериальной эмболией или токсическим парезом мелких сосудов. Отдельные неспецифические симптомы встречаются при определенных формах менингита у детей: острая надпочечниковая недостаточность - при менингококковой, дыхательная недостаточность - при пневмококковой, тяжелая диарея - при энтеровирусной инфекции.
Для общемозгового синдрома, сопровождающего течение менингита у детей, типичны интенсивные головные боли, связанные как с токсическим, так и механическим раздражением мозговых оболочек. Головная боль может быть диффузной, распирающей или локализованной в лобно-височной или затылочной области. Вследствие рефлекторного или прямого раздражения рецепторов рвотного центра в продолговатом мозге возникает повторная, не связанная с приемом пищи и не приносящая облегчения рвота. Нарушение сознания при менингите у детей может выражаться в сомнолентности, психомоторном возбуждении, развитии сопорозного состояния или комы. Нередко при менингите у детей возникают судороги, выраженность которых может варьировать от подергиваний отдельных мышц до генерализованного эпиприступа. Возможно развитие очаговой симптоматики в виде глазодвигательных расстройств, гемипареза, гиперкинезов.
К течению гнойного менингита у детей могут присоединяться другие инфекционно-септические осложнения - пневмония, артриты, эндокардит, перикардит, эпиглоттит, остеомиелит, сепсис. Поздними осложнениями со стороны нервной системы могут стать нарушения интеллекта, гипертензионно-гидроцефальный синдром, эпилепсия, параличи и парезы, гипоталамический синдром, поражение черепных нервов (косоглазие, птоз верхнего века, тугоухость, асимметрия лица и др.).
Диагностика менингита у детей
В процессе распознавания менингита у детей для педиатра и детского инфекциониста важен учет эпиданамнеза, клинических данных, менингеальных симптомов. Для правильной оценки объективного статуса ребенка необходимы консультации детского невролога, детского офтальмолога с осмотром глазного дна (офтальмоскопией); при необходимости – детского отоларинголога и нейрохирурга.
Подозрение на менингит у детей является показанием к проведению люмбальной пункции и получению ликвора для биохимического, бактериологического/вирусологического и цитологического исследования. Результаты исследования цереброспинальной жидкости позволяют дифференцировать менингизм и менингит, определить этиологию серозного или гнойного менингита у детей.
С помощью серологических методов (РНГА, РИФ, РСК, ИФА) выявляется наличие и нарастание специфических антител в сыворотке крови. Перспективно ПЦР-исследование спинномозговой жидкости и крови на наличие ДНК возбудителя. В рамках диагностического поиска проводятся бактериологические посевы крови и отделяемого носоглотки на селективные питательные среды.
По назначению консультантов может рекомендоваться расширенное обследование с выполнением нейросонографии через родничок, рентгенографии черепа, ЭЭГ, МРТ головного мозга ребенку.
Дифференциальную диагностику менингита у детей необходимо проводить с субарахноидальным кровоизлиянием, артериовенозными мальформациями головного мозга, ЧМТ, опухолями головного мозга, синдромом Рея, нейролейкозом, диабетической комой и др.
Лечение менингита у детей
Подозрение на менингит является абсолютным показанием к госпитализации детей в инфекционный стационар. В остром периоде детям показан постельный режим; максимальный покой; полноценная, механически и химически щадящая диета; контроль показателей гемо- и ликвородинамики, физиологических отправлений.
Этиотропная терапия менингита у детей предполагает внутримышечное или внутривенное назначение антибактериальных препаратов: пенициллинов, цефалоспоринов, аминогликозидов, карбапенемов. При тяжелом течении менингита у детей антибиотики могут вводится эндолюмбально. До установления этиологии антибиотик назначается эмпирически; после получения результатов лабораторной диагностики проводится коррекция терапии. Длительность антибиотикотерапии при менингите у детей составляет не менее 10-14 дней.
После установления этиологии менингита у детей может осуществляться введение противоменингококкового гамма-глобулина или плазмы, антистафилококковой плазмы или гамма-глобулина и др. При вирусных менингитах у детей проводится противовирусная терапия ацикловиром, рекомбинантными интерферонами, индукторами эндогенного интерферона, иммуномодуляторами.
Патогенетическая подход к лечению менингита у детей включает дезинтоксикационную (введение глюкозо-солевых и коллоидных растворов, альбумина, плазмы), дегидратационную (фуросемид, маннитол), противосудорожную терапию (ГОМК, тиопентал натрия, фенобарбитал). С целью профилактики мозговой ишемии используются ноотропные препараты и нейрометаболиты.
При тяжелом течении менингита у детей показана респираторная поддержка (кислородотерапия, ИВЛ), УФО крови.
Прогноз и профилактика менингита у детей
Прогноз менингита у детей определяется его этиологией, преморбидным фоном, тяжестью течения заболевания, своевременностью и адекватностью терапии. В настоящее время в большинстве случаев удается достичь выздоровления детей; летальные исходы регистрируются в 1-5% случаев. В резидуальном периоде менингита у детей чаще всего отмечаются астенический и гипертензивный синдромы.
Дети, переболевшие менингитом, подлежат наблюдению педиатра, инфекциониста и невролога с проведением инструментальных исследований (ЭЭГ, ЭхоЭГ, ультрасонографии).
В числе мер, направленных на снижение заболеваемости менингитом, главная роль принадлежит вакцинопрофилактике. При выявлении ребенка, больного менингитом в детском учреждении, осуществляются карантинные мероприятия, проводится бакобследование контактных лиц, введение им специфического гамма-глобулина или вакцины. Неспецифическая профилактика менингита у детей заключается в своевременном и полном лечении инфекций, закаливании детей, приучению их к соблюдению норм личной гигиены и питьевого режима (мытью рук, употреблению кипяченой воды и т. д.).
Читайте также:

