Что за лекарство которое убивает бактерию хеликобактер пилори
Обновлено: 18.04.2024
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Напоминаем вам, что самостоятельная интерпретация результатов недопустима, и приводимая ниже информация носит исключительно справочный характер.
13С-уреазный дыхательный тест: показания к назначению, правила подготовки к сдаче анализа, расшифровка результатов и показатели нормы.
Синонимы: 13C-Urea Breath test, UBT; 13С-уреазный дыхательный тест, дыхательный тест с 13С-меченной мочевиной, 13С-УДТ.
Показания для назначения исследования
13С-уреазный дыхательный тест – лабораторный метод диагностики хеликобактериоза (инфекционного заболевания, вызванного бактерией Helicobacter pylori), основанный на анализе проб выдыхаемого пациентом воздуха.
Этот неинвазивный высокочувствительный и высокоспецифичный тест рекомендуется использовать в целях диагностики Helicobacter pylori, а также подтверждения ее эрадикации (уничтожения) по истечении четырех недель после окончания терапии.
Противопоказания к проведению исследования
13С-уреазный дыхательный тест не проводят людям, у которых были операции на желудке, поскольку результат исследования может быть ложноположительным.
13С-уреазный дыхательный тест имеет возрастные ограничения – его применяют только для пациентов старше 12 лет.
Безопасность проведения 13С-уреазного дыхательного теста во время беременности и в период лактации не исследовалась.
Подготовка к процедуре
- Тест необходимо проводить утром натощак или не ранее, чем через 6 часов после легкого приема пищи; воду в небольшом количестве пить можно.
- Накануне следует избегать пищевых перегрузок.
- Тест можно проводить не ранее, чем через четыре недели после окончания приема антибиотиков, препаратов висмута или сукральфата.
- После окончания приема ингибиторов протонной помпы (препаратов, снижающих образование соляной кислоты в желудке) должно пройти не менее двух недель.
- После приема 13С изотопных растворов должно пройти не менее 24 часов.
- Не следует проводить тест в один и тот же день с эндоскопическим исследованием (гастроскопией) желудка и 12-перстной кишки с биопсией.
- Рекомендуется исключить прием антацидов и блокаторов Н2-гистаминовых рецепторов за 1-2 дня до исследования.
- Исключить физические и эмоциональные перегрузки накануне исследования.
- В течение 1 часа до исследования не следует курить.
- Исключить прием алкоголя накануне исследования.
Как проходит процедура 13С-уреазный дыхательный тест
- Перед началом проведения теста пациенту предлагают выпить 200 мл апельсинового сока (в случае аллергии на апельсины можно использовать яблочный сок).
- Через 5 минут после приема кислого напитка проводится сбор выдыхаемого воздуха в специальный контейнер.
- Содержимое флакона с 13С-мочевиной растворяют в 50 мл воды (выполняется медицинским персоналом), и пациент выпивает приготовленный раствор.
- В течение 30 минут пациенту необходимо находится в спокойном состоянии, ожидая в медицинском офисе.
- Строго через 30 минут после приема раствора проводят сбор выдыхаемого воздуха во второй контейнер.
Синонимы: Дыхательный тест с 13С-меченной мочевиной. 13 UBT; 13C-UBT. Краткая характеристика 13С-уреазного дыхательного теста Дыхательный тест в текущей модификации предназначен для лиц старше 12 лет. 13С-уреазный дыхательный тест относится к неинвазивным безопасным методам исследования.
Срок исполнения
До 5 рабочих дней (указанный срок не включает день взятия биоматериала).
Что может повлиять на результаты
К ложноположительному результату (когда тест показывает, что бактерия Helicobacter pylori присутствует, а на самом деле ее нет) могут привести следующие причины:
- ахлоргидрия - атрофия слизистой оболочки желудка;
- присутствие других спиралевидных желудочных бактерий с уреазной активностью;
- нарушение правил подготовки к исследованию и процедуры проведения (в т.ч. выполнение теста вскоре после эзофагогастродуоденоскопии, повторное проведение дыхательного теста в тот же день).
- использование антибиотиков, ингибиторов протонной помпы, препаратов висмута в течение предшествующих 2 недель;
- проведение дыхательного теста ранее, чем через 4 недели после окончания терапии, направленной на эрадикацию (уничтожение) Helicobacter pylori;
- нарушение процедуры (проведение сбора пробы слишком рано или слишком поздно после приема тестового раствора, взятие второй пробы при неглубоком выдохе).
13С-уреазный дыхательный тест
Референсные значения 13С-уреазного дыхательного теста представлены в таблице.
Единицы измерения: DOB, ‰. При проведении 13С-уреазного дыхательного теста с применением 13С-мочевины измеряемым показателем является относительная разница между отношением 13С/12С в пробах выдыхаемого воздуха до и после приема раствора препарата (обозначается как DOB – Delta over Baseline, измеряется в промилле (‰)).
| DOB, ‰ | Результат | пояснение |
| < 3,0 | отрицательный | отсутствие Helicobacter pylori |
| 3,0-4,5 | сомнительный | рекомендуется проведение любого альтернативного дополнительного теста |
| > 4,5 | положительный | наличие Helicobacter pylori |
Положительный результат с высокой вероятностью говорит об инфицировании Helicobacter pylori, отрицательный – об отсутствии инфицирования. При получении промежуточных значений от 3,0 до 4,5 ‰ рекомендуется проведение любого альтернативного дополнительного теста, направленного на выявление Helicobacter pylori.
Helicobacter pylori (H. pylori) - это короткие, извитые S-образные бактерии средних размеров, подвижные, имеющие 4-5 жгутиков.
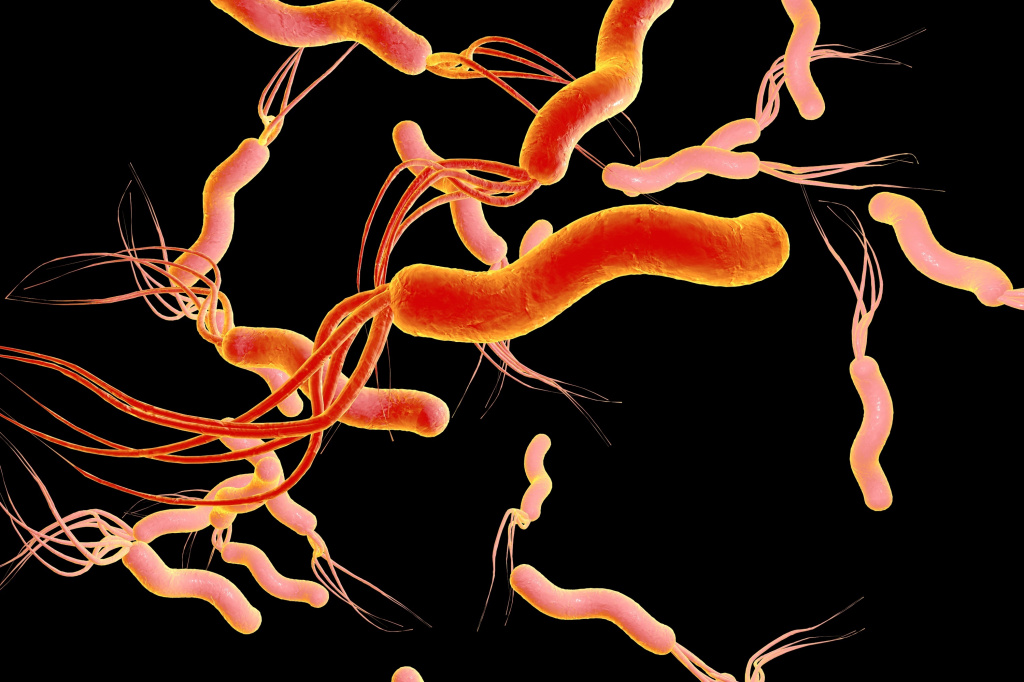
Бактерии Helicobacter pylori
H. pylori играют существенную роль в развитии острого и хронического гастритов, язвенной болезни желудка и 12-перстной кишки. Кроме того, инфицирование H. pylori является предрасполагающим фактором развития рака желудка и лимфоцитарной опухоли желудочно-кишечного тракта (мальтомы).
Спиралевидная форма и наличие жгутиков позволяют бактерии, подобно штопору, ввинчиваться в слой желудочной слизи и прилепляться к эпителиальным клеткам желудка. Основным фактором, обеспечивающим выживание H. pylori в кислой среде желудка, является бактериальный фермент - уреаза, обладающий специфическим свойством - при взаимодействии с водой расщеплять мочевину с образованием диоксида углерода и аммиака. Аммиак нейтрализует ионы водорода и обеспечивает бактерии локальное поддержание комфортного для нее pH.
Именно это свойство Н. pylori лежит в основе 13С-уреазного дыхательного теста. Пациенту предлагают сделать выдох в специальную емкость, которую закупоривают. В этой пробе определят базовое содержание 13 С (углерода 13) и 12 С (углерода 12). Затем пациент выпивает специальный раствор, в котором содержится мочевина с углеродом 13 С (он нерадиоактивен и безопасен). Если в желудке есть H. pylori, то бактерия расщепляет мочевину, и углерод 13 С попадает в кровь и выводится через легкие. Поэтому собирают вторую пробу выдыхаемого воздуха и определяют содержание 13 С. Если в желудке нет бактерии, то вторая проба не будет отличаться по содержанию углерода 13 от первой пробы.
- Tsachi Tsadok Perets, Rachel Gingold-Belfer et al. Optimization of 13C-urea breath test threshold levels for the detection of Helicobacter pylori infection in a national referral laboratory. J Clin Lab Anal. 2019;33:e22674.
- Malfertheiner P, Megraud F, O’Morain CA, et al. Management of Helicobacter pylori infection-the Maastricht V/Florence consensus report. Gut. 2017;66:6‐30.
- Li Z‐X, Huang L‐L, Liu C, et al. Cut‐off optimization for 13C‐urea breath test in a community‐based trial by mathematic, histology and serology approach. Sci Rep. 2017;7:2072.
- Athanasios Makristathis, Alexander M. Hirschl, Francis Mégraud, Emilie Bessède, Review: Diagnosis of Helicobacter pylori infection, Helicobacter, 10.1111/hel.12641, 24, S1, (2019).
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Еще каких‑то 30–40 лет назад диагноз язвенной болезни желудка выбивал почву из‑под ног. Пожизненная диета и бесконечное лечение язвы, которая, несмотря на все ухищрения врачей, прекрасно себя чувствовала в желудке и не собиралась заживать. Сегодня решение найдено. Триумфальное открытие, ставшее ключом к разгадке язвенной болезни, до сих пор придает уверенности ученым. А главное, вселяет надежду тысячам людей, которые ждут новых лекарств от рака, СПИДа и множества других тяжелых заболеваний.

Провизор первой категории и заведующая аптекой. Автор многочисленных работ по фармакологии и фармакотерапии
Язвенная болезнь в мире больших цифр
С каждым годом диагностируется все больше новых случаев заболевания. Медики связывают такую неутешительную тенденцию с широким использованием нестероидных противовоспалительных препаратов, значительно повышающих уязвимость стенки желудка. Однако достижения современной медицины позволяют давать очень благоприятный прогноз при язвенной болезни. А ведь еще в конце прошлого века все было не так однозначно.
Схемы эрадикационной терапии
| Препарат | Доза | Кратность применения |
| Эрадикационная терапия 1 линии (7–10 дней) | ||
| ИПП | стандартная доза | 2 раза в день |
| кларитромицин | 500 мг | |
| амоксициллин | 1г | |
| Терапия 2 линии (10–14 дней) — при неэффективности или непереносимости терапии первой линии | ||
| ИПП | стандартная доза | 2 раза в день |
| метронидазол или амоксициллин | 500 мг (амоксициллин — 1 г) | 3 раза в день (амоксициллин 2 раза в день) |
| тетрациклин | 500 мг | 4 раза в день |
| висмута препарат | 120 мг | |
Методом проб и ошибок
Долгие годы происхождение язвенной болезни трактовалось неверно. Ложные теории становились крепким основанием для ошибочного лечения, не приносившего ожидаемых результатов. В начале XX века врачи склонялись к мнению, что язвенной болезнью желудка человек расплачивается за нервные потрясения. Основой терапии были диета, исключающая все жареное, острое и пряное, и, разумеется, успокоительные препараты. Неудивительно, что на фоне такого лечения выздоровление было весьма сомнительным исходом.
Чуть позже в возникновении язвенной болезни начинают обвинять злосчастную соляную кислоту. Она и только она объявляется первопричиной заболевания. В привычную схему лечения вносятся соответствующие коррективы: основой противоязвенной терапии становятся антациды. Эти препараты, несомненно, облегчали течение язвенной болезни, однако полного излечения гарантировать не могли. Временная ремиссия, наступавшая после курса эрадикационной терапии антацидами, как правило, заканчивалась рецидивом. И только в начале 80‑х годов забрезжила долгожданная и выстраданная миллионами больных истина.
ОткрытиеHelicobacter pylori
После неудачной попытки заразить хеликобактерной инфекцией поросят Маршалл решился на эксперимент, достойный великих исследователей. Он выпил содержимое чашки Петри, в которой культивировались H. pylori, и приготовился к ожиданию. Ученый надеялся, что через год или чуть больше у него смогут диагностировать язвенную болезнь желудка, и он наконец докажет очевидную причинно-следственную связь. Однако события не заставили себя долго ждать.
Спустя три дня после начала эксперимента мать Маршалла заметила, что у сына стало дурно пахнуть изо рта. Вскоре к симптомам присоединилась тошнота и рвота, а всего лишь спустя восемь дней после отчаянного поступка эндоскопическое исследование подтвердило: в желудке врача начался острый гастрит, а из мазка со слизистой была культивирована H. pylori. На 14‑й день эксперимента Маршалл начал принимать антибиотики. После курса лечения было зафиксировано полное выздоровление.
В 1985 году подробности эксперимента появились на страницах Медицинского журнала Австралии. Кстати, вскоре эта статья приобрела всемирную известность и стала самой цитируемой за всю историю издания. Казалось бы, доказательства очевидны и дело — за малым. Однако до полного признания оставалось еще почти десятилетие.
Препараты для эрадикационной терапии(международные и торговые названия)
| Группа | Международное название | Торговое название |
| антибиотики пенициллины | амоксициллин | Оспамокс, Флемоксин Солютаб, Хиконцил |
| антибиотики макролиды | кларитромицин | лабакс, Клабакс ОД, Кларитромицин-Зентива, Кларитромицин Пфайзер, Клацид, Клацид СР, Фромилид, Фромилид Уно |
| антибиотики тетрациклины | тетрациклин | Тетрациклин |
| ингибиторы протонной помпы | омепразол | Зероцид, Лосек, Омез, Омизак, Ортанол, Ромесек, Улкозол, Ультоп, Хелицид, Цисагаст |
| лансопразол | Ланзабел, Ланзап, Ланзоптол, Ланцид, Лоэнзар-сановель, Эпикур | |
| рабепразол | Берета, Золиспан, Зульбекс, Нофлюкс, Онтайм, Париет, Рабелок, Хайрабезол | |
| пантопразол | Зипантола, Контролок, Кросацид, Нольпаза, Пантаз, Панум, Пептазол, Пиженум-сановель, Пулореф, Санпраз, Ультера | |
| эзомепразол | Нексиум, Нео-зекст, Эманера | |
| противомикробные и противопротозойные средства | метронидазол | Клион, Метрогил, Метронидазол, Трихопол, Флагил, Эфлоран |
| гастропротекторы | висмута трикалия дицитрат | Де-Нол, Новобисмол |
Борьба за признание
Только в 1994 году Национальные институты здравоохранения США документально подтвердили тесную связь между H. pylori и язвенной болезнью и рекомендовали лечить ее с помощью антибиотиков. Тем не менее в 1995 году большинство больных язвой желудка по‑прежнему получали антисекреторную терапию, и лишь 5 % счастливчиков встречали врачей, которые назначали антибиотики.
В том же 95‑м Американский фонд здравоохранения провел крупный опрос среди людей, страдающих язвенной болезнью. Результаты были впечатляющими. Спустя более чем 10 лет после открытия H. pylori 90 % пациентов не имели понятия о том, что истинной причиной их заболевания была инфекция, и винили во всем стрессы и слабые нервы.
В 1996 году Американское агентство по контролю за лекарственными препаратами (FDA) впервые в мире одобрило применение антибиотика для лечения язвенной болезни. Еще через год, в тех же Соединенных Штатах, запускается национальная кампания, цель которой — информировать врачей и фармацевтов о связи между язвенной болезнью желудка и H. pylori. Вскоре весть об абсолютной излечимости прежде довольно тяжелого заболевания разлетелась по странам, городам и весям, и началась новая эпоха в терапии язвенной болезни.
Комбинированные препараты для эрадикационной терапии
| Международное название | Торговое название |
| омепразол+амоксициллин+кларитромицин | Пилобакт АМ |
| лансопразол+амоксициллин+кларитромицин | Ланцид Кит, Хелитрикс |
Препараты для эрадикации Helicobacter pylori
Сегодня разработано несколько схем эрадикационной терапии хеликобактер пилори, которые подбираются индивидуально. Традиционный антихеликобактерный комплекс включает:
антибиотик (амоксициллин, кларитромицин или тетрациклин);
ингибитор протонной помпы;
метронидазол;
препараты висмута.
Амоксициллин
Антибиотик пенициллинового ряда, амоксициллин, и структурно, и по спектру активности очень близок к ампициллину. Амоксициллин стабилен в кислой среде. Препарат ингибирует синтез клеточной стенки бактерий, действует и местно, и системно после абсорбции в кровоток и последующего проникновения в просвет желудка. H. pylori демонстрирует хорошую чувствительность к амоксициллину in vitro, однако для эрадикации бактерии требуется комплексная терапия.
Кларитромицин
Кларитромицин, 14‑членный макролид, представляет собой производное эритромицина с аналогичным спектром активности и показаниями к применению. Однако в отличие от эритромицина он более устойчив к воздействию кислот и имеет более длительный период полувыведения. Результаты исследований, доказывающих, что схема тройной антихеликобактерной терапии с использованием кларитромицина дает положительный результат в 90 % случаев, привели к широкому использованию антибиотика. В связи с этим в последние годы было зафиксировано увеличение распространенности устойчивых к кларитромицину штаммов H. pylori.
Тетрациклины
Точкой приложения тетрациклинов является бактериальная рибосома. Антибиотик прерывает биосинтез белка и специфически связывается с 30S-субъединицей рибосомы, исключая добавление аминокислот к растущей пептидной цепи. Тетрациклин доказал in vitro эффективность против H. pylori и сохраняет активность при низком pH.
Ингибиторы протонной помпы (ИПП)
Терапия ИПП доказала свою эффективность в различных клинических исследованиях. Предполагается, что антисекреторные препараты группы ИПП могут способствовать повышению концентрации антимикробных средств, в частности, метронидазола и кларитромицина, в просвете желудка. ИПП уменьшают объем желудочного сока, вследствие чего вымывание антибиотиков с поверхности слизистой уменьшается и концентрация, соответственно, увеличивается. Кроме того, снижение объема соляной кислоты поддерживает стабильность антимикробных препаратов. Различные ИПП не отличаются по эффективности.
Метронидазол
H. pylori, как правило, очень чувствительны к метронидазолу, эффективность которого не зависит от pH среды. После перорального или инфузионного применения в желудочном соке достигаются высокие концентрации препарата, что позволяет достичь максимального терапевтического эффекта. Метронидазол приводит к потере спиральной структуры ДНК H. pylori, в результате чего происходит поломка в ДНК и бактерия погибает.
Препараты висмута
Висмут стал одним из первых препаратов для эрадикации H. pylori. Существуют доказательства, что висмут оказывает непосредственное бактерицидное действие, хотя его минимальная ингибирующая концентрация (МИК — наименьшее количество препарата, ингибирующее рост возбудителя) в отношении H. pylori слишком высока. Как и другие тяжелые металлы, такие как цинк и никель, соединения висмута снижают активность фермента уреазы, который принимает участие в жизненном цикле H. pylori. Кроме того, препараты висмута обладают местной антимикробной активностью, действуя непосредственно на клеточную стенку бактерий и нарушая ее целостность.
Гарантии эффективности — в руках фармацевта?
Эффективность эрадикационной терапии подсчитана и разложена по полочкам. Терапия первой линии успешна более чем в 75 % случаев, а лечение по альтернативной схеме (второй линии) приносит выздоровление 93 % больных. Неудовлетворительный результат лечения объясняется просто: бактерии быстро приспосабливаются к антибиотикам и появляются новые, устойчивые штаммы. Чтобы победить H. pylori, нужно строго соблюдать схему лечения. И недисциплинированный пациент, пытающийся заменить, отменить или отложить прием одного или даже нескольких компонентов эрадикационной терапии, должен знать о поджидающей его опасности.
Одной из закономерностей, характерных для нормальной микрофлоры желудочно-кишечного тракта, является определенная качественная и количественная специфичность ее в различных отделах пищеварительного тракта, обусловленная морфологическими и функциональными особенностями соответствующих отделов. Общепризнанной в последние десятилетия являлась этиологическая роль Хеликобактер пилори (Helicobacter pylori) в развитии воспалительных заболеваний желудка и 12-перстной кишки (хронического гастрита, язвенной болезни, рака желудка). Попробуем разобраться, так ли это в действительности.
Состав микрофлоры ЖКТ
Полость рта – входные ворота для микроорганизмов. Оптимальные и стабильные условия для жизнедеятельности микроорганизмов в полости рта (температура, влажность, питание и др.) приводят к тому, что качественный состав микрофлоры чрезвычайно разнообразен и постоянен. Общее количество микроорганизмов в 1 мл слюны примерно находится на таком же уровне, как в дистальных отделах толстой кишки и составляет 10^7 и 10^8, но отличается видовой специфичностью. Среди бактерий доминируют стрептококки, составляющие 30-60%.
Содержимое желудка у 10% здоровых людей стерильно благодаря бактериостатическому и бактерицидному действию соляной кислоты и лизоциму, при сохраненной желудочной секреции, не превышает 10^3 микроорганизмов в 1 мл желудочного сока и преобладают анаэробные микроорганизмы.
По данным Drazer B.A. et al, 1969, Bauchop N.,1971, Browning et al., 1974 и др., у здоровых лиц в слизистой оболочке желудка и желудочном соке наблюдаются: бактериоиды, лактобактерии, энтеробактерии, вейлонелла, стрептококки, стафилококки, микрококки, нейссерии, кампилобактер и др., всего более 14-22 видов бактерий. Среди микрофлоры преобладают стафилококки и стрептококки, грамотрицательные бактерии.
Исследования последних лет по данным разных авторов показал, что у здоровых людей выделяется от 6 – 85% хеликобактер пилори и в 46% определяются антитела к хеликобактеру, у некоторых людей в желудке вместе с хеликобактером определяются кандиды. Основная масса бактерий обитает в пилорическом (выходном) отделе желудка, у здоровых лиц выделяются в 44,4% случаев Н.pylori., в 55,5% — стрептококки, в 61.1% — стафилококки, в 50% молочнокислые лактобациллы, в 22,2% грибы рода Candida и др. Из биоптатов слизистой желудка разных отделов желудка обнаружены Н.pylori — в 33,3%, стафилококки -в 61,1%, стрептококки и лактобациллы встретились в 44,4% случаев и в 27,7% — грибы рода Candida и др. микроорганизмы. Представляется чрезвычайно интересным сочетанность выявления микроорганизмов в слизистой оболочке различных отделов желудка.
Такое разнообразие представителей микрофлоры желудка составляет микроэкологию желудка у здорового человека и нарушение ее приводит к проявлением патогенных свойств микроорганизмов, относящихся к условно-патогенной микрофлоре (H.pylori, стафилококки, стрептококки, Candida, коринобактерии и другие) и находящихся в избыточном количестве в желудке, наряду с другими причинными факторами, может способствовать или поддерживать патологические процессы в желудке.
К вопросу о Хеликобактер пилори
Высока распространенность хеликобактериоза, составляющая две трети населения Земного шара, в Азии и Африке -100% населения (Av.J.Gastroenterol.1999), но риск развития язвы составляет 1% в год или 10% за всю жизнь. Тотальное уничтожение НР (Хеликобактер пилори ) в Германии и Англии не выявило связи между наличием НР и раком желудка. В Японии, несмотря на уничтожение НР, рак желудка лидирует среди причин смерти (Kurihara,1998). По-видимому, Helicobacter pylori не может рассматриваться как единственный этиологический фактор хронического гастрита и язвенной болезни. Следует говорить о нарушении в целом микроэкологии желудка, состоящей из различных представителей условно-патогенной и облигатной флоры.
Концепция первичной ответственности НР при язвенной болезни дефекта при сохранении НР на слизистой желудка не отвечает особенностям заболевания, таким как цикличность течения, различные ритмы рецидивирования, успешное рубцевание язвенного, рецидивы язвы при отсутствии НР, высокая степень заживления язв на плацебо (30%). НР – реальность, которая сосуществует с человеком на протяжении тысячелетий и не может не иметь полезных свойств и является компонентом микрофлоры желудка.
Некоторые эпидемиологи и гастроэнтерологи считают, что лечение хеликобактер пилори и другой микрофлоры желудка ведет к резкому нарастанию изжоги, на 8% в год увеличивается частота рака пищевода. Недавние исследования показали, что хеликобактер пилори увеличивает синтез гормонов лептина, снижающего аппетит и грелина, вызывающего голод. После лечения – уничтожения микрофлоры желудка — пациенты набирают массу тела и повышается уровень холестерина в крови, возможной причиной которых может быть нарушения микроэкологии желудочно-кишечного тракта.
В настоящее время известно, что причинами нарушений микрофлоры желудка могут быть препараты, которые применяются при заболеваниях желудка и 12-перстной кишки – это антисекреторные препараты и антациды, которые уменьшают кислотность желудочного сока, защищают слизистую желудка. Возникает дисбактериоз желудка, когда условно-патогенная флора становится патогенной (может вызвать повреждения слизистой желудка – гастрит, язву). Доказано, что прием антацидов приводит к повышенному росту энтеробактера, хеликобактер пилори, стафиолококка, пропионобактерий и др.
При эрадикационной терапии легко развивается резистентность к препаратам. По мнению Директора Германского Национального центра по изучению НР, доктора Kist, в настоящее время 50% больных имеют штаммы НР, устойчивые к антибиотикам. Таким образом, язвенную болезнь необходимо лечить всеми известными способами, не забывая о микроэкологии желудка, которая является отделом желудочно-кишечного тракта.
В настоящее время в диагностике нарушения микробиоценоза желудка предпочтение отдано роли хеликобактер пилори, определению кандид.
Диагностика инфекции Хеликобактер пилори
- Инвазивные методы диагностики — исследование в биоптатах слизистой оболочки желудка, полученных при эндоскопическом исследовании, с помощью гистологии, бактериологии или быстрого уреазного теста (Хелпил=тест).
- Неинвазивные методы диагностики — уреазные дыхательные тесты (с мочевиной, меченной С13, или мочевины). Следует отметить,что уреазной активностью обладают все штаммы хеликобактера, а также стафилоккоки, стрептококки, микрококки, кандиды, псевдомонады и другие представители условно-патогенной флоры желудка.
- Количественный ИФА концентрации антигена H.pylori в кале – высокоэффективный метод для первичной диагностики и контроля эрадикационной терапии.
- Иммунологические методы:
- иммуноблот для определения в крови Ig G / Ig A-антител против различных антигенов Helicоbacter pylori, обладающих патогенностью – Cag A и Vac A белки (используется редко),
- серологический метод — ИФА содержания антител против Н.pylori в сыворотке крови Ig G и Ig A (высоко специфичный метод диагностики и контроля лечения),
- серологический метод – ИФА содержания антихеликобактерных антител в слюне (чувствительность и специфичность уступают исследованию антител в сыворотке крови),
- экспресс-тест на основе иммунопреципитации и иммунохроматографии капиллярной крови пациента (не применяется у детей, при контроле лечения в виду низкой чувствительности).
Наличие инфицирования хеликобактер пилори должно быть доказано двумя методами. Диагностики хеликобактерной инфекции, разработанные в настоящее время, отражают нарушение микроэкологии желудка в целом и требуют новых подходов к профилактике и лечению этих нарушений.
Лечение Хеликобактер пилори
Эрадикационная терапия
Эволюция применяемых методик диагностики и лечения хеликобактериоза желудка за последние 10 – 12 лет, использование различных схем лечения с увеличение компонентов эрадикационной терапии, количества и доз антимикробных средств, продолжительности лечения, убедительно демонстрирует недостаточность положительных результатов.
В России отмечаются наиболее низкие показатели эффективности эрадикационной терапии хеликобактера, что возможно связано с со следующими факторами:
- высокой степенью обсемененности слизистой оболочки желудка,
- мутацией микроорганизмов,
- резистентностью хеликобактер пилори к используемым антибактериальным средствам,
- генетическим полиморфизмом генов цитохрома Р-4590, снижающих эффективность антисекреторных препаратов (ИПП),
- иммуногенетическими особенности макроорганизма,
- низкой комплаентности (приверженности) пациентов к лечению,
- развитием побочных эффектов.
Фитотерапия
Принципы коррекции нарушений микроэкологии желудка включают в себя применение антибактериальных препаратов пре- и пробиотиков, фитопрепараты.
Исходя из принципов коррекции микроэкологии желудочно-кишечного тракта, изложенных ранее, возможно использование уже описанных препаратов фитотерапии и лекарственных средств. В добавление к вышеизложенному можно добавить известный опыт американских ученых, которые показали, что прием имбиря активно угнетает рост условно-патогенной флоры желудка и, в том числе, НР. Солодка, издавна использовалась при лечении язв желудочно-кишечного тракта. Исследования, проведенные в институте медицинской микробиологии и вирусологии в Германии, показали, что экстракт солодки уничтожает штамм НР, устойчивый к кларитромицину — одному их трех компонентов антихеликобактерной терапии (Fukai T, et al.,2003). Исследования показали, что антихеликобактерными свойствами обладает большое число растений: лук, чеснок, тмин, берберин, куркума и др.
Нами проведены исследования, целью которых явилась оценка эффективности применения фитотерапевтических сборов и бактериальных пробиотиков в лечении и профилактике язвенной болезни, ассоциированной с хеликобактерной инфекцией. Приводим растительные сборы, разработанные фитотерапевтом Михальченко С.И.
Состав: Сабельник болотный, бадан, кубышка, душица, зверобой продырявленный, кровохлебка обыкновенная, лист и почки березы, корни лабазника, калган, золотарник обыкновенный, исланский мох.
Состав: калган (корни), кровохлебка (корни), зверобой продырявленный, пастушья сумка (трава), ромашка(соцветия), пустырник (трава, исланский мох (слоевище), кипрей узколистный, кубышка, почки тополя, золотарник обыкновенный (трава), кора дуба.
Применение: 1 десертную ложку сбора залить 500 мл кипятка, настоять ночь в фарфоровой посуде или термосе, процедить.
Прием: по 150 мл 3 раза в день за 30 минут до еды. 10 дней пить, 2 дня перерыв, лечебная порция сбора 200-400 г. Курс лечения 1-3 месяца.
Лечение фитотерапевтическими сборами сочеталось с разработанными нами прерывистыми курсами бактериальных пробиотиков не более 10 дней. Исследования показали, что применение фитотерапии и пробиотиков в лечении язвенной болезни обладает антихеликобактерной направленностью, точнее восстановлением нарушений микроэкологии желудка и соответственно улучшает течение язвенной болезни.
Неэффективность традиционного лечения

В последние годы отмечается снижение эффективности лечения хеликобактерной инфекции, связанной с несколькими причинами:
- нечувствительность хеликобактера к антибиотикам,
- большое количество побочных эффектов на прием ИПП и антибиотиков,
- активное нежелание пациентов принимать антибиотики.
Стандарты лечения регламентируются международными и российскими соглашениями, в основе которых лежит курс лечения с назначением препаратов, снижающих кислотность желудочного сока (антисекреторные препараты – ИПП, например, Омез, Париет и др.), двух антибиотиков (например, Клацид и Амоксициллин).
Лечение хеликобактерной инфекции в любой возрастной категории сопровождается большим количеством побочных, нежелательных реакций на применяемые препараты и то, что их применение не исключает повторения инфекции или повторного заражения препараты-ИПП).
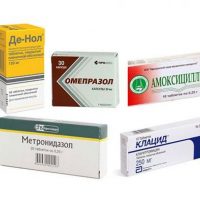
Почему при лечении хеликобактера отказываются от антибиотиков
Наличие хеликобактера — не всегда хроническая инфекция.
Нечувствительность хеликобактера к антибиотикам приводит к уменьшению эффективности лечения – отмечено снижение эффективности с 80-90% до 30-60%, что является характерным для многих стран, для различных регионов в России.
Сегодня стоит еще раз напомнить о побочных эффектах применения антисекреторных препаратов и антибиотиков.
Так, при приеме антисекреторных препаратов (ИПП) нарушаются процессы переваривания пищи и всасывания кальция, железа, цинка, лекарственных препаратов при приеме внутрь. При длительном применении ИПП существует риск развития инфекций желудочно-кишечного тракта и легких, т. к. в желудок попадают микроорганизмы из ротовой полости, носоглотки, кишечника. Если они не инактивируются в условиях сниженной желудочной секреции, то некоторые из них могут вырабатывать вещества (канцерогены), которые могут вызывать онкологические заболевания. Длительный прием препаратов, снижающих желудочную секрецию, может привести к
- поносам, вызванным микроорганизмом клостридией,
- грибковому поражению желудочно-кишечного тракта,
- воспалению легких,
- перелому шейки бедра.
Применение антибиотиков в лечении различных заболеваний и, в том числе, хеликобактериозе, несколько ограничено при наличии заболеваний печени, почек, нарушений микрофлоры кишечника, аллергии на антибиотики
Лечение антибиотиками может привести к развитию антибиотико-ассоциированного поноса, ухудшению пищеварения, вызвать дисепсические жалобы – тошноту, рвоту, изменение вкуса, нередко головную боль. Особенно это характерно для пожилых людей. Кроме того, могут развиваться аллергические реакции, вплоть до формирования поливалентной аллергии. Эти побочные эффекты, знакомые нашим пациентам, заставляют многих отказаться от приема антибиотиков из-за риска их развития.
К сожалению, официальные стандарты-IV Маастрихтского соглашения продолжают рекомендовать применение этих схем, однако…
Лечение хеликобактер пилори по-новому
В последние годы официальные стандарты-IV Маастрихтского соглашения пополнились применением препаратов висмута (Денол), пробиотиком Saccharomyces boulardii (препарат Энтерол) – тропического штамма дрожжевых грибов, выделенных из сока личи и манго.
Наиболее перспективным направлением оптимизации лечения хеликобактериоза желудка являлось использование пробиотиков, в первую очередь, лактобацилл в виде монотерапии. Исследования, проведенные российскими, зарубежными учеными и собственные данные подтверждают эффективность пробиотиков для эрадикации хеликобактер пилори. Опыт показал, что применение молочно-кислых бактерий, лактобацилл ацидофилюс, сочетание нескольких штаммов лактобацилл (Трилакт), позволило получить достаточно высокий процент положительных результатов, (39 — 54%) у детей и взрослых. При таком подходе к лечению встает вопрос, какой пробиотик выбрать, при каких заболеваниях желудка и других ситуациях применить, в каком возрасте, какова продолжительность курса.
Как выбрать пробиотик для лечения хеликобактера
Важным условием применения пробиотика является кислотоустойчивость штамма живых микроорганизмов, которая доказана в отношении группы лактобацилл (L.rbamnosus, L.reuteri, L.plantarum, L.acidophilus, способных оказывать прямое действие на хеликобактер пилори. Эти штаммы лактобацилл вырабатывают вещества (метаболиты), которые подавляют рост, обладают антибактериальным действием, снижают активность ферментов хеликобактерий и других микроорганизмов, уменьшают воспаление слизистой оболочки желудка.
Кому показано лечение пробиотиками
Лечение хеликобактерной инфекции с применением только пробиотиков показано:
- лицам, у кого в анамнезе аллергия к антибиотикам,
- при категорическом отказе пациента от приема антибиотиков,
- лицам при выявленном хеликобактериозе без клинических проявлений и жалоб,
- членам семьи пациентов, инфицированных хеликобактером,
- пациентам с хроническим гастродуоденитом, язвенной болезнью вне обострения,
- пожилым людям,
- детям,
- лицам, имеющим поражения печени и почек.
Дальнейшие исследования показали, что положительно действуют не только пробиотики на основе живых микроорганизмов, но и продукты их метаболизма (обмена). На основе этого открытия был разработан в 2014 году в России новый препарат с уникальным антихеликобактерным действием.
Хелинорм – инновационное антихеликобактерное средство из группы метаболиков
Принцип действия

Хелинорм содержит в своем составе субстанцию Pylopass – специфический штамм Лактобациллы реутери, обладающий уникальной способностью специфически связываться с клетками хеликобактера, не влияя на нормальную флору.
Связывание снижает подвижность хеликобактерий — бактерии перестают связываться со слизистой оболочкой желудка и вымываются из желудка, что приводит к уменьшению бактерий в слизистой оболочке и снижают риск развития гастрита, язвенной болезни.
Хелинорм – разумная альтернатива антибиотикотерапии при хеликобактериозе.
Схема лечения
Курс лечения Хелинормом составляет 4 недели, по 1 капсуле во время еды 1 раз в день.

Курс пробиотиков занимает месяц, например, жидкий пробиотик Трилакт для взрослых 5 мл утром натощак, детям по возрасту, и далее короткими курсами по разработанной много лет назад методике — прием пробиотика по 10 дней каждого месяца, с контролем анализов на хеликобактерную инфекцию и дисбактериоз кишечника.
С профилактической целью в дальнейшем возможно использовать закваски Эвиталия или Нарине, которые позволяют готовить лечебный кисломолочный продукт в домашних условиях, в котором оптимальное сочетание и живых бактерий – лактобацилл, и продуктов их жизнедеятельности. Использовать его в натуральном виде, с добавлением растительных компонентов (овощи, фрукты, отруби), заправлять им разнообразные салаты.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Хеликобактериоз: причины появления, симптомы, диагностика и способы лечения.
Определение
Хеликобактериоз – инфекционное заболевание, поражающее пилорический отдел желудка, или привратник, и двенадцатиперстную кишку. Его возбудителем является уникальная патогенная микроаэрофильная грамотрицательная бактерия хеликобактер пилори (H. pylori). Свое название бактерия получила за счет отдела желудка, в котором она обитает – пилорического.
В результате микроорганизм еще сильнее колонизирует слизистую оболочку, формирует ее повышенную восприимчивость к соляной кислоте и провоцирует воспаление, приводящее к развитию язвенных дефектов.
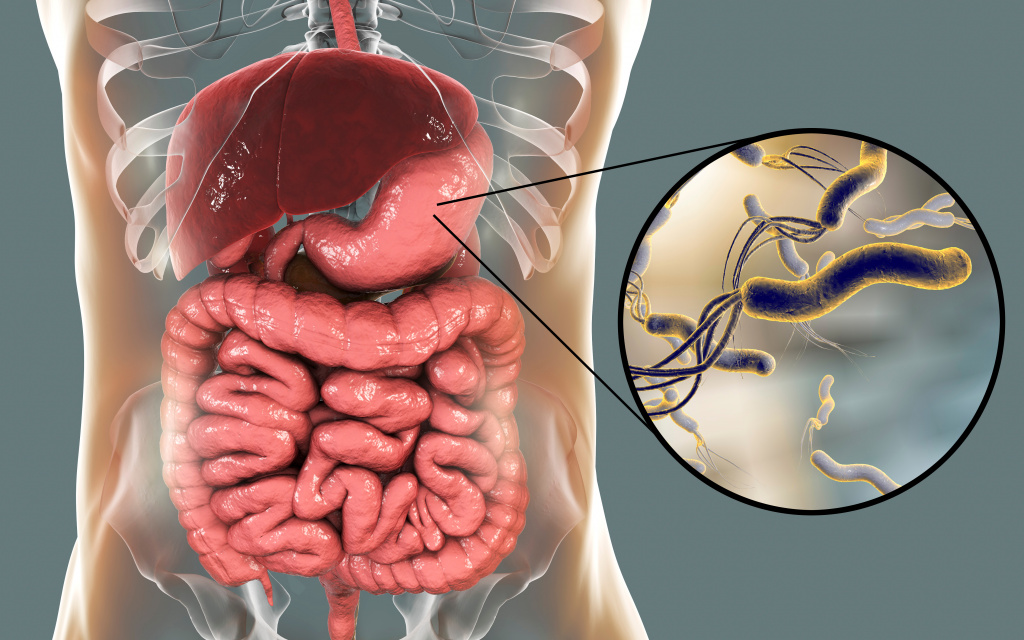
Хеликобактер пилори – спиралевидная бактерия длиной 3,5 и шириной 0,5 микрон. Она имеет жгутики, с помощью которых свободно перемещается по стенке желудка либо надежно на ней закрепляется. Бактерия H. pylori очень изменчива, ее штаммы (разновидности) отличаются друг от друга способностью прикрепляться к слизистой оболочке желудка, вызывать воспалительный процесс и обладают разной степенью патогенности.

Хеликобактер пилори, колонизирующая слизистую оболочку желудка, — частая причина ее воспалительных изменений, она признана этиологическим фактором гастрита, а сам гастрит — инфекционным заболеванием. В зависимости от состояния защитных факторов желудка возникший инфекционный процесс может протекать латентно или с выраженной клинической симптоматикой воспаления. Согласно современным представлениям, H. pylori вызывает хронический гастрит у всех зараженных лиц. Это может привести к язвенной болезни, атрофическому гастриту, аденокарциноме желудка или низкодифференцируемой лимфоме желудка. H. pylori относится к канцерогенам первого порядка.
Результаты многочисленных исследований дают основание предполагать возможную патогенетическую или опосредованную роль инфекции H. pylori в развитии и/или течении заболеваний, не относящихся к пищеварению: кардио-, цереброваскулярных, аутоиммунных заболеваний, заболеваний крови, кожи, нервной системы и многих других.
Патоген отличается относительной устойчивостью к окружающей среде: при кипячении хеликобактерии гибнут практически мгновенно, при обработке дезинфицирующими составами — в течение нескольких минут.
Причины появления хеликобактериоза
Заразиться бактерией можно при контакте с загрязненной водой или продуктами питания. Инфицирование возможно во время проведения эндоскопии и при использовании других плохо стерилизованных медицинских инструментов, которые имели прямой контакт со слизистой желудка пациента.
Бытовой способ передачи (например, через поцелуи, личные вещи и проч.) также возможен, о чем свидетельствует выделение бактерии из слюны и зубного налета.
Распространенность инфекции варьируется в зависимости от географического региона, возраста пациента, его этнической принадлежности и социально-экономического статуса. По данным Департамента здравоохранения г. Москвы (2019), распространенность этой инфекции в Москве составляет 60,7–88%, в Санкт-Петербурге - 63,6%, в Восточной Сибири достигает 90%.
Классификация заболеваний
Заболевания, связанные с H. pylori:
- гастрит,
- дуоденит,
- гастродуоденит,
- эзофагит,
- язвенная болезнь желудка,
- язвенная болезнь двенадцатиперстной кишки,
- железодефицитная анемия неясного генеза,
- рак желудка,
- рак двенадцатиперстной кишки.
Основной жалобой, с которой больные с признаками Helicobacter-инфекции обращаются к врачу, являются желудочные боли. Локализация симптома может меняться и переходить в область расположения двенадцатиперстной кишки.
Боли бывают острыми, ноющими, тупыми, возникают в верхних отделах живота слева и по центру в околопупочной области. Дискомфорт может возникать при длительном голодании, натощак или через определенное время после приема пищи.
Симптоматика хеликобактериоза зависит от клинической формы заболевания и может включать:
- чувство тяжести в животе после еды;
- нарушение аппетита, связанное с внезапными приступами тошноты (если слизистая желудка сильно травмирована);
- беспричинная рвота на фоне нормальной температуры тела;
- изжога (жгучие ощущения в пищеводе и даже гортани) и отрыжка с неприятным кислым или горьким привкусом;
- хронические запоры (отсутствие дефекации в течение трех суток и более);
- разжижение каловых масс, появление пенистой или водянистой консистенции;
- кишечные спазмы и вздутие живота.
- снижение аппетита до полного его отсутствия;
- тошнота может сменяться рвотой со сгустками крови;
- резкое снижение массы тела, не являющееся нормой;
- сухость во рту и привкус металла;
- появление белого налета на языке;
- неприятный запах изо рта при отсутствии кариеса;
- заеды в уголках рта;
- кровоточивость десен.
Диагностика хеликобактериоза
Долгое время хеликобактериоз может никак себя не проявлять, при этом провоцируя развитие язвы, аденокарциномы или мальтомы желудка. В особой зоне риска люди, чьи родственники имеют эти заболевания в анамнезе.
Диагностика может быть инвазивной (эндоскопия с последующей биопсией желудочных тканей) и неинвазивной (лабораторные исследования).
Согласно международным рекомендациям, методами выбора для диагностики бактерии и оценки эффективности лечения H. pylori служат дыхательный̆ тест с мочевиной, меченной 13С и определение специфических антигенов H. pylori в кале иммунохроматографическим методом.
Синонимы: Дыхательный тест с 13С-меченной мочевиной. 13 UBT; 13C-UBT. Краткая характеристика 13С-уреазного дыхательного теста Дыхательный тест в текущей модификации предназначен для лиц старше 12 лет. 13С-уреазный дыхательный тест относится к неинвазивным безопасным методам исследования.
Читайте также:

