Циклоферон от золотистого стафилококка
Обновлено: 24.04.2024
Установлена профилактическая эффективность препарата циклоферон (снижение заболеваемости ОРЗ и гриппом в 2,9–7,2 раза для микст-инфекций респираторного тракта) в группе часто болеющих детей. Индекс эффективности колебался от 2,4 до 3,4, колебания показателя защиты от 58,5 до 67,1 %, снижение заболеваемости более чем в 2,9 раза. Отмечено и снижение кратности (в 4,1 раза) и длительности острых (в 1,7 раза) эпизодов ОРЗ/ОРВИ, частоты развития аллергии в 4,6 раза, уменьшение проявлений синдрома лимфоаденопатии, астенического синдрома, осложненного течения заболевания, восстановление нормальной флоры слизистых оболочек носа и зева. Во вновь организованных коллективах, как у детей, так и у подростков выявлено снижение заболеваемости ОРЗ и гриппом (в 2,4–4,4 раза). Цитопротекторное действие проявлялось усилением активности факторов (лизоцим, секреторный иммуноглобулин А) местной неспецифической резистентности. Прием препарата снижал видовое разнообразие микрофлоры поверхности миндалин, уменьшал обсеменённость поверхности миндалин микрофлорой, в том числе золотистым стафилококком, что обеспечило снижение штаммов золотистого стафилококка, устойчивых к бензилпенициллинам. Отмечена минимизация симптомов интоксикации, выраженности и продолжительности катаральных явлений, отсутствие нежелательных реакций на препарат.

1. Маркова Т.П. Длительно и часто болеющие дети / Т.П. Маркова, Д.Г. Чувиров // Ремедиум. – 2010. – № 6. – С. 26–28.
2. Василевский И.В. Часто болеющие дети: практические подходы к иммунокорригирующей терапии. – М.: Медицина, 2008. – № 2. – С. 93–99.
3. Альбицкий В.Ю. Часто болеющие дети. Клинико-социальные аспекты. Пути оздоровления / В.Ю. Альбицкий, А.А. Баранов. – Саратов, 1986. – 165 с.
5. Самсыгина Г.А. Проблемы диагностики и лечения часто болеющих детей на современном этапе / Г.А. Самсыгина, Г.С. Коваль // Педиатрия им. Г.Н. Сперанского. – 2010. – Т. 89, № 2. – С. 137–145.
6. Василевский И.В. Реабилитация часто болеющих детей: учеб-метод пособие. – Минск: БелМАПО, 2006. – 44 с.
8. Микробиологические методы исследования биологического материала: инструкция по применению: утв. М-вом здравоохранения Республики Беларусь 19.03.2010. – Минск, 2010. – 129 с.
9. Введение в клиническую микробиологию / А.Г. Бойцов [и др.]. – СПб.: Изд-во СПбГМА им. И.И. Мечникова, 1999. – 115 с.
10. Влияние интерферона I типа на персистенцию стафилококка и некоторые показатели иммунореактивности организма / И.Я. Спивак [и др.] // Журнал микробиологии, эпидемиологии и иммунобиологии. – 1984. – № 11. – С. 74–77.
11. Лутовина, О.В. Состояние микробиоценозов кишечника и ротоглотки у часто и длительно болеющихреспираторнымизаболеваниями детей раннего возраста // Вестник новых медицинских технологий. – 2008. – Т. 15, № 3. – С. 56–60.
12. Микробиоценоз ротоглотки и кишечника у детей, посещающих дошкольные учреждения / Л.В. Феклисова [и др.] // Эпидемиология и инфекционные болезни. – 2007. – № 4. – С. 14–18.
Уменьшение количества устойчивых к антибиотикам штаммов на фоне приема циклоферона, несомненно, представляется весьма интересным и важным эффектом ввиду всеобщей тенденции к развитию резистентности к используемым в повседневной практике антибактериальным препаратам.
В группу часто болеющих детей (ЧБД) входят на том или ином возрастном этапе от 15 до 75 % детской популяции, в связи с чем,частые респираторные заболевания является актуальной проблемой педиатрии. К категории ЧБД относят детей, страдающих повторными острыми респираторными заболеваниями (ОРЗ) свыше 4–6 раз в год, имеющих инфекционный индекс от 1,1 до 3,5. Среди всей популяции ЧБД выделяют категорию ложно болеющих с индексом резистентности от 0,3 до 0,49, а к категории истинно часто болеющих детей, относят часто болеющих детей при индексе резистентности 0,5 и выше 2.
Система иммунитета в детском возрасте характеризуется относительно пониженным уровнем нейтрофилов основных эффекторных клеток естественного (врожденного) звена иммунного ответа и низкой продукцией иммуноглобулинов на фоне повышенного числа Т- и В-лимфоцитов, что свидетельствует о неполноценности адаптивного (приобретенного) звена, а в совокупности с анатомо-физиологическими особенностями органов дыхания, недостаточными гигиеническими навыками и значительным контактом с окружающим миром делает детей дошкольного возраста особенно уязвимыми для инфекций [5, 6].
После перенесенного эпизода ОРЗ дисбиотические изменения микрофлоры зева сохраняются до 1,5 месяцев. Вирусы являются этиологическими агентами более чем в 80 % случаев ОРЗ для их лечения даже при неосложнённом течении, используются антибактериальные (АБ) препараты, что способствует усугублению дисбиоза. 35 % детей, относящихся к группе ЧБД, имеют хроническую ЛОР патологию. Не менее, чем в 30 % случаев, ЧБД являются носителями β-гемолитического стрептококка группы А, а 50 % детей являются носителями золотистого стафилококка [11, 12].
Введение интерферона 1 типа в экспериментальных исследованиях сокращало сроки персистенции золотистого стафилококка и количество персистирующих бактерий, способствуя нормализации показателей иммунного статуса, повышая выживаемость животных при стафилококковой инфекции. Иммуномодулирующий эффект интерферона II типа ещё более выражен,γ-интерферон активно стимулирует макрофаги, усиливает экспрессию молекул МНС I и II, стимулирует дифференцировку Т-хелперов нулевого типа в Т-хелперы первого типа.
В связи с этим, нами выбран метилглюкаминакридоноацетат- ранний индуктор смешанного (Th1/Th2) типа иммунного ответа, увеличивающий функциональную активность фагоцитирующих клеток и обеспечивающий их бактерицидность[2, 4, 5].
Напомним механизм действия препарата, описанный нами ранее[1].
Циклоферон как индуктор интерферонов. Продукция эндогенного интерферона под воздействием циклоферона обусловлена наличием чувствительных клеточных систем, способных синтезировать интерферон в ответ на индуктор.Иммунокомпетентные клетки (моноциты, лимфоциты, макрофаги, купферовские клетки печени) способны индуцировать интерферон. Циклоферон индуцирует ранний интерферон.
Одним из важных направлений формирования полноценного иммунного ответа является регуляция синтеза ИФН-g. Продукция ИФН-γTh1 осуществляется благодаря стимуляции ИЛ-12, ИЛ-2 и ФНО-a, а ИЛ-18, являясь потенциальным индуктором синтеза ИФН-g, выступает в роли синергиста ИЛ-12 и оба этих цитокина лидируют в быстрой активации моноцит/макрофагальной системы посредством стимуляции выработки ИФН-g, который также стимулируется при действии циклоферона.
Иммунотропная активность циклоферона. В основе развития иммунного дисбаланса лежат функциональная клеточная блокада (блокада рецепторов и механизмов передачи сигналов); дисбаланс клеточных субпопуляций – хелперов Th1/Th2, супрессоров/цитотоксических лимфоцитов, хелперов/эффекторов и другие. В экспериментальных исследованиях циклоферон индуцировал в линии клеток К562 иммунного происхождения синтез мРНКинтерферона-гамма и IL-2, а также IL-1 и IL-6 (представители гуморального Th-2 типа иммунитета). При этом, циклоферон не индуцирует мРНК цитокинов в линиях клеток неиммунного происхождения (MG-63), что свидетельствует о высокой тропности циклоферона к клеткам иммунной системы.Введение циклоферона приводит к существенным изменениям в составе субпопуляций лимфоцитов (повышается относительное и абсолютное число исходно сниженных общих Т-лимфоцитов (СD3 +), Т-хелперов (СD4 +), иммунорегуляторного индекса и естественных киллеров (СD16 +); снижение СD8 + и СD72 + – лимфоцитов). Повышается уровень иммуноглобулина А (IgA) при одновременном снижении концентрации иммуноглобулина Е (IgE). Циклоферон увеличивает провоспалительный потенциал нейтрофилов периферической крови, а также функциональную активность фагоцитирующих клеток за счет генерации активных форм кислорода, обеспечивая бактерицидность клеток.
Циклоферон как стимулятор образования дефект-интерферирующих вирусных частиц. В ряде случаев размножение вирусов подавляется дефектными частицами, которые известны как дефект-интерферирующие частицы (ДИ-частицы). ДИ-частицы препятствуют нормальной репродукции вируса, что ведет к подавлению его цитоцидного действия. Накопление достаточного количества ДИ-частиц в инфицированном организме приводит к самоограничению инфекции, при этом, дефектные частицы сохраняют цитокин- и интерферон (ИФН)-индуцирующие свойства, стимулируя неспецифический иммунитет.
Противовирусная активность циклоферона. Циклоферон оказывает непосредственное противовирусное действие, восстанавливает способность лейкоцитов крови к синтезу интерферона, подавляет проникновение вирусной частицы в клетку путем ингибирования синтеза мРНК и трансляции вирусных белков, а также через блокирование процессов сборки вирусной частицы и ее выхода из инфицированной клетки. В результате связывания молекулы интерферона с интерфероновыми рецепторами на поверхности клеток происходит активация генов, локализованных в 21 хромосоме у человека. Этот процесс сопровождается формированием более 20 новых внутриклеточных белков, способствующих возникновению резистентности к вирусам. Данные белки отсутствуют в клетках, не подвергшихся воздействию интерферона. К этим белкам относят фермент А-синтетазу, осуществляет расщепление мРНК путем подавления удлинения полипептидных цепей. Также под действием данного фермента продуцируются олигомеры адениловой кислоты, которые блокируют синтез вирусных белков, что приводит к нарушению трансляции с вирусной РНК.
Вышесказанное, определило цель исследования – установить способность меглюминакридонацетата (циклоферона) индуктора раннего эндогенного интерферона смешанного типа влиять на микробиологический пейзаж поверхности миндалин часто болеющих детей.
Материалы и методы исследования
Под наблюдением находилось 16151 детей дошкольного и школьного возраста, которым в период повышенного сезонного подъема респираторной заболеваемости была проведена экстренная неспецифическая профилактика повторных ОРЗ (эпидемиологическое исследование).Препарат назначался детям в соответствии с указаниями инструкции по медицинскому применению.
Также в сезон 2010/11 года наблюдали 68 детей (32 девочки и 36 мальчиков) в возрасте от 4 до 7 лет, медиана (Ме) – 5,1 лет, нижняя квартиль (Q25) – 4,5 года, верхняя квартиль (Q75) – 5,8 лет, посещающих специализированные детские сады (№ 94 и № 95) для часто болеющих детей.
При получении информированного согласия от законных представителей ребенка, отсутствии острых инфекционных заболеваний, наличии в анамнезе 6-и и более эпизодов ОРЗ за последний год, ребенок включался в протокол врачебного наблюдения.
Препарат циклоферон (таблетки по 150 мг) назначали двумя курсами (с перерывом в 1 месяц) 10 мг/кг массы тела, согласно инструкции по медицинскому применению препарата. Двукратно, до начала приема препарата и через 2 недели после окончания приема, выполнили посев микрофлоры с поверхности миндалин. Материал – слизь с поверхности миндалин – брали стерильными ватными тампонами натощак и помещали в универсальную гелевую транспортную среду Стюарта фирмы Copan (Италия). В течение 2 часов полученный материал доставлялся в лабораторию. Для идентификации микрофлоры и определения её чувствительности к антибактериальным препаратам была использована автоматизированная система VITEC-2 фирмы Bio Merieux (Франция).Тестирование чувствительности к антибактериальным препаратам осуществлялось методом минимальных ингибирующих концентраций [8, 9].
Статистический анализ проводился с использованием стандартного пакета прикладных программ Statistica версия 6.0. При сравнении двух независимых групп изучаемой переменной использовали тест Манна-Уитни (U), в случае зависимости групп – тест Вилкоксона (Z). При сравнении долей (процентов) использовался метод Фишера. Нулевая гипотеза об отсутствии различий между переменными отвергалась на уровне значимости α = 0,05 (p £ 0,05) для каждого из использованных тестов. Для представления результатов статистической обработки использовали величины медианы (Me), верхней (Q75) и нижней квартилей (Q25) в формате Me (Q25-Q75).
Результаты исследования и их обсуждение
В раннее проведенных исследованиях[2] нами показано, что циклоферон используется как средство неспецифической профилактики ОРЗ/ОРВИ и гриппа у детей во время эпидемического подъема заболеваемости. Под наблюдением находилось 16151 человек, из них 9299 получали препарат, а 6852 – плацебо (дети в возрасте от 10 до 16 лет). Кроме этого выборка в 1255 детей включала возраст от 7 до 10 лет. Препарат получали 524 ребенка, а 731 человек получали активное плацебо. 114 детей в возрасте от 4 до 7 лет получали циклоферон, в сравнении с ревитом. Индекс эффективности составил 2,9 (колебания от 2,4 до 3,4), показатель защиты 62,8 % (колебания от 58,5 до 67,1 %), снижение заболеваемости более чем в 2,9 раза. Установлена профилактическая эффективность препарата (снижение заболеваемости ОРЗ и гриппом наблюдалось в 2,9–7,2 раза для микст-инфекций респираторного тракта). Отмечена минимизация симптомов интоксикации, выраженности и продолжительности катаральных явлений, отсутствие нежелательных реакций на препарат. Цитопротекторное действие, проявлялось снижением степени деструкции клеток эпителия, усилением в 4,5 раза активности факторов (лизоцим, секреторный иммуноглобулин А) местной неспецифической резистентности. Показано снижение кратности (в 4,1 раза) и длительности острых (в 1,7 раза) эпизодов ОРЗ/ОРВИ, частоты развития аллергии в 4,6 раза, уменьшение проявлений синдрома лимфоаденопатии, астенического синдрома, осложненного течения заболевания, восстановление нормальной флоры слизистых оболочек носа и зева. Выявлено снижение заболеваемости ОРЗ и гриппом (в 2,4–4,4 раза) во вновь организованных коллективах, как у детей, так и у подростков. При проведении курса циклоферона наблюдалась смена структуры ОРЗ среди заболевших. Увеличивались легкие (в 4,3 и более раза), уменьшались тяжелые и осложненные формы заболеваний, число заболевших, получавших циклоферон составило 6 %. Наблюдалось легкое течение ОРЗ, число пропущенных дней по болезни (в пересчете на 1 ребенка) составило 4,8 дня. Среди детей, не получавших средств неспецифической профилактики, уровень заболеваемости составил 58 %, при заболеваемости в 19 % у детей, получавших гриппол. Наблюдая 116 детей в возрасте до 14 лет с неосложненным и осложненным (со стороны ЛОР-органов) течением ОРВИ, установлено, что в 95,7 % случаев заболевание начиналось с лихорадки, симптомов интоксикации, проявляющихся вялостью, адинамичностью, бледностью кожных покровов, головной болью, судорожным синдромом, рвотой. У 17 детей выявлен бронхит, а при отоларингологическом осмотре выделены наблюдавшиеся группы детей: 1-я – ОРВИ с превалированием клиники ринофарингита; 2-я – с наличием острого катарального среднего отита (ОКСО); 3-я – острого гнойного среднего отита (ОГСО); 4-я – острого катарального синусита (ОКС) и 5-я – острого гнойного синусита (ОГС). Вирусная этиология ОРВИ из 116 обследованных детей, была подтверждена в 74,1 % случаев.
Оценка неспецифической резистентности слизистой оболочки, изучена по показателям фагоцитарной активности, фагоцитарного числа, степени завершенности фагоцитоза (на слизистой ротоглотки и в крови), также оценивался уровень SigА. Выявлено снижение фагоцитарной активности нейтрофилов (ФА) и фагоцитарного числа (ФЧ) относительно нормы в начале заболевания, но степень снижения была различна. В группе больных гриппом А показатели достоверно ниже, чем в группе сравнения. Активность фагоцитов падает более чем в 2 раза от нормы как в крови, так и на слизистых оболочках. При выявлении катарального отита или синусита на фоне гриппа А, ФА и ФЧ на слизистых выше, чем в крови. При парагриппозной инфекции эти процессы активированы в крови. ОГСО сопровождается теми же изменениями, но в меньшей степени выраженности. ОГС при парагриппе протекает с высокой активностью фагоцитоза в крови.
В мазках из зева, полученных до лечения, у наблюдаемых нами 68 детей, относящихся к часто болеющим, выделены представители 25 семейств, родов и видов микроорганизмов, но наиболее частой находкой явился золотистый стафилококк, обнаруживаемый в титрах 1∙104–1∙106 у половины обследованных детей. У 44 детей (64,71 %) идентифицирована 1 культура, у 14 (20,58 %) – 2, у 9 (13,24 %) – 3, у 1 (1,47 %) – 4 культуры бактерий. При повторном обследовании спектр микроорганизмов значительно сузился, обнаружены представители только 16 семейств, родов и видов микроорганизмов, как и при первом исследовании, золотистый стафилококк выявлялся у половины обследованных, но в более низких титрах (рисунок). У 11 детей (25,58 %) рост бактерий отсутствовал, у 24 детей (55,81 %) идентифицирована 1 культура, у 6 (13,96 %) – 2, у 2 (13,96 %) – 3 культуры бактерий.
При анализе чувствительности к антибиотикам золотистого стафилококка, высеянного с поверхности миндалин, при повторном исследовании установлено уменьшение доли метициллин-, рифампицин-, эритромицин-, тетрациклин резистентных штаммов и достоверное снижение процента штаммов устойчивых к бензилпенициллинам, по сравнению с исходными показателями.
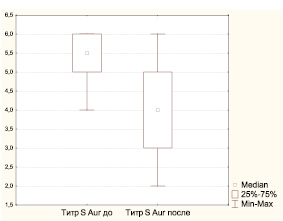
Динамика титра S. аureus у ЧБД, принимавших циклоферон
Ингибирование циклофероном персистентного потенциала внутриклеточных патогенов способствует их элиминации при острых и хронических инфекционных процессах [7].
Уменьшение количества устойчивых к антибиотикам штаммов на фоне приема циклоферона, несомненно, представляется весьма интересным и важным эффектом ввиду всеобщей тенденции к развитию резистентности к используемым в повседневной практике антибактериальным препаратам.
Таким образом, препарат циклоферон можно рекомендовать к применению в составе комплексной терапии и для реабилитации часто и длительно болеющих детей.
Установлена профилактическая эффективность препарата (снижение заболеваемости ОРЗ и гриппом наблюдалось в 2,9–7,2 раза для микст-инфекций респираторного тракта). Индекс эффективности составил 2,9 (колебания от 2,4 до 3,4), показатель защиты 62,8 % (колебания от 58,5 до 67,1 %), снижение заболеваемости более чем в 2,9 раза.
Отмечена минимизация симптомов интоксикации, выраженности и продолжительности катаральных явлений, отсутствие нежелательных реакций на препарат. Цитопротекторное действие, проявлялось снижением степени деструкции клеток эпителия, усилением в 4,5 раза активности факторов (лизоцим, секреторный иммуноглобулин А) местной неспецифической резистентности. Показано снижение кратности (в 4,1 раза) и длительности острых (в 1,7 раза) эпизодов ОРЗ/ОРВИ, частоты развития аллергии в 4,6 раза, уменьшение проявлений синдрома лимфоаденопатии, астенического синдрома, осложненного течения заболевания, восстановление нормальной флоры слизистых оболочек носа и зева. Выявлено снижение заболеваемости ОРЗ и гриппом (в 2,4–4,4 раза) во вновь организованных коллективах, как у детей, так и у подростков.
Прием препарата снижает видовое разнообразие микрофлоры поверхности миндалин, уменьшает обсеменённость поверхности миндалин микрофлорой, в том числе золотистым стафилококком, приводит к значимому снижениюштаммов золотистого стафилококка, устойчивых к бензилпенициллинам.

2. Бухарин О. В. Связь биологических свойств стафилококков с течением гнойных синуситов / О. В. Бухарин, О. Л. Чернова, С. Б. Киргизова и др. // Вестник оториноларингологии. – 1998. – № 5. – С. 16-18.
3. Бухарин О. В. Способ санации стафилококковых бактерионосителей / О. В. Бухарин, О. Л. Карташова, С. Б. Киргизова и. др.; Патент № 2441656, опубл. 10.02.2012. Бюл. № 4.
4. Бухарин О. В. Экология микроорганизмов человека / О. В. Бухарин, А. В. Валышев, Ф. Г. Гильмутдинова и др. – Екатеринбург: УрО РАН, 2006. – 479 с.
5. Бухарин О. В., Усвяцов Б. Я. Бактерионосительство (медико-экологический аспект). – Екатеринбург: УрО РАН, 1996. – 206 с.
6. Бухарин О. В., Усвяцов Б. Я., Карташова О. Л. Биология патогенных кокков. – М.: Меди-цина; Екатеринбург: УрО РАН, 2002. – 282 с.
7. Диагностика и санация стафилококковых бактерионосителей: Методические рекоменда-ции. – М.: Федеральный центр госсанэпиднадзора Минздрава России, 2001. – 15 с.
9. Киргизова С. Б. Факторы персистенции Staphylococcus aureus под воздействием препара-тов индукторов эндогенного интерферона // Фундаментальные исследования. – 2012. – № 11/2. – С. 296-298.
10. Романцов М. Г. Эффективность циклоферона при вирусных и бактериальных заболева-ниях у детей (клинический обзор) / М. Г. Романцов, Л. Г. Горячева, М. К. Бехтерева и др. // Антибиотики и химиотерапия. – 2010. – Т. 55, № 11-12. – С. 39-51.
Проблема профилактики стафилококковых инфекций, вызываемых Staphylococcus aureus, по-прежнему остается актуальной в современной медицине и практическом здравоохранении. Коагулазоположительные стафилококки являются обитателями кожи и слизистых оболочек. С одной стороны, они встречаются у здоровых лиц - бактерионосителей, с другой - являются опасными микроорганизмами, способными вызывать тяжелейшие инфекции [6]. Известно, что при бактерионосительстве имеет место перестройка механизмов защиты макроорганизма, т.е. создаются условия для выживания (персистирования) возбудителя и дальнейшего развития резидентного типа бактерионосительства.
Санация организма от бактерионосительства - одна из труднейших проблем современной медицины. В качестве показаний для проведения санационных мероприятий на первый план выдвигается не столько этиологические особенности данного состояния, связанного с переживанием на слизистой оболочке верхних дыхательных путей Staphylococcus aureus, сколько более принципиальные критерии, определяющие опасность данного состояния для самого носителя или его окружения [5].
В связи с этим важное практическое значение приобретает разработка эффективных и безопасных методов санации стафилококкового бактерионосительства и, соответственно, профилактики стафилококковых инфекций, при этом важно, чтобы способ санации был не только эффективен, но и обладал длительным пролонгированным действием.
Материалы и методы исследования
В рамках настоящего исследования первичное обследование (бактериологический посев) проводили не ранее, чем за одну неделю до начала санации, второе обследование в течение одной недели после окончания санации, третье - через месяц, а четвертое обследование (катамнестическое) в срок шесть месяцев после санации. В качестве носителей патогенных стафилококков определены лица, у которых из носовой полости выделяли штаммы Staphylococcus aureus резидентного типа. Диагностику типа носительства стафилококков проводили с помощью разработанных диагностических моделей, построенных на информативных тестах, дифференцирующих резидентную и транзиторную стафилококковую микрофлору [7].
Результаты исследования и обсуждение
В ходе первичного бактериологического обследования 59 человек на назальное носительство Staphylococcus aureus было выявлено 16 (27,1 %) бактерионосителей резидентного типа. Все обследуемые лица являлись бессимптомными носителями золотистого стафилококка. Для исключения развития дисбиотических состояний санировать необходимо лишь резидентных бактерионосителей, т.е. лиц, длительно и упорно выделяющих патогенные стафилококки в окружающую среду, тогда как микрофлора транзиторного типа элиминирует из организма в результате гибели или бактериовыделения, и проведение в отношении нее санирующих мероприятий не требуется [5]. В ходе первичного бактериологического обследования от постоянных бактерионосителей были изолированы резидентные варианты S. aureus, обладающие показателем микробной обсемененности, в диапазоне от 4,5 до 5,6 lg КОЕ.
Первое обследование, проведенное через неделю после санации, показало, что S. аureus был изолирован только у шести из 16 санируемых лиц (в 37,5 % случаев), при этом у 4-х обследуемых выделяли смешанную культуру золотистого и коагулазонегативных стафилококков (S.epidermidis, S.hominis), причем штаммы S. аureus обладали достаточно низкими показателем микробной обсемененности (1,0-1,5 lg КОЕ), и тип носительства золотистых стафилококков, согласно использованной методике определения характера носительства, изменился с резидентного на транзиторный, а у 10 человек произошла полная элиминация S. аureus и замена патогенного стафилококка на Staphylococcus epidermidis - представителя нормофлоры данного биотопа. Эффективность проведенной санации резидентного носительства S. aureus составила 62,5 %.
При изучении пролонгированного действия препарата оказалось, что санирующий эффект у лиц свободных от носительства патогенных стафилококков через месяц сохранился, а процент обнаружения S. аureus в исследуемой популяции снизился до 25,0 % (4 человека, из которых у 2 был диагностирован транзиторный тип носительства). Микробиологический пейзаж слизистых оболочек лиц свободных от носительства S. аureus был представлен коагулазонегативными стафилококками (S.epidermidis, S.capitis, S.hominis, S.warneri) и другими представителями нормофлоры.
Рецензенты:
Резюме. Для оценки способности препарата циклоферон влиять на микробиологический пейзаж поверхности миндалин у часто болеющих детей (ЧБД) была изучена микрофлора миндалин до и после стандартного курса этого препарата у 68 дошкольников, относящихся к категории ЧБД. Установлено, что микробный пейзаж поверхности миндалин детей после курса циклоферона характеризовался уменьшением разнообразия микрофлоры и снижением титра бактерий, в том числе и золотистого стафилококка, а также уменьшением количества штаммов, резистентных к бензилпенициллину, клиндамицину и ванкомицину. Таким образом, препарат циклоферон можно рекомендовать для реабилитации ЧБД.
Ключевые слова: часто болеющие дети, циклоферон, микрофлора миндалин.
Введение.
По современным литературным данным в группу часто болеющих детей (ЧБД) входят на том или ином возрастном этапе от 15 до 65% детской популяции [10], в связи с этим частые респираторные заболевания является актуальной проблемой педиатрии [4, 9]. В 1986 году В.Ю. Альбицким и А.А. Барановым была предложены критерии включения детей в группу часто болеющих. К (ЧБД) относят детей, страдающих острыми респираторными заболеваниями (ОРЗ) свыше 4-х раз в год в возрасте до 1 года, 6-и раз – в 1-3 года, 5-и раз – в 4-5 лет и 4-х раз – после 5 лет [1].
Система иммунитета в детском возрасте характеризуется относительно пониженным уровнем нейтрофилов – основных эффекторных клеток врожденного звена иммунного ответа, а также низкой продукцией иммуноглобулинов на фоне повышенного числа Т- и В-лимфоцитов, что свидетельствует о неполноценности адаптивного звена [8]. Это в совокупности с анатомо-физиологическими особенностями органов дыхания [6], недостаточными гигиеническими навыками и расширением контактов с окружающим миром делает детей дошкольного возраста особенно уязвимыми для инфекций.
Несмотря на то, что вирусы являются этиологическими агентами более чем в 80% случаев ОРЗ [2], по данным литературы в практической медицине для их лечения в большинстве случаев, даже при неосложнённом течении, используются антибактериальные (АБ) препараты [13, 14], что способствует развитию дисбиоза. Показано, что после перенесенного эпизода ОРЗ дисбиотические изменения микрофлоры зева сохраняются до 1,5 месяцев [11]. Гибель резидентной микрофлоры приводит к заселению биотопа условно-патогенными микроорганизмами. Существуют данные, что 35% детей, относящихся к группе ЧБД, имеют хроническую ЛОР патологию [10]. Не менее, чем в 30% случаев, ЧБД являются носителями β-гемолитического стрептококка группы А [3, 7]. Не менее 50% детей являются носителями золотистого стафилококка [7, 9].
В эксперименте на мышах было продемонстрировано, что введение интерферона 1 типа сокращало сроки персистенции золотистого стафилококка и количество персистирующих бактерий, способствовало нормализации показателей иммунного статуса и повышению выживаемости при стафилококковой инфекции [5]. Иммуномодулирующий эффект интерферона II типа ещё более выражен. Установлено, что ?-интерферон активно стимулирует макрофаги, усиливает экспрессию молекул МНС I и II, стимулирует дифференцировку Т-хелперов нулевого типа в Т-хелперы первого типа [12].
Приведенное выше факты определили цель нашего исследования: оценить способность индуктора эндогенного интерферона – препарата циклоферон влиять на микробиологический пейзаж поверхности миндалин у часто болеющих детей.
Материалы и методы.
Было обследовано 68 детей (32 девочки и 36 мальчиков) в возрасте от 4 до 7 лет, медиана (Ме) – 5,1 лет, нижняя квартиль (Q25) – 4,5 года, верхняя квартиль (Q75) – 5,8 лет. Все дети посещали специализированные детские сады (№94 и №95) г. Гродно для ЧБД. Критериями включения в исследование были добровольное информированное согласие законных представителей детей, возраст 4-7 лет, отсутствие острых инфекционных заболеваний на момент обследования, наличие в анамнезе 6-и и более эпизодов ОРЗ за предшествующие 12 месяцев. Обследование включало клинический осмотр детей, анкетирование родителей и выкопировку данных из амбулаторной карты (форма №112-у).
Двукратно, до начала приема препарата циклоферон и через 2 недели после окончания приема детям выполнили посев микрофлоры с поверхности миндалин. Материал – слизь с поверхности миндалин – брали стерильными ватными тампонами натощак и помещали в универсальную гелевую транспортную среду Стюарта фирмы Copan (Италия). В течение 2 часов полученный материал доставлялся в лабораторию. Для идентификации микрофлоры и определения её чувствительности к антибактериальным препаратам была использована автоматизированная система VITEC-2 фирмы BioMerieux (Франция). Тестирование чувствительности к антибактериальным препаратам осуществлялось методом минимальных ингибирующих концентраций.
Препарат циклоферон (таблетки по 0,15) назначался двумя курсами (с перерывом в 1 месяц) по схеме, указанной в аннотации: на курс по 1 таблетке 1 раз в день за полчаса до еды в 1, 2, 4, 6, 8, 11, 14, 17, 20 и 23 дни.
Статистический анализ проводился с использованием стандартного пакета прикладных программ Statistica версия 6.0. При сравнении двух независимых групп изучаемой переменной использовали тест Манна-Уитни (U), в случае зависимости групп – тест Вилкоксона (Z). При сравнении долей (процентов) использовался метод Фишера (Fisher exact test). Нулевая гипотеза об отсутствии различий между переменными отвергалась на уровне значимости α=0,05 (p ≤0,05) для каждого из использованных тестов. Для представления результатов статистической обработки использовали величины медианы (Me), верхней (Q75) и нижней квартилей (Q25) в формате Me (Q25-Q75).
Результаты и обсуждение.
В мазках из зева, полученных до лечения, были выделены представители 25 семейств, родов и видов микроорганизмов (таблица 1). Наиболее частой находкой был золотистый стафилококк. В титрах 1*104 - 1*106 он обнаруживался практически у половины обследованных. У 44 детей (64,71%) была идентифицирована 1 культура, у 14 (20,58%) – 2, у 9 (13,24%) – 3, у 1 (1,47%) – 4 культуры бактерий.
Таблица 1.
Микрофлора с поверхности миндалин ЧБД, выделенная при первом обследовании
| Название | Количество культур | % носителей |
|---|---|---|
| Aerococcus viridans | 1 | 1,47 |
| Candida famata | 3 | 4,41 |
| Dermococcus nishinomiyaensis | 1 | 1,47 |
| Erisipelotrix rusiopathiae | 4 | 5,88 |
| Fackmalia hominis | 1 | 1,47 |
| Granulicatella adiacens | 3 | 4,41 |
| Granulicatella elegans | 1 | 1,47 |
| Kocuria kristinae | 1 | 1,47 |
| Kocuria rosea | 4 | 5,88 |
| Leuconostoc mesenterioides | 1 | 1,47 |
| Leuconostoc mesenteroides cremosis | 3 | 4,41 |
| Rothia mucilaginosa | 1 | 1,47 |
| S. aureus | 33 | 48,53 |
| S. epidermidis | 1 | 1,47 |
| S. haemolyticus | 1 | 1,47 |
| S. hominis | 7 | 10,29 |
| S. ludgunensis | 3 | 4,41 |
| S. vitulinus | 1 | 1,47 |
| Serratia marcescens | 1 | 1,47 |
| Sphingomonas thalpophilium | 1 | 1,47 |
| Str. oralis | 12 | 17,65 |
| Str. parasanguinis | 2 | 2,94 |
| Str. pneumoniae | 11 | 16,18 |
| Str. salivarius | 2 | 2,94 |
| Str. spp. | 4 | 5,88 |
| Всего | 103 |
При повторном обследовании спектр микроорганизмов значительно сузился. В мазках с поверхности миндалин у детей были обнаружены представители только 16 семейств, родов и видов микроорганизмов (таблица 2). Как и при первом исследовании, золотистый стафилококк выявлялся практически у половины обследованных, но в более низких титрах (по сравнению с исходными р=0,04) (рисунок 1). У 11 детей (25,58%) рост бактерий отсутствовал, у 24 детей (55,81%) была идентифицирована 1 культура, у 6 (13,96%) – 2, у 2 (13,96%) – 3 культуры бактерий.
Таблица 2.
Микрофлора с поверхности миндалин ЧБД, выделенная при повторном обследовании
| Название | Количество культур | % носителей |
|---|---|---|
| Нет роста | 11 | 25,58 |
| Acinetobacter ursingii | 1 | 2,32 |
| Candida | 3 | 6,98 |
| E.coli | 1 | 2,32 |
| Enterobacter cloacae | 2 | 4,65 |
| Kocuria roseae | 1 | 2,32 |
| Micrococcus luteus | 1 | 2,32 |
| Pantoteae spp. | 1 | 2,32 |
| Ps.aeruginosa | 1 | 2,32 |
| S.aureus | 19 | 44,19 |
| S.epidermidis | 1 | 2,32 |
| S.warneri | 1 | 2,32 |
| Stenotrophomonas maltophyla | 1 | 2,32 |
| Str.oralis | 3 | 6,98 |
| Str.parasanguinis | 1 | 2,32 |
| Str.sanguinis | 2 | 4,65 |
| Str.spp. | 3 | 6,98 |
| Всего | 42 | 100,0 |
Рисунок 1. Динамика титра S. aureus у ЧБД, принимавших циклоферон
При анализе чувствительности к антибиотикам золотистого стафилококка, высеянного с поверхности миндалин ЧБД, при повторном исследовании было установлено несущественное уменьшение доли метициллин-, рифампицин-, эритромицин-, тетрациклин резистентных штаммов и достоверное снижение процента штаммов устойчивых к бензилпенициллину, ванкомицину и клиндамицину по сравнению с исходными показателями (таблица 3).
Таблица 3.
Доля (%) S. aureus, резистентных к антибиотикам до и после лечения
| Антибиотики | До приема циклоферона | После приема циклоферона | Р |
|---|---|---|---|
| MRSA | 10,00 | 5,26 | - |
| Бензилпенициллин | 84,09 | 63,64 | 0,05 |
| Ванкомицин | 26,67 | 4,55 | 0,03 |
| Клиндамицин | 20,93 | 0,0 | 0,02 |
| Линезолид | 0,0 | 0,0 | - |
| Моксифлоксацин | 0,0 | 0,0 | - |
| Оксациллин | 15,56 | 4,55 | - |
| Рифампицин | 4,44 | 0,0 | - |
| Эритромицин | 11,11 | 9,09 | - |
| Гентамицин | 0,0 | 0,0 | - |
| Ципрофлоксацин | 0,0 | 0,0 | - |
| Левофлоксацин | 0,0 | 0,0 | - |
| Тетрациклин | 6,67 | 0,0 | - |
| Нитрфурантоин | 0,0 | 0,0 | - |
| Бисептол | 0,0 | 0,0 | - |
| Дальфопристин | 0,0 | 0,0 | - |
На фоне приема циклоферона изменилась не только обсемененность поверхности миндалин золотистым стафилококком, но и непатогенной микрофлорой. При повторном обследовании среднее количество обнаруженных непатогенных видов бактерий и их титры были достоверно ниже (в обоих случаях p
Рисунок 2. Количество непатогенных видов микроорганиз
Рисунок 3. Динамика титра непатогенной микрофлоры у ЧБД, принимавших циклоферон
Поскольку циклоферон не обладает прямой антибактериальной активностью, можно предположить, что снижение обсемененности и видового разнообразия микроорганизмов поверхности миндалин обусловлено иммунокоррегирующими свойствами этого препарата.
Уменьшение количества устойчивых к антибиотикам штаммов на фоне приема циклоферона, несомненно, представляется весьма интересным и важным эффектом ввиду всеобщей тенденции к развитию резистентности к используемым в повседневной практике антибактериальным препаратам. Таким образом, препарат циклоферон можно рекомендовать к применению в составе комплексной терапии и для реабилитации ЧБД.
Выводы
Прием двух курсов препарата циклоферон (с перерывом в 1 месяц) по схеме, указанной в аннотации снижает у ЧБД видовое разнообразие микрофлоры поверхности миндалин, достоверно уменьшает обсеменённость поверхности миндалин микрофлорой, в том числе золотистым стафилококком.
Приём препарата циклоферон приводит к значимому снижению количества штаммов золотистого стафилококка устойчивых к бензилпенициллину, ванкомицину и клиндамицину.
Список литературы
В. Ю. Альбицкий, А. А. Баранов, Частоболеющие дети. Клинико-социальные аспекты. Пути оздоровления, Саратов (1986). А. Г.
Бойцов В.П. Иванов, О.Н. Ластовка, А.А. Порин, Введение в клиническую микробиологию, издательство СПбГМА им. И.И. Мечникова, Санкт Петербург (1999).
И. В. Василевский, Реабилитация часто болеющих детей: учебебно-методическое пособие, БелМАПО, Минск (2006).
И. В. Василевский, Медицина, № 2, 93 – 99 (2008).
Н. Я. Спивак, В.Г. Лисовенко, В.С. Зуева [и др.], Журнал микробиологии, эпидемиологии и иммунобиологии, № 5, 74 – 77 (1984).
Т. В. Капитан, Пропедевтика детских болезней с уходом за детьми, МЕДпресс-информ, Москва (2004).
О. В. Лутовина, Вестник новых медицинских технологий, 15(3), 56 – 60 (2008).
С. А. Ляликов, Медико-биологические проблемы жизнедеятельности, 5(1), 109 – 115 (2011).
Т. П. Маркова, Д. Г. Чувиров, Ремедиум, № 6, 26 – 28 (2010).
Г. А. Самсыгина, Г. С. Коваль, Педиатрия им. Г.Н. Сперанского, 89(2), 137 – 145 (2010).
Л . В. Феклисова, Е.Р. Мескина, Е.А. Воропаева, Л.В. Пожалостина [и др.], Эпидемиология и инфекционные болезни, № 4, 14 – 18 (2007).
А. А. Ярилин, Иммунология, Медицина, Москва (1999).
R. Gonzales, D.C. Malone, J.H. Maselli, M.A. Sande, Clin. Infect. Dis., 33, 757 – 762 (2001).
H. Goossens, M. Ferech, R.V. Stichele, M. Elseviers, The Lancet, 365, 579 – 587 (2005).
В.К. ТАТОЧЕНКО, докор медицинских наук, профессор, заслуженный деятель науки РФ, член группы советников ВОЗ, эксперт ВОЗ. АНТИБАКТЕРИАЛЬНОЕ ЛЕЧЕНИЕ ОСТРЫХ ЗАБОЛЕВАНИЙ ВЕРХНИХ ДЫХАТЕЛЬНЫХ ПУТЕЙ У ДЕТЕЙ
Основная масса (92-94%) острых заболеваний верхних дыхательных путей у детей обусловливается респираторными вирусами (ОРВИ) и в антибактериальном лечении не нуждается. К сожалению, частота назначения противомикробных препаратов у детей с ОРВИ достигает в поликлиниках 65-85%, а в некоторых стационарах 98%. Конечно, в некоторых случаях антибиотики назначать приходится и при неуверенности в бактериальном происхождении болезни из-за сложности диагностики, но лечить ими всех подряд - тактика негодная.
Такую частоту иногда пытаются объяснить попыткой предотвратить бактериальные осложнения вирусной инфекции; эта тактика, как правило, не дает результатов по двум причинам. Во-первых, бактериальные осложнения развиваются обычно быстро, уже в первый день заболевания, на фоне вызываемых вирусами нарушений мукоцилиарного клиренса (система очищения дыхательных путей) и кратковременной иммуносупрессии, так что их отсутствие в начале болезни позволяет прогнозировать гладкое дальнейшее ее течение. Во-вторых, подавляемые антибиотиком чувствительные к нему представители обычной флоры дыхательных путей (пневмококки, стрептококки, гемофильная палочка - Haemophilus influenzae) быстро замещаются устойчивой флорой (стафилококки, Moraxella catarrhalis), на которую в случае развития осложнения он действовать не будет.
Какие же заболевания следует лечить антибиотиками? Очевидно, что повышение температуры, насморк, кашель, головная или мышечная боль сами по себе не являются поводом для назначения антибиотиков, так как сопровождают ОРВИ.
Ангина, острый тонзиллит, тонзил-лофарингит проявляются покраснением зева и миндалин, гнойными пробками или налетами, болью в горле при глотании. Чаще всего, особенно у детей раннего возраста, их вызывают адено- или энтеровирусы; но в возрасте старше 4-5 лет повышается доля ангин, вызванных гемолитическим стрептококком группы А, что может привести к развитию ревматизма. Для выявления стрептококка, а также для исключения дифтерии делают посевы из зева, без посева диагноз можно поставить лишь предположительно, впрочем этого достаточно для назначения антибиотика с целью профилактики ревматизма.
Ангина может сопровождаться нагноением тканей глотки (глоточный абсцесс) или вовлечением в процесс лимфатического узла, обычно у угла нижней челюсти или на шее. Увеличение узлов часто сопутствует ангине, о лимфадените говорят при его нагноении. Эти осложнения проявляются болезненностью, высокой температурой, интоксикацией.
Средний отит - самое частое заболевание маленьких детей - проявляется болями в ухе, высокой температурой, симптомами интоксикации; при перфорации барабанной перепонки видны выделения из уха. Отит вызывают пневмококки, реже стрептококки и гемофильная палочка, а у детей, получавших недавно антибиотики, - стафилококки, Moraxella catharalis.
Во многих странах мира в последнее десятилетие наблюдается рост устойчивости флоры дыхательных путей, в значительной степени в связи с неоправданно широким применением антибиотиков.
Синусит. Изменения в придаточных пазухах носа сопровождают большинство ОРВИ и не нуждаются в антибактериальном лечении. При присоединении бактериальной инфекции (гемофильная палочка, пневмококк) эти изменения сохраняются более 3 недель и обусловливают упорный насморк, заложенность носа, боли в области пазух. Стафилококковый синусит протекает остро, с покраснением и отеком мягких тканей лица и глазницы.
Острый бронхит - заболевание в основном вирусное, оно проявляется кашлем, сухими и разнокалиберными влажными хрипами, обычно невысокой температурой. Лишь в 5-15% случаев у детей дошкольного и школьного возраста, особенно в осенний период, лечение бронхита антибиотиками оправдано - это бронхиты, вызванные микоплазмой (Mycoplasma pneumoniae). Для них характерны обилие мелкопузырчатых хрипов и их асимметрия, а также наличие конъюнктивита. При сочетании бронхита с ангиной (что наблюдается нечасто) можно думать о хламидийной его этиологии (Clamidia pneumoniae). Остальные бронхиты в применении антибактериальных средств не нуждаются, в том числе и в поздние сроки, при усилении отхождения мокроты (нередко зеленоватой).
У части больных при отсутствии указанных выше достаточно легко выявляемых бактериальных заболеваний все-таки нельзя снять подозрение на наличие бактериального осложнения, прежде всего пневмонии. Диагностика пневмонии несложна при наличие характерных физикальных изменений (укорочение перкуторного звука, бронхиальное или ослабленное дыхание, мелкопузырчатые хрипы над ограниченным участком грудной клетки), но эти признаки наблюдаются далеко не всегда. Поэтому назначение антибактериальных средств оправдано и при наличии одного или нескольких следующих признаков:
- температура выше 38°С более 3 дней;
- одышка в отсутствие бронхиальной обструкции: у детей до 2 месяцев при наличии более 60 вдохов в минуту, у детей 3-12 мес - более 50 и у детей 1-3 лет - более 40;
- втяжения уступчивых мест грудной клетки или кряхтящее дыхание в отсутствие бронхиальной обструкции;
- выраженный токсикоз;
- лейкоцитоз > 12 000 в 1 мкл, >5% палочкоядерных, СОЭ >20 мм/час.
У детей с повторными синуситами и отитами, у леченных ранее антибиотиками можно ожидать устойчивости флоры (особенно гемофильной палочки, моракселл, стафилококков) к антибиотикам. Moraxella catharalis обычно устойчива к пенициллинам, но чувствительна к макролидам, цефалоспоринам 2-3-го поколения, аминогликозидам. Стафилококки помимо пенициллина и ампициллина часто резистентны к цефалоспоринам.
Эти данные позволяют сделать рекомендации по рациональному выбору антибактериального препарата. До недавнего времени отечественные педиатры отдавали предпочтение инъекционным антибиотикам, что было связано как с силой традиций, так и с нехваткой эффективных оральных препаратов. Среди последних получили распространение оральный феноксиметил-бензатин-пенициллин (оспен), новые макролиды (рокситромицин, мидекамицин и др., имеющие лучшие органолептические свойства, чем эритромицин), цефалоспорины 1-го поколения (цефалексин, цефадроксил), действующие на пневмо- и стрептококки, но они слабо или совсем не действуют на гемофильную палочку. Ампициллин, действующий на оба этих возбудителя, при приеме внутрь плохо всасывается; однако его аналог - амоксициллин имеет такой же широкий спектр противомикробного действия и прекрасно всасывается при приеме внутрь (даже при приеме вместе с пищей). Если биодоступность ампициллина составляет 40%, то амоксициллин в капсулах в кишечнике всасывается на 70%, в виде суспензии - на 80-90%, а в форме растворимых таблеток Флемоксин Солютаб - на 93%. Высокая биодоступность Флемоксина Солютаб приближена к парентеральным формам, что, с одной стороны, обеспечивает терапевтическую концентрацию препарата в очаге инфекции, с другой - позволяет значительно снизить частоту и степень выраженности такого побочного эффекта, как кишечный дисбактериоз. Неудивительно, что амоксициллин во всем мире стал наиболее широко применяемым антибиотиком при заболеваниях дыхательных путей у детей. Расширяется его использование и в России. В комбинации с клавуланатом (коамоксиклав, аугментин) амоксициллин действует и на возбудители (гемофильная палочка, стафилококк, моракселлы и др.), выделяющие фермент лактамазу, разрушающую большинство природных и полусинтетических пенициллинов.
Антибиотики при бактериальных инфекциях верхних дыхательных путей
| Форма | Возбудитель | Стартовый препарат | Замена при неэффективности |
| Отит средний острый | Пневмококк, стрептококк, гемофилюс | Внутрь: амоксициллин; оспен, макролид | Внутрь: амоксициллин/клавуланат, цефуроксим (внутрь, в/м) |
| Синусит острый негнойный | Пневмококк, гемофилюс | Внутрь: амоксициллин, амоксициллин/клавуланат | Внутрь: цефуроксим, цефаклор (внутрь, в/м), азитромицин |
| Синусит гнойный | Золотистый стафилококк | В/в, в/м: оксациллин или цефазолин + гентамицин | Линкомицин в/м или ванкомицин в/в |
| Отит, синусит рецидивирующий, леченный антибиотиками | Устойчивые стафилококк, гемофилюс, реже Moraxella catharalis | Внутрь: амоксициллин/клавуланат, внутрь или в/м цефуроксим, цефаклор | В/м: оксациллин, цефалоспорин 2-3-го поколения, в том числе в комбинации с гентамицином или др. аминогликозидом |
| Тонзиллит острый | бета-гемолитический стрептококк группы А | Внутрь: оспен, гамма-пенициллин, амоксициллин, макролид, цефалексин, цефадроксил, доксициклин (у детей старше 8 лет) 10 дней | |
| Бронхит | Вирусы | Антибактериальное лечение не проводится | |
| Бронхит | Микоплазма, хламидии | Внутрь: эритромицин, другие макролиды, доксициклин (у детей старше 8 лет) | |
| Подозрение на пневмонию | Пневмококк, микоплазма | Внутрь: амоксициллин, оспен, макролид | |
Особая форма амоксициллина - Флемоксин Солютаб. Это таблетка, которую можно глотать целиком, разжевывать или растворять в воде. Приятный вкус и удобный режим приема (два раза в день) позволяют с успехом применять препарат у детей.
Рекомендации по лечению бактериальных ОРЗ противомикробными средствами представлены в таблице. В лечении стрептококковых ангин используют любые оральные пенициллины, макролиды, цефалоспорины 1-го поколения в обычных дозах, у детей старше 8 лет - также доксициклин в растворимой форме (Юнидокс Солютаб - 2-4 мг/кг/сут). Повторный посев желателен через 10 дней и через 4-6 недель, когда нередко наблюдаются бактериологические рецидивы.
Для лечения среднего отита и синусита наиболее подходит амоксициллин (Флемоксин Солютаб - 40 мг/кг/сут), активный в отношении как пневмококка, так и гемофильной палочки. При отите, где ведущими возбудителями являются пневмо- и стрептококки, вполне пригоден Оспен (50 мг/кг/сут), при аллергии к пенициллинам назначают макролиды (эритромицин 30-50 мг/кг/сут и др.). При синусите вместо амоксициллина надежны амоксициллин/клавуланат (Аугментин - 50 мг/кг/сут) или азитромицин (Сумамед - 5 мг/кг/сут). Длительность лечения отита - не менее 10 дней, при применении азитромицина - 3 дня.
При неэффективности этих средств, как и у детей, получавших до заболевания антибиотики, следует применять препараты второго выбора - амоксициллин/ клавуланат, внутрь цефуроксим-аксетил (Зиннат) 25-50 мг/кг/сут, цефаклор (20 мг/ кг/сут). В тяжелых случаях цефалоспорины вводят парентерально одни или в комбинации с гентамицином (5 мг/кг/сут). При рецидивирующих формах следует руководствоваться результатами посева отделяемого из уха.
Гнойный синусит требует интенсивной противостафилококковой терапии и, часто, хирургического вмешательства. Вводят оксациллин (150 мг/кг/сут) или цефамизин (Кефзол - 100 мг/кг/сут), лучше в комбинации с гентамицином (5 мг/кг/сут).
Острый бронхит у дошкольников и школьников с указанными выше признаками микоплазменной инфекции (особенно в период ее эпидемического подъема) допустимо лечить макролидами (эритромицин - 30-50 мг/кг/сут, рокситромицин - Рулид - 50-100 мг/кг/сут, мидекамицин - Макропен - 30-50 мг/кг/ сут). У детей старше 8 лет возможно применение и доксициклина (Юнидокс Солютаб) в указанной выше дозе. Те же препараты эффективны и при хламидийных бронхитах.
При указанных признаках возможной пневмонии есть два подхода. Если состояние ребенка тяжелое, выражен токсикоз, целесообразна госпитализация, лучше с предварительным введением пенициллинового антибиотика (предпочтительно внутримышечно). При нетяжелом состоянии желательно подтвердить подозрение, сделав, например, рентгенографию. Если это в данный момент невозможно, следует назначить оральные препараты (амоксициллин, оспен, макролид) и постараться как можно скорее подтвердить или снять подозрение на пневмонию; в последнем случае антибиотик следует сразу отменить.
Прогресс наших знаний о бактериальных инфекциях дыхательных путей и расширение спектра антибактериальных средств существенно улучшили их прогноз. Сейчас стоит задача сузить показания к антибактериальному лечению случаями, где оно действительно эффективно. Важно сделать лечение целенаправленным и менее травмирующим, более безопасным и дешевым. Но и педиатры, и родители должны контролировать себя, стремиться сокращать излишнее использование антибактериальных средств, уменьшая травматизацию и другие нежелательные эффекты их применения.

1. Беседнова Н.Н., Запорожец Т.С. Антиинфекционное, антитоксическое и антипаразитарное действие экзогенной ДНК // Антибиотики и химиотерапия. – 2010. – Т. 55, № 7–8. – С. 46–54.
2. Бухарин О.В. Персистенция патогенных бактерий. – М.: Медицина; Екатеринбург: УрО РАН, 1999. – 366 с.
3. Экология микроорганизмов человека / О.В. Бухарин, А.В. Валышев, Ф.Г. Гильмутдинова и др. – Екатеринбург: УрО РАН, 2006. – 479 с.
4. Влияние циклоферона на биологические свойства бактериальных внутриклеточных патогенов / О.В. Бухарин, Д.А. Кириллов, Н.В. Шеенков, В.А. Кириллов // Журнал микробиол. – 2005. – № 3. – С. 8–10.
5. Бухарин О.В., Усвяцов Б.Я., Карташова О.Л. Биология патогенных кокков. – М.: Медицина; Екатеринбург: УрО РАН, 2002. – 282 с.
7. Ершов Ф.И. Использование иммуномодуляторов при вирусных инфекциях // Антибиотики и химиотерапия. – 2003. – Т. 48, № 6. – С. 27–32.
8. Влияние иммуномодулятора полиоксидония на биологические свойства микроорганизмов / Д.А. Кириллов, И.Н. Чайникова, Н.Б. Перунова и др. // Журнал микробиол. – 2003. – № 4. – С. 74–78.
10. Эффективность циклоферона при вирусных и бактериальных заболеваниях у детей (клинический обзор) / М.Г. Романцов, Л.Г. Горячева, М.К. Бехтерева и др. // Антибиотики и химиотерапия. – 2010. – Т. 55, № 11–12. – С. 39–51.
Среди наиболее интенсивно разрабатываемых в последние годы лекарственных средств антивирусные препараты занимают одно из первых мест, при этом особую значимость приобретают препараты, влияющие на механизмы естественного (врожденного) иммунитета (интерфероны и их индукторы). Главной особенностью препаратов является широкий спектр биологической активности, выявленный в процессе многолетнего клинического применения, но если механизм действия на макроорганизм подробно описан [6, 7], то характер их влияния на биологические свойства бактериальных патогенов изучен недостаточно.
Имеются лишь единичные сведения о влиянии препаратов-иммуномодуляторов, в том числе индукторов интерферона на биологические свойства патогенных и условно-патогенных микроорганизмов [4, 8].
Staphylococcus aureus обладает высокой этиологической значимостью в патологии человека и является причиной дисбиотических изменений в микробиоценозах верхних дыхательных путей [3]. Известно, что S. aureus благодаря наличию набора биологических, в частности персистентных свойств, способен колонизировать слизистые оболочки носовой полости, что может способствовать развитию ряда гнойно-воспалительных заболеваний различной локализации [5].
В связи с вышесказанным, нами была предпринята попытка оценить способность препаратов индукторов эндогенного интерферона оказывать влияние на факторы персистенции Staphylococcus aureus.
Материалы и методы исследования
Антилизоцимную и антикарнозиновую активности изучали фотометрическим методом [2].
Для оценки влияния лекарственных веществ на антилизоцимную и антикарнозиновую активности бактерий ежедневно в течение 12 дней проводили соинкубирование взвеси S. aureus с препаратами в условиях шейкер-инкубатора при 37 °С – 60 минут. Затем смесь центрифугировали при 3000 оборотов в минуту, после чего двукратно отмывали клетки физиологическим раствором и рассеивали на 1,5 % мясо-пептонный агар. Чашки инкубировали при температуре 37 °С в течение 16–18 ч с последующим определением у 20 изолятов персистентных свойств. В качестве контроля вместо препаратов использовали изотонический раствор хлорида натрия.
Все эксперименты проводили в двух сериях при трехкратном воспроизведении. Полученные результаты обрабатывали с использованием t-критерия Фишера-Стьюдента и представляли в виде средней арифметической и ее ошибки (M± m).
Результаты исследования
и их обсуждение
При изучении антимикробной активности препаратов в используемых концентрациях установлено, что они не обладали бактерицидным и бактериостатическим действием, о чем свидетельствовало отсутствие разницы в росте стафилококка вокруг контрольных и опытных лунок.
Тестирование воздействия лекарственных веществ на распространенность антилизоцимной и антикарнозиновой активности у изолятов S.aureus показало, что препарат полудан in vitro оказывал ингибирующее влияние на антилизоцимную и антикарнозиновую активности у 15,0 ± 4,3 % изолятов золотистого стафилококка. Циклоферон подавлял персистентные свойства: антилизоцимную активность у 15,0 ± 4,3 %, а антикарнозиновую – у 30,0 ± 8,6 % штаммов. Препарат экзогенного интерферона гриппферон не оказывал ингибирующего влияния на изученные персистентные свойства бактерий.
При изучении действия лекарственных веществ на уровень экспрессии факторов персистенции золотистого стафилококка оказалось, что наиболее эффективное ингибирование экспрессии персистентных свойств регистрировалось под влиянием препаратов индукторов эндогенного интерферона. Так, при оценке влияния полудана на персистентный потенциал исследованных изолятов S. aureus установлено, что у бактерий, инкубированных с препаратом, по сравнению с контролем, наблюдалось снижение уровня антилизоцимной активности на 57,9 ± 9,0 % (средний показатель –
1,04 ± 0,06 мкг/мл×ОП) и антикарнозинового признака на 67,4 ± 8,6 % (средняя величина – 0,91 ± 0,08 мг/мл).
Соинкубирование золотистого стафилококка с циклофероном приводило к снижению уровня антилизоцимной активности среди всех исследованных изолятов до среднего значения 0,89 ± 0,07 мкг/мл×ОП, что составляло 63,8 ± 8,8 % от исходного уровня признака. Сходные данные были получены при анализе влияния циклоферона на антикарнозиновую активность изолятов S. aureus: под действием препарата средняя величина данного признака среди всех исследуемых опытных изолятов, по сравнению с контролем, снизилась на 74,6 ± 7,9 % и составила 0,71 ± 0,09 мг/мл.
При изучении характера влияния на изоляты S.aureus препарата экзогенного интерферона было установлено, что стафилококки к нему менее чувствительны. Так, снижение уровня антилизоцимной активности среди штаммов S.aureus под действием гриппферона составило 13,8 ± 0,02 % от начальных значений (средний показа-
тель – 2,13 ± 0,02 мкг/мл×ОП), а антикарнозиновой активности на 10,4 ± 5,6 %
(в среднем – 2,5 ± 0,01 мг/мл).
Таким образом, экспериментальные данные демонстрируют модифицирующую способность препаратов индукторов эндогенного интерферона на персистентный потенциал S. aureus, причем более выраженную, по сравнению с препаратом рекомбинантного интерферона.
Полученные результаты по влиянию индукторов интерферона на персистентный потенциал S. aureus показывают, что биологически активные вещества в применяемых концентрациях могут оказывать угнетающее действие на распространенность и выраженность факторов персистенции.
Характерной особенностью современной инфекционной патологии является рост числа хронических инфекционно-воспалительных заболеваний разнообразной этиологии и локализации, вызываемых слабопатогенными оппортунистическими микроорганизмами, обладающими множественной антибиотикорезистентностью [1]. Изучение клинической эффективности индукторов интерферона выявило их способность нормализовать микробиоценоз слизистых оболочек носа и зева и восстанавливать уровень нормальной микрофлоры кишечника [10].
Двойная направленность действия препаратов с иммуномодулирующим действием, проявляющаяся, с одной стороны, активацией механизмов естественной иммунологической защиты организма [6], а с другой стороны, влиянием на биологические свойства микроорганизмов [4], может потенциировать результат терапевтического воздействия, что позволит использовать их для более эффективной борьбы с возбудителями бактериальных инфекций и разработки новых подходов к коррекции дисбиотических нарушений в микробиоценозах тела человека.
Результаты проведенных исследований свидетельствуют, что область применения индукторов интерферона может быть значительно расширена путем использования их в качестве весьма перспективных лекарственных веществ, подавляющих персистентный потенциал патогенов, что может иметь существенное значение в лечении и профилактике бактериальных инфекций, а также коррекции дисбиотических нарушений в микробиоценозах тела человека.
Рецензенты:
Читайте также:

