Цинковые пальцы в лечении вич
Обновлено: 18.04.2024
Появление методов манипулирования генетическим материалом ознаменовало собой настоящую революцию в биологии, биотехнологии и медицине. Направленное вмешательство в геном живых организмов позволило решать широкий спектр задач, начиная от создания модифицированных видов бактерий, растений и животных, обладающих новыми ценными свойствами, и клеточных моделей, необходимых для создания новых лекарств, до разработки методов генотерапии, открывающей перспективы исправления врожденных генетических нарушений.
Об авторах
Валентин Викторович Власов — академик РАН, доктор химических наук, профессор, директор Института химической биологии и фундаментальной медицины СО РАН. Лауреат Государственной премии РФ (1999). Автор и соавтор более 200 научных работ и девяти патентов.
Сергей Петрович Медведев — кандидат биологических наук, старший научный сотрудник Института цитологии и генетики СО РАН (Новосибирск) и Института химической биологии и фундаментальной медицины СО РАН (Новосибирск), ведущий научный сотрудник Сибирского федерального биомедицинского исследовательского центра им. акад. Е. Н. Мешалкина (Новосибирск). Автор и соавтор 25 научных работ, 5 патентов и 3 монографий.
Закиян Сурен Минасович — доктор биологических наук, профессор, заведующий лабораторией эпигенетики развития Института цитологии и генетики СО РАН (Новосибирск), лабораторией молекулярной и клеточной медицины Сибирского федерального биомедицинского исследовательского центра им. акад. Е. Н. Мешалкина (Новосибирск), лабораторией стволовой клетки Института химической биологии и фундаментальной медицины СО РАН (Новосибирск). Автор и соавтор 215 научных работ, 5 патентов и 3 монографий.
Открытие ферментов рестрикции и ДНК-лигаз в 1960–1970-х гг. стало толчком к появлению генетической инженерии: с помощью этих ферментов оказалось возможным расщеплять ДНК на заданные фрагменты и вновь соединять их, формируя новые генетические конструкции. Так получали (и получают сейчас) различные варианты бактериальных и вирусных геномов.
Но специфичности рестриктаз совершенно недостаточно для работы с геномами растений и животных. Такие геномы содержат множество коротких последовательностей нуклеотидов, которые узнаются рестриктазами, поэтому направленное воздействие на один определенный участок становится невозможным. Между тем для решения большого числа важнейших задач биотехнологии и фундаментальной медицины требовались эффективные и точные инструменты для осуществления точечного воздействия на определенные участки ДНК в составах геномов высших организмов, в том числе человека.
- создание растений и животных, обладающих новыми, ценными свойствами и признаками (урожайность, устойчивость к неблагоприятным условиям среды, вредителям и патогенам);
- получение мутантных модельных животных для исследования заболеваний человека;
- разработка методов генотерапии, исправления генетических мутаций в культивируемых стволовых клетках человека;
- создание клеточных моделей для поиска и доклинического исследования новых лекарств.
Сначала были химеры
Бактериальное ноу-хау
Однако в 2012–2013 гг. в этой области произошел поистине революционный прорыв: был разработан новый метод генетической инженерии CRISPR/Cas, открывший принципиально новые возможности для манипуляций на уровне генома высших организмов (Cong et al., 2013). Этот метод чрезвычайно прост, обеспечивает точное воздействие на заданные участки ДНК и может быть использован практически в любой современной молекулярно-биологической лаборатории.
Природная защитная система CRISPR/Cas типа II-А бактерии Streptococcus pyogenes, состоит из трех генов (вверху). Созданная на ее основе упрощенная искусственная генетическая конструкция состоит всего из двух генов, в том числе гена, кодирующего одну направляющую РНК, способную опознавать целевой участок ДНК (внизу). В конструкцию также встроен ген NLS, кодирующий сигнал ядерной локализации — белок, обеспечивающий поступление конструкции в ядро клетки
С помощью системы CRISPR/Cas можно осуществлять все виды модификаций генома: вносить точечные мутации, встраивать в определенные места новые гены либо, наоборот, удалять крупные участки нуклеотидных последовательностей, исправлять или заменять отдельные генетические элементы и фрагменты генов.
Технологически стратегия геномной инженерии с помощью системы CRISPR/Cas включает в себя следующие этапы: выбор целевой последовательности и определение вида необходимого воздействия; создание ген-направленной конструкции и доставка ее в клеточное ядро; анализ участка генома, подвергнутого воздействию.
Настоящее и будущее
Благодаря своей простоте, эффективности и широким возможностям система CRISPR/Cas за короткое время уже нашла применение в самых различных областях фундаментальной и прикладной биологии, биотехнологии и медицины.
Внося модификации в различные элементы генома клеток животных и растений и изучая последствия, ученые получают возможность исследовать роль отдельных генов в функционировании отдельных клеток и всего организма в целом. С помощью системы CRISPR/Cas уже получен ряд мутантных лабораторных животных (мышей, крыс, лягушек, рыб). Все эти модельные организмы открывают новые перспективы для исследований в области биологии развития, иммунологии и изучения заболеваний человека и животных.
Уникальная способность комплекса системы CRISPR/Cas избирательно связываться с определенными участками ДНК позволила разработать на ее основе регуляторы активности генов. Для этого в систему включают каталитически неактивный мутантный белок Cas9, к которому могут быть присоединены белки, активирующие или подавляющие функции промоторов, управляющих работой генов. При связывании такого комплекса с целевой ДНК может подавляться либо стимулироваться работа целевого гена.
Более того, при использовании системы CRISPR/Cas возможно одновременно вводить в клетки несколько генетических конструкций, направленных на разные участки генома. Это позволяет воздействовать на работу одновременно нескольких генов, чтобы исследовать взаимоотношения между ними и их участие в нормальных и патологических процессах жизнедеятельности. Таким способом можно, например, определить мутации в генах, ответственные за развитие устойчивости раковых опухолей к химиотерапии.
Применение метода CRISPR/Cas в комбинации с клеточными технологиями открывает принципиальную возможность радикального избавления людей от генетических заболеваний, таких как сахарный диабет, хорея Хантингтона, мышечные дистрофии и др. Генетическое вмешательство может быть осуществлено на уровне эмбрионов, получаемых при проведении экстракорпорального оплодотворения, из которых можно вырастить организм, все клетки которого будут иметь модифицированный геном. Препятствием на пути развития таких технологий являются только этические проблемы: вся необходимая техника уже существует и опробована на лабораторных животных. Например, удалось вырастить здоровых мышей из эмбриональных клеток, в которых был скорректирован дефектный ген, ответственный за развитие катаракты. Эти особи дали здоровое потомство (Wu et al., 2013).
Одной из важнейших задач современной биотехнологии является создание новых пород скота, а также сельскохозяйственных культур растений, высокоурожайных и устойчивых к неблагоприятным условиям. Главной целью применения метода CRISPR/Cas в биотехнологии является создание генетически модифицированных животных и посевных растений, которые бы обладали новыми ценными свойствами. С помощью этой системы уже внесены точные модификации в геном пшеницы и табака, получены сорта риса, устойчивые к бактериям Xanthomonas, вызывающие бактериальную гниль, которая наносит большой экономический ущерб сельскому хозяйству (Chen, Gao, 2013).
Еще одним интересным биотехнологическим направлением применения системы CRISPR/Cas является получение линий животных или растений, способных синтезировать белки человека, например, инсулин, необходимый больным сахарным диабетом, или альбумин, использующийся при лечении геморрагического шока, ожогов и цирроза печени. Сейчас альбумин получают из плазмы крови человека — весьма ограниченного источника, однако мировая потребность в этом препарате постоянно растет и сегодня составляет 500 т в год. С помощью методов геномной инженерии ген альбумина человека уже введен в геном риса и крупного рогатого скота (He et al., 2011; Moghaddassi et al., 2014). Такой белок может быть выделен из растительных и животных тканей, где он синтезировался, и после очищения использован для медицинских целей.
Несомненно, в ближайшее время система CRISPR/Cas будет усовершенствована: можно ожидать упрощения белкового каталитического компонента, повышения избирательности действия системы, создания более эффективных средств доставки в разные типы клеток и целые организмы. Уже получены данные, указывающие на то, что на основе системы CRISPR можно создать средства направленного воздействия не только на ДНК, но и на РНК, что откроет новые возможности для регуляции активности генов и борьбы с вирусными инфекциями.
Хотя система редактирования геномов CRISPR/Cas была создана лишь в 2012 г., она уже применяется во многих лабораториях и компаниях развитых стран. Опубликованы сотни результатов исследований с применением этой технологии, описаны десятки успешных экспериментов по редактированию геномов дрожжей, грызунов, насекомых, растений и человеческих клеток.
Компоненты системы в виде готовых наборов производятся компанией Life Technologies, недавно слившейся с компанией Thermo Fisher (США), и доступны для исследователей. Крупнейшие фармацевтические фирмы, такие как Takeda, формируют с помощью технологии CRISPR банки генетически модифицированных стволовых клеток — клеточных моделей заболеваний.
Несмотря на активное применение этой технологии в крупных мировых научных центрах, в России CRISPR/Cas используют лишь в нескольких исследовательских центрах, в том числе в Новосибирском Академгородке. Сегодня технологии TALENs и CRISPR/Cas используют в лаборатории эпигенетики развития Института цитологии и генетики СО РАН, лаборатории молекулярной и клеточной медицины Института патологии кровообращения им. академика Е. Н. Мешалкина и в лаборатории стволовых клеток Института химической биологии и фундаментальной медицины СО РАН в работах, связанных с внесением мутаций в стволовые клетки человека, в частности, для создания клеточных моделей бокового амиотрофического склероза, болезни Альцгеймера, Паркинсона и синдрома удлиненного интервала QT.
Однако для проведения полномасштабных исследовательских работ с использованием TALENs и CRISPR/Cas необходимо создание консорциума по клеточным технологиям с привлечением ведущих специалистов на базе профильных НИИ РАМН: кардиологии, иммунологии, неврологии, онкологии и др. Создание в Новосибирском Академгородке Центра клеточных технологий может стать инфраструктурной основой для развития новых биомедицинских технологий и высокотехнологичной фармацевтической промышленности — приоритетных направлений развития научно-технического потенциала страны.
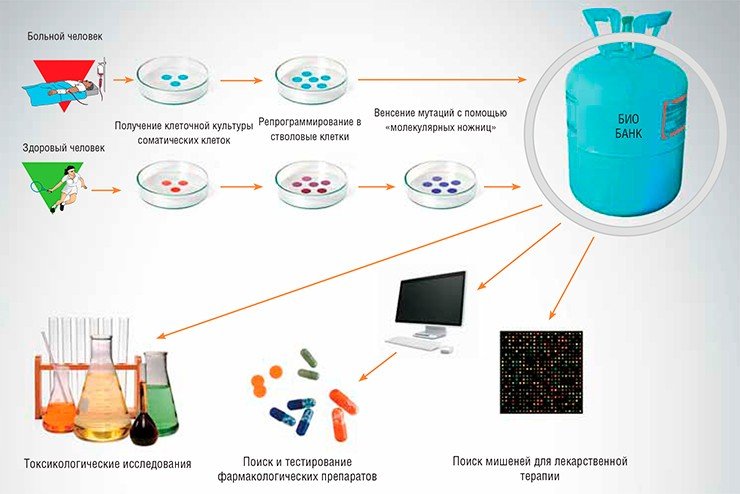
В настоящее время в разработке находится проект Биобанка клеточных моделей заболеваний человека, основой которого станут линии индуцированных плюрипотентных стволовых клеток, полученных из обычных соматических клеток людей, страдающих различными наследственными и приобретенными заболеваниями. Кроме того, в Биобанк войдут клеточные модели наследственных заболеваний человека — клеточные линии, полученные с помощью методов геномной инженерии TALENs и CRISPR/Cas.
Литература
1. Власов В. В. и др. Комплементарные здоровью. Прошлое, настоящее и будущее антисмысловых технологий // Наука из первых рук. 2014. № 1 (55). С. 38–50.
2. Кнорре Д. Г., Власов В. В. // Успехи химии. 1985. Т. 54. № 9. С. 1420–1447.
3. Медведев С. П. Как отредактировать наследственность // Наука из первых рук. 2014, № 1 (55). С. 10–14.
4. Cong L., Ran F. A., Cox D. et al. Multiplex genome engineering using CRISPR/Cas systems // Science. 2013, V. 339. P. 819–823.
5. Kim Y. G., Cha J., Chandrasegaran, S. (1996). Hybrid restriction enzymes: zinc finger fusions to Fok I cleavage domain // Proc. Natl. Acad. Sci. USA, 93, 1156–1160.
6. Moghaddassi S., Eyestone W., Bishop C. E. (2014). TALEN-mediated modification of the bovine genome for large-scale production of human serum albumin // PLoS One, 9, e89631.
7. Schwank, G., Koo, B. K., Sasselli, V. et al. (2013). Functional repair of CFTR by CRISPR/Cas9 in intestinal stem cell organoids of cystic fibrosis patients // Cell Stem Cell, 13, 653–658.
8. Wu, Y., Liang, D., Wang, Y., Bai, M. et al. Correction of a genetic disease in mouse via use of CRISPR-Cas9 // Cell Stem Cell, 13, 659–662.
Поскольку антиретровирусная терапия требует режима лечения на протяжении всей жизни, в настоящее время ведутся исследования по поиску более надежных способов лечения ВИЧ- инфекции. [1] Можно синтезировать нуклеотиды цинкового пальца с компонентами цинкового пальца, которые избирательно (почти избирательно) связываются с определенными участками ДНК . По идее, таргетинг и редактирование могут быть сосредоточены на корецепторах клеток хозяина для ВИЧ или на провирусной ДНК ВИЧ.
Также было замечено, что 20% населения европеоидной расы обладают мутацией, называемой CCR5-Δ32 (частота 0,0808 для гомозиготного аллеля), которая предотвращает распространение белка хемокинового рецептора CCR5 , который является основным средством проникновения вируса в клетку. экспрессируются на поверхности их CD4 + Т-клеток . [2] [3] [4] [5] [6] Лица, гомозиготные по этой мутации, обладают иммунитетом к штаммам ВИЧ, которые используют рецептор CCR5 для доступа к клетке, в то время как те, которые являются гетерозиготными по этой мутации, снижают вирусная нагрузка в плазме и замедление прогрессирования СПИДа. [7] [8] Объединив эти факты, исследователи предложили новый метод лечения ВИЧ . Этот метод пытается лечить инфекцию путем разрушения гена CCR5, например, путем введения мутации CCR5-Δ32 с использованием рекомбинантного аденовирусного вектора или принудительного восстановления ДНК путем негомологичного соединения концов, что подвержено ошибкам и приводит к нефункциональному гену. Как следствие, это приводит к экспрессии нефункциональных корецепторов CCR5 на CD4 + Т-клетках, обеспечивая иммунитет против инфекции. [9] [7] [10] [11]
В цинковых пальцах нуклеазы , которые были синтезированы для этого лечения производится путем комбинирования FokI рестрикции типа II эндонуклеаз с конструированными цинковыми пальцами. [9] [12] Количество цинковых пальцев, прикрепленных к эндонуклеазе, контролирует специфичность ZFN, поскольку они сконструированы так, чтобы предпочтительно связываться с конкретными последовательностями оснований в ДНК . Каждый ZFN состоит из нескольких цинковых пальцев и одного фермента нуклеазы . [9]
Точный состав ZFN, которые будут использоваться для лечения ВИЧ , все еще неизвестен. Связывание ZFNs для изменения генеалогической связи Zif268, однако, хорошо изучено и описано ниже, чтобы проиллюстрировать механизм, с помощью которого домен цинкового пальца ZFNs связывается с ДНК. [25] [26]
Аминоконец части альфа-спирали цинковых пальцев нацелен на основные бороздки спирали ДНК и связывается рядом с геном CCR5 , располагая FokI в подходящем месте для расщепления ДНК. [9] [25] [26]
Цинковые пальцы - это повторяющиеся структурные белковые мотивы с функцией распознавания ДНК, которые соответствуют основным бороздкам ДНК. [25] Три цинковых пальца расположены в виде полукруга или С-образной формы. [26] Каждый цинковый палец состоит из антипараллельных бета-листов и альфа-спирали , удерживаемых вместе ионом цинка и гидрофобными остатками. [25] [26]
Атом цинка ограничен в тетраэдрической конформации за счет координации Cys3, Cys6, His19 и His23 и расстояния связи цинк-сера 2,30 +/- 0,05 Ангстрем и расстояний связи Цинк-Азот 2,0 +/- 0,05 Ангстрем. [26] [27] [28]
Каждый цинковый палец имеет аминокислоту аргинин (arg), выступающую из альфа-спирали , которая образует водородную связь с азотом 7 и кислородом 6 гуанина (гуа), расположенного на 3'-конце сайта связывания. [25] [26] [28] Связь арг-гуа стабилизируется аспарагиновой кислотой из 2-го остатка, который позиционирует длинную цепь аргинина за счет взаимодействия водородной связи с солью . [25] [29]
В остатке 3 2-го (т.е. среднего) цинкового пальца гистидин 49 образует водородную связь с копланарным гуанином в паре оснований 6. Укладка гистидина против тимина в паре оснований 5 ограничивает конформационную способность гистидина 49, приводя к повышенная специфичность водородной связи гистидин-гуанин . [25] [26]
В 6-м остатке пальцы 1 и 3 имеют аргинин, дающий пару заряженных водородных связей азоту 7 и кислороду 6 гуанина на 5'-конце, усиливая последовательность распознавания сайтов цинковых пальцев. [25] [26]
Контакты с позвоночником ДНК
Гистидин , координированный с атомом цинка, который также является седьмым остаток в альфа - спирали из цинковых пальцев, координирует ион цинка через его N & epsi и водородные связи с фосфодиэфирным кислородом через Nδ на цепи первичной ДНК. [25] [26] [29]
Помимо гистидина , консервативный аргинин на второй бета-цепи цинковых пальцев контактирует с фосфодиэфирным кислородом на цепи ДНК . [25] [26] [29]
Также серин 75 на третьем пальце водородом связывается с фосфатом между парами оснований 7 и 8, поскольку единственный скелет контактирует со вторичной цепью ДНК. [25] [26] [29]
Было обнаружено, что FokI не обладает внутренней специфичностью в расщеплении ДНК и что домен узнавания цинкового пальца придает селективность нуклеазам цинкового пальца. [9] [12]
Специфичность обеспечивается димеризацией , которая снижает вероятность расщепления вне сайта. Каждый набор цинковых пальцев специфичен для нуклеотидной последовательности по обе стороны от гена-мишени с разделением 5-7 п.н. между компонентами нуклеазы . [9]
Димеризация двух ZFN необходима для создания необходимого двухцепочечного разрыва в гене CCR5 , поскольку взаимодействие между ферментом FokI и ДНК является слабым. [11] Этот разрыв восстанавливается естественными механизмами репарации клетки, в частности негомологичным соединением концов . [11]
Внесение изменений в геном зависит от любого из двух естественных механизмов репарации клетки: негомологичное соединение концов (NHEJ) и гомологически-направленная репарация (HDR). [11] Восстановление с помощью NHEJ происходит путем лигирования конца разорванных цепей и, при возникновении ошибки, может приводить к небольшим вставкам и делециям. HDR, с другой стороны, использует гомологичную цепь ДНК для репарации, а ген, использующий этот механизм репарации и обеспечивающий желаемую нуклеотидную последовательность, позволяет встраивать или модифицировать ген. [11]
В отсутствие гомологичной последовательности нуклеотидных оснований, которая может быть использована с помощью механизма гомологичной рекомбинации , основной путь репарации DSB у млекопитающих осуществляется через негомологичное соединение концов (NHEJ). [30] NHEJ , хотя и способен восстанавливать поврежденный ген, подвержен ошибкам. [30] DSB, таким образом, вводятся в ген до тех пор, пока не произойдет ошибка в его репарации, после чего ZFN больше не могут связываться и димеризоваться, и мутация завершается. [30] Чтобы ускорить этот процесс, можно ввести экзонуклеазы для переваривания концов цепей, образующихся в DSB. [30]
Увеличение количества цинковых пальцев увеличивает специфичность за счет увеличения количества пар оснований, с которыми может связываться ZFN. [9] Однако слишком много цинковых пальцев может привести к нецелевому связыванию и, следовательно, к расщеплению за пределами участка. [9] Это связано с повышенной вероятностью связывания цинковых пальцев с частями генома за пределами интересующего гена.
Текущие методы лечения ZFN сосредоточены на гене CCR5 , поскольку изменение CCR5 не приводит к побочным эффектам . [31] Существуют штаммы ВИЧ, которые могут использовать CXCR4 для проникновения в клетку-хозяина, полностью обходя CCR5 . [31] Та же технология редактирования генов была применена только к CXCR4 и в комбинации с CCR5 [32] [33]
С этим экспериментальным лечением существует несколько проблем. Одна из проблем заключается в обеспечении того, чтобы желаемый механизм репарации был тем, который используется для репарации DSB после добавления гена. [34] Другая проблема, связанная с нарушением работы гена CCR5 , заключается в том, что штаммы, специфичные для CXCR4 или двутропные, все еще могут получить доступ к клетке. [34] Этот метод может предотвратить прогрессирование ВИЧ- инфекции.
Чтобы использовать ZFN в клинических условиях, должны быть соблюдены следующие критерии:
i) Высокая специфичность связывания ДНК - коррелирует с лучшей производительностью и меньшей токсичностью ZFN. Разработанные ZFN учитывают позиционные и контекстно-зависимые эффекты цинковых пальцев для повышения специфичности. [35]
б) Включить аллостерическую активацию из Foki сразу связывается с ДНК, для того , чтобы произвести только необходимый DSB. [35]
iii) Чтобы доставить в клетку две разные субъединицы нуклеазы цинкового пальца и донорскую ДНК, используемые векторы необходимо улучшить, чтобы снизить риск мутагенеза. [35] К ним относятся аденоассоциированные вирусные векторы, лентивирусные векторы с дефицитом интегразы и векторы аденовируса 5 типа. [35]
v) Во время нацеливания генов генотоксичность, связанная с высокой экспрессией ZFN, может привести к апоптозу клеток и, следовательно, требует тщательной проверки в анализах трансформации in vitro и in vivo . [35]
Клетки, в которых мутации индуцируются ex vivo , отфильтровываются от лимфоцитов с помощью афереза для получения аналогичных сконструированных лентивирусами CD4 + Т-клеток . [36] Они повторно вводятся в организм в виде однократной дозы 1 X 10 10 модифицированных геном аналогичных CD4 + Т-клеток. [36] Вирусный вектор используется для доставки ZFN, которые вызывают желаемую мутацию в клетки. Условия , которые способствуют этому процессу тщательно контролируют обеспечение производства CCR5 - штамм ВИЧ - резистентные Т - клетки . [37]
Берлинский пациент
Тимоти Рэй Браун , которому в 2007 году была сделана трансплантация костного мозга для лечения лейкемии , одновременно болел ВИЧ . [38] Вскоре после операции уровень ВИЧ упал до неопределяемого уровня. [38] Это результат того, что донор костного мозга гомозиготен по мутации CCR5-Δ32 . [38] Эта новая мутация придала реципиенту устойчивость к ВИЧ, что в конечном итоге привело к почти полному исчезновению частиц ВИЧ в его организме. [38] Спустя почти 2 года без антиретровирусной терапии ВИЧ все еще не мог быть обнаружен ни в одной из его тканей. [38] [39] Хотя этот метод оказался эффективным в снижении уровня инфекции, риски, связанные с трансплантацией костного мозга, перевешивают его потенциальную ценность в качестве лечения ВИЧ. [3]
Появление методов манипулирования генетическим материалом ознаменовало собой настоящую революцию в биологии, биотехнологии и медицине. Направленное вмешательство в геном живых организмов позволило решать широкий спектр задач, начиная от создания модифицированных видов бактерий, растений и животных, обладающих новыми ценными свойствами, и клеточных моделей, необходимых для создания новых лекарств, до разработки методов генотерапии, открывающей перспективы исправления врожденных генетических нарушений
Открытие ферментов рестрикции и ДНК-лигаз в 1960—1970-х гг. стало толчком к появлению генетической инженерии: с помощью этих ферментов оказалось возможным расщеплять ДНК на заданные фрагменты и вновь соединять их, формируя новые генетические конструкции. Так получали (и получают сейчас) различные варианты бактериальных и вирусных геномов.
Но специфичности рестриктаз совершенно недостаточно для работы с геномами растений и животных. Такие геномы содержат множество коротких последовательностей нуклеотидов, которые узнаются рестриктазами, поэтому направленное воздействие на один определенный участок становится невозможным. Между тем для решения большого числа важнейших задач биотехнологии и фундаментальной медицины требовались эффективные и точные инструменты для осуществления точечного воздействия на определенные участки ДНК в составах геномов высших организмов, в том числе человека.
Сначала были химеры
Бактериальное ноу-хау
Однако в 2012—2013 гг. в этой области произошел поистине революционный прорыв: был разработан новый метод генетической инженерии CRISPR/Cas, открывший принципиально новые возможности для манипуляций на уровне генома высших организмов (Cong et al., 2013). Этот метод чрезвычайно прост, обеспечивает точное воздействие на заданные участки ДНК и может быть использован практически в любой современной молекулярно-биологической лаборатории.
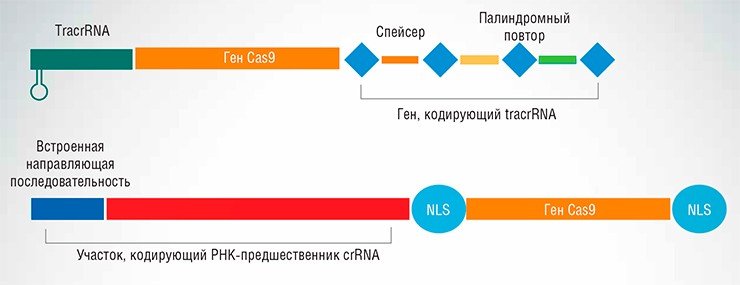
С помощью системы CRISPR/Cas можно осуществлять все виды модификаций генома: вносить точечные мутации, встраивать в определенные места новые гены либо, наоборот, удалять крупные участки нуклеотидных последовательностей, исправлять или заменять отдельные генетические элементы и фрагменты генов.
Технологически стратегия геномной инженерии с помощью системы CRISPR/Cas включает в себя следующие этапы: выбор целевой последовательности и определение вида необходимого воздействия; создание ген-направленной конструкции и доставка ее в клеточное ядро; анализ участка генома, подвергнутого воздействию.
Настоящее и будущее
Благодаря своей простоте, эффективности и широким возможностям система CRISPR/Cas за короткое время уже нашла применение в самых различных областях фундаментальной и прикладной биологии, биотехнологии и медицины.
Внося модификации в различные элементы генома клеток животных и растений и изучая последствия, ученые получают возможность исследовать роль отдельных генов в функционировании отдельных клеток и всего организма в целом. С помощью системы CRISPR/Cas уже получен ряд мутантных лабораторных животных (мышей, крыс, лягушек, рыб). Все эти модельные организмы открывают новые перспективы для исследований в области биологии развития, иммунологии и изучения заболеваний человека и животных.
Уникальная способность комплекса системы CRISPR/Cas избирательно связываться с определенными участками ДНК позволила разработать на ее основе регуляторы активности генов. Для этого в систему включают каталитически неактивный мутантный белок Cas9, к которому могут быть присоединены белки, активирующие или подавляющие функции промоторов, управляющих работой генов. При связывании такого комплекса с целевой ДНК может подавляться либо стимулироваться работа целевого гена.
Более того, при использовании системы CRISPR/Cas возможно одновременно вводить в клетки несколько генетических конструкций, направленных на разные участки генома. Это позволяет воздействовать на работу одновременно нескольких генов, чтобы исследовать взаимоотношения между ними и их участие в нормальных и патологических процессах жизнедеятельности. Таким способом можно, например, определить мутации в генах, ответственные за развитие устойчивости раковых опухолей к химиотерапии.
К важнейшим задачам современной биотехнологии и биомедицины, нуждающихся в развитии технологий редактирования геномов, относятся:
• создание растений и животных, обладающих новыми, ценными свойствами и признаками (урожайность, устойчивость к неблагоприятным условиям среды, вредителям и патогенам);
• получение мутантных модельных животных для исследования заболеваний человека;
• разработка методов генотерапии, исправления генетических мутаций в культивируемых стволовых клетках человека;
• создание клеточных моделей для поиска и доклинического исследования новых лекарств
Применение метода CRISPR/Cas в комбинации с клеточными технологиями открывает принципиальную возможность радикального избавления людей от генетических заболеваний, таких как сахарный диабет, хорея Хантингтона, мышечные дистрофии и др. Генетическое вмешательство может быть осуществлено на уровне эмбрионов, получаемых при проведении экстракорпорального оплодотворения, из которых можно вырастить организм, все клетки которого будут иметь модифицированный геном. Препятствием на пути развития таких технологий являются только этические проблемы: вся необходимая техника уже существует и опробована на лабораторных животных. Например, удалось вырастить здоровых мышей из эмбриональных клеток, в которых был скорректирован дефектный ген, ответственный за развитие катаракты. Эти особи дали здоровое потомство (Wu et al., 2013).
Одной из важнейших задач современной биотехнологии является создание новых пород скота, а также сельскохозяйственных культур растений, высокоурожайных и устойчивых к неблагоприятным условиям. Главной целью применения метода CRISPR/Cas в биотехнологии является создание генетически модифицированных животных и посевных растений, которые бы обладали новыми ценными свойствами. С помощью этой системы уже внесены точные модификации в геном пшеницы и табака, получены сорта риса, устойчивые к бактериям Xanthomonas, вызывающие бактериальную гниль, которая наносит большой экономический ущерб сельскому хозяйству (Chen, Gao, 2013).
Еще одним интересным биотехнологическим направлением применения системы CRISPR/Cas является получение линий животных или растений, способных синтезировать белки человека, например, инсулин, необходимый больным сахарным диабетом, или альбумин, использующийся при лечении геморрагического шока, ожогов и цирроза печени. Сейчас альбумин получают из плазмы крови человека – весьма ограниченного источника, однако мировая потребность в этом препарате постоянно растет и сегодня составляет 500 т в год. С помощью методов геномной инженерии ген альбумина человека уже введен в геном риса и крупного рогатого скота (He et al., 2011; Moghaddassi et al., 2014). Такой белок может быть выделен из растительных и животных тканей, где он синтезировался, и после очищения использован для медицинских целей.
Несомненно, в ближайшее время система CRISPR/Cas будет усовершенствована: можно ожидать упрощения белкового каталитического компонента, повышения избирательности действия системы, создания более эффективных средств доставки в разные типы клеток и целые организмы. Уже получены данные, указывающие на то, что на основе системы CRISPR можно создать средства направленного воздействия не только на ДНК, но и на РНК, что откроет новые возможности для регуляции активности генов и борьбы с вирусными инфекциями.
Хотя система редактирования геномов CRISPR/Cas была создана лишь в 2012 г., она уже применяется во многих лабораториях и компаниях развитых стран. Опубликованы сотни результатов исследований с применением этой технологии, описаны десятки успешных экспериментов по редактированию геномов дрожжей, грызунов, насекомых, растений и человеческих клеток.
Несмотря на активное применение этой технологии в крупных мировых научных центрах, в России CRISPR/Cas используют лишь в нескольких исследовательских центрах, в том числе в Новосибирском Академгородке. Сегодня технологии TALENs и CRISPR/Cas используют в лаборатории эпигенетики развития Института цитологии и генетики СО РАН, лаборатории молекулярной и клеточной медицины Института патологии кровообращения им. академика Е. Н. Мешалкина и в лаборатории стволовых клеток Института химической биологии и фундаментальной медицины СО РАН в работах, связанных с внесением мутаций в стволовые клетки человека, в частности, для создания клеточных моделей бокового амиотрофического склероза, болезни Альцгеймера, Паркинсона и синдрома удлиненного интервала QT.
Однако для проведения полномасштабных исследовательских работ с использованием TALENs и CRISPR/Cas необходимо создание консорциума по клеточным технологиям с привлечением ведущих специалистов на базе профильных НИИ РАМН: кардиологии, иммунологии, неврологии, онкологии и др. Создание в Новосибирском Академгородке Центра клеточных технологий может стать инфраструктурной основой для развития новых биомедицинских технологий и высокотехнологичной фармацевтической промышленности – приоритетных направлений развития научно-технического потенциала страны.
В настоящее время в разработке находится проект Биобанка клеточных моделей заболеваний человека, основой которого станут линии индуцированных плюрипотентных стволовых клеток, полученных из обычных соматических клеток людей, страдающих различными наследственными и приобретенными заболеваниями. Кроме того, в Биобанк войдут клеточные модели наследственных заболеваний человека – клеточные линии, полученные с помощью методов геномной инженерии TALENs и CRISPR/Cas.
Власов В. В. и др. Комплементарные здоровью. Прошлое, настоящее и будущее антисмысловых технологий // НАУКА из первых рук. 2014. № 1 (55). С. 38—50.
Кнорре Д. Г., Власов В. В. // Успехи химии. 1985. T. 54, № 9. С.1420—1447.
Медведев С. П. Как отредактировать наследственность // НАУКА из первых рук. 2014, № 1 (55). С. 10—14.
Сong L., Ran F.A., Cox D. et al. Multiplex genome engineering using CRISPR/Cas systems // Science. 2013, V. 339.
Kim Y.G., Cha J., Chandrasegaran, S. (1996). Hybrid restriction enzymes: zinc finger fusions to Fok I cleavage domain. Proc Natl Acad Sci U S A 93, 1156—1160.
Moghaddassi S., Eyestone W., Bishop C.E. (2014). TALEN-mediated modification of the bovine genome for large-scale production of human serum albumin. PLoS One 9, e89631.
Schwank, G., Koo, B.K., Sasselli, V. et al. (2013). Functional repair of CFTR by CRISPR/Cas9 in intestinal stem cell organoids of cystic fibrosis patients. Cell Stem Cell 13, 653—658.
Wu, Y., Liang, D., Wang, Y., Bai, M. et al. Correction of a genetic disease in mouse via use of CRISPR-Cas9. Cell Stem Cell 13, 659—662.
Цинк — один из микроэлементов в нашем организме. Они так называются потому, что потребность в них и их содержание невысокие (не более 100 мг в день). Тем не менее, микроэлементы необходимы для правильного развития, созревания и функционирования организма.
Все микроэлементы:
Микроэлемент цинк в организме выполняет ряд важных функций:
В организме человека в среднем хранится от 2 до 4 г цинка. Большая часть, то есть около 85-90%, находится в костях и мышцах, а оставшееся количество — в других тканях или жидкостях организма.
Потребность в цинке зависит от возраста: она увеличивается в периоды повышенного роста и развития, а также во время беременности и кормления грудью.
Рекомендуемая суточная доза:

Дефицит цинка — симптомы
Дефицит цинка у младенцев и детей может привести к задержке роста, задержке психомоторного развития и полового созревания. Могут появиться псориазоподобные поражения кожи, алопеция и заболевание ногтей, снижение аппетита и диарея.
Младенцы и дети с дефицитом цинка могут иметь пониженную сопротивляемость инфекциям.
Симптомы дефицита цинка у взрослых включают:
- эритематозные поражения кожи и другие дерматологические заболевания,
- заболевания щитовидной железы и печени,
- ухудшение заживления ран и иммунитета,
- нарушения вкуса и запаха,
- выпадение волос и куриную слепоту.
Ранние и неспецифические симптомы включают:
- раздражительность,
- нервозность,
- возбужденное состояние,
- вялость,
- снижение аппетита.
Из-за влияния цинка на функционирование поджелудочной железы, его недостаток в организме может привести к нарушению углеводного обмена.
Дефицит цинка также может быть одной из причин дефицита фолиевой кислоты и связанной с ним анемии.
Недостаточный уровень цинка у мужчин отрицательно сказывается на процессах сперматогенеза. Это может привести к снижению количества сперматозоидов и их жизнеспособности, снижению уровня тестостерона и вызвать проблемы с сексуальной потенцией.
Дефицит цинка в организме беременной женщины может привести к нарушению развития плода и формированию дефектов нервной системы, а также нарушить течение беременности: способствовать преждевременным родам, повысить риск перинатальных осложнений и способствовать низкому весу ребенка при рождении.
Причины дефицита цинка
Факторами, негативно влияющими на усвоение цинка, являются:
- загрязнение окружающей среды,
- стресс,
- использование стимуляторов,
- плохо сбалансированное, однообразное меню,
- потребление продуктов с высокой степенью переработки.
Важной причиной дефицита цинка в организме являются заболевания желудочно-кишечного тракта, которые ухудшают и нарушают всасывание питательных веществ в кишечнике. Все заболевания, связанные с нарушением питания, могут привести к недостаточному поступлению цинка в организм.
Его дефицит также может быть вызван увеличением спроса на него, как это происходит во время беременности, кормления грудью или во время интенсивного роста.
Недостаток цинка наблюдается и у людей, злоупотребляющих алкоголем.
Пожилые люди, госпитализированные пациенты, профессиональные спортсмены и вегетарианцы также подвержены повышенному риску.
Избыток цинка — симптомы
Мало того, что недостаток цинка в организме вызывает неблагоприятные последствия — его избыток также может быть вредным.
Чрезмерное количество цинка также может способствовать развитию болезни Альцгеймера.
Острая передозировка проявляется такими симптомами, как:
- боль в животе,
- тошнота и рвота,
- диарея,
- слабость,
- снижение аппетита,
- головные боли.
Причины избытка цинка
Количество цинка, поступающее с пищей, вряд ли приведет к избытку цинка в организме. Основная причина — длительное и необдуманное употребление пищевых добавок. Другим источником избыточного количества этого элемента могут быть искусственные цинковые удобрения или профессиональное воздействие, например, у людей, которые работают на производстве сплавов.

Что снижает уровень цинка в организме, а что увеличивает?
Человек получает цинк в основном с пищей. Его абсорбция увеличивается натощак и в присутствии витамина B6, витамина A, и некоторых аминокислот. С другой стороны, алкоголь, клетчатка, фитаты и оксалаты снижают его усвояемость. Цинк легче усваивается из рациона, богатого животными белками, чем из продуктов на основе растительных белков.
Продукты, богатые цинком (содержание цинка в мг на 100гр продукта):
- Пшеничные отруби 15 -16
- Печень телячья (жареная) 15
- Угри (вареные) 13
- Говядина, баранина, свинина 7-9
- Кунжутное, маковое семя 7,5-8
- Тыквенные семечки (нежаренные) 7,5
- Куриное сердца (отварные) 7
- Кедровые орехи 4-6,5
- Какао (натуральный) 6,5
- Печень баранья (жаренная) 6
- Семена подсолнечника, льна (нежаренные) 5,5
- Соевая мука (грубого помола) 4,8
- Язык говяжий (отварной) 4,7
- Соя, бобы 4,2
- Бразильский орех 4
- Чечевица 3,8
- Капуста кольраби 3,5
- Пшеничная мука (цельнозерновая) 3
- Гречневая, ячневая, овсяная каша 2,5-3
- Арахис, грецкий орех 2,7
- Утка, индейка 2,5
- Миндаль, кешью, лесной орех 2,1
- Фасоль, горох 1,6-2,5
- Курага (без обработки) 0,75
- Чернослив (без обработки) 0,45
- Зелёный лук 0,4
- Капуста цветная, авокадо, редис, морковь 0,3
Дефицит цинка можно восполнить с помощью соответствующих пищевых добавок. Однако, учтите, что такие препараты никогда не могут заменить здоровую и сбалансированную диету, а их чрезмерное употребление или неправильная конфигурация могут быть вредными.
Перед тем, как начать их использовать, обязательно проконсультируйтесь с врачом. Стоит знать, что при некоторых заболеваниях цинк является одним из элементов лечения.
Ионы цинка помогают при симптоматическом лечении неприятного запаха изо рта, связывая сульфидные радикалы и останавливая рост некоторых бактерий.
Цинк препятствует всасыванию меди из желудочно-кишечного тракта, что используется при лечении болезни Вильсона (генетически обусловленное заболевание, при котором накопление меди в организме приводит к повреждению органов).
Все представленные на сайте материалы предназначены исключительно для образовательных целей и не предназначены для медицинских консультаций, диагностики или лечения. Администрация сайта, редакторы и авторы статей не несут ответственности за любые последствия и убытки, которые могут возникнуть при использовании материалов сайта.
Читайте также:

