Цитология шейки матки при вич
Обновлено: 18.04.2024
Ключевые слова: папилломавирусная инфекция (ПВИ), вирус папилломы человека (ВПЧ), Полижинакс, оптическая когерентная томография (ОКТ), ВПЧ-ассоциированные заболевания шейки матки, фотодинамическая терапия (ФДТ).
Инфекции, передаваемые половым путем (ИППП), являются одной из самых распространенных причин обращения женщин к гинекологу.
Среди вирусных ИППП наибольшего внимания заслуживает возрастающая заболеваемость папилломавирусной инфекцией (ПВИ), инфицированность сексуально активного населения планеты которой составляет 20-60% [6]. У 94,9% женщин, страдающих ИППП, выявляется ДНК вируса папилломы человека (ВПЧ). За последнее десятилетие число инфицированных ВПЧ, по данным Всемирной организации здравоохранения (ВОЗ, 2004), увеличилось более чем в 10 раз и составляет 23,5% населения. Проблема диагностики и лечения заболеваний, ассоциированных с ВПЧ за последнее десятилетие, является актуальной в связи с резким ростом заболеваемости, значительной контагиозностью и высоким онкогенным потенциалом данного возбудителя в разных возрастных группах. Частота инфицирования ВПЧ в возрастной группе 16-29 лет составляет 45-81%, однако эти цифры не регистрируют субклинические и латентные формы инфекции. Субклинические формы - плоские кондиломы, вирусные цервициты и вагиниты - являются причиной частых обращений больных к врачам с жалобами на дискомфорт, обусловленный зудом, жжением, обильными выделениями, рецидивирующим бактериальным вагинозом и кандидозом. В большинстве случаев у таких пациенток возникают обострения клинических симптомов перед каждой менструацией [8]. Латентное течение ПВИ характеризуется отсутствием клинических и морфологических изменений при обнаружении ДНК-вируса. У 5-15% пациенток ВПЧ вызывает хроническое воспаление шейки матки (ВПЧ-ассоциированный цервицит), реже - вульвы и влагалища. Наиболее часто неблагоприятное течение и исход ПВИ шейки матки отмечается среди женщин с сочетанной вирусно-бактериальной, вирусно-грибковой инфекцией нижнего отдела генитального тракта. Кроме того, при таких сочетаниях наблюдается затяжное течение заболевания с большим числом рецидивов.
ВПЧ является доказанным экзогенным этиопатогенетическим фактором в развитии цервикальной интраэпителиальной неоплазии (ЦИН), а у 15-20% -рака шейки матки (РШМ), поэтому некоторые авторы (Ann Roman, Helena Spartz, Darron R. Brown, 2012) рассматривают ВПЧ-ассоциированный цервицит как ранний показатель предракового состояния. Частота прогрессии ЦИН в более высокую степень или инвазивный рак колеблется в очень широких пределах от 1,4 до 60%. В настоящее время не существует ни одного метода прогнозирования течения и времени длительности ЦИН у конкретной больной. Поэтому лечебная тактика должна быть адекватна на начальных этапах естественного процесса развития данной патологии.
За последние 20 лет количество больных РШМ in situ и инвазивным раком в позднем подростковом возрасте и в начале третьей декады жизни диагностируется чаще (Philip J. DiSaia, 2011). Так, в группе женщин до 30 лет рост заболеваемости РШМ за период с 1993 по 2002 г. составил 150%. Медиана возраста больных РШМ in situ снизилась с 40 до 28 лет, она на 10-15 лет меньше аналогичного показателя у пациенток с инвазивным раком.
Тем не менее, некоторые исследователи утверждают, что ДНК ВПЧ убиквитарная и распространена повсеместно, и вероятность ее обнаружения в женских половых органах достаточно высока. По их мнению, даже ВПЧ высокого канцерогенного риска обычно вызывают умеренные транзиторные цитологические изменения и редко ведут к ЦИН высокой степени или инвазивному раку.
Подобные научные противоречия привели к проблеме отсутствия единого подхода к диагностике и лечению ВПЧ-ассоциированных заболеваний шейки матки в нашей стране. Практикующие врачи определяют тактику ведения таких пациенток, основываясь на личных предпочтениях, выбирая между длительным консервативным лечением и хирургической агрессией. В обоих случаях велик процент тактических ошибок из-за отсутствия новых диагностических технологий и недостаточной эффективности методов выявления цервикальной патологии. Подобные ошибки в первом случае зачастую влекут прогрессирование, осложнение процесса, возникновение онкологической ятрогенной патологии либо, при излишней онкологической настороженности врача, приводят к неоправданному радикализму и трудностям в осуществлении репродуктивного потенциала пациенток. К примеру, статистический анализ результатов гистологического исследования фрагментов шейки матки, полученных после эксцизий, показал необоснованность данной тактики в 80% случаев среди врачей районных больниц Нижегородской области и 18,5% -среди врачей областной клинической больницы Нижнего Новгорода.
Актуальность данной проблемы диктует необходимость внедрения в практику новых диагностических технологий и щадящих методов лечения у пациенток репродуктивного возраста.
Цель исследования - повысить эффективность неинвазивных методов диагностики ВПЧ-ассоцииро-ванных цервицитов и обосновать дифференцированную тактику лечения данной патологии у женщин репродуктивного возраста.
Материалы и методы
Обследовано 170 пациенток в возрасте от 17 до 46 лет с ПВИ. Пациентки, у которых в процессе обследования были диагностированы интраэпителиальные поражения высокой степени тяжести (HSIL) в соответствии с классификацией Бетесда, из дальнейшего исследования были исключены.
Все пациентки, вошедшие в исследование, по результатам обследования на ВПЧ с типированием и определением вирусной нагрузки, были разделены на 3 группы: ВПЧ высокого канцерогенного риска были выявлены в 53% случаев, ВПЧ низкого канцерогенного риска - в 16%, ДНК ВПЧ не было обнаружено у 31% пациенток.
Неомицин (в одной капсуле содержится 35 000 МЕ), являясь аминогликозидом широкого спектра действия, активен в отношении большинства грамположительных и грамотрицательных кокков, грамположительных палочек, таких, как коринебактерии и Mycobacterium tuberculosis, грамотрицательных бактерий, в частности Еscherichia coli, Enterobacter aerogenes, Haemophilus influnenzae, Klebsiella pneumoniae, Proteus vulgaris.
Полимиксин В (в одной капсуле содержится 35 000 МЕ) - полипептидный антибиотик,активен в основном в отношении таких грамотрицательных бактерий, как
Pseudomonas aeruginosa, исключая Proteus и Neisseria, а также in vitro в отношении Ureaplasma urealyticum. Большинство анаэробных микробов устойчивы к этим двум антибиотикам.
Нистатин (в одной капсуле содержится 100 000 МЕ) оказывает in vitro и in vivo фунгицидное и фунгистатическое действие на грибы рода Candida, а также на грибы родов Histoplasma, Coccidioides, Cryptococcus. Гель диметикон является активным компонентом препарата с функцией распространения основных его элементов по всей поверхности влагалища, он также обладает успокаивающим, защитным действием на воспаленную слизистую оболочку влагалища.
В качестве одного варианта лечения применялась фотодинамическая терапия (ФДТ), в основе которой лежит фотохимическая реакция введенного в организм фотосенсибилизатора, в нашем исследовании - Фотодитазина и лазерного излучения определенной длины волны в аэробных условиях. В результате этой реакции выделяются активные формы кислорода, разрушающие пораженные клетки. ФДТ позволяет не только выполнить локальную деструкцию патологических очагов эпителия, где произошла клиническая манифестация ПВИ, но и воздействовать на резервуар ВПЧ в латентном состоянии или недиагностированной субклинической форме, который остается в окружающих тканях и может являться основой для дальнейшего развития онкопатологии. Всем пациенткам назначался комплексный препарат Полижинакс по 1 капсуле 6 дней до и по 1 капсуле 6 дней после процедуры ФДТ с целью профилактики воспалительных осложнений при отхождении некрозов.
Результаты
Возраст обследованных пациенток составил от 17 до 46 лет (средний возраст - 29 лет). Большинство женщин находились в возрастной группе до 30 лет (69%), что подтверждает многочисленные данные международных и отечественных исследований о том, что у женщин молодого возраста ВПЧ-ассоциированная патология встречается чаще, однако и в зрелом возрасте является актуальной проблемой.
При первом визите всем пациенткам проводилась ОКТ-кольпоскопия. Согласно общим положениям по кольпоскопической классификации Рио де Жанейро неадекватная картина отмечалась в 87% случаев из-за проявлений воспаления, контактных кровотечений, рубцовых деформаций, III типа зоны трансформации. При ОКТ-зондировании влагалищной порции шейки матки у 66% пациенток были получены изображения в соответствующей желто-коричневой палитре, где оттенки желтого соответствуют большей, а оттенки коричневого - меньшей оптической плотности. Данные изображения были отнесены к доброкачественным из-за наличия субэпителиальных включений, нормальной скорости угасания сигнала и четкой двуслойности изображения, где верхний слой имеет меньшую оптическую плотность, чем нижний. Кроме доброкачественности, изображения отражали интенсивность воспалительного процесса эктоцервикса: явное усиление, ветвистость сосудистого рисунка, отек стромы, оцениваемый с помощью сниженной скорости угасания оптического сигнала.
В остальных 23% случаев были получены сомнительные изображения, характеризующиеся двуслойностью с одинаковой оптической плотностью слоев, либо наличием оптически более плотного верхнего слоя, либо с локусами злокачественного (быстроугасаемого) сигнала.
У 75% пациенток наблюдалась сопутствующая патология шейки матки, из них у 70% женщин ПВИ протекала на фоне эктопии либо эктропиона, рубцовая деформация цервикса отмечалась в 13% случаев, эндометриоз шейки матки - в 8%, полипы цервикального канала - у 3,5% обследованных пациенток.
Генитальные кондиломы как клиническая форма течения ПВИ были выявлены у 9,5% пациенток, в 3,5% случаев были диагностированы кондиломы шейки матки, в 5% - вульвы и влагалища. Частота встречаемости данной патологии при беременности составила 62,5% случаев.
Лечение генитальных кондилом являлось обязательным этапом ведения пациенток с ВПЧ-ассоциированными цервицитами. С профилактической целью на 6 дней пациенткам перед лечебными манипуляциями назначались капсулы Полижинакс, обладающие не только выраженными антибактериальными и фунгицидными свойствами, но и успокаивающим, репарационным действием на воспаленную слизистую оболочку.
На втором этапе диагностического исследования выявлялась этиология воспалительного процесса.
По нашим данным, ПВИ чаще всего сочетается с уреаплазмозом (в 35% случаев) и кандидозом (в 10% случаев), в 7,5% случаев у пациенток с ПВИ был обнаружен микоплазмоз, в 5% - гонорея и цитомегаловирус, в 2,5% - трихомониаз и хламидиоз. В 30% случаев ВПЧ-инфекция протекала на фоне дисбаланса за счет снижения количества лактобактерий, а в 32,5% случаев - на фоне анаэробного дисбиоза.
Все пациентки получали соответствующую этиотропную терапию с последующим восстановлением лактофлоры влагалища и контролем эффективности лечения через 3-4 недели после его окончания. В качестве местного лечения использовался препарат Полижинакс.
Нами были обследованы 90 ВПЧ-позитивных пациенток с нарушением влагалищного биоценоза.
Клиническое и лабораторное исследования пациенток осуществлялись до начала терапии Полижинаксом, через 12 дней и через 3-4 недели после окончания лечения.
Оценку эффективности терапии препаратом проводили по 3 критериям: 1) оценка общего состояния и самочувствия пациенток; 2) оценка клинических данных (по данным анамнеза и гинекологического осмотра); 3) оценка лабораторных бактериоскопических данных.
По результатам обследования и лечения выявлено общее улучшение состояния и купирование симптомов вагинита у абсолютного большинства пациенток (94%). Отмечено изменение клинической картины и субъективных ощущений: изменение характера белей, уменьшение раздражения, зуда, жжения. По данным гинекологического осмотра, также отмечено улучшение состояния слизистой оболочки влагалища -уменьшение отечности и гиперемии. У большинства пациенток отмечен положительный бактериологический эффект препарата: подавление патогенной микрофлоры, в том числе и грибов рода Candida (по данным бактериоскопии).
После проведенного восстановления биоценоза нижнего отдела гениталий и соответственно после купирования признаков воспаления на третьем диагностическом этапе проводилась повторная ОКТ-кольпоскопия.
На третьем диагностическом этапе ОКТ-кольпоскопия имела прицельный характер: щуп ставился на зону максимальных кольпоскопических изменений для оценки ее оптической плотности и поиска злокачественных ОКТ-локусов.
Следующим важнейшим диагностическим шагом являлось контролируемое ОКТ-кольпоскопией прицельное цитологическое исследование, производимое методом жидкостной цитологии.
По результатам нашего исследования, у 87% пациенток цитологический мазок был отнесен к LSIL по классификации Бетесда, из них 59,7% - мазки типа ASCUS, то есть II класс мазка по Папаниколау, что соответствует признакам ПВИ по системе ЦИН, а 27,3% мазков были отнесены к III классу по Папаниколау или к ЦИН I. У 13% женщин была выявлена нормальная цитологическая картина.
При выборе тактики дальнейшего ведения пациентки были разделены на три группы, в зависимости от конкретной клинической ситуации и согласно совокупности полученных результатов на этапах диагностики.
40% пациенток, у которых имело место сочетание доброкачественного типа ОКТ, I степени кольпоскопических изменений, LSIL, р16ink4a-негативной реакции, была определена тактика активного динамического наблюдения после курса противовирусной и иммуномодулирующей терапии при Е7-отрицательной реакции или нескольких курсов - при Е7-положительной реакции, в том числе и в группе планирующих беременность женщин.
18% пациенток при наличии злокачественных ОКТ-локусов, I-II степени кольпоскопических изменений, LSIL, р16ink4a-негативной или позитивной реакции было выполнено прицельное гистологическое исследование, ФДТ, далее тактика ведения пациенток соответствовала 1-й группе.
Всем пациенткам через 10 дней после процедуры ФДТ с профилактической целью назначались капсулы Полижинакс. Гель диметикон способствует ускорению процессов заживления многослойного плоского эпителия эктоцервикса после отхождения некрозов.
Ни у одной пациентки 2-й и 3-й групп не было отмечено возможных воспалительных осложнений после ФДТ.
Всем небеременным больным с ВПЧ-ассоциированным цервицитом проводилось противовирусное и иммуномодулирующее лечение и вакцинация квадривалентной вакциной с целью профилактики повторного инфицирования.
ОКТ-кольпоскопия на первом диагностическом этапе позволяет в режиме реального времени исключить инвазивную патологию шейки матки, оценить интенсивность воспалительного процесса и морфофункциональные особенности поверхностных и подповерхностных слоев исследуемой ткани. Таким образом, ОКТ повышает информативность кольпоскопии.
На втором диагностическом этапе ОКТ-кольпоскопия, при наличии адекватной кольпоскопической картины, позволяет после лечения осуществлять динамический контроль по всей поверхности эктоцервикса, определить истинные размеры изменений и
обнаружить резервные очаги ВПЧ, что важно при планировании светового пятна при ФДТ, оценить локусы максимальных изменений с целью прицельного забора материала для цитологического или гистологического исследования, а также проводить ОКТ-контроль после ФДТ.
Применение капсул Полижинакс целесообразно на втором этапе обследования пациенток с хроническим экзоцервицитом на фоне ПВИ для санации влагалища и достижения адекватной кольпоскопической картины, необходимой для осуществления третьего этапа ведения пациенток с данной патологией.
По нашему мнению, использование предлагаемой тактики при хронических цервицитах, ассоциированных с ВПЧ, позволит оптимизировать диагностический процесс, исключив неадекватные травматизации шейки матки, а также обосновать щадящее лечебное воздействие у женщин репродуктивного возраста.
Литература:
1. Апгар Б.С, Броцман Г.Л, Шпицер М. Клиническая кольпосопия. Иллюстрированное руководство. Пер. с англ под общей ред. В.Н. Прилепской. М. 2012.
2. Барышников А.Н., Новиков В.В. Программированная клеточная смерть (апоптоз). Клиническая онкогематология: руководство для врачей. М. 2007; 99-106.
3. Бауэр Г. Цветной атлас по кольпоскопии. М.2007; 288 с.
4. Дамиров М.М. Радиоволновые, криогенные илазерные технологии в диагностике и лечении в гинекологии. М. 2011.
5. Дисаи Ф.Дж, Крисман У.Т. Клиническая онкогинекология в 3 томах. Том 1. Переводчик Е. Новикова. 2011
6. Краснопольский В.И., Шипулина О.Ю., Мельник Т.Н., Михеева И.В., Серова О.Ф., Зароченцева Н.В., Белая Ю.М. Инфицированность вирусом папилломы человека среди девочек-подростков в Московской области. Российский вестникакушера-гинеколога. 2010; 5: 46-49.
7. Кузнецова И.А. Диагностические возможности оптической когерентной томографии в оценке состояния шейки матки. Дисс. канд. мед. наук. 2003; 157с.
8. Прилепская В.Н., Костава М.Н. Возможности терапии папилломавирусной инфекции. РМЖ. 2009; 17 (1): 16-19.
9. Роговская С.И. Практическая кольпоскопия.М.2011.
10. Роговская С.И. Папилломавирусная инфекция у женщин и патология шейки матки. 2-е изд., испр. и доп. М. 2011.
11. Роговская С.И., Акопова Е.С., Коган Е.А. Совершенствование лечебно-диагностических подходов к ВПЧ-инфекции гениталий. РМЖ. 2011; 20: 1238.
12. Роговская С.И. Папилломавирусная инфекция нижних отделов гениталий: клиника, диагностика, лечение. Дисс. докт. мед. наук.2003.
13. Серов В.Н. Изучение эффективности Полижинакса в лечении неспецифических бактериальных и грибковых кольпитов. АГ-инфо. 2003. сентябрь.
14. Kanodia S., Fahey L.M., Kast W.M. Mechanisms used by human papillomavirus to escape the host immune response. Curr. Cancer. Drug. Targets. 2007; 7: 79-89.
15. Moscicki A.B., Ma Y. et al. The role of sexual behavior and HPV persistence in predicting repeated infections with new HPV types. Cancer. Epidemiol. Biomarkers. Prev.2010 Aug.; 19 (8): 2055-2065.
16. Schiffman M., Castle P.E. The promise of global cervical-cancer prevention. N. Engl. J. Med. 2005; 353: 2101-2104.
17. Schiffman M.H., Kiviat N.B. et al. Accuracy and interlaboratory reability of human papillomavirus DNA testing By Hybrid Capture. J. Clin. Microbiol. 1995; 33: 545 p.
18. Wright T.C., Cox J.T. et al. American Society for Colposcopy and Cervical Pathology. 2001 consensus guidelines for the management of women with cervical intraepithelial neoplasia. Am. J. Obstet. Gynaecol. 2003 Jul; 189 (1):295-304.
CHRONIC CERVICITIS AND HPV-INFECTION IN REPRODUCTIVE PERIOD. ROUTS TO DECREASE DIAGNOSTIC AND TREATMENT AGRESSION
Kachalina T.S., Shakhova N.M., Kachalina O.V., Eliseyeva D.D.
GBOU VPO NizhnyNovgorod State Medical Academy Ministry Of Health and Social Development of Russian Federation
Key words: HPV infection, human papilloma virus (HPV), Polygynax, optical coherence tomography (OCT),HPV-associated cervicaldisease, photodynamic therapy (PDT).
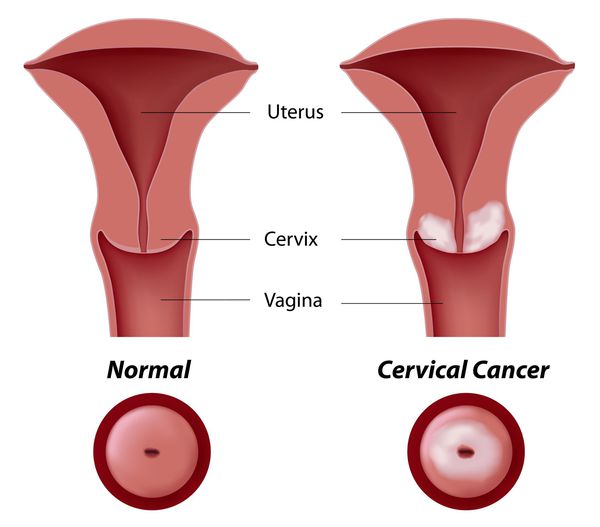
Актуальность. Рак шейки матки (РШМ) представляет собой одну из наиболее частых злокачественных опухолей̆ женской репродуктивной системы. Среди онкологических заболеваний у молодых женщин рак шейки матки имеет самые высокие показатели смертности. Источником раковой опухоли шейки матки служат нормальные клетки, покрывающие шейку матки. Ежегодно эту опухоль выявляют более чем у 600 тысяч пациенток [6]. Вирус иммунодефицита человека (ВИЧ) вызывает синдром приобретенного иммунодефицита (СПИД) и является одним из факторов риска развития плоскоклеточного интраэпителиального поражения или squamous intraepithelial lesion (SIL), возникающего в результате нарушения иммунного контроля. С течением времени SIL переходит в инвазивный рак шейки матки.
Цель работы. Изучить особенности возникновения, течения, диагностики, лечения рака шейки матки у ВИЧ- инфицированных женщин.
Задачи исследования. Установить взаимосвязь прогрессирования рака шейки матки у женщин с ВИЧ-положительным статусом.
Материалы и методы. По классификации выделяют LSIL, или Low grade SIL, или легкая степень и HSIL, или Hight grade SIL, или тяжелая степень. SIL должна своевременно лечиться (путем удаления или уничтожения внешних слоев клеток шейки
матки), чтобы не дать ей перерасти в инвазивный рак.
У ВИЧ инфицированных женщин переход SIL в рак шейки матки происходит намного быстрее, чем у здоровых женщин, вследствие поражения иммунной системы. ВИЧ поражает клетки крови человека, имеющие на своей поверхности CD4-рецепторы, а именно: Т-лимфоциты, макрофаги и дендритные клетки. Инфицированные Т-лимфоциты гибнут из-за разрушения вирусом, апоптоза и уничтожения цитотоксическими Т-лимфоцитами. Если число CD4+ T-лимфоцитов становится ниже 200 в одном микролитре крови, система клеточного иммунитета перестает защищать организм [3]. Исследования показали, что нелеченая неоплазия шейки матки с большей вероятностью переходит в инвазивный рак у ВИЧ-инфицированных женщин, чем у здоровых [4, 5].
При жидкостной цитологии забор материала проводится цитощетками, которые предназначены для взятия биологического материала с поверхности шейки матки и из цервикального канала для цитологических и бактериологических исследований, при этом образец не сразу переносится на стекло, а цитощетка с собранным материалом погружается в специальный раствор и затем с помощью прибора готовится образец для исследования. Цитощетка удобна в применении, атравматична для взятия материала. При необходимости рабочая часть может быть согнута под любым углом по отношению к рукоятке. Это позволяет адаптировать инструмент в зависимости от анатомических особенностей зоны, с которой выполняется забор материала.
Терапия требует чёткого соблюдения графика приёма. Недопустимо пропускать приемы препаратов, как и принимать уменьшенные или увеличенные дозы в случае пропуска.
Появление и развитие рака шейки матки — это многоступенчатый процесс. Этапы развития рака шейки матки представлены следующим образом: нормальный эпителий шейки матки => дисплазия эпителия (легкая, умеренная, тяжелая) => внутриэпителиальный рак (или рак 0 стадии, неинвазивный рак) => микроинвазивный рак => инвазивный рак. Самыми ранними проявлениями могут быть водянистые обильные выделения, кровянистые выделения, которые у женщин детородного возраста не связаны с менструациями, а у женщин в постменопаузе наблюдаются постоянно или периодически, выделения могут иметь неприятный запах. Выделение мочи и кала через влагалище свидетельство мочевлагалищных и прямокишечно-влагалищных свищей. При IV стадии появляются метастатические паховые и надключичные лимфоузлы.
Рак шейки матки делят на четыре стадии (I, II, III и IV), каждая из стадий делится на две подстадии (A и B), а каждая из подстадий IA и IB еще на две — IA1, IA2 и IB1, IB2. Выбор метода лечения рака шейки матки зависит от стадии заболевания. Хирургическое лечение используют при стадиях IA1, IA2, IB и реже IIA. Объем операции зависит от глубины инвазии, наличии метастазов в тазовых и парааортальных лимфоузлах. При стадии IA1 возможно выполнение конизации шейки матки (клиновидная биопсия, конусовидная эксцизия — ампутация конусовидного участка шейки матки, которая состоит в удалении части шейки матки в виде конуса) или простой экстирпации матки с придатками: трубами и яичниками. При стадиях IA2, IB1, IB2 и IIA показана радикальная экстирпация матки с удалением тазовых, а иногда и парааортальных лимфоузлов. Во время этой операции кроме матки с придатками и лимфоузлов удаляют еще и верхнюю треть влагалища, а также части связок матки и жировую клетчатку параметрия и клетчатку, окружающую шейку матки. При обнаружении метастазов в лимфоузлах, лечение после операции дополняют лучевой или одновременной химиолучевой терапией. Обычно комбинированное лечение (операция+лучевая терапия) проводят при стадиях IB и IIA. Иногда при инвазивном раке шейки матки (стадии IA2, IB1) выполняют сложную радикальную операцию, которая позволяет сохранить детородную функцию, под названием трахелэктомия. Во время операции удаляют только пораженную раком ткань шейки матки и окружающие лимфатические узлы [4]. Эффективность хирургического лечения и лучевой терапии при ранних стадиях инвазивного рака шейки матки практически одинаковая, лучевая терапия используется в виде дистанционной гамматерапии и брахитерапии. Длительность сочетанной лучевой терапии (дистанционной и брахитерапии) не должна превышать 55 дней. При стадиях IB2–IV стандартным лечением во всем мире признана одновременная химиолучевая терапия (раньше при этих стадиях проводили только лучевую терапию). При IVB стадии возможно применение только химиотерапию. Однако, женщины больные СПИДом и раком шейки матки одновременно, вылечиваются от рака не так успешно, как ВИЧ-отрицательные пациентки [5, 6].
Результаты исследования. Таким образом, в связи с большой вероятностью возникновения рака шейки матки у ВИЧ-инфицированных женщин и с целью раннего его выявления, им необходимо сделать ПАП-мазок, при отсутствии выявления атипичных клеток, необходимо повторить исследование через полгода, а затем, при отрицательных результатах, 1 раз в год. При обнаружении в ПАП-мазке всех видов SIL выполняется кольпоскопия с прицельной биопсией изменённых участков слизистой матки. Это позволяет не только выявить рак шейки матки на начальных стадиях, но также предупредить его развитие, путём диагностирования предопухолевых изменений эпителия шейки матки, лечение которых не позволяет развиться опухоли.
Выводы. СПИД-ассоциированный рак шейки матки развивается более стремительно, чем рак шейки матки ВИЧ-отрицательных женщин и приводит к многочисленным осложнениям. У женщин с положительным ВИЧ статусом предопухолевое состояние шейки матки с большей̆ вероятностью переходит в инвазивный рак, чем у ВИЧ-отрицательных женщин. Женщины, больные СПИД и ВИЧ-инфицированные женщины, должны находиться под постоянным наблюдением системой здравоохранения, так как имеют более высокий риск развития рака шейки матки.
Список литературы
1. У В.Н. Ошибки в лечении дисплазии шейки матки / В.Н. Беляковский // Иммунопатология, аллергология, инфектология. – 2008. – №1. – С. 83-87.
2. Биджиева Б.А. Генетическая нестабильность и аллельный полиморфизм у больных с дисплазиями и раком шейки матки, вызванными персистенцией ДНК вируса папилломы человека / Б.А. Биджиева. – М.: МИА, 2008. – 34 с.
3. Красногольский В.И. Патология влагалища и шейки матки / В.И. Красногольский. – М.: Медицина, 2007. – 172 с.
4. Прилепская В.Н., Роговская С.И., Межевитинова С.А. Кольпоскопия: практическое руководство / В.Н. Прилепская, С.И. Роговская, С.А. Межевитинова. – М.: МИА, 2001. – 100 с.
5. Садовникова В.Н., Вартапетова Н.В., Карпушкина A.B. Эпидемиологическая характеристика ВИЧ-инфекции у женщин / В.Н. Садовникова, Н.В. Вартапетова, А.В. Карпушкина // Эпидемиология и вакцинопрофилактика. – 2011. – №6. – С. 4-10.
6. Трушина О.И., Новикова Е.Г. Роль папилломавирусной инфекции в генезе рака шейки матки / О.И. Трушина, Е.Г. Новикова // Российский онкологический журнал. – 2009. – №1. – С. 45- 51.
Для женщин, живущих с ВИЧ-инфекцией в Московской области, наш Центр предлагает уникальную возможность по ранней диагностике предраковых и онкологических заболеваний шейки матки. Уже более пяти лет всем женщинам, наблюдающимся в нашем Центре, доступно обследование на вирус папилломы человека (ВПЧ). Обследование проводится путем двойного цервикального скрининга - комплексное обследование, включающее в себя: цитологическое исследование соскобов с шейки матки и из цервикального канала методом жидкостной цитологии и ПЦР-исследование на ВПЧ высокого канцерогенного риска. Комбинация двух методов является признанным стандартом для выявления патологий и установления возможного риска развития рака шейки матки всего за одно посещение врача-гинеколога.
Я – женщина и у меня выявлена ВИЧ-инфекция.
• Я живу с ВИЧ и не принимаю АРВТ.
• Мой иммунный статус ниже 500 кл;
• Раньше у меня выявлялись инфекции, передаваемые половым путем (герпес, хламидиоз, гонорея, бактериальный вагиноз и др.).
• Количество рожденных мною детей 2 и более.
• Мои первые роды были в возрасте до 20 лет.
На сегодняшний день у нас в Центре обследовано уже более 2000 женщин с ВИЧ-инфекцией в возрасте от 19 до 62 лет (средний возраст - 33,2 года). При обследовании в нашем Центре ВПЧ высокого онкогенного риска (ВКР) выявились почти у 50% женщин, что почти в 4 раза чаще, чем в общей популяции. Предраковые заболевания шейки матки были выявлены в 13% случаев, из них почти половина уже в тяжелой степени.
Основные факты по Российской Федерации:
Ежегодно регистрируется 17000 новых случаев рака шейки матки.
Каждый третий случай рака шейки матки (34,6%) является запущенным.
Для женщин, живущих с ВИЧ-инфекцией вероятность развития рака шейки матки в 9 раз больше, чем у женщин без ВИЧ-инфекции.
В группе женщин с низким уровнем СD4+ лимфоцитов поражения эпителия шейки матки, ассоциированные с ВПЧ ВКР наблюдались в 3 раз чаще, чем у женщин с иммунным статусом более 200 клеток и получающих лечение. В присутствии ВИЧ-инфекции, особенно без АРВТ свою онкопрограмму ВПЧ может реализовать менее чем за год.
Комплексная борьба с раком шейки матки включает первичную профилактику (вакцинацию против ВПЧ), вторичную профилактику (скрининг и лечение предраковых поражений), третичную профилактику (диагностику и лечение инвазивного рака шейки матки) и паллиативную помощь.
ВПЧ передается главным образом при сексуальных контактах, и большинство людей инфицируются ВПЧ вскоре после того, как начинают вести половую жизнь.
Рак шейки матки развивается в результате инфицирования половым путем определенными типами ВПЧ: два типа ВПЧ (16 и 18) вызывают 70% всех случаев рака и предраковых поражений шейки матки.
Вакцины, защищающие от ВПЧ 16 и 18, рекомендованы ВОЗ и одобрены для использования во многих странах.
Скрининг и лечение предраковых поражений у женщин является эффективным с точки зрения затрат способом профилактики рака шейки матки.
Рак шейки матки можно вылечить, если диагностировать его на ранней стадии и начать лечение незамедлительно.
Основные факты по данным Всемирной организации здравоохранения:
Существует более 100 типов вирусов папилломы человека (ВПЧ), из которых как минимум 14 приводят к развитию рака.
Рак шейки матки является четвертым наиболее распространенным видом рака среди женщин в мире.
Мы предлагаем пациенткам проходить данное исследование ежегодно. Обследование проводится совершенно бесплатно.
Для обследования необходима явка в Центр к врачу-гинекологу в рабочие дни, кроме четверга (детский день) с 8:00 до 15:00, в субботу – по отдельно утвержденному расписанию.
В нашем Центре мы делаем все возможное для сохранения женского здоровья наших пациентов. Вы можете сделать главное: позаботиться о себе и сохранить свое здоровье! Обратитесь к врачам-гинекологам Центра и пройдите обследование!
Инфекционная клиническая больница №2, Москва
Московский областной НИИ акушерства и гинекологии;
кафедра акушерства и гинекологии ФУВ МОНИКИ им. М.Ф. Владимирского
Кафедра акушерства, гинекологии, перинатологии и репродуктологии факультета последипломного профессионального обучения врачей Московской медицинской академии им. И.М. Сеченова;
Научный центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова
Инфекционная клиническая больница №2, Москва
Особенности патологии шейки матки у больных c ВИЧ-инфекцией
Журнал: Российский вестник акушера-гинеколога. 2013;13(1): 17‑22
Гафуров Ю.Т., Краснопольская К.В., Назаренко Т.А., Сундуков А.В. Особенности патологии шейки матки у больных c ВИЧ-инфекцией. Российский вестник акушера-гинеколога. 2013;13(1):17‑22.
Gafurov IuT, Krasnopol'skaia KV, Nazarenko TA, Sundukov AV. The specific features of abnormalities of the cervix uteri in HIV-infected patients. Russian Bulletin of Obstetrician-Gynecologist. 2013;13(1):17‑22. (In Russ.).
Инфекционная клиническая больница №2, Москва
В обзоре отражены частота, особенности этиологии, патогенеза предраковых заболеваний и рака шейки матки у ВИЧ-инфицированных пациенток. Описаны методы обследования и лечения данной категории больных. Собраны разные мнения об эффективности стандартных методов терапии, приведены данные о положительной роли применения высокоактивной антиретровирусной терапии в комплексе лечебных мероприятий.
Инфекционная клиническая больница №2, Москва
Московский областной НИИ акушерства и гинекологии;
кафедра акушерства и гинекологии ФУВ МОНИКИ им. М.Ф. Владимирского
Кафедра акушерства, гинекологии, перинатологии и репродуктологии факультета последипломного профессионального обучения врачей Московской медицинской академии им. И.М. Сеченова;
Научный центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова
Инфекционная клиническая больница №2, Москва
Рак шейки матки (РШМ) занимает второе место в структуре смертности от онкологических заболеваний у женщин [3]. Диагностика и лечение патологии шейки матки остается одной из актуальных проблем гинекологии и, несмотря на успехи современной медицины, уровень заболеваемости имеет устойчивый восходящий тренд. Этиологическим фактором в развитии дисплазии шейки матки признано поражение вирусом папилломы человека (ВПЧ), а длительная персистенция ВПЧ способствует возникновению рецидивов и/или злокачественной трансформации поражений [4]. Особую актуальность представляет проблема заболеваний шейки матки у больных, пораженных вирусом иммунодефицита человека (ВИЧ). Это обусловлено тем, что повреждения шейки матки ВПЧ развиваются на фоне дисфункции иммунитета с нарушением противовирусного ответа [2], а наблюдение и обследование больных ВИЧ-инфекцией могут помочь смоделировать развитие интраэпителиальных повреждений в условиях иммунодефицита и разработать методы профилактики и лечения.
Накопленные данные исследователей всего мира показывают, что ВИЧ-инфицированные женщины отличаются более высоким уровнем хронического поражения ВПЧ, многообразием типов онкогенных вирусов, более частыми патологическими изменениями мазков по Папаниколау, агрессивностью течения РШМ по сравнению с этими данными у ВИЧ-отрицательных пациенток [64]. Выявлена прямая зависимость между продолжительностью заражения ВИЧ-инфекцией и возникновением патологии шейки матки [41]. Несмотря на успехи применения высокоактивной антиретровирусной терапии (ВААРТ), уровень поражения РШМ у ВИЧ-инфицированных остается выше, чем в популяции [13]. Длительное применение ВААРТ продлевает жизнь ВИЧ-инфицированных пациенток, следовательно, растет удельный вес ВПЧ-индуцированных заболеваний у этой категории больных [64].
ВИЧ-инфекция повышает риск поражения наружных половых органов ВПЧ [66], способствует более раннему [17] и более частому [37, 43] развитию тяжелой формы дисплазии и РШМ. При этом, чем выше степень иммунносупрессии и ниже уровень клеток СD4+, тем чаще выявляются высокоонкогенные штаммы ВПЧ и интраэпителиальные заболевания шейки матки, вплоть до рака [6, 18, 24, 45, 63].
Повреждения шейки матки способствуют гетеросексуальной и перинатальной передаче ВИЧ-инфекции [74]. У юных беременных, перинатально зараженных ВИЧ-инфекцией, при обследовании во время беременности чаще, чем в популяции, выявляли патологию шейки матки методом Папаниколау [15].
Мониторинг больных с дисплазией шейки матки показал значимое прогрессирование процесса у ВИЧ-инфицированных больных по сравнению с его течением у здоровых женщин [59, 63]. При обследовании больных с дисплазией шейки матки II-III степени выявлено, что у ВИЧ-инфицированных снижены показатели местного иммунного ответа [5]. ВПЧ высокого онкогенного риска, выявленный методом полимеразной цепной реакции из отделяемого цервикального канала, низкий уровень СD4+ и высокая вирусная нагрузка, являются факторами, способствующими возникновению дисплазии шейки матки, интраэпителиальной неоплазии [30, 37, 50, 73]. Напротив, при уровне СД4+ более 500 клеток/мл частота диагностики внутриэпителиальных повреждений у больных с ВИЧ-инфекцией не отличается от таковой у здоровых пациенток [81].
Частота выявления ВПЧ-инфекции быстро возрастает в течение первых лет после сероконверсии ВИЧ, по всей видимости, вследствие иммунной дисфункции слизистой оболочки шейки матки, характерной для ВИЧ-инфекции [79]. Хотя ВПЧ-инфицирование связано с передачей половым путем, у 22% ВИЧ-инфицированных больных с уровнем СD4+ менее 200 клеток/мл, не живущих половой жизнью, выявляли, по крайней мере, один тип ВПЧ [75].
В образцах, полученных при биопсии шейки матки, с нормальным эпителием и особенно с цервикальной интраэпителиальной неоплазией (CIN) у ВИЧ-инфицированных больных значительно чаще выявляли маркеры апоптоза [78].
ВИЧ-инфекция запускает патогенез плоскоклеточного РШМ у ВПЧ-пораженных больных [8, 38]. Уровень заболеваемости РШМ у лиц с ВИЧ или СПИДом имел стойкую тенденцию к увеличению в США за период с 1980 по 2007 г. [72]. В некоторых странах Африки РШМ является причиной самой высокой смертности [54]. Этот факт объясняется большим количеством ВИЧ-инфицированных женщин и отсутствием возможности цитологического исследования шейки матки [20]. Замечено, что РШМ чаще поражает больных, заразившихся половым путем [28], причем количество больных РШМ растет вместе с ростом числа ВИЧ-инфицированных [62].
У ВИЧ-инфицированных спектр ВПЧ более многообразен, чем у ВИЧ-негативных больных [24]. ВИЧ-инфицированные больные, пораженные РШМ, в среднем на 13 лет моложе ВИЧ-негативных [61]. Одни авторы указывают, что ВПЧ 16-го типа выявлялся у больных с ВИЧ-инфекцией, повреждениями шейки матки высокой степени тяжести и РШМ значительно чаще, чем у женщин с нормальными цитологическими мазками [24, 30, 44, 70]. Другие получили противоположный результат - ВПЧ
В настоящее время обязательным является ежегодный осмотр пациентки, включающий цитологическое исследование (РАР-тест), кольпоскопию, типирование ВПЧ у ВИЧ-инфицированных больных [19, 46]. Часто ВИЧ-инфицированные пациентки не знают, что использование РАР-теста может помочь в предотвращении РШМ [65], поэтому цитологическое исследование шейки матки должно быть включено в стандарт оказания помощи ВИЧ-инфицированным больным [65, 73]. Обязательному цитологическому обследованию должны быть подвергнуты ВИЧ-инфицированные пациентки старше 30 лет, так как у них вероятность диагностики повреждений шейки матки высокой степени тяжести достигает более 70% [9], и пациентки с уровнем СD4+ менее 200 клеток/мл [31].
Помимо РАР-теста в настоящее время для скрининга применяют цитологическое исследование вагинальных смывов, типирование ВПЧ, методы прямой визуализации [42]. Тестирование ВПЧ может способствовать сокращению числа случаев прогрессирующего РШМ [71]. Цитологическое исследование вагинальных смывов может быть альтернативой РАР-тесту [36], но не имеет преимуществ перед тестом Папаниколау [76]. Использование количественной оценки уровня вирусной нагрузки ВПЧ как маркера повреждения шейки матки у ВИЧ-инфицированных пациенток [51] и уровня СD4+ может быть полезным в качестве индикатора риска прогрессирования процесса [63].
ВПЧ проявляет наибольшую активность при уровне СD4+ менее 200 клеток/мл и вирусной нагрузке более чем 100 000 копий/мл [31, 75]. Любой подозрительный участок должен быть подвергнут биопсии и гистологической экспертизе [27], так как у 14,3% ВИЧ-инфицированных с нормальной цитологической картиной шейки матки выявляли CIN [7]. Эта группа больных характеризовалась уровнем СD4+ менее 500 клеток/мкл и поражением ВПЧ. Биопсия шейки матки должна сочетаться с выскабливанием цервикального канала, так как при этом значительно чаще выявляется патология у серопозитивных женщин [16].
Чаще всего для лечения повреждения шейки матки используется петлевая эксцизия, так как данная процедура может быть выполнена амбулаторно, позволяет исключить инвазивную неоплазию, оценить края резекции, сохранить репродуктивную функцию, сопровождается минимальной кровопотерей и низким процентом послеоперационных осложнений [68]. Однако данное вмешательство у ВИЧ-инфицированных больных менее эффективно, чем у ВИЧ-негативных пациенток [9, 52]. Петлевая эксцизия, выполненная больным с HSIL, несмотря на свою эффективность в 15% случаев дает рецидив процесса [53]. Рецидивы CIN после конизации составляют от 20 до 75% [77]. Описаны случаи развития рака через 2 года после петлевой эксцизии, выполненной по поводу LSIL [36]. Одной из причин неудачи считается низкий иммунный статус: при уровне СD4+ меньше 200 клеток/мл и CIN II-III степени [56]. Напротив, при уровне СD4+ более 500 клеток/мл, 5-летний мониторинг после конизации или петлевой эксцизии, выполненной по поводу HSIL, не выявил различий в группах ВИЧ-позитивных и ВИЧ-негативных пациенток [33]. Еще одна причина рецидива в том, что дооперационная кольпоскопия не всегда в состоянии визуализировать всю зону преобразования, и у части больных было эндоцервикальное распространение поражения [32].
ВИЧ-инфицированные больные хуже поддаются лучевой терапии РШМ [35]. В результате применения сочетанного (дистанционное + внутриполостное) лучевого лечения больных РШМ IIB-III стадии 4-летняя выживаемость у ВИЧ-негативных и ВИЧ-инфицированных составила 46% и 0 соответственно [47]. Поэтому есть мнение, что более предпочтительны радикальные методы лечения, например, экстирпация матки с верхней третью влагалища при дисплазии шейки матки [1].
Профилактика РШМ у ВИЧ-инфицированных больных остается важной задачей [40]. Среди женщин с ВИЧ-инфекцией в проспективном исследовании, которое включало меры по профилактике РШМ, уровень последнего не превышал такового в группе сравнения ВИЧ-негативных женщин [57].
Многие исследователи утверждают, что ВААРТ способствует снижению частоты, регрессу ВПЧ-повреждений шейки матки [60], предотвращению рецидива повреждений и РШМ [21, 39]. К примеру, ингибитор протеазы ВИЧ индинавир способен воздействовать на клетки, пораженные РШМ [48]. Следовательно, применение ВААРТ может быть приоритетом в профилактике РШМ по сравнению с вакциной.
Таким образом, большинство исследователей указывают на более высокую заболеваемость РШМ у ВИЧ-инфицированных больных по сравнению с таковой в общей популяции. Многие авторы обращают внимание на большую распространенность ВПЧ у этой категории больных.
В то же время существуют противоположные публикации, утверждающие, что вероятность более частого возникновения CIN и РШМ у больных ВИЧ-инфекцией не доказана [19], уровень клеток СD4+ у пораженных ВПЧ и ВПЧ-отрицательных не различается [19] и не влияет на возникновение интраэпителиальных повреждений [61]. Уровень повреждения эпителия шейки матки не зависит от продолжительности ВИЧ-инфекции, использования ВААРТ, вирусной нагрузки [30, 49, 59]. Уровень СD4+ до ВААРТ и после нее не имеет значения для прогнозирования течения РШМ [10]. Применение ВААРТ, увеличивая выживаемость за счет сокращения случаев смерти от оппортунистических инфекций, не влияет на продолжительность жизни больных раком шейки матки [14].
Таким образом, в мировой литературе нет единого мнения об особенностях патогенеза, терапии и профилактики интраэпителиальных повреждений у ВИЧ-инфицированных больных, и, следовательно, данная проблема ждет своего разрешения.
Что такое дисплазия шейки матки? Причины возникновения, диагностику и методы лечения разберем в статье доктора Игнатенко Татьяны Алексеевны, гинеколога со стажем в 14 лет.
Над статьей доктора Игнатенко Татьяны Алексеевны работали литературный редактор Елена Бережная , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Дисплазия шейки матки, или цервикальная интраэпителиальная неоплазия (ЦИН), или Cervical Intraepithelial neoplasia (CIN) — это патологический процесс, при котором в толще клеток, покрывающих шейку матки, появляются клетки с различной степенью атипии (неправильного строения, размера, формы).
Причины дисплазии шейки матки
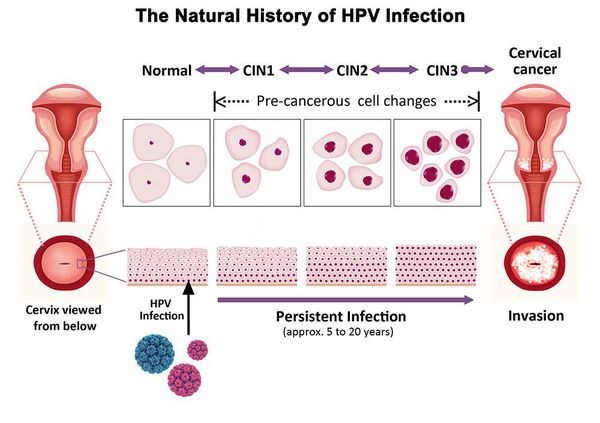
Папилломавирусная инфекция (ВПЧ) — основная причина дисплазии и рака шейки матки. К болезни приводит длительное персистирование именно ВПЧ высокого канцерогенного риска. У женщин с риском развития цервикальной неоплазии распространенность онкогенных типов ВПЧ чрезвычайно велика. ВПЧ становится причиной CIN 2-3 и рака шейки матки в 91,8% и 94,5% случаев соответственно. [1]
К факторам риска дисплазии шейки матки относится длительный приём контрацептивов и курение. Выявлена связь между пассивным курением среди некурящих и повышенным риском возникновения CIN 1. [3]
Другие факторы риска — раннее начало половой жизни, большое число и частая смена половых партнеров, употребление алкоголя, сопутствующие половые инфекции, много беременностей и родов. Риск цервикальной CIN 2 особенно высок у женщин, которые до этого имели опыт пересадки органов, у них выявлена ВИЧ-инфекция или они принимают иммунодепрессанты. [2]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы дисплазии шейки матки
Дисплазия шейки матки, как правило, имеет бессимптомное течение, поэтому пациентки не предъявляют никаких специфических жалоб.
Патогенез дисплазии шейки матки
Критический фактор развития цервикальной интраэпителиальной неоплазии — инфицирование вирусом папилломы человека. Во многих случаях цервикальная интраэпителиальная неоплазия легкой степени отражает временную реакцию организма на папиломавирусную инфекцию и без лечения исчезает в течение полугода-года наблюдения. При цервикальной интраэпителиальной неоплазии умеренной и тяжелой степени высока вероятность встраивания вируса папилломы человека в клеточный геном. Инфицированные клетки начинают продуцировать вирусные белки E6 и Е7, которые продлевают жизнь клетки, сохраняя ее способность к неограниченному делению. Неизбежно формирующиеся на этом фоне мутации клеток ведут к формированию предрака (дисплазии) и рака шейки матки, влагалища и вульвы.
Онкогенные белки ВПЧ (Е6, Е7) взаимодействуют с регуляторными белками клеток шейки матки, приводя к повышению активности онкомаркера p16INK4A, что свидетельствует о неконтролируемом размножении клеток шейки матки. Таким образом, сверхэкспрессия p16INK4A, определяемая в материале шейки матки, который получают при биопсии, является биомаркером интеграции вируса папилломы человека высокого риска в геном и трансформации эпителиальных клеток под действием вируса, что делает эту информацию полезной при оценке прогноза развития предраковых и злокачественных поражений, связанных с инфицированием генитального тракта вирусом папилломы человека. [5]
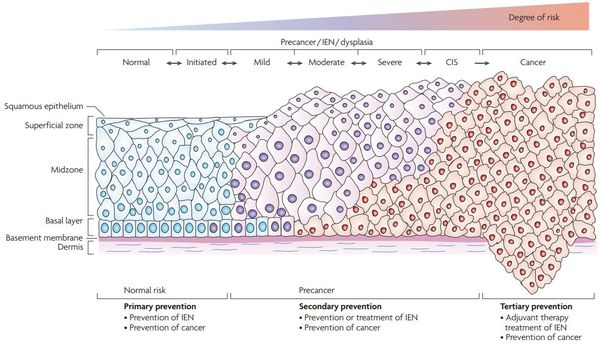
Классификация и стадии развития дисплазии шейки матки
Для постановки цитологического диагноза (по результатам цитологического исследования соскобов шейки матки и цервикального канала с окрашиванием по Папаниколау (Рар-тест) или жидкостной цитологии) используется классификация Бетесда (The Bethesda System, 2014), основанная на термине SIL (Squamous Intraepithelial Lesion) – плоскоклеточное интраэпителиальное поражение. [10]
Выделяют три вида результатов соскобов с поверхности шейки матки (экзоцервикса):
Классификация Папаниколау
- 1-й класс — нормальная цитологическая картина (отрицательный результат);
- 2-й класс — изменение морфологии клеток, которое обусловлено воспалением во влагалище и (или) шейке матки;
- 3-й класс — единичные клетки с аномалией ядер и цитоплазмы (подозрение на злокачественное новообразование);
- 4-й класс — отдельные клетки с явными признаками озлокачествления;
- 5-й класс — много типично раковых клеток (злокачественное новообразование).
Существуют также гистологические классификации для оценки материала, полученного при биопсии.
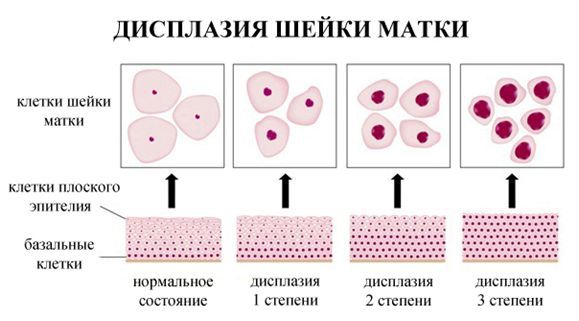
По классификации R. M. Richart (1968) в зависимости от глубины поражения поверхностного клеточного слоя выделяют три степени дисплазии шейки матки:
- ЦИН 1 (дисплазия слабой степени) — признаки папилломавирусной инфекции (койлоцитоз и дискератоз). Поражение до 1/3 толщины клеточного пласта;
- ЦИН 2 (дисплазия средней степени) — поражена 1/2 толщины клеточного слоя;
- ЦИН 3 (дисплазия тяжелой степени) — поражение более 2/3 клеточного слоя. [8]
В приведенной ниже таблице даны соотношения классификаций предраковых поражений шейки матки. [9]
| Система Папаниколау | Описательная система ВОЗ | CIN | Терминологи- ческая система Бетесда (ТСБ) |
|---|---|---|---|
| Класс 1 (норма) | Отсутствие злокачественных клеток | Отсутствие неопластических изменений | Норма |
| Класс 2 (метаплазия эпителия, воспалительный тип) | Атипия, связанная с воспалением | Реактивные изменения клеток ASC: ASC - US, ASC - H | |
| Класс 3 ("дискариоз") | Слабая дисплазия | CIN 1 койлоцитоз | LSIL |
| Умеренная дисплазия | CIN 2 | HSIL | |
| Тяжелая дисплазия | CIN 3 | ||
| Класс 4 (клетки, подозрительные на рак или карцинома in situ | Карцинома in situ | ||
| Класс 5 (рак) | Инвазивная карцинома | Карцинома | Карцинома |
Осложнения дисплазии шейки матки
Последствия дисплазии шейки матки
Основное и самое опасное осложнение цервикальной интраэпителиальной неоплазии заключается в развитии рака шейки матки, любой случай развития которого — результат упущенных возможностей диагностики и лечения дисплазии шейки матки. [7]
Проводились длительные, систематические исследования риска рака шейки матки у женщин с диагнозом цервикальной интраэпителиальной неоплазии 3 степени (CIN3) по сравнению с женщинами, у которых были нормальные цитологические результаты. Согласно полученным данным, долгосрочный относительный риск развития рака шейки матки зависит от различных гистологических типов CIN3 и выше всего он для аденокарциномы in situ. Даже через 25 и более лет после конизации (хирургического иссечения патологических тканей шейки матки) риск злокачественного перерождения клеток был значительным. [4]
Диагностика дисплазии шейки матки
Для ранней диагностики предраковых поражений шейки матки во многих странах мира существует система цервикального скрининга.
Методы диагностики дисплазии шейки матки
В России система цервикального скрининга включает последовательность действий:
- Цитологическое исследование: РАР-тест;
- ВПЧ-тестирование: в США и странах Евросоюза ВПЧ-тест применяется для первичного скрининга рака шейки матки (РШМ). В России его использование вариативно: при первичном скрининге в сочетании с РАР-тестом, в качестве самостоятельного теста, при ведении пациенток с неясными результатами РАР-теста (ASCUS) и для наблюдения паценток после лечения HSIL;
- Кольпоскопия: показаниями к исследованию являются положительные результаты РАР-теста (класс 2-5). Метод основан на осмотре шейки матки при помощи увеличивающих оптических систем и проведения диагностических проб с растворами уксусной кислоты и йода (Люголя). С помощью кольпоскопии определяют локализацию поражения, его размер, выбирают участок для проведения биопсии, определяют тактику лечения.
При кольпоскопии должна быть тщательно оценена зона трансформации (переходная зона стыка двух видов покровного эпителия шейки матки).
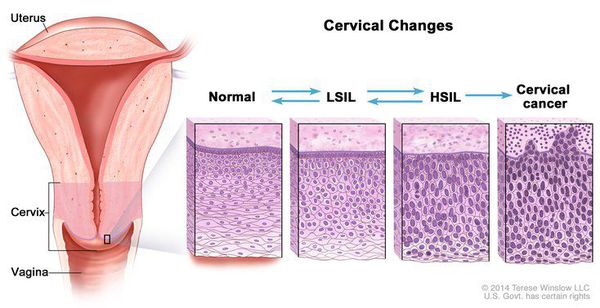
Влагалищная часть шейки матки (экзоцервикс) покрыта многослойным плоским эпителием. В канале шейки матки (цервикальном канале, эндоцервиксе) — цилиндрический эпителий. Место перехода цилиндрического эпителия цервикального канала в многослойный плоский эпителий поверхности шейки матки носит название зоны трансформации. Эта область имеет большое клиническое значение, поскольку именно в ней возникает более 80% случаев дисплазии и рака шейки матки.
Лечение дисплазии шейки матки
Динамическому наблюдению подлежат молодые пациентки (до 35 лет) с LSIL (ВПЧ, ЦИН 1, ЦИН 2, если при биопсии не обнаружен белок р16, являющийся признаком проникновения ВПЧ высокого риска в геном и трансформации опухолевых клеток под действием вируса). Наблюдать возможно пациенток только с 1 и 2 кольпоскопическим типом зоны трансформации.
Контрольные осмотры, цитологическое и ВПЧ-тестирование показаны через 6 и 12 месяцев после первичного обнаружения патологии.
Хирургическое лечение дисплазии
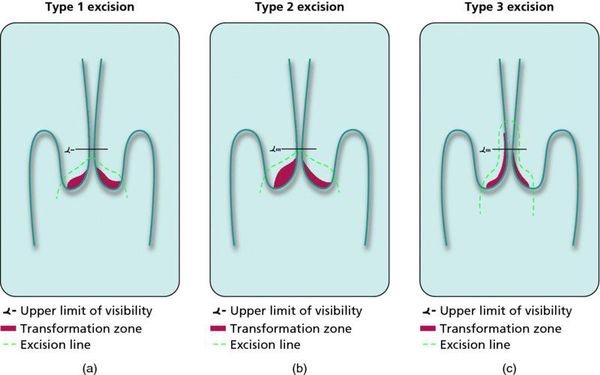
Немаловажно, что при выявлении по кольпоскопии 3 типа зоны трансформации на фоне положительного РАР-теста гинеколог обязан провести выскабливание слизистой канала шейки матки и/или широкую эксцизионную биопсию (конизацию шейки матки) для исключения опухолевого процесса, потенциально располагающегося вне зоны кольпоскопического обзора. Немаловажно наблюдение после операции через 6 и 12 месяцев с выполнением цитологического соскоба и ВПЧ-теста.
Следует отметить, что процедура хирургического иссечения патологических тканей на шейке матки увеличивает риск преждевременных родов. А сама по себе цервикальная интраэпителиальная неоплазия первой степени на течении беременности и родов никак не отражается и зачастую опасности не представляет. [12]
Средний возраст женщин, когда может потребоваться хирургическая коррекция цервикальной внутриэпителиальной неоплазии — около 30 лет. Хирургическое лечение нередко ассоциировано с неблагоприятным течением последующей беременности. Частота и тяжесть неблагоприятных осложнений возрастают с увеличением глубины иссекаемых тканей. [13]
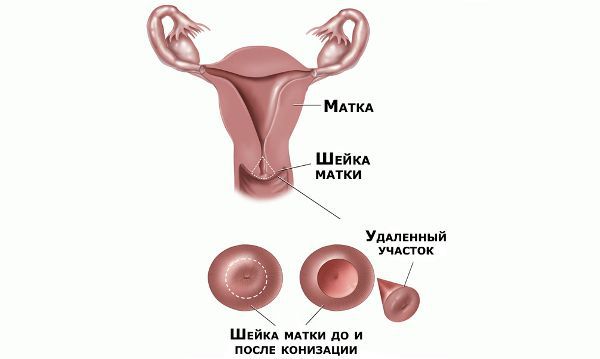
Реабилитация после хирургического лечения
В течение месяца после операции следует воздержаться от спринцеваний, половых контактов и не пользоваться тампонами. На 2–3 недели исключают тяжёлые физические нагрузки и тепловые процедуры. Незначительные сукровичные выделения, усиливающиеся иногда до менструальноподобных, в течение 10–20 дней после операции — это нормальное явление.
При реабилитации после хирургического лечения шейки матки эффективны препараты, содержащие антисептик и стимулятор регенерации эпителия.
После лечения возможен рецидив, поэтому необходимо пожизненное наблюдение: цитологический мазок через 6 и 12 месяцев после операции, затем раз в год в течение 10 лет, далее раз в 3 года.
Планировать беременность после операции на шейке матки можно не ранее, чем через 3–6 месяцев. Эти сроки будут зависеть от глубины эксцизии или конизации и длины шейки матки [9] .
Лечение дисплазии при беременности
В большинстве случаев лечение должно быть отложено на послеродовый период. При беременности на фоне дисплазии шейки матки каждые три месяца проводится кольпоскопический и цитологический контроль. При выявлении рака шейки матки пациентку консультирует онкогинеколог. Доктор подбирает тактику лечения, может потребоваться прервать беременность по онкологическим показаниям [9] .
Прогноз. Профилактика
Дополнительными факторами риска прогрессирования ПВИ с формированием предраковой патологии являются:
- курение;
- длительное использование гормональных контрацептивов;
- многократные травматичные роды;
- ВИЧ-инфекция.
- У пациенток с ЦИН часто обнаруживают вирус простого герпеса 2 типа, цитомегаловирусную инфекцию, хламидийную урогенитальную инфекцию, бактериальный вагиноз, ассоциированный с резким снижением или отсутствием вагинальной лактофлоры, повышенным ростом во влагалище Gardnerella vaginalis и Atopobium vaginae, повышение концентрации в бакпосеве грибов рода Candida, Mycoplasma hominis.
Устранение и профилактика данных факторов способны снизить вероятность развития предраковой патологии шейки матки.
Рак шейки матки поражает преимущественно женщин репродуктивного возраста. Скрининг является важной стратегией вторичной профилактики. Длительный процесс канцерогенной трансформации от появления в организме вируса папилломы человека (ВПЧ) до инвазивного рака дает широкие возможности для выявления заболевания на стадии, когда лечение высокоэффективно. Подходящими скрининговыми тестами в мире признаны цитологическое исследование, визуальный осмотр после применения уксусной кислоты и тесты на выявление ВПЧ. Всемирная организация здравоохранения рекомендует проводить скрининг женщин по крайней мере один раз в жизни в возрасте от 30 до 49 лет. [14]
Согласно приказу Министерства здравоохранения РФ от 03.02.2015. N36ан "Об утверждении порядка проведения диспансеризации определенных групп взрослого населения", осмотр со взятием мазка (соскоба) с поверхности шейки матки и цервикального канала на цитологическое исследование производится 1 раза в 3 года для женщин в возрасте от 21 года до 69 лет включительно.
Читайте также:

