Цитомегаловирус и болезнь крона
Обновлено: 12.05.2024
Олег Самуилович Шифрин, профессор, доктор медицинских наук:
Диагностический процесс – это динамический процесс. Лечение обострения болезни Крона, как, впрочем, и язвенного колита, не тождественно лечению в аспекте поддержания ремиссии. Поэтому мы должны проводить диагностический процесс постоянно, мониторировать состояние пациента с тем, чтобы решить такую задачу: какую терапию нам назначить в каждый определенный момент времени в аспекте лечения обострения или поддержания ремиссии.
Диагностические ошибки. Они зависят от двух обстоятельств: от объективных трудностей диагностики, особенно в каких-то определенных конкретных случаях; и безусловно, они могут быть связаны, и очень часто, к сожалению, с субъективным фактором – недопониманием врачей каких-то сущностных явлений заболевания, незнанием клиники, которые предопределяются чаще всего, что врач мало видит больных данных нозологий, а именно болезнью Крона.
В нашей клинике под руководством Владимира Трофимовича Ивашкина мы очень часто видим пациентов с болезнью Крона. У многих из них это заболевание недодиагностировано на догоспитальном этапе – примерно у пятой части пациентов, которые поступают в клинику. Это связано, во-первых, и прежде всего, с небольшим опытом врачей, которые поставили на догоспитальном этапе неправильный диагноз.
Какие еще наблюдаются огрехи ведения подобных пациентов, даже если диагноз был поставлен? Неверный выбор тактики лечения. Это связано, прежде всего, с тем, что, несмотря на то, что нозологический диагноз был поставлен верно, не была проведена оценка топической локализации заболевания, топической локализации воспалительного процесса и выбран неверный лечебный подход к ведению подобных пациентов. Ну и, наконец, во многих случаях врачи на местах не выполняют рекомендации специализированного центра: иногда по собственной оплошности, а иногда – из-за неимения достаточного количества современных лекарственных препаратов.
Итак, мы видим, что объективные трудности и ошибки диагностики – это понятие относительное. Один и тот же случай, если его рассматривать в крупном, мультидисциплинарном центре, который глубоко занимается проблемой болезни Крона, при той же самой сложности каждого конкретного клинического случая, должен ставиться диагноз даже в сложном случае. В то же время, когда врачи не имеют опыта ведения таких пациентов, то диагноз в этом же случае, той же самой сложности, может быть не поставлен, и будет совершена диагностическая ошибка.
На данном слайде представлена модель течения болезни Крона. Выделяют начальную стадию и позднюю стадию течения заболевания. Принципиально важно, когда поставлен диагноз и когда назначена адекватная терапия. Что такое поздняя стадия? Это стадия, сопряженная с органной недостаточностью, с развитием стриктур кишки, с развитием различных фистул, которые плохо поддаются лечению. У больных в поздней стадии обычно проводятся многочисленные хирургические вмешательства. Так вот развитие поздней стадии заболевания очень тесно связано с поздним диагнозом и, соответственно, неназначением терапии в тот момент, когда она должна была быть назначена. Опять же, мы упираемся в проблему нозологической диагностики заболевания, проблему диагностики топических локализаций заболевания и так далее.
Надо сказать, что воспалительные заболевания кишечника, в том числе и болезнь Крона, совершенно не редкие заболевания. Соотношение населения к числу пациентов в Западной Европе, в Соединенных Штатах, в Канаде составляет примерно 320 пациентов на 100 тысяч человек. Это значительное количество, и поэтому нельзя считать данные заболевания редкими. Отмечается рост заболеваемости практически во всех странах мира.
К сожалению, в нашей стране эпидемиология болезни Крона не разработана. В отдельных исследованиях, которые проводились в регионах, получено довольно странное соотношение пациентов с болезнью Крона к числу пациентов с язвенным колитом: 1 к 10, когда во всем мире это соотношение приближается к единице. Это говорит о том, что, к сожалению, в нашей стране проблема диагностики болезни Крона далеко не решена, что болезнь Крона не диагностируется у многих больных. Это приводит, конечно, к тяжелому течению заболевания.
На данном слайде показана работа, в которой изучалась смертность при неконтролируемой болезни Крона, то есть неадекватно леченой болезни Крона, то есть недиагностированной во многих случаях болезни Крона в такой стране, как Великобритания. Посмотрите соотношение смертности пациентов даже при легкой форме болезни Крона – 1,27. А при тяжелой форме, при неадекватном лечении, то есть, соответственно, у пациентов, у которых не поставлен вовремя диагноз, соотношение смертности у нелеченых и леченых пациентов составляет почти 2,5.
Конечно, клиника болезни Крона очень полиморфна, огромное разнообразие клинических проявлений: это и абдоминальные боли, диарея, дефицит питания, лихорадка, артралгии, свищи, анемия, кровотечение, пальпируемые инфильтраты, парапроктиты. Причем все эти клинические стигматы могут находиться в разной пропорции, составлять мозаику разного типа.
Я хочу привести небольшой клинический пример. К нам в клинику обратился молодой человек с жалобами на постоянное похудание – потерю массы тела на протяжении 5 лет. До начала заболевания, как вы видите, индекс массы тела – 28 килограмм на квадратный метр, то есть он был довольно полный. И, наконец, на момент обращения в клинику – 20 килограмм на квадратный метр. Существенная разница. Помимо прогрессирующей потери массы тела его особенно ничто не беспокоило. Отмечал умеренный метеоризм, у него был кашицеобразный стул, но отнюдь не понос. Кашицеобразный стул один раз в день, который он, собственно, считал нормальным. И, наверное, он таковым и является. Не было ни гематохезии, ни лихорадки. Пациент обследовался. Вернее, его тщательно обследовали заботливые родители. Высказывалось предположение о многочисленных диагнозах. Думали о туберкулезе, о каком-то загадочном онкозаболевании. Некоторые высказывали мысль, что молодой человек просто болен шизофренией. Обратите внимание: псевдодиагноз – дисбактериоз. На протяжении двух лет молодому человеку ставился диагноз, которого вообще нет в природе.
При обследовании анализа крови в пределах нормы не было ни гипоальбуминемии, ни анемии. Колоноскопия в полном объеме выполнена не была, поскольку при проведении процедуры у молодого человека возникла выраженная абдоминальная боль. Ограничились сигмоскопией, которая не обнаружила каких-либо изменений.
Итак, молодой человек поступил в нашу клинику. Концепцию болезни Крона мы рассмотрели с самого начала и провели соответствующее обследование. И достаточно быстро получили подтверждение данной диагностической гипотезы. Нам помогли, конечно, лучевые методы исследования, еще до проведения полной колоноскопии с осмотром подвздошной кишки. Выявлен терминальный илеит, локальное сужение подвздошной кишки (это же подтвердило и ультразвуковое исследование), утолщение стенок терминального отдела подвздошной кишки. Кстати, у него был существенно повышен уровень кальпротектина – в 10 раз. Но об этом мы поговорим чуть позже. И, наконец, колоноскопия подтвердила наличие воспалительных изменений кишки.
Мы подтвердили диагноз. Пациенту было назначена адекватная терапия, о которой я не буду говорить, поскольку это не тема моего доклада. В настоящее время пациент чувствует себя совершенно неплохо, у него практически нет жалоб, но он получает соответствующую поддерживающую терапию.
Так где же могут скрываться пациенты с недиагностированной болезнью Крона? Наш случай показывает, что это могут быть люди с необъяснимой потерей массы тела. Нужно думать не только об онкологии, нужно думать не только о туберкулезе и прочем, но в том числе и о воспалительных заболеваниях кишечника – прежде всего, болезни Крона.
Парапроктит. К сожалению, мы подчас видим, что пациенты с парапроктитами и какими-то абдоминальными симптомами наблюдаются разными докторами. По поводу парапроктитов их наблюдают проктологи, а по поводу абдоминальных жалоб (боли в животе, неустойчивый стул) их наблюдают терапевты-гастроэнтерологи. Соответственно, правильный диагноз не ставится.
Инфильтраты брюшной полости – это не диагноз, это повод к диагностическому поиску. Но также иногда в течение длительного времени пациент фигурирует под такой, мягко говоря, диагностической концепцией, и не принимается попыток уточнения истинного диагноза.
Остановимся вкратце на тех диагностических методиках, которые представляют наибольший интерес и которые помогают диагностировать болезнь Крона. На первом этапе, когда мы ставим инициальный диагноз болезни Крона, мы в любом случае должны проводить дифференциальный диагноз инфекции. У меня нет времени, чтобы подробно осветить данный раздел, но иерсиниоз – инфекционное заболевание, клиника которого во многом похожа на течение относительно нетяжелой болезни Крона, – занимает здесь, наверное, первое место. Безусловно, нужно на первом, нозологическом этапе диагностики болезни Крона проводить дифференциальный диагноз иерсиниоза. Об этом я еще скажу чуть позже.
Но диагноз – это динамический процесс. Диагностический поиск должен проводиться пациенту при уже установленном диагнозе. И если наше лечение неэффективно, даже при правильной постановке диагноза болезни Крона, на первоначальном этапе следует думать о возможном присоединении вторичной инфекции.
Очень часто мы видим, что клостридиальная инфекция присоединяется к течению заболевания у пациентов с гранулематозным колитом, даже без всякого предшествующего назначения антибиотикотерапии. И это необходимо учитывать
Фекальный кальпротектин – очень ценный метод. Кальцийсодержащий белок, содержание которого в каловых массах в просвете кишки коррелирует с активностью воспаления слизистой оболочки кишечника. Его содержание очень хорошо коррелирует с эндоскопической картиной заболевания. Повышение уровня кальпротектина может служить своеобразным предиктором возможного рецидива через какое-то время.
Еще одно обстоятельство. Мы все знаем, что С-реактивный белок – очень важный и нужный маркер для оценки активности воспаления при болезни Крона. Он хорошо коррелирует с клинической симптоматикой, он хорошо ассоциируется с сывороточным уровнем фактора некроза опухоли у данных пациентов. Но в отдельных случаях, несмотря на видимую активность воспалительного процесса у пациента, С-реактивный белок остается в нормальных пределах. И в этих случаях как раз мы можем во многом рассчитывать на кальпротектин, в тех случаях, когда С-реактивный белок не повышен. Это самое простое исследование, но оно дает массу важной информации.
Когда поступает тяжелый больной с гранулематозным колитом, впрочем, как и с болезнью Крона, – обязательно следует проводить рентгенографическое исследование брюшной полости, причем обязательно в положении лежа, для того чтобы исключить токсическую дилатацию кишки, которая может быть и при язвенном колите, и при болезни Крона. Естественно, рентгеновскую картину следует коррелировать с клинической симптоматикой. В данном случае нет токсической дилатации, мы исключили ее. Но, тем не менее, данный подход является совершенно правомерным.
Лучевые методы при болезни Крона играют очень большую роль. При язвенном колите ситуация несколько проще. Поступает тяжелый пациент, ему нельзя проводить подготовку перед проведением колоноскопии, поэтому мы в этих случаях можем провести эндоскопическое исследование без предшествующей подготовки дистальных отделов толстой кишки и на этом основании поставить диагноз. При болезни Крона ситуация иная: в большинстве случаев поражается тонкая кошка. Добраться до нее с помощью эндоскопических методов у тяжелого пациента крайне затруднительно, из-за опасения не вызвать у него прогредиентного ухудшения течения заболевания. Поэтому лучевые методы нам могут очень помочь.
Ультразвук в данном случае не требует существенной подготовки, но может, с одной стороны, показать нам наличие воспалительных изменений кишки, дать топическую диагностику процесса, показать, нет ли у пациента наличия инфильтратов и так далее. Конечно, это в опытных руках и на хорошем аппарате.
Компьютерная энтерография – метод крайне важный, крайне нужный. Но все же перед его проведением следует проводить подготовку кишечника, нужно очистить кишку. Здесь встречаются, конечно, определенные сложности у тяжелых пациентов. Но, тем не менее, это исследование очень ценное, и мы стараемся всегда проводить его, когда есть такая возможность, еще до колоноскопии.
Вот посмотрите, какую важную информацию может нам дать компьютерная энтероколонография. Она может показать, с одной стороны, и наличие глубоких язв в стенке кишки. Она может показать нам разнообразные свищевые поражения – например, межкишечные свищи, кишечно-пузырные свищи, наличие инфильтратов. Ведь почему клиническая картина болезни Крона такая сложная? Потому что возникают крайне разнообразные морфологические изменения кишки, и это определяет клиническую сложность общей симптоматики заболевания.
Задача диагностики болезни Крона, как я уже говорил, это процесс динамический. Для оценки того, что у пациента – ремиссия или обострение, – мы не можем базироваться только на клинической картине, даже с учетом возможности проведения лабораторных тестов, определения кальпротектина, С-реактивного белка и так далее. Мы должны знать состояние слизистой оболочки.
Разработан эндоскопический индекс болезни Крона. Он, может быть, не слишком простой, но достаточно точно отражает состояние слизистой оболочки и тонкой и толстой кишки. Критерии: это наличие глубоких язв, поверхностных язв, площадь изъязвлений, причем в каждом отделе кишечника.
Возьмем крайний случай, крайнюю эндоскопическую активность заболевания. Допустим, что обширные глубокие язвы, наиболее выраженные, имеют место в каждом отделе кишки. В первом столбике у нас получается, соответственно, 12 умножить на 5 – 60 баллов. Во втором столбике, при наличии обширных поверхностных язв, у нас получается, соответственно, 30, 50 и 50, итого – 190. Мы делим 190 баллов на 5 отделов кишки, в которых рассматриваем эндоскопические изменения, получаем, соответственно, 38. Причем некое уточнение. Если у пациента имеются язвенные стенозы и неязвенные стенозы, мы добавляем еще 3 плюс 3. Итого, максимальное количество баллов, которое мы оцениваем при данном индексе, может быть 44, от 0 до 44.
Течение заболевания различается на ранних стадиях. Если мы говорим о ранней стадии заболевания (а ранняя стадия может продолжаться длительное время, если вовремя поставлен диагноз, если вовремя назначена адекватная терапия), не возникает таких осложнений, как стенозы кишки, незаживающие свищи, у пациента не проводились многочисленные операции. Критериями вот этой ранней стадии, наличия ремиссии, выступает заживление слизистой (если брать эндоскопический аспект).
Владимир Трофимович Ивашкин, академик РАМН, доктор медицинских наук:
– Олег Самуилович, можно вам сразу вопрос? Почему у вас биологическая ремиссия как бы опережает клиническую ремиссию? Ведь в жизни все наоборот, вначале все-таки идет клиническая ремиссия, а затем уже, наверное, мы на протяжении длительного времени наблюдаем процесс биологической ремиссии.
Шифрин О.С.:
– Я здесь исхожу из мнения Коломбеля.
Ивашкин В.Т.:
– Ну, Коломбель-то Коломбелем, но у нас тоже головы есть.
Шифрин О.С.:
– Да, безусловно. Под биологической ремиссией в данном случае, скорее, подразумевается эндоскопическая ремиссия, потому что описываются эндоскопические изменения.
Ивашкин В.Т.:
– При пневмонии уходит кашель, уходит температура, а консолидация рентгенологическая (00:19:23) еще держится очень долго, а бронхоспастический синдром – полгода. При язвенной болезни уходит боль на второй-третий день после назначения ингибиторов протонной помпы, а язвенный дефект держится еще две недели, три недели, и так далее. И я думаю, здесь такая же закономерность.
Шифрин О.С.:
Ивашкин В.Т.:
– Вначале уходит лихорадка, улучшается общее самочувствие, появляется аппетит, улучшается кровь и так далее. А затем уже мы смотрим, и там постепенно начинает вся картина кишки меняться. Я думаю, все-таки такая последовательность.
Шифрин О.С.:
– Владимир Трофимович, я, собственно, это же хотел сказать, только другими словами. Что происходит при отсутствии клинической картины при ранней стадии заболевания? То есть во втором столбике отсутствуют жалобы, но при этом, как вы совершенно справедливо заметили, у пациента остаются единичные афтозные язвы, то есть ремиссия клиники опережает ремиссию эндоскопических изменений, то есть это фактически то, о чем вы только что сказали.
Но при поздней стадии заболевания ситуация несколько иная. Мы должны учитывать, что не может быть полной редукции клинических жалоб, как раз в связи с тем, что у пациента уже сформировались невоспалительные стенозы, ему проводились повторные операции. Соответственно, у него может присутствовать и абдоминальная боль, у него может присутствовать и учащенный стул и так далее, и так далее.
Еще два слова о дифференциальном диагнозе. У меня время кончается, я буду крайне краток. Иерсиниоз – заболевание достаточно коварное. Мы часто видим, что к нам в клинику под маской, соответственно, болезни Крона обращаются пациенты с иерсиниозом и наоборот. Клиника похожа. Мы должны на предварительном этапе обследования провести соответствующие иммунологические тесты на обнаружение антител.
Сейчас как раз (Владимир Трофимович, мы вам докладывали) у нас лежит пациентка, которой мы проводим дифференциальный диагноз между болезнью Крона и туберкулезом, потому что клиника очень похожа, эндоскопическая картина тоже очень похожа. И все это требует, безусловно, постоянного внимания.
Ну и, наконец, не следует думать, что первичный склерозирующий холангит – это удел только пациентов с язвенным колитом. Он встречается и при болезни Крона, и мы это видим. Какие тяжелейшие внекишечные поражения? Остеопороз с множественными переломами у пациентов, даже не получающих гормоны. Остеопороз у пациентов с воспалительными заболеваниями кишечника (естественно, и при болезни Крона) развивается совершенно не только потому, что они могут получать глюкокортикоиды. Высокий уровень провоспалительных цитокинов, активность заболевания сама по себе приводит к повышенному остеолизу костей, гормональным нарушениям, дефициту витамина D, кальция, который бывает порой в связи с неуместно жесткой диетой, которую назначают врачи. Так, мы видим, что в период ремиссии болезни Крона врачи на догоспитальном этапе объявляют пациентам о том, что они не должны употреблять молочные продукты. Поэтому пациенты пожилого возраста, с низкой массой тела, с сидячим образом жизни, не говоря уже о длительной терапии кортикостероидами, безусловно, должны в диагностическом плане подвергаться проведению остеоденситометрии.
И, наконец, благоприятным исходом заболевания в нашем случае будет высокое качество жизни и неснижение продолжительности жизни пациента. И этого можно добиться с помощью наших дел, то есть адекватной диагностики заболевания.
Цитомегаловирусный колит - диагностика
У людей с нормальным иммунитетом цитомегаловирус очень редко вызывает симптоматический колит. При сильном ослаблении иммунитета заболевание плохо поддается лечению и может угрожать жизни пациента. Предполагают, что вирус вызывает ишемический инсульт кишки (кровоизлияние) с образованием глубоких пенетрирующих язв и дальнейшей перфорацией.
При обзорной рентгенографии обнаруживают дилатацию кишки, иногда — наличие газа в просвете. При компьютерной томографии диагностируют значительное утолщение стенки кишки. Обычно при сигмоидоскопии и колоноскопии обнаруживают только признаки неспецифической воспалительной реакции.
В некоторых случаях, как и в пищеводе, в сигмовидной и прямой кишке язвы напоминают злокачественные. При биопсии наблюдается картина воспаления и включения цитомегаловируса. Распространено бессимптомное носительство цитомегаловируса (как и вируса герпеса). Диагноз цитомегаловирусного колита ставят только при наличии воспалительной реакции, сопутствующей вирусным включениям.
При наличии у больного язвенного колита и цитомегаловируса отдельную проблему представляет установление роли вируса в возникновении заболевания.
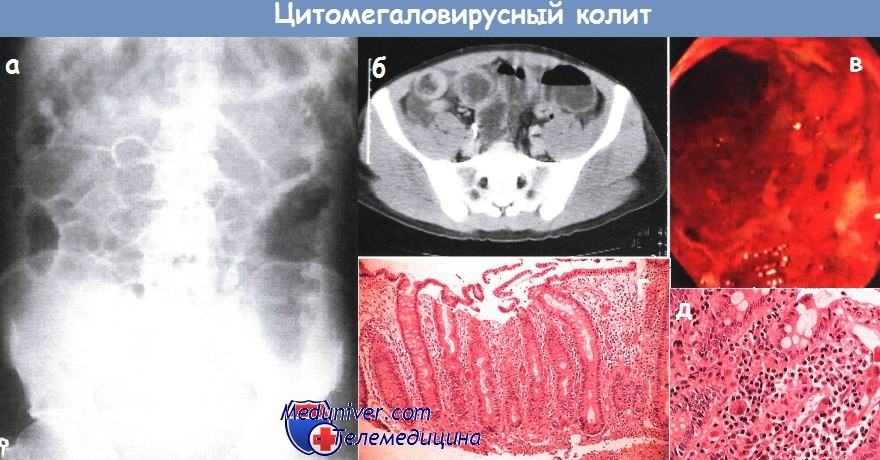
а - обзорная рентгенограмма брюшной полости при остром цитомегаловирусном колите. Наблюдаются утолщение стенки толстой кишки (особенно поперечно-ободочной) и небольшое вздутие тонкой и толстой кишки.
б - цитомегаловирусный колит. Значительное утолщение стенки толстой кишки. Компьютерная томография.
в - картина тяжелого изъязвления, вызванного цитомегаловирусом. Колоноскопия.
г - цитомегаловирусный колит. Повреждение эпителия с уплощением клеток, отделением их от основной мембраны и реактивной гиперплазией (удлинением) желез, сопровождающейся умеренным стромальным воспалительным инфильтратом.
Биопсия слизистой оболочки
д - слизистая оболочка толстой кишки: видно характерное массивное расширение зараженных цитомегаловирусом эпителиальных клеток собственной пластинки.
В зараженных клетках присутствуют амфифильные внутриядерные и гранулярные цитоплазматические включения. Большое увеличение
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Инфекции вызванные цитомегаловирусом: диагностика, лечение, профилактика
Вирусы герпеса — большие, покрытые оболочкой, двунитевые ДНК-вирусы (120—200 нм). Геном содержит 120—240 тыс. пар нуклеотидов, кодирующих более 35 белков. Оболочка состоит из гликопротеинов и Fc-рецепторов. Инфекция персистирует у человека на протяжении всей жизни, переходя в латентную форму после острой стадии и периодически рецидивируя (особенно при снижении иммунитета у человека).
Классификация герпес-вирусов
Все вирусы герпеса разделяют на:
• а-герпес-вирусы — быстрорастущие цитолитические вирусы, вызывающие латентную инфекцию и поражающие нейроны (вирусы простого и опоясывающего герпеса);
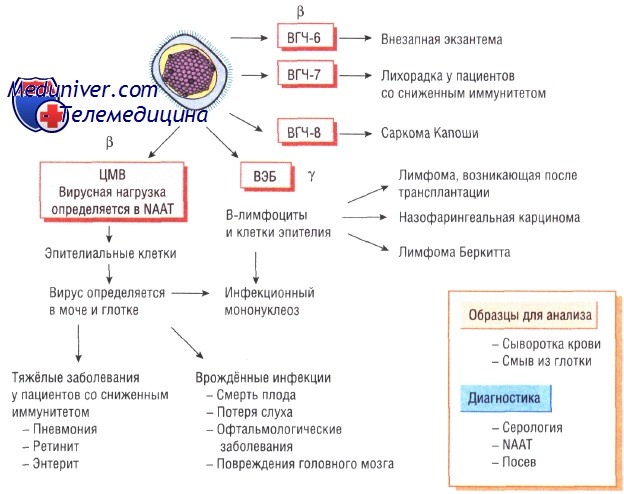
• бета-герпес-вирусы — медленно растущие вирусы, вызывающие латентные инфекции секреторных желёз и почек (цитомегаловирус);
• у-герпес-вирусы — вирусы, вызывающие латентный инфекционный процесс в лимфоидной ткани (вирус Эпштейна—Барр).
Недавно обнаруженные вирусы герпеса человека типа 6 и 7 (ВГЧ-6 и ВГЧ-7) относят к у-герпес-вирусам, так как они вызывают латентные инфекции лимфатических узлов и имеют генетические сходства именно с этой группой вирусов герпеса. ВГЧ-8, ассоциированный с саркомой Капоши, сходен с вирусом Эпштейна—Барр. Все вирусы герпеса, за исключением вируса простого герпеса типа 1 и 2, различны по антигенной структуре.
Инфекции вызванные цитомегаловирусом
По своей структуре цитомегаловирус похож на все остальные вирусы герпеса. Обычно он персистирует в организме на протяжении всей жизни. Его обнаруживают в моче и слюне человека. Примерно 50% населения Великобритании инфицированы ВГЧ-5.
Эпидемиология и патогенез цитомегаловирусной инфекции. Механизм передачи инфекции — вертикальный или контактный (от человека к человеку). Чем ниже социально-экономические условия, тем раньше происходит инфицирование. Возможен вертикальный механизм передачи инфекции. Кроме того, заражение может произойти при переливании крови или пересадке органов; в этом случае инфекции свойственно очень тяжёлое течение.
Клинические признаки инфекции вызванной цитомегаловирусом. Врождённая инфекция обычно протекает в тяжёлой форме. В начальном периоде выраженные симптомы заболевания отсутствуют. В дальнейшем возникает прогрессирующая глухота, задержка развития. При заражении после рождения заболевание протекает в лёгкой форме. У пациентов со сниженным иммунитетом (ВИЧ-инфекция, состояние после трансплантации органов) может развиться тяжёлая пневмония, ретинит, поражение кишечника, причём вирусная инфекция может быть приобретённой (от пересаженного органа) или собственной (латентная форма).
Диагностика инфекции вызванной цитомегаловирусом. Врождённую инфекцию диагностируют при проведении анализа мочи через 3 нед после рождения. У взрослых цитомегаловирус может быть культивирован либо определён молекулярно-генетическим методом в образцах мочи и крови. Исследование вирусной нагрузки имеет большое значение для диагностики тяжёлого течения инфекции и назначения своевременного лечения.
Лечение и профилактика инфекции вызванной цитомегаловирусом. При тяжёлой инфекции, угрожающей жизни пациента, а также при риске потери зрения лечение проводят ганцикловиром в комплексе с иммуноглобулином (при развитии пневмонии). Эфир ганцикловира, валганцикловир принимают внутрь, назначают в начале лечения и в качестве поддерживающей терапии. Ещё более токсичные альтернативные препараты (фоскарнет и цидофовир) ингибируют цепочечную ДНК-полимеразу. Важная мера профилактики заболевания — тщательный подбор донорских органов для пересадки и крови для переливания.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Цитомегаловирусная инфекция у больных воспалительными заболеваниями кишечника: первый клинический опыт в Донецкой области
Авторы: И.А. Зайцев, Г.Е. Полунин, А.Э. Дорофеев, Э.А. Майлян, И.В. Василенко, Ю.В. Пшеничная. Донецкий национальный медицинский университет им. М. Горького
Версия для печати
В настоящее время воспалительные заболевания кишечника (ВЗК) — неспецифический язвенный колит (НЯК) и болезнь Крона (БК) — рассматриваются
как состояния с высоким риском развития инфекционных осложнений. Связано это прежде всего с широким использованием в лечении больных препаратов, вызывающих развитие иммуносупрессии. Определенное значение имеет снижение естественной резистентности из-за нарушения целостности слизистой кишечника и изменения состава микрофлоры. Наконец, не исключено, что одной из причин или по крайней мере предрасполагающих к возникновению заболевания факторов является дефект иммунной системы [1].
Одним из частых возбудителей оппортунистических инфекций у больных с ВЗК является цитомегаловирус (ЦМВ) [2, 3]. Еще в 1961 г. Powell и соавт. впервые указали на возможную связь ЦМВ и ВЗК [4]. В настоящее время роль ЦМВ в развитии устойчивых к лечению кортикостероидами форм ВЗК, а также некоторых хирургических осложнений признается большинством авторов [5, 6]. Однако до сих пор не определены критерии диагноза, не ясна роль противовирусной терапии в лечении этих больных, не конкретизированы показания к ее назначению.
Целью нашего исследования было определение взаимосвязи между наличием маркеров цитомегаловирусной инфекции и показателями, характеризующими тяжесть течения и исходы заболевания у пациентов, страдающих болезнью Крона (БК) и неспецифическим язвенным колитом (НЯК).
Настоящая работа — первое обобщение опыта диагностики ЦМВ у больных с ВЗК в Украине.
Материалы и методы
При проспективном анализе нами была проведена оценка клинической и диагностической значимости выявления маркеров ЦМВ-инфекции у больных неспецифическим язвенным колитом и болезнью Крона (табл. 1). Пациенты вовлекались в исследование по мере их поступления в гастроэнтерологическое отделение ГБ № 3 г. Донецка и проктологическое отделение Донецкого областного клинического территориального медицинского объединения в случае, если им по клиническим показаниям выполнялась колоно- или ректоскопия с биопсией и они были ЦМВ-позитивными по результатам теста на наличие антител к вирусу. Основной причиной госпитализации в клинику было обострение основного заболевания.
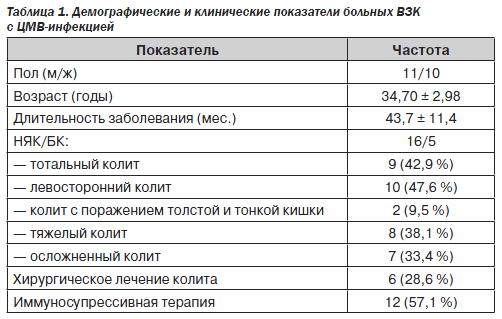
ЦМВ-инфекция была диагностирована у 21 человека. Возраст больных колебался от 21 до 71 года, хотя большинство пациентов были молодыми (средний возраст составил 34,7 ± 2,98 года). Число мужчин и женщин было приблизительно одинаковым. У 15 пациентов (71,4 %) отмечалось хроническое течение болезни, у 6 (28,6 %) — острое. 76,2 % обследованных составили пациенты с НЯК. Давность заболевания колебалась от 1 месяца до 10 лет (в среднем около 3,5 года).
Колоноскопическая оценка распространенности поражения и степени активности ВЗК. Две трети обследованных пациентов (66,7 %) подверглись фиброколоноскопии. Воспаление было оценено по стадиям, описанным Baron с соавт. [7]: стадия 0 — нормальная слизистая; стадия 1 — потеря сосудистого рисунка; стадия 2 — зернистая, нерыхлая слизистая; стадия 3 — кровоточивость и рыхлость слизистой; стадия 4 — спонтанное кровотечение, язвообразование. Тотальный колит диагностировали в случае, если в заболевание вовлекались проксимальные отделы толстого кишечника до печеночного угла; заболевание от селезеночного угла с поражением дистальных отделов обозначалось как левосторонний колит [8]. Обследуемые больные в группе распределились следующим образом: у 9 больных (42,9 %) отмечалось тотальное поражение толстой кишки, у 10 (47,6 %) — левостороннее поражение толстой кишки и 2 человека (9,5 %) имели поражение как толстой, так и тонкой кишки.
Наблюдение и лечение. Пациенты наблюдались в гастроэнтерологическом отделении ГБ № 3 и проктологическом отделении Донецкого областного клинического территориального медицинского объединения. В качестве базовой терапии всем больным были назначены препараты 5-аминосалициловой кислоты. Иммуносупрессивную терапию получали 12 человек (57,1 %). В большинстве случаев это была местная или системная терапия глюкокортикостероидами. Один пациент получал азатиоприн.
Биопсия. Пациентам, подвергшимся фиброколоноскопии, была проведена биопсия толстой кишки с целью гистологической оценки воспалительной активности и определения наличия специфических ЦМВ-включений (биоптат помещался в нейтральный формалин), а также для обнаружения ДНК ЦМВ методом ПЦР (биоптат помещался в физиологический раствор).
Серология. Всем пациентам были проведены следующие серологические исследования: определение антител классов IgM и IgG к ЦМВ методом ИФА, ДНК ЦМВ в крови и биоптате методом ПЦР. Для серологических исследований взяли по пять миллилитров венозной крови от каждого пациента.
Критерии диагностики ЦМВ-инфекции. Положительный результат в любом из тестов (антитела IgM и IgG, ДНК ЦМВ в крови и тканях кишки, а также специфические включения в биоптатах, окрашенных гематоксилин-эозином) расценивался как случай ЦМВ-инфекции.
Результаты исследования
Антитела класса IgG были обнаружены у 19 больных (90,5 % от пациентов с диагностированной ЦМВ-инфекцией). Антитела класса IgM были выявлены у трех пациентов (14,3 %) с НЯК, двое из них были IgG- и ДНК ЦМВ-позитивными. У третьего пациента выявили только антитела класса IgM без IgG и вирусной ДНК. Вирусная ДНК в крови была обнаружена у 5 человек (23,8 %), в биоптате толстой кишки — у 8 (30,1 %).
ДНК-позитивные пациенты были моложе и с меньшей давностью заболевания, чем ДНК-негативные. 6 из 10 больных НЯК и 4 из 5 пациентов с БК были ДНК-позитивными (соответственно 60 и 80 %) (табл. 2). У пациентов с БК ДНК вируса чаще находили в биоптате толстой кишки, в то время как при НЯК — в крови.
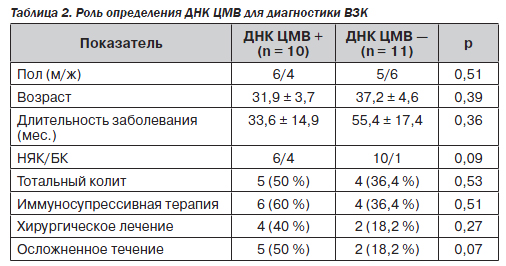
ДНК-позитивные пациенты чаще имели тяжелое и осложненное течение заболевания, большая часть получала иммуносупрессивную терапию. В этой группе также была выше частота оперативных вмешательств.
Мы оценили биоптаты тканей толстой кишки от четырнадцати пациентов (66,7 %) и не смогли обнаружить специфические ЦМВ-включения ни в одном случае.
Цитомегаловирусная инфекция достаточно распространена в популяции, в том числе среди больных ВЗК. В Донецкой области антитела к ЦМВ выявляются приблизительно у 80 % условно здоровой популяции (табл. 3). Среди больных с ВЗК распространенность ЦМВ еще выше (в нашем исследовании — 90,5 %). Это может быть результатом трансфузий крови и кровезаменителей в анамнезе, частых эндоскопических манипуляций, которые проводятся этим больным [10].
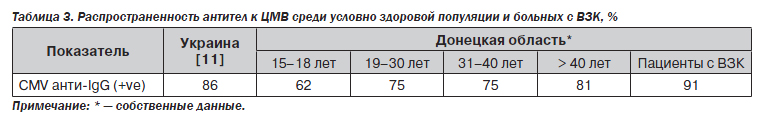
ВЗК рассматривается как иммунодефицитное состояние ввиду нарушения целостности кишечной стенки, состава нормальной микрофлоры кишечника, хирургического лечения, нарушения всасывания витаминов и питательных веществ. Главным же фактором обычно является проводимая иммуносупрессивная терапия (в нашей серии наблюдений — у 57 % больных).
Наличие антител класса IgG — признак инфицированности цитомегаловирусом. В то же время наличие антител IgM несет гораздо большую нагрузку. Среди наших больных антитела этого класса выявлены у 3 пациентов (табл. 4).
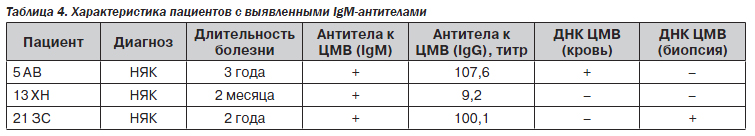
У пациентов 5 и 21 выявлены антитела к ЦМВ класса IgG в высоком титре, а также ДНК вируса в крови или биоптате, что скорее всего свидетельствует о реактивации латентной инфекции либо суперинфекции другим субтипом ЦМВ. У пациента 13 ни антитела класса IgG, ни ДНК вируса обнаружены не были, что говорит о высокой вероятности первичной инфекции. Это тем более интересно, что в литературе иногда описывают случаи, когда ЦМВ-инфекция является причиной манифестации ВЗК, провоцируя его. Данное предположение вполне вероятно с учетом небольшой продолжительности заболевания у нашего больного (2 месяца).
Наличие ДНК ЦМВ обычно рассматривают как признак активной инфекции. Из-за небольшого числа наблюдений мы не вполне можем быть уверены в правомочности наших выводов, тем не менее многие из них хорошо согласуются с данными литературы, в связи с чем позволим остановиться на них подробнее.
Во-первых, наши данные прямо указывают на то, что к развитию ЦМВ-инфекции предрасполагает иммунодефицит: среди получавших иммуносупрессивную терапию было больше ДНК-позитивных пациентов.
Во-вторых, обращает на себя внимание, что у большей части ДНК-позитивных больных имело место тяжелое течение заболевания, чаще встречался тотальный колит и осложнения. Возможно, это может служить доказательством того, что ЦМВ-инфекция играет отягощающую роль в течении ВЗК.
Во всяком случае, согласно литературным данным, нельзя отрицать тот факт, что среди состояний, послуживших показанием к хирургическому лечению у наших больных (табл. 5), практически все, за исключением поддиафрагмального абсцесса, могли быть ассоциированы с цитомегаловирусной инфекцией. Пусть роль ЦМВ в развитии полипоза пока уточняется, однако тяжелое воспаление, образование язв, свойственное ЦМВ-инфекции, вполне могло способствовать перфорации, тяжелым стриктурам кишечника и псевдополипозу.
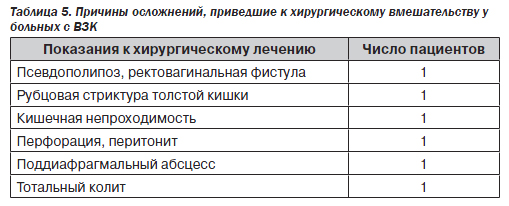
К сожалению, ни в одном из образцов биопсий нам не удалось найти характерные для ЦМВ-инфекции изменения. Это лишний раз подтверждает, что цитомегалия хотя и является высокоспецифичным маркером ЦМВ-инфекции, встречается достаточно редко.
Наше исследование было проспективным, ни в одном случае больные не получали противовирусную терапию. Нам трудно было бы оценить ее эффективность, не имея адекватной группы сопоставления. Хотя, по данным литературы, отношение к противовирусной терапии скорее позитивное, лишь некоторые авторы не видят особой пользы от ее применения.
Таким образом, на небольшом числе наблюдений мы впервые в Украине продемонстрировали распространенность и значимость ЦМВ-инфекции среди больных с ВЗК. Нам представляется вполне очевидной связь инфекции с тяжелым и осложненным течением заболевания и то, что фактором риска ее возникновения является иммуносупрессия.
Также очевидным является несовершенство современных диагностических критериев ЦМВ-инфекции, в первую очередь таких, которые бы позволили отличить инфицирование вирусом от вызываемого им активного заболевания. Безусловно, мы нуждаемся в оценке иммунологических факторов риска ЦМВ и определения роли количественного анализа ДНК ЦМВ, изолированной из крови больного и биопсийного материала. И конечно же, мы ожидаем многоцентровых контролируемых исследований с целью оценки эффективности противовирусной терапии у пациентов с воспалительными заболеваниями кишечника и ЦМВ-инфекцией.
1. Sood A., Midha V., Sood N., Bhatia A.S., Avasthi G. Incidence and prevalence of ulcerative colitis in Punjab, North India // Gut. — 2003. — 52. — 1587-1590.
2. Kho Y.H., Pool M.O., Jansman F.G., Harting J.W. Pharmacotherapeutic options in inflammatory bowel disease: an update // Pharm. World Sci. — 2001. — 23. — 17-21.
3. Kishore J., Ghoshal U., Ghoshal U.C., Krishnani N. et al. Infection with cytomegalovirus in patients with inflammatory bowel disease: prevalence, clinical signifi cance and outcome // J. Med. Microbiol. — 2004. — 53. — 1155-1160.
4. Powell R.D., Warne N.E., Levine R.S., Kirsner J.B. Cytomegalic inclusion disease and ulcerative colitis; report of a case in a young adult // Am. J. Med. — 1961. — 30. — 334-340.
5. Kaufman H.S., Kahn A.C., Iacobuzio-Donahue C., Talamini M.A. et al. Cytomegaloviral enterocolitis: clinical associations and outcome // Dis. Colon Rectum. — 1999. — 42. — 24-30.
6. Ng F.H., Chau T.N., Cheung T.C. et al. Cytomegalovirus colitis in individuals without apparent cause of immunodeficiency // Dig. Dis. Sci. — 1999. — 44. — 945-952.
7. Baron J.H., Connell A.M., Lennard-Jones J.E. Variation between observers in describing mucosal appearance in proctocolitis // Br. Med. J. — 1964. — 5375. — 89-92.
8. Pera A., Bellando P., Caldera D. et al. Colonoscopy in inflammatory bowel disease: diagnostic accuracy and proposal of an endoscopic score // Gastroenterology. — 1987. — 92. — 181-185.
9. Truelove S.C., Witts L.J. Cortisone in ulcerative colitis; final report on a therapeutic trial // Br. Med. J. — 1955. — 4947. — 1041-1048.
10. Berkelhammer C. Cytomegalovirus (CMV)-negative blood transfusions in CMV-negative inflammatory bowel disease patients // Inflamm. Bowel Dis. — 2007. — 13(9). — 1184.
11. Марков И.С. Диагностика и лечение герпетической инфекции и токсоплазмоза. — К., 2002.

Поражение толстой кишки, обусловленное вирусами семейства Herpesviridae.
Распространенность герпесвирусных инфекций неуклонно возрастает во всем мире. Считается, что к 18 годам 60 - 90% жителей городов инфицируются одним или несколькими типами клинически значимых герпесвирусов. Рост заболеваемости в значительной мере связан с распространением бессимптомной и недиагностированной герпетической инфекции. Это вызвано легкостью распространения инфекции (возможны контактно-бытовой, половой, воздушно-капельный, вертикальный, трансфузионный и трансплантационный механизмы передачи). Универсальный тропизм герпесвирусов обусловил значительный полиморфизм клинических проявлений, которые попадают в поле зрения врачей различных специальностей. [5]
В настоящее время известно около 200 в разной степени изученных герпесвирусов. Это крупные оболочечные ДНК-содержащие вирусы. Из них патогенными для человека являются 8 типов:
1.Вирус простого герпеса – ВПГ тип 1 (Herpes simplex virus тип 1 – HSV-1), или герпесвирус человека ГВЧ-1.
2. Вирус простого герпеса – ВПГ тип 2 (HSV-2), или ГВЧ-2.
3. Вирус ветряной оспы – опоясывающего герпеса (Varicella-zoster virus – VZV), или ГВЧ-3.
4. Вирус Эпштейна-Барр – ВЭБ (Epstein-Barr virus – EBV), или ВГЧ-4.
5. Цитомегаловирус – ЦМВ (CMV), или ГВЧ-4.
6. Герпесвирус человека тип 6 – ГВЧ-6 (Human herpesvirus – HHV6).
7. Герпесвирус человека тип 7 – ГВЧ-7 (HHV7).
8. Герпесвирус человека тип 8 – ГВЧ-8 (HHV8).
Все они относятся к семейству Herpesviridae, которое делится на три подсемейства: α-herpesviruses, β-herpesviruses и γ-herpesviruses, в зависимости от характера поражения вирусом клетки, скорости репликации, места латенции и персистенции.
Альфа-вирусы (вирус простого герпеса 1 и 2 типа, вирус варицела Зостер). Характеризуются быстрой репликацией, 4—8 часов), способностью к цитолизу и бессимптомным персистированием в нейрональных клетках.
Бета-вирусы (цитомегаловирус, герпесвирус человека тип 6, герпесвирус человека тип 7) Медленно реплицируются, вызывают цитомегалическую трансформацию клеток, а основными очагами латенции являются моноциты и их предшественники, эндотелиальные клетки сосудов микроциркуляторного русла, альвеолярные макрофаги, Т-лимфоциты и стромальные клетки костного мозга.
Гамма-вирусы (вирус Эбштейн-Барр (синоним ВГЧ4), ВГЧ-8). Трансформирующие вирусы человека, способствующие развитию злокачественного перерождения клеток. Пожизненно персистируя в В-лимфоцитах или находясь в латентном состоянии, обладают способностью делать их злокачественными.
Персистенция бета- и гамма-вирусов в иммунокомпетентентных клетках может приводить к развитию вторичной иммунной недостаточности с выраженной депрессией клеточного иммунитета.
Формы взаимодействия герпесвирусов с организмом хозяина различны. Инфекционный процесс может протекать:
1 В острой форме.
2 В хронической форме (более 6 месяцев).
3 В инаппарантной (бессимптомной) форме.
4 В форме медленной вирусной инфекции — длительный инкубационный период (месяцы и годы) с последующим медленным прогрессирующим течением, с развитием тяжелых клинических симптомов и в итоге — смертью больного.
Уникальным биологическим свойством всех ГВ человека является их способность к персистенции и латенции в организме инфицированного человека. Персистенция представляет собой непрерывное и цикличное размножение (репликацию) вируса в инфицированных клетках тропных тканей, что является причиной развития инфекционного процесса. Латенция герпесвирусов клинически себя не проявляет, а диагностируется только при наличии специфических IgG против вируса (серопозитивность) в невысоких титрах, а сам вирус в этот период в периферической крови не определяется даже таким высокочувствительным методом, как ПЦР. В состоянии латенции нарушается полный цикл репродукции вируса, и он находится в клетках хозяина в виде субвирусных структур. [4; 5]
Таблица 1 Классификация клинических форм заболеваний, обусловленных герпесвирусами [4]
Первичная инфекция
Реактивация после латенции
Вирус простого герпеса I типа — ВПГ-1-ВГЧ-1 —
Герпес кожи. Лабиальный герпес. Гингивостоматит. Офтальмогерпес. Генитальный герпес. Неонатальный герпес. Энцефалит (редко). Невропатии
Рецидивирующий орально-лабиальный герпес. Рецидивирующий аногенитальный герпес.
Вирус простого герпеса II типа — ВПГ-2-ВГЧ-2 — HSV-2
Генитально-ректальный герпес. Неонатальный герпес. Менингоэнцефалит. Крестцовый
Генитальный герпес. Менингоэнцефалит. Хроническая кожно-слизистая форма
Вирус варицелла зостер-ВВЗ — вирус герпеса человека III типа — ВГЧ3-VZV
Опоясывающий герпес. Постгерпетическая невралгия
Вирус герпеса человека IV типа — ВГЧ-4 — Эпштейна-Барр вирус —
Инфекционный мононуклеоз. Саркома мышц. Энцефалит у новорожденных. Лимфоидная интерстициальная пневмония у детей
Лимфома Беркитта. Назофарингиальная карцинома.
Волосатая лейкоплакия языка.
EBV-ассоциированный лимфопролиферативный синдром.
Синдром хронической усталости и иммунной депрессии.
Вирус герпеса человека V типа — ВГЧ-5 — Цитомегаловирус — ЦМВ-СМV
CMV-колит/холангит. CMV-адреналовая недостаточность.
Реакция отторжения трансплантата. Атеросклероз
Летальный энцефаломиелит при инфицировании людей
Вирус герпеса человека VI типа —
Внезапная экзантема у детей. Гетерофильно-негативный мононуклеоз. Васкулит
Интерстициальная пневмония у лиц с иммунодефицитом.
Синдром хронической усталости и иммунной депрессии.
Аутоиммунная патология. Психозы
Вирус герпеса человека VII типа — ВГЧ-7-HHV-7
Возможна экзантема у детей
Синдром хронической усталости и иммунной депрессии.
Заболевания кожи и ЦНС аутоиммунной природы. Рак желудка
Саркома Капоши.
Лимфопролеферативное заболевание болезнь Кастлемана
Таким образом, поражение слизистых нижних отделов желудочно-кишечного тракта может быть обусловлено вирусами простого герпеса 1 и 2 типа, цитомегаловирусом (ВГЧ 5 типа) и вирусом герпеса человека 8 типа.
Герпесвирусы 1 и 2 типов
Вторичная (рецидивирующая) ГИ встречается в любом возрасте после первичного герпеса. Поскольку рецидивы возникают на фоне наличия противовирусных антител, то они протекают со слабовыраженным общеинфекционным синдромом и, как правило, на фоне болезней и/или состояний, снижающих иммунитет.
В зависимости от распространенности процесса клинически выделяются следующие формы вирусной инфекции:
1. Локализованная форма, при которой отмечается так называемый "замкнутый круг хождения вируса: входные ворота - нервный ганглий - входные ворота". Как правило, при обострении заболевания патологические изменения всегда локализуются в одном месте.
2. Распространенная форма, при которой наблюдаются отсевы вируса из очага первичной инвазии в близлежащие зоны (например, лабиальный герпес – герпетический эзофагит)
3. Генерализованные формы (висцеральная и диссеминированная), которые наиболее часто встречаются у иммунокомпрометированных пациентов.
В течение заболевания выделяют две стадии: 1 стадия - везикулов и 2 стадия - образования дефектов слизистой оболочки.
Макроскопически при 1-й стадии обнаруживаются характерные изменения слизистой оболочки пораженного сегмента толстой кишки: множественные рассеянные или сгруппированные пузырьки диаметром 0,1-0,3 см с серозным или мутным содержимым. Пузырьки склонны к слиянию. Окружающая слизистая оболочка может быть не изменена или с явлениями очагового умеренно выраженного поверхностного воспаления.
При колоноскопии во 2-й стадии заболевания имеются множественные поверхностные дефекты слизистой оболочки округлой формы, размерами до 0,5 см с четко очерченными эритематозными приподнятыми краями и некротическим налетом в дне ("вулканические" изъязвления). При тяжелых генерализованных формах инфекции дефекты слизистой оболочки сливаются с образованием обширной изъязвленной поверхности (Морозова СВ., Пархоменко Ю.Г., 2002). Контактная кровоточивость выражена умеренно, на окружающей слизистой оболочке имеются множественные субэпителиальные кровоизлияния. При морфологическом исследовании тканей, взятых из краев изъязвления, на фоне воспалительной инфильтрации слизистой оболочки выявляются типичные для этой инфекции гигантские клетки с мультинуклеацией и феноменом "глаза совы" или (в более поздние сроки) внутриядерные включения, окруженные светлой зоной (Cirillo N.W. et al., 1993). Таким образом, для герпетических колитов характерны следующие эндоскопические признаки: поражение имеет сегментарный характер, сегменты короткие, могут локализоваться в любом анатомическом отделе, но чаще обнаруживаются в прямой кишке. Макроскопические изменения в пределах пораженного сегмента однородны. (Рис.1) При хроническом прогрессирующем течении заболевания отмечаются протяженные поражения толстой кишки с элементами герпетического процесса на разных стадиях его развития. [3: 9]
Рис.1 герпетический проктит [9]
Эндоскопическая картина слизистой оболочки прямой кишки. (а) эритема, рыхлость и множественные язвенные поражения слизистой оболочки прямой кишки. (B) кроме множественных язв на поверхности слизистой присутствует слизисто-гнойный экссудат.
ЦИТОМЕГАЛОВИРУСНАЯ ИНФЕКЦИЯ
Цитомегаловирусная инфекция (ЦМВИ) — общее инфекционное заболевание, вызываемое β -герпесвирусом человека, характеризующееся многообразием форм (от бессимптомных до генерализованных), морфологически проявляющееся образованием в слюнных железах, висцеральных органах и ЦНС цитомегалов — гигантских клеток с типичными внутриядерными и цитоплазматическими включениями. Инфекция относится к антропонозам. Отличается различными механизмами передачи: капельный, гемоконтактный, контактный. Пути передачи: воздушно-капельный; артифициальный (парентеральный); контактно-бытовой (в том числе при непосредственном контакте со слюной); половой; вертикальный, трансфузионный, трансплантационный. Иммунитет нестойкий, нестерильный. Механизм развития ЦМВИ зависит от дозы вируса, путей заражения, возраста пациента, генетических особенностей и состояния иммунитета в момент заражения.
При персистенции ЦМВ выделяют две стадии: стадию продуктивной репликации и стадию латенции. Обе стадии персистирующей инфекции не являются стабильными в течение жизни человека, сменяя одна другую. В популяции не менее 10 % населения являются вирусовыделителями. Реактивация ЦМВИ обычно не сопровождается какими-либо симптомами и для организма человека протекает незаметно.
Читайте также:

