Цитомегаловирус и воспаление эндометрия
Обновлено: 18.04.2024
Московский государственный медико-стоматологический университет им. А.И. Евдокимова
Особенности течения цитомегаловирусной инфекции урогенитального тракта у сексуально активных женщин
Журнал: Клиническая дерматология и венерология. 2013;11(3): 69‑75
Чернова Н.И. Особенности течения цитомегаловирусной инфекции урогенитального тракта у сексуально активных женщин. Клиническая дерматология и венерология. 2013;11(3):69‑75.
Chernova NI. Specific features of cytomegalovirus infection of the urogenital tract in sexually active women. Klinicheskaya Dermatologiya i Venerologiya. 2013;11(3):69‑75. (In Russ.).
Московский государственный медико-стоматологический университет им. А.И. Евдокимова
Московский государственный медико-стоматологический университет им. А.И. Евдокимова
Цитомегаловирусная инфекция (ЦМВИ) — широко распространенное инфекционное заболевание человека, с вертикальным, половым, парентеральным, оральным путями передачи, реализующимися через кровь, цервикальный и вагинальный секреты, сперму и женское молоко. В большинстве случаев инфекция протекает без клинических проявлений. При иммуносупрессии, вызванной разными причинами, цитомегаловирус (ЦМВ) способен привести к развитию заболевания с многообразными симптомами, что обусловлено его способностью инфицировать практически все системы органов (ретинит, увеит, серонегативный мононуклеоз, пневмония, гепатит, болезни желудочно-кишечного тракта, центральной нервной системы, посттрансфузионный синдром) [1—5].
В среднем у 90—95% взрослого населения обнаруживаются антитела к ЦМВ. В литературе приводятся многочисленные данные об особенностях течения ЦМВИ у новорожденных, беременных и иммунонекомпетентных пациентов. В настоящий момент обследованию на ЦМВИ подлежат следующие категории граждан: женщины при подготовке к беременности, беременные и пациенты с выявленными иммунодефицитными состояниями. Изучению значимости ЦМВ в патологии взрослого населения уделяется особое внимание [6—9]. Однако не учитывается, что ЦМВ нередко способствует хроническому воспалительному поражению органов малого таза и гениталий, что обусловливает низкую эффективность терапии инфекций, передаваемых половым путем (ИППП), и снижение репродуктивной способности пациентов.
Цель настоящего исследования — определение форм течения ЦМВИ урогенитального тракта у сексуально активных женщин репродуктивного возраста.
Материал и методы
Под наблюдением находились 356 пациенток с ЦМВИ, которая характеризовалась наличием в крови анти-CMV IgG.
Для выявления достоверных триггерных клинических и лабораторных факторов, ассоциирующихся с ЦМВИ урогенитального тракта, данные опроса и обследования больных сравнивали с результатами аналогичных исследований, проведенных в контрольной группе, которая состояла из 120 женщин. Критериями отбора являлись: репродуктивный возраст, отсутствие беременности, лактации, системной и местной антибактериальной терапии в течение 1 месяца до начала данного обследования, нормальное состояние микрофлоры урогенитального тракта и исключенная ЦМВИ.
Результаты
Важное значение для выяснения характера ЦМВИ имеют сведения о перенесенных соматических и инфекционных заболеваниях. Частота экстрагенитальной патологии косвенно отражает состояние противоинфекционной защиты организма и иммунной системы в целом.

При анализе соматической патологии (табл. 2) наиболее часто в основной группе по сравнению с контрольной отмечались инфекционные вирусные заболевания (82,58% случаев), патология желудочно-кишечного тракта (55,9%) и заболевания органов дыхания (20,51%). У пациенток с ЦМВИ в 4,2 раза чаще отмечалась патология эндокринной системы (в 31,46% случаев; p<0,05).
Подробному анализу были подвергнуты данные о гинекологических заболеваниях, которые относятся к факторам, влияющим на состояние системного и локального иммунитета.

Среди перенесенных гинекологических заболеваний наиболее часто встречались патология шейки матки (44,10% случаев; p<0,05) и воспалительные заболевания органов малого таза (75%; p<0,05) по сравнению с контролем (табл. 3). Кроме того, у женщин с ЦМВИ чаще наблюдались ИППП (в 55,34% случаев; p<0,05) и бесплодие (28,65%; p<0,05).

При изучении особенностей сексуального анамнеза (табл. 4) выявлено, что у пациенток с ЦМВИ в 3 раза чаще (p<0,05) отмечалось раннее начало половой жизни. Соотношение женщин по количеству половых партнеров в обеих группах было сопоставимым. В ходе анализа особенностей сексуальных предпочтений установлено, что пациентки основной группы чаще практиковали аногенитальные контакты (p<0,05).
Незащищенные половые контакты (включая без использования презерватива с последующей обработкой раствором мирамистина) в анамнезе имели более 84% пациенток с ЦМВ и 70% женщин из группы контроля (p<0,05).
Таким образом, вероятным предрасполагающим фактором для ЦМВИ урогенитального тракта являлось раннее начало половой жизни и большое количество незащищенных аногенитальных контактов.
При клиническом обследовании анализировали особенности субъективных ощущений, проводили тщательный общий и гинекологический осмотр.
Таким образом, у пациенток с ЦМВИ при гинекологическом осмотре чаще выявлялся острый или хронический воспалительный процесс в малом тазу.

Результаты микроскопического исследования мазков отделяемого генитального тракта, окрашенных по Граму, представлены в табл. 6.

Анализ результатов культурального исследования отделяемого мочеполового тракта женщин выявил доминирование грибов Candida spp. (48,60%), G. vaginalis (30,62%), T. vaginalis (21,35%). У большинства женщин в биотопах влагалища имела место ассоциация ЦМВИ с условно-патогенными бактериями (Streptococcus, St. aureus, Ureaplasma spp., M. hominis) в высоком титре (более 10 5 КОЕ/мл; табл. 7).

Результаты комплексного обследования этих женщин представлены в табл. 8.
У 71 (19,9%) женщины состояние вагинальной микроэкологии было оценено как нормоценоз. Проанализировав полученные данные, можно было выделить его некоторые особенности, которые в ряде случаев позволили назвать указанное состояние нормоценозом только условно. Так, только у 22 (6,18%) женщин из 356 состояние микроэкологии полностью соответствовало всем критериям нормы репродуктивного возраста: при микроскопии вагинального отделяемого отсутствовала выраженная лейкоцитарная реакция (количество лейкоцитов не превышало 10 в поле зрения), эпителий был представлен клетками поверхностного и промежуточного слоев, количество микрофлоры было умеренным при абсолютном преобладании морфотипа лактобактерий. Морфотипы условно-патогенных микроорганизмов (УПМ) не определялись. При культуральном исследовании титр лактобацилл составлял 10 6-8 КОЕ/мл вагинального отделяемого, а концентрации УПМ были низкими (менее 10 3 КОЕ/мл).
Наиболее частой патологией среди 356 обследованных пациенток с ЦМВИ оказался кандидоз (57,30%), в большинстве случаев сопровождавшийся умеренным повышением титра УПМ (Streptococcus группы В в 10 6 КОЕ/мл и St. aureus более 10 6 КОЕ/мл).
Аэробный вагинит (1,12%) как вариант дисбиоза влагалища был обусловлен колонизацией вагинального биотопа высокими титрами E. coli (более 10 7 КОЕ/мл) и стрептококков группы В (10 6 КОЕ/мл). По данным микроскопии в этих случаях также отмечалась выраженная лейкоцитарная реакция (более 40 лейкоцитов в поле зрения).
У 21,06% женщин микроскопически был установлен бактериальный вагиноз, что сопровождалось высокой колонизацией факультативно-анаэробной и анаэробной флоры (более 10 6 КОЕ/мл).
В 0,56% случаев состояние вагинальной микроэкологии было оценено как другой вариант дисбиоза влагалища, когда при минимальном содержании микрофлоры (данные микроскопии) доминировали факультативно-анаэробные и аэробные УПМ (грамположительные кокки), а лактоморфотипы были единичными в поле зрения.
Таким образом, только у 19,9% пациенток с ЦМВИ имелся классический вариант микроценоза, в остальных случаях микрофлора влагалища претерпевала изменения, связанные с нарастанием титра факультативно-анаэробных УПМ. У 80,1% женщин выявлены нарушения микроценоза влагалища, в большинстве случаев связанные с увеличением количества Candida spp. При исследовании отделяемого из уретры с помощью ПЦР идентифицированы возбудители ИППП и УПМ. Наиболее часто выявлялись ДНК HPV (11,52%), T. vaginalis, M. hominis, HSV 1-го и 2-го типов (2,81 и 3,08% соответственно), С. trachomatis были идентифицированы в уретре у 5,34% больных.
В цервикальном канале в 5 раз чаще определялись УПМ и патогены. Так, наиболее часто у женщин с ЦМВИ были выделены вирус папилломы человека (42,13%), T. vaginalis (11,52%), M. hominis (21,63%), С. trachomatis (18,82%) и Ureaplasma spp. (24,44%).
В соскобах из влагалища также наиболее часто определялась ДНК вируса папилломы человека (43,25%), T. vaginalis (21,35%), M. hominis (14,89%), Ureaplasma spp. (19,38%), а также G. vaginalis (25%).
При исследовании проб из прямой кишки были идентифицированы ДНК ВПЧ (28,93%) и M. hominis (11,24%).

Для верификации диагноза ЦМВИ проводили расширенный анализ результатов, полученных разными методами исследования (табл. 9).
При анализе данных с целью выявления маркеров ЦМВИ установлена наибольшая частота обнаружения анти-CMV IgG — 356 (100%) случаев. Анти-CMV IgM были выявлены у 89 (25%) женщин. Обнаружение антител класса G к CMV свидетельствовало как об инфицированности, так и о наличии в большинстве случаев сформированного специфического противовирусного иммунитета. Выявление антител класса М совместно с IgG было одним из признаков реактивации данной вирусной инфекции.
При исследовании материала, полученного из урогенитального тракта с помощью ПЦР, ДНК CMV была обнаружена у 208 (58,43%) женщин.
ЦМВ на культуре фибробластов легких человека при исследовании крови выявлен у 93 (26,12%) женщин, мочи — у 199 (55,90%), слюны — у 204 (57,30%) больных, влагалищного отделяемого — у 225 (63,20%), из цервикального канала — в 268 (75,28%) случаях. В целом ЦМВ был обнаружен у 268 (75,28%) пациенток.
Учитывая этиологию, патогенез и клинические проявления ЦМВИ урогенитального тракта, пациенткам с реактивированной и латентной формой ЦМВИ проводилась комплексная терапия инфекционного процесса в соответствии с клиническими рекомендациями по ведению больных с ИППП. Противовирусное лечение включало использование препарата Панавир. Основное действующее вещество данного препарата — гексозный гликозид, полученный методом ферментативного гидролиза с последующей газожидкостной хроматографией, состоящий из глюкозы, рамнозы, арабинозы, маннозы, ксилозы, галактозы, уроновых кислот. В ряде экспериментальных и клинических исследований установлена противовирусная и иммуномодулирующая активность Панавира. Данный препарат повышает неспецифическую резистентность организма к разным инфекциям и способствует индукции интерферона, Панавир (5 мл 0,004% раствора) применялся парентерально (внутривенно струйно) 1 раз в сутки через 48 ч (3 инъекции в 1-ю неделю лечения), затем — через 72 ч (2 инъекции во 2-ю неделю терапии). Всего на курс пришлось 5 инъекций в течение 2 недель.
При контрольном исследовании, проведенном через 14 дней после лечения, лишь у 2 (8,0%) пациенток с латентной формой ЦМВИ выявлен CMV в культуре клеток отделяемого цервикального канала, ДНК CMV не определялась у 24 (96%) больных. В результате лечения при реактивированной форме ЦМВИ была констатирована негативация IgM анти-CMV в крови у 100% женщин. При исследовании CMV на культуре фибробластов эмбрионов человека вирурия установлена у 1 (5,56%) пациентки, выделение из цервикального канала отмечено у 3 (16,67%). Результаты вирусологического обследования крови, слюны, влагалищных выделений были отрицательными у всех женщин. При проведении ПЦР наличие ДНК CMV выявлено у 2 (11,11%) пациенток, получавших парентерально Панавир.
Таким образом, в ходе исследования определены основные диагностические клинико-лабораторные критерии разных форм ЦМВИ урогенитального тракта сексуально активных женщин репродуктивного возраста, на основании которых возможности определения данной инфекции существенно увеличились. Наличие клинических проявлений при реактивированной ЦМВИ и определение вирусов при подостром или хроническом течении воспалительных заболеваний органов малого таза способствовали определению значимости данной инфекции в развитии патологии гениталий. Применение препарата Панавир в комплексной терапии повышало эффективность лечения в 89,5% случаев, что позволяет рекомендовать препарат Панавир для комплексной терапии ЦМВИ.
В последнее десятилетие характер серьезной медико-социальной проблемы приобрели оппортунистические инфекции вследствие их широкого распространения и крайне неблагоприятного влияния на уровень общего и репродуктивного здоровья населения [1,2,6,7]. Результаты проведенных исследований свидетельствуют о росте ЦМВ-инфекции при патологии генитального тракта у женщин [5,7]. Генерализованная форма цитомегаловирусной инфекции у женщин может проявляться в виде воспаления и эрозии шейки матки, внутреннего слоя матки, влагалища и яичников, а у мужчин генерализованная форма цитомегаловирусной инфекции поражает яички, околоушные железы, вызывает воспаление мочеиспускательного канала и неприятные ощущения при мочеиспускании. Так, цитомегалические клетки были выявлены, в соскобах шейки матки, цервикального канала, эндометрия, что свидетельствует о возможности ЦМВ вызывать эрозии шейки матки, цервициты, эндометриты. Гигантские ядерные включения обнаруживались и при исследовании кондилом [1,7]. Наиболее часто ЦМВИ органов малого таза возникает на фоне иммуносупрессии, выражающейся в дисбалансе регуляции иммунной системы, в том числе цитокиновой [3,4,5,7]. Способность вируса реплицироваться в клетках иммунной системы и индуцировать ее недостаточность является фоном для развития рецидивирующих бактериальных, грибковых и вирусных заболеваний.
Эффективное лечение цитомегалии сопряжено с определенными трудностями в выборе медикаментов. В арсенале врачей сегодня имеется несколько терапевтических средств - противовирусные препараты и человеческие иммуноглобулины [6,7]. До настоящего времени для лечения ЦМВИ наиболее широко использовались ацикловир и ганцикловир[2,6]. Высоким профилем безопасности обладает ацикловир, однако его действие на ЦМВ в 100 раз ниже, чем на ВПГ1/2 типа. Ганцикловир - характеризуется большей активностью против ЦМВ (в 50 раз), но выраженным токсическим эффектом [2,5]. В экспериментальных исследованиях доказано, что ганцикловир может угнетать сперматогенез и не исключается его канцерогенное воздействие на организм[9]. Во многих медицинских центрах мира проводиться пассивная иммунопрофилактика ЦМВИ с помощью иммуноглобулинов. При этом имеется достаточное количество работ, в которых дискутируется эффективность профилактического назначения иммуноглобулина у разных групп больных[2].
Все вышеперечисленное определяет необходимость поиска новых безопасных высокоэффективных препаратов обладающих противовирусным и иммуномодулирующим действием. Именно поэтому представляет интерес отечественный противовирусный препарат растительного происхождения Панавир, эффективный в отношении инфекций вызываемых разными ДНК- и РНК- содержащими вирусами (ЦМВ, ВПГ, ВПЧ). Руководствуясь инструкцией препарат может назначаться врачом при цитомегаловирусной инфекции, в том числе у пациенток с привычным невынашиванием беременности. Может применяться у женщин с хронической вирусной инфекцией и интерферонодефицитным состоянием на этапе подготовки к беременности. Характерными особенностями противовирусной активности Панавира является ингибирование синтеза вирусных белков, повышение жизнеспособности клеток, а так же индуцирование продукции IFN-a и IFN-y лейкоцитами.
Целью исследования явилось определение эффективности ректальных суппозиторий Панавир в лечении пациентов с ЦМВИ органов малого таза.
Материалы и методы
Под наблюдением находилось 30 больных с реактивацией ЦМВИ в органах малого таза, в возрасте от 20 до 40 лет. Диагностику ЦМВИ проводили при помощи исследования соскобов из уретры, вагины и цервикального канала с выявлением ДНК ЦМВ методом ампфликации нуклеиновых кислот ПЦР. Интерфероновый статус определяли в крови больных полученной из кубитальной вены. Забор материала для лабораторных исследований проводился до и через месяц после окончания лечения. Изучение эффективности, переносимости препарата проводилось на основании изучения: динамики показателей интерферонового статуса, отсутствия ДНК вируса цитомегалии в соскобах из урогенитального тракта после лечения и длительности ремиссии.
Панавир назначали, по 1 суппозиторию ректально на ночь. Процедура повторялась через день, 5 свечей на курс.
Результаты
При исследовании соскобов из урогенитального тракта при помощи ПЦР и ПЦР real time у всех больных выделены ДНК ЦМВ в клинически значимом титре, что свидетельствовало реактивации инфекции в нижних отделах органов малого таза.
При оценке показателей интерферонового статуса до лечения выявлены нарушения у всех 30 больных с цитомегаловирусной инфекцией органов малого таза.
Динамика показателей интерферонового статуса после терапии больных суппозиториями панавир
| Показатели (Ме/мл) | До лечения (п=30) | После лечения (п=30) | Контрольная группа |
| сывороточный IFN | 16,8±3,1* | 6 ±2,0** | 4,8 ±0,5 |
| Продукция FN-a | 24,2 ±2,6* | 67,6 ±4,6** | 89 ±1,5 |
| Продукция IFN-y | 12,4 ±2,7* | 27,3 ± 2,66** | 32,4 ±5,9 |
Частота выделения ДНК ЦМВ из эпителия урогенитального тракта после терапии больных суппозиториями панавир
| Срок лечения | Число больных | ЦМВ не выявлен | ЦМВ выявлен |
| До лечения | 30 | 0 | 30 |
| После лечения | 30 | 27 | 3 |
Через месяц после терапии суппозиториями панавир ДНК ЦМВ в соскобах из урогенитального тракта не обнаруживалась у 27 пациентов из 30.
При наблюдении за больными в период 60 дней после проведенного лечения ремиссия наблюдалась у 29 пациентов.
Выводы:
Литература
1. Прозоровский СВ., Тартаковский И.С. Возбудители оппортунистических инфекций - роль в инфекционной патологии человека и методы лабораторной диагностики. Клин. лаб. диаг. 1998; 2: 24, 33-5.
2. Чешек Н.И. Методическое пособие для врачей. Цитомегаловирусная инфекция. Эпидемиология, клиника, диагностика, лечение и профилактика. М, 2001, 3-5.
3. Белокрицкая Т.Е., Витковский Ю.А., Пономарева Ю.Н. Роль цитокинов в патогенезе нарушений иммунитета и гемостаза у больных с тяжелыми дисплазиями и раком шейки матки. Вопр. онкол. 2003; 49 (1): 51-4.
4. Краснопольский В. И., Радзинский В.Е., Буянова С.Н. Патология влагалища и шейки матки. М.: Медицина, 1997.
5. Козлова В.И., Пухнер А.Ф. Вирусные, хламидийные и микоплазменные заболевания гениталий. М., 1997; с. 536.
6.0shiro ВТ. Cytomegalovirus Infection in Pregnancy. In Protocols for Infectious Diseases in Obstetrics and Gynecology, 2nd ed. Mead PB, Hager WD, Faro S, eds.: BlackwellScience, 2000; 157-70.
7. Sweet RL, Gibbbs RS (eds.). Infectious Diseases of the Female Genital Tract, 3d ed.: Williams and Wilkins, 2005; 469-79.
Что такое эндометрит? Причины возникновения, диагностику и методы лечения разберем в статье доктора Делеске И. А., гинеколога со стажем в 9 лет.
Над статьей доктора Делеске И. А. работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина

Определение болезни. Причины заболевания
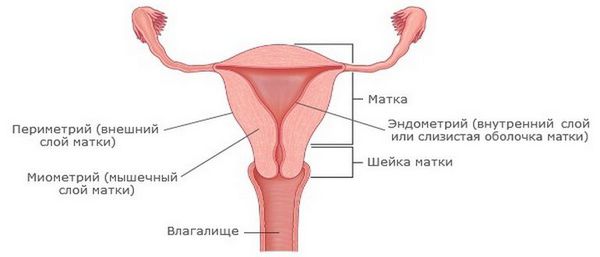
Эндометрит — это воспаление внутреннего слоя матки (эндометрия), которое приводит к изменению его функций. Возникает в результате заражения этой области микробами, вирусами и грибковыми инфекциями.
Эндометрит — одно из наиболее распространенных гинекологических заболеваний. По данным зарубежных источников, распространенность эндометрита составляет 20% в популяции, отечественные авторы указывают до 60-70%, чаще всего болеют женщины репродуктивного возраста [9] [11] . Стабильный рост заболеваемости отмечается последние 20-30 лет [1] [10] . Часто встречается в сочетании с ранним началом половой жизни, отсутствием контрацепции, абортами, наличием хронических воспалительных заболеваний нижнего отдела репродуктивного тракта. [7] [8] .
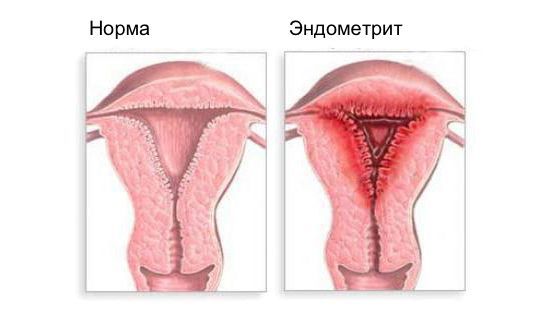
Эндометрит часто является причиной бесплодия, привычного невынашивания (два и более выкидыша в анамнезе), нарушения менструального цикла, осложнений беременности, родов и послеродового периода, неудачных попыток ЭКО, гиперпластических заболеваний эндометрия и сексуальных проблем [1] .
Чем эндометрит отличается от эндометриоза
Эндометриоз — это разрастание эндометриоидной ткани. Эндометриоз может поражать полость матки, её оболочки, маточные трубы, яичники, брюшину и области вне половых органов. Эндометритом же называют воспаление внутреннего слоя матки.
Причины эндометрита
В женском репродуктивном тракте присутствуют различные микроорганизмы, среди которых преобладают Lactobacillus spp. Эндометрит чаще ассоциирован с чрезмерным размножением бактерий Enterobacter, Enterococcus, Streptococcus, Staphylococcus, Ureaplasma, Mycoplasma.
Эндометрит вызывают также вирусные инфекционные агенты: вирус герпеса, цитомегаловирус, вирус папилломы человека, энтеровирусы и аденовирусы.
Возможен эндометрит специфической этиологии: гонорейный, туберкулезный, актиномикотический (грибковая инфекция) и неспецифический. [8] [7] [10] .
Риск развития эндометрита увеличивают:
- манипуляции в полости матки — аборты, выскабливания, метросальпингография (контрастное рентгенологическое исследование полости матки и проходимости фаллопиевых труб), введение внутриматочного контрацептива, инсеминация (введение спермы), ЭКО;
- заболевания мочевыделительной системы;
- операции на органах малого таза;
- послеродовые гнойно-воспалительные осложнения;
- другие гинекологические заболевания (хронический сальпингоофорит, цервицит, гиперплазия эндометрия, полип эндометрия);
- частая смена половых партнеров;
- незащищенные половые связи;
- предшествующие прерывания беременности;
- кесарево сечение до 28 недель гестации;
- длительный безводный период в родах;
- ручное отделение плаценты;
- инвазивные исследования для пренатальной диагностики;
- длительное ношение внутриматочного контрацептива.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы эндометрита
Воспаление может протекать в острой и хронической форме. Чаще всего симптомы эндометрита появляются на четвёртый день после инфицирования. При острой форме эндометрита отмечаются общие симптомы воспаления, такие как слабость, быстрая утомляемость, повышение температуры тела, изменения в общем анализе крови (сдвиг лейкоцитарной формулы влево и повышение СОЭ).
К локальным симптомам острого эндометрита можно отнести:
- периодические умеренные или острые тянущие боли внизу живота, иногда отдающие вниз спины и в пах;
- жидкие гноевидные выделения из половых путей с неприятным запахом (возможно с примесью крови);
- диспареуния (боль при половом акте).
При отсутствии правильного и своевременного лечения эндометрита в течении 10 дней возможен переход в хронический воспалительный процесс. При этом держится повышенная температура, появляются новые симптомы:
- нарушение менструального цикла, мажущие кровянистые выделения в середине цикла;
- привычное невынашивание беременности;
- серозно-гнойные выделения из половых путей;
- ноющие боли внизу живота;
- боль во время секса [3][5][8] .
Течение острого послеродового эндометрита более тяжёлое, проявляется в следующих симптомах:
Эндометрит при беременности
Эндометрит препятствует имплантации плодного яйца, из-за чего оно может отторгнуться полностью или возникнет нарушение процессов имплантации. В дальнейшем это может привести к выкидышу или замершей беременности.
Если воспалительный процесс усиливается, может развиться хориоамнионит — воспаление плаценты, которое приводит к разрыву плодных оболочек, излитию околоплодных вод и преждевременным родам.
Чтобы избежать возможных осложнений, женщинам с хроническим эндометритом при планировании беременности необходимо пройти комплексное лечение.
Патогенез эндометрита
На начальном этапе воспаления инфекционный агент (бактерии, вирусы или грибки) внедряется в слизистую оболочку матки. Начинается выработка медиаторов воспаления, которая приводит к нарушению микроциркуляции крови в его очаге. Миграция лейкоцитов в зону повреждения, активация нейтрафилов и макрофагов ведёт к активной выработке цитокинов и перекиси водорода, запуску перекисного окисления липидов с повреждением мембран клеток. В это время на фоне повышенной выработки цитокинов и факторов роста происходит деградация матрикса клеток. Нарушение микроциркуляции крови приводит к развитию локальной ишемии и гипоксии ткани, которые затем активируют процессы склерозирования. При длительной стимуляции иммунной системы происходит её истощение и появление аутоиммунных реакций.
В 95% случаев эндометрит является первичным — патогенные микроорганизмы попадают в полость матки восходящим путём, при половом контакте или гинекологических манипуляциях . В 5% случае эндометрит носит вторичный характер: инфекция попадает в эндометрий гематогенным путем, либо же лимфогенным или нисходящим путём (с верхних отделов репродуктивного тракта).
При длительности воспалительного процесса более 2 месяцев можно расценивать его как хронический процесс. Развиваются изменения в структуре и функции ткани, происходит нарушение пролиферации (деления клеток) и физиологической циклической трансформации эндометрия. В связи с этим возможно нарушение нормальной имплантации эмбриона при беременности.
Существует аутоиммунная теория патогенезе хронического эндометрита. Она говорит о том, что при длительном воздействии инфекционного агента на иммунную систему происходит вторичное повреждение эндометрия. При этом нарушается процесс апоптоза (запрограммированной гибели клетки) [11] .
Классификация и стадии развития эндометрита
Эндометрит можно разделить на острую и хроническую форму.
Острый эндометрит возникает при абортах, диагностических манипуляциях, выскабливании, развивается быстро, воспаление сопровождается острыми или ноющими болями и повышением температуры. Наиболее частый путь инфекции при нём — восходящий. Распространение инфекции из влагалища в верхние отделы репродуктивного тракта происходит при несостоятельности барьера шейки матки. Воспаление может локализоваться в эндометрии, а также переходить на миометрий. При несвоевременном и неполноценном лечении возможно развитие пельвиоперитонита (воспаление оболочки брюшины в области малого таза).
Отдельно выделяется острый послеродовый эндометрит — начинается на 2-4 сутки после родов, ему может предшествовать хориоамнионит (инфицирование оболочек плода и жидкости).
При хроническом эндометрите симптоматика сглажена. Характерны периодические обострения и рецидивы после переохлаждения и воспаления другой локализации урогенитального тракта.
По клиническим проявлениям эндометрит подразделяется на клиничеcки выраженную и субклиническую форму.
По характеру воспалительного процесса эндометрит можно разделить на:
- Катаральную форму (поражение поверхностных слоев слизистой оболочки матки и выделение слизистого экссудата).
- Катарально-гнойную форму.
- Гнойную форму.
- Некротическую форму.
- Гангренозную форму.
По морфологическим признакам:
- Атрофический эндометрит — наблюдается атрофия желез эндометрия, фиброз стромы, инфильтрация лимфоидными элементами;
- Кистозный эндометрит — сдавление протоков желез фиброзной тканью, образование кистозных элементов в эндометрии;
- Гипертрофический эндометрит — характеризуется гипертрофией желез эндометрия в результате хронического воспаления [5] .
Осложнения эндометрита
Осложнения у эндометрита могут быть достаточно серьёзными.
Метротромбофлебит (тромбоз тазовых вен) развивается через 2-3 недели от начала заболевания эндометритом. Пациентки отмечают общие симптомы воспаления, сохраняющуюся повышенную температуру тела, тянущие или острые боли внизу живота, выделения из половых путей [1] [2] .
Параметрит — воспаление околоматочной клетчатки. После внедрения инфекционного возбудителя в параметрий возможно образование диффузного воспалительного инфильтрата. При отсутствии лечения происходит нагноение и переход в хроническое течение. При переходе на всю клетчатку развивается пельвиоцеллюлит (воспаление клетчатчки малого таза) [2] [9] [10] .
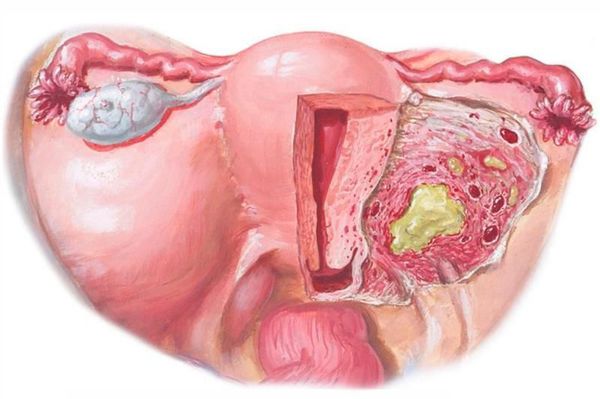
Пельвиоперитонит — воспаление выходит за пределы матки, в процесс вовлекаются листки брюшины. Пациентки отмечают резкое повышение температуры, симптомы интоксикации, тошноту, рвоту, интенсивные боли внизу живота (основная локализация ниже пупка), симптом раздражения брюшины ( резкое усиление боли в животе при быстром надавливании и снятии руки).
Сальпингоофорит — воспалительный процесс в маточных трубах и яичнике. Наиболее частые осложнения при несвоевременном лечении: пиовар (гнойное воспаление яичника) и туюоовар (формирование единого гнойного конгламерата из воспаленного яичника и маточной трубы). Все вышеперечисленные осложнения требуют оперативного лечения [2] [9] [10] .
Другими осложнениями могут быть бесплодие, нарушение менструального цикла, выкидыши, внематочная беременность, спаечный процесс в малом тазу [1] [2] [3] .
В некоторых случаях возникает септический шок — угрожающее жизни осложнение, в условиях которого критически нарушается кровоснабжение тканей и клеточный метаболизм. Главные симптомы сепсиса — высокие показатели температуры тела, симптомы интоксикации, снижение давления и тахикардия, изменения в общих анализах крови, обильное потоотделение, спутанность сознания [8] [9] .
Диагностика эндометрита
Диагностика хронического эндометрита должна быть основана на комплексном подходе анализа жалоб пациентки, анамнеза, симптомов, результатов эхографических исследований, лабораторной диагностики, данных морфологического исследования эндометрия и иммунного статуса.
Пайпель-биопсия эндометрия
Хронический эндометрит диагностируют прежде всего с помощью морфологического исследования [8] .
Гистологический материал получают при выскабливании стенок полости матки под контролем гистероскопа или пайпель-биопсии. Пайпель-биопсия — это получение гистологического материала с помощью тонких канюль при аспирации (удалении) эндометрия. Данный метод имеет большую диагностическую ценность в амбулаторных условиях.
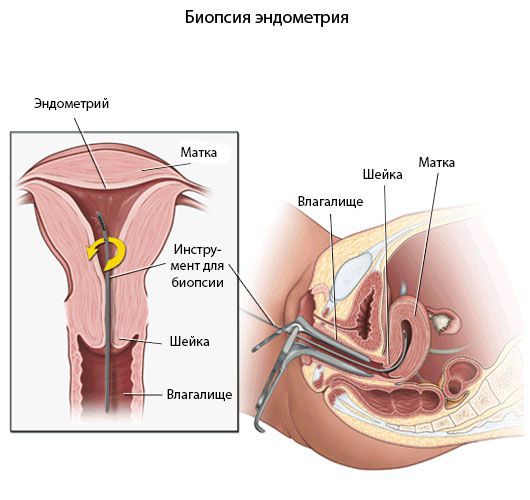
Критериями хронического эндометрита является наличие очаговых или диффузных лимфоидных инфильтратов, склероз стенок спиральных артерий, фиброз стромы и наличие плазматических клеток. При этом к абсолютным признакам хронического эндометрита относят плазматические клетки.
Микробиологическое исследование
Микробиологические посевы используются для выявления возбудителя воспалительного процесса.
Иммуногистохимическое исследование
Иммуногистохимическое исследование при эндометрите заключается в исследовании биоптата слизистой оболочки матки с целью определения мембранного белка, который является маркером плазматических клеток. Информативность гистологического исследования при этом возрастает до 85-90%, можно установить и иммунный характер повреждения эндометрия [5] [7] [8] .
УЗИ при эндометрите
При эхографии (УЗИ) хронический эндометрит определяют по:
- изменениям в структуре эндометрия;
- участкам повышенной эхогенности различной формы и величины в зоне М-Эхо;
- наличию сниженной эхогенности в эндометрии;
- наличию жидкости в полости матки;
- присутствию мелких кальцинатов 1-3 мм в эндометрии;
- участкам фиброза в эндометрии разной степени;
- наличию внутриматочных синехий.
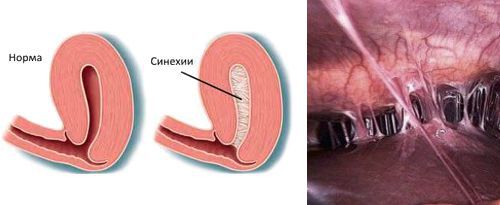
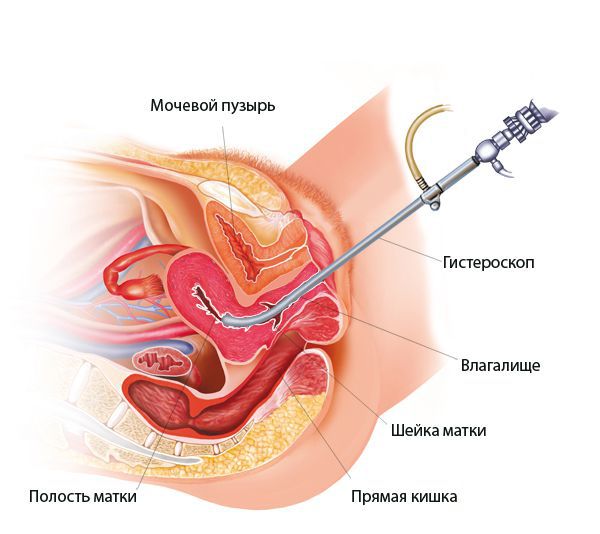
Гистероскопия при эндометрите
При гистероскопии определяются следующие признаки хронического эндометрита: гиперемия слизистой оболочки матки, неровномерная толщина эндометрия, полипообразные образования, кровоизлияния, очаговая гиперплазия эндометрия.
Лечение эндометрита
Лечение эндометрита на первом этапе заключается в устранении бактериального или грибкового возбудителя, а для эндометрита вирусной этиологии — снижении вирусной нагрузки [7] . Для этого проводят комплексное лечение, включающее в себя антибактериальную терапию, анаэробные средства, противовоспалительные и противовирусные лекарственные средства [5] [6] [8] .
Второй этап заключается в восстановлении рецептивности эндометрия и его функциональности. Успешное восстановление рецепторного аппарата эндометрия должно происходить без снижения пролиферации (размножения, разрастания) клеток. Устраняются последствия ишемии, склеротические процессы, восстановливается отток крови. Длительность и объёмы терапии зависят от тяжести воспалительного процесса и сопутствующей гинекологической патологии. После проведения основных этапов лечения необходим курс реабилитации (физио-терапевтическое лечение) [7] [8] [10] .
Иммуностимулирующую терапию применяют при комплексном лечении хронического эндометрита, если выявлена вирусная инфекция: вирус папилломы человека, герпеса, Эпштейна — Барр, цитомегаловирус.
Гормональную терапию используют для подготовки эндометрия, чаще всего перед ЭКО. Для применения гормональных препаратов необходимо гистологическое подтверждение патологии эндометрия.
Контрольные критерии эффективности терапии хронического эндометрита:
- допплерометрическое исследование сосудов матки с ЦДК во 2 фазу менструального цикла;
- определение ангиогенных факторов;
- клиническое улучшение.
Рекомендации по диагностике и лечении эффективны лишь у половины больных, а частота рецидивов остается на уровне 25 % [13] .
Прогноз. Профилактика
При своевременном и полноценном лечении прогноз благоприятный. Пациентки отмечают улучшение состояния в течении двух суток. При запоздалом лечении эндометрита возможно развитие септического шока.
Что такое гиперплазия эндометрия? Причины возникновения, диагностику и методы лечения разберем в статье доктора Анькиной Анны Олеговны, врача УЗИ со стажем в 10 лет.
Над статьей доктора Анькиной Анны Олеговны работали литературный редактор Юлия Липовская , научный редактор Юлия Кондратенко и шеф-редактор Маргарита Тихонова

Определение болезни. Причины заболевания
Гиперплазия эндометрия (гиперпластические процессы эндометрия) — это патологическое разрастание желёз слизистой оболочки матки. Эндометрий состоит из желёз и стромы (основы). В норме строма занимает более половины площади эндометрия, при гиперплазии соотношение желёз к строме становится более 50 % [24] .
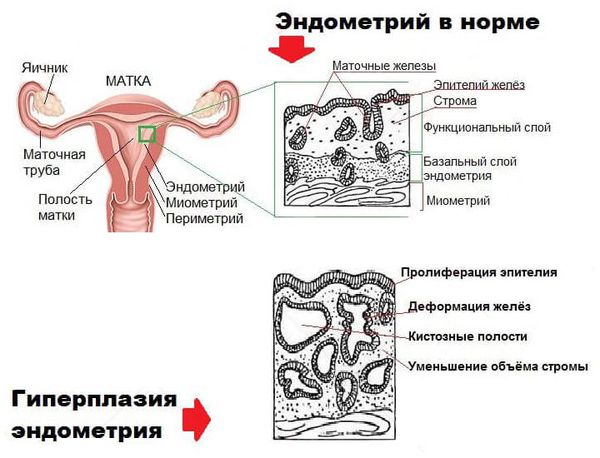
Гиперплазию нужно отличать от пролифелирующего эндометрия, при котором эндометрий растёт, но не имеет структурных особенностей, характерных для ранней, средней или поздней стадии пролиферации в нормальном менструальном цикле. Также он отличается наличием участков кровоизлияний, дистрофических изменений и распадом [22] .
Пролиферирующий эндометрий не является формой гиперплазии, так как соотношение желёз эндометрия к строме не изменяется. Однако если состояние не лечить, повышается риск развития гиперплазии [23] .
Распространённость заболевания составляет 15–50 % от всех гинекологических патологий [7] . Гиперплазия эндометрия может возникнуть у женщин всех возрастов, но чаще развивается в 40-44 года, когда происходит гормональная перестройка из-за приближения менопаузы [1] [6] .
В составе маточного эндометрия есть специфические рецепторы, которые делают его органом-мишенью для половых гормонов. При гормональном сбое нарушается рост и дифференцировка эндометриальных клеток, что приводит к разрастанию эндометрия.
Факторы риска развития гиперплазии эндометрия [1] [8] [11] :
-
и связанное с ним избыточное образование эстрогенов из андрогенов в жировой ткани [3] ;
- возраст старше 35 лет;
- наследственность и генетические мутации;
- злостное курение табака;
- раннее менархе (начало менструации) — до 12 лет;
- поздняя менопауза — позже 55 лет;
- затянувшийся период менопаузального перехода;
- хроническая ановуляция (отсутствие овуляции у женщины репродуктивного возраста более шести циклов подряд);
- сопутствующие заболевания: сахарный диабет 2-го типа, ожирение, синдром Линча (наследственный неполипозный колоректальный рак), синдром поликистозных яичников (СПКЯ), гормональные опухоли яичников, бесплодие, а также заболевания пищеварительного тракта, иммунной системы и щитовидной железы;
- приём некоторых лекарственных препаратов: менопаузальная заместительная гормональная терапия (ЗГТ), содержащая только эстрогены; длительная терапия Тамоксифеном. Этот препарат применяется в составе комплексного лечения рака молочной железы. Его побочным эффектом является влияние на слизистую оболочку матки с развитием гиперплазии [14] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы гиперплазии эндометрия
В редких случаях гиперплазия эндометрия может протекать без симптомов [16] [17] . Но обычно для гиперпластических процессов эндометрия характерны нарушения менструального цикла:
- интервал между менструациями более 35 дней или менее 21 дня;
- затяжные, обильные менструации;
- кровянистые выделения из половых путей между менструациями;
- отсутствие менструаций более шести месяцев вне беременности и лактации.
Пациентки репродуктивного возраста иногда жалуются на отсутствие беременности при регулярной половой жизни [15] [18] .
В период перехода к менопаузе основным симптомом заболевания являются нерегулярные обильные менструации, сменяющиеся длительными мажущими кровянистыми выделениями.
Женщины менопаузального возраста жалуются на скудные кровянистые выделения из половых путей. Они могут проявляться эпизодически либо быть продолжительными.
Иногда пациенток беспокоят симптомы, характерные для обменных и эндокринных нарушений: головные боли, избыточная прибавка веса, нарушение сна, периодически возникающая жажда, утомляемость, пониженная работоспособность и раздражительность, чрезмерный рост волос (в том числе на участках кожи, для которых это несвойственно) [2] [11] .
Патогенез гиперплазии эндометрия
Состояние эндометрия зависит от фазы менструального цикла:
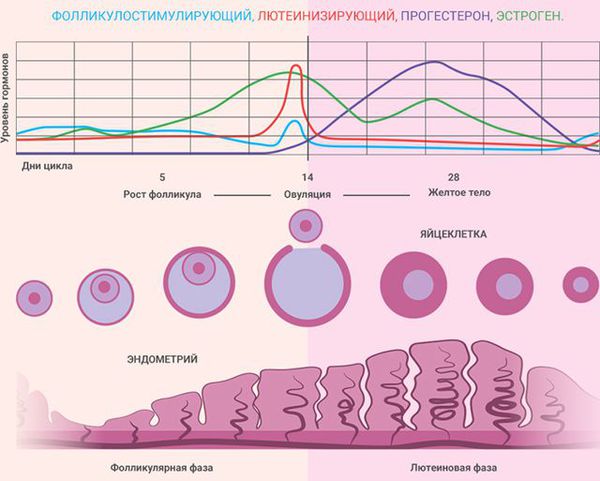
В патогенезе гиперплазии эндометрия выделяют два варианта развития событий:
- Гормонозависимый — избыточное влияние эстрогенов на слизистую оболочку матки при недостаточном воздействии прогестерона, который должен подавлять действие эстрогенов. Наблюдается при недостатке прогестерона или при избытке эстрогенов. В этом случае эстрогены провоцируют патологический рост эндометриальных желёз, при котором изменяется их форма и размер. Из-за недостатка прогестерона не наступает фаза секреции, поэтому эндометрий продолжает активно расти. Гиперплазия эндометрия почти всегда является гормонозависимой.
- Гормононезависимый — патологический ответ желёз и стромы эндометрия на нормальный уровень эстрогена. Может возникнуть из-за хронического воспаления эндометрия. В этом случае аномальное разрастание эндометрия связано с тем, что у рецепторов меняется структура и функции.
При гиперплазии эндометрия без клеточной атипии из-за гормонального дисбаланса увеличивается количество желёз. Их соотношение к строме эндометрия начинает превышать 50 % [3] [7] .
В случае гиперплазии эндометрия с атипией избыток желёз эндометрия сочетается с клеточными мутациями (атипическим перерождением). Атипическая гиперплазия эндометрия является предраковым состоянием.
Классификация и стадии развития гиперплазии эндометрия
Рассмотрим две основные международные классификации гиперплазии эндометрия, которые основаны на оценке строения ткани [4] [9] [12] .
Международная классификация болезней 10-го пересмотра (МКБ-10):
- N85.0 Железистая гиперплазия эндометрия (кистозная, железисто-кистозная, полипоидная).
- N85.1 Аденоматозная (атипическая) гиперплазия эндометрия.
Пересмотренная классификация ВОЗ 2014 года:
Основная цель этих классификаций — разграничить доброкачественную гиперплазию и гиперплазию с наличием атипических клеток. Это важно, чтобы определить дальнейшую тактику ведения пациенток, так как атипичная гиперплазия часто перерождается в рак [9] .
Осложнения гиперплазии эндометрия
Анемия. Для гиперплазии эндометрия характерны аномальные маточные кровотечения. В связи с этим женщины часто страдают от хронического малокровия разной степени выраженности.
Бесплодие. Гормональные изменения отражаются на качестве эндометрия, что создаёт риск неудачной имплантации эмбриона. Помимо этого, гиперплазия эндометрия часто выявляется на фоне хронической ановуляции, при которой зачатие невозможно.
Перерождение в рак эндометрия. Самое грозное осложнение гиперплазии эндометрия. Согласно исследованию 2006 года, атипическая гиперплазия эндометрия перерождается в аденокарциному эндометрия в 29 % случаев. Гиперплазия без атипии становится злокачественной менее чем в 5 % случаев [4] [10] .
Риск озлокачествления зависит в первую очередь от выраженности клеточного атипизма, т. е. от степени изменения клеток. Возраст, состояние яичников, сопутствующие эндокринные заболевания, ожирение и приём гормональных препаратов не так сильно влияют на риск перерождения [10] . Поэтому так важна своевременная диагностика гиперплазии эндометрия и последующее выделение пациенток с этой патологией в группу онкологического риска [13] .
Диагностика гиперплазии эндометрия
Диагностика основана на анализе данных анамнеза пациентки (истории болезни), клинической картины заболевания (жалоб и физикального осмотра), а также на результатах ультразвукового и гистероскопического исследования с обязательным патоморфологическим анализом соскоба из полости матки.
Анамнез и клиническая картина
При сборе анамнеза врач-гинеколог задаёт пациентке вопросы:
- Были ли гинекологические проблемы у мамы, бабушки или других родственников по женской линии.
- Какой образ жизни ведёт пациентка.
- Есть ли вредные привычки.
- Какой характер питания.
- Как проходят менструации: длина цикла, характер и продолжительность менструаций.
- Бывают ли аномальные маточные кровотечения. Если да, каков их характер и продолжительность.
- Была ли беременность и роды, планируется ли беременность в будущем. Невозможность зачать ребёнка и невынашивание могут быть симптомом гиперплазии эндометрия [18] .
- Есть ли сопутствующие заболевания из группы риска по развитию гиперплазии эндометрия.
- Принимает ли пациентка какие-либо гормональные препараты.
Физикальный осмотр включает в себя местный осмотр наружных половых органов, исследование влагалища и шейки матки в зеркалах, а также бимануальное (двумя руками) исследование матки и придатков. Осмотр проводится на первичном приёме, чтобы исключить воспалительные заболевания и/или объёмные опухолевые образования.
Инструментальная диагностика
Трансвагинальное ультразвуковое исследование (ТВУЗИ) органов малого таза. Толщина эндометрия по данным УЗИ не является надёжным критерием выявления гиперплазии эндометрия у женщин репродуктивного возраста [26] . Исследование проводят, чтобы исключить другие причины аномальных маточных кровотечений или оценить толщину эндометрия у женщин в постменопаузе [23] [27] .
У женщин репродуктивного и пременопаузального возрастов при подозрении на гиперплазию эндометрия ТВУЗИ органов малого таза проводится на 5 – 7-й день менструального цикла. В норме в это время толщина эндометрия не превышает 6 мм. Патологию эндометрия подозревают, когда его толщина не соответствует определённой фазе менструального цикла:
В постменопаузе толщина эндометрия в норме должна быть не более 4 – 5 мм. Патологическое утолщение диагностируют, когда этот показатель превышает 5 мм [12] . Допустимая толщина эндометрия на фоне приёма Тамоксифена не больше 9 мм.
Помимо измерения толщины врач ультразвуковой диагностики оценивает кровоснабжение эндометрия, а также его контуры, однородность и соответствие фазе цикла у женщин репродуктивного возраста. Для атипической гиперплазии характерно более выраженное утолщение слизистого слоя матки, его неоднородность, неровные извилистые контуры и более интенсивная васкуляризация (кровоснабжение) [2] [7] .
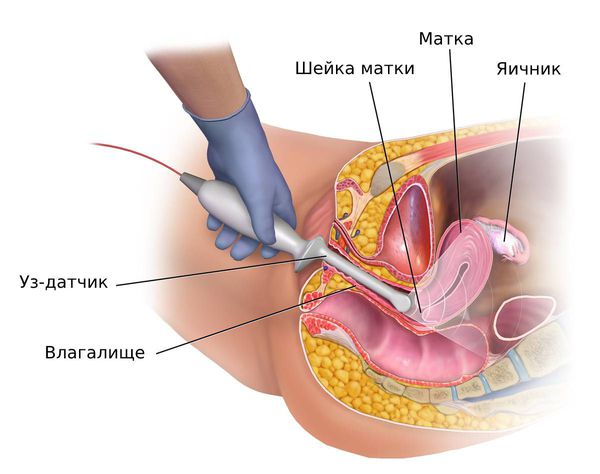
В некоторых случаях, например при обильном кровотечении, которое угрожает здоровью пациентки, ТВУЗИ не проводится. Сразу принимается решение об обоснованном диагностическом выскабливании по жизненным показаниям [19] .
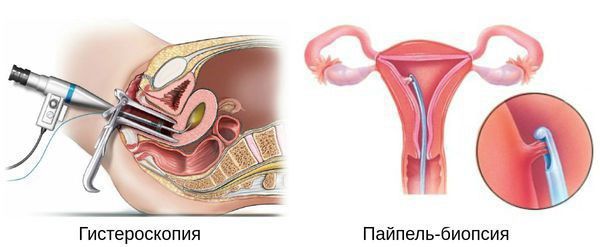
Гистероскопия с раздельным диагностическим выскабливанием (РДВ) матки и цервикального канала — информативный метод в диагностике гиперпластических процессов эндометрия. При помощи гистероскопа (эндоскопического прибора для осмотра полости матки) врач оценивает состояние слизистой оболочки матки и цервикального канала. При необходимости удаляет локальные поражения и обязательно берёт материал для последующего гистологического исследования.
Если выскабливание проводят как лечебную процедуру при обильном маточном кровотечении, врач полностью удаляет слизистую оболочку матки под контролем гистероскопии.
У женщин репродуктивного возраста (15 – 49 лет) аспират берут на 2 – 26-й день менструального цикла. У женщин в пременопаузе (с 40 – 45 лет и до наступления менопаузы) и в менопаузальном возрасте (своевременная менопауза наступает в 46 – 54 года) пайпель-биопсию можно делать в любой день [20] [21] .
Дифференциальная диагностика гиперплазии эндометрия проводится с полипом эндометрия, субмукозной (подслизистой) миомой матки, эндометритом, прервавшейся беременностью и раком эндометрия.
Лечение гиперплазии эндометрия
Лечение патологии эндометрия основывается на трёх принципах:
- Предупредить развитие/прогрессирование злокачественного процесса эндометрия.
- Исключить сопутствующие злокачественные процессы в эндометрии.
- Выбрать наиболее подходящий пациентке план лечения [3] .
Тактика лечения будет зависеть от результата гистологического исследования эндометрия, полученного в ходе выскабливания, от возраста женщины, сопутствующих заболеваний и репродуктивных планов.
Лечебная тактика в зависимости от наличия или отсутствия атипии [27] [29] .
Гиперплазия эндометрия без атипии:
Гиперплазия эндометрия с атипией:
- Консервативное лечение проводится только у женщин, желающих сохранить способность к деторождению. Назначаются высокие дозы гестагенов и гистологический мониторинг.
- Хирургическое лечение. Выполняется пангистерэктомия — радикальная операция, при которой тело, шейка матки, маточные трубы и яичники удаляются через разрез в брюшной полости.
Наблюдение. У 70–80 % пациенток наблюдается самостоятельное исчезновение признаков гиперплазии. Поэтому если у женщины нет никаких симптомов и факторов риска, то врач наблюдает за состоянием эндометрия с помощью контрольных биопсий один раз в 6 месяцев. При получении двух последовательных негативных биопсий пациентку снимают с учёта [12] .
Медикаментозное лечение гормональными препаратами проводится пациенткам репродуктивного возраста с неатипической гиперплазией эндометрия при наличии симптомов, факторов риска, отсутствии регресса за 6 месяцев наблюдения и при атипической гиперплазии эндометрия у женщин, планирующих беременность.
В периоды пери- и постменопаузы гормонотерапию проводят только при неатипических формах гиперплазии эндометрия [30] .
Гормональную терапию назначают не менее чем на 6 месяцев:
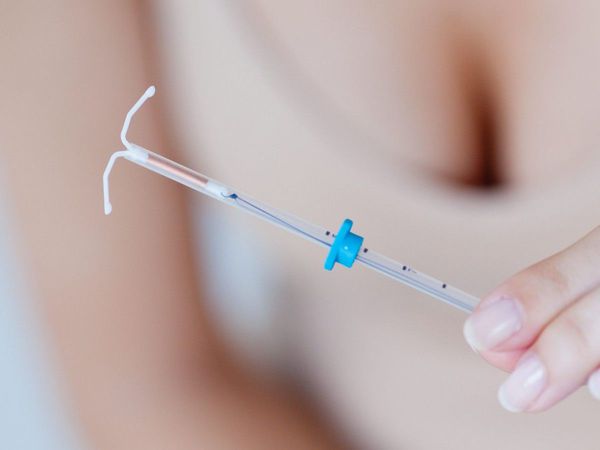
После курса медикаментозной терапии необходимо сделать не менее двух контрольных биопсии эндометрия с интервалом один раз в 6 месяцев [3] [11] . Критерием излеченности гиперплазии эндометрия будет отсутствие патологических изменений в биоптате.
В качестве негормональной терапии возможно применение препаратов:
-
— негормональный лекарственный растительный препарат из плодов Витекса священного. Компоненты препарата нормализуют концентрацию половых гормонов. — комбинированный препарат на растительной основе [32] .
Лечение нужно сочетать с низкокалорийной диетой и достаточной физической нагрузкой согласно общему физическому развитию женщины. При необходимости врач назначает препараты, которые нормализуют метаболизм углеводов в организме: подавляют образование глюкозы клетками печени, повышают чувствительность тканей к инсулину, расщепляют сложные сахара.
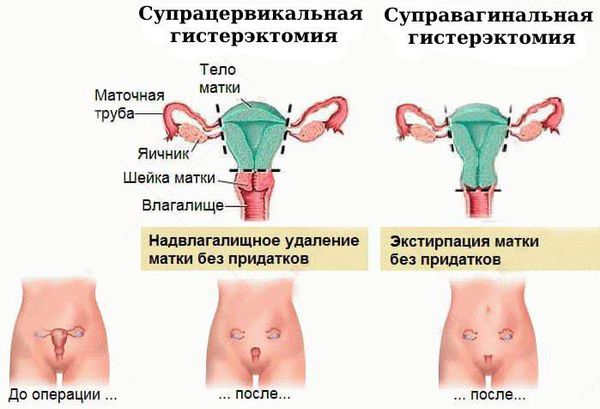
Хирургическое лечение. Атипическая гиперплазия эндометрия на начальном этапе требует обязательной консультации онкогинеколога, который должен установить, нужна ли операция и в каком объёме.
Чаще всего выполняется надвлагалищная ампутация матки — суправагинальная гистерэктомия (удаление тела и шейки матки). Вопрос о сохранении яичников решается строго индивидуально, зависит от возраста пациентки и факторов риска.
Показания к гистерэктомии:
- Атипический гиперпластический процесс эндометрия у пациенток старше 50 лет.
- Атипическая гиперплазия эндометрия, развившаяся в ходе лечения неатипической гиперплазии.
- Рецидивирующая гиперплазия эндометрия, особенно в сочетании с миомой матки и аденомиозом (эндометриоз тела матки) [3][11] .
Прогноз. Профилактика
После успешного лечения пациентки должны находиться на диспансерном учёте: посещать гинеколога и делать ТВУЗИ органов малого таза один раз в пол года на протяжении пяти лет [11] [12] .
Применение прогестагенов в лечении гиперплазии эндометрия без атипии дают хорошие результаты: в 89–96 % случаев патологические изменения достаточно быстро регрессируют [3] [5] . Рецидив заболевания при неатипическом процессе выявляют в 6 % случаев.
В случае атипической гиперплазии эффективность лечения составляет 50 %. Рецидив регистрируется в 25 % случаев, ещё в 25 % выявляется рак эндометрия [10] .
Обследование для исключения гиперплазии или рака эндометрия показано в следующих случаях:
1. Если есть аномальные маточные кровотечения [29] [31] :
- В постменопаузальном периоде показанием является любое маточное кровотечение, независимо от объёма и длительности. Первый шаг в этом случае — измерение толщины эндометрия с помощью ТВУЗИ:
- если этот показатель менее 5 мм — риск атипии минимальный;
- если толщина эндометрия более 5 мм — показана биопсия эндометрия.
- В период перименопаузы (от 45 лет и до менопаузы) обследование необходимо при частых, длительных или обильных аномальных маточных кровотечениях.
- До 45 лет:
- Показания у женщин с ожирением: частые, длительные или обильные аномальные маточные кровотечения.
- У женщин без ожирения: длительные аномальные маточные кровотечения в сочетании с хронической ановуляцией, монотерапией эстрогенами, эстрогенпродуцирующей опухолью, отсутствием эффекта от лечения аномальных маточных кровотечений, высоким риском развития рака эндометрия (синдром Линча), отсутствием менструации в течение шести и более месяцев с хронической ановуляцией.
2. Если по результатам цитологического исследования соскоба шейки матки отмечается:
Цитомегаловирус является представителем семейства герпесвирусов. Если этот вирус попадает в организм человека, то он остается там пожизненно. По различным исследованиям, инфицированность цитомегаловирусом составляет около 40% населения земного шара. При этом большая доля заражений приходится на младенческий и детский возраст.
ПУТИ ЗАРАЖЕНИЯ ЦИТОМЕГАЛОВИРУСОМ
Цитомегаловирус не является особо заразным, поэтому инфицирование происходит чаще всего в результате длительных и тесных контактов с вирусоносителем: через слюну (при поцелуях), через биологические жидкости при половом контакте, при переливании крови, от матери к ребенку во время беременности, родов и лактации.
КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ ПРИ ЗАРАЖЕНИИ ЦИТОМЕГАЛОВИРУСОМ
Инкубационный период в 20-60 дней обычно завершается стартом острой фазы болезни, продолжающейся от 2 до 6 недель. Для цитомегаловируса характерны признаки общей интоксикации: повышение температуры, озноб, головные и мышечные боли, слабость. После окончания острой фазы в течение многих недель может развиваться состояние слабости с поражением внутренних органов.
Обычно активизация цитомегаловируса проявляется в трех основных формах:
ДИАГНОСТИКА ЦИТОМЕГАЛОВИРУСА
Диагностика цитомегаловируса основана, как правило, на предположениях о наличии вируса при трудности лечения клинических проявлений обычными способами, после чего делаются биохимические анализы: ПЦР или посев клеток на культуре. Обычно результаты этих исследований дают ответ на вопросы о том, есть ли цитомегаловирус в крови, насколько он активен и эффективна ли терапия.
ЛЕЧЕНИЕ ЦИТОМЕГАЛОВИРУСНОЙ ИНФЕКЦИИ
Лечение цитомегаловируса проводится в стандартной для большинства вирусных инфекций последовательности действий – иммуномодулирующее (укрепление защитных сил организма) воздействие, а также комплекс противовирусных терапевтических мероприятий.
Сам цитомегаловирус, попавший в кровь, излечить полностью невозможно, но отсутствие его в биологических жидкостях говорит о его переходе в безопасную латентную фазу, которая, при хорошем иммунном статусе, может всегда такой и оставаться.
ЦИТОМЕГАЛОВИРУС И БЕРЕМЕННОСТЬ
Первичное заражение матери цитомегаловирусом является достаточно опасным для плода, т.к. существует вероятность поражения ЦНС ребенка и различных отклонений в его развитии. По статистике, заражение плода происходит в 30% случаев, а отклонения в развитии наблюдаются только в 15% случаев, поэтому обычно прерывания беременности не рекомендуют.
При обострении уже имеющейся инфекции вред для ребенка гораздо меньший, т.к. у матери уже присутствуют антитела, ослабляющие вирус и препятствующие проникновению через плаценту.
Важным фактором также является и срок беременности: более опасны в плане инфицирования более ранние сроки – в этот период активизация цитомегаловируса может привести к выкидышу и серьезным нарушениям в развитии. А вот после 4 месяцев беременности вреда фактически не наблюдается, но инфицирование может произойти при родах, что, к счастью, не так опасно, как внутриутробное заражение.
ПРОФИЛАКТИКА ОСЛОЖНЕНИЙ БЕРЕМЕННОСТИ
Так что при планировании беременности всегда очень важно пройти полное обследование на наличие бактерий и вирусов и провести их своевременное лечение заранее. Вы всегда можете сделать это у нас – в Клинике Доктора Назимовой, где можете быть уверены в качестве диагностики и лечения.
Читайте также:

