Цитомегаловирус и желтуха новорожденных лечение
Обновлено: 24.04.2024
В статье описано течение холестатического варианта врожденной цитомегаловирусной инфекции у детей с оценкой акушерско-гинекологического анамнеза матерей и особенностей неонатального периода у новорожденных. Беременность у женщин протекала с признаками фет
Abstract. The article describes the course of the cholestatic variant of congenital cytomegalovirus infection in children with an assessment of the obstetric and gynecological history of mothers and the characteristics of the newbornneonatal period. Pregnancy in women proceeded with signs of fetal-placental insufficiency, which led to the birth of children with a low gestational age, since cytomegalovirus infection developed in an acute form. The newborns had a low Apgar score and signs of hypotrophy of I-II degrees. The clinical picture of congenital cytomegalovirus hepatitis was characterized by a protracted course and had an undulating character, a complete recovery of mass-growth parameters, a symptom of jaundice took place within 3 months. It was revealed that a longer cholestasis syndrome was observed in children who had both congenital cytomegalovirus infection and impaired bilirubin uptake, in particular, Gilbert's syndrome. Ursodeoxycholic acid is the only generally accepted starting drug for the drug effect on cholestasis syndrome in children with liver disease. Complex therapy with the use of the drug Ursodeoxycholic acid at a dose of 15-20 mg/kg per day, at the early stages of treatment, this infectious pathology made it possible to stabilize the clinical and laboratory parameters. In the absence of complaints and clinical manifestations, the levels of ALT, AST and ALP were restored for a long period within 5-6 months, while the cholesterol values returned to normal by 3 months. The chosen scheme of therapy with Ursodeoxycholic acid at a dose of 15-20 mg/kg per day contributed to the prevention of severe complications from the biliary tract, such as chronic cholecystocholangitis, primary biliary cirrhosis. The use of therapeutic tactics, taking into account the individual characteristics of young children, was not accompanied by the presence of side effects. For citation: Pervishko O. V., Soboleva N. G., Baum T. G., Volik D. V., Kalinovskya D. Yu. Congenital cytomegalovirus hepatitis: cholestatic syndrome and its correction // Lechaschi Vrach. 2022; 2 (25): 20-24. DOI: 10.51793/OS.2022.25.2.003
Резюме. В статье описано течение холестатического варианта врожденной цитомегаловирусной инфекции у детей с оценкой акушерско-гинекологического анамнеза матерей и особенностей неонатального периода у новорожденных. Беременность у женщин протекала с признаками фетоплацентарной недостаточности, что обуславливало рождение детей с низким сроком гестации, так как цитомегаловирусная инфекция развивалась в острой форме. Новорожденные имели низкую оценку по шкале Апгар и признаки гипотрофии I-II степени. Клиническая картина врожденного цитомегаловирусного гепатита характеризовалась затяжным течением и носила волнообразный характер, полное восстановление весоростовых показателей, симптома желтухи проходило в течение 3 месяцев. Выявлено, что более длительный синдром холестаза отмечался у детей, которые имели одновременно врожденную цитомегаловирусную инфекцию и нарушение захвата билирубина, в частности синдром Жильбера. Единственным общепринятым стартовым препаратом для медикаментозного воздействия на синдром холестаза при заболеваниях печени у детей является урсодезоксихолевая кислота. Комплексная терапия с применением препарата урсодезоксихолевой кислоты в дозе 15-20 мг/кг в сутки на ранних этапах лечения данной инфекционной патологии позволила стабилизировать клинико-лабораторные показатели. При отсутствии жалоб и клинических проявлений уровни аланинаминотрансферазы, аспартатаминотрансферазы и щелочной фосфатазы восстанавливались в течение 5-6 месяцев, тогда как показатели холестерина нормализовались к 3 месяцам. Выбранная схема терапии препаратом урсодезоксихолевой кислоты в дозе 15-20 мг/кг в сутки способствовала профилактике тяжелых осложнений со стороны желчевыводящих путей, таких как хронические холецистохолангиты, первичный билиарный цирроз. Применение лечебной тактики с учетом индивидуальных особенностей детей раннего возраста не сопровождалось побочными эффектами.
В зарубежных и отечественных литературных источниках наиболее исследованной инфекцией раннего детского возраста была и остается одна из герпетических, а именно цитомегаловирусная (ЦМВИ). Влияние вирусного агента на различных этапах внутриутробного и внеутробного периода формирует основную клиническую картину. Вариантами течения заболевания являются:
- острый приобретенный ЦМВ-гепатит с полным выздоровлением;
- первично-хронический приобретенный ЦМВ-гепатит умеренной степени активности;
- врожденный ЦМВ-гепатит с формированием порока развития (атрезии) желчевыводящих путей;
- формирующийся билиарный цирроз печени 4.
Механизм формирования отличных друг от друга патологий печени при ЦМВИ до конца не изучен [5]. В то же время с помощью нецелевой газовой хроматографии – масс-спектрометрии активно исследуются изменения аминокислотного, азотного и энергетического обмена у детей с инфантильной холестатической гепатопатией и внепеченочной билиарной атрезией [6]. Современные клинические характеристики ЦМВ-гепатита связаны с синдромом длительной желтухи, гиперферментемией, холестазом, а также с формированием аплазии/гипоплазии желчных протоков 8.
Современная лабораторная диагностика позволяет установить причину заражения гепатотропным вирусом и определить вовлеченность паренхимы в патологический процесс [9]. Холестатический вариант течения болезни является наиболее распространенным. Он характеризуется наличием желтухи у 62% детей. Основным биохимическим показателем холестаза у новорожденных и детей раннего возраста является повышение в сыворотке крови щелочной фосфатазы (ЩФ), 5-нуклеотидазы (5-НТ), гаммаглутамилтранспептидазы (ГГТ) [10]. В этом случае показатели аланинаминотрансферазы (АЛТ)/аспартатаминотрансферазы (АСТ) повышаются одновременно в 1,5-2 раза, но с преобладанием уровня АСТ [11].
Длительное хроническое течение заболевания требует назначения гепатопротекторов комбинированного воздействия, в частности, обладающих желчегонным, цитопротективным, антифибринолитическим действием. Единственным общепринятым стартовым препаратом для медикаментозного воздействия на синдром холестаза при заболеваниях печени у детей является урсодезоксихолевая кислота (УДХК) [12]. В литературных источниках широко описаны области ее применения, в частности в составе комплексной терапии холестаза у новорожденных и детей раннего возраста 13, при вирусных гепатитах В и С, а также с целью проведения дифференциальной диагностики билиарной атрезии и неонатального гепатита у 101 ребенка [17]. Основное холеретическое действие УДХК обусловлено несколькими механизмами, в частности конкурентной борьбой с токсичными желчными кислотами за рецепторы в подвздошной кишке, влиянием на гидрофобные желчные кислоты с целью их выведения, активацией транспортных белков [18].
На основании вышесказанного целью нашей работы явилось изучение эффективности применения УДХК при врожденном ЦМВ-гепатите у детей с признаками холестатического синдрома.
Материалы и методы исследования
Под наблюдением находились 34 ребенка в возрасте от 28 дней до 12 месяцев с висцеральной формой врожденной ЦМВИ, протекавшей с синдромом холестаза. Среди них было 19 мальчиков и 15 девочек, выписанных из родильного дома или со второго этапа выхаживания. Ежемесячно при проведении объективного осмотра измеряли антропометрические параметры, оценивали динамику результатов лабораторно-инструментальных обследований.
При выявлении синдрома холестаза всем обследуемым назначали суспензию УДХК (Урсофальк) в вечернее время (19-22 часа) в дозе 15-20 мг/кг в сутки в 1 прием в течение первого месяца с последующим ежемесячным динамическим контролем.
Результаты и обсуждение
У большинства наших пациентов акушерско-гинекологический анамнез был отягощен. В частности, угроза прерывания беременности на ранних сроках отмечалась у 21 женщины; признаки хронической фетоплацентарности – у 67%.
Проведение скрининга на TORCH-инфекции показало, что ЦМВ выявлялся у 7 из 34 обследуемых женщин во время беременности с помощью метода ПЦР-диагностики в крови. После консультации инфекциониста женщины получали лечение интерфероном α-2b по схеме, с последующим динамическим контролем. Остальные беременные на герпетические инфекции не обследовались, 2 женщины на учете не состояли. При сборе акушерского анамнеза обращало на себя внимание наличие контактов внутри семьи с детьми, посещающими детский сад и школу, при этом 9 детей получали лечение по поводу приобретенной ЦМВИ.
Большинство детей родились в срок, но 6 из них имели низкий срок гестации от 32 до 36 недель. Путем кесарева сечения родились 11 детей, при этом отмечен длительный безводный период продолжительностью более 14 часов. При рождении большинство детей имели низкую оценку по шкале Апгар: 6-7 баллов – 21 ребенок; 5-7 баллов – 9 новорожденных; 3-5 баллов – 4 пациента. Оценка весоростовых показателей выявила у 19 новорожденных признаки гипотрофии I–II степени. Признаки врожденной пневмонии отмечались у 12 детей (35%), синдром дыхательных расстройств – у 11 пациентов (32%). Неврологическая симптоматика с момента рождения у 14 (41%) наблюдаемых была представлена синдромом двигательных нарушений, 18 (53%) имели признаки вегетовисцеральных нарушений, 2 (6%) – гипертензионно-гидроцефальный синдром.
Продолжительность лабораторных изменений в биохимических анализах и их показатели перед началом и после терапии представлены в табл. 2.
Прием Урсофалька позволил нормализовать уровень общего и прямого билирубина, содержание холестерина в течение первых 2-3 месяцев лечения, тогда как максимально долго сохранялись высокими уровни АЛТ, АСТ, ГГТ, ЩФ. Особенностями ОАК крови при висцеральной форме ЦМВИ были лейкоцитоз до 13,6 ± 3,1 × 10 9 г/л со сдвигом влево у 2/3 больных; увеличение лимфоцитов – у 55,8% детей; нейтропения – у 41,2%; гипохромная анемия – у 50% обследуемых. Стабилизация показателей тромбоцитов происходила в течение двух месяцев.
По данным ультразвукового обследования органов брюшной полости определялись увеличение печени у 2/3 детей, которое держалось более 6 месяцев, и спленомегалия – до 5 месяцев. Толщина стенки желчного пузыря нормализовалась на фоне применения препарата Урсофальк в течение 2 месяцев у большинства пациентов.
При проведении контроля ПЦР-диагностики на ЦМВ в крови, моче, слюне динамика отрицательных результатов выявилась следующая: в крови вирус перестал определяться в течение 2,5 месяцев. Вирус продолжал сохраняться в слюне (до 2000 копий/ мл) в течение 10 месяцев, в моче (до 1500 копий/ мл) – 9 месяцев при отсутствии клинических проявлений, переводя данное заболевание в стадию стабилизации.
Комплексное лечение позволило нормализовать показатели биохимического анализа крови, в частности показатели общего и прямого билирубина, уровней ферментов печени и холестерина (табл. 2). Применение препарата УДХК (Урсофальк) в дозировке 15-20 мг/кг в лечении синдрома холестаза показало высокую эффективность данной лекарственной формы, а также не позволило развиться осложнениям в виде холецистохолангитов, внутридолькового холестаза, холангита, цирроза печени.
Лечение холестатического варианта врожденной ЦМВИ с использованием препарата УДХК (Урсофальк) в суспензии проводилось длительно, за время наблюдения родители не отмечали побочных эффектов терапии, а ее эффективность оценивали положительно.
Выводы:
- Формирование холестатического варианта врожденной ЦМВИ происходило при первичном инфицировании женщины во время беременности.
- Источниками инфекции для женщины явилось эпидокружение, в частности, дети дошкольного и школьного возраста, посещающие организованные коллективы.
- Холестатический синдром при ЦМВ-гепатите протекает длительно и носит волнообразный характер.
- На формирование длительного синдрома холестаза также оказывали влияние наследственные заболевания, связанные с нарушением захвата билирубина (в частности, синдром Жильбера).
- Назначение препарата УДХК (Урсофальк) приводило к нормализации клинико-лабораторных и инструментальных показателей у детей с синдромом желтухи и холестаза при ЦМВ-гепатите.
- Длительность терапии препаратом УДХК (Урсофальк) определяется индивидуальными особенностями пациента.
- Антихолестатическая терапия препаратом Урсофальк при его длительном приеме направлена на профилактику осложнений при врожденном ЦМВ-гепатите.
КОНФЛИКТ ИНТЕРЕСОВ. Авторы статьи подтвердили отсутствие конфликта интересов, о котором необходимо сообщить.
CONFLICT OF INTERESTS. Not declared.
Литература/References
1 Федеральное государственное бюджетное образовательное учреждение высшего образования Кубанский государственный медицинский университет Министерства здравоохранения Российской Федерации; 350063, Россия, Краснодар, ул. Седина, 4
2 Клиника G8 Centre, 350062, Россия, Краснодар, ул. Совхозная, 1, корп. 7
Сведения об авторах:
Information about the authors:
Врожденный цитомегаловирусный гепатит: холестатический синдром и его коррекция/ О. В. Первишко, Н. Г. Соболева, Т. Г. Баум, Д. В. Волик, Д. Ю. Калиновская
Для цитирования: Первишко О. В., Соболева Н. Г., Баум Т. Г., Волик Д. В., Калиновская Д. Ю. Врожденный цитомегаловирус¬ный гепатит: холестатический синдром и его коррекция // Лечащий Врач. 2022; 2 (25): 20-24. DOI: 10.51793/OS.2022.25.2.003
Теги: новорожденные, цитомегаловирус, желтуха, холестаз
Лечение ЦМВ-инфекции у новорожденного и грудного ребенка
У всех пациентов, получивших лечение в возрасте до трех месяцев, к 1 году наступило полное выздоровление от CMV-гепатита с элиминацией anti-CMV IgM, у 11 и anti-CMV IgG. Психомоторное развитие соответствует возрасту у всех детей, получавших интерферонотерапию с первых трех месяцев жизни. Включение в комплекс терапии виферона позволяет достичь выздоровления от гепатита и избежать серьезных неврологических расстройств. Приводим типичные клинические примеры тактики диагностики и лечения перинатальной цитомегаловирусной инфекции с исходом в выздоровление.
Ребенок В. госпитализирован в возрасте 1 месяца по поводу гепатита в сочетании с неврологической симптоматикой. При поступлении общее состояние ребенка средней тяжести. Жалобы на беспокойства, нарушение сна, периодически — вялость, срыгивание, отказ от еды. Вес при рождении 3 100 г, в возрасте 1 месяца 3 300 г. Бледен. Желтуха средней интенсивности, маскируется бледностью, сероватым оттенком кожи. Печень на 4—3—3 см выступает из подреберья, плотновата, чувствительна при пальпации. Селезенка до 3 см выступает из подреберья.
Активность АЛТ 500 ед, ACT 270 ед, билирубин 80 мкмоль/л, прямой 46 ммоль. DNA СMV обнаружена в возрасте 1 и 2,5 месяца. anti-CMV IgG — с нарастанием титра от 1,403 до 2,129. Диагностирована генерализованная форма ЦМВ инфекции. Получал комбинированную терапию с исходом в выздоровление в возрасте 1,5 лет. Концентрация anti-CMV снизилась до 1,330 о. е. Элиминировала DNA CMV, нормализовались биохимические пробы печени.
В случаях генерализованной инфекции и поздней диагностики, тяжелого поражения головного мозга достичь излечения не удавалось, оставались резидуальные явления со стороны ЦНС.
У ряда детей отмечалось волнообразное течение инфекции — после периода благополучия неожиданное возобновление симптоматики, усиление выраженности внутричерепной гипертензии, что соответствовало фазе репликации цитомегаловируса. К ухудшению состояния больных приводили интеркуррентные заболевания, очередная по календарю прививок вакцинация, смена климатической зоны. Приводим клинический пример провоцирующей роли вакцинации живыми вирусными вакцинами детей с перинатальной цитомегаловирусной инфекцией.

Ребенок В. от первой беременности, протекавшей с токсикозом, водянкой. Родился в срок, с весом 3150, оценка по шкале по Апгар 8 баллов. С рождения недостаточная прибавка в весе, задержка психомоторного развития, упорные срыгивания. В хирургическом отделении исключен пилоростеноз. В возрасте 5 месяцев обследован на ЦМВИ, обнаружены антитела классов IgM и IgG в высоких титрах. В условиях инфекционного отделения был пролечен вифероном короткими повторными курсами. После этого обнаружены только антитела класса IgG с нарастанием титра в 4 раза.
В дальнейшем ребенок неоднократно лечился стационарно по поводу рецидивирующих бронхолегочных заболеваний, задержки психомоторного развития. В возрасте 1 года 3 месяцев после введения первой дозы вакцины АКДС развился судорожный статус, явления энцефалита, ребенок госпитализирован в реанимационное отделение, получал активную синдромальную терапию, затем долечивался е детском психоневрологическом отделении с диагнозом: Рецидив генерализованной цитомегаловирусной инфекции, энцефалит, судорожный синдром.
Несмотря на проведение активной терапии, реабилитационных мероприятий, отмечалась утрата ранее приобретенных навыков, сохранялся судорожный синдром. В возрасте 1 года 10 месяцев ребенок вновь поступил с РО с явлениями тяжелой дыхательной недостаточности на фоне диффузного гнойного эндобронхита, двусторонней пневмонии синегнойной этиологии, бронхоплеврального свища, пневмоторакса справа, пневмомедиастинеума, синдрома полиорганной недостаточности, гепатита. Несмотря на активную терапию, наступил летальный исход. При патологоанатомическом исследовании подтвержден диагноз генерализованной ЦМВИ, в печени и головном мозге обнаружены клетки, содержащие CMV. Вирусные гепатиты исключены.
Таким образом, у наблюдавшихся детей отмечались следующие клинические проявления перинатальной ЦМВИ: врожденная гипотрофия, геморрагический синдром, желтуха, гепатит, неврологические расстройства, в основном, задержка психомоторного развития и гипертензионно-гидроцефальный синдром, анемия. Поздняя диагностика приводила к позднему назначению лечения и низкой его эффективности. По нашему мнению, обследование необходимо проводить в периоде новорожденности. При лечении детей с неврологической симптоматикой, особенно при отсутствии, по данным НСГ, травматических и гипоксических поражений, следует иметь в виду возможность инфекционной этиологии этих нарушений.
Включение в комплекс терапии этих детей противовирусных препаратов позволяет достичь более высоких и стабильных результатов. При лечении вифероном следует придерживаться рекомендаций фирмы-производителя, неуменьшать дозу и не сокращать длительность курса. В группе сравнения — более длительное течение гепатита с тенденцией к хронизации, выраженное отставание в психомоторном развитии, приведшее к инвалидизации у 4 больных, anti CMV IgG обнаруживаются у всех детей более 2 лет. В последние годы нами проводится обследование на широкий спектр Herpes-вирусов.
Как правило, одновременно с маркерами CMV обнаруживаются в диагностических (в большинстве случаев более высоких) титрах антитела к вирусам герпеса 1 и 2, реже — 6 типа. По-видимому, ранее диагностируемая цитомегаловирусная инфекция в ряде случаев была лишь маркером смешанной инфекции.
Желтуха у новорожденного ребенка при цитомегаловирусной (CMV) инфекции
Новорожденные инфицируются цитомегаловирусом (CMV) в период внутриутробного развития, во время родов или постнатально через слюну и грудное молоко, секретируемые инфицированной матерью.
CMV-инфекция представляет собой значительную проблему для всего мира, частота ее возникновения у живорожденных детей достигает 2%. Большинство инфицированных детей не имеют симптомов заболевания. Материнский иммунитет к CMV, в отличие от иммунитета при краснухе и токсоплазмозе, не предотвращает реактивации вируса и не контролирует его распространение, тем самым делая возможным возникновение врожденной инфекции.
В целом рецидивы инфекции приводят к гораздо меньшему риску ее вертикальной передачи. При врожденной CMV-инфекции диагностируют микроцефалию, наличие кальцификатов в перивентрикулярных зонах головного мозга, хориоретинит, пурпуру, задержку психомоторного развития, глухоту и гепатоспленомегалию. Гепатомегалию и желтуху обычно отмечают с первых дней жизни. К гистологическим находкам при исследовании печени в случае CMV-инфекции относят трансформацию гигантских клеток и выраженную воспалительную реакцию.
Редко обнаруживают большие внутриядерные включения в эпителии желчных протоков и включения в цитоплазме гепатоцитов, но данные находки подтверждают диагноз. У детей редко описывают билиарный цирроз и нецирротический портальный фиброз.
Врожденная CMV-инфекция обусловливает выявление кальцификатов в печени на рентгенограммах. В большинстве случаев при катамнестическом исследовании не подтверждается тяжелое заболевание печени, в то время как воздействие на нервную систему носит разрушительный характер.
При ассоциации CMV-инфекции с синдромом приобретенного иммунодефицита (СПИДом) как осложнения выявляют папиллярный стеноз и склерозирующий холангит. Все инфицированные CMV новорожденные выделяют вирус с мочой с момента рождения. Таким образом, диагноз подтверждается при обнаружении CMV в моче.
В настоящее время диагностика с помощью ПЦР стала более доступной, можно напрямую определять ДНК CMV в ткани печени, сыворотке или других жидких средах организма человека, тем не менее однозначная польза перечисленных методов пока не доказана.
У иммунокомпрометированных пациентов с CMV была продемонстрирована эффективность применения ганцикловира. Этот препарат снижает риск нейросенсорной тугоухости при врожденной CMV-инфекции. Валацикловир — препарат, который можно применять перорально, он является предшественником ганцикловира и возможной альтернативой. К вопросу о назначении ганцикловира младенцам с подтвержденной патологией ЦНС, обусловленной CMV, необходимо подходить очень ответственно.
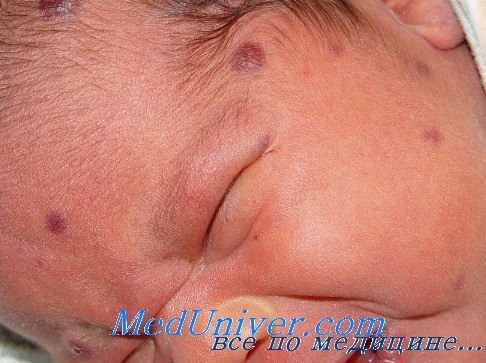
- Вернуться в оглавление раздела "физиология человека"
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Внутриутробная цитомегаловирусная инфекция. Врожденная ЦМВ-инфекция плода
При цитомегаловирусной инфекции бычно выражены проявления гепатита, желтуха, гипербилирубинемия. Функции печени при ЦМВ инфекции обычно у новорожденных уже в первые недели приходит в норму. Петехии обычно носят преходящий характер, чаще обнаруживаются в комбинации с гепатоспленомегалий и тромбоцитопенией.
По данным S. Stagno с соавторами, проникновение ЦМВ к плоду при острой инфекции составляет 45 %, при этом в 2-4 % случаев развивается тяжелая генерализованная цитомегалия. В исследованиях А. П. Скоромец было показано, что внутриутробная цитомегалия может приводить как к формированию врожденных пороков развития, так и разнообразным изменениям, сходным с описанными при внутриутробном герпесе. У детей, больных ЦМВ, наблюдается угнетение клеточного иммунитета.
Мы провели анализ клинико-лабораторных особенностей перинатальной цитомегаловирусной инфекции у детей, направленных по поводу клинигеских проявлений гепатита. Под наблюдением Центра гепатологии Детской инфекционной больницы Тулы находилось 63 ребенка, впервые обратившихся в возрасте от 12 дней до 6 месяцев с различными проявлениями ЦМВИ. Поводом для направления ребенка в стационар были: гепатоспленомегалия, затянувшаяся желтуха, неврологическая симптоматика в сочетании с соматическими нарушениями.
Для верификации диагноза, помимо общеклинических анализов, мы исследовали биохимические показатели, серологические маркеры перинатальных инфекций, в том числе вирусов гепатитов В, С, CMV, Herpes. В лабораториях НИИЭМ им. Н. Ф. Гамалеи и Центра молекулярной диагностики ЦНИИЭ МЗ РФ определяли DNA CMV и концентрацию антител anti-CMV классов IgM, IgG в динамике. Проводили ультразвуковое исследование органов брюшной полости и нейросонографию (НСГ).
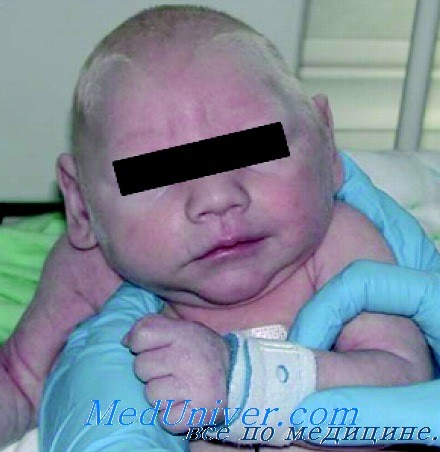
С низкой к сроку гестации массой тела и признаками внутриутробной гипотрофии родились 50 (79,4%) детей. У 33 больных (52,3%) после рождения отмечался кожно-геморрагический синдром, у трех из них — мелена. У 50 (79,4%) детей отмечалось затяжное течение желтухи, которая начиналась, как правило, на 3-5 сутки жизни и сохранялась до 1,5-2-месячного возраста. Преобладала неконъюгированная фракция билирубина. У 25 (39,6 %) новорожденных отмечались дыхательные расстройства, эти дети впоследствии страдали частыми бронхолегочными заболеваниями.
Поражение печени проявлялось в клинической форме гепатита. Увеличение (на 2-5 см из-под края реберной дуги) и плотноватая консистенция печени отмечены у 38 (60,3%) детей. Несколько реже — у 19 (30,2%) — отмечалось увеличение селезенки до 2 см ниже края реберной дуги. У 12 детей (19%) отмечено расширение вен передней брюшной стенки. Функциональные пробы печени были изменены у всех больных: активность АЛТ повышалась в 3-5 раз, ACT — в 2-3 раза, ЩФ — в 1,5-2 раза по сравнению с возрастной нормой.
При УЗИ печени увеличение размеров регистрировалось в основном за счет правой доли, с тенденцией к повышению эхоплотности. Соотношение долей, индекс 1 сегмента, плотность стенок сосудов и желчных протоков мало изменялись, в отличие от УЗИ-картины при врожденных гепатитах В и С. При серологическом исследовании у детей в возрасте до трех месяцев во всех случаях обнаружены антитела anti-CMV класса IgG, в 49,2% (31 человек) обнаружены также anti-CMV класса IgM. При обследовании детей старше трех месяцев более регулярно обнаруживали антитела класса IgG, с нарастанием титра в парных сыворотках.
У 76,2% (48 больных) проведено исследование крови и/или слюны и мочи методом ПЦР, у 31 из них (64,6%) обнаружена DNA CMV. У 39 детей (61,9%) — снижение количества эритроцитов и гемоглобина до уровня легкой и среднетяжелой степени анемии.
Все дети находились под наблюдением невропатолога. Диагностированы: синдром задержки психомоторного развития —у 47 (74,6%), гипертензионно-гидроцефальный синдром — у 27 (42,8%), синдром двигательных нарушений — у 23 (36,5 %). При НСГ отмечалось повышение эхогенности паренхимы мозга, ее неоднородность и зернистость, субэпиндимальные кисты и/или кисты сосудистых сплетений, периваскулярная инфильтрация, проявления смешанной или наружной гидроцефалии. Отличительной особенностью неврологических проявлений цитомегаловирусной инфекции являлась их резистентность к традиционной терапии (сосудистые, ноотропные, витаминные препараты).
Цитомегаловирусная инфекция (ЦМВИ) у новорожденных и детей первых месяцев жизни может протекать в различных клинических формах, требующих дифференцированной терапии. Представлены особенности двух различных вариантов течения ЦМВИ — генерализованной с манифестной клинической картиной и характерными сдвигами в лабораторных анализах у ребенка в возрасте 2,5 мес с сочетанной генетической патологией и латентной внутриутробной у ребенка в возрасте 5 дней, приведшей к развитию нейросенсорной тугоухости. Освещены трудности диагностики стертой (латентной) формы болезни и выбора тактики лечения пациента. Представлен успешный результат этиопатогенетической терапии препаратом ганцикловира у ребенка с постнатальной генерализованной ЦМВИ.
Цитомегаловирусная инфекция (ЦМВИ) широко распространена в популяции. Это одна из наиболее частых из диагностируемых внутриутробных инфекций: протективные антитела к вирусу ЦМВИ обнаруживаются у 80% населения старше 35 лет, что свидетельствует о перенесенной подавляющим большинством латентной (бессимптомной) форме этой инфекции. По другим данным, удельный вес серопозитивных матерей (имеющих протективные антитела) среди социально незащищенных слоев населения достигает 100%.
Тяжелые генерализованные формы ЦМВИ отмечаются только у иммунокомпрометированных пациентов (новорожденные при внутриутробном трансплацентарном заражении, дети первых месяцев жизни, пациенты, получающие иммунодепрессанты).
Не исключается интранатальное инфицирование (наличие вируса в вагинальном секрете). При постнатальном инфицировании возможны контактный или алиментарный (в т.ч. с материнским молоком) пути передачи. Недостаточная настороженность врачей в отношении повышенного риска постнатального инфицирования пациентов неонатальных стационаров может свести на нет усилия по выхаживанию тяжело больных детей. Так, описаны случаи тяжелой ЦМВИ с высоким риском летального исхода у недоношенных новорожденных при постнатальном инфицировании через нативное материнское молоко. Вирус может длительно выделяться с мочой, калом, слюной;
Даже в настоящее время, когда контроль доноров достаточно строгий, допускается возможность передачи ЦМВ при гемотрансфузиях через инфицированные препараты крови. В этой связи к группе пациентов высокого риска тяжелых — генерализованных — форм ЦМВИ наряду с глубоко недоношенными детьми (не получившими протективных антител из-за преждевременного рождения) относятся младенцы с недостаточностью иммунной защиты и дети, перенесшие трансфузии и/или хирургические вмешательства.
В последние годы все чаще у младенцев, умерших от различных причин, при гистологическом исследовании выявляют неустановленную при жизни ЦМВИ. В связи с этим обсуждаются проблемы негативного влияния латентной инфекции на онтогенез многих функциональных систем. Вместе с тем диагностика латентных форм инфекции у новорожденных объективно затруднительна, и часто диагноз устанавливается ретроспективно — при выявлении нарушений слуха или когнитивной недостаточности.
Наряду с диагностическими трудностями при стертых (маломанифестных) формах ЦМВИ у младенцев существуют также разногласия по проблеме этиопатогенетического лечения, причем как в отношении манифестных, так и бессимптомных форм болезни.
Так, в отечественных руководствах протокол терапии манифестных форм ЦМВИ включает препараты:
- Ганцикловира, применяемые у детей до 12 лет по показаниям off-label,
- Противоцитомегаловирусный иммуноглобулин,
- Иммуноглобулин человека нормальный [IgG + IgM + IgA] и
- Препарат интерферон альфа-2b человеческий рекомбинантный.
Применять перечисленные препараты при латентных формах ЦМВИ не рекомендуется.
В то же время проект новых клинических рекомендаций Российской ассоциации специалистов перинатальной медицины включает применение при манифестной форме только Ганцикловира (Валганцикловира) и Противоцитомегаловирусного иммуноглобулина.
В отношении противоцитомегаловирусного иммуноглобулина считается подтвержденной лишь его профилактическая эффективность при антенатальном использовании у беременных женщин.
В данной статье представлен анализ типичной клинической ситуации, вызванной затруднениями в диагностике манифестной и стертой формы ЦМВИ у младенцев первых месяцев жизни, в разграничении внутриутробной и постнатальной инфекции, а также в выборе методов и продолжительности лечения с учетом многочисленных побочных действий препаратов ганцикловира и возможной терапевтической эффективности специфического противоцитомегаловирусного иммуноглобулина.
Это важно, как для образовательных целей, так и для обсуждения альтернативных вариантов терапии, особенно при латентных формах болезни.
КЛИНИЧЕСКИЕ ПРИМЕРЫ
В практике выхаживания младенцев с сочетанной перинатальной патологией нередки ситуации, при которых затруднительно дифференцировать внутриутробное и постнатальное инфицирование ЦМВИ. В качестве примера представляем две истории болезни детей, находившихся на стационарном лечении.
Тяжелое (генерализованное) течение ЦМВИ.
Исследования на вирусные инфекции, в т.ч. ЦМВИ, в этом периоде не проводились.
Иммуноферментный анализ выявил анти-ЦМВ иммуноглобулина (Ig) G в титре 59 ЕД/мл (при норме
На основании клинико-лабораторных данных установлен диагноз: «Острая генерализованная цитомегаловирусная инфекция (гепатит, интерстициальная пневмония с дыхательной недостаточностью II степени).
После получения разрешения локального независимого этического комитета на использование по жизненным показаниям препарата ганцикловира off-label и оформления матерью информированного согласия на лечение ребенка этим препаратом проведено этиотропное и патогенетическое лечение:
Курс Ганцикловира из расчета 6 мг/кг массы тела 2 раза/сут внутривенно в течение 2 нед, далее по 10 мг/кг 1 раз через сутки на 3 мес;
Курс противоцитомегаловирусного иммуноглобулина — 1 мл/кг каждые 48 ч внутривенно, всего на курс 5 инъекций; кроме того, была продолжена антибактериальная и симптоматическая терапия. На фоне комплексного лечения удалось добиться существенного улучшения состояния ребенка: уменьшились проявления системной воспалительной реакции и гепатоспленомегалии; стало возможным начало энтерального питания; уменьшились проявления буллезного эпидермолиза. Нарос уровень тромбоцитов, результаты определения ДНК ЦМВ методом ПЦР отрицательные, что позволило в возрасте 3,5 мес выполнить хирургическую коррекцию: проведены релапаротомия, разделение спаек, наложение еюностомы. Учитывая отсутствие явных клинических признаков ЦМВИ (в т.ч. тромбоцитопении, гепатоспленомегалии) на первом месяце жизни ребенка и их появление в начале третьего месяца жизни в сочетании с результатами лабораторной диагностики (выявление ДНК ЦМВ в возрасте 3 мес, нарастание титра острого маркера специфического воспаления —анти-ЦМВ IgG) на четвертом месяце жизни, наиболее вероятно предположить постнатальное инфицирование и бурное развитие генерализованной ЦМВ-инфекции у иммунокомпрометированного младенца с генетической патологией; однако, нельзя полностью исключить и отсроченную постнатальную генерализацию латентной в/утробной ЦМВИ.
Латентное течение внутриутробной ЦМВИ
Мальчик С., 5 дней, родился у женщины 25 лет,имевшей до беременности эрозию шейки матки. Беременность первая, с угрозой прерывания в первом триместре, тяжелым гестозом, анемией. Однократно (во втором триместре) перенесла острую респираторную инфекцию. При ультразвуковом исследовании заподозрена добавочная верхняя полая вена у плода (впоследствии не подтвердилось). Обследование женщины на оппортунистические инфекции не проводилось. Роды на 37-й нед с ранним излитием околоплодных вод; масса при рождении 3110 г, длина 52 см, оценка по шкале APGAR 8/9 баллов. В раннем неонатальном периоде состояние мальчика средней тяжести за счет общего угнетения: преобладала мышечная гипотония, снижение безусловно-рефлекторной активности. При ультразвуковом исследовании выявлено левостороннее внутрижелудочковое кровоизлияние I–II степени; отмечались единичные петехии на лице, экхимоз в затылочной области.
Проведен курс лечения противоцитомегаловирусным иммуноглобулином: 3 внутривенных введения из расчета 1 мл/кг каждые 48 ч внутривенно.
Ребенок повторно дважды госпитализировался —в возрасте 2 и 4 мес. На протяжении этого времени у него сохранялась умеренная задержка моторного развития; изменения боковых желудочков мозга по данным нейросонограммы имели тенденцию к уменьшению.
Результаты динамического исследования ПЦР в моче и крови: ДНК ЦМВ не обнаружена. В возрасте 2 мес выполнено исследование коротколатентных слуховых вызванных потенциалов: при интенсивности стимуляции70–80 дБ основные пики слева и справа не определяются, при 90–105 дБ — низкоамплитудные пики определяются неотчетливо. Латентности III и V пиков с двух сторон превышают референсный интервал.
Заключение по результатам исследования коротколатентных слуховых вызванных потенциалов: выраженное нарушение проведения по слуховым структурам ствола мозга — двусторонняя нейросенсорная тугоухость. Проводилась комплексная реабилитация — музыкально-сенсорная стимуляция, механотерапия, сухая иммерсия, кинезитерапия (лечебная физкультура, массаж). Ребенок направлен в сурдологический центр.
Ребенку даны рекомендации: бинауральное протезирование цифровыми многоканальными супермощными слуховыми аппаратами; изготовление индивидуальных ушных вкладышей; консультация сурдопедагога, оценка эффективности настройки слуховых аппаратов (определение показаний к проведению кохлеарной имплантации). Исходя из сроков манифестации поражения слуха, можно предположить, что ребенок был внутриутробно инфицирован ЦМВ, и внутриутробный инфекционный процесс привел к развитию нейросенсорной тугоухости с поражением центральной нервной системы легкой степени и неонатальной тромбоцитопенией.
Прогноз: ребенок нуждается в наблюдении сурдолога и коррекции нарушения слуха, а также в этапной реабилитации в связи с задержкой темпов психомоторного развития.
ОБСУЖДЕНИЕ
В первом из представленных клинических примеров у ребенка с манифестными клиническими проявлениями инфекции наиболее вероятно предположить постнатальную ЦМВИ, поскольку уже на третьем месяце жизни обнаружен острофазный маркер воспаления (анти-ЦМВ IgM) в сочетании с вирусом, выделенным из крови при помощи метода ПЦР. Вместе с тем не исключаются и внутриутробное инфицирование, и отсроченная манифестация на фоне тяжелой сочетанной врожденной (генетической) патологии. Возможно, симптомы бактериальной инфекции (энтероколита) на фоне непроходимости кишечника маскировали характерные проявления врожденной ЦМВИ
- увеличение паренхиматозных органов;
- интоксикацию;
- проявления интерстициальной пневмонии;
С другой стороны, постнатальное инфицирование ЦМВ у ребенка, находившегося длительное время в критическом состоянии, могло произойти либо при контакте с вирусоносителями, либо в стационаре, либо при переливаниях препаратов крови и плазмы. Обследование на специфические внутриутробные инфекции на первом месяце у ребенка не проводилось. Следует отметить, что на фоне этиотропной терапии у младенца не только купировались клинические проявления ЦМВИ (тромбоцитопения, гепатоцитолиз, гепатоспленомегалия, желтуха), но и отмечено явное улучшение состояния кожи и функции желудочно-кишечного тракта. Отрицательные результаты ПЦР на ДНК цитомегаловируса после курса лечения, по мнению некоторых специалистов, являются показателем успешности терапии.
Во втором наблюдении инфицирование у ребенка произошло внутриутробно; инфекционный процесс носил характер латентного или маломанифестного (умеренная желтуха, некоторая тенденция к гипокоагуляции, признаки внутриутробного поражения центральной нервной системы), однако реализовался в нейросенсорных нарушениях слуха, которые не имели тенденции к уменьшению после курса специфической иммунотропной терапии. Тем не менее отрицательные результаты ПЦР в динамике стали основанием для отказа в данной ситуации от терапии ганцикловиром. Известно, что у детей, перенесших генерализованную врожденную ЦМВИ, почти в 50% случаев отмечаются грубые нарушения слуха и психомоторного развития; при латентной форме врожденной ЦМВИ риск поражения слуха существенно ниже — около 7%. Чаще нарушения слуха выявляются уже за пределами периода новорожденности: они могут прогрессировать, периодически уменьшаться или сочетаться с вестибулярными нарушениями. Надежных критериев прогноза развития отдаленных нарушений слуха у детей как при манифестной и тяжелой, так и при латентной ЦМВИ пока не существует. Тем не менее некоторые авторы указывают, что более низкие уровни виремии, определяемые при ПЦР крови, сопряжены с лучшим прогнозом для развития слуха. Так, при обследовании детей в возрасте 6 лет, перенесших латентную врожденную ЦМВИ, установлено, что нейросенсорная тугоухость чаще развивалась у тех из них, у которых при рождении уровень виремии был17 тыс. копий/мл. Проблема этиотропной терапии новорожденных с латентным (бессимптомным) течением ЦМВИ остается дискуссионной. Большинством отечественных и зарубежных исследователей применение ротивовирусных препаратов при этих формах заболевания не рекомендуется. В то же время указывается, что длительная терапия врожденной латентной ЦМВИ с использованием антивирусных препаратов снижает частоту нарушений слуха. В этой связи высказываются предположения по изменению общепринятых подходов в терапии бессимптомных форм инфекции, хотя бы в отношении новорожденных с выявленными при скрининге нарушениями слуха в сочетании с обнаружением ЦМВ методом ПЦР, при этом имеется в виду терапия валганцикловиром.
Таким образом, вопросы лечения младенцев с латентными формами ЦМВИ требуют дальнейшего обсуждения.
В плане профилактики врожденной ЦМВИ заслуживают внимания работы по антенатальному использованию противоцитомегаловирусного иммуноглобулина. Этот препарат применяют курсами в виде внутривенных введений беременным; в последние годы практикуется так-же интраамниотическое введение и введение в сосуды пуповины плода при подтвержденной ЦМВИ. Такая профилактика хорошо переносится внутриутробным ребенком и снижает риск трансплацентарной передачи инфекции.
ЗАКЛЮЧЕНИЕ
Первый из представленных примеров продемонстрировал затруднения при постановке диагноза (внутриутробной или ранней постнальной ЦМВИ) и успешность сочетанной терапии; в то же время вторая история болезни (ребенок с латентной формой ЦМВИ) показала недостаточную эффективность одной лишь иммунозаместительной терапии (как это рекомендовано проектом Российской ассоциации специалистов перинатальной медицины). Возможно, необходима дискуссия об использовании Валганцикловира при высоком риске развития тугоухости вследствие латентной ЦМВИ.
В зарубежных странах принято относить противоцитомегаловирусный иммуноглобулин к средствам специфической профилактики ЦМВИ, но не к средствам терапии уже развившейся инфекции. Следует отметить, что строго доказательных исследований терапевтической эффективности противоцитомегаловирусного иммуноглобулина у детей раннего возраста с ЦМВИ пока нет, тем не менее проект клинических рекомендаций по лечению врожденной ЦМВИ предусматривает лечебное применение противоцитомегаловирусного иммуноглобулина как при манифестных, так и при латентных формах ЦМВИ.
Успешный зарубежный опыт пренатального применения (по сути, лечение внутриутробного ребенка) позволяет предположить, что и постнатально этот препарат может быть использован с лечебной целью при подтвержденной методом полимеразной цепной реакции или иммуноферментным анализом манифестной форме, а так-же при латентной форме инфекции, в первую очередьу новорожденных с выявленными путем аудиоскрининга нарушениями слуха.
Читайте также:

