Цитомегаловирус после трансплантации почки
Обновлено: 23.04.2024
ПЦР — полимеразная цепная реакция
АГУС — атипичный гемолитико-уремический синдром
ТМА — тромботическая микроангиопатия
МАГА — микроангиопатическая гемолитическая анемия
ОПП — острое повреждение почек
СКр — креатинин сыворотки крови
НС — нефротический синдром
АД — артериальное давление
АГ — артериальная гипертония
ТТП — тромбоцитопеническая пурпура
БПГН — быстропрогрессирующий гломерулонефрит
ГБМ — гломерулярная базальная мембрана
Цитомегаловирус (ЦМВ) — важный патоген у реципиентов трансплантированных органов. Некоторые рандомизированные исследования показали, что антивирусная профилактика значительно уменьшает частоту развития ЦМВ-инфекций (ЦМВИ) и заболеваний [1—9]. Общепризнано, что наличие ЦМВИ повышает риск отторжения, а также увеличивает летальность и, следовательно, ухудшает результаты пересадки почек. В следствие этого в повседневной практике многих центрах трансплантации назначают антивирусные препараты всем пациентам из группы повышенного риска (ЦМВ-серопозитивные реципиенты или ЦМВ-серонегативные реципиенты, получившие трансплантат от ЦМВ-серопозитивных доноров). Мы назначаем антивирусные препараты всем ЦМВ-серопозитивным реципиентам и ЦМВ-серонегативным, реципиентам, получившим трансплантат от ЦМВ-серопозитивного донора. Обычно достаточно провести 2—3-недельный курс валганцикловира (вальцит), чтобы добиться элиминации вируса, о чем судят по отрицательным результатам определения ЦМВ с помощью полимеразной цепной реакции (ПЦР). Однако встречаются реципиенты, резистентные к указанному препарату и виремия ЦМВ сохраняется у них довольно продолжительное время. В связи с этим мы решили проанализировать группу из 17 резистентных к валганцикловиру больных, чтобы выяснить, каким образом данная ситуация влияет у них на результаты пересадки почек от живого родственного донора.
Материалы и методы
С апреля 2004 г. по июль 2013 г. в отделении трансплантации почки ФГБНУ РНЦХ им. акад. Б.В. Петровского выполнены 272 пересадки почки от живого родственного донора у 127 детей и 145 взрослых в возрасте от 1 года до 63 лет.
В основную группу вошли 17 (7,27%) пациентов (возраст от 3 лет до 51 года; 10 мужчин и 7 женщин, 8 детей и 9 взрослых), у которых развилась резистентная ЦМВИ. Для сравнительного анализа сформирована контрольная группа из 113 (возраст от 1 до 61 года; 61 мужчина и 52 женщины, 40 детей и 73 взрослых), у которых ЦМВ-ПЦР всегда была отрицательной, т. е. отсутствовала ДНК ЦМВ. Демографическая структура больных контрольной и основной групп больных практически идентична.
При статистической обработке полученных данных использована оценка кумулятивной выживаемости по Каплану—Мейеру, кумулятивного риска по Вилкоксону. Кроме того, высчитывали процент потерь трансплантатов и процент летальных исходов.
Результаты
Эпизоды резистентной к валганцикловиру ЦМВИ наблюдалась у 17 (7,27%) из 272 реципиентов в сроки от 0,20 до 127,7 мес (в среднем 29,8±43,7 мес) после пересадки почек. Ранние эпизоды ЦМВИ отмечены у 8 реципиентов через 0,2—3,21 мес после трансплантации (в среднем 1,9±1,1 мес). У 9 реципиентов эпизоды ЦМВИ наблюдались в отдаленные сроки после операции — 10,5—127,7 мес (в среднем 63,3±44,7 мес).
У детей длительность виремии составила 104,6±61,4 дня, у взрослых — 99,2±23,4 дня (критерий Стьюдента t=0,25; p=0,805). Следовательно, возраст больного не влияет на продолжительность эпизода ЦМВИ. Продолжительность ранних эпизодов ЦМВИ достигала 86,5±23,31 дня, поздних эпизодов — 115,3±54,3 дня. На первый взгляд создается впечатление, что чем больше срок после пересадки, тем продолжительнее эпизоды ЦМВИ. Однако, как показал статистический анализ с использованием критерия Стьюдента, эти различия статистически незначимы (критерий Стьюдента t=1,32; p=0,207). Следовательно, срок после пересадки почки также не влияет на продолжительность эпизода ЦМВИ.
У женщин эпизоды ЦМВИ оказались короче, чем у мужчин (95,6±34,9 и 108,0±50,7 дня соответственно), но различия статистически незначимы (t=0,469; p=0,645). Следовательно, пол также не влияет на продолжительность эпизодов ЦМВИ.
Терапия этих эпизодов ЦМВИ осуществлялась с помощью валганцикловира для перорального применения. У 13 больных доза препарата составляла 450 мг/сут, у 3 ограничились его введением в дозе 225 мг/сут, поскольку у них была снижена функция трансплантированных почек. Одной пациентке 16 лет вынуждены были увеличить дозу валганцикловира до 900 мг/сут, поскольку упорно сохранялся высокий титр ЦМВ. У всех пациентов удалось добиться отсутствия ДНК ЦМВ в крови, что свидетельствовало об успешном подавлении ЦМВИ.
В контрольной группе умерли 4 (3,54%) больных из 113 и потеряны 6 (5,31%) аллогенных почек из 113. В группе больных с ЦМВИ летальные исходы отсутствовали (100% кумулятивная выживаемость реципиентов) и потерян один трансплантат в группе взрослых больных через 18 мес после трансплантации почки; 3-летняя кумулятивная выживаемость трансплантатов составила 94,11%. Причина потери трансплантата — острое отторжение на фоне фибропластических изменений. В группе детей не потеряно ни одного трансплантата (100% кумулятивная выживаемость реципиентов с функционирующими трансплантатами). Результаты вычисления кумулятивной выживаемости по Каплану—Мейеру представлены на рис. 1. При этом различия по данному показателю (t=0,2661; р=0,7912), а также по степени кумулятивного риска (рис. 2) статистически незначимы.

Рис. 1. Кумулятивная выживаемость пациентов в исследуемой группе и контрольной группе.

Рис. 2. Степень кумулятивного риска в исследуемой и контрольной группах.
Согласно сложившемуся мнению ЦМВИ обязательно сопровождается увеличением летальности реципиентов трансплантированных органов, повышением частоты эпизодов отторжения, сопровождающихся потерей аллопочек [10—13]. Однако, как показал анализ нашего клинического материла (17 резистентных к валганцикловиру пациентов), это не всегда справедливо. Из 17 резистентных к валганцикловиру пациентов не умер ни один, а потерян один трансплантат у пациента 21 года.
Таким образом, анализ нашего клинического материала показал, что вопреки всеобщему мнению о неизбежном увеличении частоты потери трансплантированных почек и летальных исходов при ЦМВИ мы не наблюдали подобного явления.
В группе ЦМВ-серонегативных реципиентов процент потерь трансплантатов был практически таким же, как и в основной группе, — не было ни одного летального исхода.
Заключение
Преодоление резистентной ЦМВИ достигается увеличением длительности применения валганцикловира или повышением его дозы.
Осложнения трансплантации почек. Последствия иммуносупрессии
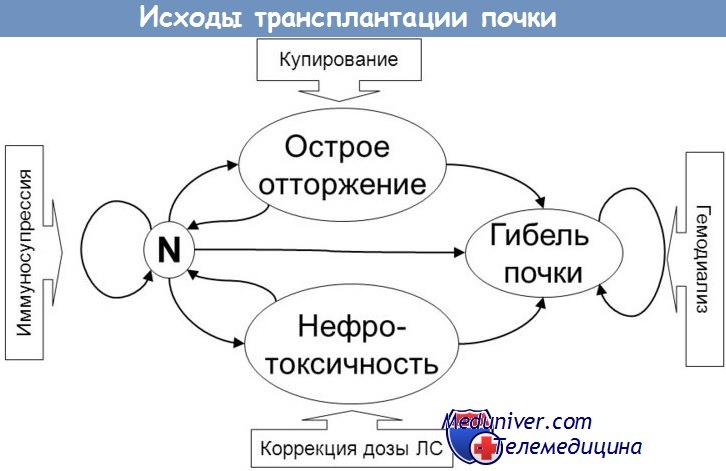
Самой частой причиной смерти в течение первого года после трансплантации является инфекция, особенно цитомегаловирусная. Определение титра антицитомегаловирусных антител должно входить в обязательную программу обследования донора и реципиента. ЦМВ-инфекция может быть как первичной (т. е. передаваться реципиенту с трансплантированной почкой или компонентами крови), так и связанной с реактивацией вируса у реципиента с положительными результатами серологических проб вследствие иммуносупрессивной терапии. В последнем случае заболевание проявляется через 1-3 мес. После трансплантации.
Иммуносупрессия остается необходимым условием трансплантации. К сожалению, применение иммунодепрессантов может вызывать репликацию вируса Эпштейна-Барр с развитием потенциально смертельного посттрансплантационного лимфопролиферативного заболевания в 1-2 % случаев. В 2001 г. в Северной Америке это наблюдалось у 121 из 7545 детей, которым с 1987 по 2000 г. проводилась трансплантация почки (1,7 %). Однако обследование на ВИЧ-инфекцию не проводилось. По данным одного французского центра, посттрансплантационное лимфопролиферативное заболевание наблюдалось у 16 из 1420 взрослых больных, не инфицированных ВИЧ (1,1 %; средний возраст — 45,5 года (27-64 лет)). Лимфопролиферативный процесс у маленьких детей в течение первого года после трансплантации остается основной причиной тяжелой заболеваемости и смертности.
Его необходимо диагностировать по возможности раньше, обращая пристальное внимание на лихорадку, лимфаденопатию, симптомы со стороны ЖКТ (объемные образования в животе, кровотечения, боль, непроходимость, перфорация, асцит), судороги и другие нарушения ЦНС, а также бессимптомные объемные образования в грудной клетке и средостении у перенесших трансплантацию больных. Помимо клинического обследования требуются биопсия тканей и все возможные лабораторные исследования: определение РНК вируса Эпштейна-Барр и ЦМВ в крови (с помощью ПЦР и саузерн-блоттинга), а также определение скрытой экспрессии мембранного белка 1 на парафиновых или замороженных тканевых срезах.
Лимфопролиферативное заболевание, возникшее менее чем через 1 год после трансплантации, обычно имеет более благоприятный прогноз и при снижении доз или отмене иммунодепрессантов может регрессировать. Из упомянутых выше 16 больных с тяжелым лимфопролиферативным заболеванием в поздние сроки после трансплантации 11 получали полную химиотерапию (протокол CHOP: циклофосфамид, доксорубицин, винкристин и преднизолон), у 6 пациентов наблюдалась полная и постоянная ремиссия. Лечение по этому протоколу не оказывало нефротоксического действия, и в тех случаях, когда после противоопухолевой терапии приходилось кратковременно снижать дозы или отменять иммунодепрессанты, реакция отторжения трансплантата не развивалась.
Улучшение прогноза для ВИЧ-инфицированных больных (в результате создания средств эффективной специфической терапии) позволяет рассматривать возможность трансплантации почки и им. Однако это требует соблюдение определенных условий. В течение 2 лет до трансплантации у ВИЧ-инфицированного больного не должно быть никаких оппортунистических инфеккций, его состояние должно быть стабильным, и должен хорошо переносить специфическую терапию. Обязательные условия включают также строгое соблюдение врачебных рекомендаций, отсутствие вирусной РНК в крови, достаточное колиство СD4-лимфоцитов и отсутствие осложнений.
Возобновление патологии клубочков в трансплантированной почке. В трансплантате возможны любые рекуррентные гломерулопатии, и в 5-10 % случаев потеря аллотранплантатов происходит именно по этой причине, наиболее часто, по-видимому, возобновляется фокально-сегментарный гломерулосклероз — с трудом поддающееся лечению заболевание, механизм развития которого остается неизвестным.
Гемолитико-уремический синдром (ГУС) не возобновляется, но может быть возникать de novo. В 1-3 % случаев его причиной является семейный вариант неинфекционного ГУС (вероято, наследственный), в остальных — использование ингибиторов кальциневрина (циклоспорина и др.). Однако зто более характерно для транспланции костного мозга, чем почки. Факторами риска неинфекционного ГУС после трансплантации почки является семейное заболевание (аутосомно-доминантное или рецессивное наследование), проведение трансплантации ранее 0,5-1 года после полной ремиссии заболевания у реципиента и использование циклоспорина (если этот синдром развился при предыдущей трансплантации, то рекомендуется применять лишь низкие дозы циклоспорина).
Известны также случаи de novo развития этого синдрома после трансплантации почки от живых родственников с семейным нарушением синтеза простациклина, после приема оральных контрацептивов и при посттрансплантационном лечении антилимфоцитарным иммуноглобулином.
Инфекции после трансплантации почки ребенку
Инфекции остаются важнейшей причиной заболеваемости и смертности у больных с пересаженными почками.
1. Бактериальные инфекции после трансплантации почки. Чаще всего встречаются пневмония и инфекции мочевых путей. Последние могут быстро переходить в уросепсис и иногда бывают ошибочно приняты за острое отторжение трансплантата.
2. Вирусные инфекции после трансплантации почки. Особую опасность представляют герпесвирусы (цитомегаловирус, вирус простого герпеса, вирус varicella-zoster и вирус Эпштейна—Барр). У детей младшего возраста первый контакт с этими вирусами часто бывает уже после трансплантации почки, и тогда первичная инфекция на фоне иммунодепрессантов может протекать у них очень тяжело.
Частота этих заболеваний существенно возрастает после лечения антилимфоцитарными препаратами или пульс-терапии большими дозами глюкокортикоидов. В таких случаях показана профилактика герпесвирусных инфекций.
а) Цитомегаловирус. Цитомегаловирусная инфекция может протекать в виде носительства (вирус персистирует в лимфоидной ткани). Серологические пробы на цитомегаловирус положительны приблизительно у 30% детей старше 5 лет и у 60% подростков. Следовательно, чем младше ребенок, тем выше риск первичной цитомегаловирусной инфекции при трансплантации почки от инфицированного донора.
Она может проявляться лихорадкой, лейкопенией, тромбоцитопенией, пневмонией, язвами ЖКТ, гепатитом, гломерулопатией и почечной недостаточностью, острым отторжением трансплантата и подавлением иммунитета. Установлена связь между цитомегаловирусной инфекцией и хроническим отторжением при трансплантации любых органов. Для лечения и профилактики применяют иммуноглобулин против цитомегаловируса, нормальный иммуноглобулин для в/в введения в высоких дозах и противовирусные препараты — ацикловир, валацикловир, ганцикловир и валганцикловир.
Профилактическое лечение ганцикловиром показано серонегативным реципиентам почки от серопозитивного донора.
б) Вирус varicella-zoster. У детей старшего возраста, перенесших трансплантацию почки, вирус varicella-zoster чаще всего вызывает опоясывающий лишай — локальные пузырьковые высыпания в пределах одного дерматома. У детей младшего возраста возможна быстропрогрессирующая тяжелейшая инфекция с энцефалитом, пневмонией, печеночной недостаточностью, панкреатитом и ДВС-синдромом.
Серонегативным детям в течение 72 ч с момента случайного контакта с больным необходимо ввести иммуноглобулин против вируса varicella-zoster, в 75% случаев это существенно облегчает протекание инфекции. До трансплантации ребенка следует вакцинировать против вируса varicella-zoster. При появлении ветряночной сыпи у ребенка с пересаженной почкой необходимо немедленно ввести ацикловир парентерально. Опоясывающий лишай менее склонен к диссеминации, но ацикловир все же показан.
в) Вирус Эпштейна—Барр. Примерно 50% детей серонегативны в отношении вируса Эпштейна— Барр, и приблизительно 75% из них после трансплантации почки инфицируются. Инфекция вирусом Эпштейна—Барр даже на фоне иммунодепрессантов в большинстве случаев протекает бессимптомно. В то же время у 0,5—2% детей после трансплантации почки возникает лимфопролиферативный синдром, часто обусловленный инфекцией вирусом Эпштейна—Барр на фоне интенсивной иммуносупрессивной терапии.
Он может проявляться лихорадкой, потерей веса, гепатоспленомегалией, поносом, увеличением лимфоузлов, а при поражении ЦНС — неврологической симптоматикой. Лечение включает резкое снижение доз иммунодепрессантов, а при наличии очагов высокой степени злокачественности — химиотерапию и антилимфоцитарные средства.
г) Вирус простого герпеса. Типичные герпетические изъязвления около рта при применении иммунодепрессантов встречаются часто и обычно излечиваются при приеме ацикловира внутрь.
3. Пневмоцистная пневмония после трансплантации почки. Для профилактики пневмоцистной пневмонии после трансплантации показан 3—6-месячный курс триметоприма/сульфаметоксазола.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Цитомегаловирусная инфекция (ЦМВ-инфекция) у гематологических больных
Среди вирусных инфекций, поражающих больных с нарушениями иммунитета, герпетическим вирусам принадлежит особая роль. С одной стороны, вирусы этой группы часто вызывают тяжелые органные поражения, напрямую угрожающие жизни больного, а с другой — разработанные методы вирусологического мониторинга, профилактической и упреждающей терапии позволяют свести этот риск к минимуму.
В статьях на нашем сайте рассмотрены особенности эпидемиологии и клинической картины инфекций, вызываемых лишь несколькими герпес-вирусами, наиболее часто встречающихся у гематоонкологических больных, а также изложены рациональные подходы к диагностике и лечению этих заболеваний.
Цитомегаловирус (ЦМВ) — один из самых частых вирусных спутников человека. В развитых странах 50—80 % населения в возрасте до 50 лет переносят инаппарантную инфекцию и являются серопозитивными по ЦМВ, в то время как в странах с низким или средним социально-экономическим развитием практически 100 % населения к 30 годам являются серопозитивными. Такая же закономерность наблюдается в различных в отношении материальной обеспеченности слоях населения: при высоком материальном достатке и часто соответствующем ему более высоком культурном уровне средний возраст первичной ЦМВ-контаминации, регистрируемой по сероконверсии, значительно выше, чем при среднем и низком достатке.
Причина этого феномена кроется, по всей вероятности, в менее строгих гигиенических правилах и традициях (например, облизывание матерями детских сосок, пользование одной и той же посудой и столовыми приборами и т. д.).

Главными эффекторами антицитомегаловирусного иммунитета являются вирусспецифические цитотоксические лимфоциты, в то время как все типы антител в лучшем случае играют вспомогательную роль. Отсюда очевидно, что наиболее уязвимой группой в отношении развития тяжелой первичной инфекции или клинически значимой реактивации являются больные с врожденным либо приобретенным (в том числе ятрогенным) дефицитом клеточного иммунитета.
Кроме факта наличия клеточного иммунодефицита, важный фактор риска — его длительность. Классической демонстрацией данного положения является различие в частоте реактивации ЦМВ и развития ЦМВ-синдрома и ЦМВ-пневмонии у реципиентов при трансплантации аллогенного и аутологичного костного мозга. При одинаковой исходной степени иммуносупрессии, но несоизмеримо более короткой ее продолжительности ЦМВ-пневмония, которая развивалась у 30—40 % реципиентов после аллогенной трансплантации костного мозга (ТКМ) до разработки упреждающего или профилактического лечения ганцикловиром, является казуистикой (не более 0,5 %) после аутологичной трансплантации.
Группы риска в отношении развития тяжелой ЦМВ-инфекции:
1) перинатально инфицированные новорожденные (особенно недоношенные);
2) дети с тяжелыми комбинированными врожденными иммунодефицитами;
3) больные СПИДом;
4) реципиенты аллогенной трансплантации гемо-поэтических стволовых клеток;
5) реципиенты солидных органов.
В отношении больных, которым проводят стандартную химиотерапию по поводу лейкозов, лимфом или солидных опухолей, статистики, оценивающей частоту развития ЦМВ-ассоциированных клинических синдромов, не существует, хотя описаны как отдельные случаи, так и небольшие серии тяжелых проявлений ЦМВ-инфекции в данных группах.
Справедливо считать, что развитие клинически значимых симптомов ЦМВ-инфекции теоретически возможно у любого больного после цитотоксической иммуносупрессивной терапии, однако большинство таких больных составляют реципиенты аллогенной ТКМ. Наличие современных специфичных и чувствительных методов быстрой диагностики делают абсолютно неприемлемой эмпирическую терапию не только потому, что такое лечение достаточно дорого и токсично, но и потому, что цена ошибки и соответственно неадекватного лечения при постановке диагноза только по клиническим симптомам слишком велика. Так, на основании клинической картины очень трудно отличить ЦМВ-пневмонию от пневмоцистоза или лучевого пневмонита, а затяжной ЦМВ-гепатит — от хронического гепатолиенального кандидоза.
Как отмечалось, подавляющее большинство взрослых больных и значительный процент детей в нашей стране ЦМВ-серопозитивны, поэтому наблюдать в гематологическом стационаре первичную ЦМВ-инфекцию приходится нечасто. Непосредственная передача ЦМВ от одного больного к другому маловероятна, если больные не вступают в контакт более близкий, чем это предписано больничным режимом. В зависимости от серологического статуса, степени и длительности иммуносупрессии проявления ЦМВ-инфекции у гематологических больных могут быть различными.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Х.С. ХАЕРТЫНОВ 1 , Ш.Р. ГАЛЕЕВ 2,3
1 Казанский государственный медицинский университет, 420012, г. Казань, ул. Бутлерова, д. 49
2 Казанская государственная медицинская академия, 420012, г. Казань, ул. Бутлерова, д. 36
3 Республиканская клиническая больница МЗ РТ, 420064, г. Казань, Оренбургский тракт, д. 138
В статье представлен обзор современной литературы посвященной проблеме влияния цитомеголовирусной инфекции на пациентов, перенесших трансплантацию солидных органов. В обзоре рассматриваются вопросы особенности течения патологического процесса у пациентов после трансплантации солидных органов, стратегии предотвращения развития цитомеголовирусной инфекции после трансплантации и получающих иммуносупрессивную терапию. Демонстрируется влияние цитомегаловирусной инфекции на выживаемость пациентов и трансплантатов.
Ключевые слова: трансплантация солидных органов, цитомегаловирус, инфекции, профилактика.
Kh.S. KHAERTYNOV 1 , Sh.R. GALEEV 2,3
¹Kazan State Medical University, 49 Butlerov Str., Kazan, Russian Federation, 420012
2 Kazan State Medical Academy, 36 Butlerov Str., Kazan, Russian Federation, 420012
3 Republican Clinical Hospital of the MH of RT, 138 Orenburgskiy Trakt, Kazan, Russian Federation, 420064
Role of cytomegalovirus infection in solid organs transplantation
The article reviews the modern literature on the problem of the influence of cytomegalovirus infection on patients after solid organs transplantation. The review discusses the issues of pathologies after solid organ transplantation, strategies to prevent cytomegalovirus infection after transplantation in patients receiving immunosuppressive therapy. It shows the effect of cytomegalovirus infection on the survival of patients and implants.
Key words: solid organs transplantation, cytomegalovirus, infection, prevention.
Среди инфекционных заболеваний, представляющих интерес для специалистов различных направлений медицины, важное место занимает цитомегаловирусная инфекция (ЦМВИ). ЦМВИ ― одна из самых распространенных и значимых оппортунистических заболеваний. Актуальность ее обусловливается, прежде всего, высоким риском развития манифестных форм заболевания на фоне состояний, сопровождающихся иммуносупрессией: у больных с ВИЧ-инфекцией, с онкогематологической патологией, у пациентов после трансплантации солидных органов. Одной из основных проблем трансплантологии являются инфекционные осложнения. При этом вирусы становятся причиной не менее 50% всех инфекций у реципиентов почечных аллографтов [1]. До 80% случаев вирусных заболеваний после трансплантации органов приходится на ЦМВИ [2]. В связи с ростом количества операций по пересадке различных органов актуальными являются вопросы профилактики ЦМВИ среди трансплантированных пациентов.
Этиология и эпидемиология
Возбудитель заболевания цитомегаловирус (ЦМВ) способен вызывать инфекционный процесс в различных органах и системах, что обуславливается тропностью вируса к эпителиальным клеткам слюнных желез, желчных путей, эндотелию сосудов, фибробластам, клеткам центральной нервной системы (ЦНС) ― астроцитам, нейронам, нейроглии, различным иммунокомпетентным клеткам ― моноцитам, лимфоцитам, дендритным клеткам [3]. Источником ЦМВИ является только человек, больной манифестной или бессимптомной формой, а также вирусоноситель. ЦМВ обнаруживается в различных биологических жидкостях инфицированного человека: крови, слюне, моче, ликворе, сперме, вагинальном секрете, носоглоточной слизи, амниотической жидкости, грудном молоке. Основные пути заражения при ЦМВИ: контактно-бытовой, алиментарный (при грудном вскармливании), половой, гемотрансфузионный, а также в результате трансплантации органов от инфицированных вирусом цитомегалии доноров.
Распространенность ЦМВИ среди населения значительно варьирует и зависит от географических, социально-экономических и гигиенических условий жизни людей, а также возрастных и расовых различий [4, 5]. Инфицированность цитомегаловирусом взрослого населения значительная, она колеблется от 40-60% (США, страны Западной Европы, Австралия) до 80-90% (Бразилия, Индия, Турция, Чили) [6].
На протяжении жизни человека выделяют два периода, характеризующихся высокой вероятностью развития первичной ЦМВИ. Во-первых, это возраст до пяти лет, когда отмечается высокая циркуляция ЦМВ в детских коллективах и преобладает оральный путь инфицирования. При этом от 15 до 70% детей после перенесенной первичной ЦМВИ продолжают выделять вирус со слюной и мочой на протяжении 6-48 месяцев, становясь естественным резервуаром ЦМВ. Второй период приходится на возраст от 16 до 40 лет с доминированием полового пути заражения.
Реактивация ЦМВИ ассоциируется с развитием иммуносупрессии, причиной которой может быть использование иммуносупрессивных препаратов у пациентов после трансплантации солидных органов. В качестве ко-факторов реактивации ЦМВИ могут выступать герпетические инфекции, обусловленные вирусами герпеса человека 6-го и 7-го типов [7].
У больных с трансплантированными органами выделяют три основных эпидемиологических варианта ЦМВИ [8]:
― первичная инфекция, развивающаяся у ЦМВ-серонегативных больных, получивших трансплантат от серопозитивных доноров ― D+R- (частота развития ЦМВИ составляет до 60%);
― реактивация латентного эндогенного вируса, когда донор серонегативен по ЦМВ, а реципиент серопозитивен ― D-R+ (частота ЦМВИ ― 10-15%);
― суперинфекция, когда и донор, и реципиент серопозитивны, а активный ЦМВ имеет донорское происхождение ― D+R+ (ЦМВИ развивается у 25-30% больных).
Клинические проявления
В большинстве случаев ЦМВИ протекает латентно, развитие клинических манифестных форм заболевания отмечается только в 10% случаев. При этом имеются различия в клинических проявлениях ЦМВИ у пациентов с иммуносупрессией и без нее.
ЦМВИ у пациентов без иммуносупрессии проявляется редко и, как правило, в виде развития мононуклеозоподобного синдрома, а у реципиентов трансплантатов солидных органов (ТСО) проявляется развитием ЦМВ-синдрома (гриппоподобные проявления, лейкопения и тромбоцитопения), либо инвазивных форм ― нефрита, гепатита, пневмонии, миокардита, панкреатита, соответственно трансплантируемому органу: почки, печени, легких, сердца или поджелудочной железы [12]. Следует отметить, что ЦМВИ у реципиентов ТСО не имеет специфических симптомов, поэтому чрезвычайно важную роль имеют специальные лабораторные методы диагностики, включающие обследование как доноров, так и реципиентов.
ЦМВИ у реципиентов ТСО может проявиться в срок до шести месяцев после операции, но чаще в период с 1-го по 3-й месяц, что связано с высоким уровнем лекарственной иммуносупрессии в этот период [2, 14]. Риск развития ЦМВИ в ранние сроки после трансплантации почки зависит от таких факторов, как серологический статус по ЦМВ у донора и реципиента до операции, наличие индукционной иммунодепрессии моно-, поликлональными антилимфоцитарными антителами, возраст реципиента, совместимость донора и реципиента по HLA, типа трансплантата [8, 12]. Наибольший риск развития ЦМВИ имеют ЦМВ-серонегативные пациенты, получившие трансплантат от серопозитивных доноров (D-R+). Высокий риск развития ЦМВИ имеют пациенты, которым была проведена трансплантация легких и тонкого кишечника, что может быть связано с большим количеством лимфоидных клеток в этих органах [13].
Диагностика ЦМВИ включает использование методов, направленных, с одной стороны, на регистрацию иммунного ответа в виде выработки антител к ЦМВ, с другой, на выявление ЦМВ либо его ДНК или антигена (в частности рр65) в крови, а также проведение гистологического исследования. Однако чувствительность и значение этих методов в диагностике ЦМВИ у реципиентов ТСО заметно отличаются. Серологическое исследование (ИФА) имеет большое значение в оценке факторов риска развития ЦМВИ в предтрансплантационном периоде и выбора стратегии профилактики ЦМВИ. С этой целью проводится определение серопозитивности доноров и реципиентов ТСО. Однако в посттрансплантационном периоде данный метод существенной роли не играет. Вирусологический метод диагностики ЦМВИ характеризуется высокой специфичностью, но невысокой чувствительностью, и для получения результатов данного метода исследования может потребоваться несколько недель.
Анализ антигенемии представляет собой полуколичественный метод, который направлен на обнаружение рр65 антигена ЦМВ на лейкоцитах периферической крови. Метод определения антигенемии имеет более высокую чувствительность, чем культуральный, и сравним с ПЦР. В зависимости от количества ЦМВ-инфицированных клеток можно оценить величину вирусной репликации. Анализ ЦМВ-антигенемии может быть использован для быстрой диагностики ЦМВ инфекции, а также для определения эффективности лечения. Однако определение ЦМВ-антигенемии имеет низкую чувствительность у пациентов с лейкопенией.
Для диагностики ЦМВИ у реципиентов ТСО предпочтительным является использование метода количественной ПЦР, которая позволяет дифференцировать активную форму ЦМВИ (ассоциируется с высокой вирусной нагрузкой) от латентной формы заболевания. Высокая вирусная нагрузка, как правило, отмечается при инвазивных формах ЦМВИ, при которых развиваются поражения различных органов. Низкая вирусная нагрузка характерна для бессимптомной ЦМВИ.
Гистологическое исследование используется для подтверждения тканевых инвазивных форм ЦМВИ. Основанием для проведения биопсии и гистологического исследования может быть подозрение на отторжение аллотрансплантата, ко-инфекция с возбудителями других инфекционных заболеваний и высокая вероятность развития ЦМВИ, несмотря на отсутствие вируса в крови.
Профилактика ЦМВИ у реципиентов ТСО
Существуют две стратегии предупреждения ЦМВИ [12, 13]:
- противовирусная профилактика;
- превентивная терапия.
Анти-ЦМВ иммуноглобулин для в/в применения. Этот препарат разрешен Управлением по контролю качества продуктов и лекарств США (FDA) для профилактики ЦМВ-инфекции у реципиентов трансплантатов солидных органов. Препарат содержит антитела, специфичные к ЦМВ, которые связываются с вирусом и нейтрализуют его (т.е. это лечение обеспечивает пассивный иммунитет). Однако механизм действия анти-ЦМВ иммуноглобулина сложен и, по-видимому, включает также другие иммуномодулирующие эффекты. Предложены механизмы антитело-зависимой клеточной цитотоксичности (когда связывание антитела с антигеном на поверхности вируса приводит к уничтожению вируса лейкоцитами) и антитело-опосредуемого комплемент-зависимого цитолиза (когда связывание антитела с антигеном приводит к разрушению вируса, опосредуемому через активацию комплемента). Реализации антивирусного эффекта анти-ЦМВ иммуноглобулина может способствовать опсонизация вируса (т.е. покрытие его поверхности антителами), которая облегчает эндоцитоз вируса макрофагами.
Эффективность анти-ЦМВ иммуноглобулина для профилактики ЦМВ-инфекции была продемонстрирована в рандомизированном контролируемом исследовании с участием 56 ЦМВ-серонегативных реципиентов почек от сероположительных доноров (D+/R-), имеющий высокий риск развития ЦМВ-инфекции. Среди больных, получавших анти-ЦМВ иммуноглобулин, заболеваемость ЦМВ-инфекцией была значительно ниже, чем среди контрольных больных, не получавших лечения (соответственно 21 и 60%), хотя частота ЦМВ-носительства в двух группах больных была одинакова. Дополнительным преимуществом анти-ЦМВ иммуноглобулина является то, что он снижает риск развития бактериальной инфекции. Поэтому этот препарат часто применяют совместно с антивирусными препаратами (в частности, ганцикловиром) у больных из групп высокого риска.
Так же проведенное ретроспективное исследование у пациентов после трансплантации почек, получивших препарат иммуноглобулина против ЦМВ с целью профилактики, показало, что в первый год после трансплантации не наблюдалось развития неходжкинскойлимфомы и лимфомы, ассоциированной с вирусом Эпштейна ― Барр [17].
Превентивная терапия заключается в назначении противовирусного лечения пациентам с бессимптомной формой ЦМВИ, имеющим признаки ранней репликации ЦМВ, с целью предупреждения развития ЦМВИ. Для превентивной терапии ЦМВИ у реципиентов ТСО используют противовирусные препараты ганцикловир и валганцикловир. Дозирование данного класса препаратов должно осуществляется с учетом степени нарушения почечной функции, и корректируется в зависимости от скорости клубочковой фильтрации. Превентивная терапия предусматривает регулярный мониторинг (1 раз в неделю) содержания ДНК ЦМВ в крови методом количественной ПЦР и немедленное назначение лечения при обнаружении более 2000 копий ДНК вируса [8].
ЦМВИ остается наиболее серьезной инфекционной патологией у пациентов-реципиентов ТСО. Противовирусная терапия и использование специфического цитомегаловирусного иммуноглобулина в настоящее время являются единственным подходом к профилактике ЦМВИ. Дальнейшие перспективы профилактики ЦМВИ связаны с созданием вакцины от нее.
1. Prokopenko E.I. Viral infections and kidney transplantation (Review of literature). Nefrologiya i dializ, 2003, 5 (2), pp. 6-13 (in Russ.).
2. Got’e S.V. Infektsii v transplantologii [Infection in Transplantation]. Moscow: Triada, 2010. 382 p.
3. Sinzger C., Digel M., Jahn G.Cytomegalovirus cell tropism. Current Topics in Microbiology and Immunology, 2008, 325, pp. 63-83.
4. Michael J. Cannon. Incidence of cytomegalovirus infection among the general population and pregnant women in the United States. BMC Infectious Diseases, 2007, 7, p. 71.
5. Michael J. Cannon., Scott Schmid D., Terri B. Hyde Review of cytomegalovirus seroprevalence and demographic characteristics associated with infection. Rev. Med. Virol, 2010, 20, pp. 202-213.
6. Manicklal S., Emery V.C., Lazzarotto T. et al. The “silent” global burden of congenital cytomegalovirus. Clinical Microbiology Reviews, 2013, 26 (1), pp. 86-102.
7. Dzieciatkowski T., Tomaszewska A., Przybylski M. et al. Analysis of the shedding of three β-herpesviruses DNA in Polish patients subjected to allogeneic hematopoietic stem cell transplantation: Six-year follow up. J. Clin. Virol, 2016, 76, pp. 30-35.
8. Vatazin A.V., Got’e S.V., Moysyuk Ya.G. et al. Tsitomegalovirusnaya infektsiya u vzroslykh posle transplantatsii solidnyk horganov. Klinicheskie rekomendatsii. Ministerstvozdravookhraneniya Rossiyskoy Federatsii [Cytomegalovirus infection in adults after solid organ transplantation. Clinical guidelines]. Moscow, 2014. 63 p.
9. Volkova S.D., Chebotkevich V.N., Kir’yanova G.Yu. et al. Algorithm ensure CMV-negative patients at risk gemokomponentami. Transfuziologiya, 2015, 1, pp. 35-37 (in Russ.).
10. Elfath M., Luka J., Tahhan R. et al. Detection of CMV by polymerase chain reaction (PCR) in seropositive blood donors. Transfusion, 1996, 36, p. 34.
11. Dodd R.Y., Notari E.P., Stramer S.L. Current prevalence and incidence of infectious disease markers and estimated window-period risk in the American Red Cross blood donor population. Transfusion, 2002, 42, pp. 975-979.
12. Ramanan P., Razonable P.P. Cytomegalovirus Infections in Solid Organ Transplantation: A Review. Infect. Chemother, 2013, 45 (3), pp. 260-271.
13. Razonable R.R. Cytomegalovirus in Solid Organ Transplantation. American Journal of Transplantation, 2013, 13, pp. 93-106.
14. Sadovskiy D.N., Kalachik O.V., Yunis N. et al. Cytomegalovirus infection in kidney transplantation. Meditsinskiy zhurnal, 2012, no. 4, pp. 85-88 (in Russ.).
15. Snydman D.R., Falagas M.E., Avery R.et al. Use of combination cytomegalovirus immune globulin plus ganciclovir for prophylaxis in CMV-seronegative liver transplant recipients of a CMV-seropositive donor organ: A multicenter, open-label study. Transplant Proc, 2001, 33, pp. 2571-2575.
16. Bonaros N., Mayer B., Schachner T. et al. CMV hyperimmune globulin for preventing cytomegalovirus infection and disease in solid organ transplant recipients: A meta-analysis. Clin. Transplant, 2008, 22, pp. 89-97.
17. Opelz G., Daniel V., Naujokat H. et al. Effect of cytomegalovirus prophylaxis with immunoglobulin or antiviral drugs on post-transplant non-Hodgkin lymphoma: a multicentre retrospective analysis. Lancet Oncol, 2007, 8, pp. 212-218.
18. Khoury J.A., Storch G.A., Bohl D.L. et al. Prophylactic versus preemptive oral valganciclovir for the management of cytomegalovirus infection in adult renal transplant recipients. Am. J. Transplant, 2006, 6, pp. 2134-2143.
19. Kliem V., Fricke L., Wollbrink T., Burg M., Radermacher J., Rohde F. Improvement in long-term renal graft survival due to CMV prophylaxis with oral ganciclovir: Results of a randomized clinical trial. Am. J. Transplant, 2008, 8, pp. 975-983.
20. Reischig T., Jindra P., Hes O., Svecova M., Klaboch J., Treska V. Valacyclovir prophylaxis versus preemptive valganciclovir therapy to prevent cytomegalovirus disease after renal transplantation. Am. J. Transplant, 2008, 8, pp. 69-77.
21. Witzke O., Hauser I.A., Bartels M. et al. Valganciclovir prophylaxis versus preemptive therapy in cytomegalovirus-positive renal allograft recipients: 1-year results of a randomized clinical trial. Transplantation, 2012, 93, pp. 61-68.
22. Mark D. Pescovitz Formulary Considerations for Drugs Used to Prevent Cytomegalovirus Disease. Disclosures Am. J. Health Syst. Pharm, 2003, 60, p. 23.
23. Khoury J.A., Storch G.A., Bohl D.L. et. al. Prophylactic Versus Preemptive Oral Valganciclovir for the Management of Cytomegalovirus Infection in Adult Renal Transplant Recipients. American Journal of Transplantation, 2006, vol. 6, I. 9, pp. 2134-2143.
Читайте также:

