Цитомегаловирус в стволовых клетках
Обновлено: 24.04.2024
Цитомегаловирус (ЦМВ) относится к семейству β-герпесвирусов, в котором является самым крупным представителем. Его геном представляет собой двухспиральную ДНК, а вирион покрыт гликопротеиновой оболочкой [4]. Распространение ЦМВ в человеческой популяции составляет в разных странах от 40 до 100% [12]. ЦМВ персистирует в организме человека пожизненно в виде латентной инфекции, не вызывая у иммунокомпетентных носителей клинических проявлений [13], но при иммуносупрессивных состояниях ЦМВ может стать причиной многих тяжелых органных поражений, в том числе цитомегаловирусного ретинита (ЦМВР) [14]. ЦМВР является самым распространенным офтальмологическим осложнением синдрома приобретенного иммунодефицита [5, 8], но после трансплантации гемопоэтических стволовых клеток (ТГСК) встречается значительно реже [2, 7].
Представить разработанный авторами протокол диагностики и лечения цитомегаловирусного ретинита, развивающегося после трансплантации гемопоэтических стволовых клеток.
Материал и методы
Развитию органных поражений, ассоциированных с ЦМВ, предшествует ЦМВ-виремия. Для верификации этого состояния проводят полимеразную цепную реакцию (ПЦР) плазмы крови один раз в неделю после ТГСК. При обнаружении ЦМВ-виремии пациенту проводится офтальмоскопия глазного дна с мидриазом 1 раз в неделю. В тех случаях, когда значения копий вируса в плазме крови достигают 3000 копий/мл, осмотр глазного дна проводят в условиях седации с полной циклоплегией и склерокомпрессией, а также делают флюоресцентную ангиографию 1 раз в неделю вплоть до появления в крови специфических анти-ЦМВ лимфоцитов.
При появлении на глазном дне белых очагов неправильной формы пациенту проводится интравитреальное введение ганцикловира 2,0 мг в 1,0 мл физиологического раствора с одномоментным забором внутриглазной жидкости 1 раз в неделю. При выявленной ганцикловир-резистентности проводят интравитреальное введение фоскавира 2,4 мг / 0,1 мл. При суммарной площади очагов 10 ДД и более или при обнаружении в водянистой влаге копий ЦМВ, количество которых превышает 50000, дозу увеличивают до 4,0 мг / 0,1 мл. Введения противовирусных препаратов в витреальную полость проводятся до двукратного определения отрицательной ПЦР камерной влаги и офтальмоскопически определенной регрессии очагов ЦМВ ретинита. Непосредственно перед каждой манипуляцией ребенку осматривают глазное дно с полной циклоплегией и склерокомпрессией и проводят флюоресцентную ангиографию 1 раз в неделю.
После элиминации воспалительных очагов и негативизации ПЦР водянистой влаги пациенту проводят осмотр глазного дна в условиях седации с полной циклоплегией и склерокомпрессией и флюоресцентную ангиографию 1 раз в неделю вплоть до появления в крови специфических антиЦМВ лимфоцитов.
Реципиент был ЦМВ серопозитивен, донор серонегативен. Приживление наступило в декретированные сроки, на 30 сутки после ТГСК химеризм донорский.
При вирусологическом мониторинге на 30 сутки в крови методом ПЦР отмечалось появление 2800 коп/мл ЦМВ, начата противовирусная терапия ганцикловиром. Однако, учитывая отсутствие иммунореконституции, ЦМВ негативный статус донора, отмечался рост ЦМВ-виремии, что потребовало проведение эскалации противовирусной терапии фоскарнетом и инфузии донорских лимфоцитов памяти (СD45RA деплетированных) от альтернативного ЦМВ позитивного донора (матери), после чего отмечено постепенное уменьшение ЦМВ-виремии и экспансии на 150 сутки после ТГСК в периферической крови CD8 Т-лимфоцитов, специфичных к цитомегаловирусу.
На 60 сутки, во время планового офтальмологического осмотра, выявлены двухсторонние белые ретинальные очаги с неровными краями, суммарной площадью до 7 ДД. Методом флюоресцентной ангиографии глазного дна выявлена ретинальная гипоперфузия в зоне воспалительных изменений, наблюдаемая во время артериальной фазы. Начиная с капиллярной фазы исследования отмечалось накопление контраста в зоне очагов, гиперфлюоресценция усиливалась с каждым циклом рециркуляции контрастного вещества. Был поставлен диагноз: двухсторонний острый ЦМВ ретинит.
Пациенту проведена серия интравитреальных введений противовирусных препаратов (Ганцикловир 2,0 мг в 0,1 мл физиологического раствора № 7 и фоскавир 2,4 мг в 0,1 мг № 4). Инъекции проводились в условиях асептического операционного блока и сопровождались забором водянистой влаги из передней камеры. В получаемом материале отмечался рост копий ЦМВ до 76 суток, несмотря на 3 инъекции препарата ганцикловир. Однако начиная с четвертой манипуляции и далее было выявлено уменьшение содержания ЦМВ во внутриглазной жидкости и полная их элиминация после 11 интравитреальных введений противовирусных препаратов. После каждой инъекции площадь воспалительного очага уменьшалась, он становился менее ярким, а его края более ровными. Разрешение ЦМВ хориоретинита совпало с появлением ЦМВ специфичных лимфоцитов в периферической крови.
ЦМВ-ретинит, развивающийся у реципиентов костного мозга и гемопоэтических стволовых клеток, часто становится причиной необратимой слепоты. Вышесказанное связано с неконтролируемым ростом площади патологических очагов в период острого воспаления [1], а также с развитием отслойки сетчатки в отсроченном периоде [3]. Принимая во внимание сложность визометрического исследования в педиатрической практике, следует помнить о том, что манифестация ЦМВ-ретинита может характеризоваться бессимптомным течением, особенно если первичные очаги расположены на периферии. Из вышесказанного следует, что единственной возможностью сохранить зрение у детей, страдающих ЦМВ-ретинитом, является постоянный офтальмологический мониторинг в посттрансплантационном периоде.
Эффективность интравитреального введения противовирусных препаратов, описанная в мировой литературе [6, 10, 11], демонстрируется в описанном клиническом примере. Мониторинг активности ЦМВ поражения заднего отрезка глаза при помощи ПЦР камерной влаги позволил нам контролировать активность вируса и быть уверенными в его элиминации после завершения лечения.
Лечение цитомегаловирусной инфекции - препараты
Подход к лечению ЦМВ-инфекции существенно отличается у реципиентов после аллогенной трансплантации костного мозга (ТКМ) и у больных, подвергающихся химиотерапии (в том числе высокодозной после трансплантации аутологичных стволовых клеток). Больным первой группы необходимо упреждающее лечение, поскольку, несмотря на наличие препаратов, эффективно ингибирующих репликацию вируса, лечение уже развившихся висцеральных поражений эффективно не более чем в половине случаев.
Больным, получающим стандартную химиотерапию, специфическое лечение проводят только при установленном или высоковероятном висцеральном поражении.
Методы контроля ЦМВ-инфекции у реципиентов аллогенного костного мозга зависят от ЦМВ-статуса пары донор — реципиент. При серонегативности как донора, так и реципиента самым надежным способом профилактики ЦМВ-инфекции является использование для трансфузий препаратов крови от серонегативных доноров или лейкодеплеция с помощью фильтров последнего поколения, предназначенных для фильтрации в банках крови. При любом другом сочетании ЦМВ-статусов главные инструменты контроля — еженедельный мониторинг ЦМВ-виремии (методом ПЦР или выявлением антигенемии рр65) и упреждающее лечение ганцикловиром при позитивном результате.
Для начала терапии больных высокого риска (реципиенты неродственной или неполностью совместимой трансплантации, лечение РТПХ антитимоцитарным глобулином) достаточно однократного позитивного анализа. В то же время у больных низкого риска при невысокой вирусной нагрузке назначение специфической терапии можно отложить до повторного позитивного анализа, выполненного с интервалом 3— 5 дней. Этот подход проверен многими исследователями, в том числе нами. Доказано, что такой подход эффективнее и дешевле, чем профилактическое использование высоких доз иммуноглобулина и ацикловира, которое было популярно в конце 80-х — начале 90-х годов.

Ганцикловир (1,3-дигидрокси-пропоксиметил-гуанин) сам по себе не является активным противовирусным агентом, необходимо его фосфорилирование вирусной тимидинкиназой. В форме трифосфата ганцикловир ингибирует вирусную ДНК-полимеразу. Сродство ганцикловира к тимидинкиназам человека значительно меньше, поэтому его токсичность для человеческих клеток относительно невелика.
Доза ганцикловира для курса индукции составляет 10 мг/кг в сутки на два введения. Курс индукции продолжается 2—3 нед, после чего назначают поддерживающую дозу — 5 мг/кг в сутки на одно введение ежедневно или 5—6 раз в неделю. Длительность курса поддерживающей терапии определяют индивидуально. При упреждающем лечении реактивации ЦМВ после аллогенной ТКМ при достижении негативной реакции на антигене-мию или виремию поддерживающее лечение можно не проводить, в то время как при органном поражении (пневмония, ЦМВ-колит) лечение должно быть продолжено до купирования симптомов и негативизации результатов вирусологических исследований, а при ЦМВ-ретините терапия может быть пожизненной.
При длительном профилактическом или упреждающем применении ганцикловира в раннем посттрансплантационном периоде высока частота поздних ЦМВ-пневмоний. Таким пациентам необходимо продолжать мониторинг ЦМВ-виремии или антигенемии и после 100-го дня после трансплантации [11]. Примерно у 20 % больных, леченных ганцикловиром в указанной дозе, развивается гранулоцитопения менее 1000 в 1 м\ во всех случаях обратимая (быстрее под влиянием G-CSF), с медианой длительности 12 дней. Резистентность ЦМВ к ганцикловиру является редкостью.
Отличным от ганцикловира по механизму действия (прямое ингибирование ДНК-полимеразы) является натрия фосфоноформат (фоскарнет, фоскавир), который может быть эффективен при резистентности данного штамма вируса к ганцикловиру. Индукционная доза натрия фосфоноформата 90 мг/кг каждые 12 ч. Продолжительность курса лечения составляет 14 дней, затем проводят поддерживающую терапию в половинной дозе. Побочными реакциями являются нарушение функции почек, гипомагнезиемия, гипокальциемия и изъязвление слизистых оболочек наружных половых органов.
Необходимо отметить коммерчески доступный специфический антицитомегаловирусный иммуноглобулин. Убедительных доказательств его эффективности в лечении вызванных ЦМВ болезней нет. С учетом его дороговизны, а также наличия препаратов, оказывающих специфическое противовирусное действие, дальнейшее применение этого препарата вряд ли оправдано.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Цитомегаловирусная инфекция (ЦМВ-инфекция) у гематологических больных
Среди вирусных инфекций, поражающих больных с нарушениями иммунитета, герпетическим вирусам принадлежит особая роль. С одной стороны, вирусы этой группы часто вызывают тяжелые органные поражения, напрямую угрожающие жизни больного, а с другой — разработанные методы вирусологического мониторинга, профилактической и упреждающей терапии позволяют свести этот риск к минимуму.
В статьях на нашем сайте рассмотрены особенности эпидемиологии и клинической картины инфекций, вызываемых лишь несколькими герпес-вирусами, наиболее часто встречающихся у гематоонкологических больных, а также изложены рациональные подходы к диагностике и лечению этих заболеваний.
Цитомегаловирус (ЦМВ) — один из самых частых вирусных спутников человека. В развитых странах 50—80 % населения в возрасте до 50 лет переносят инаппарантную инфекцию и являются серопозитивными по ЦМВ, в то время как в странах с низким или средним социально-экономическим развитием практически 100 % населения к 30 годам являются серопозитивными. Такая же закономерность наблюдается в различных в отношении материальной обеспеченности слоях населения: при высоком материальном достатке и часто соответствующем ему более высоком культурном уровне средний возраст первичной ЦМВ-контаминации, регистрируемой по сероконверсии, значительно выше, чем при среднем и низком достатке.
Причина этого феномена кроется, по всей вероятности, в менее строгих гигиенических правилах и традициях (например, облизывание матерями детских сосок, пользование одной и той же посудой и столовыми приборами и т. д.).

Главными эффекторами антицитомегаловирусного иммунитета являются вирусспецифические цитотоксические лимфоциты, в то время как все типы антител в лучшем случае играют вспомогательную роль. Отсюда очевидно, что наиболее уязвимой группой в отношении развития тяжелой первичной инфекции или клинически значимой реактивации являются больные с врожденным либо приобретенным (в том числе ятрогенным) дефицитом клеточного иммунитета.
Кроме факта наличия клеточного иммунодефицита, важный фактор риска — его длительность. Классической демонстрацией данного положения является различие в частоте реактивации ЦМВ и развития ЦМВ-синдрома и ЦМВ-пневмонии у реципиентов при трансплантации аллогенного и аутологичного костного мозга. При одинаковой исходной степени иммуносупрессии, но несоизмеримо более короткой ее продолжительности ЦМВ-пневмония, которая развивалась у 30—40 % реципиентов после аллогенной трансплантации костного мозга (ТКМ) до разработки упреждающего или профилактического лечения ганцикловиром, является казуистикой (не более 0,5 %) после аутологичной трансплантации.
Группы риска в отношении развития тяжелой ЦМВ-инфекции:
1) перинатально инфицированные новорожденные (особенно недоношенные);
2) дети с тяжелыми комбинированными врожденными иммунодефицитами;
3) больные СПИДом;
4) реципиенты аллогенной трансплантации гемо-поэтических стволовых клеток;
5) реципиенты солидных органов.
В отношении больных, которым проводят стандартную химиотерапию по поводу лейкозов, лимфом или солидных опухолей, статистики, оценивающей частоту развития ЦМВ-ассоциированных клинических синдромов, не существует, хотя описаны как отдельные случаи, так и небольшие серии тяжелых проявлений ЦМВ-инфекции в данных группах.
Справедливо считать, что развитие клинически значимых симптомов ЦМВ-инфекции теоретически возможно у любого больного после цитотоксической иммуносупрессивной терапии, однако большинство таких больных составляют реципиенты аллогенной ТКМ. Наличие современных специфичных и чувствительных методов быстрой диагностики делают абсолютно неприемлемой эмпирическую терапию не только потому, что такое лечение достаточно дорого и токсично, но и потому, что цена ошибки и соответственно неадекватного лечения при постановке диагноза только по клиническим симптомам слишком велика. Так, на основании клинической картины очень трудно отличить ЦМВ-пневмонию от пневмоцистоза или лучевого пневмонита, а затяжной ЦМВ-гепатит — от хронического гепатолиенального кандидоза.
Как отмечалось, подавляющее большинство взрослых больных и значительный процент детей в нашей стране ЦМВ-серопозитивны, поэтому наблюдать в гематологическом стационаре первичную ЦМВ-инфекцию приходится нечасто. Непосредственная передача ЦМВ от одного больного к другому маловероятна, если больные не вступают в контакт более близкий, чем это предписано больничным режимом. В зависимости от серологического статуса, степени и длительности иммуносупрессии проявления ЦМВ-инфекции у гематологических больных могут быть различными.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Цитомегалия – это инфекционное заболевание вирусного генеза, передающееся половым, трансплацентарным, бытовым, гемотрансфузионным путем. Симптоматически протекает в форме упорной простуды. Отмечается слабость, недомогание, головные и суставные боли, насморк, увеличение и воспаление слюнных желез, обильное слюноотделение. Часто протекает бессимптомно. Опасна цитомегалия беременных: она может вызывать самопроизвольный выкидыш, врожденные пороки развития, внутриутробную гибель плода, врожденную цитомегалию. Диагностика осуществляется лабораторными методами (ИФА, ПЦР). Лечение включает противовирусную и симптоматическую терапию.
МКБ-10
Общие сведения
Другие названия цитомегалии, встречающиеся в медицинских источниках, - цитомегаловирусная инфекция (ЦМВ), инклюзионная цитомегалия, вирусная болезнь слюнных желез, болезнь с включениями. Цитомегалия является широко распространенной инфекцией, и многие люди, являясь носителями цитомегаловируса, даже не подозревают об этом. Наличие антител к цитомегаловирусу выявляется у 10—15% населения в подростковом возрасте и у 50% взрослых людей. По некоторым источникам, носительство цитомегаловируса определяется у 80% женщин детородного периода. В первую очередь это относится к бессимптомному и малосимптомному течению цитомегаловирусной инфекции.

Причины
- воздушно-капельным: при чихании, кашле, разговоре, поцелуях и т.д.;
- половым путем: при сексуальных контактах через сперму, влагалищную и шеечную слизь;
- гемотрансфузионным: при переливании крови, лейкоцитарной массы, иногда - при пересадке органов и тканей;
- трансплацентарным: во время беременности от матери плоду.
Нередко цитомегаловирус находится в организме многие годы и может ни разу не проявить себя и не нанести вреда человеку. Проявление скрытой инфекции происходит, как правило, при ослаблении иммунитета. Угрожающую по своим последствиям опасность цитомегаловирус представляет у лиц со сниженным иммунитетом (ВИЧ-инфицированных, перенесших трансплантацию костного мозга или внутренних органов, принимающих иммунодепрессанты), при врожденной форме цитомегалии, у беременных.
Патогенез
Попадая в кровь, цитомегаловирус вызывает выраженную иммунную реакцию, проявляющуюся в выработке защитных белковых антител – иммуноглобулинов М и G (IgM и IgG) и противовирусной клеточной реакцией - образованием лимфоцитов CD 4 и CD 8. Угнетение клеточного иммунитета при ВИЧ-инфекции приводит к активному развитию цитомегаловируса и вызываемой им инфекции.
Даже при бессимптомном течении инфекции носитель цитомегаловируса является потенциально заразным для неинфицированных лиц. Исключение составляет внутриутробный путь передачи цитомегаловируса от беременной женщины плоду, который происходит в основном при активном течении процесса, и лишь в 5% случаев вызывает врожденную цитомегалию, в остальных же носит бессимптомный характер.
Симптомы цитомегалии
Врожденная цитомегалия
В 95% случаев внутриутробное инфицирование плода цитомегаловирусом не вызывает развития заболевания, а протекает бессимптомно. Врожденная цитомегаловирусная инфекция развивается у новорожденных, матери которых перенесли первичную цитомегалию. Врожденная цитомегалия может проявляться у новорожденных в различных формах:
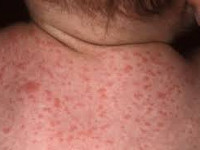
- петехиальная сыпь – мелкие кожные кровоизлияния - встречается у 60-80% новорожденных;
- недоношенность и задержка внутриутробного развития плода - встречается у 30% новорожденных;
- желтуха;
- хориоретинит – острый воспалительный процесс в сетчатке глаза, часто вызывающий снижение и полную потерю зрения.
Летальность при внутриутробном инфицировании цитомегаловирусом достигает 20-30%. Из выживших детей большая часть имеет отставание в умственном развитии или инвалидность по слуху и зрению.
Приобретенная цитомегалия у новорожденных
При инфицировании цитомегаловирусом в процессе родов (при прохождении плода по родовым путям) или в послеродовом периоде (при бытовом контакте с инфицированной матерью или грудном вскармливании) в большинстве случаев развивается бессимптомное течение цитомегаловирусной инфекции. Однако у недоношенных младенцев цитомегаловирус может вызывать затяжную пневмонию, к которой часто присоединяется сопутствующая бактериальная инфекция. Часто при поражении цитомегаловирусом у детей отмечается замедление в физическом развитии, увеличение лимфоузлов, гепатит, сыпь.
Мононуклеозоподобный синдром
У лиц, вышедших из периода новорожденности и имеющих нормальный иммунитет, цитомегаловирус может вызывать развитие мононуклеозоподобного синдрома. Течение мононуклеазоподобного синдрома по клинике не отличается от инфекционного мононуклеоза, вызываемого другой разновидностью герпесвируса – вирусом Эбштейна-Барр. Течение мононуклеозоподобного синдрома напоминает упорную простудную инфекцию. При этом отмечается:
- длительная (до 1 месяца и более) лихорадка с высокой температурой тела и ознобами;
- ломота в суставах и мышцах, головная боль;
- выраженные слабость, недомогание, утомляемость;
- боли в горле;
- увеличение лимфоузлов и слюнных желез;
- кожные высыпания, напоминающие сыпь при краснухе (обычно встречается при лечении ампициллином).
В отдельных случаях мононуклеозоподобный синдром сопровождается развитием гепатита – желтухой и повышением в крови печеночных ферментов. Еще реже (до 6% случаев) осложнением мононуклеозоподобного синдрома служит пневмония. Однако у лиц с нормальной иммунной реактивностью она протекает без клинических проявлений, выявляясь лишь при проведении рентгенографии легких.
Длительность течения мононуклеозоподобного синдрома составляет от 9 до 60 дней. Затем обычно наступает полное выздоровление, хотя на протяжении нескольких месяцев могут сохраняться остаточные явления в виде недомогания, слабости, увеличенных лимфоузлов. В редких случаях активизация цитомегаловируса вызывает рецидивы инфекции с лихорадкой, потливостью, приливами и недомоганием.
Цитомегаловирусная инфекция у лиц с ослабленным иммунитетом
Ослабление иммунитета наблюдается у лиц, страдающих синдромом врожденного и приобретенного (СПИД) иммунодефицита, а также у пациентов, перенесших пересадку внутренних органов и тканей: сердца, легкого, почки, печени, костного мозга. После пересадки органов пациенты вынуждены постоянно принимать иммунодепрессанты, ведущие к выраженному подавлению иммунных реакций, что вызывает активность цитомегаловируса в организме.
У пациентов, перенесших трансплантацию органов, цитомегаловирус вызывает поражение донорских тканей и органов (гепатит – при пересадке печени, пневмонию при пересадке легкого и т. д.). После трансплантации костного мозга у 15-20% пациентов цитомегаловирус может привести к развитию пневмонии с высокой летальностью (84-88%). Наибольшую опасность представляет ситуация, когда инфицированный цитомегаловирусом донорский материал пересажен неинфицированному реципиенту.
Цитомегаловирус поражает практически всех ВИЧ-инфицированных. В начале заболевания отмечаются недомогание, суставные и мышечные боли, лихорадка, ночная потливость. В дальнейшем к этим признакам могут присоединяться поражения цитомегаловирусом легких (пневмония), печени (гепатит), мозга (энцефалит), сетчатки глаза (ретинит), язвенные поражения и желудочно-кишечные кровотечения.
У мужчин цитомегаловирусом могут поражаться яички, простата, у женщин – шейка матки, внутренний слой матки, влагалище, яичники. Осложнениями цитомегаловирусной инфекции у ВИЧ-инфицированных могут стать внутренние кровотечения из пораженных органов, потеря зрения. Множественное поражение органов цитомегаловирусом может привести к их дисфункции и гибели пациента.
Диагностика
С целью диагностики цитомегаловирусной инфекции проводится лабораторное обследование. Постановка диагноза цитомегаловирусной инфекции основана на выделении цитомегаловируса в клиническом материале или при четырехкратном повышении титра антител.
- ИФА-диагностика. Включает определение в крови специфических антител к цитомегаловирусу - иммуноглобулинов М и G. Наличие иммуноглобулинов М может свидетельствовать о первичном заражении цитомегаловирусом либо о реактивации хронической ЦМВИ. Определение высоких титров IgМ у беременных может угрожать инфицированию плода. Повышение IgМ выявляется в крови спустя 4-7 недель после заражения цитомегаловирусом и наблюдается на протяжении 16-20 недель. Повышение иммуноглобулинов G развивается в период затухания активности цитомегаловирусной инфекции. Их наличие в крови говорит о присутствии цитомегаловируса в организме, но не отражает активности инфекционного процесса.
- ПЦР-диагностика. Для определения ДНК цитомегаловируса в клетках крови и слизистых (в материалах соскобов из уретры и цервикального канала, в мокроте, слюне и т. д.) используется метод ПЦР-диагностики (полимеразной цепной реакции). Особенно информативно проведение количественной ПЦР, дающей представление об активности цитомегаловируса и вызываемого им инфекционного процесса.
В зависимости от того, какой орган поражен цитомегаловирусной инфекцией, пациент нуждается в консультации гинеколога, андролога, гастроэнтеролога или других специалистов. Дополнительно по показаниям проводится УЗИ органов брюшной полости, кольпоскопия, гастроскопия, МРТ головного мозга и другие обследования.
Лечение цитомегаловирусной инфекции
Неосложненные формы мононуклеазоподобного синдрома не требует специфической терапии. Обычно проводятся мероприятия, идентичные лечению обычного простудного заболевания. Для снятия симптомов интоксикации, вызываемой цитомегаловирусом, рекомендуется пить достаточное количество жидкости.
Лечение цитомегаловирусной инфекции у лиц, входящих в группу риска, проводится противовирусным препаратом ганцикловиром. В случаях тяжелого течения цитомегалии ганцикловир вводится внутривенно, т. к. таблетированные формы препарата обладают лишь профилактическим эффектом в отношении цитомегаловируса. Поскольку ганцикловир обладает выраженными побочными эффектами (вызывает угнетение кроветворения - анемию, нейтропению, тромбоцитопению, кожные реакции, желудочно-кишечные расстройства, повышение температуры и ознобы и др.), его применение ограничено у беременных, детей и у людей, страдающих почечной недостаточностью (только по жизненным показаниям), он не используется у пациентов без нарушения иммунитета.
Для лечения цитомегаловируса у ВИЧ-инфицированных наиболее эффективен препарат фоскарнет, также обладающий рядом побочных эффектов. Фоскарнет может вызывать нарушение электролитного обмена (снижение в плазме крови магния и калия), изъязвление половых органов, нарушение мочеиспускания, тошноту, поражение почек. Данные побочные реакции требуют осторожного применения и своевременной корректировки дозы препарата.
Прогноз
Особую опасность цитомегаловирус представляет при беременности, так как может провоцировать выкидыш, мертворождение или вызывать тяжелые врожденные уродства у ребенка. Поэтому цитомегаловирус, наряду с герпесом, токсоплазмозом и краснухой, относится к числу тех инфекций, обследоваться на которые женщины должны профилактически, еще на этапе планирования беременности.
Профилактика
Особенно остро вопрос профилактики цитомегаловирусной инфекции стоит у лиц, входящих в группу риска. Наиболее подвержены инфицированию цитомегаловирусом и развитию заболевания ВИЧ-инфицированные (особенно больные СПИДом), пациенты после трансплантации органов и лица с иммунодефицитом иного генеза.
Неспецифические методы профилактики (например, соблюдение личной гигиены) неэффективны в отношении цитомегаловируса, так как заражение им возможно даже воздушно-капельным путем. Специфическая профилактика цитомегаловирусной инфекции проводится ганцикловиром, ацикловиром, фоскарнетом среди пациентов, входящих в группы риска. Также для исключения возможности инфицирования цитомегаловирусом реципиентов при пересадке органов и тканей необходим тщательный подбор доноров и контроль донорского материала на наличие цитомегаловирусной инфекции.
Цитомегаловирусная инфекция у детей — это инфекционное заболевание, которое вызвано цитомегаловирусом и поражает слюнные железы, внутренние органы, ЦНС. В детстве патология чаще возникает при трансплацентарном или интранатальном заражении. Локализованные формы проявляются сиаладенитом, гепатитом, нефритом и т. д., распространенный вариант инфекции характеризуется поражением головного мозга, легких, почек и органов ЖКТ. Диагностика предполагает идентификацию возбудителя цитологическими, гистологическими, серологическими и молекулярно-биологическими методами. Лечение цитомегаловирусной болезни проводится специфическим иммуноглобулином и противовирусными препаратами.
МКБ-10
Общие сведения
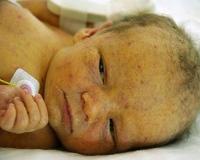
Заражение цитомегаловирусной инфекцией (ЦМВИ) наблюдается у 20%‒60% всего детского населения, но в большинстве случаев оно протекает бессимптомно. Внутриутробное инфицирование вирусом от больной матери происходит в 30-50% случаев, при этом до 18% младенцев после рождения имеют клинические симптомы. Учитывая полиморфизм клинической картины, ранняя диагностика и лечение у детей затруднены. Цитомегаловирусная инфекция представляет серьезную опасность, особенно для плода и новорожденного, у которых заболевание, как правило, вызывает необратимые осложнения.

Причины
Болезнь вызвана герпесвирусом 5 типа — Cytomegalovirus hominis. Он имеет 6 штаммов: Davis, AD 169, Kerr, C-87, Esp, Towne, причем ребенок может быть инфицирован сразу несколькими подтипами возбудителя. Цитомегаловирус (ЦМВ) имеет ДНК-геном, отличается медленной репликацией и сравнительно низкой вирулентностью. Он термолабилен, уничтожается при температуре более 56°С, но длительно сохраняет жизнеспособность в комнатных условиях.
При врожденной ЦВМИ передача вируса к плоду происходит трансплацентарно, при перинатальной инфекции — путем контакта с вагинальными выделениями матери, грудным молоком или препаратами крови. Риск заражения увеличивается, если мать с острой формой болезни не получает специфическое лечение. В постнатальном периоде ребенок чаще всего заражается от ближайших родственников и сверстников воздушно-капельным или контактно-бытовым путем.
Патогенез
Попадая в кровь, вирус реплицируется в лейкоцитах, моноцитах и макрофагах и в дальнейшем он пожизненно сохраняется в лимфоцитарных органах. Зачастую процесс выражается в виде латентной инфекции, при которой у ребенка нет симптомов, и ему не требуется лечение. Активность цитомегаловируса зависит от состояния иммунитета: при физиологической иммунной недостаточности, которая наблюдается у детей раннего возраста, риск манифестной цитомегаловирусной инфекции возрастает в разы.
Классификация
В детской инфектологии различают врожденную (внутриутробную) и приобретенную формы патологии. По течению инфекция бывает острой (до 3 месяцев), подострой (3-6 месяцев), затяжной (6-12 месяцев) и хронической (более 1 года). По клиническим признакам выделяют локализованный (сиаладенит, нефрит, гепатит, энцефалит) и генерализованный вариант. С учетом тяжести течения цитомегаловирусную болезнь делят на 3 степени:
- Легкая. Отличается незначительными патоморфологическими изменениями во внутренних органах, которые не сказываются на их функциональной активности.
- Среднетяжелая. Проявляется выраженными органическими поражениями в сочетании с клиническими симптомами и расстройством функции некоторых внутренних органов.
- Тяжелая. Манифестирует тяжелыми органическими патологиями, резко выраженной интоксикацией и генерализованным характером поражения.
Симптомы
Врожденная ЦМВИ
У пациентов с манифестной врожденной форме цитомегаловирусной болезни признаки наблюдаются с первых дней жизни. Типичный комплекс симптомов у новорожденных детей включает недоношенность и/или низкую массу тела, поражение гепатобилиарной системы (увеличение печени, желтуха, гепатиты и циррозы), лимфаденопатии и геморрагическую сыпь на коже. Если инфицирование произошло на ранних сроках беременности, ребенок рождается с аномалиями — микроцефалией, гипоплазией легких, атрезией пищевода.
Приобретенная ЦМВИ
Приобретенная цитомегаловирусная болезнь обычно протекает в субклинической или латентной форме, когда у ребенка возникают гриппоподобные симптомы, субфебрильная температура без видимой причины. После заражения инфекция может длительное время себя не проявлять и давать обострения при снижении иммунного статуса, действии неблагоприятных эндо- или экзогенных факторов.
Течение манифестной приобретенной формы напоминает инфекционный мононуклеоз. У ребенка внезапно появляется слабость, повышается температура, беспокоят недомогание, головные боли, отсутствует аппетит. Позже присоединяются сильные боли в горле, увеличиваются подчелюстные и шейные лимфоузлы. Если цитомегаловирусная инфекция проявляется сиаладенитом, наблюдается резкое увеличение и болезненность слюнных желез на фоне фебрильной лихорадки.
Генерализованная ЦМВИ
При генерализованном варианте течения инфекции у детей поражается бронхолегочная система (пневмонии, дыхательная недостаточность), ЖКТ (энтероколит, мальабсорбция), печень (желтуха, цитомегаловирусный гепатит, билиарный цирроз). Особенно опасно вовлечение в процесс нервной системы, что проявляется судорожным синдромом, парезами и параличами, задержкой психомоторного развития.
Осложнения
Поражение клеток при цитомегаловирусной болезни создает благоприятные условия для возникновения аутоиммунных поражений — системной красной волчанки, рассеянного склероза, гломерулонефрита. Иногда после малосимптомной врожденной цитомегаловирусной инфекции осложнения наблюдаются в отдаленном периоде (в возрасте ребенка 2-5 лет). В основном они проявляются неврологическими расстройствами и поражением органов чувств.
Диагностика
Цитомегаловирусная инфекция отличается многообразием клинических признаков и часто протекает под маской других патологий, что затрудняет работу детского инфекциониста. На первичном приеме, помимо стандартного физикального осмотра, врач собирает детальный акушерский анамнез, чтобы выявить факторы риска антенатального инфицирования. Диагноз ЦМВИ правомочен только при лабораторном подтверждении, для чего используют следующие методы:
Инструментальные методы подбираются соответственно форме заболевания. Для оценки структурно-функциональных особенностей печени и билиарного тракта назначают УЗИ органов брюшной полости. КТ и МРТ головного мозга информативны для выявления врожденных пороков и кальцификатов. Рентгенография ОГК необходима при симптомах дыхательных расстройств. По показаниям ребенка направляют на консультации к профильным специалистам— кардиологу, неврологу, отоларингологу.
Лечение цитомегаловирусной инфекции у детей
Препаратом выбора у новорожденных и детей первого года жизни является специфический антицитомегаловирусный иммуноглобулин, который имеет повышенную концентрацию IgG. Лечение начинают при манифестных формах заболевания и проводят по схеме: вначале вводится высокая доза препарата, а спустя 9-10 дней дозировку постепенно уменьшают, контролируя степень ответа на терапию и активность процесса.
В старшем возрасте перечень препаратов, применяемых при цитомегаловирусной инфекции, значительно расширяется. Лечение включает противовирусные средства из группы нуклеозидов и нуклеотидов (ганцикловир, валганцикловир), производные ортофосфорной кислоты (фоскарнет). При легкой и среднетяжелой формах назначают интерфероны, иммуностимуляторы.
Для купирования интоксикации показано обильное питье (при легких формах), при среднетяжелых и тяжелых клинических вариантах рекомендована инфузионная терапия. Патогенетическая терапия подбирается в соответствии с характером течения болезни и может включать пищеварительные ферменты, ингибиторы протеиназ, гемостатики. Для предупреждения вторичных бактериальных осложнений используют антибиотики (макролиды, цефалоспорины, гликопептиды).
Прогноз и профилактика
При малосимптомных приобретенных вариантах цитомегаловирусная болезнь протекает без осложнений, зачастую у ребенка выявляется только латентное носительство. Угрозу для жизни и здоровья представляют тяжелые генерализованные инфекции, которые в 50-60% случаев сопровождаются осложнениями, несмотря на проводимое лечение. Особо опасно поражение цитомегаловирусом для детей с иммунодефицитными состояниями.
Основу профилактики врожденной ЦМВИ составляет обязательное лабораторное обследование женщин на носительство цитомегаловируса, которое проводится при планировании зачатия и во время беременности. Если в семье есть пациент с цитомегаловирусной инфекцией, необходимо ограничить его общение с ребенком и обеспечить лечение. Карантинно-изоляционные мероприятия в отношении заболевших и контактных лиц не производятся.
2. Клинические рекомендации (протокол лечения) оказания медицинской помощи детям больным цитомегаловирусной инфекцией. — 2015.
Читайте также:

