Цитомегаловирусная инфекция и тромбоциты
Обновлено: 17.04.2024
Цитомегаловирусная инфекция (ЦМВИ) у новорожденных и детей первых месяцев жизни может протекать в различных клинических формах, требующих дифференцированной терапии. Представлены особенности двух различных вариантов течения ЦМВИ — генерализованной с манифестной клинической картиной и характерными сдвигами в лабораторных анализах у ребенка в возрасте 2,5 мес с сочетанной генетической патологией и латентной внутриутробной у ребенка в возрасте 5 дней, приведшей к развитию нейросенсорной тугоухости. Освещены трудности диагностики стертой (латентной) формы болезни и выбора тактики лечения пациента. Представлен успешный результат этиопатогенетической терапии препаратом ганцикловира у ребенка с постнатальной генерализованной ЦМВИ.
Цитомегаловирусная инфекция (ЦМВИ) широко распространена в популяции. Это одна из наиболее частых из диагностируемых внутриутробных инфекций: протективные антитела к вирусу ЦМВИ обнаруживаются у 80% населения старше 35 лет, что свидетельствует о перенесенной подавляющим большинством латентной (бессимптомной) форме этой инфекции. По другим данным, удельный вес серопозитивных матерей (имеющих протективные антитела) среди социально незащищенных слоев населения достигает 100%.
Тяжелые генерализованные формы ЦМВИ отмечаются только у иммунокомпрометированных пациентов (новорожденные при внутриутробном трансплацентарном заражении, дети первых месяцев жизни, пациенты, получающие иммунодепрессанты).
Не исключается интранатальное инфицирование (наличие вируса в вагинальном секрете). При постнатальном инфицировании возможны контактный или алиментарный (в т.ч. с материнским молоком) пути передачи. Недостаточная настороженность врачей в отношении повышенного риска постнатального инфицирования пациентов неонатальных стационаров может свести на нет усилия по выхаживанию тяжело больных детей. Так, описаны случаи тяжелой ЦМВИ с высоким риском летального исхода у недоношенных новорожденных при постнатальном инфицировании через нативное материнское молоко. Вирус может длительно выделяться с мочой, калом, слюной;
Даже в настоящее время, когда контроль доноров достаточно строгий, допускается возможность передачи ЦМВ при гемотрансфузиях через инфицированные препараты крови. В этой связи к группе пациентов высокого риска тяжелых — генерализованных — форм ЦМВИ наряду с глубоко недоношенными детьми (не получившими протективных антител из-за преждевременного рождения) относятся младенцы с недостаточностью иммунной защиты и дети, перенесшие трансфузии и/или хирургические вмешательства.
В последние годы все чаще у младенцев, умерших от различных причин, при гистологическом исследовании выявляют неустановленную при жизни ЦМВИ. В связи с этим обсуждаются проблемы негативного влияния латентной инфекции на онтогенез многих функциональных систем. Вместе с тем диагностика латентных форм инфекции у новорожденных объективно затруднительна, и часто диагноз устанавливается ретроспективно — при выявлении нарушений слуха или когнитивной недостаточности.
Наряду с диагностическими трудностями при стертых (маломанифестных) формах ЦМВИ у младенцев существуют также разногласия по проблеме этиопатогенетического лечения, причем как в отношении манифестных, так и бессимптомных форм болезни.
Так, в отечественных руководствах протокол терапии манифестных форм ЦМВИ включает препараты:
- Ганцикловира, применяемые у детей до 12 лет по показаниям off-label,
- Противоцитомегаловирусный иммуноглобулин,
- Иммуноглобулин человека нормальный [IgG + IgM + IgA] и
- Препарат интерферон альфа-2b человеческий рекомбинантный.
Применять перечисленные препараты при латентных формах ЦМВИ не рекомендуется.
В то же время проект новых клинических рекомендаций Российской ассоциации специалистов перинатальной медицины включает применение при манифестной форме только Ганцикловира (Валганцикловира) и Противоцитомегаловирусного иммуноглобулина.
В отношении противоцитомегаловирусного иммуноглобулина считается подтвержденной лишь его профилактическая эффективность при антенатальном использовании у беременных женщин.
В данной статье представлен анализ типичной клинической ситуации, вызванной затруднениями в диагностике манифестной и стертой формы ЦМВИ у младенцев первых месяцев жизни, в разграничении внутриутробной и постнатальной инфекции, а также в выборе методов и продолжительности лечения с учетом многочисленных побочных действий препаратов ганцикловира и возможной терапевтической эффективности специфического противоцитомегаловирусного иммуноглобулина.
Это важно, как для образовательных целей, так и для обсуждения альтернативных вариантов терапии, особенно при латентных формах болезни.
КЛИНИЧЕСКИЕ ПРИМЕРЫ
В практике выхаживания младенцев с сочетанной перинатальной патологией нередки ситуации, при которых затруднительно дифференцировать внутриутробное и постнатальное инфицирование ЦМВИ. В качестве примера представляем две истории болезни детей, находившихся на стационарном лечении.
Тяжелое (генерализованное) течение ЦМВИ.
Исследования на вирусные инфекции, в т.ч. ЦМВИ, в этом периоде не проводились.
Иммуноферментный анализ выявил анти-ЦМВ иммуноглобулина (Ig) G в титре 59 ЕД/мл (при норме
На основании клинико-лабораторных данных установлен диагноз: «Острая генерализованная цитомегаловирусная инфекция (гепатит, интерстициальная пневмония с дыхательной недостаточностью II степени).
После получения разрешения локального независимого этического комитета на использование по жизненным показаниям препарата ганцикловира off-label и оформления матерью информированного согласия на лечение ребенка этим препаратом проведено этиотропное и патогенетическое лечение:
Курс Ганцикловира из расчета 6 мг/кг массы тела 2 раза/сут внутривенно в течение 2 нед, далее по 10 мг/кг 1 раз через сутки на 3 мес;
Курс противоцитомегаловирусного иммуноглобулина — 1 мл/кг каждые 48 ч внутривенно, всего на курс 5 инъекций; кроме того, была продолжена антибактериальная и симптоматическая терапия. На фоне комплексного лечения удалось добиться существенного улучшения состояния ребенка: уменьшились проявления системной воспалительной реакции и гепатоспленомегалии; стало возможным начало энтерального питания; уменьшились проявления буллезного эпидермолиза. Нарос уровень тромбоцитов, результаты определения ДНК ЦМВ методом ПЦР отрицательные, что позволило в возрасте 3,5 мес выполнить хирургическую коррекцию: проведены релапаротомия, разделение спаек, наложение еюностомы. Учитывая отсутствие явных клинических признаков ЦМВИ (в т.ч. тромбоцитопении, гепатоспленомегалии) на первом месяце жизни ребенка и их появление в начале третьего месяца жизни в сочетании с результатами лабораторной диагностики (выявление ДНК ЦМВ в возрасте 3 мес, нарастание титра острого маркера специфического воспаления —анти-ЦМВ IgG) на четвертом месяце жизни, наиболее вероятно предположить постнатальное инфицирование и бурное развитие генерализованной ЦМВ-инфекции у иммунокомпрометированного младенца с генетической патологией; однако, нельзя полностью исключить и отсроченную постнатальную генерализацию латентной в/утробной ЦМВИ.
Латентное течение внутриутробной ЦМВИ
Мальчик С., 5 дней, родился у женщины 25 лет,имевшей до беременности эрозию шейки матки. Беременность первая, с угрозой прерывания в первом триместре, тяжелым гестозом, анемией. Однократно (во втором триместре) перенесла острую респираторную инфекцию. При ультразвуковом исследовании заподозрена добавочная верхняя полая вена у плода (впоследствии не подтвердилось). Обследование женщины на оппортунистические инфекции не проводилось. Роды на 37-й нед с ранним излитием околоплодных вод; масса при рождении 3110 г, длина 52 см, оценка по шкале APGAR 8/9 баллов. В раннем неонатальном периоде состояние мальчика средней тяжести за счет общего угнетения: преобладала мышечная гипотония, снижение безусловно-рефлекторной активности. При ультразвуковом исследовании выявлено левостороннее внутрижелудочковое кровоизлияние I–II степени; отмечались единичные петехии на лице, экхимоз в затылочной области.
Проведен курс лечения противоцитомегаловирусным иммуноглобулином: 3 внутривенных введения из расчета 1 мл/кг каждые 48 ч внутривенно.
Ребенок повторно дважды госпитализировался —в возрасте 2 и 4 мес. На протяжении этого времени у него сохранялась умеренная задержка моторного развития; изменения боковых желудочков мозга по данным нейросонограммы имели тенденцию к уменьшению.
Результаты динамического исследования ПЦР в моче и крови: ДНК ЦМВ не обнаружена. В возрасте 2 мес выполнено исследование коротколатентных слуховых вызванных потенциалов: при интенсивности стимуляции70–80 дБ основные пики слева и справа не определяются, при 90–105 дБ — низкоамплитудные пики определяются неотчетливо. Латентности III и V пиков с двух сторон превышают референсный интервал.
Заключение по результатам исследования коротколатентных слуховых вызванных потенциалов: выраженное нарушение проведения по слуховым структурам ствола мозга — двусторонняя нейросенсорная тугоухость. Проводилась комплексная реабилитация — музыкально-сенсорная стимуляция, механотерапия, сухая иммерсия, кинезитерапия (лечебная физкультура, массаж). Ребенок направлен в сурдологический центр.
Ребенку даны рекомендации: бинауральное протезирование цифровыми многоканальными супермощными слуховыми аппаратами; изготовление индивидуальных ушных вкладышей; консультация сурдопедагога, оценка эффективности настройки слуховых аппаратов (определение показаний к проведению кохлеарной имплантации). Исходя из сроков манифестации поражения слуха, можно предположить, что ребенок был внутриутробно инфицирован ЦМВ, и внутриутробный инфекционный процесс привел к развитию нейросенсорной тугоухости с поражением центральной нервной системы легкой степени и неонатальной тромбоцитопенией.
Прогноз: ребенок нуждается в наблюдении сурдолога и коррекции нарушения слуха, а также в этапной реабилитации в связи с задержкой темпов психомоторного развития.
ОБСУЖДЕНИЕ
В первом из представленных клинических примеров у ребенка с манифестными клиническими проявлениями инфекции наиболее вероятно предположить постнатальную ЦМВИ, поскольку уже на третьем месяце жизни обнаружен острофазный маркер воспаления (анти-ЦМВ IgM) в сочетании с вирусом, выделенным из крови при помощи метода ПЦР. Вместе с тем не исключаются и внутриутробное инфицирование, и отсроченная манифестация на фоне тяжелой сочетанной врожденной (генетической) патологии. Возможно, симптомы бактериальной инфекции (энтероколита) на фоне непроходимости кишечника маскировали характерные проявления врожденной ЦМВИ
- увеличение паренхиматозных органов;
- интоксикацию;
- проявления интерстициальной пневмонии;
С другой стороны, постнатальное инфицирование ЦМВ у ребенка, находившегося длительное время в критическом состоянии, могло произойти либо при контакте с вирусоносителями, либо в стационаре, либо при переливаниях препаратов крови и плазмы. Обследование на специфические внутриутробные инфекции на первом месяце у ребенка не проводилось. Следует отметить, что на фоне этиотропной терапии у младенца не только купировались клинические проявления ЦМВИ (тромбоцитопения, гепатоцитолиз, гепатоспленомегалия, желтуха), но и отмечено явное улучшение состояния кожи и функции желудочно-кишечного тракта. Отрицательные результаты ПЦР на ДНК цитомегаловируса после курса лечения, по мнению некоторых специалистов, являются показателем успешности терапии.
Во втором наблюдении инфицирование у ребенка произошло внутриутробно; инфекционный процесс носил характер латентного или маломанифестного (умеренная желтуха, некоторая тенденция к гипокоагуляции, признаки внутриутробного поражения центральной нервной системы), однако реализовался в нейросенсорных нарушениях слуха, которые не имели тенденции к уменьшению после курса специфической иммунотропной терапии. Тем не менее отрицательные результаты ПЦР в динамике стали основанием для отказа в данной ситуации от терапии ганцикловиром. Известно, что у детей, перенесших генерализованную врожденную ЦМВИ, почти в 50% случаев отмечаются грубые нарушения слуха и психомоторного развития; при латентной форме врожденной ЦМВИ риск поражения слуха существенно ниже — около 7%. Чаще нарушения слуха выявляются уже за пределами периода новорожденности: они могут прогрессировать, периодически уменьшаться или сочетаться с вестибулярными нарушениями. Надежных критериев прогноза развития отдаленных нарушений слуха у детей как при манифестной и тяжелой, так и при латентной ЦМВИ пока не существует. Тем не менее некоторые авторы указывают, что более низкие уровни виремии, определяемые при ПЦР крови, сопряжены с лучшим прогнозом для развития слуха. Так, при обследовании детей в возрасте 6 лет, перенесших латентную врожденную ЦМВИ, установлено, что нейросенсорная тугоухость чаще развивалась у тех из них, у которых при рождении уровень виремии был17 тыс. копий/мл. Проблема этиотропной терапии новорожденных с латентным (бессимптомным) течением ЦМВИ остается дискуссионной. Большинством отечественных и зарубежных исследователей применение ротивовирусных препаратов при этих формах заболевания не рекомендуется. В то же время указывается, что длительная терапия врожденной латентной ЦМВИ с использованием антивирусных препаратов снижает частоту нарушений слуха. В этой связи высказываются предположения по изменению общепринятых подходов в терапии бессимптомных форм инфекции, хотя бы в отношении новорожденных с выявленными при скрининге нарушениями слуха в сочетании с обнаружением ЦМВ методом ПЦР, при этом имеется в виду терапия валганцикловиром.
Таким образом, вопросы лечения младенцев с латентными формами ЦМВИ требуют дальнейшего обсуждения.
В плане профилактики врожденной ЦМВИ заслуживают внимания работы по антенатальному использованию противоцитомегаловирусного иммуноглобулина. Этот препарат применяют курсами в виде внутривенных введений беременным; в последние годы практикуется так-же интраамниотическое введение и введение в сосуды пуповины плода при подтвержденной ЦМВИ. Такая профилактика хорошо переносится внутриутробным ребенком и снижает риск трансплацентарной передачи инфекции.
ЗАКЛЮЧЕНИЕ
Первый из представленных примеров продемонстрировал затруднения при постановке диагноза (внутриутробной или ранней постнальной ЦМВИ) и успешность сочетанной терапии; в то же время вторая история болезни (ребенок с латентной формой ЦМВИ) показала недостаточную эффективность одной лишь иммунозаместительной терапии (как это рекомендовано проектом Российской ассоциации специалистов перинатальной медицины). Возможно, необходима дискуссия об использовании Валганцикловира при высоком риске развития тугоухости вследствие латентной ЦМВИ.
В зарубежных странах принято относить противоцитомегаловирусный иммуноглобулин к средствам специфической профилактики ЦМВИ, но не к средствам терапии уже развившейся инфекции. Следует отметить, что строго доказательных исследований терапевтической эффективности противоцитомегаловирусного иммуноглобулина у детей раннего возраста с ЦМВИ пока нет, тем не менее проект клинических рекомендаций по лечению врожденной ЦМВИ предусматривает лечебное применение противоцитомегаловирусного иммуноглобулина как при манифестных, так и при латентных формах ЦМВИ.
Успешный зарубежный опыт пренатального применения (по сути, лечение внутриутробного ребенка) позволяет предположить, что и постнатально этот препарат может быть использован с лечебной целью при подтвержденной методом полимеразной цепной реакции или иммуноферментным анализом манифестной форме, а так-же при латентной форме инфекции, в первую очередьу новорожденных с выявленными путем аудиоскрининга нарушениями слуха.
Цитомегаловирусная инфекция (ЦМВ-инфекция) у гематологических больных
Среди вирусных инфекций, поражающих больных с нарушениями иммунитета, герпетическим вирусам принадлежит особая роль. С одной стороны, вирусы этой группы часто вызывают тяжелые органные поражения, напрямую угрожающие жизни больного, а с другой — разработанные методы вирусологического мониторинга, профилактической и упреждающей терапии позволяют свести этот риск к минимуму.
В статьях на нашем сайте рассмотрены особенности эпидемиологии и клинической картины инфекций, вызываемых лишь несколькими герпес-вирусами, наиболее часто встречающихся у гематоонкологических больных, а также изложены рациональные подходы к диагностике и лечению этих заболеваний.
Цитомегаловирус (ЦМВ) — один из самых частых вирусных спутников человека. В развитых странах 50—80 % населения в возрасте до 50 лет переносят инаппарантную инфекцию и являются серопозитивными по ЦМВ, в то время как в странах с низким или средним социально-экономическим развитием практически 100 % населения к 30 годам являются серопозитивными. Такая же закономерность наблюдается в различных в отношении материальной обеспеченности слоях населения: при высоком материальном достатке и часто соответствующем ему более высоком культурном уровне средний возраст первичной ЦМВ-контаминации, регистрируемой по сероконверсии, значительно выше, чем при среднем и низком достатке.
Причина этого феномена кроется, по всей вероятности, в менее строгих гигиенических правилах и традициях (например, облизывание матерями детских сосок, пользование одной и той же посудой и столовыми приборами и т. д.).

Главными эффекторами антицитомегаловирусного иммунитета являются вирусспецифические цитотоксические лимфоциты, в то время как все типы антител в лучшем случае играют вспомогательную роль. Отсюда очевидно, что наиболее уязвимой группой в отношении развития тяжелой первичной инфекции или клинически значимой реактивации являются больные с врожденным либо приобретенным (в том числе ятрогенным) дефицитом клеточного иммунитета.
Кроме факта наличия клеточного иммунодефицита, важный фактор риска — его длительность. Классической демонстрацией данного положения является различие в частоте реактивации ЦМВ и развития ЦМВ-синдрома и ЦМВ-пневмонии у реципиентов при трансплантации аллогенного и аутологичного костного мозга. При одинаковой исходной степени иммуносупрессии, но несоизмеримо более короткой ее продолжительности ЦМВ-пневмония, которая развивалась у 30—40 % реципиентов после аллогенной трансплантации костного мозга (ТКМ) до разработки упреждающего или профилактического лечения ганцикловиром, является казуистикой (не более 0,5 %) после аутологичной трансплантации.
Группы риска в отношении развития тяжелой ЦМВ-инфекции:
1) перинатально инфицированные новорожденные (особенно недоношенные);
2) дети с тяжелыми комбинированными врожденными иммунодефицитами;
3) больные СПИДом;
4) реципиенты аллогенной трансплантации гемо-поэтических стволовых клеток;
5) реципиенты солидных органов.
В отношении больных, которым проводят стандартную химиотерапию по поводу лейкозов, лимфом или солидных опухолей, статистики, оценивающей частоту развития ЦМВ-ассоциированных клинических синдромов, не существует, хотя описаны как отдельные случаи, так и небольшие серии тяжелых проявлений ЦМВ-инфекции в данных группах.
Справедливо считать, что развитие клинически значимых симптомов ЦМВ-инфекции теоретически возможно у любого больного после цитотоксической иммуносупрессивной терапии, однако большинство таких больных составляют реципиенты аллогенной ТКМ. Наличие современных специфичных и чувствительных методов быстрой диагностики делают абсолютно неприемлемой эмпирическую терапию не только потому, что такое лечение достаточно дорого и токсично, но и потому, что цена ошибки и соответственно неадекватного лечения при постановке диагноза только по клиническим симптомам слишком велика. Так, на основании клинической картины очень трудно отличить ЦМВ-пневмонию от пневмоцистоза или лучевого пневмонита, а затяжной ЦМВ-гепатит — от хронического гепатолиенального кандидоза.
Как отмечалось, подавляющее большинство взрослых больных и значительный процент детей в нашей стране ЦМВ-серопозитивны, поэтому наблюдать в гематологическом стационаре первичную ЦМВ-инфекцию приходится нечасто. Непосредственная передача ЦМВ от одного больного к другому маловероятна, если больные не вступают в контакт более близкий, чем это предписано больничным режимом. В зависимости от серологического статуса, степени и длительности иммуносупрессии проявления ЦМВ-инфекции у гематологических больных могут быть различными.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Цитомегаловирусная инфекция у детей — это инфекционное заболевание, которое вызвано цитомегаловирусом и поражает слюнные железы, внутренние органы, ЦНС. В детстве патология чаще возникает при трансплацентарном или интранатальном заражении. Локализованные формы проявляются сиаладенитом, гепатитом, нефритом и т. д., распространенный вариант инфекции характеризуется поражением головного мозга, легких, почек и органов ЖКТ. Диагностика предполагает идентификацию возбудителя цитологическими, гистологическими, серологическими и молекулярно-биологическими методами. Лечение цитомегаловирусной болезни проводится специфическим иммуноглобулином и противовирусными препаратами.
МКБ-10
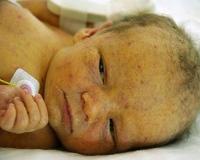
Общие сведения
Заражение цитомегаловирусной инфекцией (ЦМВИ) наблюдается у 20%‒60% всего детского населения, но в большинстве случаев оно протекает бессимптомно. Внутриутробное инфицирование вирусом от больной матери происходит в 30-50% случаев, при этом до 18% младенцев после рождения имеют клинические симптомы. Учитывая полиморфизм клинической картины, ранняя диагностика и лечение у детей затруднены. Цитомегаловирусная инфекция представляет серьезную опасность, особенно для плода и новорожденного, у которых заболевание, как правило, вызывает необратимые осложнения.

Причины
Болезнь вызвана герпесвирусом 5 типа — Cytomegalovirus hominis. Он имеет 6 штаммов: Davis, AD 169, Kerr, C-87, Esp, Towne, причем ребенок может быть инфицирован сразу несколькими подтипами возбудителя. Цитомегаловирус (ЦМВ) имеет ДНК-геном, отличается медленной репликацией и сравнительно низкой вирулентностью. Он термолабилен, уничтожается при температуре более 56°С, но длительно сохраняет жизнеспособность в комнатных условиях.
При врожденной ЦВМИ передача вируса к плоду происходит трансплацентарно, при перинатальной инфекции — путем контакта с вагинальными выделениями матери, грудным молоком или препаратами крови. Риск заражения увеличивается, если мать с острой формой болезни не получает специфическое лечение. В постнатальном периоде ребенок чаще всего заражается от ближайших родственников и сверстников воздушно-капельным или контактно-бытовым путем.
Патогенез
Попадая в кровь, вирус реплицируется в лейкоцитах, моноцитах и макрофагах и в дальнейшем он пожизненно сохраняется в лимфоцитарных органах. Зачастую процесс выражается в виде латентной инфекции, при которой у ребенка нет симптомов, и ему не требуется лечение. Активность цитомегаловируса зависит от состояния иммунитета: при физиологической иммунной недостаточности, которая наблюдается у детей раннего возраста, риск манифестной цитомегаловирусной инфекции возрастает в разы.
Классификация
В детской инфектологии различают врожденную (внутриутробную) и приобретенную формы патологии. По течению инфекция бывает острой (до 3 месяцев), подострой (3-6 месяцев), затяжной (6-12 месяцев) и хронической (более 1 года). По клиническим признакам выделяют локализованный (сиаладенит, нефрит, гепатит, энцефалит) и генерализованный вариант. С учетом тяжести течения цитомегаловирусную болезнь делят на 3 степени:
- Легкая. Отличается незначительными патоморфологическими изменениями во внутренних органах, которые не сказываются на их функциональной активности.
- Среднетяжелая. Проявляется выраженными органическими поражениями в сочетании с клиническими симптомами и расстройством функции некоторых внутренних органов.
- Тяжелая. Манифестирует тяжелыми органическими патологиями, резко выраженной интоксикацией и генерализованным характером поражения.
Симптомы
Врожденная ЦМВИ
У пациентов с манифестной врожденной форме цитомегаловирусной болезни признаки наблюдаются с первых дней жизни. Типичный комплекс симптомов у новорожденных детей включает недоношенность и/или низкую массу тела, поражение гепатобилиарной системы (увеличение печени, желтуха, гепатиты и циррозы), лимфаденопатии и геморрагическую сыпь на коже. Если инфицирование произошло на ранних сроках беременности, ребенок рождается с аномалиями — микроцефалией, гипоплазией легких, атрезией пищевода.
Приобретенная ЦМВИ
Приобретенная цитомегаловирусная болезнь обычно протекает в субклинической или латентной форме, когда у ребенка возникают гриппоподобные симптомы, субфебрильная температура без видимой причины. После заражения инфекция может длительное время себя не проявлять и давать обострения при снижении иммунного статуса, действии неблагоприятных эндо- или экзогенных факторов.
Течение манифестной приобретенной формы напоминает инфекционный мононуклеоз. У ребенка внезапно появляется слабость, повышается температура, беспокоят недомогание, головные боли, отсутствует аппетит. Позже присоединяются сильные боли в горле, увеличиваются подчелюстные и шейные лимфоузлы. Если цитомегаловирусная инфекция проявляется сиаладенитом, наблюдается резкое увеличение и болезненность слюнных желез на фоне фебрильной лихорадки.
Генерализованная ЦМВИ
При генерализованном варианте течения инфекции у детей поражается бронхолегочная система (пневмонии, дыхательная недостаточность), ЖКТ (энтероколит, мальабсорбция), печень (желтуха, цитомегаловирусный гепатит, билиарный цирроз). Особенно опасно вовлечение в процесс нервной системы, что проявляется судорожным синдромом, парезами и параличами, задержкой психомоторного развития.
Осложнения
Поражение клеток при цитомегаловирусной болезни создает благоприятные условия для возникновения аутоиммунных поражений — системной красной волчанки, рассеянного склероза, гломерулонефрита. Иногда после малосимптомной врожденной цитомегаловирусной инфекции осложнения наблюдаются в отдаленном периоде (в возрасте ребенка 2-5 лет). В основном они проявляются неврологическими расстройствами и поражением органов чувств.
Диагностика
Цитомегаловирусная инфекция отличается многообразием клинических признаков и часто протекает под маской других патологий, что затрудняет работу детского инфекциониста. На первичном приеме, помимо стандартного физикального осмотра, врач собирает детальный акушерский анамнез, чтобы выявить факторы риска антенатального инфицирования. Диагноз ЦМВИ правомочен только при лабораторном подтверждении, для чего используют следующие методы:
Инструментальные методы подбираются соответственно форме заболевания. Для оценки структурно-функциональных особенностей печени и билиарного тракта назначают УЗИ органов брюшной полости. КТ и МРТ головного мозга информативны для выявления врожденных пороков и кальцификатов. Рентгенография ОГК необходима при симптомах дыхательных расстройств. По показаниям ребенка направляют на консультации к профильным специалистам— кардиологу, неврологу, отоларингологу.
Лечение цитомегаловирусной инфекции у детей
Препаратом выбора у новорожденных и детей первого года жизни является специфический антицитомегаловирусный иммуноглобулин, который имеет повышенную концентрацию IgG. Лечение начинают при манифестных формах заболевания и проводят по схеме: вначале вводится высокая доза препарата, а спустя 9-10 дней дозировку постепенно уменьшают, контролируя степень ответа на терапию и активность процесса.
В старшем возрасте перечень препаратов, применяемых при цитомегаловирусной инфекции, значительно расширяется. Лечение включает противовирусные средства из группы нуклеозидов и нуклеотидов (ганцикловир, валганцикловир), производные ортофосфорной кислоты (фоскарнет). При легкой и среднетяжелой формах назначают интерфероны, иммуностимуляторы.
Для купирования интоксикации показано обильное питье (при легких формах), при среднетяжелых и тяжелых клинических вариантах рекомендована инфузионная терапия. Патогенетическая терапия подбирается в соответствии с характером течения болезни и может включать пищеварительные ферменты, ингибиторы протеиназ, гемостатики. Для предупреждения вторичных бактериальных осложнений используют антибиотики (макролиды, цефалоспорины, гликопептиды).
Прогноз и профилактика
При малосимптомных приобретенных вариантах цитомегаловирусная болезнь протекает без осложнений, зачастую у ребенка выявляется только латентное носительство. Угрозу для жизни и здоровья представляют тяжелые генерализованные инфекции, которые в 50-60% случаев сопровождаются осложнениями, несмотря на проводимое лечение. Особо опасно поражение цитомегаловирусом для детей с иммунодефицитными состояниями.
Основу профилактики врожденной ЦМВИ составляет обязательное лабораторное обследование женщин на носительство цитомегаловируса, которое проводится при планировании зачатия и во время беременности. Если в семье есть пациент с цитомегаловирусной инфекцией, необходимо ограничить его общение с ребенком и обеспечить лечение. Карантинно-изоляционные мероприятия в отношении заболевших и контактных лиц не производятся.
2. Клинические рекомендации (протокол лечения) оказания медицинской помощи детям больным цитомегаловирусной инфекцией. — 2015.
Цитомегалия – это инфекционное заболевание вирусного генеза, передающееся половым, трансплацентарным, бытовым, гемотрансфузионным путем. Симптоматически протекает в форме упорной простуды. Отмечается слабость, недомогание, головные и суставные боли, насморк, увеличение и воспаление слюнных желез, обильное слюноотделение. Часто протекает бессимптомно. Опасна цитомегалия беременных: она может вызывать самопроизвольный выкидыш, врожденные пороки развития, внутриутробную гибель плода, врожденную цитомегалию. Диагностика осуществляется лабораторными методами (ИФА, ПЦР). Лечение включает противовирусную и симптоматическую терапию.
МКБ-10
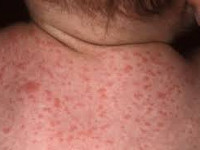
Общие сведения
Другие названия цитомегалии, встречающиеся в медицинских источниках, - цитомегаловирусная инфекция (ЦМВ), инклюзионная цитомегалия, вирусная болезнь слюнных желез, болезнь с включениями. Цитомегалия является широко распространенной инфекцией, и многие люди, являясь носителями цитомегаловируса, даже не подозревают об этом. Наличие антител к цитомегаловирусу выявляется у 10—15% населения в подростковом возрасте и у 50% взрослых людей. По некоторым источникам, носительство цитомегаловируса определяется у 80% женщин детородного периода. В первую очередь это относится к бессимптомному и малосимптомному течению цитомегаловирусной инфекции.

Причины
- воздушно-капельным: при чихании, кашле, разговоре, поцелуях и т.д.;
- половым путем: при сексуальных контактах через сперму, влагалищную и шеечную слизь;
- гемотрансфузионным: при переливании крови, лейкоцитарной массы, иногда - при пересадке органов и тканей;
- трансплацентарным: во время беременности от матери плоду.
Нередко цитомегаловирус находится в организме многие годы и может ни разу не проявить себя и не нанести вреда человеку. Проявление скрытой инфекции происходит, как правило, при ослаблении иммунитета. Угрожающую по своим последствиям опасность цитомегаловирус представляет у лиц со сниженным иммунитетом (ВИЧ-инфицированных, перенесших трансплантацию костного мозга или внутренних органов, принимающих иммунодепрессанты), при врожденной форме цитомегалии, у беременных.
Патогенез
Попадая в кровь, цитомегаловирус вызывает выраженную иммунную реакцию, проявляющуюся в выработке защитных белковых антител – иммуноглобулинов М и G (IgM и IgG) и противовирусной клеточной реакцией - образованием лимфоцитов CD 4 и CD 8. Угнетение клеточного иммунитета при ВИЧ-инфекции приводит к активному развитию цитомегаловируса и вызываемой им инфекции.
Даже при бессимптомном течении инфекции носитель цитомегаловируса является потенциально заразным для неинфицированных лиц. Исключение составляет внутриутробный путь передачи цитомегаловируса от беременной женщины плоду, который происходит в основном при активном течении процесса, и лишь в 5% случаев вызывает врожденную цитомегалию, в остальных же носит бессимптомный характер.
Симптомы цитомегалии
Врожденная цитомегалия
В 95% случаев внутриутробное инфицирование плода цитомегаловирусом не вызывает развития заболевания, а протекает бессимптомно. Врожденная цитомегаловирусная инфекция развивается у новорожденных, матери которых перенесли первичную цитомегалию. Врожденная цитомегалия может проявляться у новорожденных в различных формах:
- петехиальная сыпь – мелкие кожные кровоизлияния - встречается у 60-80% новорожденных;
- недоношенность и задержка внутриутробного развития плода - встречается у 30% новорожденных;
- желтуха;
- хориоретинит – острый воспалительный процесс в сетчатке глаза, часто вызывающий снижение и полную потерю зрения.
Летальность при внутриутробном инфицировании цитомегаловирусом достигает 20-30%. Из выживших детей большая часть имеет отставание в умственном развитии или инвалидность по слуху и зрению.
Приобретенная цитомегалия у новорожденных
При инфицировании цитомегаловирусом в процессе родов (при прохождении плода по родовым путям) или в послеродовом периоде (при бытовом контакте с инфицированной матерью или грудном вскармливании) в большинстве случаев развивается бессимптомное течение цитомегаловирусной инфекции. Однако у недоношенных младенцев цитомегаловирус может вызывать затяжную пневмонию, к которой часто присоединяется сопутствующая бактериальная инфекция. Часто при поражении цитомегаловирусом у детей отмечается замедление в физическом развитии, увеличение лимфоузлов, гепатит, сыпь.
Мононуклеозоподобный синдром
У лиц, вышедших из периода новорожденности и имеющих нормальный иммунитет, цитомегаловирус может вызывать развитие мононуклеозоподобного синдрома. Течение мононуклеазоподобного синдрома по клинике не отличается от инфекционного мононуклеоза, вызываемого другой разновидностью герпесвируса – вирусом Эбштейна-Барр. Течение мононуклеозоподобного синдрома напоминает упорную простудную инфекцию. При этом отмечается:
- длительная (до 1 месяца и более) лихорадка с высокой температурой тела и ознобами;
- ломота в суставах и мышцах, головная боль;
- выраженные слабость, недомогание, утомляемость;
- боли в горле;
- увеличение лимфоузлов и слюнных желез;
- кожные высыпания, напоминающие сыпь при краснухе (обычно встречается при лечении ампициллином).
В отдельных случаях мононуклеозоподобный синдром сопровождается развитием гепатита – желтухой и повышением в крови печеночных ферментов. Еще реже (до 6% случаев) осложнением мононуклеозоподобного синдрома служит пневмония. Однако у лиц с нормальной иммунной реактивностью она протекает без клинических проявлений, выявляясь лишь при проведении рентгенографии легких.
Длительность течения мононуклеозоподобного синдрома составляет от 9 до 60 дней. Затем обычно наступает полное выздоровление, хотя на протяжении нескольких месяцев могут сохраняться остаточные явления в виде недомогания, слабости, увеличенных лимфоузлов. В редких случаях активизация цитомегаловируса вызывает рецидивы инфекции с лихорадкой, потливостью, приливами и недомоганием.
Цитомегаловирусная инфекция у лиц с ослабленным иммунитетом
Ослабление иммунитета наблюдается у лиц, страдающих синдромом врожденного и приобретенного (СПИД) иммунодефицита, а также у пациентов, перенесших пересадку внутренних органов и тканей: сердца, легкого, почки, печени, костного мозга. После пересадки органов пациенты вынуждены постоянно принимать иммунодепрессанты, ведущие к выраженному подавлению иммунных реакций, что вызывает активность цитомегаловируса в организме.
У пациентов, перенесших трансплантацию органов, цитомегаловирус вызывает поражение донорских тканей и органов (гепатит – при пересадке печени, пневмонию при пересадке легкого и т. д.). После трансплантации костного мозга у 15-20% пациентов цитомегаловирус может привести к развитию пневмонии с высокой летальностью (84-88%). Наибольшую опасность представляет ситуация, когда инфицированный цитомегаловирусом донорский материал пересажен неинфицированному реципиенту.
Цитомегаловирус поражает практически всех ВИЧ-инфицированных. В начале заболевания отмечаются недомогание, суставные и мышечные боли, лихорадка, ночная потливость. В дальнейшем к этим признакам могут присоединяться поражения цитомегаловирусом легких (пневмония), печени (гепатит), мозга (энцефалит), сетчатки глаза (ретинит), язвенные поражения и желудочно-кишечные кровотечения.
У мужчин цитомегаловирусом могут поражаться яички, простата, у женщин – шейка матки, внутренний слой матки, влагалище, яичники. Осложнениями цитомегаловирусной инфекции у ВИЧ-инфицированных могут стать внутренние кровотечения из пораженных органов, потеря зрения. Множественное поражение органов цитомегаловирусом может привести к их дисфункции и гибели пациента.
Диагностика
С целью диагностики цитомегаловирусной инфекции проводится лабораторное обследование. Постановка диагноза цитомегаловирусной инфекции основана на выделении цитомегаловируса в клиническом материале или при четырехкратном повышении титра антител.
- ИФА-диагностика. Включает определение в крови специфических антител к цитомегаловирусу - иммуноглобулинов М и G. Наличие иммуноглобулинов М может свидетельствовать о первичном заражении цитомегаловирусом либо о реактивации хронической ЦМВИ. Определение высоких титров IgМ у беременных может угрожать инфицированию плода. Повышение IgМ выявляется в крови спустя 4-7 недель после заражения цитомегаловирусом и наблюдается на протяжении 16-20 недель. Повышение иммуноглобулинов G развивается в период затухания активности цитомегаловирусной инфекции. Их наличие в крови говорит о присутствии цитомегаловируса в организме, но не отражает активности инфекционного процесса.
- ПЦР-диагностика. Для определения ДНК цитомегаловируса в клетках крови и слизистых (в материалах соскобов из уретры и цервикального канала, в мокроте, слюне и т. д.) используется метод ПЦР-диагностики (полимеразной цепной реакции). Особенно информативно проведение количественной ПЦР, дающей представление об активности цитомегаловируса и вызываемого им инфекционного процесса.
В зависимости от того, какой орган поражен цитомегаловирусной инфекцией, пациент нуждается в консультации гинеколога, андролога, гастроэнтеролога или других специалистов. Дополнительно по показаниям проводится УЗИ органов брюшной полости, кольпоскопия, гастроскопия, МРТ головного мозга и другие обследования.
Лечение цитомегаловирусной инфекции
Неосложненные формы мононуклеазоподобного синдрома не требует специфической терапии. Обычно проводятся мероприятия, идентичные лечению обычного простудного заболевания. Для снятия симптомов интоксикации, вызываемой цитомегаловирусом, рекомендуется пить достаточное количество жидкости.
Лечение цитомегаловирусной инфекции у лиц, входящих в группу риска, проводится противовирусным препаратом ганцикловиром. В случаях тяжелого течения цитомегалии ганцикловир вводится внутривенно, т. к. таблетированные формы препарата обладают лишь профилактическим эффектом в отношении цитомегаловируса. Поскольку ганцикловир обладает выраженными побочными эффектами (вызывает угнетение кроветворения - анемию, нейтропению, тромбоцитопению, кожные реакции, желудочно-кишечные расстройства, повышение температуры и ознобы и др.), его применение ограничено у беременных, детей и у людей, страдающих почечной недостаточностью (только по жизненным показаниям), он не используется у пациентов без нарушения иммунитета.
Для лечения цитомегаловируса у ВИЧ-инфицированных наиболее эффективен препарат фоскарнет, также обладающий рядом побочных эффектов. Фоскарнет может вызывать нарушение электролитного обмена (снижение в плазме крови магния и калия), изъязвление половых органов, нарушение мочеиспускания, тошноту, поражение почек. Данные побочные реакции требуют осторожного применения и своевременной корректировки дозы препарата.
Прогноз
Особую опасность цитомегаловирус представляет при беременности, так как может провоцировать выкидыш, мертворождение или вызывать тяжелые врожденные уродства у ребенка. Поэтому цитомегаловирус, наряду с герпесом, токсоплазмозом и краснухой, относится к числу тех инфекций, обследоваться на которые женщины должны профилактически, еще на этапе планирования беременности.
Профилактика
Особенно остро вопрос профилактики цитомегаловирусной инфекции стоит у лиц, входящих в группу риска. Наиболее подвержены инфицированию цитомегаловирусом и развитию заболевания ВИЧ-инфицированные (особенно больные СПИДом), пациенты после трансплантации органов и лица с иммунодефицитом иного генеза.
Неспецифические методы профилактики (например, соблюдение личной гигиены) неэффективны в отношении цитомегаловируса, так как заражение им возможно даже воздушно-капельным путем. Специфическая профилактика цитомегаловирусной инфекции проводится ганцикловиром, ацикловиром, фоскарнетом среди пациентов, входящих в группы риска. Также для исключения возможности инфицирования цитомегаловирусом реципиентов при пересадке органов и тканей необходим тщательный подбор доноров и контроль донорского материала на наличие цитомегаловирусной инфекции.
Читайте также:

