Цитомегаловирусная инфекция у новорожденного что это такое
Обновлено: 25.04.2024
ЦМВИ у детей. Что делать если у ребенка обнаружили цитомегаловирусную инфекцию?
Цитомегаловирусная инфекция (ЦМВИ) во многом остается "темной лошадкой" для современных инфекционистов. Обладателям вируса-возбудителя в теории может быть кто угодно, но далеко не каждый об этом догадывается. Дело обстоит таким образом, во-первых, потому что довольно часто носительство бывает бессимптомным, во-вторых, в связи с тем что возможности передачи вируса весьма широкие. Возбудитель ЦМВИ попадает в организм через плаценту, вертикально (когда плод проходит через родовые пути), при грудном вскармливании с молоком, при переливании крови и в процессе полового контакта. В отношении детей большую роль играют первые три способа передачи вируса.
Цитомегаловирус в организме может вести себя по-разному, собственно, именно это во многом затрудняет его диагностику. Как уже говорилось выше, он может вообще никак себя не проявлять, но лишь при одном условии - прочной и хорошо функционирующей иммунной системе, которая активное размножение вируса в клетках организма может подавить. Однако в условиях иммунодефицита этот вирус становится по-настоящему опасен. Поэтому от него страдают помимо больных СПИДом и людей пожилого возраста еще и дети.
ЦМВИ выявляется особенно часто у детей до двух лет - это период становления иммунитета ребенка. Его иммунная система не в столько в дефиците, сколько супрессирована, то есть в некоторой степени подавлена, особенно на первых месяцах жизни. Таким образом природа защищает новорожденного от чрезмерно сильных реакций иммунитета на огромное множество чужеродных агентов. После года та защита, которую малыш получал с молоком матери, начинает исчезать, а свои противовирусные частицы вырабатываться в должной мере пока не могут. В связи с этим дети нередко страдают от ЦМВИ.

Проявления ЦМВИ достаточно широко варьируют, так как вирус способен проникать практически во все клетки организма и вызывать цитопатический эффект. Проще говоря, клетки меняются и утрачивают способность нормально функционировать. Что говорит о врожденной ЦМВИ, которую ребенок получил либо через плаценту еще в утробе, либо в процессе родов?
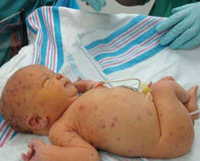
1. У таких детей имеется желтушность кожных покров и склер глаз. Печень значительно увеличена, так как цитомегаловирус имеет склонность поселяться сразу в клетки этого органа.
2. Из-за нарушения работы печени страдает и свертываемость крови, на основании этого дети с ЦМВИ страдают от повышенной кровоточивости (на коже появляются синячки, сыпь, плохо заживает пупочная ранка, кровь может появиться в стуле).
3. Также значительно увеличивается селезенка.
4. Помимо этого есть ряд других признаков: страдают легкие (вплоть до развития пневмонии), нарушена центральная нервная система (менингит, энцефалит, гидроцефалия характеризуются судорогами, повышенной возбудимостью). Изменено состояние органов ЖКТ, что характеризуется колитами, энтеритами, недостаточностью поджелудочной железы. Вирус не обходит стороной и почки, приводя к развитию нефрита.
К сожалению, выхаживать таких новорожденных чрезвычайно трудно, ведь на фоне такого "букета" к ослабленному организму присоединяются другие инфекционные заболевания. Поэтому тяжело текущие ЦМВИ часто заканчиваются гибелью новорожденного еще в первые недели его жизни, либо вовсе приводят к выкидышу, если женщина заразилась на ранних сроках беременности.
К счастью, такое тяжелое течение заболевания бывает далеко не у всех новорожденных (всего у 10 %), так что причина тяжести ЦМВИ в этом случае во многом остается загадкой. Те же дети, которые относительно легко переживают инфекцию, нередко впервые сталкиваются с ней через месяц-два после рождения. И в этом случае симптомы могут быть самыми разными. Обычно снижается слух или зрение, нарушается работа нервной системы, страдает физическое развитие. Вот с такими проблемами родители приходят к педиатру, и установить истинную причину - ЦМВИ удается не всегда.
Стоит помнить о и передаче вируса ребенку с материнским молоком. Когда инфицирование происходит таким путем, у ребенка часто возникает пневмония, которая лечению антибактериальными препаратами не поддается.

Дети старшего возраста и подростки с ЦМВИ сталкиваются еще реже в силу прочности их иммунной системы. Но если вирус все же активизировался, то проявляет он себя обычно снижением работоспособности, болью в суставах, лихорадкой и головными болями. Вывод таков, что по одним признакам установить наличие ЦМВ невозможно, всегда требуется лабораторное подтверждение. Оно заключается в поиске специфических антител, которые наш организм вырабатывает в ответ на наличие конкретных вирусных частиц. Есть специфические антитела - есть и вирус. Что же делать, если у ребенка обнаружили ЦМВИ?
1. Обнаружение ЦМВИ возможно еще в процессе беременности, посредством УЗИ, ведь вирус может приводить к формированию множественных видимых пороков у плода. Поскольку такие дети в будущем практически не жизнеспособны, беременность предлагается прервать.
2. В том случае, когда ЦМВИ выявляется у ребенка через некоторое время после рождения (не в первые дни), тактика врача будет зависеть от течения инфекционного процесса. Есть конкретные лекарственные средства, которые назначают для подавления ЦМВ - Ганцикловир, Фоскарнет. Однако принимать решение об их применении самостоятельно нельзя, так как эти лекарственные средства обладают рядом очень серьезных побочных эффектов. Они негативно сказываются на состоянии крови и токсичны для почек. В связи с этим их применяют только при острой необходимости, когда цитомегаловирус выходит из-под контроля. Новый препарат Цитотект, тоже подходит для лечения ЦМВИ, но вводится он также исключительно по назначению специалиста.
3. Нужно добиваться, чтобы признаки ЦМВИ не появлялись у ребенка. А для этого очень важно укреплять его иммунитет, который самостоятельно способен подавлять вирус и не давать ему негативно влиять на здоровье малыша. Есть множество природных иммуностимуляторов, которые разрешено давать детям (настойка эхинацеи, элеутерококка), Иммунал, Иммудон и другие средства, которые можно использовать курсами после консультации у педиатра с целью улучшения работы иммунной системы. Не последнюю роль играет питание. Не забывайте, что оно должно привносить в организм нужное количество белков, углеводов и жиров, микроэлементов, витаминов. Следите за тем, чтобы ребенок соблюдал режим, не переутомлялся, регулярно бывал на свежем воздухе и физически был активен.
- Вернуться в оглавление раздела "Микробиология"
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Врожденная цитомегалия – инфекционное заболевание, которое развивается при внутриутробном или интранатальном заражении ребенка цитомегаловирусом и характеризуется множественными пороками и поражениями внутренних органов. Заболевание часто протекает бессимптомно, при выраженной клинике основными симптомами являются поражения мозга (энцефалопатии, микроцефалия, гидроцефалия и др.), гепатит, пневмония, нефрит, сиалоаденит, патология органов зрения и слуха. Врожденная цитомегалия диагностируется методами ИФА и ПЦР, вирус обнаруживается в крови, моче, мазке из горла. Основа специфического лечения – антицитомегаловирусный иммуноглобулин.
Общие сведения
Врожденная цитомегалия – наиболее часто встречающаяся врожденная инфекция. Частота заболевания среди новорожденных – 0,2-2,5%. Если беременная женщина переносит первичную цитомегаловирусную инфекцию, вероятность заболевания ребенка колеблется от 30 до 50%. В случае вторичной инфекции у матери заражение плода встречается крайне редко и составляет 1% случаев. Врожденная цитомегалия является актуальной проблемой для педиатрии. В настоящее время заболеваемость значительно возросла. Очень часто имеет место запоздалая диагностика в связи с отсутствием клинических проявлений сразу после рождения ребенка. Огромное внимание уделяется вопросу ранней профилактики заболевания. Проводится обучение медицинского персонала, меняются стандарты обследования беременных и новорожденных. Своевременно начатая терапия позволяет значительно снизить уровень инвалидности среди детей, перенесших врожденную цитомегалию. Активно ведется разработка вакцины против цитомегаловируса.

Причины врожденной цитомегалии
Причина инфекции – ДНК-содержащий вирус цитомегалии, относящийся к семейству герпес-вирусов. Во внешней среде вирус устойчив при комнатной температуре, однако не выдерживает воздействия 20% раствора этилового спирта и других дезинфектантов. Возбудитель цитомегалии способен выживать внутри клетки в течение многих лет. Риск инфицирования женщины повышается, если во время беременности она контактирует с больными цитомегалией, работает в местах большого скопления людей (детские сады, школы, медицинские учреждения). Особую роль играет иммунитет самой матери. Например, если женщина уже перенесла цитомегаловирусную инфекцию прежде, то при повторной активации вируса во время беременности ребенок с большой долей вероятности родится неинфицированным.
Инфицирование ребенка возможно пренатально (трансплацентарным путем) и интранатально, то есть при прохождении через родовые пути. Второй вариант встречается значительно чаще. С кровотоком возбудитель разносится ко всем тканям и органам. Вирус высокотропен к клеткам слюнных желез, именно в эти клетки он внедряется в первую очередь. Чаще всего его обнаруживают в околоушных слюнных железах, реже – в подчелюстных и других. В выводных протоках слюнных желез вирус может долгое время размножаться, не выходя за их пределы. Вирус специфическим образом изменяет клетки, и эти изменения легко обнаружить при микроскопии. Пораженные клетки значительно увеличиваются в размерах и содержат скопления вируса (видимые под микроскопом включения). Такие клетки называют цитомегалами. Кроме слюнных желез, поражаются многие другие органы, в основном, паренхиматозные: печень, почки, поджелудочная железа. Для врожденной цитомегалии характерно поражение головного мозга.
Классификация врожденной цитомегалии
Различают локализованную и генерализованную форму врожденной цитомегалии, однако такое разделение условно, поскольку при малейшем снижении иммунитета у плода инфекция приобретает генерализованное течение. Врожденная цитомегалия может быть острой, затяжной и хронической. При острой и затяжной формах наблюдаются характерные симптомы; если процесс хронический, он может диагностироваться только по вирусемии. Некоторые авторы отдельно выделяют гепатолиенальную, легочную, мозговую и кишечную форму инфекции, однако поскольку врожденная цитомегалия часто сопровождается симптомами со стороны нескольких органов, данная классификация также условна.
Симптомы врожденной цитомегалии
Если заражение женщины происходит на ранних сроках гестации, то беременность может закончиться выкидышем или внутриутробной гибелью плода. При рождении инфицированного ребенка в 90% случаев врожденная цитомегалия протекает бессимптомно (субклинически). На манифестную форму приходится около 10% наблюдений, однако уровень смертности при клинически выраженной форме заболевания достигает 10-30%. Манифестная форма инфекции сопровождается триадой симптомов: желтуха, геморрагический синдром и гепатоспленомегалия. С рождения выявляется петехиальная сыпь по всему телу, кровоизлияния в кожу и слизистые оболочки, кровь в стуле. Геморрагический синдром самостоятельно проходит через 1-2 недели после рождения.
Отличие врожденной цитомегалии от приобретенной – обязательное поражение головного мозга. У новорожденного может диагностироваться энцефалопатия, микроцефалия, гидроцефалия, часто отмечаются судороги и тремор. Иногда при манифестной форме заболевания развивается энцефалит с последующим образованием кальцификатов в головном мозге. Со стороны других органов нередко диагностируется пневмония, поражение почек, гепатит, сиалоаденит, ретинопатия, поражение органа слуха. Частота сенсоневральной тугоухости составляет, по разным данным, от 10 до 25% случаев. Реже выявляются врожденные пороки сердца: дефекты межпредсердной и межжелудочковой перегородки, пороки развития клапанов (аортального, митрального, легочной артерии).
Характерным признаком заболевания является низкая масса тела ребенка. В 30% случаев дети рождаются недоношенными. В дальнейшем нарастает гипотрофия, что также требует специального лечения. Поражение мозга впоследствии приводит к задержке психомоторного развития и олигофрении. Минимальная мозговая дисфункция имеет место, даже если мозговые нарушения не выявлялись в период новорожденности и первых лет жизни. Тяжелое течение цитомегаловирусного гепатита, как правило, приводит к билиарному циррозу печени в возрасте от 6 до 12 месяцев.
Диагностика врожденной цитомегалии
Пренатальная диагностика проводится в том случае, если будущая мать переносит цитомегаловирусную инфекцию в период беременности. Однако это лишь позволяет выявить у плода патологии, сопутствующие инфекции, но не само заболевание. Если врожденная цитомегалия была заподозрена еще во время беременности, то у новорожденного обязательно производится забор крови для исключения или подтверждения диагноза. Это важный момент, поскольку после рождения симптомы инфекции в большинстве случаев отсутствуют. Поэтому лабораторные исследования играют огромную роль в диагностике врожденной цитомегалии.
Диагноз ставится при обнаружении в крови и моче непосредственно частиц вируса (ПЦР), а также признаков иммунного ответа на вирусемию, то есть антител IgM и IgG (метод ИФА). Основные сложности диагностики связаны с тем, что антитела обнаруживаются в крови новорожденного, даже если заболевание было у его матери во время беременности, а сам малыш при этом не был инфицирован. Обнаруженные антитела в этом случае могут быть материнскими. Поэтому ИФА-исследование проводится в динамике. Для подтверждения диагноза необходимо повышение титра IgG-антител не менее чем в 4 раза в повторном анализе, который выполняется через неделю после первого.
Врожденная цитомегалия также диагностируется с помощью метода ПЦР. Обнаружение ДНК вируса в крови подтверждает заражение на 100%. Минус данного метода – его длительность. Кроме того, вирусемия не является достоверным признаком активности инфекции. ПЦР-диагностика позволяет подтвердить заключение ИФА, поэтому используется в совокупности с другими методами.
В связи с частым бессимптомным течением врожденной цитомегалии важную роль играют стандарты диагностики. Заболевание новорожденного обязательно исключается педиатром, если мать переносила во время беременности цитомегалию или мононуклеозоподобные заболевания, либо имеет в анамнезе случаи выкидышей или мертворождения. Основная цель диагностики – раннее выявление заболевания. Чем раньше начато лечение, тем лучше дальнейший прогноз для ребенка.
Лечение и профилактика врожденной цитомегалии
Назначение терапии возможно только после точной диагностики заболевания. Это очень важный момент, потому что проведение лечения без подтвержденного диагноза может навредить ребенку. Лечение проводится строго в условиях стационара. Применяется специфический антицитомегаловирусный иммуноглобулин. Препарат содержит антитела против цитомегаловируса. Попадая в кровь, они связываются с частицами вируса и инактивируют их. Помимо специфической терапии, используются препараты интерферона и индукторы интерферона. Проводится симптоматическая терапия гепатита, нефрита, мозговых нарушений и других сопутствующих патологий. Лечение считается успешным, если вирус не обнаруживается в крови.
Профилактика врожденной цитомегалии у ребенка начинается с первых дней беременности. Будущей маме важно полностью исключить контакты с больными цитомегаловирусной инфекцией, а также избегать мест большого скопления людей. Если заражение вирусом уже случилось, очень важно, как можно раньше это обнаружить. С целью снижения риска передачи вируса от матери к ребенку используется антицитомегаловирусный иммуноглобулин, который вводится внутривенно беременной женщине. Для повышения противовирусного иммунитета также используются индукторы интерферона. Специфическая профилактика (вакцина) в настоящее время находится в стадии разработки и клинических исследований.
Цитомегаловирусная инфекция у детей — это инфекционное заболевание, которое вызвано цитомегаловирусом и поражает слюнные железы, внутренние органы, ЦНС. В детстве патология чаще возникает при трансплацентарном или интранатальном заражении. Локализованные формы проявляются сиаладенитом, гепатитом, нефритом и т. д., распространенный вариант инфекции характеризуется поражением головного мозга, легких, почек и органов ЖКТ. Диагностика предполагает идентификацию возбудителя цитологическими, гистологическими, серологическими и молекулярно-биологическими методами. Лечение цитомегаловирусной болезни проводится специфическим иммуноглобулином и противовирусными препаратами.
МКБ-10
Общие сведения
Заражение цитомегаловирусной инфекцией (ЦМВИ) наблюдается у 20%‒60% всего детского населения, но в большинстве случаев оно протекает бессимптомно. Внутриутробное инфицирование вирусом от больной матери происходит в 30-50% случаев, при этом до 18% младенцев после рождения имеют клинические симптомы. Учитывая полиморфизм клинической картины, ранняя диагностика и лечение у детей затруднены. Цитомегаловирусная инфекция представляет серьезную опасность, особенно для плода и новорожденного, у которых заболевание, как правило, вызывает необратимые осложнения.

Причины
Болезнь вызвана герпесвирусом 5 типа — Cytomegalovirus hominis. Он имеет 6 штаммов: Davis, AD 169, Kerr, C-87, Esp, Towne, причем ребенок может быть инфицирован сразу несколькими подтипами возбудителя. Цитомегаловирус (ЦМВ) имеет ДНК-геном, отличается медленной репликацией и сравнительно низкой вирулентностью. Он термолабилен, уничтожается при температуре более 56°С, но длительно сохраняет жизнеспособность в комнатных условиях.
При врожденной ЦВМИ передача вируса к плоду происходит трансплацентарно, при перинатальной инфекции — путем контакта с вагинальными выделениями матери, грудным молоком или препаратами крови. Риск заражения увеличивается, если мать с острой формой болезни не получает специфическое лечение. В постнатальном периоде ребенок чаще всего заражается от ближайших родственников и сверстников воздушно-капельным или контактно-бытовым путем.
Патогенез
Попадая в кровь, вирус реплицируется в лейкоцитах, моноцитах и макрофагах и в дальнейшем он пожизненно сохраняется в лимфоцитарных органах. Зачастую процесс выражается в виде латентной инфекции, при которой у ребенка нет симптомов, и ему не требуется лечение. Активность цитомегаловируса зависит от состояния иммунитета: при физиологической иммунной недостаточности, которая наблюдается у детей раннего возраста, риск манифестной цитомегаловирусной инфекции возрастает в разы.
Классификация
В детской инфектологии различают врожденную (внутриутробную) и приобретенную формы патологии. По течению инфекция бывает острой (до 3 месяцев), подострой (3-6 месяцев), затяжной (6-12 месяцев) и хронической (более 1 года). По клиническим признакам выделяют локализованный (сиаладенит, нефрит, гепатит, энцефалит) и генерализованный вариант. С учетом тяжести течения цитомегаловирусную болезнь делят на 3 степени:
- Легкая. Отличается незначительными патоморфологическими изменениями во внутренних органах, которые не сказываются на их функциональной активности.
- Среднетяжелая. Проявляется выраженными органическими поражениями в сочетании с клиническими симптомами и расстройством функции некоторых внутренних органов.
- Тяжелая. Манифестирует тяжелыми органическими патологиями, резко выраженной интоксикацией и генерализованным характером поражения.
Симптомы
Врожденная ЦМВИ
У пациентов с манифестной врожденной форме цитомегаловирусной болезни признаки наблюдаются с первых дней жизни. Типичный комплекс симптомов у новорожденных детей включает недоношенность и/или низкую массу тела, поражение гепатобилиарной системы (увеличение печени, желтуха, гепатиты и циррозы), лимфаденопатии и геморрагическую сыпь на коже. Если инфицирование произошло на ранних сроках беременности, ребенок рождается с аномалиями — микроцефалией, гипоплазией легких, атрезией пищевода.
Приобретенная ЦМВИ
Приобретенная цитомегаловирусная болезнь обычно протекает в субклинической или латентной форме, когда у ребенка возникают гриппоподобные симптомы, субфебрильная температура без видимой причины. После заражения инфекция может длительное время себя не проявлять и давать обострения при снижении иммунного статуса, действии неблагоприятных эндо- или экзогенных факторов.
Течение манифестной приобретенной формы напоминает инфекционный мононуклеоз. У ребенка внезапно появляется слабость, повышается температура, беспокоят недомогание, головные боли, отсутствует аппетит. Позже присоединяются сильные боли в горле, увеличиваются подчелюстные и шейные лимфоузлы. Если цитомегаловирусная инфекция проявляется сиаладенитом, наблюдается резкое увеличение и болезненность слюнных желез на фоне фебрильной лихорадки.
Генерализованная ЦМВИ
При генерализованном варианте течения инфекции у детей поражается бронхолегочная система (пневмонии, дыхательная недостаточность), ЖКТ (энтероколит, мальабсорбция), печень (желтуха, цитомегаловирусный гепатит, билиарный цирроз). Особенно опасно вовлечение в процесс нервной системы, что проявляется судорожным синдромом, парезами и параличами, задержкой психомоторного развития.
Осложнения
Поражение клеток при цитомегаловирусной болезни создает благоприятные условия для возникновения аутоиммунных поражений — системной красной волчанки, рассеянного склероза, гломерулонефрита. Иногда после малосимптомной врожденной цитомегаловирусной инфекции осложнения наблюдаются в отдаленном периоде (в возрасте ребенка 2-5 лет). В основном они проявляются неврологическими расстройствами и поражением органов чувств.
Диагностика
Цитомегаловирусная инфекция отличается многообразием клинических признаков и часто протекает под маской других патологий, что затрудняет работу детского инфекциониста. На первичном приеме, помимо стандартного физикального осмотра, врач собирает детальный акушерский анамнез, чтобы выявить факторы риска антенатального инфицирования. Диагноз ЦМВИ правомочен только при лабораторном подтверждении, для чего используют следующие методы:
Инструментальные методы подбираются соответственно форме заболевания. Для оценки структурно-функциональных особенностей печени и билиарного тракта назначают УЗИ органов брюшной полости. КТ и МРТ головного мозга информативны для выявления врожденных пороков и кальцификатов. Рентгенография ОГК необходима при симптомах дыхательных расстройств. По показаниям ребенка направляют на консультации к профильным специалистам— кардиологу, неврологу, отоларингологу.
Лечение цитомегаловирусной инфекции у детей
Препаратом выбора у новорожденных и детей первого года жизни является специфический антицитомегаловирусный иммуноглобулин, который имеет повышенную концентрацию IgG. Лечение начинают при манифестных формах заболевания и проводят по схеме: вначале вводится высокая доза препарата, а спустя 9-10 дней дозировку постепенно уменьшают, контролируя степень ответа на терапию и активность процесса.
В старшем возрасте перечень препаратов, применяемых при цитомегаловирусной инфекции, значительно расширяется. Лечение включает противовирусные средства из группы нуклеозидов и нуклеотидов (ганцикловир, валганцикловир), производные ортофосфорной кислоты (фоскарнет). При легкой и среднетяжелой формах назначают интерфероны, иммуностимуляторы.
Для купирования интоксикации показано обильное питье (при легких формах), при среднетяжелых и тяжелых клинических вариантах рекомендована инфузионная терапия. Патогенетическая терапия подбирается в соответствии с характером течения болезни и может включать пищеварительные ферменты, ингибиторы протеиназ, гемостатики. Для предупреждения вторичных бактериальных осложнений используют антибиотики (макролиды, цефалоспорины, гликопептиды).
Прогноз и профилактика
При малосимптомных приобретенных вариантах цитомегаловирусная болезнь протекает без осложнений, зачастую у ребенка выявляется только латентное носительство. Угрозу для жизни и здоровья представляют тяжелые генерализованные инфекции, которые в 50-60% случаев сопровождаются осложнениями, несмотря на проводимое лечение. Особо опасно поражение цитомегаловирусом для детей с иммунодефицитными состояниями.
Основу профилактики врожденной ЦМВИ составляет обязательное лабораторное обследование женщин на носительство цитомегаловируса, которое проводится при планировании зачатия и во время беременности. Если в семье есть пациент с цитомегаловирусной инфекцией, необходимо ограничить его общение с ребенком и обеспечить лечение. Карантинно-изоляционные мероприятия в отношении заболевших и контактных лиц не производятся.
2. Клинические рекомендации (протокол лечения) оказания медицинской помощи детям больным цитомегаловирусной инфекцией. — 2015.
Цитомегаловирусная инфекция (ЦМВИ) у новорожденных и детей первых месяцев жизни может протекать в различных клинических формах, требующих дифференцированной терапии. Представлены особенности двух различных вариантов течения ЦМВИ — генерализованной с манифестной клинической картиной и характерными сдвигами в лабораторных анализах у ребенка в возрасте 2,5 мес с сочетанной генетической патологией и латентной внутриутробной у ребенка в возрасте 5 дней, приведшей к развитию нейросенсорной тугоухости. Освещены трудности диагностики стертой (латентной) формы болезни и выбора тактики лечения пациента. Представлен успешный результат этиопатогенетической терапии препаратом ганцикловира у ребенка с постнатальной генерализованной ЦМВИ.
Цитомегаловирусная инфекция (ЦМВИ) широко распространена в популяции. Это одна из наиболее частых из диагностируемых внутриутробных инфекций: протективные антитела к вирусу ЦМВИ обнаруживаются у 80% населения старше 35 лет, что свидетельствует о перенесенной подавляющим большинством латентной (бессимптомной) форме этой инфекции. По другим данным, удельный вес серопозитивных матерей (имеющих протективные антитела) среди социально незащищенных слоев населения достигает 100%.
Тяжелые генерализованные формы ЦМВИ отмечаются только у иммунокомпрометированных пациентов (новорожденные при внутриутробном трансплацентарном заражении, дети первых месяцев жизни, пациенты, получающие иммунодепрессанты).
Не исключается интранатальное инфицирование (наличие вируса в вагинальном секрете). При постнатальном инфицировании возможны контактный или алиментарный (в т.ч. с материнским молоком) пути передачи. Недостаточная настороженность врачей в отношении повышенного риска постнатального инфицирования пациентов неонатальных стационаров может свести на нет усилия по выхаживанию тяжело больных детей. Так, описаны случаи тяжелой ЦМВИ с высоким риском летального исхода у недоношенных новорожденных при постнатальном инфицировании через нативное материнское молоко. Вирус может длительно выделяться с мочой, калом, слюной;
Даже в настоящее время, когда контроль доноров достаточно строгий, допускается возможность передачи ЦМВ при гемотрансфузиях через инфицированные препараты крови. В этой связи к группе пациентов высокого риска тяжелых — генерализованных — форм ЦМВИ наряду с глубоко недоношенными детьми (не получившими протективных антител из-за преждевременного рождения) относятся младенцы с недостаточностью иммунной защиты и дети, перенесшие трансфузии и/или хирургические вмешательства.
В последние годы все чаще у младенцев, умерших от различных причин, при гистологическом исследовании выявляют неустановленную при жизни ЦМВИ. В связи с этим обсуждаются проблемы негативного влияния латентной инфекции на онтогенез многих функциональных систем. Вместе с тем диагностика латентных форм инфекции у новорожденных объективно затруднительна, и часто диагноз устанавливается ретроспективно — при выявлении нарушений слуха или когнитивной недостаточности.
Наряду с диагностическими трудностями при стертых (маломанифестных) формах ЦМВИ у младенцев существуют также разногласия по проблеме этиопатогенетического лечения, причем как в отношении манифестных, так и бессимптомных форм болезни.
Так, в отечественных руководствах протокол терапии манифестных форм ЦМВИ включает препараты:
- Ганцикловира, применяемые у детей до 12 лет по показаниям off-label,
- Противоцитомегаловирусный иммуноглобулин,
- Иммуноглобулин человека нормальный [IgG + IgM + IgA] и
- Препарат интерферон альфа-2b человеческий рекомбинантный.
Применять перечисленные препараты при латентных формах ЦМВИ не рекомендуется.
В то же время проект новых клинических рекомендаций Российской ассоциации специалистов перинатальной медицины включает применение при манифестной форме только Ганцикловира (Валганцикловира) и Противоцитомегаловирусного иммуноглобулина.
В отношении противоцитомегаловирусного иммуноглобулина считается подтвержденной лишь его профилактическая эффективность при антенатальном использовании у беременных женщин.
В данной статье представлен анализ типичной клинической ситуации, вызванной затруднениями в диагностике манифестной и стертой формы ЦМВИ у младенцев первых месяцев жизни, в разграничении внутриутробной и постнатальной инфекции, а также в выборе методов и продолжительности лечения с учетом многочисленных побочных действий препаратов ганцикловира и возможной терапевтической эффективности специфического противоцитомегаловирусного иммуноглобулина.
Это важно, как для образовательных целей, так и для обсуждения альтернативных вариантов терапии, особенно при латентных формах болезни.
КЛИНИЧЕСКИЕ ПРИМЕРЫ
В практике выхаживания младенцев с сочетанной перинатальной патологией нередки ситуации, при которых затруднительно дифференцировать внутриутробное и постнатальное инфицирование ЦМВИ. В качестве примера представляем две истории болезни детей, находившихся на стационарном лечении.
Тяжелое (генерализованное) течение ЦМВИ.
Исследования на вирусные инфекции, в т.ч. ЦМВИ, в этом периоде не проводились.
Иммуноферментный анализ выявил анти-ЦМВ иммуноглобулина (Ig) G в титре 59 ЕД/мл (при норме
На основании клинико-лабораторных данных установлен диагноз: «Острая генерализованная цитомегаловирусная инфекция (гепатит, интерстициальная пневмония с дыхательной недостаточностью II степени).
После получения разрешения локального независимого этического комитета на использование по жизненным показаниям препарата ганцикловира off-label и оформления матерью информированного согласия на лечение ребенка этим препаратом проведено этиотропное и патогенетическое лечение:
Курс Ганцикловира из расчета 6 мг/кг массы тела 2 раза/сут внутривенно в течение 2 нед, далее по 10 мг/кг 1 раз через сутки на 3 мес;
Курс противоцитомегаловирусного иммуноглобулина — 1 мл/кг каждые 48 ч внутривенно, всего на курс 5 инъекций; кроме того, была продолжена антибактериальная и симптоматическая терапия. На фоне комплексного лечения удалось добиться существенного улучшения состояния ребенка: уменьшились проявления системной воспалительной реакции и гепатоспленомегалии; стало возможным начало энтерального питания; уменьшились проявления буллезного эпидермолиза. Нарос уровень тромбоцитов, результаты определения ДНК ЦМВ методом ПЦР отрицательные, что позволило в возрасте 3,5 мес выполнить хирургическую коррекцию: проведены релапаротомия, разделение спаек, наложение еюностомы. Учитывая отсутствие явных клинических признаков ЦМВИ (в т.ч. тромбоцитопении, гепатоспленомегалии) на первом месяце жизни ребенка и их появление в начале третьего месяца жизни в сочетании с результатами лабораторной диагностики (выявление ДНК ЦМВ в возрасте 3 мес, нарастание титра острого маркера специфического воспаления —анти-ЦМВ IgG) на четвертом месяце жизни, наиболее вероятно предположить постнатальное инфицирование и бурное развитие генерализованной ЦМВ-инфекции у иммунокомпрометированного младенца с генетической патологией; однако, нельзя полностью исключить и отсроченную постнатальную генерализацию латентной в/утробной ЦМВИ.
Латентное течение внутриутробной ЦМВИ
Мальчик С., 5 дней, родился у женщины 25 лет,имевшей до беременности эрозию шейки матки. Беременность первая, с угрозой прерывания в первом триместре, тяжелым гестозом, анемией. Однократно (во втором триместре) перенесла острую респираторную инфекцию. При ультразвуковом исследовании заподозрена добавочная верхняя полая вена у плода (впоследствии не подтвердилось). Обследование женщины на оппортунистические инфекции не проводилось. Роды на 37-й нед с ранним излитием околоплодных вод; масса при рождении 3110 г, длина 52 см, оценка по шкале APGAR 8/9 баллов. В раннем неонатальном периоде состояние мальчика средней тяжести за счет общего угнетения: преобладала мышечная гипотония, снижение безусловно-рефлекторной активности. При ультразвуковом исследовании выявлено левостороннее внутрижелудочковое кровоизлияние I–II степени; отмечались единичные петехии на лице, экхимоз в затылочной области.
Проведен курс лечения противоцитомегаловирусным иммуноглобулином: 3 внутривенных введения из расчета 1 мл/кг каждые 48 ч внутривенно.
Ребенок повторно дважды госпитализировался —в возрасте 2 и 4 мес. На протяжении этого времени у него сохранялась умеренная задержка моторного развития; изменения боковых желудочков мозга по данным нейросонограммы имели тенденцию к уменьшению.
Результаты динамического исследования ПЦР в моче и крови: ДНК ЦМВ не обнаружена. В возрасте 2 мес выполнено исследование коротколатентных слуховых вызванных потенциалов: при интенсивности стимуляции70–80 дБ основные пики слева и справа не определяются, при 90–105 дБ — низкоамплитудные пики определяются неотчетливо. Латентности III и V пиков с двух сторон превышают референсный интервал.
Заключение по результатам исследования коротколатентных слуховых вызванных потенциалов: выраженное нарушение проведения по слуховым структурам ствола мозга — двусторонняя нейросенсорная тугоухость. Проводилась комплексная реабилитация — музыкально-сенсорная стимуляция, механотерапия, сухая иммерсия, кинезитерапия (лечебная физкультура, массаж). Ребенок направлен в сурдологический центр.
Ребенку даны рекомендации: бинауральное протезирование цифровыми многоканальными супермощными слуховыми аппаратами; изготовление индивидуальных ушных вкладышей; консультация сурдопедагога, оценка эффективности настройки слуховых аппаратов (определение показаний к проведению кохлеарной имплантации). Исходя из сроков манифестации поражения слуха, можно предположить, что ребенок был внутриутробно инфицирован ЦМВ, и внутриутробный инфекционный процесс привел к развитию нейросенсорной тугоухости с поражением центральной нервной системы легкой степени и неонатальной тромбоцитопенией.
Прогноз: ребенок нуждается в наблюдении сурдолога и коррекции нарушения слуха, а также в этапной реабилитации в связи с задержкой темпов психомоторного развития.
ОБСУЖДЕНИЕ
В первом из представленных клинических примеров у ребенка с манифестными клиническими проявлениями инфекции наиболее вероятно предположить постнатальную ЦМВИ, поскольку уже на третьем месяце жизни обнаружен острофазный маркер воспаления (анти-ЦМВ IgM) в сочетании с вирусом, выделенным из крови при помощи метода ПЦР. Вместе с тем не исключаются и внутриутробное инфицирование, и отсроченная манифестация на фоне тяжелой сочетанной врожденной (генетической) патологии. Возможно, симптомы бактериальной инфекции (энтероколита) на фоне непроходимости кишечника маскировали характерные проявления врожденной ЦМВИ
- увеличение паренхиматозных органов;
- интоксикацию;
- проявления интерстициальной пневмонии;
С другой стороны, постнатальное инфицирование ЦМВ у ребенка, находившегося длительное время в критическом состоянии, могло произойти либо при контакте с вирусоносителями, либо в стационаре, либо при переливаниях препаратов крови и плазмы. Обследование на специфические внутриутробные инфекции на первом месяце у ребенка не проводилось. Следует отметить, что на фоне этиотропной терапии у младенца не только купировались клинические проявления ЦМВИ (тромбоцитопения, гепатоцитолиз, гепатоспленомегалия, желтуха), но и отмечено явное улучшение состояния кожи и функции желудочно-кишечного тракта. Отрицательные результаты ПЦР на ДНК цитомегаловируса после курса лечения, по мнению некоторых специалистов, являются показателем успешности терапии.
Во втором наблюдении инфицирование у ребенка произошло внутриутробно; инфекционный процесс носил характер латентного или маломанифестного (умеренная желтуха, некоторая тенденция к гипокоагуляции, признаки внутриутробного поражения центральной нервной системы), однако реализовался в нейросенсорных нарушениях слуха, которые не имели тенденции к уменьшению после курса специфической иммунотропной терапии. Тем не менее отрицательные результаты ПЦР в динамике стали основанием для отказа в данной ситуации от терапии ганцикловиром. Известно, что у детей, перенесших генерализованную врожденную ЦМВИ, почти в 50% случаев отмечаются грубые нарушения слуха и психомоторного развития; при латентной форме врожденной ЦМВИ риск поражения слуха существенно ниже — около 7%. Чаще нарушения слуха выявляются уже за пределами периода новорожденности: они могут прогрессировать, периодически уменьшаться или сочетаться с вестибулярными нарушениями. Надежных критериев прогноза развития отдаленных нарушений слуха у детей как при манифестной и тяжелой, так и при латентной ЦМВИ пока не существует. Тем не менее некоторые авторы указывают, что более низкие уровни виремии, определяемые при ПЦР крови, сопряжены с лучшим прогнозом для развития слуха. Так, при обследовании детей в возрасте 6 лет, перенесших латентную врожденную ЦМВИ, установлено, что нейросенсорная тугоухость чаще развивалась у тех из них, у которых при рождении уровень виремии был17 тыс. копий/мл. Проблема этиотропной терапии новорожденных с латентным (бессимптомным) течением ЦМВИ остается дискуссионной. Большинством отечественных и зарубежных исследователей применение ротивовирусных препаратов при этих формах заболевания не рекомендуется. В то же время указывается, что длительная терапия врожденной латентной ЦМВИ с использованием антивирусных препаратов снижает частоту нарушений слуха. В этой связи высказываются предположения по изменению общепринятых подходов в терапии бессимптомных форм инфекции, хотя бы в отношении новорожденных с выявленными при скрининге нарушениями слуха в сочетании с обнаружением ЦМВ методом ПЦР, при этом имеется в виду терапия валганцикловиром.
Таким образом, вопросы лечения младенцев с латентными формами ЦМВИ требуют дальнейшего обсуждения.
В плане профилактики врожденной ЦМВИ заслуживают внимания работы по антенатальному использованию противоцитомегаловирусного иммуноглобулина. Этот препарат применяют курсами в виде внутривенных введений беременным; в последние годы практикуется так-же интраамниотическое введение и введение в сосуды пуповины плода при подтвержденной ЦМВИ. Такая профилактика хорошо переносится внутриутробным ребенком и снижает риск трансплацентарной передачи инфекции.
ЗАКЛЮЧЕНИЕ
Первый из представленных примеров продемонстрировал затруднения при постановке диагноза (внутриутробной или ранней постнальной ЦМВИ) и успешность сочетанной терапии; в то же время вторая история болезни (ребенок с латентной формой ЦМВИ) показала недостаточную эффективность одной лишь иммунозаместительной терапии (как это рекомендовано проектом Российской ассоциации специалистов перинатальной медицины). Возможно, необходима дискуссия об использовании Валганцикловира при высоком риске развития тугоухости вследствие латентной ЦМВИ.
В зарубежных странах принято относить противоцитомегаловирусный иммуноглобулин к средствам специфической профилактики ЦМВИ, но не к средствам терапии уже развившейся инфекции. Следует отметить, что строго доказательных исследований терапевтической эффективности противоцитомегаловирусного иммуноглобулина у детей раннего возраста с ЦМВИ пока нет, тем не менее проект клинических рекомендаций по лечению врожденной ЦМВИ предусматривает лечебное применение противоцитомегаловирусного иммуноглобулина как при манифестных, так и при латентных формах ЦМВИ.
Успешный зарубежный опыт пренатального применения (по сути, лечение внутриутробного ребенка) позволяет предположить, что и постнатально этот препарат может быть использован с лечебной целью при подтвержденной методом полимеразной цепной реакции или иммуноферментным анализом манифестной форме, а так-же при латентной форме инфекции, в первую очередьу новорожденных с выявленными путем аудиоскрининга нарушениями слуха.
Читайте также:

