Цмв пневмония при вич
Обновлено: 25.04.2024
Цитомегаловирусная пневмония, обусловленная цитомегаловирусом, представителем семейства Herpesviridae, часто имеет место у новорожденных и детей первого года жизни, у больных, перенесших операцию по пересадке костного мозга, почек, печени, легких и сердца, у больных, страдающих гемобластозами, у взрослых лиц, со сниженным иммунитетом (ВИЧ-инфекция).
При ЦМВ-инфекции пневмония часто является лишь одним из проявлений генерализованного заболевания.
Что провоцирует / Причины Цитомегаловирусной пневмонии:
Возбудитель цитомегаловирусной инфекции- ДНК-геномный вирус рода Cytomegalovirus (Cytomegalovirus hominis) подсемейства Веtaherpesvirinae семейства Herpesviridae. Известно 3 штамма вируса: Davis, AD-169 и Kerr. Медленная репродукция вируса в клетке возможна без её повреждения. Вирус инактивируется при нагревании и замораживании, хорошо сохраняется при комнатной температуре. При - 90 °С сохраняется длительное время, сравнительно стабилен при рН 5,0-9,0 и быстро разрушается при рН 3,0.
Резервуар и источник инфекции - человек с острой или латентной формой заболевания. Вирус может находиться в различных биологических секретах: слюне, отделяемом носоглотки, слезах, моче, испражнениях, семенной жидкости, секрете шейки матки.
Механизмы передачи многообразны, пути передачи - воздушно-капельный, контактный (прямой и опосредованный - через предметы обихода) и трансплацентарный. Возможно заражение половым путём, при пересадке внутренних органов (почек или сердца) и переливании крови инфицированного донора. Интранатальное заражение ребёнка наблюдают гораздо чаще трансплацентарного. Наиболее опасно для плода инфицирование матери в I триместр беременности. В подобных ситуациях наиболее велика частота нарушений внутриутробного развития.
Естественная восприимчивость людей высокая, но широко распространена латентная инфекция. Клинические проявления инфекции, относимой к оппортунистическим заболеваниям, возможны в условиях первичного или вторичного иммунодефицита.
Основные эпидемиологические признаки цитомегаловирусной инфекции. Болезнь регистрируют повсеместно, о её широком распространении свидетельствуют противовирусные антитела, выявляемые у 50-80% взрослых. Многообразие путей заражения ЦМВ и полиморфность клинической картины определяют эпидемиологическую и социальную значимость ЦМВ-инфекции. Это заболевание играет важную роль в трансплантологии, гемотрансфузиологии, перинатальной патологии, может быть причиной недоношенности, мертворождений, врождённых дефектов развития. У взрослых ЦМВ-инфекцию встречают как сопутствующее заболевание при различных иммунодефицитных состояниях. Продолжающееся загрязнение окружающей среды, применение цитостатиков и иммунодепрессантов способствуют росту частоты ЦМВ-инфекции. В последние годы особенно актуальным стало её обострение у ВИЧ-инфицированных. У беременных с латентной ЦМВ-инфекцией поражение плода происходит далеко не всегда. Вероятность внутриутробного заражения значительно выше при первичном инфицировании женщины во время беременности. Сезонных или профессиональных особенностей заболеваемости не выявлено.
Патогенез (что происходит?) во время Цитомегаловирусной пневмонии:
При различных путях передачи воротами инфекции могут быть слизистые оболочки верхних дыхательных путей, ЖКТ или половых органов. Вирус проникает в кровь; кратковременная вирусемия быстро завершается локализацией возбудителя при внедрении в лейкоциты и мононуклеарные фагоциты, где происходит его репликация. Инфицированные клетки увеличиваются в размерах (цитомегалия), приобретают типичную морфологию с ядерными включениями, представляющими собой скопления вируса. Образование цитомегалических клеток сопровождается интерстициальной лимфогистиоцитарной инфильтрацией, развитием узелковых инфильтратов, кальцификатов и фиброза в различных органах, железистоподобных структур в головном мозге.
Вирус способен длительно и латентно персистировать в органах, богатых лимфоидной тканью, будучи защищенным от воздействия антител и интерферона. В то же время он может подавлять клеточный иммунитет прямым воздействием на Т-лимфоциты. При различных иммунодефицитных состояниях (в раннем детском возрасте, при беременности, применении цитостатиков и иммунодепрессантов, ВИЧ-инфекции) и прежде всего при нарушениях клеточного иммунитета, дополнительно усугублённых прямым воздействием вируса, возможны реактивация возбудителя и его гематогенная генерализация с поражением практически всех органов и систем. При этом большое значение имеет эпителиотропность вируса. Она особенно выражена по отношению к эпителию слюнных желёз, под воздействием вируса превращающемуся в цитомегалические клетки.
Необратимые повреждения легких, связанные с иммунопатологическими реакциями, предшествуют клинической манифестации заболевания. Вследствие избыточной иммунопатологической реакции на ЦМВ-антигены, экспрессированные на инфицированных клетках легких, клетки подвергаются иммунному разрушению специфическими цитотоксическими лимфоцитами, что ведет к функциональному повреждению альвеол, развитию частичного дефицита альвеолярной диффузии. Лишь в дальнейшем, при выраженном угнетении иммунитета, начинается репликация вируса, обсеменение им легких, развитие тяжелого поражения легочных сосудов, альвеол, бронхиол. Косвенным доказательством наличия иммунопатологического процесса в легочной ткани служит эффективность ЦМВ-иммуноглобулина цитотекта в комбинации с ганцикловиром при лечении интерстициальной цитомегаловирусной пневмонии у реципиентов костного мозга
Симптомы Цитомегаловирусной пневмонии:
При анализе течения цитомегаловирусной инфекции в различных группах больных, прежде всего, необходимо отметить сходную клиническую картину заболевания. Характерно его постепенное развитие с наличием симптомов-предвестников, опережающих на несколько недель выраженную органную патологию.
У большинства взрослых больных отмечаются длительная волнообразная лихорадка неправильного типа с подъемами температуры тела выше 38.50°С, слабость, быстрая утомляемость, потеря аппетита, существенное снижение веса, реже - потливость по ночам, артралгии, миалгии. К указанным симптомам присоединяется постепенно усиливающийся сухой или со скудной мокротой кашель.
В дальнейшем состояние пациентов значительно ухудшается. Симптомы интоксикации становятся выраженными, пики повышения температуры тела достигают 39-40°С, отмечаются крайне выраженная слабость, анорексия, умеренная потливость, похудание.
Основным клиническим симптомом цитомегаловирусной пневмонии, присутствующим практически у 100% больных, является сильный приступообразный сухой или малопродуктивный коклюшеподобный кашель. Одним из ранних и наиболее постоянных признаков заболевания служит одышка, которая носит инспираторный или смешанный характер, вначале появляется только при физической нагрузке, а затем и в покое. Одышка постоянная, умеренная (в отличие от пневмоцистной пневмонии), но значительно возрастающая при минимальной нагрузке.
Для ЦМВ-пневмонии характерно длительное рецидивирующее течение с постепенным нарастанием тяжести заболевания. При несвоевременной постановке этиологического диагноза, отсутствии этиотропной терапии, присоединении бактериальной инфекции возможно развитие симптомов дыхательной недостаточности, нарастающего респираторного дистресс-синдрома с высокой вероятностью летального исхода.
Диагностика Цитомегаловирусной пневмонии:
Изменения лабораторных показателей включают тромбоцитопению, анемию, лейкопению, лимфоцитоз, повышение активности АлАТ, АсАт, ЩФ, ГГТ.
Клинический диагноз ЦМВ-инфекции требует обязательного лабораторного подтверждения. Цитомегаловирус в организме человека может находиться в латентном состоянии, в стадии активной репликации без развития органных поражений и быть причиной тяжелой клинически выраженной патологии. Следовательно, цель лабораторного подтверждения манифестной ЦМВИ заключается не в установлении самого факта присутствия цитомегаловируса в организме пациента и даже не в выявлении косвенных признаков его активности, а в доказательстве этиологической роли ЦМВ в развитии органной патологии. Поставить прижизненный диагноз ЦМВ-пневмонии крайне трудно по следующим причинам: ее клиническая картина не является патогномоничной, вирус можно выделить из легочного секрета при отсутствии клинических проявлений инфекции и гистологических признаков заболевания, у иммуносупрессивных больных ЦМВ часто сосуществует с другими возбудителями инфекционной легочной патологии.
В настоящее время можно считать доказанным, что определение в крови больного специфических антител класса IgМ и/или существенного увеличения титров антител класса IgG, выявление ЦМВ в слюне, моче, сперме, вагинальном секрете недостаточно ни для установления факта активной репликации цитомегаловируса, ни для подтверждения диагноза манифестной ЦМВ-инфекции. Напротив, обнаружение вируса (его антигенов или ДНК) в крови имеет важное диагностическое значение. Показано, что определение в лейкоцитах крови вирусного антигена (pp65) говорит об активной инфекции, что в свою очередь косвенно свидетельствует о цитомегаловирусной природе имеющихся органных поражений. Появление в крови вирусного белка pp65 предшествует клиническим симптомам ЦМВИ, поэтому этот маркер имеет и определенное прогностическое значение. Обнаружение вирусных антигенов быстрым культуральным методом в биологических материалах путем анализа инфицированных ими клеток культуры считается специфическим и чувствительным методом, доказывающим наличие у больного инфекционно активного вируса.
На сегодняшний день в практике лабораторной диагностики активной ЦМВ-инфекции все большее внимание уделяется методикам, основанным на полимеразной цепной реакции (ПЦР), которая дает возможность прямого качественного и количественного обнаружения ДНК возбудителя в биологических жидкостях и тканях. Последние годы ознаменовались подтверждением преимуществ метода ПЦР в лабораторной диагностике многих инфекционных заболеваний
Достоверным критерием высокой активности цитомегаловируса, доказывающим его этиологическую роль в развитии тех или иных клинических синдромов, служит титр ДНК ЦМВ, равный 1:1000 и более в 105 лейкоцитах крови.
Определения ДНК ЦМВ в крови методом ПЦР имеет и большое прогностическое значение. Постепенное повышение уровня ДНК ЦМВ в лейкоцитах крови и плазме опережает развитие клинической симптоматики. С каждым повышением концентрации ДНК ЦМВ в плазме на 1 log10 риск развития ЦМВ-заболевания возрастает в 3 раза. Выявление высокой концентрации ДНК ЦМВ в лейкоцитах крови или плазме требует безотлагательного начала этиотропной терапии.
Безусловным подтверждением цитомегаловирусной природы имеющихся у больного клинических симптомов и патологических изменений в органах является обнаружение при гистологических исследованиях биопсийных или аутопсийных материалов цитомегалоклеток.
Лечение Цитомегаловирусной пневмонии:
Лекарственными средствами, эффективность которых при лечении больных манифестной ЦМВИ доказана многочисленными исследованиями, являются противовирусные препараты ганцикловир, валганцикловир, фоскарнет и сидофовир.
При выявлении активной ЦМВИ у беременных женщин или новорожденных препаратом выбора является цитотект - иммуноглобулин человека с повышенным содержанием антител к ЦМВ. Применение цитотекта в качестве монотерапии у взрослых больных с клинически выраженной ЦМВИ не показано.
Противогерпетические препараты (ацикловир, валацикловир, фамцикловир) мало эффективны в отношении ЦМВ и не должны применяться при манифестных формах заболевания.
ЦМВ в сотни раз менее чувствителен к ацикловиру и его аналогам, чем вирусы простого герпеса. Во многих работах отечественных авторов имеют место указания на возможное применение препаратов интерферонового ряда (циклоферон, неовир, виферон и др.) и/или иммунокорректоров (Тактивин, тималин и др.) для лечения ЦМВИ.
Механизм воздействия данных лекарственных средств на иммунную систему детально не изучен. Не определены оптимальные показания по времени применения препаратов и продолжительности их использования в разных фазах инфекционного процесса. В связи с этим, препараты интерферонового ряда и иммунокорректоры не должны применяться для лечения манифестной ЦМВ-инфекции.
Ганцикловир является препаратом выбора для лечения и вторичной профилактики манифестной ЦМВИ, в частности, цитомегаловирусной пневмонии. Противовирусный эффект ганцикловира обусловлен подавлением синтеза ДНК ЦМВ путем конкурентного ингибирования вирусной ДНК-полимеразы и нарушения удлинения цепи ДНК. Препарат имеет лекарственные формы в виде флаконов - для в/в введения (в одном флаконе содержится 500 мг ганцикловира) и капсул - для приема внутрь (одна капсула содержит 250 мг ганцикловира).
Профилактика Цитомегаловирусной пневмонии:
С целью профилактики манифестации ЦМВИ используются ганцикловир (в дозе 5 мг/кг/сут в/в или 3 г/сут per os), валганцикловир (900 мг/сут), у детей и беременных женщин - цитотект (1 - 2 мл/кг/сут не менее 6 введений с интервалом в 1 - 2 недели). Опубликованные результаты исследований по предупреждению манифестной ЦМВИ с использованием ганцикловира или валганцикловира показывают достоверное снижение частоты развития клинически выраженных форм ЦМВИ, в частности пневмонии, у больных после аллогенной пересадки костного мозга, легких, сердца, почки, печени, а также у ВИЧ-инфицированных пациентов. Первые результаты нашей работы профилактического применения ганцикловира у больных ВИЧ-инфекцией с количеством CD4-лимфоцитов < 100 кл/мм3 и наличием ДНК ЦМВ в крови показали за два года наблюдения существенное снижение частоты манифестной ЦМВ-инфекции в данной группе пациентов. В заключение отметим, что разработанные на сегодняшний день диагностические методы и созданные противовирусные препараты, дают возможность как своевременного выявления цитомегаловирусного поражения легких, так и его эффективного лечения.
К каким докторам следует обращаться если у Вас Цитомегаловирусная пневмония:
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Цитомегаловирусной пневмонии, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору .
Пневмоцистная пневмония – это тяжелая форма интерстициального легочного воспаления, вызываемая пневмоцистами и развивающаяся на фоне выраженных иммунодефицитных состояний. Клиническое течение характеризуется нарастающей одышкой, непродуктивным кашлем, фебрильной лихорадкой, болями в груди, развитием сердечно-легочной недостаточности. Диагноз ставится на основании рентгенологических признаков, состояния иммунного статуса, лабораторной идентификации патогена в крови, БАЛ, мокроте, биоптате (ПЦР, серологические тесты, РНИФ). Для этиотропной терапии используются сульфаниламидные, противопротозойные, иммуномодулирующие средства.
МКБ-10
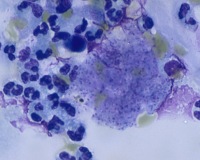


Общие сведения
Пневмоцистная пневмония (ПП) относится к оппортунистическим инфекциям, поражающим лиц с иммунодефицитом и иммуносупрессией. При этом большинство людей с нормальным уровнем иммунитета переносит пневмоцистную инфекцию в виде ОРВИ. Антитела к возбудителю имеют около 90% взрослого населения, около 10% являются бессимптомными носителями пневмоцист – именно они представляют наибольшую угрозу для иммунокомпрометированных пациентов. Пневмоцистная пневмония является самой тяжелой клинической формой пневмоцистоза.

Причины
Характеристика возбудителя
Pneumocystis jirovecii – микроорганизм, вызывающий пневмоцистную пневмонию и другие виды пневмоцистоза у человека. До недавнего времени пневмоцисты считались простейшими, однако в 1988 г. на основании ряда характерных генетических, морфологических и биохимических признаков были отнесены к грибам семейства актиномицетов. Пневмоцисты обладают тропизмом к легочной ткани, весь их жизненный цикл протекает внутри альвеол и проходит 4 стадии:
- Трофозоит. Представляет собой вегетативную стадию P. Jirovecii. Имеет амебоидную форму, диаметр 1-5 мкм, одно ядро и тонкую двухслойную мембрану. Прикрепляется к альвеолоцитам, где увеличивается в размерах и делится.
- Прециста. Имеет овальную форму, диаметр 5 мкм. В ранней стадии содержит одно ядро, окруженное митохондриями, на поздней – 2-6 ядер с мембранами.
- Циста. Зрелая циста округлой формы, с 3-слойной стенкой, диаметром 7-8 мкм. Внутри цисты содержится четное количество (обычно 8 шт.) внутрицистных телец ‒ спорозоитов.
- Спорозоит. При разрыве зрелых цист из них высвобождаются спорозоиты, часть которых обладает одинарным набором хромосом (являются гаплоидными). Сливаясь, они вновь образуют трофозоиты, и жизненный цикл патогена повторяется.
В описанном цикле различают две фазы: неполовую, или асексуальную (деление трофозоита), и половую, или сексуальную (спорозоит-трофозоит-прециста-циста).
Пути передачи
Источниками P. jirovecii являются носители (бессимптомные или больные ОРЗ) и больные пневмоцистной инфекцией. В 30% случаев выявляется вовлеченность в эпидемический процесс медицинских работников. При кашле и чихании носители выделяют мелкодисперсный аэрозоль, содержащий патогены. Заражение восприимчивого макроорганизма происходит при вдыхании контаминированного воздуха (воздушно-капельным, воздушно-пылевым путем). Воротами для входящей инфекции служат дыхательные пути. Редко реализуется трансплацентарный путь передачи.
Характерны внутрисемейные и внутрибольничные эпидемические вспышки пневмоцистной пневмонии. Последние чаще происходят в отделениях недоношенных, домах престарелых, инфекционных стационарах. Пик детской заболеваемости пневмоцистной пневмонией приходится на конец лета – начало осени, взрослые болеют круглогодично.
Группы риска
Пневмоцисты являются типичными оппортунистами, поскольку вызывают манифестную инфекцию только при выраженном дефиците клеточного и гуморального иммунитета у определенного контингента пациентов. К группам риска по заболеваемости пневмоцистной пневмонией относятся:
- ВИЧ-инфицированные и больные СПИДом;
- пациенты с ЦМВ-инфекцией;
- недоношенные дети и младенцы с ЗВУР;
- дети, страдающие гипотрофией, рахитом;
- больные, получающие иммуносупрессивную терапию (по поводу лейкозов, миеломной болезни, других видов рака, трансплантации органов, коллагенозов);
- пациенты с первичными иммунодефицитами, болезнями крови (анемией, полицитемией), туберкулезом, патологией почек.

Патогенез
Пневмоцисты присутствуют в дыхательных путях здоровых людей, но вызывают пневмоцистную пневмонию только у лиц с нарушением гуморального и клеточного звена иммунитета. Экспериментально доказано, что ведущую роль в механизме пневмоцистоза играет снижение Т-хелперов (критическим является снижение СД4+ лимфоцитов ˂300-200 клеток/мкл), увеличение количества цитотоксических лимфоцитов СД8+.
P. Jirovecii с помощью особых выростов – филоподий – прикрепляется к альвеолоцитам первого порядка и альвеолярным макрофагам. Клеточной адгезии также способствуют гликопротеины пневмоцистов, которые взаимодействуют с фосфолипидами, апопротеинами, мукополисахаридами, сурфактантом альвеолярного эпителия. В условиях иммунокомпрометации цисты размножаются, используя сурфактант-ассоциированные белки, выделяют токсические метаболиты.
Происходит разрушение альвеолоцитов, заполнение альвеол пенистым экссудатом, содержащим большое количество пневмоцист на разных стадиях развития, воспалительные клетки, детрит. Интерстициальная ткань инфильтрируется плазматическими клетками. Развивается интерстициальная плазмоклеточная пневмония. Межальвеолярные перегородки гипертрофируются, что приводит к резкому снижению диффузии газов (альвеолярно-капиллярный блок), формированию дыхательной недостаточности и тяжелой гипоксии.
Классификация
В соответствии с патоморфологическими критериями в современной пульмонологии выделяют три стадии пневмоцистной пневмонии:
- I стадия. Происходит прикрепление пневмоцист к альвеолярной стенке. Воспалительная реакция и клинические проявления отсутствуют.
- II стадия. Отмечается десквамация альвеолоцитов, увеличение числа возбудителей в форме цист в макрофагах. В эту стадию появляются начальные клинические проявления пневмоцистной пневмонии.
- III стадия. Развивается альвеолит, плазмоцитарная инфильтрация интерстиция, гигантские скопления пневмоцист в макрофагах и альвеолах. Соответствует разгару заболевания.
Этапы развития пневмоцистной пневмонии:
- отечная фаза ‒ длится 7-10 дней, характеризуется нарастанием симптоматики;
- ателектатическая фаза ‒ продолжается в течение 4-х недель, сопровождается выраженной легочной недостаточностью;
- эмфизематозная фаза – имеет различную длительность, знаменуется обратным развитием симптоматики.
Симптомы пневмоцистной пневмонии
Инкубационный период вариабелен – от 7-10 дней до 2-4 недель (у больных СПИДом – до 10 недель). В отечную стадию клинические признаки пневмоцистной пневмонии легко спутать с обычной респираторной инфекцией. Симптомы нарастают постепенно: вначале беспокоит слабость, недомогание, субфебрилитет. Затем появляется одышка при умеренной нагрузке, боли в грудной клетке, сухой кашель.
В ателектатической стадии лихорадка принимает фебрильный характер, усиливается интоксикационный синдром (отсутствие аппетита, снижение веса, потливость по ночам). Кашель становится коклюшеподобным, постоянным, особенно беспокоит в ночное время суток. Одышка до 30-50 дыхательных движений в минуту выражена в покое. Отмечаются бледность кожных покровов с носогубным цианозом, тахикардия. В этот период пациент может погибнуть от сердечно-легочной недостаточности (СЛН).
У выживших пациентов наступает эмфизематозная стадия. Температура тела снижается, дыхательные расстройства исчезают. В исходе пневмоцистной пневмонии формируется эмфизема легких, легочное сердце. Пневмоцистная пневмония часто протекает в ассоциации с туберкулезом легких.
Четкая стадийность при пневмоцистозе прослеживается в основном у детей раннего возраста. У ВИЧ-инфицированных болезнь имеет стертое затяжное течение, у ВИЧ-негативных лиц с иммунодефицитом – более активное, с быстрым нарастанием СЛН.
Осложнения
Типичными осложнениями, развивающимися в разгар болезни, являются пневмоторакс, подкожная эмфизема, пневмомедиастинум, возникающие вследствие разрыва мелких кистозных образований. Возможно развитие абсцедирующей пневмонии. Эти состояния еще более усугубляют дыхательную недостаточность, повышают летальность. При значительном подавлении иммунитета может произойти генерализация пневмоцистной инфекции с мультиорганным поражением печени, селезенки, ЖКТ, щитовидной железы, органов зрения и слуха, лимфоузлов, костного мозга.

Диагностика
Из-за неспецифичности и стертости симптоматики существенной проблемой является гиподиагностика пневмоцистной пневмонии. Иногда патология диагностируется только посмертно. Все больные с подозрением на ПП должны быть в срочном порядке проконсультированы врачом-пульмонологом, инфекционистом. При выставлении диагноза опираются на следующие данные:
Дифференциальная диагностика
Комплексное клинико-лабораторное, рентгенологическое и бронхологическое обследование позволяет отличить пневмоцистную пневмонию от других поражений легких:
- легочного кандидоза;
- криптококковой пневмонии;
- цитомегаловирусной пневмонии;
- микоплазменной пневмонии;
- хламидийной пневмонии;
- туберкулеза легких;
- респираторного криптоспоридиоза;
- саркомы Капоши;
- бактериальной пневмонии.
Лечение пневмоцистной пневмонии
Стандартные антибактериальные средства при ПП неэффективны. В настоящее время препаратами первой линии считаются комбинированные сульфаниламиды, оказывающие противомикробное, бактерицидное и противопротозойное действие. Могут назначаться как перорально, так и внутривенно. Курс лечения составляет 1-3 недели.
При выраженных токсических эффектах и резистентности подбираются другие антибиотики, активные в отношении пневмоцист (линкозамиды, противолепрозные, противомалярийные, антипротозойные препараты). Из-за массовой гибели патогенов в первые дни терапии состояние пациентов с пневмоцистной пневмонией может ухудшиться, в связи с чем целесообразно назначение кортикостероидов.
Прогноз и профилактика
Смертность от пневмоцистной пневмонии достигает 50% среди недоношенных детей, 25-40% ‒ среди больных СПИДом. У 10-30% иммунокомпрометированных пациентов через несколько месяцев после излечения возникают рецидивы ПП. При отсутствии лечения летальность 100%.
Профилактическая работа реализуется в двух направлениях: эпидемиологическом и медикаментозном. Первый аспект предполагает широкое тестирование на пневмоцистную инфекцию представителей групп риска: пациентов с ВИЧ, онкопатологией, иммунодефицитами, недоношенных детей, сотрудников роддомов и стационаров. Второе направление – это фармакопрофилактика пневмоцистной пневмонии у лиц с количеством СД4+ клеток ˂200. Она заключается в приеме сульфаниламидов в профилактических дозах длительными курсами.
1. Пневмоцистная пневмония. Этиология, патогенез, клиника, дифференциальная диагностика, лечение (лекция)/ Боровицкий В.С.// Проблемы медицинской микологии. – 2012.
2. Пневмоцистная пневмония: исторические, эпидемиологические, клинико-морфологические аспекты/ Марковский В. Д., Плитень О. Н., Мирошниченко М. С., Мирошниченко А. А.// Annals of Mechnikov Institute, - 2012. - №3.
3. Особенности пневмоцистной пневмонии у ВИЧ-инфицированных лиц/ Пузырёва Л.В., Сафонов А.Д., Мордык А.В.// Медицинский вестник Северного Кавказа. – 2016. – Т.11, №3.
4. Пневмоцистоз. Современное состояние проблемы/ Каражас Н.В.// Альманах клинической медицины. – 2010.
Цитомегалия – это инфекционное заболевание вирусного генеза, передающееся половым, трансплацентарным, бытовым, гемотрансфузионным путем. Симптоматически протекает в форме упорной простуды. Отмечается слабость, недомогание, головные и суставные боли, насморк, увеличение и воспаление слюнных желез, обильное слюноотделение. Часто протекает бессимптомно. Опасна цитомегалия беременных: она может вызывать самопроизвольный выкидыш, врожденные пороки развития, внутриутробную гибель плода, врожденную цитомегалию. Диагностика осуществляется лабораторными методами (ИФА, ПЦР). Лечение включает противовирусную и симптоматическую терапию.
МКБ-10
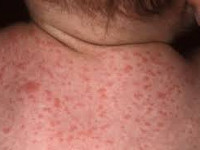
Общие сведения
Другие названия цитомегалии, встречающиеся в медицинских источниках, - цитомегаловирусная инфекция (ЦМВ), инклюзионная цитомегалия, вирусная болезнь слюнных желез, болезнь с включениями. Цитомегалия является широко распространенной инфекцией, и многие люди, являясь носителями цитомегаловируса, даже не подозревают об этом. Наличие антител к цитомегаловирусу выявляется у 10—15% населения в подростковом возрасте и у 50% взрослых людей. По некоторым источникам, носительство цитомегаловируса определяется у 80% женщин детородного периода. В первую очередь это относится к бессимптомному и малосимптомному течению цитомегаловирусной инфекции.

Причины
- воздушно-капельным: при чихании, кашле, разговоре, поцелуях и т.д.;
- половым путем: при сексуальных контактах через сперму, влагалищную и шеечную слизь;
- гемотрансфузионным: при переливании крови, лейкоцитарной массы, иногда - при пересадке органов и тканей;
- трансплацентарным: во время беременности от матери плоду.
Нередко цитомегаловирус находится в организме многие годы и может ни разу не проявить себя и не нанести вреда человеку. Проявление скрытой инфекции происходит, как правило, при ослаблении иммунитета. Угрожающую по своим последствиям опасность цитомегаловирус представляет у лиц со сниженным иммунитетом (ВИЧ-инфицированных, перенесших трансплантацию костного мозга или внутренних органов, принимающих иммунодепрессанты), при врожденной форме цитомегалии, у беременных.
Патогенез
Попадая в кровь, цитомегаловирус вызывает выраженную иммунную реакцию, проявляющуюся в выработке защитных белковых антител – иммуноглобулинов М и G (IgM и IgG) и противовирусной клеточной реакцией - образованием лимфоцитов CD 4 и CD 8. Угнетение клеточного иммунитета при ВИЧ-инфекции приводит к активному развитию цитомегаловируса и вызываемой им инфекции.
Даже при бессимптомном течении инфекции носитель цитомегаловируса является потенциально заразным для неинфицированных лиц. Исключение составляет внутриутробный путь передачи цитомегаловируса от беременной женщины плоду, который происходит в основном при активном течении процесса, и лишь в 5% случаев вызывает врожденную цитомегалию, в остальных же носит бессимптомный характер.
Симптомы цитомегалии
Врожденная цитомегалия
В 95% случаев внутриутробное инфицирование плода цитомегаловирусом не вызывает развития заболевания, а протекает бессимптомно. Врожденная цитомегаловирусная инфекция развивается у новорожденных, матери которых перенесли первичную цитомегалию. Врожденная цитомегалия может проявляться у новорожденных в различных формах:
- петехиальная сыпь – мелкие кожные кровоизлияния - встречается у 60-80% новорожденных;
- недоношенность и задержка внутриутробного развития плода - встречается у 30% новорожденных;
- желтуха;
- хориоретинит – острый воспалительный процесс в сетчатке глаза, часто вызывающий снижение и полную потерю зрения.
Летальность при внутриутробном инфицировании цитомегаловирусом достигает 20-30%. Из выживших детей большая часть имеет отставание в умственном развитии или инвалидность по слуху и зрению.
Приобретенная цитомегалия у новорожденных
При инфицировании цитомегаловирусом в процессе родов (при прохождении плода по родовым путям) или в послеродовом периоде (при бытовом контакте с инфицированной матерью или грудном вскармливании) в большинстве случаев развивается бессимптомное течение цитомегаловирусной инфекции. Однако у недоношенных младенцев цитомегаловирус может вызывать затяжную пневмонию, к которой часто присоединяется сопутствующая бактериальная инфекция. Часто при поражении цитомегаловирусом у детей отмечается замедление в физическом развитии, увеличение лимфоузлов, гепатит, сыпь.
Мононуклеозоподобный синдром
У лиц, вышедших из периода новорожденности и имеющих нормальный иммунитет, цитомегаловирус может вызывать развитие мононуклеозоподобного синдрома. Течение мононуклеазоподобного синдрома по клинике не отличается от инфекционного мононуклеоза, вызываемого другой разновидностью герпесвируса – вирусом Эбштейна-Барр. Течение мононуклеозоподобного синдрома напоминает упорную простудную инфекцию. При этом отмечается:
- длительная (до 1 месяца и более) лихорадка с высокой температурой тела и ознобами;
- ломота в суставах и мышцах, головная боль;
- выраженные слабость, недомогание, утомляемость;
- боли в горле;
- увеличение лимфоузлов и слюнных желез;
- кожные высыпания, напоминающие сыпь при краснухе (обычно встречается при лечении ампициллином).
В отдельных случаях мононуклеозоподобный синдром сопровождается развитием гепатита – желтухой и повышением в крови печеночных ферментов. Еще реже (до 6% случаев) осложнением мононуклеозоподобного синдрома служит пневмония. Однако у лиц с нормальной иммунной реактивностью она протекает без клинических проявлений, выявляясь лишь при проведении рентгенографии легких.
Длительность течения мононуклеозоподобного синдрома составляет от 9 до 60 дней. Затем обычно наступает полное выздоровление, хотя на протяжении нескольких месяцев могут сохраняться остаточные явления в виде недомогания, слабости, увеличенных лимфоузлов. В редких случаях активизация цитомегаловируса вызывает рецидивы инфекции с лихорадкой, потливостью, приливами и недомоганием.
Цитомегаловирусная инфекция у лиц с ослабленным иммунитетом
Ослабление иммунитета наблюдается у лиц, страдающих синдромом врожденного и приобретенного (СПИД) иммунодефицита, а также у пациентов, перенесших пересадку внутренних органов и тканей: сердца, легкого, почки, печени, костного мозга. После пересадки органов пациенты вынуждены постоянно принимать иммунодепрессанты, ведущие к выраженному подавлению иммунных реакций, что вызывает активность цитомегаловируса в организме.
У пациентов, перенесших трансплантацию органов, цитомегаловирус вызывает поражение донорских тканей и органов (гепатит – при пересадке печени, пневмонию при пересадке легкого и т. д.). После трансплантации костного мозга у 15-20% пациентов цитомегаловирус может привести к развитию пневмонии с высокой летальностью (84-88%). Наибольшую опасность представляет ситуация, когда инфицированный цитомегаловирусом донорский материал пересажен неинфицированному реципиенту.
Цитомегаловирус поражает практически всех ВИЧ-инфицированных. В начале заболевания отмечаются недомогание, суставные и мышечные боли, лихорадка, ночная потливость. В дальнейшем к этим признакам могут присоединяться поражения цитомегаловирусом легких (пневмония), печени (гепатит), мозга (энцефалит), сетчатки глаза (ретинит), язвенные поражения и желудочно-кишечные кровотечения.
У мужчин цитомегаловирусом могут поражаться яички, простата, у женщин – шейка матки, внутренний слой матки, влагалище, яичники. Осложнениями цитомегаловирусной инфекции у ВИЧ-инфицированных могут стать внутренние кровотечения из пораженных органов, потеря зрения. Множественное поражение органов цитомегаловирусом может привести к их дисфункции и гибели пациента.
Диагностика
С целью диагностики цитомегаловирусной инфекции проводится лабораторное обследование. Постановка диагноза цитомегаловирусной инфекции основана на выделении цитомегаловируса в клиническом материале или при четырехкратном повышении титра антител.
- ИФА-диагностика. Включает определение в крови специфических антител к цитомегаловирусу - иммуноглобулинов М и G. Наличие иммуноглобулинов М может свидетельствовать о первичном заражении цитомегаловирусом либо о реактивации хронической ЦМВИ. Определение высоких титров IgМ у беременных может угрожать инфицированию плода. Повышение IgМ выявляется в крови спустя 4-7 недель после заражения цитомегаловирусом и наблюдается на протяжении 16-20 недель. Повышение иммуноглобулинов G развивается в период затухания активности цитомегаловирусной инфекции. Их наличие в крови говорит о присутствии цитомегаловируса в организме, но не отражает активности инфекционного процесса.
- ПЦР-диагностика. Для определения ДНК цитомегаловируса в клетках крови и слизистых (в материалах соскобов из уретры и цервикального канала, в мокроте, слюне и т. д.) используется метод ПЦР-диагностики (полимеразной цепной реакции). Особенно информативно проведение количественной ПЦР, дающей представление об активности цитомегаловируса и вызываемого им инфекционного процесса.
В зависимости от того, какой орган поражен цитомегаловирусной инфекцией, пациент нуждается в консультации гинеколога, андролога, гастроэнтеролога или других специалистов. Дополнительно по показаниям проводится УЗИ органов брюшной полости, кольпоскопия, гастроскопия, МРТ головного мозга и другие обследования.
Лечение цитомегаловирусной инфекции
Неосложненные формы мононуклеазоподобного синдрома не требует специфической терапии. Обычно проводятся мероприятия, идентичные лечению обычного простудного заболевания. Для снятия симптомов интоксикации, вызываемой цитомегаловирусом, рекомендуется пить достаточное количество жидкости.
Лечение цитомегаловирусной инфекции у лиц, входящих в группу риска, проводится противовирусным препаратом ганцикловиром. В случаях тяжелого течения цитомегалии ганцикловир вводится внутривенно, т. к. таблетированные формы препарата обладают лишь профилактическим эффектом в отношении цитомегаловируса. Поскольку ганцикловир обладает выраженными побочными эффектами (вызывает угнетение кроветворения - анемию, нейтропению, тромбоцитопению, кожные реакции, желудочно-кишечные расстройства, повышение температуры и ознобы и др.), его применение ограничено у беременных, детей и у людей, страдающих почечной недостаточностью (только по жизненным показаниям), он не используется у пациентов без нарушения иммунитета.
Для лечения цитомегаловируса у ВИЧ-инфицированных наиболее эффективен препарат фоскарнет, также обладающий рядом побочных эффектов. Фоскарнет может вызывать нарушение электролитного обмена (снижение в плазме крови магния и калия), изъязвление половых органов, нарушение мочеиспускания, тошноту, поражение почек. Данные побочные реакции требуют осторожного применения и своевременной корректировки дозы препарата.
Прогноз
Особую опасность цитомегаловирус представляет при беременности, так как может провоцировать выкидыш, мертворождение или вызывать тяжелые врожденные уродства у ребенка. Поэтому цитомегаловирус, наряду с герпесом, токсоплазмозом и краснухой, относится к числу тех инфекций, обследоваться на которые женщины должны профилактически, еще на этапе планирования беременности.
Профилактика
Особенно остро вопрос профилактики цитомегаловирусной инфекции стоит у лиц, входящих в группу риска. Наиболее подвержены инфицированию цитомегаловирусом и развитию заболевания ВИЧ-инфицированные (особенно больные СПИДом), пациенты после трансплантации органов и лица с иммунодефицитом иного генеза.
Неспецифические методы профилактики (например, соблюдение личной гигиены) неэффективны в отношении цитомегаловируса, так как заражение им возможно даже воздушно-капельным путем. Специфическая профилактика цитомегаловирусной инфекции проводится ганцикловиром, ацикловиром, фоскарнетом среди пациентов, входящих в группы риска. Также для исключения возможности инфицирования цитомегаловирусом реципиентов при пересадке органов и тканей необходим тщательный подбор доноров и контроль донорского материала на наличие цитомегаловирусной инфекции.
Пневмоцистная пневмония – это тяжелая форма интерстициального легочного воспаления, вызываемая пневмоцистами и развивающаяся на фоне выраженных иммунодефицитных состояний. Клиническое течение характеризуется нарастающей одышкой, непродуктивным кашлем, фебрильной лихорадкой, болями в груди, развитием сердечно-легочной недостаточности. Диагноз ставится на основании рентгенологических признаков, состояния иммунного статуса, лабораторной идентификации патогена в крови, БАЛ, мокроте, биоптате (ПЦР, серологические тесты, РНИФ). Для этиотропной терапии используются сульфаниламидные, противопротозойные, иммуномодулирующие средства.
МКБ-10



Общие сведения
Пневмоцистная пневмония (ПП) относится к оппортунистическим инфекциям, поражающим лиц с иммунодефицитом и иммуносупрессией. При этом большинство людей с нормальным уровнем иммунитета переносит пневмоцистную инфекцию в виде ОРВИ. Антитела к возбудителю имеют около 90% взрослого населения, около 10% являются бессимптомными носителями пневмоцист – именно они представляют наибольшую угрозу для иммунокомпрометированных пациентов. Пневмоцистная пневмония является самой тяжелой клинической формой пневмоцистоза.

Причины
Характеристика возбудителя
Pneumocystis jirovecii – микроорганизм, вызывающий пневмоцистную пневмонию и другие виды пневмоцистоза у человека. До недавнего времени пневмоцисты считались простейшими, однако в 1988 г. на основании ряда характерных генетических, морфологических и биохимических признаков были отнесены к грибам семейства актиномицетов. Пневмоцисты обладают тропизмом к легочной ткани, весь их жизненный цикл протекает внутри альвеол и проходит 4 стадии:
- Трофозоит. Представляет собой вегетативную стадию P. Jirovecii. Имеет амебоидную форму, диаметр 1-5 мкм, одно ядро и тонкую двухслойную мембрану. Прикрепляется к альвеолоцитам, где увеличивается в размерах и делится.
- Прециста. Имеет овальную форму, диаметр 5 мкм. В ранней стадии содержит одно ядро, окруженное митохондриями, на поздней – 2-6 ядер с мембранами.
- Циста. Зрелая циста округлой формы, с 3-слойной стенкой, диаметром 7-8 мкм. Внутри цисты содержится четное количество (обычно 8 шт.) внутрицистных телец ‒ спорозоитов.
- Спорозоит. При разрыве зрелых цист из них высвобождаются спорозоиты, часть которых обладает одинарным набором хромосом (являются гаплоидными). Сливаясь, они вновь образуют трофозоиты, и жизненный цикл патогена повторяется.
В описанном цикле различают две фазы: неполовую, или асексуальную (деление трофозоита), и половую, или сексуальную (спорозоит-трофозоит-прециста-циста).
Пути передачи
Источниками P. jirovecii являются носители (бессимптомные или больные ОРЗ) и больные пневмоцистной инфекцией. В 30% случаев выявляется вовлеченность в эпидемический процесс медицинских работников. При кашле и чихании носители выделяют мелкодисперсный аэрозоль, содержащий патогены. Заражение восприимчивого макроорганизма происходит при вдыхании контаминированного воздуха (воздушно-капельным, воздушно-пылевым путем). Воротами для входящей инфекции служат дыхательные пути. Редко реализуется трансплацентарный путь передачи.
Характерны внутрисемейные и внутрибольничные эпидемические вспышки пневмоцистной пневмонии. Последние чаще происходят в отделениях недоношенных, домах престарелых, инфекционных стационарах. Пик детской заболеваемости пневмоцистной пневмонией приходится на конец лета – начало осени, взрослые болеют круглогодично.
Группы риска
Пневмоцисты являются типичными оппортунистами, поскольку вызывают манифестную инфекцию только при выраженном дефиците клеточного и гуморального иммунитета у определенного контингента пациентов. К группам риска по заболеваемости пневмоцистной пневмонией относятся:
- ВИЧ-инфицированные и больные СПИДом;
- пациенты с ЦМВ-инфекцией;
- недоношенные дети и младенцы с ЗВУР;
- дети, страдающие гипотрофией, рахитом;
- больные, получающие иммуносупрессивную терапию (по поводу лейкозов, миеломной болезни, других видов рака, трансплантации органов, коллагенозов);
- пациенты с первичными иммунодефицитами, болезнями крови (анемией, полицитемией), туберкулезом, патологией почек.

Патогенез
Пневмоцисты присутствуют в дыхательных путях здоровых людей, но вызывают пневмоцистную пневмонию только у лиц с нарушением гуморального и клеточного звена иммунитета. Экспериментально доказано, что ведущую роль в механизме пневмоцистоза играет снижение Т-хелперов (критическим является снижение СД4+ лимфоцитов ˂300-200 клеток/мкл), увеличение количества цитотоксических лимфоцитов СД8+.
P. Jirovecii с помощью особых выростов – филоподий – прикрепляется к альвеолоцитам первого порядка и альвеолярным макрофагам. Клеточной адгезии также способствуют гликопротеины пневмоцистов, которые взаимодействуют с фосфолипидами, апопротеинами, мукополисахаридами, сурфактантом альвеолярного эпителия. В условиях иммунокомпрометации цисты размножаются, используя сурфактант-ассоциированные белки, выделяют токсические метаболиты.
Происходит разрушение альвеолоцитов, заполнение альвеол пенистым экссудатом, содержащим большое количество пневмоцист на разных стадиях развития, воспалительные клетки, детрит. Интерстициальная ткань инфильтрируется плазматическими клетками. Развивается интерстициальная плазмоклеточная пневмония. Межальвеолярные перегородки гипертрофируются, что приводит к резкому снижению диффузии газов (альвеолярно-капиллярный блок), формированию дыхательной недостаточности и тяжелой гипоксии.
Классификация
В соответствии с патоморфологическими критериями в современной пульмонологии выделяют три стадии пневмоцистной пневмонии:
- I стадия. Происходит прикрепление пневмоцист к альвеолярной стенке. Воспалительная реакция и клинические проявления отсутствуют.
- II стадия. Отмечается десквамация альвеолоцитов, увеличение числа возбудителей в форме цист в макрофагах. В эту стадию появляются начальные клинические проявления пневмоцистной пневмонии.
- III стадия. Развивается альвеолит, плазмоцитарная инфильтрация интерстиция, гигантские скопления пневмоцист в макрофагах и альвеолах. Соответствует разгару заболевания.
Этапы развития пневмоцистной пневмонии:
- отечная фаза ‒ длится 7-10 дней, характеризуется нарастанием симптоматики;
- ателектатическая фаза ‒ продолжается в течение 4-х недель, сопровождается выраженной легочной недостаточностью;
- эмфизематозная фаза – имеет различную длительность, знаменуется обратным развитием симптоматики.
Симптомы пневмоцистной пневмонии
Инкубационный период вариабелен – от 7-10 дней до 2-4 недель (у больных СПИДом – до 10 недель). В отечную стадию клинические признаки пневмоцистной пневмонии легко спутать с обычной респираторной инфекцией. Симптомы нарастают постепенно: вначале беспокоит слабость, недомогание, субфебрилитет. Затем появляется одышка при умеренной нагрузке, боли в грудной клетке, сухой кашель.
В ателектатической стадии лихорадка принимает фебрильный характер, усиливается интоксикационный синдром (отсутствие аппетита, снижение веса, потливость по ночам). Кашель становится коклюшеподобным, постоянным, особенно беспокоит в ночное время суток. Одышка до 30-50 дыхательных движений в минуту выражена в покое. Отмечаются бледность кожных покровов с носогубным цианозом, тахикардия. В этот период пациент может погибнуть от сердечно-легочной недостаточности (СЛН).
У выживших пациентов наступает эмфизематозная стадия. Температура тела снижается, дыхательные расстройства исчезают. В исходе пневмоцистной пневмонии формируется эмфизема легких, легочное сердце. Пневмоцистная пневмония часто протекает в ассоциации с туберкулезом легких.
Четкая стадийность при пневмоцистозе прослеживается в основном у детей раннего возраста. У ВИЧ-инфицированных болезнь имеет стертое затяжное течение, у ВИЧ-негативных лиц с иммунодефицитом – более активное, с быстрым нарастанием СЛН.
Осложнения
Типичными осложнениями, развивающимися в разгар болезни, являются пневмоторакс, подкожная эмфизема, пневмомедиастинум, возникающие вследствие разрыва мелких кистозных образований. Возможно развитие абсцедирующей пневмонии. Эти состояния еще более усугубляют дыхательную недостаточность, повышают летальность. При значительном подавлении иммунитета может произойти генерализация пневмоцистной инфекции с мультиорганным поражением печени, селезенки, ЖКТ, щитовидной железы, органов зрения и слуха, лимфоузлов, костного мозга.

Диагностика
Из-за неспецифичности и стертости симптоматики существенной проблемой является гиподиагностика пневмоцистной пневмонии. Иногда патология диагностируется только посмертно. Все больные с подозрением на ПП должны быть в срочном порядке проконсультированы врачом-пульмонологом, инфекционистом. При выставлении диагноза опираются на следующие данные:
Дифференциальная диагностика
Комплексное клинико-лабораторное, рентгенологическое и бронхологическое обследование позволяет отличить пневмоцистную пневмонию от других поражений легких:
- легочного кандидоза;
- криптококковой пневмонии;
- цитомегаловирусной пневмонии;
- микоплазменной пневмонии;
- хламидийной пневмонии;
- туберкулеза легких;
- респираторного криптоспоридиоза;
- саркомы Капоши;
- бактериальной пневмонии.
Лечение пневмоцистной пневмонии
Стандартные антибактериальные средства при ПП неэффективны. В настоящее время препаратами первой линии считаются комбинированные сульфаниламиды, оказывающие противомикробное, бактерицидное и противопротозойное действие. Могут назначаться как перорально, так и внутривенно. Курс лечения составляет 1-3 недели.
При выраженных токсических эффектах и резистентности подбираются другие антибиотики, активные в отношении пневмоцист (линкозамиды, противолепрозные, противомалярийные, антипротозойные препараты). Из-за массовой гибели патогенов в первые дни терапии состояние пациентов с пневмоцистной пневмонией может ухудшиться, в связи с чем целесообразно назначение кортикостероидов.
Прогноз и профилактика
Смертность от пневмоцистной пневмонии достигает 50% среди недоношенных детей, 25-40% ‒ среди больных СПИДом. У 10-30% иммунокомпрометированных пациентов через несколько месяцев после излечения возникают рецидивы ПП. При отсутствии лечения летальность 100%.
Профилактическая работа реализуется в двух направлениях: эпидемиологическом и медикаментозном. Первый аспект предполагает широкое тестирование на пневмоцистную инфекцию представителей групп риска: пациентов с ВИЧ, онкопатологией, иммунодефицитами, недоношенных детей, сотрудников роддомов и стационаров. Второе направление – это фармакопрофилактика пневмоцистной пневмонии у лиц с количеством СД4+ клеток ˂200. Она заключается в приеме сульфаниламидов в профилактических дозах длительными курсами.
1. Пневмоцистная пневмония. Этиология, патогенез, клиника, дифференциальная диагностика, лечение (лекция)/ Боровицкий В.С.// Проблемы медицинской микологии. – 2012.
2. Пневмоцистная пневмония: исторические, эпидемиологические, клинико-морфологические аспекты/ Марковский В. Д., Плитень О. Н., Мирошниченко М. С., Мирошниченко А. А.// Annals of Mechnikov Institute, - 2012. - №3.
3. Особенности пневмоцистной пневмонии у ВИЧ-инфицированных лиц/ Пузырёва Л.В., Сафонов А.Д., Мордык А.В.// Медицинский вестник Северного Кавказа. – 2016. – Т.11, №3.
4. Пневмоцистоз. Современное состояние проблемы/ Каражас Н.В.// Альманах клинической медицины. – 2010.
Цитомегалия – это инфекционное заболевание вирусного генеза, передающееся половым, трансплацентарным, бытовым, гемотрансфузионным путем. Симптоматически протекает в форме упорной простуды. Отмечается слабость, недомогание, головные и суставные боли, насморк, увеличение и воспаление слюнных желез, обильное слюноотделение. Часто протекает бессимптомно. Опасна цитомегалия беременных: она может вызывать самопроизвольный выкидыш, врожденные пороки развития, внутриутробную гибель плода, врожденную цитомегалию. Диагностика осуществляется лабораторными методами (ИФА, ПЦР). Лечение включает противовирусную и симптоматическую терапию.
МКБ-10

Общие сведения
Другие названия цитомегалии, встречающиеся в медицинских источниках, - цитомегаловирусная инфекция (ЦМВ), инклюзионная цитомегалия, вирусная болезнь слюнных желез, болезнь с включениями. Цитомегалия является широко распространенной инфекцией, и многие люди, являясь носителями цитомегаловируса, даже не подозревают об этом. Наличие антител к цитомегаловирусу выявляется у 10—15% населения в подростковом возрасте и у 50% взрослых людей. По некоторым источникам, носительство цитомегаловируса определяется у 80% женщин детородного периода. В первую очередь это относится к бессимптомному и малосимптомному течению цитомегаловирусной инфекции.

Причины
- воздушно-капельным: при чихании, кашле, разговоре, поцелуях и т.д.;
- половым путем: при сексуальных контактах через сперму, влагалищную и шеечную слизь;
- гемотрансфузионным: при переливании крови, лейкоцитарной массы, иногда - при пересадке органов и тканей;
- трансплацентарным: во время беременности от матери плоду.
Нередко цитомегаловирус находится в организме многие годы и может ни разу не проявить себя и не нанести вреда человеку. Проявление скрытой инфекции происходит, как правило, при ослаблении иммунитета. Угрожающую по своим последствиям опасность цитомегаловирус представляет у лиц со сниженным иммунитетом (ВИЧ-инфицированных, перенесших трансплантацию костного мозга или внутренних органов, принимающих иммунодепрессанты), при врожденной форме цитомегалии, у беременных.
Патогенез
Попадая в кровь, цитомегаловирус вызывает выраженную иммунную реакцию, проявляющуюся в выработке защитных белковых антител – иммуноглобулинов М и G (IgM и IgG) и противовирусной клеточной реакцией - образованием лимфоцитов CD 4 и CD 8. Угнетение клеточного иммунитета при ВИЧ-инфекции приводит к активному развитию цитомегаловируса и вызываемой им инфекции.
Даже при бессимптомном течении инфекции носитель цитомегаловируса является потенциально заразным для неинфицированных лиц. Исключение составляет внутриутробный путь передачи цитомегаловируса от беременной женщины плоду, который происходит в основном при активном течении процесса, и лишь в 5% случаев вызывает врожденную цитомегалию, в остальных же носит бессимптомный характер.
Симптомы цитомегалии
Врожденная цитомегалия
В 95% случаев внутриутробное инфицирование плода цитомегаловирусом не вызывает развития заболевания, а протекает бессимптомно. Врожденная цитомегаловирусная инфекция развивается у новорожденных, матери которых перенесли первичную цитомегалию. Врожденная цитомегалия может проявляться у новорожденных в различных формах:
- петехиальная сыпь – мелкие кожные кровоизлияния - встречается у 60-80% новорожденных;
- недоношенность и задержка внутриутробного развития плода - встречается у 30% новорожденных;
- желтуха;
- хориоретинит – острый воспалительный процесс в сетчатке глаза, часто вызывающий снижение и полную потерю зрения.
Летальность при внутриутробном инфицировании цитомегаловирусом достигает 20-30%. Из выживших детей большая часть имеет отставание в умственном развитии или инвалидность по слуху и зрению.
Приобретенная цитомегалия у новорожденных
При инфицировании цитомегаловирусом в процессе родов (при прохождении плода по родовым путям) или в послеродовом периоде (при бытовом контакте с инфицированной матерью или грудном вскармливании) в большинстве случаев развивается бессимптомное течение цитомегаловирусной инфекции. Однако у недоношенных младенцев цитомегаловирус может вызывать затяжную пневмонию, к которой часто присоединяется сопутствующая бактериальная инфекция. Часто при поражении цитомегаловирусом у детей отмечается замедление в физическом развитии, увеличение лимфоузлов, гепатит, сыпь.
Мононуклеозоподобный синдром
У лиц, вышедших из периода новорожденности и имеющих нормальный иммунитет, цитомегаловирус может вызывать развитие мононуклеозоподобного синдрома. Течение мононуклеазоподобного синдрома по клинике не отличается от инфекционного мононуклеоза, вызываемого другой разновидностью герпесвируса – вирусом Эбштейна-Барр. Течение мононуклеозоподобного синдрома напоминает упорную простудную инфекцию. При этом отмечается:
- длительная (до 1 месяца и более) лихорадка с высокой температурой тела и ознобами;
- ломота в суставах и мышцах, головная боль;
- выраженные слабость, недомогание, утомляемость;
- боли в горле;
- увеличение лимфоузлов и слюнных желез;
- кожные высыпания, напоминающие сыпь при краснухе (обычно встречается при лечении ампициллином).
В отдельных случаях мононуклеозоподобный синдром сопровождается развитием гепатита – желтухой и повышением в крови печеночных ферментов. Еще реже (до 6% случаев) осложнением мононуклеозоподобного синдрома служит пневмония. Однако у лиц с нормальной иммунной реактивностью она протекает без клинических проявлений, выявляясь лишь при проведении рентгенографии легких.
Длительность течения мононуклеозоподобного синдрома составляет от 9 до 60 дней. Затем обычно наступает полное выздоровление, хотя на протяжении нескольких месяцев могут сохраняться остаточные явления в виде недомогания, слабости, увеличенных лимфоузлов. В редких случаях активизация цитомегаловируса вызывает рецидивы инфекции с лихорадкой, потливостью, приливами и недомоганием.
Цитомегаловирусная инфекция у лиц с ослабленным иммунитетом
Ослабление иммунитета наблюдается у лиц, страдающих синдромом врожденного и приобретенного (СПИД) иммунодефицита, а также у пациентов, перенесших пересадку внутренних органов и тканей: сердца, легкого, почки, печени, костного мозга. После пересадки органов пациенты вынуждены постоянно принимать иммунодепрессанты, ведущие к выраженному подавлению иммунных реакций, что вызывает активность цитомегаловируса в организме.
У пациентов, перенесших трансплантацию органов, цитомегаловирус вызывает поражение донорских тканей и органов (гепатит – при пересадке печени, пневмонию при пересадке легкого и т. д.). После трансплантации костного мозга у 15-20% пациентов цитомегаловирус может привести к развитию пневмонии с высокой летальностью (84-88%). Наибольшую опасность представляет ситуация, когда инфицированный цитомегаловирусом донорский материал пересажен неинфицированному реципиенту.
Цитомегаловирус поражает практически всех ВИЧ-инфицированных. В начале заболевания отмечаются недомогание, суставные и мышечные боли, лихорадка, ночная потливость. В дальнейшем к этим признакам могут присоединяться поражения цитомегаловирусом легких (пневмония), печени (гепатит), мозга (энцефалит), сетчатки глаза (ретинит), язвенные поражения и желудочно-кишечные кровотечения.
У мужчин цитомегаловирусом могут поражаться яички, простата, у женщин – шейка матки, внутренний слой матки, влагалище, яичники. Осложнениями цитомегаловирусной инфекции у ВИЧ-инфицированных могут стать внутренние кровотечения из пораженных органов, потеря зрения. Множественное поражение органов цитомегаловирусом может привести к их дисфункции и гибели пациента.
Диагностика
С целью диагностики цитомегаловирусной инфекции проводится лабораторное обследование. Постановка диагноза цитомегаловирусной инфекции основана на выделении цитомегаловируса в клиническом материале или при четырехкратном повышении титра антител.
- ИФА-диагностика. Включает определение в крови специфических антител к цитомегаловирусу - иммуноглобулинов М и G. Наличие иммуноглобулинов М может свидетельствовать о первичном заражении цитомегаловирусом либо о реактивации хронической ЦМВИ. Определение высоких титров IgМ у беременных может угрожать инфицированию плода. Повышение IgМ выявляется в крови спустя 4-7 недель после заражения цитомегаловирусом и наблюдается на протяжении 16-20 недель. Повышение иммуноглобулинов G развивается в период затухания активности цитомегаловирусной инфекции. Их наличие в крови говорит о присутствии цитомегаловируса в организме, но не отражает активности инфекционного процесса.
- ПЦР-диагностика. Для определения ДНК цитомегаловируса в клетках крови и слизистых (в материалах соскобов из уретры и цервикального канала, в мокроте, слюне и т. д.) используется метод ПЦР-диагностики (полимеразной цепной реакции). Особенно информативно проведение количественной ПЦР, дающей представление об активности цитомегаловируса и вызываемого им инфекционного процесса.
В зависимости от того, какой орган поражен цитомегаловирусной инфекцией, пациент нуждается в консультации гинеколога, андролога, гастроэнтеролога или других специалистов. Дополнительно по показаниям проводится УЗИ органов брюшной полости, кольпоскопия, гастроскопия, МРТ головного мозга и другие обследования.
Лечение цитомегаловирусной инфекции
Неосложненные формы мононуклеазоподобного синдрома не требует специфической терапии. Обычно проводятся мероприятия, идентичные лечению обычного простудного заболевания. Для снятия симптомов интоксикации, вызываемой цитомегаловирусом, рекомендуется пить достаточное количество жидкости.
Лечение цитомегаловирусной инфекции у лиц, входящих в группу риска, проводится противовирусным препаратом ганцикловиром. В случаях тяжелого течения цитомегалии ганцикловир вводится внутривенно, т. к. таблетированные формы препарата обладают лишь профилактическим эффектом в отношении цитомегаловируса. Поскольку ганцикловир обладает выраженными побочными эффектами (вызывает угнетение кроветворения - анемию, нейтропению, тромбоцитопению, кожные реакции, желудочно-кишечные расстройства, повышение температуры и ознобы и др.), его применение ограничено у беременных, детей и у людей, страдающих почечной недостаточностью (только по жизненным показаниям), он не используется у пациентов без нарушения иммунитета.
Для лечения цитомегаловируса у ВИЧ-инфицированных наиболее эффективен препарат фоскарнет, также обладающий рядом побочных эффектов. Фоскарнет может вызывать нарушение электролитного обмена (снижение в плазме крови магния и калия), изъязвление половых органов, нарушение мочеиспускания, тошноту, поражение почек. Данные побочные реакции требуют осторожного применения и своевременной корректировки дозы препарата.
Прогноз
Особую опасность цитомегаловирус представляет при беременности, так как может провоцировать выкидыш, мертворождение или вызывать тяжелые врожденные уродства у ребенка. Поэтому цитомегаловирус, наряду с герпесом, токсоплазмозом и краснухой, относится к числу тех инфекций, обследоваться на которые женщины должны профилактически, еще на этапе планирования беременности.
Профилактика
Особенно остро вопрос профилактики цитомегаловирусной инфекции стоит у лиц, входящих в группу риска. Наиболее подвержены инфицированию цитомегаловирусом и развитию заболевания ВИЧ-инфицированные (особенно больные СПИДом), пациенты после трансплантации органов и лица с иммунодефицитом иного генеза.
Неспецифические методы профилактики (например, соблюдение личной гигиены) неэффективны в отношении цитомегаловируса, так как заражение им возможно даже воздушно-капельным путем. Специфическая профилактика цитомегаловирусной инфекции проводится ганцикловиром, ацикловиром, фоскарнетом среди пациентов, входящих в группы риска. Также для исключения возможности инфицирования цитомегаловирусом реципиентов при пересадке органов и тканей необходим тщательный подбор доноров и контроль донорского материала на наличие цитомегаловирусной инфекции.
Читайте также:

