Дцп как следствие внутриутробной инфекции
Обновлено: 25.04.2024
В Украине проживает около 30 000 больных детским церебральным параличом (ДЦП). Возможности этих людей существенно отличаются: одни способны самостоятельно ходить, когда другим для этого нужна постоянная поддержка; некоторые люди обходятся без посторонней помощи в своей повседневной жизни, в то время, когда другие нуждаются в специальной, адаптированной для людей с особыми потребностями среды.
Так как проявления одного и того же заболевания так сильно различаются, родители детей с ДЦП ищут ответы на довольно распространенные и вполне закономерные вопросы:
• Почему мне не предложили диагностику ДЦП при беременности?
• Почему рождаются дети с ДЦП?
• Почему мой малыш выглядит и ведет себя совсем по-другому, чем его ровесник с таким же диагнозом?
Собственно, чтобы ответить на них, ми и подготовили эту статью.
1. Причины возникновения: история изучения ДЦП
2. Причины возникновения ДЦП при беременности
3. Факторы риска развития ДЦП в течение беременности
4. Возможна ли диагностика ДЦП при беременности?
5. Причины ДЦП во время родов
6. Факторы риска развития ДЦП во время родов
7. Причины возникновения ДЦП после рождения ребенка
8. Факторы риска развития ДЦП после рождения ребенка
9. Можно ли определить ДЦП еще в первый год жизни ребенка?
10. Мифы о причинах возникновения ДЦП
Причины возникновения: история изучения ДЦП
Достоверно известно, что все формы ДЦП возникают вследствие поражения головного мозга, который развивается. Таким образом, возникает логичный вопрос: если предпосылка одна, почему же тогда проявления этого заболевания бывают такими непохожими? Дело в том, что детский церебральный паралич является следствием повреждения разных участков головного мозга ребенка по разным причинам.
Причины возникновения - то, что вероятнее всего обусловливает развитие болезни.
Факторы риска - это свойство, особенность ребенка, или любое воздействие на него, что повышает вероятность развития заболевания (согласно официальному определению ВОЗ).
Стоит отметить, что дети, у которых наблюдаются факторы риска, не обязательно будут болеть ДЦП. Но все же они обязательно требуют особого внимания и регулярных осмотров квалифицированных специалистов, которые, в случае возникновения такой необходимости, смогут помочь с диагностикой и выбором наиболее эффективного метода лечения.
Причины возникновения ДЦП при беременности
Сегодня принято считать, что чаще всего ДЦП развивается во время беременности. По разным данным, еще до родов возникают от 70% до 90% всех случаев этого заболевания.
К установленным причинам угрозы возникновения ДЦП относятся:
1. Инфекционные заболевания матери во время беременности.
Исследования демонстрируют, что инфекции матери во время беременности увеличивают риск повреждения головного мозга плода. Самая главная опасность заключается в том, что инфекционное заболевание беременной женщины может как сопровождаться какими-либо симптомами (например, лихорадкой), так и протекать без видимых проявлений. Инфекционные возбудители, которые могут стать причиной возникновения ДЦП при беременности - это так называемые TORCH-инфекции (токсоплазма, вирус краснухи, цитомегаловирус, вирус простого герпеса), а также другие бактерии и вирусы.
2. 2. Генетические мутации.
До недавнего времени считалось, что только 1-2% случаев заболевания случаются в результате генетических мутаций. Однако в 2016 году австралийские ученые доказали, что количество разнообразных мутаций, которые можно назвать причиной возникновения детского церебрального паралича, достигает не менее 14%.
3. 3. Гипоксия плода.
Гипоксия - это недостаточное количество кислорода в крови и тканях. Она может наблюдаться у плода на протяжении всей беременности из-за действия различных факторов. Особый риск развития гипоксии возникает при фетоплацентарной недостаточности. Дело в том, что комплекс симптомов, возникающий при этом состоянии, развивается вследствие патологии плаценты. Этот орган особенно важен для ребенка, ведь он получает кислород в утробе матери именно через плаценту. Гипоксия опасна из-за значительного вреда, наносимого внутренним органам, прежде всего - головному мозгу.
4. Врожденные пороки развития головного мозга
Даже малейшее движение возникает в результате сложной работы проводящих путей нервной системы. Поэтому аномалия структуры центра проводящих путей, головного мозга, может проявляться моторными нарушениями. Исследование также это подтверждают: у людей с ДЦП чаще встречаются врожденные пороки развития головного мозга.
Факторы риска развития ДЦП в течение беременности
1. Разный резус-фактор или группа крови у матери и ребенка
Бывают случаи, когда у мамы и ребенка разные резус-фактор или группа крови. В результате такого состояния клетки крови ребенка разрушаются и возникает угроза возникновения тяжелой желтухи (почему она опасна для ребенка, читайте здесь). Поэтому при вероятности развития этого состояния необходим особый контроль еще во время ведения беременности и постоянное наблюдение за малышом после его рождения.
2. Многоплодная беременность
При беременности больше, чем одним ребенком, дети с угрозой ДЦП рождаются в 12 раз чаще. Если же один из близнецов умирает, этот риск увеличивается в 108 раз.
3. Сопутствующие заболевания матери
Риск рождения детей с угрозой развития ДЦП увеличивают некоторые заболевания матери. К ним относятся эпилепсия, заболевания щитовидной железы, ожирение, патология свертывания крови, гипертоническая болезнь, пороки сердца, сахарный диабет, анемия, а также профессиональные болезни (например, при работе с тяжелыми металлами или вибрацией).
4. Вредные привычки матери
Уже доказана взаимозависимость между курением, употреблением алкоголя или наркотиков будущими мамами и рождением детей с ДЦП. Дело в том, что данные вещества являются чрезвычайно токсичными. Они могут не только вызвать гипоксию, но и быть факторами риска врожденных пороков развития внутренних органов.
5. 5. Факторы среды
Хоть и опосредованно, но всё, что окружает будущую мать во время беременности, может сказываться и на здоровье малыша. Факторы, которые влияют на риск возникновения ДЦП при беременности - это социально-экономические условия, качество медицинских услуг и даже экологические особенности места проживания беременной женщины.
Возможна ли диагностика ДЦП при беременности?
Причины ДЦП во время родов
Еще около 20 лет назад была популярной теория, что самая частая причина рождения детей с ДЦП – это тяжелые роды. Но сегодня известно, что на самом деле риск возникновения данного заболевания во время родов составляет лишь 10-20% (согласно отчету Американского колледжа акушеров-гинекологов и Американской академии педиатрии).
Основной причиной развития ДЦП во время родов является асфиксия - острая нехватка кислорода в крови и тканях ребенка. Она особенно опасна для головного мозга, который чувствителен даже к небольшому дефициту кислорода. Асфиксия возникает из-за осложнений, которые случаются во время родов, - например, при отслойке плаценты, аномальной родовой деятельности, травме головы новорожденного ребенка.
Факторы риска развития ДЦП во время родов
1. Осложненные роды
Бывают случаи, когда даже при нормальном протекании беременности роды проходят с различными осложнениями. Это создает почву для развития гипоксии и асфиксии. Наиболее опасными осложнениями могут быть преждевременные роды (до 37 недели беременности), эклампсия, разрыв матки, патология пуповины (узлы пуповины, обвитие вокруг шеи плода, выпадение петель пуповины) и плаценты (например, ее отслоение).
2. Низкая или избыточная масса тела ребенка при рождении
Новорожденные с низкой (менее 2500 граммов) и избыточной массой тела (более 4000 граммов) имеют более высокий риск возникновения ДЦП. Большая разница в массе по сравнению с нормой только повышает этот риск.
3. Тазовое предлежание плода
Физиологическим внутриутробным положением для плода является головное предлежание. Другие виды предлежания, особенно тазовое, могут осложнять течение родов и делать их гораздо более длительными. Это создает опасные предпосылки для возможного развития асфиксии.
4. Родовые травмы
К сожалению, случается, что во время родов возникает травма головного мозга ребенка, которая может быть фактором риска возникновения заболевания. Например, это может произойти при неправильном использовании вакуумного экстрактора или акушерских щипцов.
Причины возникновения ДЦП после рождения ребенка
Уже после рождения, в первые годы жизни ребенка некоторые обстоятельства могут создавать угрозу возникновения ДЦП. По статистике, это 5-10% всех случаев. Почему же так происходит?
1. Желтуха тяжелой степени.
Причиной специфической окраски кожи при желтухе является повышение билирубина. В случае, когда данное повышение в несколько раз больше нормы и желтуха не лечится должным образом, билирубин может нанести непоправимый вред головному мозгу, который развивается. Чаще всего тяжелое течение желтухи приводит к дискинетической форме ДЦП.
2. Острое нарушение кровообращения головного мозга
Обычно эта ситуация возникает из-за сопутствующих заболеваний, которые не всегда возможно вовремя обнаружить. К таким заболеваниям можно отнести аномальное развитие сосудов головного мозга, пороки сердца, а также заболевания крови. В этом случае возникает риск развития ДЦП из-за кровоизлияния в мозг, который может случиться даже спонтанно.
3. Травма головного мозга
Травма головного мозга ребенка (например, при падении или ДТП) может привести к симптомам, характерным для детского церебрального паралича.
4. Инфекционное заболевание головного мозга ребенка
Бактериальный менингит и вирусный энцефалит - это инфекционные заболевания с поражением головного мозга. Они могут вызывать задержку двигательного и психического развития и даже потерю уже приобретенных навыков.
Факторы риска развития ДЦП после рождения ребенка:
1. Разный резус-фактор или группа крови у матери и ребенка (см. тут).
2. 2. Отсутствие вакцинации ребенка.. Многие инфекционные заболевания, которые могут привести к воспалительному процессу головного мозга и его оболочек (менингококковая инфекция, туберкулез, полиомиелит, корь), возможно предупредить с помощью создания активного иммунитета путем вакцинации.
3. Болезни крови ребенка.
Некоторые редкие болезни крови, например, тромбофилия или серповидно-клеточная анемия, могут стать причиной острого нарушения кровообращения головного мозга. Это опасное состояние бывает первым сигналом болезни, которую, к сожалению, не всегда удается заподозрить.
4. Недостаточная профилактика детского травматизма
Даже обычная бытовая ситуация может стать причиной травматического повреждения головы, такого опасного для головного мозга, который развивается. Поэтому нужно помнить, что отказ от использования автокресел при перевозке ребенка, высокие пеленальные столики и отсутствие барьеров в кроватке могут привести к серьезной травме.
Стоит отметить, что сложно, а порой даже невозможно определить точную причину рождения ребенка с ДЦП, как и время возникновения заболевания. Причины и факторы риска, приведенные выше, необязательно действуют отдельно, - возможна их комбинация, которая и вызывает каждую отдельную клиническую картину.
Можно ли определить ДЦП еще в первый год жизни ребенка?
В основном, врачи ставят диагноз детям от 12 до 24 месяцев. Однако, даже если невозможно определить ДЦП раньше этого срока, с помощью детального неврологического обследования и новейших методов диагностики уже в первые месяцы жизни возможно определить риск развития заболевания и начать лечение ребенка.
Не нужно отчаиваться из-за того, что у Вашего ребенка заподозрили ДЦП. Чем раньше известно о возможности возникновения патологии, тем быстрее можно принять меры для улучшения здоровья, двигательного и психоречевого развития малыша.
Мифы о причинах возникновения ДЦП
Напоследок, рассмотрим несколько мифов о причинах возникновения ДЦП.
Миф № 1. ДЦП – это редкое заболевание.
ДИногда родителям, у которых рождаются дети с ДЦП, может показаться, что это редкое заболевание. Однако церебральный паралич является наиболее популярной причиной двигательного нарушения, вызывающего инвалидность у детей. Порой бывает совсем неочевидно, что у человека диагностирован ДЦП, потому что его проявления могут быть минимальными.
Миф № 2. Если родился малыш с ДЦП, существует большая вероятность заболевания для будущего ребенка в этой семье.
ДЦП не является наследственным заболеванием. Существует вероятность только 1%, что дети с ДЦП будут в будущем иметь братьев или сестер с таким же заболеванием.
Миф № 3. Вакцинация является причиной ДЦП.
Не существует никаких клинических и экспериментальных доказательств взаимосвязи вакцинации и ДЦП. В то же время, инфекция, развитие которой можно предупредить с помощью введения вакцины, является одной из причин церебрального паралича.
Надеемся, что информация была полезной и хоть немного помогла ответить на такие важные вопросы о церебральном параличе. Будем ждать Ваши отзывы и предложения насчет следующей темы нашего блога. Спасибо за внимание и желаем здоровья Вашим детям.
В последние десять лет отмечается увеличение частоты врожденных инфекций, причём преимущественно вирусной этиологии. Высокая младенческая смертность, а также детская инвалидизация в результате инфекционной патологии являются серьёзной демографической проблемой. Заражение плода и инфекционный процесс может начаться во внутриутробном периоде, во время родов, либо постнатально. Это так называемые перинатальные или внутриутробные инфекции (ВУИ). Наиболее распространённые ВУИ обозначаются синдромом TORCH.
Аббревиатура TORCH используется для обозначения круга заболеваний, включающих токсоплазмоз (Toxoplasmosis), сифилис (Other), краснуху (Rubella), цитомегавирусную инфекцию (Cytomegalovirus) и герпетическую инфекцию (Herpes simplex virus).
Во многих странах эта аббревиатура изменена на STARCH, включив инфекцию, вызванную вирусом иммунодефицита человека (AIDS). Опасность синдрома TORCH и других вирусных инфекций заключается в том, что они вызывают 80% врожденных пороков развития у детей. Среди них ведущее место занимают поражение ЦНС, врожденный порок сердца и почек. Установлено, что инфицирование плода в I триместре беременности приводит к развитию у него микро-, гидроцефалии, пороков сердца, желудочно-кишечного тракта, мочеполовой системы, скелета, катаракты, глухоты.
Инфицирование во II и III триместрах вызывает у плода гепатоспленомегалию, анемию, желтуху, гипотрофию, пневмонию, менингоэцефалит, сепсис.
В Медицинском центре C0RTEX в 2008 — 2013 годах и первой половине 2014 года прошли обследование и лечение 1009 детей, с выставленным диагнозом ДЦП, олигофрении, с задержками в психоречевой и двигательной сферах не уточненного генеза. Возраст детей колебался от 9 месяцев до 20 лет. Всем детям были поведены: КЭЭГ, ВП, МРТ, ( по показаниям выполнена ПЭТ) головного мозга, УЗИ внутренних органов, клинические анализы крови и мочи по общепринятым методикам, исследование на инфекции TORCH- комплекса методами полимеразной цепной реакции и иммуноферментного анализа с определением иммуноглобулинов G и M.
У всех детей был отягощен пре- и перинатальный анамнез: угроза прерывания беременности была отмечена у 69% матерей, причем у половины из них в 1-м и 2-м семестрах, сильный токсикоз −41%, иммуноконфликт −23%, хроническая внутриутробная гипоксия плода −73%, у 31% матерей выявлено обострение генитального герпеса, 15% матерей лечились от бесплодия, более 30% матерей перенесли ОРВИ и 5% токсоплазмоз во время беременности. Признаки фетоплацентарной недостаточности наблюдались у 65% матерей, а обострение хронического уреоплазмоза, хламидиоза, микоплазмоза наблюдались у 40% матерей.
Наиболее часто у обследованных больных (более45%) верифицирована хронически-персистирующая цитомегаловирусная и герпетическая инфекция с явлениями вялотекущего лейкоэнцефалита, у −21% — нейроинфекция, обусловленная листериозом, уреаплазмозом, хламидиозом. В 18% случаев дети перенесли внутриутробно токсоплазмоз, кандидоз, микоплазмоз, осложненные уросепсисом, пневмонией с отеком легких, желудочным и кишечным кровотечением, а также менингитом и менингоэнцефалитом. У 6 % пациентов выявлены поствакцинальные поражения головного мозга. У 5% диагностирован острый менингоэнцефалит и у 3% острый радикулоганглионеврит, обусловленный ассоциацией герпетических вирусов (ВПГ, Варицелла —Зостер, Эпштейн-Барра).
У трети детей диагностирована внутриутробная пневмония, гипотрофия, у 40% — неонатальная желтуха, гепато-спленомегалия, тимомегалия и субклиническая дисфункция щитовидной железы, пороки сердца и соединительной ткани обнаружены у 10% пациентов, у 6% пороки развития мочеполовой системы, у 30% патология органов зрения (глаукома, микрофтальмия, колобома, атрофия зрительных нервов) и др. .
По данным нейровизуализации у 56% обследованных больных обнаружены субкортикальные кисты и кисты в парехиме мозга, у 42% — субатрофия коры больших полушарий, вентрикуломегалия — 46%, очаги глиоза и перивентрикулярной лейкомааляции — 52%, истончение мозолистого тела — 27%, врожденные аномалии мозга −11%, внутрижелудочковые кровоизлияния 65% и окклюзии ликворовыводящих путей — 2%.
Но, что же происходит на самом деле?
К сожалению, не все медицинские учреждения соблюдают эти правила и требования, что отражается на точности результатов.
Другой вариант. Если у ребёнка изначально было тяжёлое состояние при рождении, а затем он плохо развивается и выявляются пороки развития других органов, то выставляется диагноз; последствие перенесенной ВУИ, а детей предлагают сдать в специальный интернат, как бесперспективных.
Таким образом хронические ВУИ не только поддерживает выраженность имеющихся неврологических и психических дефектов у ребёнка, но и в дальнейшем утяжеляет их степень, или в случае их отсутствия вызывает их развитие.
Обращаем внимание родителей на следующее.
Если у Вашего ребёнка имеется даже незначительная задержка в развитии, или нет эффекта от проведённого лечения при уже выставленном диагнозе: детский церебральный паралич, задержка психо-речевого или моторного развития, умственная отсталость, эпилепсия, аутизм и т.д. — необходимо срочно принять все меры к обследованию ребенка в нашем центре, с целью уточнения диагноза и причины его возникновения, а также проведения своевременного патогенетического лечения.
Медицинский центр CORTEX в настоящее время проводит эффективное лечение таких пациентов в рамках новой медицинской технологии лечения детского церебрального паралича, разработанной под руководством академика Василенко Ф.И.

Впервые разработана концептуально новая медицинская технология патогенетического лечения детского церебрального паралича и задержек в психическом, речевом и моторном развитии детей, которую можно считать основой эффективного комплексного лечения этого заболевания.
В составе комплексного лечения проводится диагностика, основное патогенетическое лечение и реабилитационные процедуры.
Помимо инструментального обследования головного и спинного мозга, совместно с лабораторной службой Хеликс проводится высокоточное вирусологическое исследование крови на TORCH — синдром (в соответствии с правилами GCP и GLP) с оценкой клеточного, гуморального иммунитета для исключения аутоиммунного демиелинизирующего процесса с % определением деструкции белого вещества мозга , и прогнозирования клинического исхода перинатальной гипоксии что позволяет уточнить природу заболевания. Это нейроиммунологическое исследование (технология и набор специальных тестов) разработано совместно с государственным медицинским университетом им. И.И. Мечникова. Очень важно качественно провести исследование крови по данной методике. Выбрана лабораторная служба Хеликс.
Поэтому специалисты МЦ CORTEX , основываясь на высокоточном исследовании крови, назначают эффективное лечение выявленной внутриутробной инфекции, что способствует повышению эффективности лечения ДЦП, умственной отсталости, ЗПРР, аутизма и других заболеваний.
Само словосочетание перинатальный период говорит о том, что перинатальное поражение ЦНС развивается у еще не родившегося или только появившегося на свет ребенка.
Перинатальное поражение центральной нервной системы (ППЦНС) — это не один, а несколько диагнозов, которые подразумевают нарушение функций работы в головном мозге новорожденного ребенка и могут привести к стойким неврологическим последствиям в более старшем возрасте (например, ДЦП, ЗПРР).
Весь перинатальный период условно делится на три этапа:
– с 28 недели и до момента родов длится антенательный период;
– сам процесс родов называется интранатальным периодом;
– неонатальный период это промежуток времени с момента рождения до 7 дня жизни включительно.
В современной медицине нет точного названия заболевания при поражении ЦНС плода, есть только сборное, его называют ППЦНС или же перинатальная энцефалопатия. Перинатальное поражение ЦНС у новорожденных, проявляется нарушениями в работе двигательного аппарата, нарушением речи и психики.
С развитием медицины, перестали данный диагноз употреблять для детей старше одного месяца. По истечении месяца врач должен поставить точный диагноз ребенку. Именно в этот период невролог с точностью определяет, насколько сильно повреждена нервная система. Назначает лечение и следит за тем, чтобы оно было подобрано правильно.
Каковы причины и факторы риска ППЦНС?
Причины, по которым может развиться перинатальное поражение центральной нервной системы достаточно разнообразны, среди самых популярных:
– соматическое заболевание матери, которое сопровождается хронической интоксикацией;
– наличие острых инфекционных заболеваний или хронических очагов инфекции, в то время когда будущая мать вынашивала ребенка;
– в случае, если у женщины нарушен процесс питания, или же она не созрела для беременности и родов;
– нарушение маточно-плачцентарного кровотока во время беременности;
– изменения в обмене веществ также влечет за собой расстройство нервной системы у будущего ребенка (повышение уровня биллирубина, неонатальная желтуха);
– в случае сильного токсикоза, как на ранней стадии, так и на поздней, или появление иных проблем с вынашиванием ребенка;
– окружающая среда выступает немаловажным фактором в развитии заболевания;
– появление патологии во время родов — это может быть слабая родовая деятельность, ускоренные роды;
– если ребенок рождается недоношенным, то и его организм не развит полностью, поэтому на данном фоне может появиться нарушение в работе ЦНС;
– наибольшему риску развития поражений ЦНС подвержены малыши, у которых присутствует наследственный фактор.
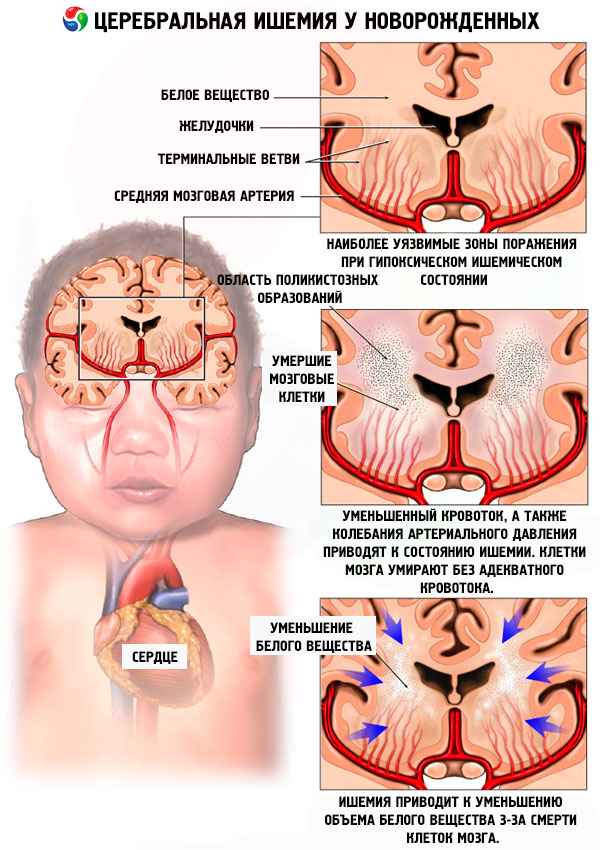
Все остальные причины возникновения ППЦНС ситуативные и в большей степени предугадать их появление просто нельзя.
Выделяют несколько путей развития перинатального поражения ЦНС у новорожденных детей в зависимости от причины и последующей симптоматики, анализ которых позволяет поставить первоначальный диагноз:
– Если четко зафиксирован недостаток кислорода, во время нахождения малыша внутри организма матери (гипоксия), то диагностируют гипоксическое поражение ЦНС.
– Во время родов у младенца может быть повреждена тканевая структура (это может быть как головной мозг, так и спинной). В этом случае, уже идет речь о травматическом поражении ЦНС, в результате чего появляются изменения в работе головного мозга.
– В случае нарушения обмена веществ могут появиться метаболические и токсико-метаболические поражения. Это может быть связано с употреблением во время беременности алкоголя, лекарственных препаратов, никотина.
– Изменения в ЦНС при наличии инфекционных заболеваний перинатального периода.
Какие бывают разновидности синдромов ППЦНС?
ППЦНС условно делится на несколько периодов, в зависимости от того, на какой стадии было выявлено нарушение и как оно проявилось.
– Острый период длится от 7 до 10 дней, крайне редко, но он может растянуться и до месяца.
– Период, в которым происходит восстановление (восстановительный период), может длиться до 6 мес. Если организм ребенка восстанавливается медленно, то данный период может занять до 2 лет.
Детские неврологи выделяют следующие разновидности перинатальных поражений ЦНС в зависимости от сопутствующих симптомов и синдромом:
– Нарушение мышечного тонуса. Этот синдром диагностируется согласно отклонениям от нормы в зависимости от возраста грудного ребенка. В начальный период времени жизни ребенка, достаточно сложно диагностировать данный синдром, так как помимо этого встречается физиологический гипертонус (физиологическая скованность мышц новорожденного).
– Синдром нервно-рефлекторной возбудимости - синдром, связанный с нарушением сна, дрожанием подбородка, вздрагиваниями ребенка на любой шорох или прикосновение. Данный синдром можно диагностировать только в том случае, когда будет исключены соматические заболевания новорожденного (например, кишечные колики). При осмотре такого ребенка невролог определяет повышение сухожильных рефлексов, а также усиление (оживление) автоматизмов новорожденного (рефлекс Моро).
– Синдром угнетения нервной системы. Такой синдром по своим характеристикам противоположен предыдущему. Его диагностируют у детей, которые в первые месяцы своей жизни не активны, они много спят, у них понижен тонус, они не могут удерживать голову, плохо цепляются своими ручками.
– Одним из наиболее опасных и тяжелых состояний при ППЦНС является судорожный синдром, именно он является одним из наиболее серьезных проявлений при перинатальном поражении ЦНС.
Кроме того, любая внимательная мама может заметить отклонения в состоянии здоровья у своего ребенка намного быстрее, чем врач невролог, хотя бы потому, что она наблюдает за ним круглосуточно и не один день.

В любом случае, малыш, живя первый год с любыми (даже минимальными, но не проходящими) отклонениями в состоянии здоровья требует неоднократных консультаций у специалистов медицинского центра, включение его в программу диспансеризации (т.е. пристального наблюдения неврологом и при необходимости — дополнительного обследования, такого как УЗИ головного мозга, электроэнцефалография, исследование крови для определения компенсаторного потенциала нервной системы и т.д.). На основании полученных заключений специалистами центра разрабатывается план развития такого ребенка, подбирается индивидуальная схема профилактических прививок, введения прикормов в рацион питания, а также проведения лечебных мероприятий при необходимости.
Какие симптомы и диагностические критерии у ППЦНС?
– Не каждая мама, которая не имеет медицинского образования, сможет на первый взгляд отличить и определить, что у ее ребенка перинатальное поражение ЦНС. Но, неврологи с точностью определяют заболевание по появлению симптомов, которые не свойственны другим нарушениям.
– при осмотре малыша может быть обнаружен гипертонус или гипотонус мышц;
– ребенок чрезмерно беспокоен, тревожен и возбужден;
– возникновение дрожания в области подбородка и конечностей (тремор);
– при осмотре с молоточком заметно нарушение рефлекторной сферы;
– появление неустойчивого стула;
– меняется частота сердечных сокращений; появление неровностей на коже ребенка.
Как правило, после года данные симптомы пропадают, но затем появляются с новой силой, поэтому запускать данную ситуацию просто нельзя. Одним из наиболее опасных проявлений и последствий ППЦНС при отсутствии реакции на симптоматику является приостановка развития психики ребенка. Не развивается речевой аппарат, наблюдается задержка развития моторики. Также одним из проявлений заболевания может стать церебрастенический синдром.
Как лечат ППЦНС?

Для восстановления основных функций ЦНС, а также для снижения проявления неврологических симптомов малышу назначаются целый комплекс лечебных препаратов. В лечении могут применяться, например, ноотропные препараты, которые смогут восстановить трофические процессы в работе головного мозга — пирацетам, церебролизин, кортексин, пантокальцин, солкосерил и многие другие. Для того чтобы простимулировать общую реактивность новорожденному ребенку проводят курс лечебного массажа, специальной гимнастики, а при необходимости комплекс физиотерапевтических процедур (напрмер, электрофорез и микротоки).
В случае, если родители обнаружили хотя бы один из признаков поражений ЦНС необходимо срочно обратиться к врачу. Не стоит забывать о том, что развитие каждого ребенка процесс индивидуальный. Такие индивидуальные особенности новорожденного ребенка в каждом конкретном случае играют немаловажную роль в процессе восстановления функций высшей нервной деятельности.
В чем опасность и последствия ППЦНС?
Среди специалистов бытует мнение о том, что в случае, если была поражена центральная нервная система плода, то полностью восстановлена она быть не может. Но неврологи-практики утверждают обратное. Они говорят о том, что если правильно и своевременно лечить заболевание, то можно добиться частичного или полного восстановления функций нервной системы. Но даже несмотря на такой оптимистический прогноз, если смотреть на все возможные заболевания ребенка, связанные с нервной системой, то к инвалидности приводит 50 % от их общего количества, при этом около 80 % от него отведено на перинатальное поражение центральной нервной системы.
В последние годы отмечается увеличение частоты врожденных инфекций, причем преимущественно вирусной этиологии, которая выявляется современными методами до 50-60% в перинатальном периоде, а в 37,5% результатов паталого-анатомических вскрытий мертворожденных, инфекционная патология является основной причиной смерти (Сидорова И.С. с соавт., 2008). Высокая младенческая смертность, а также детская инвалидизация в результате инфекционной патологии являются серьёзной демографической проблемой. Заражение плода и инфекционный процесс может начаться во внутриутробном периоде, во время родов, либо постнатально. Это, так называемые, перинатальные или внутриутробные инфекции (ВУИ). Наиболее распространенные ВУИ обозначаются синдромом TORCH или STARCH.
Аббревиатура STARCH используется для обозначения круга заболеваний, включающих токсоплазмоз (Toxoplasmosis), сифилис (Other), краснуху (Rubella), цитомегаловирусную инфекцию (Cytomegalovirus), герпетическую инфекцию (Herpes simplex virus) и инфекцию, вызванную вирусом иммунодефицита человека (AIDS). Опасность синдрома STARCH и других вирусных инфекций заключается в том, что они вызывают 80% врожденных пороков развития у детей. Среди них ведущее место занимают поражение центральной нервной системы, врожденные пороки сердца и почек, других органов и систем организма, установлено, что инфицирование плода в I триместре беременности приводит к развитию у него микро-, гидроцефалии, пороков сердца, желудочно-кишечного тракта, мочеполовой системы, скелета, катаракты, глухоты. Инфицирование во II и III триместрах вызывает у плода гепатоспленомегалию, анемию, желтуху, гипотрофию, пневмонию, менингоэнцефалит, сепсис.
В настоящей работе приводятся результаты анализа прошедших под нашим наблюдением обследование и лечение 105 детей с диагнозом ДЦП. Возраст детей колебался от 6 месяцев до 14 лет. Больным были проведены: компьютерная электроэнцефалография с вызванными потенциалами, магниторезонансная томография (по показаниям выполнена позитронно-эмиссионная томография) головного мозга, ультразвуковое исследование внутренних органов, клинические анализы крови и мочи по общепринятым методикам, исследование на инфекции STARCH — комплекса методами полимеразной цепной реакции и иммуноферментного анализа с определением иммуноглобулинов G и M.
У всех детей был отягощен акушерский и перинатальный анамнез: угрозы прерывания беременности была отмечена у 69% матерей, причем у половины из них в 1-м и 2-м триместрах, тяжелый гистоз — 41%, иммуноконфликт — 23%, у 31% матерей выявлено обострение генитального герпеса, 15% лечились от бесплодия, более 30% перенесли ОРВИ, 5% — токсоплазмоз во время беременности. Признаки фетоплацентарной недостаточности наблюдались у 65%, а обострение хронического уреоплазмоза, хломидиоза, микоплазмоза — у 40% матерей, хроническая внутриутробная гипоксия плода (ХВГП) — у 73%.
На наш взгляд, вклад ХВГП в развитие ДЦП значительно преувеличен, так как любой инфекционный процесс протекает с признаками гипоксии, и во многих случаях влияние внутриутробной инфекции, по нашему мнению, является доминирующим.
Наиболее часто у обследованных больных детей (45%) верифицирована хронически-персистирующая цитомегаловирусная или герпетическая инфекция с явлениями вялотекущего лейкоэнцефалита, арахноидита. У 21% -нейроинфекция, обусловленная листериозом, уреоплазмозом, хламидиозом. В 18% случаев дети внутриутробно перенесли токсоплазмоз, кандидоз, микоплазмоз, осложненные уросепсисом, пневмонией с отеком легких, желудочным и кишечным кровотечением, а также менингитом и менингоэнцефалитом. У 5% в период новорожденности диагностирован острый менингоэнцефалит и у 3% острый радикулоганглионеврит, обусловленный ассоциацией герпетических вирусов (вирус простого герпеса, Варицелла-Зостер, Эпштейна — Барра).
У трети детей диагностирована внутриутробная пневмония, гипотрофия; у 40% -неонатальная желтуха, гепатоспленомегалия, тимомегалия и субклиническая дисфункция щитовидной железы; пороки сердца и дисплазия соединительной ткани обнаружены у 10% пациентов, у 6%- пороки развития мочеполовой системы. У 30% патология органов зрения (глаукома, микрофтальмия, колобома, атрофия зрительных нервов) и др.
По данным нейровизуализации, у 56% обследованных больных обнаружены субкортикальные кисты в паренхиме мозга, у 42% — субатрофия коры полушарий конечного мозга, вентрикуломегалия — 46%, очаги глиоза и перивентрикулярной лейкомаляции — 52%, истончение мозолистого тела —27%, врожденные аномалии мозга —11%, внутрижелудочковые кровоизлияния — 65%, окклюзии ликворовыводящих путей — 2%.
У большинства детей с перенесенными ВУИ клинически наблюдалось формирование грубого неврологического дефекта (до 77% от общего числа пациентов) в виде центрального тетрапареза, парапареза, гемипареза или, спастической диплегии, гемиплегии, других признаков пирамидной недостаточности, статомоторной и сенсетивной атаксии, гиперкинезов, повышения позо- и вестибулотонических рефлексов.
У 45% наблюдались интеллектуальные и поведенческие нарушения, эпилептический синдром — у 55%. При более легком исходе перенесенных ВУИ в 33% случаев выявлен синдром минимальной мозговой дисфункции (ММД) в виде гиперактивности с дефицитом внимания. Данные нарушения отличались стойкостью проявлений и резистентностью к медикаментозному лечению, а также в 15% переходящих в нарушения поведения.
Иммунологический статус у детей определялся с использованием моноклональных антител CD3, CD4, CD8, CD19, CD16, CD20 и лейкоцитарной формулы в мазке крови. Иммуноглобулины определялись методом радиальной диффузии в геле по Манчине. Все дети были разделены на 3 группы в зависимости от возраста. В первую группу вошли дети до 1,5 лет, средний возраст которых составил 13,4 месяцев. Во вторую группу вошли дети от 1,5 до 6 лет, средний возраст которых составил 46,7 месяцев. Третью группу составили дети в возрасте от 6 до 14 лет, средний возраст которых составил 10,8 лет.
В первой группе средние иммунологические показатели не выходили за разброс нормальных значений у здоровых детей. Только у одной трети детей отмечалось резкое снижение общего пула лимфоцитов как в процентах (20% против 48% нижней границы нормы), так и в абсолютном показателе (1180 против 4860,2×10 6/л нижней границы нормы). Соответственно ниже нормы были CD3 в %-м и в абсолютном показателях. Так же были снижены абсолютные показатели CD16 (НК-клетки). Это клинически совпало с активной фазой вирусной нейроинфекции. В среднем по 2-ой группе у половины детей (50%) отмечалось снижение количества CD4 (хелперов/индукторов) в процентах и в абсолютном показателе, и показателя иммунорегуляторного индекса (ИРИ) 1,6 0,1 против 2,4 0,1 в норме, что указывает на нарушение соотношения иммунорегуляторных субпопуляций CD4/CD8. Помимо этого наблюдалось снижение абсолютного показателя В-лимфоцитов (CD19) у 30% детей и JgА у 48% больных.
В 3-ей группе на фоне относительного лейкоцитоза отмечался существенный лимфоцитоз. В среднем по группе 47,2 2,5 против 30,2 1,9 в 25% случаев лимфоцитоз был выше 50%. Субпопуляция CD4 (хелперы/индукторы) в 26% случаев была ниже нормы, как в относительном, так и в абсолютном показателях. Субпопуляция CD8 (цитотоксические супрессорные лимфоциты) в среднем по группе была снижена и составила 25,0 1,9 % против 31,5 2,2% в норме, а в 26% случаев CD8 была значительно сниженной, менее 17,5%. ИРИ в 60% случаев был ниже нормы. Количество В-лимфоцитов(CD19) в 26% случаев было снижено, что сказалось на количестве иммуноглобулинов в сыворотке крови больных детей. Выработка JgА в 50% случаев была ниже нормы. Уровни JgМ у 38,4% детей были выше нормы, а JgG в 23% случаев ниже нормы. Отмечено снижение количества НК-клеток (CD16) в относительном показателе в 25% случаев, а в абсолютном у 49% детей. Что соответствовало активной фазе вирусной нейроинфекции. Тяжесть нейроинфекции и неврологического дефекта коррелировала с выраженностью нарушений иммунорегуляторных субпопуляций НК-клеток, снижением CD4 и CD8.
Вирусы и некоторые другие возбудители инфекции могут персистировать в организме и жить либо в ганглиях (нервных узлах) черепных нервов в случае герпеса, либо в слюнных железах при цитомегаловирусе и т.д. Затаившиеся вирусы при удобном случае (переохлаждение, гиперинсоляция, стресс, ОРЗ и т.д.) начинают активизироваться, размножаться и проникать в мозг гематогенно либо периаксонально. Этому способствует несовершенность иммунитета у данной группы детей, что способствует развитию хронической вялотекущей или рецидивирующей нейроинфекции, которая приводит к усугублению и прогрессированию поражения всего вещества мозга, понижению функции гематоэнцефалического барьера, разрушению миелиновых оболочек аксонов, снижению общего иммунитета. А так же дисфункции клеток сосудистых сплетений желудочков мозга, что приводит к гиперсекреторному или арезорбтивному эффекту ликвородинамики с развитием гемоликворной дистензии. Эти изменения вызывают декомпенсацию уже имеющейся гидроцефалии, или приводят к ней. Увеличенные внутримозговые желудочки постоянно сдавливают проводящие пути, что не способствует компенсации двигательных расстройств и других сопутствующих нарушений функций головного мозга.
Хронические ВУИ с вторичным иммунодефицитном состоянии не только поддерживают выраженность имеющихся неврологических и психических дефектов у ребенка, но и в дальнейшем утяжеляют их степень, являются фактором прогредиентного или рецидивирующего течения ДЦП. На наш взгляд, именно этим можно объяснить появление новых сопутствующих синдромов ДЦП.
Необходимо подчеркнуть, что в случаях неблагоприятного, прогредиентного течения у ребенка ДЦП, отсутствия положительного эффекта под влиянием общепринятых (стандартных) абилитационных программ, необходимо исключить инфекционную компоненту в этиологии ДЦП.
В таких случаях помимо инструментального обследования головного и спинного мозга (в том числе МРТ и ПЭТ), проводить исследование крови на STARCH — синдром (в соответствии с правилами GCP и GLP), с оценкой клеточного, гуморального иммунитета для исключения аутоиммунного демиелинизирующего процесса, с процентным определением деструкции белого вещества мозга и прогнозирования клинического исхода перинатальной гипоксии. Все это позволит уточнить не только природу заболевания, но и его дальнейшую тяжесть.
Таким образом, можно полагать, что ВУИ имеют высокую значимость в этиологии и патогенезе развития ДЦП.
Среди заболеваний нервной системы, выявляемых у детей, наиболее распространенное – детский церебральный паралич (ДЦП), который характеризуется клинически неблагоприятным течением и ранней инвалидизацией пациентов. Частота этого заболевания составляет 2–2,5 случая на 1000 новорожденных.
Согласно современным представлениям ДЦП – это группа перманентных нарушений, ограничивающих развитие двигательных навыков и рефлексов, формирующих позу ребенка, которые связаны с непрогрессирующим повреждением развивающегося головного мозга плода или новорожденного, часто сопровождаются расстройствами чувствительности и восприятия, а также нарушениями познавательной деятельности и поведенческих реакций. Повреждение головного мозга при ДЦП происходит задолго до рождения ребенка, а регресса симптоматики заболевания не наблюдается на протяжении всей жизни больного. Практикующие врачи (педиатры, неврологи, ортопеды и др.) сталкиваются в большинстве случаев с его остаточными проявлениями.
В этиологии заболевания ведущую роль отводят гипоксии, пери- и интравентрикулярным кровоизлияниям, перивентрикулярной лейкомаляции, внутриутробной инфекции и родовой травме.
Наряду с этим выделяют значительное число факторов риска, способствующих повреждению незрелого мозга плода: во внутриутробном периоде (неинфекционные заболевания у беременной женщины, прием антибиотиков, патология плаценты), при родах (акушерские пособия и кесарево сечение) и в раннем неонатальном периоде жизни ребенка (низкая оценка по шкале Апгар, свидетельствующая об асфиксии у новорожденного, и др.). Полиэтиологичность заболевания предполагает отсутствие единого подхода к объяснению механизмов его формирования или разнообразие самих механизмов, что косвенно подтверждается полиморфизмом клинических проявлений ДЦП: различают спастические, атактическую, дискинетическую и смешанную формы заболевания. Вместе с тем универсальность неспецифических механизмов, лежащих в основе патогенеза заболеваний нервной системы, обусловленная стандартным ответом нервной ткани при ее повреждении, позволяет обнаружить сходные структурные изменения в головном мозге детей с разными клиническими формами церебральных параличей.
Ультразвуковым методом у больных детским церебральным параличом в раннем возрасте в головном мозге выявляют порэнцефалические кисты и увеличенные размеры желудочков. Показано, что эти изменения связаны с кровоизлиянием в полость желудочков мозга. Наряду с этим ультразвуковое исследование головного мозга при детском церебральном параличе позволяет выявить снижение плотности перивентрикулярного белого вещества, что может быть обусловлено не только воздействием гипоксии, но и кровоизлиянием в эту область.
Методами МРТ установлено, что повреждение перивентрикулярной области возможно как на ранних этапах внутриутробного развития плода, так и в более поздние сроки. В этом случае так называемое окно уязвимости формируется в III триместре беременности, между 24-й и 34-й неделями внутриутробного развития. Предполагают, что в этом периоде вследствие повреждения свободными радикалами олигодендроглиоцитов, которые локализуются в перивентрикулярной области, нарушается формирование их миелиновых мембран.
На основе МРТ было также установлено, что у больных детским церебральным параличом повреждается не только перивентрикулярная область, но и нейронные структуры головного мозга. В зависимости от сроков повреждения при поражении серого вещества головного мозга у больных детей выявляют грубые пороки развития или умеренные дефекты.
Пороки развития головного мозга связывают с задержкой пролиферации нейронов, нарушением их миграции, нарушением образования архитектоники клеточных колонок и организации неокортекса. Миграция нейробластов в корковую пластинку (кору больших полушарий) начинается с ранних стадий ее развития. Кора больших полушарий головного мозга человека формируется по типу вертикальных, или радиальных колонок. Длинноаксонные нейроны – клетки пирамидного и веретеновидного типа, составляющие основу этих колонок (на ранних стадиях это нейробласты, мигрировавшие в корковую пластинку), начинают быстро развиваться задолго до дифференцировки коры на слои и миграции в нее короткоаксонных нейронов. Подобный тип развития корковой пластинки позволяет предположить, что вертикальные структуры коры больших полушарий мозга человека формируются раньше гори- зонтальных – слоев коры. Опережающая дифференцировка вертикальных структур коры может быть обоснована концепцией, согласно которой вертикальная организация коры отличается простотой строения – работает по типу классифицирующей машины и неспособна обучаться, что можно сопоставить с такими данными: к рождению ребенка вертикальные структуры коры (совокупность длинноаксонных нейронов) поля 4 характеризуются высокой степенью морфохимической дифференцировки, но двигательные условные рефлексы у ребенка еще не вырабатываются. Эти рефлексы начинают формироваться на основе ориентировочных реакций не раньше чем через 1,5 мес после рождения, а произвольные движения – с 3–4-го месяцев жизни. Следовательно, вертикальная колоночная организация сама не способна обеспечить работу коры на должном аналитико-синтетическом уровне. Для этого требуется созревание другой части единой системы – горизонтальной, т.е. слоев коры.
У больных ДЦП чаще выявляют такие пороки развития головного мозга, как голопрозэнцефалия, лиссэнцефалия, шизэнцефалия, пахигирия и полимикрогирия.
Подобного рода изменения чаще имеют двустороннюю и симметричную локализацию в правом и левом полушариях головного мозга и сопровождаются нарушением дифференцировки корковой пластинки на отдельные слои (при типичной микрогирии в поперечнике коры различают 4 слоя). Аналогичные пороки развития головного мозга регистрируют у больных, которые перенесли врожденную цитомегаловирусную инфекцию и впоследствии имели клинические проявления детского церебрального паралича.
Умеренные дефекты в структурах головного мозга чаще описывают как атрофические изменения различных отделов корковой пластинки и очаги глиоза, которые формируются в III триместре внутриутробного развития. К этому же периоду относят поражения подкорковых ядер. Поражение подкорковых ядер, в частности чечевицеобразного ядра, и минимальные изменения в корковой пластинке обнаруживают при неспастических формах ДЦП, тогда как генерализованные корково-подкорковые поражения, сопровождающиеся морфологическими изменениями в височной области коры, гиппокампе, подлежащем белом веществе и других образованиях головного мозга, наблюдается при спастических формах этого заболевания, осложненных эпилепсией. Поражения мозжечка у больных детским церебральным параличом регистрируют в виде инфарктов, симметричных и асимметричных атрофических изменений, нередко сочетающихся с увеличением IV желудочка.
Кроме того, показано, что в неонатальном периоде наиболее часто структурные изменения в головном мозге определяют в связи с развитием перинатальных артериальных ишемических инсультов, которые в 39% случаев приводят к формированию ДЦП. Методами МРТ регистрируют инфаркты в области внутренней сонной артерии, передней и средней мозговых артерий. Наряду с этим у больных выявляют глубокие инфаркты серого вещества головного мозга.
Другим типом инфаркта головного мозга, который наблюдается при ДЦП, является неонатальный венозный перивентрикулярный инфаркт. По распространенности он не только не уступает артериальным ишемическим инсультам, но и превышает их (в соотношении 62 : 44). С этим типом инфаркта связывают формирование гемиплегической формы заболевания.
С помощью МРТ можно получить представление о локализации очага повреждения и наличии атрофии нейронных структур в образованиях головного мозга, но этот метод не позволяет определить объем той или иной структуры у каждого пациента и сопоставить его с аналогичными показателями в контрольной группе. Подобную возможность предоставляет воксел-ориентированная морфометрия – метод компьютерного моделирования, основанный на трехступенчатой процедуре выравнивания, т.е. наложения каждого МРТ-среза на соответствующее сканированное изображение. При помощи этого метода у пациентов с ДЦП по сравнению с контрольной группой выявили уменьшение объема серого вещества в передней и задней центральных извилинах, парацентральной дольке и зрительной области коры головного мозга. Этим же методом у детей с церебральными параличами регистрировали уменьшение объема серого вещества в островке мозга, таламусе, подкорковых ядрах (чечевицеобразном ядре и ограде) и левой ножке мозга.
Вместе с тем для прогнозирования возможных последствий повреждения головного мозга в перинатальном периоде данных, полученных методами функциональной диагностики и МРТ, явно недостаточно, так как они не дают полной картины повреждений.
Наиболее объективно процесс повреждения головного мозга отражают патологоанатомическое и патогистологическое исследование аутопсийного материала. На аутопсийном материале у детей с ДЦП было выявлено поражение большинства образований головного мозга. На макроскопическом уровне это проявлялось уменьшением размеров полушарий большого мозга и полушарий мозжечка, атрофией лобных и затылочных долей, полимикрогирией, истончением мозолистого тела, уменьшением размеров базальных ядер и таламуса, размягчением белого вещества. Морфологические изменения, определяемые при патологоанатомическом исследовании у больных ДЦП, существенно отличались от изменений, выявляемых у детей, перенесших черепно-мозговую травму в возрасте 2–3 мес и умерших впоследствии в промежутке от 2,5 года до 17 лет.
Гистологическое исследование, проведенное у больных детским церебральным параличом, позволило обнаружить в белом веществе перивентрикулярной области цитотоксический отек, вакуолизацию глиальных элементов, пикноз их ядер и набухание аксонов. Кроме того, отмечали реакцию астроглии и макрофагов. Астроглию локализовали при помощи иммуногистохимических реакций на выявление виментина и кислого глиофибриллярного белка GFAP. Астроцитарная реакция выражалась в формировании глиального рубца, отграничивающего очаги лейкодистрофии, и в наличии некроза в белом веществе. Макрофаги определяли реакцией на микроглиальный маркер Iba1 и маркеры макрофагов CD45, CD68 и др. В результате обнаружили, что увеличение числа макрофагов сопровождалось накоплением в них липидов. Клетки микроглии, представляющие собой иммунокомпетентные макрофаги, мгновенно реагируют на мельчайшие изменения в нервной ткани при патологических состояниях, фагоцитируя поврежденные нейроны и сокращая количество аксонов.
В двигательной области коры больших полушарий (поля 4 и 6) головного мозга у больных ДЦП находили очаговое выпадение типичных пирамидных нейронов в III и V слоях и, напротив, сохранение клеточных элементов IV слоя, что нехарактерно для агранулярной коры. Кроме того, в двигательной области коры обнаруживали множественные нейронные гетеротопии. При изучении нейроглиальных взаимоотношений выявляли уменьшение плотности расположения нейронов в области ядер черепных нервов, начиная со второго года жизни. В зрительной области коры (поле 17) во всех слоях корковой пластинки у больных определяли перицеллюлярный отек. У больных детей первого года жизни II–IV слои не были четко дифференцированы и выглядели как сплошной клеточный конгломерат. В I и IV слоях корковой пластинки были выявлены гетеротопии нервных клеток. Плотность расположения нейронов в основных слоях поля 17 зрительной коры у детей с детским церебральным параличом существенно отставала от контроля, тогда как плотность расположения глиоцитов начиная с 3 мес жизни превышала контрольные величины.
Морфологические изменения у детей с ДЦП, обнаруженные в двигательной и зрительной областях коры головного мозга (недостаточная дифференцировка слоев верхнего этажа корковой пластинки, отставание от нормы показателя плотности расположения нейронов, значительный глиоз), коррелировали с изменениями, выявленными в коре теменной области мозга у детей с тяжелыми формами другого заболевания – врожденной гидроцефалии. Учитывая врожденный характер этих заболеваний, можно предположить, что незавершенность формирования клеточных слоев корковой пластинки в обоих случаях могла быть связана как с морфофункциональной незрелостью нервных клеток, так и с нарушением дифференцировки корковой пластинки на отдельные слои. Указанные изменения могли быть обусловлены воздействием на плод гипоксии или инфекции, т.е., они отображали неспецифические реакции нервной ткани в ответ на воздействие неблагоприятных факторов.
Недостаточная дифференцировка слоев верхнего этажа корковой пластинки у детей с ДЦП свидетельствует о повреждении у них головного мозга на этапе дифференцировки поперечника коры на отдельные слои, которое завершается на 25–27-й неделе внутриутробного развития, а изменения в местоположении у них нервных клеток (гетеротопия) предполагает нарушение миграции нейронов в плащевой отдел (миграция протекает с 14-й по 23-ю неделю внутриутробного развития).
Таким образом, обобщая изложенное, можно сделать вывод, что при ДЦП повреждение головного мозга может происходить на разных этапах внутриутробного развития плода.
В одних случаях оно наблюдается в период миграции нейробластов вдоль отростков радиальной нейроглии в плащевой отдел (нейронные гетеротопии), в других – на этапе развития и дифференцировки нейронов (отставание в размерах тел нейронов). Третий вариант – повреждение головного мозга на этапе дифференцировки поперечника корковой пластинки на отдельные слои (слабая дифференцировка нейронов верхнего этажа коры, сохранение IV слоя в агранулярной коре), четвертый вариант – повреждение на этапе формирования борозд и извилин (признаки корковой дисплазии – лиссенцефалия, шизэнцефалия и др.). В остальных случаях головной мозг у детей поражается в более поздние сроки, чаще в последние месяцы внутриутробного развития, когда ткани плода реагируют воспалительной реакцией в ответ на воздействие неблагоприятных факторов. Следовательно, этап внутриутробного развития, во время которого происходит неблагоприятное воздействие, определяет особенности поражения головного мозга и локализацию повреждения, а также характер ответа нервной системы.
Читайте также:

