Диагностика кокцидиоза у животных
Обновлено: 24.04.2024
Кокцидиозы (эймериидозы) - протозойные болезни, возбудителями которых являются споровики из отряда Coccidiida сем. Eimeriidae. В организме животных кокцидии паразитируют в эпителиальных клетках кишечника, печени и почек. Они специфичны к хозяевам, а также к местам локализации в организме. Из кокцидий ветеринарное значение имеют представители рода Eimeria, паразитирующие у сельскохозяйственных животных и птиц, а также вида из рода Isospora, хозяевами которых нередко бывают плотоядные (собаки и кошки). В зависимости от принадлежности кокцидий к определенным родам вызываемые ими заболевания именуются эймериозами (возбудители из рода Eimeria) либо изоспорозами (кокцидии относятся к роду Isospora).
Морфология кокцидий. Выделяемые во внешнюю среду с фекалиями животных ооцисты кокцидии разных видов по форме могут быть овальными, эллипсоидными и круглыми, а по величине - крупными (30-40 u), средними (15-25 u) и мелкими (менее 15 u). Ооцисты покрыты гладкой двуслойной оболочкой серого или желтого цвета, которая у кокцидий многих видов на одном из полюсов истончается, образуя микропиле. Внутри зрелой ооцисты всегда имеется восемь спорозоитов, причем в ооцисте эймерии - четыре споры, в каждой из которых по два спорозоита; в ооцисте изоспоры - две споры, содержащие по четыре спорозоита.
Биология кокцидий. Для кокцидий характерен сложный цикл развития, состоявший из трех этапов: шизогонии и гаметогонии (в организме хозяина) и спорогонии (во внешней среде).
Шизогония (бесполое множественное размножение) является начальным этапом размножения. При попадании с кормом и водой в пищеварительный тракт хозяина зрелых ооцист оболочка растворяется (незрелые ооцисты проходят транзитно), освобождая мерозоитов, которые внедряются в эпителиальные клетки кишечника или других органов (в зависимости от вида) и образуют шизонты. При делении ядра шизонта формируется 6-30 мерозоитов I порядка, которые, попав в просвет органа, проникают в новые эпителиальные клетки, где из них образуются шизонты, из которых выходят мерозоиты II порядка, последние в дальнейшем развиваются по-разному: около 80% мерозоитов II порядка образуют шизонты, а меньшая часть мерозоитов II порядка (20%) превращается в микрогаметы (мужские половые клетки) и макрогаметы (женские половые клетки), т.е. шизогония постепенно сменяется гаметогоиией. Мерозоиты III порядка образуют 50% гамет, мерозоиты IV порядка - 80% гамет и только 20% мерозоитов V порядка, которые на 100% формируют микрогаметы и макрогаметы. Длительность шизогонии колеблется от 5 до 8 суток (ооцисты не выделяются наружу).
Гаметогония (половое размножение). Микрогамета проникает в макрогамету, и происходит копуляция (слияние ядер), в результате чего образуется зигота. После образования вокруг зигот оболочки они называются ооцистами, выпадают в просвет кишечника и с фекалиями животного выбрасываются во внешнюю среду. Образованием ооцист заканчивается гаметогония через 2-3 недели.
Спорогония (образование спорозоитов в ооцистах) происходит во внешней среде при благоприятных условиях: наличии влаги, кислорода и при температуре 15-30°. Незрелая ооциста содержит внутри протоплазменный шар, который делится на несколько споробластов; споробласты образуют четыре или две споры (спороцисты); в каждой споре через 1-8 суток формируется по два или четыре спорозоита (всего восемь), после чего ооциста становится зрелой или инвазионной (способной заразить специфического, т.е. определенного вида, хозяина). При однократном заражении животного кокцидиозом ооцисты выделяются во внешнюю среду не более 25 суток. Животные и птица заражаются кокцидиозом при заглатывании с кормом и водой зрелых ооцист.
Экономический ущерб от кокцидиозов. Кокцидиозы причиняют большой ущерб кролиководству и птицеводству, а также другим отраслям животноводства в основном вследствие гибели молодняка (до 30% крольчат и до 15% животных), снижения привесов (до 20-25% у молодых кроликов), а также низкой продуктивности животных. Это заболевание оказывает отрицательное влияние и на продуктивность овец. У них настриг шерсти снижается на 28%, а молочная продуктивность - на 36%. Нередко отмечают отход от кокцидиоза ягнят, телят и поросят. Следует также отметить, что кокцидиозы тормозят развитие пушного звероводства.
Эпизоотологические данные. Кокцидиоз протекает в виде энзоотических вспышек, реже спорадически. Наиболее восприимчив к кокцидиозу и тяжело переболевает молодняк (крольчата до 3-4-месячного возраста, цыплята до 6-недельного возраста). Больные животные и кокцидионосители, выделяющие во внешнюю среду фекалии вместе с огромным количеством ооцист кокцидий, являются источником кокцидиозной инвазии.
Способствуют распространению кокцидиозной инвазии в хозяйствах нарушения условий содержания (совместное содержание молодняка и взрослого поголовья в темных, влажных помещениях), ухода (несвоевременная уборка) и кормления (недостаток в кормах витаминов и минеральных солей). Заболевание распространяется преимущественно весной и осенью (высокая влажность внешней среды). Ооцисты кокцидий обладают высокой устойчивостью к химическим дезинфекционным средствам.
Патогенез. Болезнетворное воздействие кокцидий на организм хозяина проявляется вследствие механического разрушения большого количества эпителиальных клеток кишечника, печени и почек при шизогональном размножении паразита, сильной интоксикации (всасывание из пораженных органов продуктов гнилостного распада погибших клеток) и деятельности гнилостных микробов. Не исключается влияние на организм хозяина аллергических реакций. Нарушения нормальной деятельности желудочно-кишечного тракта (резкая смена кормовых рационов и др.) создают благоприятные условия для развития кокцидий.
Диагностика кокцидиозов. Кокцидиозы при жизни животных диагностируют на основании эпизоотологических данных (возраст животных и сезон года), клинической картины (вздутие, понос, примесь крови в фекалиях) и исследования фекалий методами флотации (Фюллеборна), а также люминесцентной микроскопии; посмертно - при вскрытии трупов (геморрагические колиты, поражение печени у кроликов) и исследовании соскобов из пораженных органов. Кокцидиоз следует дифференцировать от гельминтозов. Яйца многих гельминтов и ооцист кокцидий сходны по форме, окраске, но резко отличаются по величине (ооцисты в несколько раз мельче яиц паразитических червей).
Общие принципы мер борьбы при кокцидиозах. Для лечения домашних животных, в том числе и птиц, предложено большое количество медикаментарных средств, из которых чаще применяют кокцидин, зоален, ампролмикс, сульфаниламидные препараты (норсульфазол натрия, фталазол, сульфантрол, сульфазол, сульфазин), антибиотики (пенициллин, биомицин, синтомицин), серу, фурацилин, фуразолидин, ихтиол, йод, осарсол, фенотиазин и др. В рацион вводят углеводные корма и исключают белковые, обостряющие болезнь.
Основная роль в комплексе мер борьбы с кокцидиозами принадлежит профилактическим мероприятиям, направленным на изолированное содержание и выпас молодняка от взрослого поголовья, выделение и лечение кокцидионосителей, регулярную уборку навоза в помещениях и на выгулах с последующим биотермическим обеззараживанием его, соблюдение сухости в помещениях, предохранение кормов и воды от загрязнения фекалиями животных - носителей кокцидий, запрещение скармливания животным корма с пола, лагерное содержание скота и птицы в теплый период года, недопущение скученности животных в помещениях, карантинирование ввозимых в хозяйства животных, обеспечение скота и птицы полноценным кормовым рационом.
КОКЦИДИОЗЫ И БАЛАНТИДИОЗ
Кокцидиоз крупного рогатого скота. К названному заболеванию восприимчивы телята в возрасте от 2 до 6 мес, а также иногда болеют взрослые коровы, буйволы и зебу.
Этиология. Возбудители - 10 видов кокцидий. Наиболее часто заболевание вызывают Eimeria ziirni, Е. smithi, Е. ellipsoidal is, Е. cylindrica. Одни виды возбудителей кокцидиоза отличаются от других по форме ооцнст, строению оболочки, числу полярных транул и другим признакам.
Эпизоотология. Кокцидиозы встречаются на всей территории Советского Союза. Клиническое проявление их наблюдается при нарушении режима кормления животных, особенно при переходе от стойлового содержания к пастбищному или наоборот, при скученном содержании животных, при выпасе их на сырых, заболоченных или пойменных пастбищах. Источником заражения телят являются носители инвазии - взрослые животные и молодняк прошлого года рождения. Заражаются кокцидиозом через загрязненные ооцистами корма, кормушки, выгульные дворики, пастбища, помещения и т. д.
Диагноз. Кокцидиоз диагностируют по результатам исследования фекалий больных по методу Дарлинга или Фолленберна с учетом эпизоотологических данных и клинических признаков.
Лечение. Больным назначают норсульфазол, сульфадимезин или фталазол в дозе 30 мг кг массы животного 3 раза в сутки. Хорошие результаты получают при использовании сульфадиметаксина в дозе 30 мг кг массы животного 3 раза в день. Однако наилучшие результаты дает терапия, когда норсульфазол или сульфадимезин в дозе 30 мг применяется в сочетании с левомицетином в дозе 20 мг кг массы животного.
Профилактика. Телят следует содержать в чистых сухих помещениях. Выгульные дворики очищают от навоза и засыпают песком. При организации пастбищного содержания для телят подбирают сухие места, пасут телят отдельно от взрослых и молодняке прошлых лет.
В хозяйствах, где диагностируют кокцидиоз телят, проводят химиопрофилактику сульфадимезином или норсульфазолом в сочета-1 нии с левомицетином в лечебной дозе двумя пятидневными курсами с интервалом в 3 дня.
Кокцидиоз кур. К кокцидиозу восприимчивы цыплята от 2-недельного до 2-месячного возраста.
Этиология. Возбудители - 9 видов кокцидий рода Eimeria. Наиболее патогенными являются Eimeria tenella, Е. maxima, Е. nicatrix, Е. acervulina. Различные виды кокцидий кур отличаются между собой по форме и величине ооцисты, строению оболочки, числу полярных гранул и другим признакам.
Эпизоотология. Кокцидиоз кур распространен повсеместно. Источником заражения являются больные или переболевшие цып- лята, взрослые куры-паразнтоносители. Заражение происходит через загрязненные оонистами кокцидий корма, воду, пастбища, почву. Ооцисты могут заноситься на птичники людьми с обувью и предметами ухода. Механическими переносчиками ооцист могут быть грызуны, дикие птицы, насекомые.
Симптомы. Инкубационный период длится 4-7 дней. У цыплят заболевание, проявляется общим угнетением, отсутствием аппетита, жаждой. Цыплята стремятся к теплу, скучиваются, сидят нахохлившись. У больных цыплят перья взъерошены, крылья опущены, походка шаткая, появляется понос. Испражнения вначале зеленоватые, а затем становятся кровянистыми. При тяжелом течении болезни возникают парезы и параличи конечностей и крыльев.
Вскрытие. Трупы павших цыплят истощены. Слизистые оболочки бледные. Просвет слепых кишок заполнен беловатой творожистой массой, их слизистая оболочка геморрагически воспалена, красного или темно-красного цвета.
Диагноз. Диагностируют кокцидиоз кур по клиническим признакам, патологоанатомическим изменениям и результатам исследования фекалий по Дарлингу.
Лечение. При появлении среди цыплят первых клинических признаков кокцидиоза всем цыплятам птичника назначают кокцидиостатики: зоолен (кокцидин) в дозе 125 г на 1 т корма, кокцидиовит хлористоводородный в дозе 1 г на 1 кг корма или 1 г на 1 л воды, адренон-25 в дозе 500 г на 1 т корма, сульфадимезин в дозе 400 мг на 1 кг массы цыплят. Указанные препараты применяют 5 дней, чередуя их, чтобы не создавать устойчивых к тому или другому препарату рас кокцидий.
Профилактика. Молодняк содержат изолированно от взрослой птицы в хорошо подготовленных сухих помещениях. Лучше всего содержать цыплят до 2-месячного возраста в клетках на проволочной сетке. Начиная с 10-дневного возраста проводят химиопрофилактику кокцидиостатиками, скармливая их с комбикормом согласно наставлению. Большое значение в профилактике кокцидиоза цыплят имеет правильная технология выращивания птицы на птичниках.
Кокцидиоз кроликов. Кокцидиозом болеют кролики независимо от их породы. Наиболее восприимчив к заболеванию молодняк в возрасте от 2 до 4 мес.
Этиология. Возбудители - 7 видов кокцидий. Один из них паразитирует в желчных протоках печени - Eimeria stiedae, вызывая печеночную форму кокцидиоза. Остальные - Е. perforans, Е. media, Е. magna и другие - паразитируют в кишечнике, вызывая кишечную форму кокцидиоза. Нередко у кроликов бывает смешанная форма кокцидиоза - печеночная и кишечная.
Эпизоотология. Кокцидиоз кроликов распространен на всей территории Советского Союза. Источником заражения являются-больные или переболевшие крольчата, взрослые кролики - паразнтоноситеЛИ. Заражение молодняка может происходить через загрязненные ооцистами кокцидий помещения, клетки, корма, воду, предметы ухода, выгульные дворики, пастбища.
Большое значение в распространении кокцидиоза имеют скученное содержание молодняка, сырые крольчатники, резкое колебание в них температуры, неправильное комплектование групп животных, когда включают в них крольчат разного возраста.
Симптомы. Инкубационный период длится 4-12 дней. Печеночная форма заболевания проявляется общим угнетением, уменьшением пли отсутствием аппетита. Больные крольчата становятся малоподвижными, худеют, у них появляются анемия н желтушность слизистых оболочек. Смертельность особенно большая среди крольчат в возрасте от 3 до 4 мес.
При кишечной форме наблюдаются поносы с кровью, полиурня, риниты и конъюнктивиты. Чаще всего обе формы кокцидиоза протекают в виде смешанной инвазии н вызывают большую смертельность. Продолжительность болезни 3-6 дней, при хроническом течении - 1-3 мес.
Вскрытие. При печеночной или смешанной формах печень увеличена, желчные ходы расширены, их стенки утолщены. На поверхности печени и в ее паренхиме видны сероватые и желтоватые очажки размером с просяное зерно или горошину, заполненные ооцистами. Слизистая оболочка тонкого и толстого кишечника катарально воспалена. При кишечной форме наблюдаются изменения только в кишечнике.
Диагноз. Кокцидиоз кроликов диагностируют комплексно. Учитывают эпизоотологические данные, клинические признаки, пато- логоанатомическне изменения и результаты исследования фекалий по Дарлингу.
Лечение. Больным назначают сульфапирндазин в дозе 100 мг в сочетании с мономицнном в дозе 25 тыс, ЕД на 1 кг массы животного пли норсульфазол в дозе 400 мг в смеси с мономицнном в дозе 25 тыс. ЕД на 1 кг массы животного. Препараты в том или другом сочетании растворяют в воде и перемешивают с комбикормом. Скармливают их двумя 5-дневными курсами с интервалом в 3 дня. Для лучшего поедания препаратов разовую норму корма уменьшают в 2 раза. Можно применять сульфадимезин в дозе 0,03-0,05 г кг массы животного. Препарат растворяют в виде 0,5%-ной или 1%-ной концентрации и выпаивают вместо воды 3-5 дней подряд или смешивают с кормом и скармливают..
Хороший результат получают от использования сульфаднметаксина в дозе 0,2 г кг массы животного с кормом.
Профилактика. Крольчат содержат в клетках с решетчатыми или проволочными полами и в сухих помещениях. Большое значение в профилактике кокцидиоза кроликов имеет химиопрофнлактика, особенно когда ее проводят при отъеме крольчат. В период отъема крольчатам применяют сульфапирндазин в. дозе 100 мг в сочетании с мономицнном в дозе 25 тыс. ЕД на 1 кг массы кроликов.
Препараты скармливают с комбикормом двумя 5-дневными курсам с интервалом в 3 дня.
Балантидиоз свиней. К балантидиозу восприимчивы поросята- отъемыши, а в отдельных хозяйствах и молодняк старшего возраста, Этиология. Возбудитель - Balantidium coli. Инфузория имеет овальную, круглую или яйцевидную форму. Тело инфузории по крыто равномерно ресничками. Величина инфузорий ко еблется оя 47 до 120 мкм в длину и от 27 до 80 мкм в ширину. Паразитируют они в толстом кишечнике.
При заболевании возбудитель обнаруживается и в других отделах пищеварительного тракта.
Эпизоотология. На территории Советского Союза балантидиоз свиней встречается повсеместно. Источником заражения слу-; жат взрослые свиньи или молодняк старших возрастов. Заражение происходит алиментарно при заглатывании цист инфузорий с загрязненными кормами или водой. Балантидии паразитируют в кишечнике крыс, последние могут быть источником заражения и свиней.
При хроническом течении балантидиоза температура тела чаще нормальная или субнормальная. Аппетит уменьшенный или извращенный. Понос менее выражен, в жидких фекалиях может быть слизь, прожилки крови, но кровавого поноса не бывает. Поросята худеют, отстают в росте, у них развивается анемия, появляются слабость и полное истощение.
Вскрытие. Картина вскрытия при балантидиозе характеризуется катарально-геморрагнческпм тифлитом и колитом, нередко серозно-катаральным гастритом и энтероколитом. В толстом кишечнике обнаруживают утолщение слизистой оболочки, она покрыта слизью и усеяна кровоизлияниями, местами на ней встречаются язвы величиной от горошины до ореха.
Мезентериальные лимфатические узлы увеличены, отечны, с массовыми кровоизлияниями.
Диагноз. Диагностируют балантидиоз свиней комплексно Учитывают при этом эпизоотологические данные, клиническую картину, результаты исследования фекалий от больных на наличие в них подвижных форм инфузорий или их цист. Кроме того, проводят гистологические исследования стенки толстого кишечника, в толще которой обнаруживают балантидии.
Лечение. Применяют осарсол внутрь в дозе 0,03-0,05 г кг массы животного 2 раза в день в течение 3 дней. Можно использовать также фуразолидон. Его дают больным с малым количеством корма в дозе поросятам-сосунам 0,5 мг, отъемышам 2 мг и взрослым свиньям 5 мг 2 раза в день в течение 5 дней. Рекомендуется применять трихопол (метронидазол) поросятам массой до 20 кг в дозе 0,25 г 2 раза в день в течение 3 дней.
Профилактика. Организуют ежедневно уборку навоза и биотермпческое его обеззараживание, полноценное кормление животных с добавлением микроэлементов и витаминов. В период отъема поросят проводят хнмиопрофилактику, скармливая фуразолидон с мелом из расчета 1 г препарата на 1 кг мела. С целью профилактики балантидиоза можно также применять ятрен 3 дня в лечебной дозе и 3 дня осарсол.
Энциклопедия Животноводства
— Человечность определяется не по тому, как мы обращаемся с другими людьми. Человечность определяется по тому, как мы обращаемся с животными.
— Человек — царь природы. — Жаль, что звери об этом не знают — они неграмотные.
Домашние животноводство
Научный подход
НАВИГАЦИЯ: Главная Ветеринарная паразитология Ветеринарная протозоология КОКЦИДИОЗЫ ЖИВОТНЫХ СИСТЕМАТИКА КОКЦИДИ
КОКЦИДИОЗЫ ЖИВОТНЫХ
Кокцидиозы - протозойные болезни, возбудителями которых являются простейшие,-из отряда кокцидий (Сосcidia). У скота и птицы кокцидий паразитируют преимущественно в эпителиальных клетках кишечника. Некоторые виды этих паразитов способны поражать печень кроликов (Eimeria stiedae).
Кокцидиозы причиняют большой экономический ущерб птицеводству, кролиководству и скотоводству не только на многих фермах колхозов и совхозов, но и на ряде животноводческих комплексов (кролиководческих и на птицефабриках), главным образом за счет падежа молодняка (на кролиководческих фермах отход может достигать 60- 85 %) Кроме того, больные животные отстают в росте и теряют от 12 до 30% своей массы. У птицы, пораженной кокцидиозом, снижается упитанность, масса и яйценоскость.
СИСТЕМАТИКА КОКЦИДИЙ
Возбудители кокцидиозов сельскохозяйственных животных относятся к типу Protozoa, классу Sporozoa, отряду Coccidia, семейству Eimeriidae и двум р"0ДаМ -"Eimeria и Jsospora. Заболевания называют по названию рода возбу дителей - Eimeria - эймериоз, Jsospora - изоспороз.
Жизненные циклы у возбудителей кокцидиозов сложные. Лучше они изучены у кокцидий рода Eimeria и несколько хуже - у представителей рода Jsospora.
Так, кокцидий Eimeria media в стадии зрелой ооцисты попадают с водой или кормом в кишечник животного. Спорозоиты выходят из ооцисты н проникают в эпителиальные клетки кишечника, где растут и превращаются в шизонтов. Внутри такого шизонта образуются мелкие паразиты - мерозоиты. С развитием последних шизонт делится и разрушает эпителий стенки кишечника. Освободившиеся мерозоиты вновь проникают в эпителиальные клетки кишечника, образуя шизонты II, III, а у отдельных видов - IV и пятой генераций. Таким образом, шизогония этого рода КОКЦИДИЙ повторяется много раз. Затем бесполое множественное деление сменяется половым процессом - гаметогонией.
Сущность гаметогонип заключается в том, что последующие генерации шизонтов формируют мерозоиты, которые проникают в клетку хозяина и превращаются в одноядерные трофозопты. В дальнейшем из одноядерных трофозоитов образуются макрогаметоциты и микрогаметоциты. Затем макрогаметоциты превращаются в макрогаметы. У микрогаметоцитов ядро делится, в результате образуются мелкие мужские клетки - микрогаметы. После образования макрогамет и микрогамет они копулируют (сливаются), образуя копулу или зиготу. Зигота окружается оболочкой и превращается в ооцисту. Ооцисты в зависимости от видов могут иметь самую разнообразную форму и величину, у всех у них двуконтурная оболочка и зернистая цитоплазма. Такие ооцисты выходят во внешнюю среду и проходят стадию спорогонии. Во внешней среде при наличии тепла, влаги и кислорода в ооцисте формируются четыре споры и в каждой из них по два спорозоита. С образованием в ооцисте спор и спорозоитов заканчивается спорогония. Такие ооцисты становится зрелыми, при попадании в организм восприимчивых животных и заражают их.
Жизненный цикл кокцидий рода Jsospora ранее отождествлялся с кокцидиями рода Eimeria. Однако изучение биологии токсоплазм, а затем и саркоцист расширило знания о биологии кокцидий рода Jsospora. Так, если взять котят, свободных от кокцидий, и скормить им мозг мышей, который был поражен цистами токсоплазм, то через 5- 6 дней в стенке кишечника зараженных животных образуются шизонты и гамонты токсоплазм, а затем в фекалиях котят появляются н ооцисты. Во внешней среде в таких ооцистах образуются по две споры и в каждой споре по четыре спорозопта. Ооцисты, выделявшиеся из организма подопытных котят, морфологически похожи на ооцист Josospora bigemina.
Представленная (по Френкелю) схема жизненного цикла токсоплазм показывает, что у кокцидий рода Jsospora более сложный цикл развития, чем у рода Eimeria. В связи с этим целый ряд исследователей полагают, что токсоплазмоз - это ничто иное, как одна из стадий (пролиферативная) развития кишечной формы изоспороза кошек. Таким образом, кошки и, по-видимому, другие виды кошачьих являются дефинитивными хозяевами, в организме которых паразит проходит половой цикл развития. Кошки могут заражаться изоспорозом, поедая мышей, зараженных токсоплазмами, после чего выделяют ооцист, которые, попадая другим животным и человеку, заражают их пролиферативными формами токсоплазм. Следовательно, остальные животные и человек являются промежуточными хозяевами кокцидий Jsospora begimina.
Специфичность кокцидий. Кокцидий рода Eimeria относятся к специфическим паразитам только своих хозяев, хотя, паразитируя в кишечнике, многие из них морфологически могут быть похожими, однако паразитируют они только у одного хозяина, к которому приспособились в процессе эволюции.
Строгая специфичность кокцидий рода Eimeria проявляется пе только в отношении хозяина, но и места паразитирования в организме животного. Так, Е. tenella паразитирует только в эпителиальных клетках слепых кишок, тогда как Е. acervulina - в двенадцатиперстной кишке кур. Такая специфичность кокцидий к определенным органам и тканям или к определенному месту обитания явилась основным условием, обеспечивающим одновременное паразитирование многих видев кокцидий в одном хозяине.
Несколько по-другому следует рассматривать специфичность у кокцидий рода Jsospora особенно после того, как было установлено, что токсоплазма размножается в организме двух хозяев - дефинитивном и промежуточном. В дефинитивном - кошке токсоплазма проходит половой цикл, в результате образуются ооцисты, похожие на J. bigemina. При скармливании этих ооцист животным развивается пролиферативная форма, которую ранее считали токсоплазмой; последней могут заразиться все животные и человек. Из этих новых данных вытекает, что кокцидий рода Jsospora на разных стадиях развития могут обладать и различной специфичностью.
Патогенез. Кокцидий, проникая в эпителиальные клетки кишечника, разрушают их и таким образом причиняют механические повреждения слизистой пищеварительного тракта. В такие пораженные участки кишечника проникает микрофлора, которая обостряет течение болезни, вызывая воспаление, а затем и обширные некрозы. В связи с этим целые участки кишечника выключаются из процесса пищеварения, что и приводит к хроническому голоданию организма животного. Воспалительные процессы на слизистой и ее некрозы увеличивают скопление экссудата в просвете кишечника, который затрудняет всасывание жидкости в организм животного. В результате всех этих процессов развиваются полосы, которые и создают условия отрицательного водного баланса в организме больных, увеличивают вязкость крови и осложняют работу сердца, являясь причиной гибели больных животных.
Кокцидиозами называют большую группу заболеваний, вызываемых кокцидиями. Кокцидии - одноклеточные простейшие. Они паразитируют в эпителиальных клетках слизистой кишечника, а у некоторых животных, кроме кишечника, - и в эпителиальных клетках желчных ходов печени (кролики) или в почках (гуси).
Возбудители кокцидиозов имеют очень широкое распространение и могут вызывать опустошительные энзоотии, причиняя большой экономический ущерб сельскому хозяйству. Особенно большой падеж может быть среди молодняка животных и птиц. Так, среди крольчат смертность нередко достигает 85%, а среди цыплят - 100%; очень часто большую смертность могут вызывать кокцидиозы среди телят, ягнят и других домашних животных.
Кокцидии имеют сложный цикл развития. Паразит в одной из стадий развития проникает в эпителиальные клетки, где он растет, а затем множественным делением дает мелкие дочерние клетки. Последние вновь заражают эпителиальные клетки и повторяют свое множественное размножение. Такое бесполое размножение сменяется половым процессом.- В это время у кокцидии образуются мужские и женские половые клетки.
Мужские сливаются с женскими, в результате чего образуется так называемая ооциста. Она имеет двухконтурную оболочку и зернистую протоплазму. В таком виде ооциста выбрасывается с калом во внешнюю среду. Во внешней среде паразит проходит дальнейшее свое развитие, где и происходит его созревание до инвазионной (заразительной) стадии. Под действием света, тепла и влаги в ооцистах образуются споры, а в спорах - спорозоиты. Такие созревшие ооцисты и могут заражать животных. При попадании В организм животного оболочки ооцисты в кишечнике разрушаются, освобождаются спорозоиты, а последние внедряются в эпителиальные клетки слизистой кишечника, где вызывают воспалительные процессы, сопровождающиеся поносами.
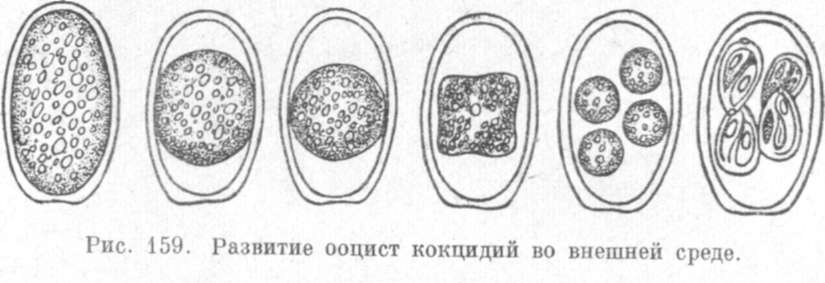
Ооцисты кокциднй имеют в зависимости от вида самую разнообразную форму: овальную, круглую, яйцевидную, грушевидную и т. д. (рис. 159). Ооцисты очень устойчивы к внешним неблагоприятным условиям. Они могут сохраняться в навозе до 3 месяцев, на пастбищах - до года и более. Ооцисты кокцидий очень устойчивы к дезинфицирующим веществам, их убивает только крутой кипяток. Кокцидии, сохраняясь во внешней среде (на пастбище, в подстилке, навозе, в мелких водоемах), попадают с загрязненными кормами или водой в организм животных, где быстро размножаются и вызывают тяжелые заболевания.
У каждого вида животных паразитируют определенные виды кокцидий, которые являются строго специфическими паразитами только своих хозяев. Следовательно, кокцидии, паразитирующие, например, у кролика, могут вызывать заболевания только у этих животных, других животных кокцидии кроликов не заражают.
Кокцидиоз крупного рогатого скота. Кокцидиоз крупного рогатого скота вызывается несколькими (до 10) видами кокцидий. Они отличаются друг от друга по форме ооцисты, строению оболочки и остаточным телам в ооцисте или спорах при созревании (спорогонии).
Распространение. Кокцидиоз встречается как в южных, так и в северных районах и главным образом в тех хозяйствах, где плохие условия кормления и содержания. Чаще всего болеют телята до 6-месячного возраста, однако могут быть отдельные случаи заболевания у молодняка более старшего возраста и даже Коров. Заражение происходит через загрязненные ооцистами кокцидий воду, корма, кормушки, а также предметы ухода.
Признаки болезни. Кокцидиоз протекает остро. Скрытый период болезни 14-21 день. Заболевание начинается расстройством пищеварения. Кал жидкий, нередко с прожилками крови. Аппетит отсутствует или ослаблен. В тяжелых случаях кровавый понос, высокая температура. Общее угнетение, быстрое исхудание животного, непроизвольное выделение кала. Жвачка прекращается. Смерть может наступить на 5-12-й день. У телят болезнь протекает в тяжелой форме и, если не лечить, может вызвать большой процент смертности. Взрослые животные болеют реже, как правило, они являются кокцидионосителями.
Патологоанатомические изменения. Трупы истощены. Слизистые оболочки глаз и ротовой полости бледные. Задний проход загрязнен каловыми массами. Отверстие прямой кишки выпячено наружу, слизистая ее отечна и типеремирована. Мезентериальные лимфатические узлы увеличены. Содержимое кишечника грязнобурого цвета, слизистая толстого отдела кишечника сильно покрасневшая с массовыми кровоизлияниями и язвами. Содержимое кишечника кровянистое.
Диагноз. Подвергают микроскопическому исследованию кал от больных. Диагноз ставят при обнаружении в кале ооцист кокцидий, учитывая при этом клинические признаки болезни.
Лечение. Больных изолируют. Пол, стенки и стойла дезинфицируют горячим щелоком. Всем больным выпаивают с молоком сернокислый аммоний в дозе 1,0-5,0 на голову; с водой выпаивают тимол 15,0 или ихтиол 5,0 на голову, можно рекомендовать также фенотиазин в дозе 0,4 на 1 кг веса животного, трехкратно с промежутком в одни сутки, скармливают с кормом. Осарсол выпаивают с молоком в дозе 0,2-0,5 на голову, 3-5 дней подряд.
Профилактика. Телят содержат изолированно от молодняка прошлых лет и коров. Ежедневно телятник очищают от навоза и меняют подстилку. Один раз в неделю моют полы крутым кипятком с добавлением 2° 0 каустической соды, кормушки и водопойные ведра ошпаривают крутым кипятком. Выгульные дворики перекапывают и засыпают слоем песка. Телят выпасают на сухих пастбищных участках, где не выпасались больной молодняк и взрослое поголовье. Организуют, там где возможно, смену выпасов один раз в 7 дней.
Кокцидиоз птиц. Кокцидиоз кур, индеек, уток и некоторых диких птиц проявляется в форме заболевания кишечника, и только у гусей кокцидии, помимо кишечника, могут паразитировать в почках и вызывать тяжелые воспалительные процессы в почечной лоханке. У каждого вида птиц паразитируют свои, свойственные только им кокцидии. Отличаются они по форме ооцист, строению оболочки, остаточным телам и месту локализации.
Распространение. Кокцидиозы птиц встречаются повсеместно и главным образом в тех хозяйствах, где молодняк содержится в тесных и грязных помещениях. Более часто заболевает молодняк от 2 до 6 недель. Заражение происходит при склевыванин зараженного корма или через воду, загрязненную оцистами кокциднй. Ооцисты кокцидии могут быть занесены в птичники с обувью обслуживающего персонала, с тарой, метлами, лопатами, скребками и другими предметами. Источником заражения часто могут быть взрослые птицы, которые являются носителями ооцист кокцидии, выделяя их с пометом.
Признаки. Скрытый период болезни при естественном заражении равен 6-8 дням. Молодняк (цыплята и другие виды птиц) становится вялым, больные больше сидят нахохлившись, малоподвижны. Аппетит понижен или совсем отсутствует. Появляется сильная жажда, развивается сильный понос. Испражнения жидкие, зеленоватого или красновато-шоколадного цвета. Гребешок п сережки бледнеют (малокровие). Зоб растянут, перья взъерошены, цыплята быстро худеют. К концу болезни расстраивается координация движения, наступают парезы крыльев и ног. Смерть наблюдается чаще всего на 2-5-й день после появления первых признаков болезни.
У молодняка старших, возрастов и взрослой птицы наблюдаются понос (то утихающий, то усиливающийся), истощение; молодняк отстает в росте, взрослые куры снижают яйценоскость.
Патологоанатомические изменения. Труп истощен. Слизистые оболочки бледные. Основные изменения наблюдаются в кишечнике. В двенадцатиперстной кишке образуются белые полоски и пятна, слизистая сероватого цвета, с большим количеством некротических фокусов. Средние части тонких кишок наполнены сероватой, буроватой или красноватой слизью, слизистая покрыта точечными кровоизлияниями. Кроме того, обнаруживается катаральный энтерит, главным образом в слепых кишках. В их просвете находят сгустки крови, слизистая красного или темно-красного цвета, с массовыми кровоизлияниями.
Диагноз. Проводят микроскопическое исследование помета больных цыплят. Диагноз устанавливают, учитывая результаты этого исследования, клинические признаки болезни и изменения, обнаруженные при вскрытии трупов птицы.
Лечение. Больных кокцидиозом цыплят изолируют и подвергают лечению. С этой целью больным дают в виде питья норсульфазол натрия в разведении - 3 дня подряд. Применяют осарсол в дозе 10 мл на 1 кг веса животного в 1%-ном растворе соды с отрубями или комбикормом 3 дня подряд, можно также рекомендовать стрептоцид с кислым молоком 0,5° 0-ной концентрации 3 дня подряд. Прекрасные результаты дает применение фуразолидона в дозе 5 г на 1000 цыплят. Препарат смешивают с кормом, овлажняют и скармливают 5 дней подряд, одновременно цыплятам назначают фурациллин в дозе 0,2 на 1 л воды в виде питья.
Профилактика.Для предупреждения кокцидиоза птиц молодняк размещают изолированно от взрослой птицы, в хорошо подготовленных теплых, сухих помещениях. Помещения и выгульные дворики очищают от помета и систематически подвергают дезинвазии. Кормушки и поилки ежедневно ошпаривают крутым кипятком. Выгульные дворики устраивают в других местах, почву перекапывают и засыпают слоем песка. Большое значение в профилактике кокцидиоза птиц имеет правильное кормление кормами, богатыми витаминами. Начиная с 2-недельного возраста, цыплятам периодически в виде питья дают норсульфазол натрия в разведении 0,3%. Фурациллин 0,2 на 1 л воды 3 дня подряд. Можно с профилактической целью скармливать фуразолидон по 3 дня с перерывом в 5 дней. Большую роль в профилактике кокцидиоза играют молочные продукты. Поэтому молодняку птиц рекомендуют скармливать простоквашу, ацидофильное молоко, молочную сыворотку.
Текст ГОСТ 25383-82 Животные сельскохозяйственные. Методы лабораторной диагностики кокцидиоза

ЖИВОТНЫЕ СЕЛЬСКОХОЗЯЙСТВЕННЫЕ
МЕТОДЫ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ КОКЦИДИОЗА
ГОСТ 25383-82 (СТ СЭВ 2547-80)
ГОСУДАРСТВЕННЫЙ КОМИТЕТ СССР ПО СТАНДАРТАМ
РАЗРАБОТАН Министерством сельского хозяйства СССР ИСПОЛНИТЕЛИ
Б. Л. Тимофеев, И. А. Коблова, Л. М. Шало за
ВНЕСЕН Министерством сельского хозяйства СССР
УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Государственного комитета СССР по стандартам от 11 августа 1982 г. № 3154
ГОСУДАРСТВЕННЫЙ СТАНДАРТ СОЮЗА ССР
ЖИВОТНЫЕ СЕЛЬСКОХОЗЯЙСТВЕННЫЕ Методы лабораторной диагностики кокцидиоза
Donic-Xr* ипитшК. .Methods of laboratory diagnostics

Постановлением Государственного комитета СССР по стандартам от 11 августа 1982 г. № 3154 срок действия установлен
с 01.01.83 до 01.01.88
Несоблюдение стандарта преследуется по закону
Настоящий стандарт распространяется на все ви iu сельскохозяйственных животных и птиц и \сгаплвливаег методы лабораторной диагностики кокцидиоза.
Стандарт полностью соответствует СТ СЭВ 2547—80.
1. МЕТОДЫ ОТБОРА ПРОБ
IЛ. Для проведения исследований отбирают пробы кала животных, пробы патологического материала, а также пробы но стилки.
1.2. Пробы кала берут от живых п павших животных.
1.2.1. От живых животных пробы кала берут у животных из одного стада, станка или же стаи с учетом числа животных в группе.
Если число животных в группе менее 100, кал берут не менее чем от 20 животных; в группе с числом животных от 101 до 500 — от 10%; с числом животных от 501 до 1000 — от 5% и с числом животных свыше 1000—от 2% животных.
1 2.2. Кал берут из прямой кишки животного. От каждой головы крупного рогатого скота берут 50 г кала, овец, коз и свиней -20 г, домашней птицы и кроликов— 10 г.
Отобранные пробы смешивают, иолуч а я объединенную пробу.
В случае проведения исследований кала от к аж юго животного смешивание проб не производят.
Издаике о фициальное
Перепечатка воспрещена (О Издательство стандартов, 1982
Допускается отбирать пробы кала с пола станков, выгулов и т. п.
1.2.3. От павших животных кал берут из конца ободочной кишки или из прямой кишки в количествах, указанных в п. 1.2.2.
1.2.4. Отобранные пробы кала упаковывают в полиэтиленовый пакет или помещают в хорошо закрывак щийся сосуд.
До проведения исследований пробы хранят при температуре 2—4°С или консервируют, добавляя 2,5%-ный раствор бихромата калия.
1.3. Пробы патологического материала отбирают при вскрытии павших животных.
Пробы берут из патологоапатомически измененных частей кишки, у кроликов—также из желчного пузыря и паренхимы печени, у гусей — из почек. Если пробы нельзя исследовать сразу, кишку разрезают в продольном направлении и помещают в 2,5%-ный раствор бихромата калия. Из печени кроликов вырезают беловатые очаги и консервируют их тем же способом. Пробы для гистологического исследования хранят в 10%-ном растворе формальдегида.
1.4. Пробы подстилки в зависимости от размера помещения отбирают не менее чем из десяти разных мест в бумажный или полиэтиленовый пакет.
1.5. Ко всем отобранным пробам прилагают сопроводительный документ с указанием:
возраста и пола животных;
заболеваемости или смертности;
способа проведенной санитарной обработки;
даты взятия материала для исследования. 2
2. МЕТОДЫ ИССЛЕДОВАНИЙ
2.1. Методы определения наличия ооцист в кале
Сущность метода заключается в определении с помощью микроскопа наличия ооцист кокцидий, всплывающих на поверхность раствора с исследуемым материалом.
2Л.1. Аппаратура, материалы и реактивы
2.1.1.1. Для проведения исследования применяют: микроскоп с окулярным микрометром марки МБИ-3 по ГОСТ
весы лабораторные по ГОСТ 24104—80;
центрифугу марки М-24 или других марок с частотой вращения 2000 об/мин;
сита с ячейками размером 0,5—1,0 мм 2 ;
стаканы стеклянные вместимостью 150—200 см 3 по ГОСТ 10394—75;
чашки стеклянные лабораторные по ГОСТ 10973—75; стекла предметные по ГОСТ 9284—75 и покровные по ГОСТ 6672—75;
пипетки градуированные вместимостью 50 см 3 по ГОСТ 20292—74;
посуду лабораторную фарфоровую; воронки стеклянные по ГОСТ 8613—75; штатив для пробирок; петли;
вату Iигроскопическую медицинскую по ГОСТ 5556—75; натрий хлористый по ГОСТ 4233—77; цинк сернокислый по ГОСТ 4174—77; магний сернокислый по ГОСТ 4523—77; воду дистиллированную по ГОСТ 6709—72.
2.1.2. Подготовка к исследованию 2Л.2.1. Приготовление раствора Бреза
Готовят насыщенный раствор сульфата магния и насыщенный раствор тиосульфата натрия. Растворы смешивают с дистиллированной водой в соотношении 3:3:1.
2.1.2.2. Приготовление флотационного раствора
К 1 л горячей дистиллированной воды добавляют избыток соответствующего химического реактива (насыщенного раствора хлористого натрия пли сульфата цинка или раствора Бреза), выдерживают в течение 12 ч и фильтруют через вату в чистую склянку. Плотность флотационного раствора должна составлять приблизительно 1,3 г/см 3 .
2.1.3. Проведение исследования
2.1.3 1. Из пробы выделяют навеску кала массой 3 г, заливают в ступке 15—20 см 3 воды, размешивают до жидкой консистенции и процеживают через сито и воронку в центрифужные пробирки.
Пробирки центрифугируют с частотой вращения 2000 об/мин в течение 1—2 мин. Жидкую часть сливают, затем добавляют 10 см 3 флотационного раствора и тщательно перемешивают палочкой так, чтобы не образовались пузыри. Не рекомендуется встряхивать содержимое пробирки. Пробирки с флотационным раствором снова центрифугируют, как указано выше.
С помощью петли пз каждой пробирки берут по три капли раствора и наносят на предметное стекло. Покровное стекло используют лишь для рассеяния капли в случае недостаточной обзорности поля зрения. При массовых исследованиях одной и той же пробы допускается не обжигать петлю после каждого переноса
раствора на предметное стекло, достаточно лишь промыть ее несколькими резкими движениями в пробирке с водой. Однако в начале и конце исследования петлю необходимо обжигать.
Определение наличия ооцист проводят под микроскопом, используя соответствующий определитель.
2.2. Метод определения количества ооцист в кале
2.2.1. Аппаратура, материалы и реактивы
2.2.1.1. Для проведения исследования применяют аппаратуру^ материалы и реактивы, указанные в п. 2.1.1, и дополнительно счетную камеру Горяева или Мак-Мастера.
2.2.2. Проведение исследования
2.2.2.1. Исследуемую пробу кала тщательно гомогенизируют. Взвешивают от 3 до 5 г кала (в зависимости от необходимости точности определения) п размешивают в стакане с 45 см 3 воды. Полученную таким образом суспензию фильтруют через сито. 10 см 3 фильтрата помещают в центрифужную пррбирку и центрифугируют с частотой вращения 2000 об/мин в течение 2 мин.
Жидкую часть сливают, к осадку добавляют 10 см 3 флотационного раствора и тщательно перемешивают. Полученной суспензией заполняют счетную камеру. Допускается при отсутствии счетной камеры использовать предметное стекло, на которое наносят 0,15 см 3 суспензии и накрывают покровным стеклом. Заполненную камеру или предметное стекло с 0,15 см 3 суспензии выдерживают в течение 2 мин, чтобы ооцисты могли подняться к поверхности, и подсчитывают количество ооцист. Полученное число, умноженное на 100, представляет собой содержание ооцист в 1 г кала.
Для более точного определения допускается использовать несколько камер и ооцисты подсчитывают в нескольких камерах. При использовании камеры Горяева ооцисты подсчитывают во всех 225 квадратах и полученную сумму умножают на коэффициент 1111. Полученное количество показывает число ооцист в 1 см 3 взвеси.
2.2.3. Обработка результатов
2.2.3.1. У домашней птицы обнаружение единичных ооцист (0—100 ооцист на 1 г кала) свидетельствует о наличии кокцидий в окружающей среде и течении субклинического заболевания.
Наличие 101—1000 ооцист в 1 г кала свидетельствует:
для Eimeria tenella и Eimeria necatux — о заражении средней степени;
для Eimeria maxima — о сильном заражении;
для Е. acervulina — о слабом заражении.
Наличие свыше 1000 ооцист в 1 г кала — признак сильного заражения.
У крупного рогатого скота и овец наличие до 1000 ооцист в 1 г кала (для Е. bovis и Е. zuetnii) свидетельствует о слабой инфек
ции, до 5000 — об инфекции средней тяжести, свыше 5000 —о сильной инфекции.
Для определения вида Eimeria используют существующие определители.
У кроликов наличие до 10000 ооцист на 1 г кала служит признаком слабой инфекции, до 100000 — сильной инфекции, свыше 100000 — очень сильной инфекции.
2.3. Метод исследования павших животных
Сущность метода заключается в выявлении и определении с помощью микроскопа различных стадий кокцидий в пробах, взятых при паталогоанатомическом вскрытии животных. У животных исследуют желудочно-кишечный тракт, при этом учитывают наличие в крови паталогоанатомических изменений, локализацию, а также размер, форму, цвет, структуру стадий развития.
2 3.1. Аппаратура и реактивы
2.3.1.1. Для проведения исследования применяют:
ножницы по ГОСТ 21239—77;
пинцеты по ГОСТ 21241—77;
чашки лабораторные стеклянные по ГОСТ 10973—75;
натрий хлористый по ГОСТ 4233—77;
воду дистиллированную по ГОСТ 6709—72.
2.3.2. Проведение исследования
2.3.2.1. Паталогически измененные части кишок кладут в чашки Петри или другую посуду и разрезают в продольном направлении. Несколько капель содержимого кишки разбавляют на предметном стекле физиологическим раствором, накрывают покровным стеклом и рассматривают под микроскопом. Можно также соскабливать краем предметного стекла слизистую оболочку пораженной кишки. Соскоб разбавляют физиологическим раствором и рассматривают под микроскопом для установления наличия меро-зоитов, шизонтов или гамет кокцидий.
У павших кроликов исследуют беловатые очаги в печени и содержимое желчного пузыря на наличие ооцист кокцидий Eimeria. Очаги разрезают и с помощью пастеровской пинетки наносят их содержимое на предметное стекло. Накрыв препарат покровным стеклом, рассматривают его под микроскопом. Аналогичным образом поступают и с поражениями почек гусей.
2.3 3. Обработка результатов
2.3.3.1. В случае установления единичных стадий развития кокцидий заболевание кокцидиозом рассматривается как вторичная инфекция, которая не играет главную роль в падеже животных. При установлении разных стадий развития патогенных видов кокцидий в большом количестве и исключении других инфекционных заболеваний кокцидиоз считают причиной падежа животных
2.4. Метод исследования подстилки на наличие ооцист кокци-дий
Сущность метода заключается в подсчете количества ооцист в 1 г подстилки и определении по данным подсчета тяжести клинического течения кокцидиоза и резистентности кокцидий к используемому антикокцидиозному препарату.
2.4.1. Аппаратура, материалы и реактивы
2.4.1.1. Для проведения исследования применяют аппаратуру, материалы и реактивы, указанные в п. 2.1.1, и дополнительно:
счетную камеру Горяева или Мак-Мастера;
2.4.2. П р оведение исследования
2.4.2.1. Пробу подстилки хорошо перемешивают. Взвешивают 10 г пробы с погрешностью не более 0,02 г и перекладывают в стакан с 100 см 3 воды, ставят в холодильник, выдерживают в течение 12 ч и гомогенизируют 2—3 мин в электрическом гомогенизаторе с частотой вращения 2000 об/мин. Полученную суспензию фильтруют в течение 5 мин. Жидкую часть сливают, к осадку добавляют 10 см 3 флотационного раствора и тщательно перемешивают, встряхивая пробирку. Наполняют счетную камеру или помещают 0,15 см 3 суспензии на предметное стекло, накрывают ее покровным стеклом и выдерживают в течение 2 мин. Число ооцист умножают на коэффициент 67, что представляет собой количество ооцист в 1 г подстилки.
2.4.3. Обработка результатов
2.4.3.1. Определение вида кокцидий проводят согласно соответствующему определителю.
При наличии до 5000 ооцист Е. acervulina в 1 г подстилки не придают им никакого клинического значения. Наличие до 5000 ооцист Е. tenella или Е. nccatux в 1 г подстилки свидетельствует о слабом течении кокцидиоза у содержавшихся на этой подстилке цыплят или же о снижении действия используемого кокцидиоста-тика. Наличие 1000 ооцист Е. maxima в 1 г подстилки свидетельствует о клиническом течении кокцидиоза и недостаточной эффективности аптикокцидиозного препарата.
2.5. Метод установления интенсивности инфекции
2.5.1. Проведение исследования
2.5.1.1. Интенсивность инфекции ооцистами Eimeria или другими формами развития этого рода устанавливают подсчетом их в микроскопическом препарате и делением полученного числа на 3.
2.5.2. Обработка результатов
2.5.2Л. Подсчитанное число ооцист делят на 3. Это число будет равным числу паразитов в 1 г кала. В зависимости от этого дтч самых патогенных видов Eimeria устанавливают следующие степени интенсивности инфекции:
слабая инфекция ( + ) — 1 —10 ооцист на 1 г кала; средняя инфекция ( + +) —11 — 100 ооцист на 1 г кала; сильная инфекция ( + + +)—больше 100 ооцист на 1 г кала. При оценке интенсивности инфекции следует учитывать не только наличие ооцист различных видов Eimeria, но и присутствие других паразитов.
Изменение 1 ГОСТ 25383—82 Животные сельскохозяйственные. Методы лабораторной диагностики кокцидиоза
Утверждено и введено в действие Постановлением Государственного комитета СССР по стандартам от 27.05.87 № 1714
Дата введения 01.01.88
Пункты 2.1.1.1, 2.1.2.1 изложить в новой редакции:
микроскоп с окулярным микрометром марки МБИ-3 по ГОСТ 8284—78; весы лабораторные общего назначения по ГОСТ 24104—80 с наибольшим пределом взвешивания 206 г;
центрифугу с частотой вращения 5000 мин- 1 ;
стаканы стеклянные вместимостью 150—200 см 3 и 1000 см 3 по Г ОСТ
чашки стеклянные лабораторные по ГОСТ 25336—82; стекла предметные по ГОСТ 9284—75 и покровные пипетки градуированные исполнений 1, 2, 4, 5, 6,
по ГОСТ 6672— 2-го класса точности
стимостью 50 см 3 по ГОСТ 20292—74; посуду лабораторную фарфоровую; воронки стеклянные по ГОСТ 25336—82; штатив для пробирок; петли;
марлю медицинскую по ГОСТ 9442—77;
вату гигроскопическую медицинскую по ГОСТ 5556—81;
фильтры беззольные по ГОСТ 12026—76;
натрий хлористый по ГОСТ 4233—77;
воду дистиллированную по ГОСТ 6709—72.
2.1 2.1. Приготовление флотационного раствора
Пункт 24.2,2 исключить.
Пункт 2.1.3.1 изложить в новой редакции: «2.1.34. Из пробы выделяют навеску кала массой 3—5 г, помещают навеску в ступку, заливают 15—20 см золы. размешивают до жидкой консистенции и процеживают через марлю в-центрифужные пробирки.
Пункты 2 2.2 1, 2.2.34 изложить в новой редакции: «2 2.2.1. Взвешивают 5 г кала, взятого из отобранной пробы, и тщательно размешивают в ступке с 45^см 3 воды. Полученную суспензию фильтруют через один слой марли, осадок отбрасывают. 10 см 3 фильтрата помещают в центрифужную пробирку и центрифугируют в течение 5 мин с частотой вращения 5000 мин- 1 . Жидкую часть сливают, к осадку добавляют 10 см 3 флотационного раствора, тщательно перемешивают и еще раз центрифугируют в течение 5 мин с частотой вращения 5000 мин — 1 . Из пробирки снимают при помощи петли поверхностный слой жидкости и в счетной камере Горяева подсчитывают количество ооцист во всех 225 квадратах. Для определения количества ооцист в 1 г кала, подсчитанное з камере Горяева, число ооцист умножают на 1111.
(Продолжение см. стр. 338)
2.2 ЗЛ. У домашней птицы наличие 50000 ооцист на 1 г кала не влияет на зоотехнические показатели цыплят, обнаружение более 100000 оосцист на 1 г кала свидетельствует о заражении средней степени, обнаружение ооцист в количестве более 300000 на 1 г кала — о высокой степени заражении и малой эффективности применяемого препарата.
У крупного рогатого скота и овец наличие до 100*0 ооцист в 1 г кала свидетельствует о низкой степени заражения, до 5000 — о средней степени заражения, более 5000 — о высокой степени заражения.
Пункт 2.3.1 Л. Заменить ссылку: ГОСТ 1.0*973—75 на ГОСТ 25336—82.
Пункт 2.3 3.1 изложить в новой редакции: «2.З.З.1. Для своевременной диагностики кокцидиоза у домашней птицы подсчет ооцист проводят один раз в 7 дней, начиная в двух-, трехнедельного возраста цыплят. Из каждой группы вскрывают по 4—6 ослабленных птиц. Исследуют соскобы со слизистой и содержимое кишечника в месте перехода дненадцатиперстной кишки в тощую, середины тонкого отдела кишечника и слепых кишок. Несколько капель наносят на предметное стекло, разбавляют водой и накрывают покровным стеклом. Просматривают под микроскопом 20 полей зрения, определяют среднее количество ооцист на. одно поле зрения и проводят идентификацию кокцидий вида Ei.meria в соответствии с ключом идентификации, представленном на схеме. В зависимости от клинических проявлений, степени и характера изменений отделов кишечника, локализации поражения и стадий развития кокцидий определяют виды ооцист Е. tenella, Е. necatrix, Е. acervulina,Е. maxima, Е. ргаесох. (см. схему. См. с. 339)?>.
Раздел 2 дополнить пунктами — 2.3.4, 2.3.4.1:
«2.3.4. Оценка результатов
2.3.4.1. Наличие ооцист видов Е. acervulina менее 50 и ооцист Е. tenella, Е. necatrix, Е. maxima менее 5 кокцидий в поле зрения — признак низкой степени заражения.
Пункты 2.4.3, 2.4.5 исключить.
(Продолжение см. с. 339)
(Продолжение изменения к ГОСТ M3-S2) КЛЮЧ И ИДЕНТИФИКАЦИИ ВИДОВ Eimeria ЦЫПЛЯТ
Читайте также:

