Диф диагностика дисбактериоза кишечника
Обновлено: 19.04.2024
Известно, что бактерии встречаются всюду в окружающем нас мире и за длительный эволюционный период тесного существования человека и микроорганизмов сформировались симбиотические (взаимовыгодно существующие) системы, составными частями которой являются микрофлора, макроорганизм и окружающая среда. В результате эволюционного процесса все органы человека, сообщающиеся с внешней средой, населены микроорганизмами: кожа, желудочно-кишечный тракт (ЖКТ), слизистые оболочки, вагина. В норме эта ассоциация находится в состоянии экологического равновесия - эубиоза и характеризуется единством, целостностью и способностью к саморегуляции. При различных неблагоприятных воздействиях на организм человека его микрофлора реагирует изменениями своего количественного и качественного состава, в крайних проявлениях приводя к нарушению равновесия - дисбактериозу.
Дисбактериоз (термин ввел немецкий ученый А.Нисле в 1916 г.) - качественное и количественное изменение бактериальной микрофлоры организма, главным образом кишечника. Однако следует помнить, что это состояние не является самостоятельным заболеванием и нозологической единицей.
На основании многолетних исследований, проведенных в этой области, микрофлору кишечника принято подразделять на несколько групп.
Облигатная флора, в которую входят микроорганизмы, постоянно населяющие кишечник, выполняющие как защитные функции, так и участвующие в обмене веществ.
Факультативная (условно-патогенная) флора, к которой относятся бактерии, живущие в организме человека, не вызывая заболевания при нормальном состоянии иммунной системы (рис. 1).
Рис. 1. Функции облигатной флоры кишечника.
| Защитная Иммунологический барьер, активация иммунной системы | ||||
| │ | ||||
| Участие в процессе пищеварения | ─ | Облигатная флора кишечника | ─ | Синтез витаминов и ферментов |
| │ | ||||
| Регулирует моторику ЖКТ |
Транзиторная флора, представители которой не приспособлены жить в организме человека, и их выделение носит случайный характер.
Патогенная флора - возбудители инфекционных заболеваний, которые в норме не присутствуют в организме человека.
К представителям облигатной микрофлоры относятся бифидо-, лактобактерии и кишечная палочка.
Бифидобактерии занимают доминирующее положение в кишечной флоре как у детей, так и у взрослых, составляя 90-95% от всех микроорганизмов кишечника. Они обладают высокой антагонистической активностью по отношению ко многим патогенным микроорганизмам, препятствуя их проникновению в организм человека. Выделяя молочно-кислую и уксусную кислоты, бифидобактерии способствуют усилению процессов пищеварения, участвуя в гидролизе белков, сбраживании сахара, расщеплении жиров. Также они растворяют клетчатку, усиливают всасывание в кишечнике кальция, железа и витамина D, стимулируют перистальтику кишечника, обеспечивая нормальную эвакуацию его содержимого. Биологически активные вещества, которые выделяют бифидобактерии, участвуют в обменных процессах организма, снижают токсическую нагрузку на печень. Кроме того, они участвуют в синтезе витамина К, витаминов группы В (В: - тиамина, В2 - рибофлавина, В3 - никотиновой кислоты, Вб - пиридоксина, В9 - фолиевой кислоты, В12 - цианокобаламина), а также аминокислот и белка. Одной из важнейших функций является иммуностимулирующее действие бифидобактерии. Они регулируют систему местного иммунитета кишечника, стимулируя образование интерферона и иммуноглобулинов. В клеточной стенке бифидобактерии содержится большое количество мурамилдипептида, который активирует образование В- и Т-лимфоцитов и макрофагов, обеспечивающих устойчивость иммунной системы к инфекционным заболеваниям. При снижении бифидобактерии активируется условно-патогенная флора.
В норме содержание бифидобактерии должно составлять не менее 10 9 -10 10 живых микробных тел на 1 г фекалий [1].
Лактобактерии обладают широким спектром антагонистической активности, благодаря чему подавляется рост патогенной, гнилостной и газообразующей микрофлоры: в первую очередь протеев, сальмонелл, дизентерийной палочки. В процессе своей жизнедеятельности лактобациллы синтезируют молочную кислоту, перекись водорода, лизоцим и другие вещества, обладающие антибиотической активностью. Также немаловажную роль они играют в регуляции иммунитета, стимулируя синтез иммуноглобулинов и интерферона.
Лактобактерии присутствуют в кишечнике здоровых людей в количестве 10 6 -10 8 клеток на 1 г фекалий [1].
Кишечная палочка заселяет слизистую оболочку ЖКТ в первые дни после рождения. Ее количество составляет примерно 0,01% от общего числа доминирующих бифидо- и лактобактерии, однако она незаменима. Кишечная палочка участвует в расщеплении лактозы, играет важную роль в синтезе витаминов К и группы В, выделяет колицины - антибиотикоподобные вещества, подавляющие рост энтеропатогенных штаммов кишечной палочки, активирует системный и местный иммунитет [2].
Факультативная часть нормальной микрофлоры составляет всего 0,6% от общего количества микроорганизмов, локализуется преимущественно в толстой кишке, и представлена стафилококками (золотистым и эпидермальным), бактериями семейства Enterobacteriaceae (протей, клебсиелла, клостридии, энтеробактер), некоторыми видами дрожжевых грибов. Они достаточно часто встречаются в кишечнике здоровых людей, но при снижении резистентности организма способны вызывать различные патологические состояния. Так, клостридии в кишечнике детей не должны превышать 10 3 клеток, а у взрослых - 10 5 клеток на 1 г кишечного содержимого. Если их содержание не превышает нормативные показатели, то они принимают участие в переваривании белков. В процессе расщепления животных протеинов образуются индол и скатол, стимулирующие перистальтику кишечника в умеренном количестве. Однако при их избыточном образовании возникают диспепсические явления, метеоризм и интоксикация организма этими веществами [1, 2].
Из группы условно-патогенных бактерий отдельно хочется выделить Klbsiellapneumoniae и Klbsiella oxytoca. В последнее время наблюдается тенденция к увеличению частоты встречаемости этих микроорганизмов в кишечнике, особенно у детей раннего возраста, и, как правило, они полностью вытесняют кишечную палочку и заменяют ее место. В отличие от кишечной палочки клебсиеллы не способны расщеплять лактозу. Среди таких детей высока частота встречаемости метеоризма, кишечных колик, они отказываются от грудного вскармливания и имеют плоскую кривую массы тела.
Вторыми в отношении тяжести течения дисбактериоза являются микроорганизмы рода протей - Proteus vulgaris и Proteus amirabilis. Они вызывают длительную диарею, и стул при этом носит зловонный характер. Как правило, дисбактериоз, обусловленный протеем, возникает как осложнение антибактериальной терапии. При лечении антибиотиками резко снижается численность облигатной флоры (бифидо-, лактобактерий и кишечной палочки), как следствие уменьшается иммунологическая защита и резко увеличиваются бактерии рода протей, обладающие устойчивостью к большинству антибактериальных препаратов, применяемых в амбулаторной практике.
Общее количество дрожжевых и мицелиальных грибов не должно превышать 1000 клеток на 1 г фекалий. Наиболее часто при дисбактериозе кишечника высеваются грибы рода Candida, которые вызывают бродильные процессы в кишечнике и утяжеляют течение атопического дерматита, но при этом они не являются первопричиной аллергии.
Процесс заселения организма человека бактериями начинается с момента прохождения ребенка по родовым путям матери, и в постнатальном периоде состав флоры продолжает формироваться в течение первых б мес жизни. Наиболее оптимальным и естественным для ребенка в этот период является грудное вскармливание. Как известно, грудное молоко в своем составе имеет высокое содержание олигосахаров, которые являются ценнейшим пробиотическим фактором и стимулируют образование кишечных колоний Lactobacillus bifidus - полезных молочно-кислых лактобактерий, которые подавляют рост патогенных микроорганизмов в кишечнике. А неусвоенная лактоза в просвете толстой кишки, снижая рН, препятствует росту гнилостной микрофлоры. Нежная лакто- и бифидофлора кишечника, формирующаяся в первые месяцы жизни, определяет в дальнейшем микробиоценоз и микробное равновесие ЖКТ. Поэтому основной задачей на первом году жизни ребенка должна быть поддержка грудного вскармливания, которое способствует более эффективному и качественному становлению микробиоценоза [3]. Использование антибактериальных препаратов, подавляющих рост бактерий, фагов, и обилие биопрепаратов, бесконтрольно используемых в этот период времени, могут способствовать приобретению дисбактериоза. У младенцев же, находящихся с рождения на искусственном вскармливании, создаются предпосылки для повышения активности аэробной условно-патогенной флоры, которые требуют микробиологической коррекции [4].
У детей старше 1 года после прекращения вскармливания грудным молоком постепенно исчезает лактозонегативная кишечная палочка, дрожжеподобные грибы рода Candida и другие представители семейства Enterobacteriaceae, снижается общее количество кишечной палочки и стафилококков. Доминирующей становится бифидофлора [5]. Именно эти микроорганизмы на протяжении всей жизни человека выполняют основную роль в регуляции процессов пищеварения, всасывания необходимых витаминов и незаменимых аминокислот, а также целого ряда биологически активных соединений.
В течение жизни на человека действуют различные неблагоприятные факторы, которые могут вызывать отдельные отклонения в составе кишечной микрофлоры, не являющиеся нарушениями микробиоценоза, так как они носят транзиторный характер и не требуют коррекции (рис. 2). Возникшее стойкое изменение количественного и видового состава бактерии, сопровождающееся нарушением защитных механизмов в организме, является дисбактериозом. Необходимо помнить, что дисбактериоз всегда вторичен и причинно обусловлен. Поэтому к трактовке микробиологического анализа кала и необходимости его коррекции следует подходить с большой осторожностью и делать практические выводы только после сопоставления данных анализа с клинической картиной и жалобами пациента.
Рис. 2. Факторы, влияющие на состав флоры кишечника.
- Экология
- Стресс
- Характер питания
- раннее искусственное вскармливание
- употребление в пищу рафинированных продуктов с длительным сроком хранения
- Медикаментозная терапия антибактериальными препаратами, гормонами, иммунодепрессантами
- Несовершенство защитных реакций организма
- Постнатальная гипоксия
- Морфофункциональная незрелость
- Недоношенность
- Заселение кишечника агрессивными внутрибольничными штаммами
- Соматическая патология и оперативные вмешательства
- Острые респираторные вирусные инфекции
Основные показания к исследованию микрофлоры кишечника представлены на рис. 3.
Рис. 3. Основные показания к исследованию микрофлоры кишечника.
| Показания к исследованию кала на дисбактериоз |
| Длительно протекающие кишечные расстройства, не поддающиеся коррекции |
| Неустойчивый характер стула |
| Наличие в кале слизи, крови, кусочков непереваренной пищи, неравномерная окраска |
| Метеоризм и кишечные колики, не поддающиеся коррекции |
| Анемия, рахит |
| Атопический дерматит с элементами вторичного инфицирования |
| Частые острые респираторные вирусные инфекции |
| Сепсис |
В зависимости от характера изменения микрофлоры, находящейся в просвете толстой кишки, выделяют 3 степени дисбактериоза (рис. 4).
Рис. 4. Классификация дисбактериозов.
Классификация дисбактериозов по степеням
- снижение количества бифидобактерий и/или лактобактерий менее 10 6 КОЕ/г фекалий
- повышение количества кишечной палочки более 10 8 КОЕ/г фекалий
- выявление одного вида условно-патогенных микроорганизмов 10 5 КОЕ/г фекалий
- выявление ассоциации условно-патогенных микроорганизмов 10 3 -10 4 КОЕ/г фекалий
- выявление одного вида условно-патогенных микроорганизмов или ассоциаций в высоких титрах
Лечение дисбактериоза всегда должно быть комплексным, с учетом основного заболевания и предрасполагающих факторов, характера симптомов и глубины нарушений, а также осуществляться под контролем врача.
Это комбинированный и уникальный по своим составу и функциям препарат применяется в педиатрической практике с первого года жизни (в том числе и у недоношенных младенцев), а также разрешен беременным и кормящим женщинам. После приема внутрь он действует только в просвете кишечника, не всасывается в кровь и выводится из пищеварительного тракта с калом. Выпускается в удобной лекарственной форме, которая обеспечивает легкость дозирования в зависимости от возраста ребенка.
Рис. 5. Применение препарата Хилак форте в составе комплексной терапии.
Хилак форте назначают младенцам по 15-30 капель, детям по 20-40 капель, взрослым по 40-60 капель 3 раза в сутки. После улучшения состояния первоначальная доза препарата может быть уменьшена наполовину. Принимают внутрь до или во время приема пищи в небольшом количестве жидкости, кроме молока.
Особенностью детей первого полугодия жизни является относительная функциональная незрелость органов (слюнных желез, печени, поджелудочной железы), обеспечивающих полостное переваривание пищи. Слизистая оболочка кишечника компенсирует эту недостаточность, беря на себя основные функции по пристеночному пищеварению. Однако при любых неблагоприятных условиях и повреждающем действии на слизистую оболочку кишечника поражаются ворсины кишечного эпителия, коррелирующие с ферментативной активностью, что проявляется синдромом мальабсорбции [9, 10]. Препарат Хилак форте, имея в своем составе значительную добавку биосинтетических бактериальных продуктов, способствует поддержанию физиологической функции слизистой оболочки кишечника, а также стимулирует ее регенеративные способности, а короткоцепочные жирные кислоты усиливают собственную ферментативную активность слизистой оболочки кишечника.
Доказана эффективность препарата в комплексной терапии при выхаживании недоношенных новорожденных как в стационаре, так и в течение первых 12 мес жизни, что имеет большое практическое значение. Недоношенные младенцы, оказываясь в условиях отделений интенсивной терапии и второго этапа выхаживания, получают агрессивные внутрибольничные штаммы. Кроме того, незрелые иммунная система и ЖКТ, а также длительная антибактериальная терапия приводят к стойкому нарушению микробиоценоза кишечника в постнатальном периоде, сопровождающемуся изменениями частоты и характера стула [11, 12]. В качестве селективной стимуляции облигатной микрофлоры у недоношенных новорожденных препарат Хилак форте рекомендуется использовать из расчета 5-10 капель на 1 кг массы тела 2-3 раза в сутки.
Препарат Хилак форте положительно зарекомендовал себя и в педиатрической практике, и среди взрослых пациентов. В ряде исследований показана высокая эффективность Хилака форте у больных с острыми кишечными инфекциями и хроническими заболеваниями ЖКТ. Добавление к терапии препарата Хилак форте позволяет быстрее устранить интоксикацию и диспепсические явления, нормализовать стул. В то же время он способствует уменьшению выраженности воспаления и атрофических процессов в слизистой оболочке толстой кишки [13].
Отчетливый элиминационный эффект Хилака форте получен в отношении клебсиелл, цитобактера и грибов рода Candida, что сопровождается нормализацией количественного содержания бифидобактерий, лактобактерий, кишечной палочки, энтерококков. Одновременно с восстановлением микрофлоры в копрограмме пациентов снижается количество непереваренных мышечных волокон, растительной клетчатки и зерен крахмала, устраняется йодофильная флора [14, 15].
Препарат Хилак форте рекомендовано использовать в комплексной терапии при лечении нарушений моторной функции толстой кишки, неалкогольной жировой болезни печени, желчно-каменной болезни [16, 17]. При включении Хилака форте в схему лечения синдрома раздраженной кишки отмечается положительное действие препарата на клиническую картину и микробиологический статус больных. Применение Хилака форте у пациентов с функциональными запорами, сопровождающимися значительными нарушениями структуры биоценоза толстой кишки, приводит к нормализации стула, улучшению его консистенции, оказывает выраженный бифидогенный эффект, способствует снижению рН кала с ингибированием роста условно-патогенных штаммов [18].
При развитии антибиотикоассоциированной диареи назначение Хилака форте нормализует биоценоз кишечника. Он способствует регенерации физиологической флоры кишечника биологическим путем, создает оптимальные условия для роста облигатных микроорганизмов и обеспечивает регенерацию поврежденной стенки кишечника [19].
Препарат рекомендован для восстановления микробиоценоза ЖКТ после курса эрадикационной терапии при заболеваниях верхних отделов пищеварительной системы, ассоциированных с Н. pylori [20].
Также отмечен положительный эффект препарата Хилак форте в составе комплексной терапии при длительном волнообразном течении заболеваний верхних дыхательных путей на фоне частых острых респираторных вирусных инфекций, сопровождающихся повышением активности условно-патогенной флоры на слизистой оболочке дыхательного тракта.
Таким образом, приведенные данные свидетельствуют о высокой эффективности препарата Хилак форте при лечении синдрома дисбактериоза в составе комплексной терапии основного заболевания, приводящего к нарушению микробиоценоза кишечника. Состав и свойства препарата Хилак форте позволяют применять его и для коррекции микробиологических нарушений, и для их профилактики, в частности при антибактериальной терапии. Безопасность и высокий терапевтический эффект обосновывают включение Хилака форте в терапию не только у взрослых, но и у детей всех возрастных групп, включая новорожденных и недоношенных младенцев.
Что такое колит? Причины возникновения, диагностику и методы лечения разберем в статье доктора Куракина Александра Анатольевича, проктолога со стажем в 11 лет.
Над статьей доктора Куракина Александра Анатольевича работали литературный редактор Елена Бережная , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Колит (лат. colitis, от греч. kolon (толстый кишечник) и itis (воспаление) — собирательное понятие, включающее большую группу заболеваний с одним общим признаком: воспалением толстого кишечника.
Основные признаки колита: частый жидкий стул с кровью, боль в животе и высокая температура.
Колиты встречаются в практике гастроэнтерологов, инфекционистов, терапевтов, колопроктологов, хирургов и других специалистов.
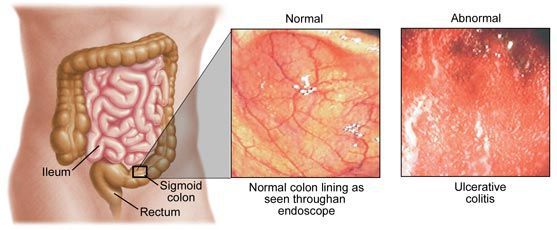
Этиология колита
Основные формы колитов можно описать только по отдельности, в зависимости от этиологического фактора. Размеры статьи не позволяют коснуться всех видов колита. Рассмотрим только основные из них.
Инфекционный колит — это заболевание кишечника, возникающее из-за активизации условно-патогенных микроорганизмов в кишечнике или попадания новых болезнетворных микробов из внешней среды. [1]
Инфекционный колит имеет очень широкое распространение: нет человека, ни разу не переносившего данное заболевание. Количество заболевших увеличивается в жаркий период, когда создаются благоприятные условия для распространения инфекции. Поэтому чаще болеют люди в регионах с жарким климатом (Африка, Юго-Восточная и Средняя Азия). Заболевание чаще встречается в детском возрасте, особенно у детей, посещающих учебные заведения (детские сады, школы и т. д.). Гастроэнтерологи и проктологи могут встречать в практике больных с данной патологией, но она не является профильной. Лечат заболевание обычно инфекционисты.
Причины инфекционного колита:
- бактерии (шигеллы, эшерихии, сальмонеллы, клостридии, иерсинии, брюшнотифозная палочка, кампилобактерии, протей, стафилококки);
- вирусы (аденовирус, энтеровирус, ротавирус);
- простейшие (амебы, лямблии и др.);
- возбудители туберкулеза и сифилиса;
- грибки (кандида, актиномицеты). Возникновение грибкового колита свидетельствует о снижении иммунитета и часто проявляется у лиц, страдающих СПИДом, получающих химиотерапию, стероидные гормоны;
- дисбактериоз.
Формы инфекционного колита:
- катаральная;
- фиброзная;
- катарально-геморрагическая;
- флегмонозная;
- флегмонозно-гангренозная;
- некротическая.
Воспалительные явления могут иметь стадийный характер, а могут сразу иметь картину запущенного воспаления. Его выраженность напрямую зависит от характера инфекции. Некротическое и флегмонозно-гангренозное воспаление встречается при клостридиальной инфекции. Катарально-геморрагическое — при дизентерии. Катаральное воспаление встречается чаще при вирусных заболеваниях. [2]
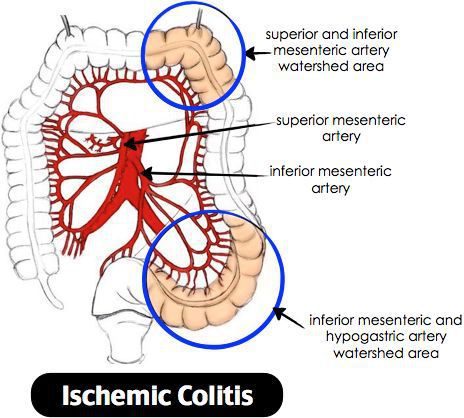
Ишемический колит — воспаление стенки толстого кишечника, возникающее из-за нарушения процессов кровобращения. Существует хроническое и острое нарушение кровообращения. [3]
Причиной нарушения кровообращения является полное прекращение или критическое снижение притока крови к толстой кишке, вследствие чего возникает воспаление. При тяжёлом течении может приводить к некрозу стенки кишечника. Причиной закупорки сосудов могут быть тромбы, но чаще всего к сужению просвета сосуда приводят атеросклеротические бляшки. Поэтому болезнь чаще проявляется у лиц пожилого возраста. Около 79% больных ишемическим колитом старше 48 лет. [4] Частота встречаемости не имеет связи с половой принадлежностью и регионом. Впервые открыт в 1966 году. Ишемический колит является профильным заболеванием для колопроктологов, но им также занимаются общие хирурги и гастроэнтерологи. [5]
Причины ишемического колита:
-
сосудов;
- закупорка брыжеечных сосудов вследствие эмболии или тромбоэмболии (в результате аллергических реакций, травм, осложнений операций, системного васкулита, ДВС-синдрома);
- снижение давления крови может приводить к нарушению питания стенки кишки.
Закупорка просвета сосуда приводит к ишемии стенки кишки, а как следствие — к некрозу и далее перфорации. [6]
Объём поражения зависит от размера питающей артерии, длительности закупорки. Если закупорка сосуда происходит постепенно (при образовании атеросклеротических бляшек в сосудах), то говорят о хроническом нарушении кровообращения, что в свою очередь приводит к стриктурам.
При критических состояниях и снижении давления крови (например, анафилактический шок, ДВС-синдром и т.д.), происходит централизация кровообращения, при этом резко снижается приток крови к кишечнику, что приводит к ишемии и некрозу.
При атеросклерозе чаще страдает сигмовидная и поперечная ободочная кишка. Воспаление начинается со слизистой оболочки, затем переходит на все слои. [7]
По характеру поражения выделяют:
- транзиторную форму (когда ишемические процессы обратимы);
- стенозирующую (когда формируются стриктуры);
- гангренозную (когда образуются язвы с дальнейшим развитием некроза, поражение носит необратимый характер). [8]
Лучевой колит — образуется в результате ионизирующего воздействия на стенку толстого кишечника.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы колита
Симптомы острого и хронического колита: боль в животе, кровь в кале, диарея, высокая температура, слабость, слизь и кровь в стуле, спазмы.
Симптомы язвенного колита: к перечисленным выше признакам добавляются боли в анусе и анемия.
Боли при колите кишечника:
Инфекционный колит
Клиника инфекционного колита напрямую зависит от возбудителя.
Для любого инфекционного колита независимо от этиологии характерно:
- начало заболевания, как правило, имеет острый характер;
- жидкий частый стул с примесью слизи в кале;
- боли локализуются чаще в левом подреберье, но могут также распространяться по всем отделам живота;
- боль имеет периодический, спазматический характер;
- высокая температура;
- чувство слабости, недомогания;
- сухость кожных покровов и слизистых;
- белый налет на корне языка;
- рвота как первый симптом колита кишечника (если в воспалительный процесс вовлечен желудок).
Для первичной оценки этиологии инфекционного колита оценивают характер дефекации, объём и особенности каловых масс.
Ишемический колит
Симптоматика очень вариабельна, характерно быстрое прогрессирование.
- болезненные ощущения в животе;
- кровь и слизь в стуле;
- неустойчивый, частый стул;
- выраженные боли в околопупочной и левой подвздошной области;
- при ректальном осмотре можно заметить кал с кровью, слизью или гноем;
- при хронической форме боли имеют низкую интенсивность, обычно возникают после еды;
- при длительной хронической ишемии появляются стриктуры в толстой кишке, которые в дальнейшем могут быть следствием непроходимости или малигнизации (раковому перерождению).
Лучевой колит
Обычно колит формируется у лиц, перенёсших курс лучевой терапии по поводу новообразований, локализующихся в области малого таза или брюшной полости. [12]
- большую чувствительность к излучению имеет тонкий кишечник, формируется лучевой энтерит, который клинически проявляется нарушением абсорбции в тонком кишечнике;
- повреждению кишечника свойствен избирательный характер, обычно воспаление локализуется в прямой и сигмовидной кишке, при этом клиника сопоставима с клиникой язвенного и ишемического колита. При воздействии больших доз радиации клиника развивается не сразу, проявляется обильным, жидким стулом, при этом нарушается всасывание в толстом кишечнике. [13]
Патогенез колита
Толстый кишечник очень восприимчив к ионизирующему излучению. [10] Лучевой колит возникает при воздействии малых доз облучения: происходит атрофия слизистой оболочки (сразу после облучения).
- Усиливаются процессы деления клеток, уменьшается длина ворсинок.
- Активизируются воспалительные процессы с нейтрофильной реакцией. Чаще всего эти процессы локализуются в прямой и сигмовидной кишке.
- При воздействии больших доз (более 40 Гр.) воспалительные процессы могут возникать спустя длительное время после облучения (до нескольких лет), в данной ситуации происходит воспаление мелких сосудов кишечника, что приводит к ишемизации кишечника. Развиваются язвы и стриктуры. Могут поражаться все отделы толстого и тонкого кишечника. [11]
Классификация и стадии развития колита
По течению:
По этиологии:
- язвенный колит кишечника и болезнь Крона (воспалительные заболевания кишечника с неизвестной этиологией);
- инфекционный (этиологический фактор бактериальный, вирусный, грибковый, паразитарный);
- ишемический (развивается вследствие снижения притока крови к толстой кишке);
- спастический (из-за неправильного питания нарушается моторика толстого кишечника и возникают спазмы);
- токсический (при применении нестероидных противовоспалительных препаратов);
- лучевой (при поражении радиацией).
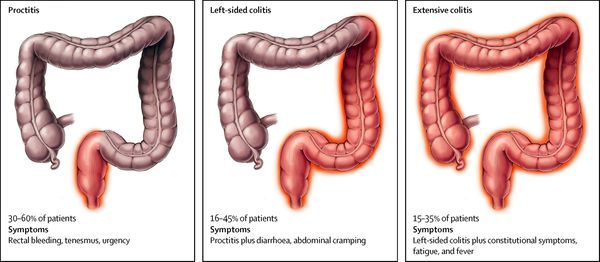
По локализации:
| Вид колита | Локализация |
|---|---|
| проктит | воспаление прямой кишки |
| панколит | тотальное поражение кишечника |
| тифлит | воспаление слепой кишки |
| трансверзит | воспаление поперечной ободочной кишки |
| сигмоидит | воспаление сигмовидной кишки |
| диффузный колит кишечника | охватывает два и более отдела кишечника |
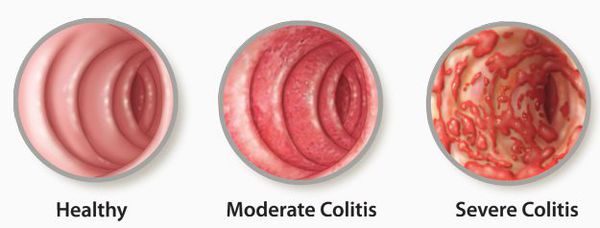
Поражение кишечной стенки подразделяют на три вида:
- катаральный колит кишечника — слабое воспаление, слизистая краснеет, и возникает отёк;
- эрозивный колит кишечника — появляются эрозии;
- атрофический колит кишечника — слизистая атрофируется.
Осложнения колита
- сильное кровотечение;
- перфорация толстой кишки;
- сильное обезвоживание; ;
- воспаление кожи, суставов и глаз;
- повышенный риск рака толстой кишки;
- токсичный мегаколон;
- повышенный риск образования тромбов в венах и артериях [15] .
Диагностика колита
Инфекционный колит:
- Лабораторные методы:
- анализ кала на вирусы, бактерии, паразиты (позволяет точно поставить диагноз);
- серологическое исследование (определяют антитела к вирусам, паразитам);
- анализ крови на стерильность (при подозрении на сепсис);
- общеклинический анализ крови (высокое СОЭ, увеличение количества лимфоцитов при вирусной этиологии).
- Инструментальные методы:
- ректороманоскопия используется как дополнительный метод для дифференциальной диагностики;
- ультразвуковое исследование используется для исключения осложнений.
Ишемический колит:
- Ректороманоскопия дает возможность оценить состояние слизистой оболочки. При осмотре можно отметить наличие точечных кровоизлияний, сглаженность сосудистого рисунка, бледность слизистой. При обнаружении данных признаков показано взятие биопсии.
- Ирригоскопия — самое необходимое исследование. Обнаруживается симптом пальцевых вдавливаний. Признаки дефектов слизистой свидетельствуют о наличии язв, сужения просвета при стриктурах.
- Колоноскопия показана для уточнения распространенности воспаления, также показана биопсия в области измененного участка.
- Ангиография позволяет определить степень сужения сосуда и его локализацию. [9]
- Злокачественные новообразования. Опухоли развиваются достаточно длительное время, в течении многих лет.
- Инфекционный колит. Преобладают симптомы общей интоксикации (слабость, лихорадка и т.д.). Кроме того, имеет место эпидемический анамнез.
- Язвенный колит и болезнь Крона. Для них характерно достаточно медленное прогрессирование. Проявляются обычно в раннем возрасте.
Лучевой колит:
- При сборе анамнеза учитывают наличие факта облучения ионизирующей радиацией.
- Ректороманоскопия и колоноскопия с биопсией позволяют выявить воспаление слизистой оболочки толстого кишечника. При лучевом энтерите воспаление сочетается с атрофией слизистой. Крипты становятся менее глубокими, уменьшается длина ворсинок. При лучевом колите на слизистой обнаруживают язвы, стриктуры. [14]
- Энтерит лучевого генеза следует дифференцировать с болезнями тонкой кишки, при которых страдает функция всасывания (целиакия), при данных заболеваниях происходит атрофия по гиперрегенераторному типу, а при лучевом поражении преобладают гипорегенераторные процессы слизистой.
- Радиационные поражения толстого кишечника дифференцируют с язвенным колитом, болезнью Крона, новообразованиями толстого кишечника. [15]
Лечение колита
Инфекционный колит:
- антибактериальные, противогрибковые средства с учетом чувствительности микроорганизмов. Предпочтение отдают таблетированным формам препаратов;
- восполнение потерянной жидкости и минералов: растворами для приема внутрь (Регидрон и др.), внутривенное введение (раствор Рингера, Трисоль и др.);
- прием сорбентов;
- пробиотики и пребиотики;
- ферменты (креон, фестал);
- симптоматическая терапия (противовоспалительные средства, спазмолитики и др.)
Ишемический колит:
- консервативное лечение колита (щадящая диета, препараты, смягчающие стул, лекарства для улучшения кровотока, дезагреганты, витаминные препараты, дезинтоксикационное лечение, восполнение баланса электролитов и жидкости, гемотрансфузии (при показаниях), антибактериальные препараты);
- оперативное лечение колита.
Показаниями для срочного хирургического лечения служат:
- перфорация, толстокишечная непроходимость. В таком случае удаляется участок кишки, с последующей санацией и дренированием брюшной полости.
- плановое оперативное лечение колита кишечника показано больным в случае сужения (стриктуры) толстого кишечника без явлений острой кишечной непроходимости.
Терапия лучевого колита схожа с терапией язвенного колита и болезни Крона:
- лекарства, содержащие 5-аминосалициловую кислоту (месалазин, салофальк);
- антибактериальная терапия.
Может быть полезно вести дневник питания, чтобы отслеживать, что вы едите, а также свои чувства. Если вы обнаружите, что некоторые продукты вызывают обострение ваших симптомов, вы можете попробовать их устранить.
Диетотерапия
Убедительных доказательств того, что неправильное питание приводит к воспалению кишечника, нет. Но оно может усугубить симптомы болезни, особенно при обострении. Поэтому полезно вести дневник питания и отслеживать свои реакции на определённые продукты.
- есть меньше молочных продуктов — у пациента может быть непереносимость лактозы, т. е. организм не переваривает молочный сахар;
- есть небольшими порциями по 5–6 раз в день;
- пить больше жидкости — предпочтительнее вода; алкоголь и напитки, содержащие кофеин, стимулируют кишечник и могут усилить симптомы болезни [15] .
Прогноз. Профилактика
На сегодняшний день хорошо известны причины возникновения инфекционного колита, разработаны современные методики лечения. Поэтому при неосложненном течении и вовремя начатой терапии удается достигнуть полного выздоровления. Менее благоприятный прогноз у лиц с явлениями иммунодефицита и ослабленной иммунной системой (например, у людей пожилого возраста). Прогноз благоприятный.
Основными методами профилактики являются:
- гигиенические мероприятия (тщательное мытье рук);
- использование только свежих продуктов, чистой воды;
- уделение особого внимания термической обработке пищи.
При транзиторной форме ишемического колита прогноз благоприятный. При гангренозной форме — зависит от вовремя поставленного диагноза и проведенного лечения.
Так как ишемический колит является осложнением других болезней, то для его профилактики необходимо:
- своевременное лечение сопутствующих заболеваний;
- сбалансированное питание.
Лучевой колит приводит к постоянным, необратимым изменениям кишечной стенки, поэтому прогноз неблагоприятный.
При радиационном колите могут появляться язвы и стриктуры на слизистой оболочке толстого кишечника, что может привести к кишечной непроходимости. В таком случае необходимо хирургическое лечение, от своевременности которого зависит прогноз. При правильном и вовремя проведенном лечении прогноз благоприятный. Специальных методов профилактики лучевого колита не существует.
Что такое псевдомембранозный колит? Причины возникновения, диагностику и методы лечения разберем в статье доктора Аверина Александра Анатольевича, гастроэнтеролога со стажем в 15 лет.
Над статьей доктора Аверина Александра Анатольевича работали литературный редактор Вера Васина , научный редактор Роман Васильев и шеф-редактор Маргарита Тихонова

Определение болезни. Причины заболевания
Псевдомембранозный колит (Pseudomembranous colitis) — это острое воспалительное заболевание толстого кишечника, вызываемое токсигенными штаммами бактерии Clostridium difficile [1] . Микроб вырабатывает токсины А и В, повреждающие кишечную стенку, и белок, угнетающий перистальтику кишечника. В результате возникает диарея, боль в животе, появляется слизь и иногда примесь крови в кале.
Характерным признаком заболевания являются фиброзные наложения на слизистой оболочке толстой кишки [27] [28] .

Псевдомембранозный колит (ПМК) чаще всего развивается после лечения антибиотиками. Его ещё называют Clostridium difficile-ассоциированным псевдомембранозным колитом, антибиотик-ассоциированным псевдомембранозным и клостридиозным колитом.
Эпидемиология
Заболеваемость ПМК лучше всего отслеживается в США и странах западной Европы [2] . В России статистический учёт заражения C. diff не ведётся. Согласно систематическому обзору за 2011 год, каждый 5-й случай из всех антибиотик-ассоциированных диарей (ААД) и каждый 2–3 случай внутрибольничной ААД в странах Европы и Северной Америки вызваны C. diff [3] .
В стационарах США среди внутрибольничных инфекций C. diff занимает первое место (12,1 % от общего количества), опережая K. pneumoniae (9, 7 %) и E. coli (9,3 %) [4] . В 2011 г. было зафиксировано более 450 тыс. случаев C. difficile-ассоциированной болезни и более 29 тыс. смертей от неё [29] .
В европейских странах заболеваемость C. diff составляет около 7 случаев на 10000 койко-дней, т. е. при средней госпитализации 10 дней, 7 случаев из 1000 госпитализаций заканчиваются ПМК. В 20 европейских странах это значение колеблется от 0,7 до 28,7 на 10000 койко-дней [5] .
В России в 2011 году было продано 295 млн упаковок антибиотиков, в 2019 — 379 млн [8] [26] . Антибактериальных препаратов потребляется всё больше, их продажа из аптек не контролируется, поэтому проблемы ААД и ПМК актуальны и в нашей стране.
В клиниках Санкт-Петербурга у пациентов с ААД тест на токсины C. diff был положительным в 47,7 % случаев [6] .
Смертность от ПМК колеблется от 9,3 до 22 % и зависит от возраста пациента, смерть чаще наступает при тяжёлом течении заболевания [7] [26] .
В настоящее время увеличилась внутри- и внебольничная заболеваемость C. difficile-ассоциированной болезнью, расширились группы риска, стали чаще встречаться рецидивы и тяжёлые формы, в том числе вызванные более патогенным штаммом BI/NAP1/027, возросла смертность [27] .
Причины псевдомембранозного колита
Основная причина болезни — это приём антибиотиков. ПМК могут вызывать любые антибактериальные препараты, но наиболее часто к нему приводит применение Клиндамицина, хинолонов, цефалоспоринов 2-го и 3-го поколения, карбапенемов. Реже ПМК развивается после приёма макролидов, пенициллина, Тетрациклина, Тигециклина.
К факторам риска, помимо приёма антибиотиков, относятся:
- возраст старше 65 лет;
- терапия ингибиторами протонной помпы и Н2-гистаминоблокаторами — препаратами, снижающими секрецию соляной кислоты в желудке;
- лечение в стационаре, особенно в отделениях реанимации, — каждые 7 дней госпитализации увеличивают риск ПМК на 8 % [1][9][10] ;
- наличие дополнительной патологии, в том числе воспалительных заболеваний кишечника, ВИЧ, сахарного диабета[31][32][33] ;
- хирургические вмешательства на органах ЖКТ;
- энтеральное питание, в том числе через назогастральный зонд;
- приём иммуносупрессивных препаратов (глюкокортикостероидов, Такролимуса) и противоопухолевых средств [31] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы псевдомембранозного колита
Наиболее частые симптомы лёгкого или умеренного псевдомембранозного колита:
- водянистая диарея (жидкие испражнения, похожие на кашицу) от трёх раз в сутки на протяжении двух и более дней в сочетании с болью в животе;
- лёгкие спазмы в животе, часто сопровождающиеся с позывами на стул, но не всегда приводящие к дефекации;
- примеси слизи, крови или гноя в испражнениях;
- температура тела 38,5 °С и более;
- тошнота или потеря аппетита.
При тяжёлом течении псевдомембранозного колита возникает водянистая диарея с кровью, уровень альбумина снижается менее 30 г/л, что сочетается с одним из следующих симптомов: высоким уровнем лейкоцитов в клиническом анализе крови (> 15×10 9 /л) и/или болезненностью при ощупывании живота. На фоне длительной диареи организм теряет много жидкости, что приводит к обезвоживанию и проявляется тёмно-жёлтой мочой, чувством жажды, усталости, головокружением, спутанностью сознания и заторможенностью [1] [9] .
При рецидиве болезни симптомы появляются повторно менее чем через 8 недель после окончания терапии.
Проявления псевдомембранозного колита схожи с симптомами других инфекций, поражающих толстый кишечник. Но в отличие от них признаки ПМК могут быть слабо выражены и, как правило, наблюдаются долго: от одной недели до нескольких месяцев. Также встречаются случаи, когда человек является носителем возбудителя ПМК — C. diff, но симптомы полностью отсутствуют.
Патогенез псевдомембранозного колита
В основе патогенеза ПМК лежит чрезмерное размножение бактерий C. diff на фоне уменьшения или гибели нормальной микробиоты толстого кишечника. C. diff вырабатывает токсины А и В, которые вызывают воспаление в кишечной стенке. На течение заболевания влияет состояние иммунной системы пациента и патогенные свойства бактерий, такие как вирулентность, наличие токсинов А и В.
Основной путь передачи инфекции — фекально-оральный. Бактерии попадают в организм с загрязнённых поверхностей, например с дверных ручек, смесителей, ручек смыва сливного бачка, мебели или медицинского инвентаря. Также переносить инфекцию может персонал больницы и заражённые пациенты.
Бактерии C.diff образуют споры, которые устойчивы к действию антибиотиков и могут длительно сохраняться в желудочно-кишечном тракте человека, заражая окружающих и вызывая рецидивы заболевания у самого пациента [12] .
Для некоторых людей C.diff — это часть нормальной микрофлоры ЖКТ, но в таком случае численность бактерий контролируется за счёт других микроорганизмов и работы иммунной системы.
Основные поражающие факторы C.diff — это выделяемые ею токсины [1] . Токсин А (энтеротоксин, белковая молекула с массой 308 кДа) влияет на секрецию жидкости, приводит к повреждению слизистой оболочки кишечника (мембран клеток) и вызывает воспалительный ответ со стороны иммунной системы.

Токсин В (цитотоксин, белковая молекула с массой от 250 до 270 кДа) в 1000 раз более цитотоксичен по сравнению с токсином А. Он вызывает распад филаментного актина — белка, поддерживающего целостность клеток. В результате клетки слизистой разрушаются и гибнут. Токсин В опасен для человека, но не приводит к воспалению и повреждению слизистой оболочки кишечника у животных.
Под действием токсинов в кишечной стенке развивается специфическое воспаление с характерными изменениями на поверхности слизистой. Она становится отёчной, разрыхляется, приобретает ярко-красный цвет, на ней исчезает сосудистый рисунок. При контакте эндоскопа со слизистой капельки крови не появляются. Наблюдается множество желтовато-белых бляшек диаметром 3–5 мм, которые плотно фиксированы к слизистой оболочке. При взятии биопсии они отрываются с трудом, торцом эндоскопа не снимаются. Преобладает два типа воспалительных реакций: диффузно-катаральное воспаление слизистой и очаги фибриноидного некроза — бело-жёлтые бляшки, или псевдомембраны, поэтому такой тип колита называется псевдомембранозным.
![Бляшки при ПМК [35]](https://probolezny.ru/media/bolezny/psevdomembranoznyy-kolit/blyashki-pri-pmk-35_s.jpg)
В биоптатах, полученных из воспалительно-изменённых участков слизистой, выявляют скопление иммунных клеток крови и слизистой, расширение капилляров и некроз клеток покровного эпителия [1] .
В биоптатах, взятых из бляшек, присутствует фибрин, обрывки некротизированного покровного эпителия, слизь, лейкоциты, плазматические клетки и колонии бактерий.
Чтобы определить патогенность клостридий, нужно выявить их токсины. Посев биоптатов на питательные среды удовлетворительных результатов не даёт. Метод в данном случае затратен и неинформативен, поэтому токсины C. diff определяют в кале.
Воспалительный процесс, как правило, захватывает несколько отделов толстого кишечника, но чаще поражена его прямая и сигмовидная часть, реже вовлекается вся толстая кишка. Протяжённость её поражения связана с тяжестью течения заболевания: чем больше толстого кишечника вовлечено в воспалительный процесс, тем тяжелее протекает колит и ярче симптомы.
Продолжительное воспаление в кишечной стенке приводит к следующим нарушениям:
- не всасывается жидкость, из-за чего развивается обезвоживание;
- потери крови из образующихся эрозий и язв приводят к анемии;
- кишечная стенка становится проницаемой для токсинов возбудителя и продуктов его жизнедеятельности, находящихся в просвете кишки, из-за чего нарастает общая интоксикация.
При тяжёлом течении прекращается перистальтика толстого кишечника, развивается токсический мегаколон и возникает полиорганная недостаточность, из-за чего пациент может погибнуть.
Классификация и стадии развития псевдомембранозного колита
ПМК входит в группу антибиотик-ассоциированных диарей. В Международной классификации болезней (МКБ-10) псевдомембранозный колит кодируется как АО 4.7 — Энтероколит, вызванный Clostridium difficile.
В зависимости от тяжести течения болезни и клинической картины выделяют следующие формы:
- ПМК лёгкой или умеренной тяжести. Проявляется диареей — неоформленным жидким, кашицеобразным стулом три или более раз в сутки и болью в животе.
- ПМК тяжёлого течения. Сопровождается водянистой диареей с кровью и изменениями в анализах. В биохимическом анализе крови отмечается низкий уровень альбумина (меньше 30 г/л), который сочетается с одним из следующих признаков: высоким уровнем лейкоцитов в клиническом анализе крови (> 15×10 9 /л) в клиническом анализе крови и/или болезненностью при ощупывании живота.
- Осложнённые формы ПМК. Протекают с водянистой диареей с кровью и одним из следующих симптомов: снижение артериального давления, температура тела ≥ 38,5 °C, отсутствие перистальтики тонкого кишечника, помрачение или угнетение сознания. В клиническом анализе крови лейкоциты повышены > 25×10 9 /л или снижены < 2×10 9 /л, возникает органная и почечная недостаточность, требуется искусственная вентиляция лёгких.
- Рецидивирующее течение ПМК. Заболевание развивается повторно менее чем через 8 недель после окончания терапии [1][14] .
Данная классификация используется для выбора схемы лечения.
Осложнения псевдомембранозного колита
Наиболее частые осложнения псевдомембранозного колита:
- Обезвоживание и электролитные нарушения — из-за сильной и длительной диареи нарушается ритм сердца, снижается артериальное давление и мышечный тонус. Чаще эти осложнения развиваются при недостаточном восполнении потерянной жидкости и солей.
- Почечная недостаточность — при стремительном обезвоживании нарушается работа почек, из-за чего снижается частота мочеиспусканий, появляются отёки, по анализам крови видно, что растёт содержание азотистых шлаков.
- Токсический мегаколон — расширение толстой кишки, редкое осложнение с плохим прогнозом. На фоне диареи частота стула резко урежается до одного раза в сутки, в дальнейшем дефекация прекращается полностью. Это происходит из-за замедления и полного прекращения перистальтики толстого кишечника. Из-за распирания толстого кишечника газами и содержимым нарастает вздутие живота, усиливается боль в нём. Интоксикация и электролитные нарушения приводят к резкому ухудшению самочувствия и выраженной слабости. В дальнейшем стенка кишки разрывается, содержимое изливается в брюшную полость (перфорация кишечника) и начинается перитонит. Как правило, это осложнение наблюдается у ослабленных пациентов, находящихся в отделении реанимации и хирургии.
- Перфорация кишечной стенки — образуется сквозное отверстие в кишечной стенке с излитием содержимого кишечника в брюшную полость и развитием перитонита.
- Полиорганная недостаточность — может привести к гибели пациента [1][15] .
Диагностика псевдомембранозного колита
Тесты на C. diff показаны при длительной диарее с болью в животе и/или примесью крови в стуле, возникшей спустя 3–60 суток после выписки из стационара и/или после приёма антибиотиков [1] .
Чтобы выявить токсигенные штаммы C. diff, токсины A и B определяют в кале [16] .
Для этого используют следующие методы:
- Цитотоксиновый копрологический тест. Чувствительность — 95 %, специфичность — 99 %, результат — в течение 2–3 дней.
- ELISA (Enzyme Linked Immuno Sorbent Assay) — фермент-связанный иммуносорбентный тест для определения токсинов. Чувствительность — 70–90 %, специфичность — 99 %, результат — через 4–6 часов.
- ПЦР (полимеразная цепная реакция) на токсин В. Чувствительность — 96 %, специфичность — 100 %, результат — в течение нескольких часов.
Чувствительность теста — это доля положительных результатов среди больных людей, т. е. вероятность правильно определить инфекцию у заболевших, отсутствие ложноотрицательных результатов. Специфичность — доля отрицательных результатов среди здоровых людей, т. е. отсутствие ложноположительных результатов.
Посев кала на C.diff не проводится, так как этим методом не удаётся определить токсигенные штаммы.
С помощью дополнительных методов можно оценить тяжесть состояния пациента и своевременно выявить осложнения.
К дополнительным обследованиям относятся:
- ректороманоскопия или сигмоидоскопия — позволяют обнаружить типичные изменения стенки кишки (множественные желтоватые бляшки 2–10 мм в диаметре, плотно фиксированные на поверхности слизистой оболочки);
- колоноскопия — помимо типичных изменений кишечной стенки, определяется распространённость процесса и поражение толстого кишечника выше сигмовидной кишки [17] ;
- обзорная рентгенография органов брюшной полости — используется, чтобы выявить признаки пареза кишечника и токсического расширения кишки;
- анализ крови — показывает уровень лейкоцитов (при ПМК повышен до 10–50 × 10 9 ), уровень креатинина (выше нормы) и альбумина (ниже нормы).
Гистологическое исследование биоптатов не является необходимым при C. difficile-ассоциированной болезни, но может быть крайне важным для дифференциальной диагностики.
Лечение псевдомембранозного колита
Методы лечения псевдомембранозного колита в российских и зарубежных клинических рекомендациях совпадают [1] [18] . При лёгком и среднетяжёлом течении его проводят в амбулаторных условиях (дома), при тяжёлом и/или осложнённом — в стационаре.
Для лечения ПМК назначаются антибиотики:
Антибиотики подавляют развитие C. diff. Бактерия чувствительна только к трём перечисленным антибактериальным препаратам.
При развитии осложнений ПМК могут применяться следующие методы:
- При токсическом мегаколоне показана колэктомия — удаление толстой кишки.
- Для лечения рецидивирующего ПМК в качестве экспериментального метода рассматривается трансплантация кишечной микробиоты (fecal microbiota transplantation, FMT) [23][24][25] . Кишечную микробиоту берут от здорового донора и при помощи назоинтестинального зонда, клизмы или колоноскопии переносят пациенту в кишечник. В России такое лечение считается экспериментальным. Проводится в научных клинических учреждениях, например в Федеральном научно-клиническом центре ФМБА России.

В качестве вспомогательных и симптоматических препаратов используются:
- Сорбенты (Диоктаэдрический смектит) — эффективно удаляет токсины C. diff, снижая их действие на кишечную стенку, улучшает качество стула.
- Пробиотики (Lactobacillus rhamnosus, Bifidobacterium longum, Bifidobacterium bifidum, Bifidobacterium infantis не менее 1×10 9 КОЕ/г) — подавляют активность C. diff. Данные об их эффективности пока противоречивы [22] .
- Препараты на основе дрожжей Saccharomyces cerevisiae (boulardii) — эффективны как вспомогательные и профилактические средства.
Прогноз. Профилактика
При лёгком или среднетяжёлом течении ПМК и хорошей реакции на стандартную терапию прогноз благоприятный, при тяжёлом и осложнённом — неблагоприятный. При рецидивирующем течении прогноз сомнительный, так как не разработаны эффективные схемы лечения.
Профилактика псевдомембранозного колита
Для профилактики развития ПМК следует:
- чаще мыть руки и соблюдать правила личной гигиены;
- рационально принимать антибиотики — строго по назначению врача с соблюдением всех указаний;
- изолировать пациентов с инфекцией C. diff в отдельные палаты, соблюдать меры санитарного режима;
- тщательно обрабатывать все поверхности хлорсодержащими или другими дезинфицирующими средствами, активными против спор C. diff;
- сокращать сроки госпитализации пациентов старше 65 лет [16] .
Чтобы предотвратить рецидив C. difficile-ассоциированной болезни, после завершения лечения Метронидазолом или Ванкомицином назначаются пробиотики курсом не менее трёх месяцев. Серьёзных побочных эффектов от них не выявлено [34] .
Читайте также:

