Дифтерия коклюш туберкулез микробиология
Обновлено: 23.04.2024
1. Микробиология возбудителей дифтерии, туберкулёза и проказы.
2. План лекции
Клинически значимые представители коринебактерий.
Возбудитель дифтерии. Таксономическое положение. Морфологические,
тинкториальные и культурально-биохимические свойства.
3.
Факторы патогенности Corynebacterium diphtheriae. Эпидемиология, патогенез и
клиническая картина дифтерии.
4.
Микробиологическая диагностика. Лечение и профилактика.
5.
Возбудители туберкулёза. Таксономическое положение. Морфологические,
тинкториальные и культурально-биохимические свойства.
6.
Факторы патогенности возбудителей туберкулёза.
7. Эпидемиология, патогенез и клиническая картина туберкулёза.
8.
Микробиологическая диагностика. Туберкулинодиагностика.
9.
Лечение и профилактика туберкулёза.
10. Проказа. Морфологические, биохимические свойства возбудителя. Клинические
проявления, патогенез, лабораторная диагностика, профилактика и лечение.
1.
2.
3. Клинически наиболее значимые коринебактерии, в патологии человека
Виды рода Corynebacterium
Болезнь
С.diphtheriae
Дифтерия
C.ulcerans *
Ангина у иммунодефицитных лиц
C.jeikeium (группа JK)
C.urealyticum (группа D2)
C.minutissimum
C.хerosis
C.pseudodiphtheriticum
C.stratum
Arcanobacterium (ранее
Corynebacterium) haenolyticum
Септицемия, инфекции мягких тканей
Инфекции мочевого тракта (пиелонефрит, цистит и др.
оппортунистические инфекции)
Эритразма, оппортунистические инфекции
Оппортунистические инфекции
Эндокардит, оппортунистические инфекции
Оппортунистические инфекции
Хронические тонзиллиты, поражение кожи
* С.ulcerans – вид мелких палочковидных грамположительных бактерий рода Corynebacterium.
4. РОД CORYNEBACTERIUM
Патогенные
ВИДЫ
БИОВАРЫ
Условно-патогенные
Непатогенные
С.hofmanii
• С.diphtheriae С.ulcerans
C.cistitidis
C.xerosis
C.haemolyticus C.vaginale
gravis
mitis
intermedius
5. Род Corynebacterium Вид Corynebacterium diphtheriae
Морфология
располагаются в виде V;
неподвижны;
клеточная стенка содержит миколовую
кислоту, корд-фактор;
при окраске по Леффлеру и Нейссеру
эксцентрически визуализируются зёрна
волютина.
C.diphtheriae окраска по Граму
C.diphtheriae окраска по Леффлеру
C.diphtheriae окраска по Нейссеру
6. Культуральные свойства
факультативные анаэробы;
растут на средах с кровью и сывороткой;
на кровяном теллуритовом агаре
образуют колонии двух типов;
по характеру колоний, биохимическим
свойствам и способности продуцировать
гемолизин выделяют три биовара: gravis,
mitis, intermedius
ДИФТЕРИЯ ( ПАТОГЕНЕЗ )
BL
ФАКТОРЫ
КОЛОНИЗАЦИИ
• Нейраминидаза
Бактериоцины
Адгезины
Fc-связывающие
белки
ФАКТОРЫ
ЗАЩИТЫ И АГРЕССИИ
Гиалуронидаза
Нейраминидаза
Корд-фактор,
липиды
ВХОДНЫЕ ВОРОТА ИНФЕКЦИИ
ТОКСИНЫ
Гемолизин
Экзотоксин –
гистотоксин
(некротоксин))
ТОКСИНЕМИЯ
Коагуляционный некроз слизистой оболочки
Фибринозное воспаление
Сердце
Периферические
нервы
Надпочечники
9. Факторы вирулентности Corynebacterium diphtheriae
Факторы вирулентности
Биологический эффект
Белковый экзотоксин
(гистотоксин) состоит из А- и Всубъединиц
Нарушает синтез белка, поражая
клетки миокарда, надпочечников,
нервных ганглиев
Гликолипид (6-6” – диэфиртрегалозы)
Нарушает фагоцитоз
Гиалуронидаза
Нейраминидаза
Нарушают проницаемость ткани
10. Клинические проявления Дифтерия зева
12. Дифтерия. Микробиологическая диагностика.
Экспресс-метод
Окраска
метиленовым синим
(по Леффлеру),
Нейссеру)
Бактериологический метод
Пленка, отделяемое
носоглотки, глаз, ушей,
уретры, раны и др.
Среда накопления
Окраска
метиленовым
синим
(по Леффлеру),
кристалл-виолетом
(по Граму)
Кровяно-теллуритовые среды, Клауберга,
среда Бучина, и др.
МБС
Чистая культура
Ферментативные свойства,
пробы Пизу, Закса
Антибиотикограм
ма
ИД на
токсигенность
Фаговары
13. Лабораторная диагностика дифтерии
Клинический материал: мазок из зева, слизь из носоглотки и др.
Методы:
бактериоскопический (окраска мазка по Леффлеру и Нейссеру –
предварительный);
бактериологический (культуральный) – основной:
1 этап: посев клинического материала на кровяной теллуритовый агар
(среда Клауберга).
2 этап: макроскопическое изучение колоний, мазок по Леффлеру или Нейссеру;
3 этап: идентификация по совокупности свойств: культуральных,
морфологических, тинкториальных, биохимических, токсигенности (методом
Оухтерлони), и чувствительности к антибиотикам.
серологический (ИФА, латексагглютинация, реакция нейтрализации антител,
РНГА) для обнаружения антител и/или токсина в сыворотке крови;
проба Шика – реакция нейтрализации токсина in vivo.
14. Двойная диффузия в геле по Оухтерлони
ДИФТЕРИЯ ( ИММУНИТЕТ )
АНТИТОКСИЧЕСКИЙ
АНТИБАКТЕРИАЛЬНЫЙ
АТ ≥ 0,1 АЕ/МЛ
Местный
Больной
Бактерионоситель
Здоровый
Антитоксический
-
+
+
Антибактериальный
-
-
+
Иммунитет
Специфическая профилактика
Действующее начало всех вакцин – дифтерийный
анатоксин (дифтерийный гистотоксин, утративший
токсичность):
АКДС – адсорбированная коклюшно-дифтерийно-столбнячная
вакцина
АД – адсорбированный дифтерийный анатоксин
АДС – адсорбированный дифтерийно-столбнячный анатоксин
АДС-М анатоксин -вакцина для профилактики дифтерии и
столбняка с уменьшенным содержанием антигенов
Имовакс Д.Т. Адюльт вакцина для профилактики дифтерии
и столбняка, аналог АДС-М (Aventis Pasteur, Франция)
ДТ Вакс вакцина для профилактики дифтерии и столбняка,
аналог АДС
(Aventis Pasteur, Франция)
18. Микробиология туберкулёза
Туберкулёз-социальная болезнь
БЕДНЫЕ
100-199 на
100 000
Россия 58 на
100 000
FREQUENCY
БОГАТЫЕ
1-9 на
MORBIDITY
100.000
ЧАСТОТА
ЗАБОЛЕВАЕМОСТИ
Заключённые
Злоупотребление
алкоголя
21. Особенности некоторых нетуберкулезных бактерий
22. МИКОБАКТЕРИИ, ПАТОГЕННЫЕ ДЛЯ ЧЕЛОВЕКА
Вид
M.tuberculosis
M.bovis (africanum)
M.kansasii
M.avium - intracellulare
M.ulcerans
M.leprae
Резервуар
Патогенность
для человека
Основные
поражения
человек
+++
туберкулез
животные
+++
туберкулез
внешняя среда
+
туберкулезоподобные
поражения
птицы
+
туберкулезоподобные
поражения
внешняя среда
+
кожные язвы
человек
+++
проказа
Микобактерии – сапрофиты: M.phlei, M.smegmatis
24. ХИМИЧЕСКИЙ СОСТАВ И ВИРУЛЕНТНОСТЬ БК
ВИД
ШТАММЫ
%
ЛИПОПОЛИСА
ХАРИДОВ
%
МИКОЛОВОЙ
КИСЛОТЫ
ВИРУЛЕНТНЫЙ
7,6
80
АВИРУЛЕНТНЫЙ
0,56
0
MYCOBACTERIUM
TUBERCULOSIS
КОРД-ФАКТОР: ГЛИКОЛИПИД, ФАКТОР ВИРУЛЕНТНОСТИ
25. Свойства М.tuberculosis, связанные с липидами
Отдел
Порядок
Семейство
Род
Firmicutes
Actinomycetales
Mycobacteriaceae
Mycobacterium
Вид Mycobacterium tuberculosis
Mycobacterium tuberculosis
Mycobacterium bovis
Mycobacterium africanum
Морфология
27. Морфология
грамположительные тонкие прямые
или слегка изогнутые палочки;
клеточная стенка содержит большое
количество восков и липидов (миколовую
кислоту), что обусловливает
гидрофобность, устойчивость к кислотам,
щелочам, спиртам;
окрашиваются по Цилю-Нильсену;
неподвижны, спор и капсул не
образует;
возможен переход в L-формы
Mycobacterium tuberculosis (красные
палочки) в мокроте. Окраска по
Цилю-Нильсену.
28. Mycobacterium tuberculosis внутри клеток легкого. Окраска по Цилю-Нильсену
29. Культуральные и биохимические свойства
Среда Левенштейна-Йенсена и
рост микобактерий
аэробы;
селективной является яичная среда
Левенштейна-Йенсена и синтетическая
среда Сотона;
растут медленно (через 2-3 недели и
позднее);
колонии сухие, морщинистые, сероватые;
биохимически активны - ниациновая
проба Конно (накопление в жидкой среде
никотиновой кислоты);
дифференциация М. tuberculosis от М.
bovis по способности редуцировать
нитраты (положительный
нитратредуктазный тест).
30. Патогенность М.tuberculosis
Факторы
Колонизации
Адгезины (гликолипиды,
липоарабиноманнан)
Бактериоцины
Персистенции
АЛА (L-формы)
Продукция аммония
Каталаза, пероксидаза
Сульфатиды
Сидорофоры
Вирулентности
Корд-фактор (гликолипиды,
миколовые кислоты)
Туберкулопротеин (эндотоксин,
аллерген)
32. ЭПИДЕМИОЛОГИЯ ТУБЕРКУЛЕЗА
МЕХАНИЗМЫ
ИСТОЧНИКИ
ВОСПРИИМЧИВОСТЬ
ЛЮДЕЙ
ПУТИ ПЕРЕДАЧИ
Воздушно-капельный
БОЛЬНОЙ
АКТИВНОЙ
ФОРМОЙ
Воздушно-пылевой
Контактно-бытовой
ДЕТИ
ПОЖИЛЫЕ
СТРАДАЮЩИЕ
БОЛЬНЫЕ
ЖИВОТНЫЕ
(крупный
рогатый скот)
ИММУНОДЕФ
Пищевой
ИЦИТОМ
ФОРМЫ ТУБЕРКУЛЕЗНОЙ ИНФЕКЦИИ
ПЕРВИЧНЫЙ
ТУБЕРКУЛЕЗ
(БОЛЕЗНЬ)
СКРЫТАЯ
ИНФЕКЦИЯ
ОЧАГ
ГОНА
Очаговый
Гематогенный
Эндогенный
Хронический
Бессимптомный
(БОЛЕЗНЬ
ВТОРИЧНЫЙ
ТУБЕРКУЛЕЗ)
Экзогенный
34. Патогенез туберкулёза
М.tuberculosis
Гликолипиды
Повреждение, активация макрофагов
Неспецифическая (доиммунная) гранулема
Иммунный ответ (аллергия), туберкулопротеины
Специфическая (постиммунная) гранулема
Репарация
Массивный некроз,
диссеминация
Фиброз,кальцификация
персистенция
М.tuberculosis
Гиперергия
Очаг Гона
Скрытая инфекция
Первичный
туберкулез
Вторичный
туберкулез
Очаговый
гематогенный
Бессимптомный
Хронический
Реинфекция
35. Структура туберкулезной гранулемы
Экспресс-метод
Гомогенизация флотация мокроты
Окраска по
Цилю-Нильсену
Люминесцентная
микроскопия
РИФ
Бактериологический метод
Мокрота, моча, СМЖ, гной,
менструальная кровь, промывные воды бронхов, пунктаты тканей и полостей,
секционный материал и др.
Выделение L-форм
10% Na3PO4
3-4% H2SO4
5-10% H2SO4
Антибиотикограмма
3-4% H2SO4
Морская свинка
(потеря веса)
Полужидкие среды
Школьниковой и др.
Яичные среды: среда
Левенштейна-Иенсена и др.
Посев на стекле в кровяную
среду по Прайсу
СМ
Окраска
по ЦилюНильсену
Ферментативные свойства
Биологический метод
Элективные среды
Ферментативные свойства
Туберкулин
ФПС
Метод выявления гиперчувствительности
Туберкулин (проба Манту)
Антибиотикограмма
Лабораторная диагностика
1. Экспресс-методы: молекулярно-генетический метод (ПЦР), РИФ.
2. Бактериологический метод.
3. Серологический метод (РСК, ИФА, радиоимунный и др.).
4. Биологический метод (заражение морских свинок или кролика с
последующим выделением чистой культуры возбудителя).
5. Туберкулинодиагностика (проба Манту).
39. Лабораторная диагностика
Клинический материал: гной, мокрота, кровь, бронхиальный
экссудат, спиномозговая жидкость и пр.
Методы:
1.
Бактериоскопический : прямая окраска мазка мокроты по методу
Циля-Нильсена или мазка после обогащения (концентрирования
методами флотации или гомогенизации)
Прямая окразка мазка мокроты по
Мазок из флотационного слоя по
Цилю-Нильсену
Цилю-Нильсену
40. Лабораторная диагностика
Метод микрокультур Прайса
(густой мазок мокроты на стекле обрабатывают
кислотой, не фиксируют и помещают в сыворотку;
через 5-7 дней окрашивают по Цилю-Нильсену;
при наличии корд-фактора видны слипшиеся в жгуты
микобактерии)
Люминесцентный метод
(окраска родамин-ауромином)
Диаскинтест
Аллерген туберкулезный рекомбинантный.
Представлен рекомбинантным белком, продуцируемый генетически
модифицированной культурой Escherichia coliВL21.
43. СПЕЦИФИЧЕСКАЯ ПЛАНОВАЯ ПРОФИЛАКТИКА ТУБЕРКУЛЕЗА И ДИФТЕРИИ
44. Лепра (проказа)
C. diphtheriae - палочковидные бактерии; вызывают дифтерию (греч. diphtheria - кожа, пленка) - острую инфекцию, характеризующуюся фибринозным воспалением в зеве, гортани, реже в других органах, и явлениями интоксикации.
Морфологические и культуральные свойства.
Corinebacterium diphteriae – тонкие, слегка изогнутые или прямые грамположительные палочки, расположенные под углом друг к другу в виде римских пятерок. Они утолщены на концах за счет наличия зерен валютина на одном или обоих полюсах клетки. Зерна валютина состоят из полифосфатов, они воспринимают анилиновые красители более интенсивно, чем цитоплазма клетки и легко выявляются при окраске по Нейссеру в виде гранул сине-черного цвета, тогда как тела бактерий – окрашивается в желто-зеленый. При окраске по Граму зерна валютина не выявляются.


Рисунок мазка из чистой культуры. Окраска по Нейссеру Мазок из чистой культуры.
Окраска щелочной синькой Леффлера
Дифтерийная палочка не обладает кислотоустойчивостью, неподвижна, спор не образует, имеет микрокапсулу с входящим в ее состав корд-фактором. В состав клеточной стенки входят галактоза, манноза, арабиноза, а также большое количество липидов, в том числе некислотоустойчивые миколовые кислоты.
Возбудитель дифтерии – факультативный анаэроб, гетеротроф, растет при 37 о С на сложных питательных средах: свернутая кровяная сыворотка, кровяной теллуритовый агар.
На теллуритовых средах возбудитель дифтерии через 24-48 час образует черные или черно-серые колонии в результате восстановления теллурита до металлического теллура.
Возбудитель дифтерии обладает высокой ферментативной активностью. Дифференциально-диагностическими признаками C. diphteriae являются:
отсутствие способности ферментировать сахарозу и разлагать мочевину,
способность продуцировать фермент цистиназу.
Возбудитель дифтерии не однороден по культуральным и биохимическим свойствам. В соответствии с рекомендациями Европейского регионального бюро ВОЗ вид C. diphteriae подразделяют на 4 биовара: gravis, mitis, intermedius, belfanti.
На теллуритовой среде биовар gravis образует сухие, матовые, крупные, плоские, серовато-черные колонии, приподнятые в центре. Периферия колонии светлая с радиальной исчерченностью и неровным краем. Такие колонии напоминают цветок маргаритку. Биовар mitis образует мелкие, гладкие, блестящие, черные, выпуклые колонии с ровным краем, окруженные зоной гемолиза. Биовары intermedius и belfanti фактически относятся к биовару mitis, так как не разлагают крахмал, а этот признак у C. diphteriae является наиболее стабильным.
Антигенная структура. C. diphteriae имеют О-антиген (липидные и полисахаридные фракции, расположенные в глубине клеточной стенки) и К-антиген (поверхностный термолабильный белок). О-антиген является межвидовым. На основании К-антигена различают около 58 сероваров.
Факторы патогенности. Основными факторами патогенности C. diphteriae являются поверхностные структуры, ферменты и токсины.
Поверхностные структуры (пили, компоненты микрокапсулы: корд-фактор, К-антиген, миколовые кислоты) имеют белковую и липидную природу, способствуют адгезии микробов в месте входных ворот, препятствуют фагоцитозу бактерий, оказывают токсическое воздействие на клетки макроорганизма, разрушают митохондрии.
Ферменты патогенности: нейраминидаза, гиалуронидаза, гемолизин, дермонекротоксин. Нейраминидаза отщепляет N-ацетилнейраминовую кислоту от гликопротеидов слизи и поверхности клеток, лиаза расщепляет ее на пируват и N-ацетилманнозамин, а пируват стимулирует рост бактерий. В результате действия гиалуронидазы повышается проницаемость кровеносных сосудов и выход плазмы за их пределы, что ведет к отеку окружающих тканей. Дермонекротоксин вызывает некроз клеток в месте локализации возбудителя. Вышедший за пределы сосудов фибриноген плазмы контактирует с тромбокиназой некротизированных клеток организма и превращается в фибрин, что и является сущностью дифтерийного воспаления. Внутри дифтерийной пленки C. diphteriae находят защиту от эффекторов иммунной системы и антибиотиков, размножаясь, они образуют в большом количестве основной фактор патогенности - дифтерийный гистотоксин.
Дифтерийный гистотоксин оказывает блокирующее действие на синтез белка в органах, наиболее интенсивно снабженных кровью: сердечно-сосудистая система, миокард, нервная система, почки и надпочечники.
Эпидемиология. В естественных условиях дифтерией болеет только человек, не обладающий устойчивостью к возбудителю и антитоксическим иммунитетом. Заболевание распространено повсеместно. Наибольшее количество больных наблюдается во второй половине сентября, октябре и ноябре. Наиболее восприимчивы дети дошкольного и младшего школьного возраста. Среди взрослых к группе повышенного риска относятся работники общественного питания и торговли, школ, детских дошкольных и медицинских учреждений.
C. diphteriae обладает устойчивостью к факторам окружающей среды: в капельках слюны, прилипших к посуде или игрушкам, на ручках дверей они могут сохраняться до 15 дней, на предметах окружающей среды – 5,5 мес., могут размножаться в молоке. При кипячении C. diphteriae погибают в течение 1 мин, в 10% растворе перекиси водорода – через 3 мин, в 5% растворе карболовой кислоты и 50-60% спирте – через 1 мин.
Дифтерийный гистотоксин очень неустойчив и быстро разрушается при действии света, нагревании, окислении.
Источником инфекции являются:
1.носители токсигенных штаммов - особенно опасны те носители, у которых нет клинических проявлений заболевания, так как они обладают антитоксическим иммунитетом.
2.больные: Среди больных наибольшее значение имеют лица с локализацией процесса в верхних дыхательных путях. Больной эпидемиологически опасен в течение всего периода болезни, даже в период выздоровления он выделяет токсигенные штаммы в окружающую среду.
Основным механизмом заражения является аэрозольный. Пути передачи:
ведущая роль принадлежит воздушно-капельному,
иногда могут осуществляться воздушно-пылевой, контактно-бытовой, а также алиментарный (через молоко) пути передачи.
Наиболее часто встречается дифтерия зева (90-95%). Инкубационный период длится от 2 до 10 дней. По патогенезу дифтерия относится к токсинемическим инфекциям, когда микроб остается в месте входных ворот инфекции, а все клинические проявления связаны с действием экзотоксина.
Начальным этапом инфекционного процесса является адгезия микроба в месте входных ворот. Размножаясь там, микроб выделяет гистотоксин, который оказывает местное действие на клетки тканей, а также поступает в кровь, что ведет к возникновению токсинемии.
В области входных ворот развивается воспалительная реакция, которая сопровождается некрозом эпителиальных клеток и отеком, образуется налет белого цвета с сероватым или желтоватым оттенком, содержащим большое количество микробов, продуцирующих токсин.
Характерным признаком дифтерии является фибринозная пленка:
Если слизистая оболочка образована однослойным эпителием (гортань, трахея, бронхи), возникает крупозное воспаление, здесь пленка располагается поверхностно и легко отделяется от подлежащих тканей.
Если слизистая оболочка образована многослойным эпителием (ротоглотка, надгортанник, голосовые связки), возникает дифтерическое воспаление, когда все клетки прочно связаны между собой и с подлежащей соединительнотканной основой. Фибринозная пленка в этом случае плотно спаяна с подлежащими тканями и не снимается тампоном. При попытке сделать это слизистая оболочка кровоточит.
Иммунитет. После перенесенного заболевания формируется стойкий и напряженный гуморальный антитоксический иммунитет. Продолжительность поствакцинального иммунитета – 3-5 лет.
Микробиологическая диагностика.
Материалом для исследования является фибринозная пленка, слизь из зева или носа.
Сбор материала необходимо проводить в течение 3-4 ч (не позднее 12 ч) с момента обращения больного. Для взятия материала используют сухие ватные тампоны, если посев будет произведен в течение 2-3 ч, при транспортировке материала тампоны смачивают 5% раствором глицерина.
Методы диагностики:
Основным методом диагностики является бактериологический. Бактериологическая лаборатория через 48 ч должна дать ответ о наличии или отсутствии C. diphteriae в анализах.
Материал засевают на питательную среду. Отбирают подозрительные колонии и выделенную культуру идентифицируют:
По наличию цистиназы (проба Пизу): в столбик питательного агара с цистином уколом засевают исследуемую культуру. Посевы инкубируют при 37 о С 24 ч. C. diphteriae вызывает почернение среды по ходу укола в результате образования сульфида свинца.
По наличию уреазы (проба Закса): готовят спиртовый раствор мочевины и раствор индикатора – фенолового красного, которые перед употреблением смешивают в соотношении 1:9 и разливают в агглютинационные пробирки. Исследуемые бактерии вносят петлей и растирают по стенке прибирки. В положительном случае через 20-30 мин инкубации при 37 о С среда приобретает красный цвет в результате расщепления мочевины уреазой.
Для определения токсигенности возбудителя дифтерии может быть использована биопроба. Морской свинке внутрикожно или подкожно вводят испытуемую культуру. Токсигенные культуры убивают животных в течение 3-5 суток, при вскрытии обнаруживаются гиперемированные надпочечники, а при внутрикожном заражении – некроз кожи.
Для бактериоскопического исследования (как самостоятельный диагностический метод применяется редко ввиду полиморфизма возбудителя, но может быть проведен по просьбе врача) из материала готовят мазки на нескольких стеклах, один мазок окрашивают по Граму, другой по Нейссеру, третий – обрабатывают флюорохромом – корифосфином для люминесцентной микроскопии.
О наличии антитоксического иммунитета судят по реакции Шика – реакции нейтрализации токсина антитоксином. В кожу предплечья вводят 1/40 DLM дифтерийного токсина. Покраснение и припухлость в месте введения свидетельствует об отсутствии антитоксинов в крови. Отрицательная реакция Шика говорит о наличии антитоксинов.
Для ускоренного обнаружения дифтерийного токсина, как в бактериальных культурах, так и в сыворотке крови, применяют: РНГА с антительным эритроцитарным диагностикумом, РИА и ИФА. Из молекулярно-генетических методов исследования применяют ПЦР.
Препараты для специфического лечения дифтерии.
В целях нейтрализации дифтерийного гистотоксина применяют специфическую противодифтерийную лошадиную очищенную концентрированную сыворотку, которую получают путем гипериммунизации лошадей дифтерийным антитоксином.
Специфическое лечение противодифтерийной сывороткой начинают немедленно при клиническом подозрении на дифтерию. Необходимо выбрать оптимальный режим введения сыворотки, так как антитоксин может нейтрализовать только не связанный с тканями токсин. Для профилактики развития анафилактического шока сыворотку вводят дробно по А.М. Безредке. Введение сыворотки позднее 3-го дня болезни нецелесообразно.
Разработан противодифтерийный иммуноглобулин человека для внутривенного введения. Его применение дает меньше побочных реакций.
Для подавления размножения C. diphteriae в месте входных ворот обязательно назначают антибиотики. Препаратами выбора являются пенициллин или эритромицин, либо другие β-лактамы и макролиды.
Препараты для специфической профилактики дифтерии.
Для создания искусственного активного антитоксического иммунитета применяют дифтерийный анатоксин. Очищенный и концентрированный препарат входит в состав ассоциированных вакцин:
1. адсорбированной коклюшно-дифтерийно-столбнячной вакцины (АКДС-вакцина),
2. адсорбированного дифтерийно-столбнячного анатоксина (АДС-анатоксин),
3. адсорбированного дифтерийно-столбнячного анатоксина с уменьшенным содержанием антигенов (АДС-М),
4. адсорбированного дифтерийного анатоксина с уменьшенным содержанием антигена (АД-М).
Базисный иммунитет создается у детей согласно календарю прививок. Только 95% охват населения прививками гарантирует эффективность вакцинации.
Возбудитель туберкулеза, его основные свойства, патогенез, лечение и профилактика туберкулеза. Методы микробиологической диагностики туберкулеза.
Возбудители дифтерии, их свойства, отличия от дифтероидов и ложнодифтерийных бактерий. Патогенез, лечение, профилактика и микробиологическая диагностика дифтерии.
Возбудители коклюша, их свойства. Патогенез, лечение, профилактика и микробиологическая диагностика коклюша.
Теоретический материал для самоподготовки
Вопрос 1. Микобактерии туберкулеза
Туберкулез – первично хроническое заболевание человека и животных, сопровождающееся поражением различных органов и систем (органов дыхания, лимфатических узлов, кишечника, костей, суставов, глаз, кожи, почек и мочевыводящих путей, половых органов, ЦНС).
Возбудители туберкулеза относятся к семейству Mycobacteriaceae, роду – Mycobacterium. Заболевание вызывается 3 видами:
M. tuberculosis – человеческий вид (в 92% случаев),
M. вovis – бычий вид (в 5% случаев),
M. аfricanum – промежуточный вид (в 3% случаев).
Морфологические и культуральные свойства.
- прямые или изогнутые палочки,
- грамположительны (но из-за большого содержания липидов в клеточной стенке плохо воспринимают красители),
- чаще применяют окраску по Цилю–Нильсену, при этом микобактерии обнаруживаются в препаратах в виде ярко-красных кислотоустойчивых палочек, расположенных поодиночке или небольшими скоплениями.
- спор не образуют,
- в состав клеточной стенки входят миколовая, фтионовая, туберкулостеариновая и другие жирные кислоты.
Родовой признак микобактерий – кислото-, спирто- и щелочеустойчивость.

Рис.Туберкулезные палочки в чистой культуре (рисунок)


Рис. Мазок из чистой культуры M. вovis Рис. M.tuberculosis в мазке
(окраска по Цилю-Нильсену) из мокроты (окраска по Цилю-Нельсену)
Растут на сложных питательных средах, содержащих яйца, глицерин, картофель, аспарагин, витамины, соли. Для подавления токсического действия образуемых в процессе метаболизма жирных кислот к средам добавляют активированный уголь или сыворотки животных, для подавления роста сопутствующей микрофлоры – красители (малахитовый зеленый) и антибиотики, не действующие на микобактерии. Элективной средой является среда Левенштейна–Йенсена.


Рис. Корд-фактор M.tuberculosis: палочки, Рис. Незавершенный фагоцитоз микобактерий
расположены в виде "косы", жгутов (окраска по Цилю-Нильсену)
Биохимические признаки.
В отличие от условно-патогенных микобактерий, M. tuberculosis и M. bovis в большом количестве образуют никотиновую кислоту (ниацин), которая накапливается в жидкой питательной среде.
В отличие от M. bovis, M. tuberculosis обладают способностью редуцировать нитраты в нитриты.
Факторы патогенности.
К факторам патогенности микобактерий относятся компоненты клеточной стенки бактерий: туберкулопротеины, липиды и их комплексы.
- Туберкулопротеины являются основными носителями антигенных свойств микобактерий, они – высокотоксичны и вызывают развитие гиперчувствительности 4-го типа.
- Липиды (миколовая и фтионовая кислоты, корд-фактор) вызывают развитие гранулем, подавляют активность фагоцитарных клеток.
- Корд-фактор – это гликолипид, состоящий из трегалозы и димиколата. Он разрушает митохондрии клеток инфицированного организма, чем нарушает функцию дыхания.
Экзотоксины микобактерии не образуют.
Устойчивость в окружающей среде.
В естественных условиях при отсутствии солнечного света жизнеспособность микобактерий сохраняется в течение нескольких месяцев, при рассеянном свете – погибают через 1-1,5 мес.
В уличной грязи они сохраняются до 4 мес., в речной воде – до 7 мес., в сточной воде – до 15 мес., в навозе – до 2-х лет.
При кипячении они погибают через 5 мин, при пастеризации – в течение 30 мин, под воздействием ультрафиолетовых лучей – через 2-3 мин.
Возбудители туберкулеза устойчивы к действию дезинфицирующих веществ. Для дезинфекции используются активированные растворы хлорамина и хлорной извести, вызывающие гибель бактерий в течение 3-5 ч.
Источники инфекции:
1.Основной - больной туберкулезом органов дыхания человек, выделяющий микробы в окружающую среду с мокротой.
2. Второстепенную роль играют больные сельскохозяйственные животные (крупный рогатый скот, верблюды, свиньи, козы, овцы) и люди, страдающие внелегочными формами туберкулеза (пищеварительного тракта или урогенитальной системы) и выделяющие микробактерии с мочой и калом.
Пути передачи:
Реже заражение туберкулезом может происходить пищевым путем при употреблении термически не обработанных мясных или молочных продуктов, что особенно характерно для заболеваний, вызванных M. bovis, чаще поражающих детей.
Возможен контактный путь передачи инфекции от больных туберкулезом через поврежденные кожные покровы и слизистые оболочки при использовании инфицированной одежды больных, игрушек, книг, посуды. Известны случаи заражения людей при уходе за больными животными. Описаны редкие случаи заражения хирургов, паталогоанатомов, мясников.
Возможен и трансплацентарный путь передачи, но он, как правило, не реализуется вследствие тромбоза кровеносных сосудов плаценты в местах поражения. Внутриутробное заражение плода может происходить не только через пупочную вену и плаценту, но и при заглатывании амниотической жидкости, содержащей микобактерии.
Организм человека обладает высокой устойчивостью к действию патогенных микобактерий, поэтому большое значение для возникновения заболевания имеют длительность контакта с источником инфекции, массивность инфицирования, вирулентность микобактерий и снижение резистентности макроорганизма.
Инкубационный период длится от 3-8 недель до 1 года и более (40 лет). Возбудитель в течение длительного времени сохраняется в фагоцитирующих клетках региональных лимфатических узлов.
В развитии заболевания выделяют первичный туберкулез, диссеминированный и вторичный.
Первичный туберкулез возникает у ранее неинфицированных людей и характеризуется выраженными токсикоаллергическими осложнениями и некротическими изменениями в тканях, возникающими на фоне высокой чувствительности макроорганизма к возбудителям туберкулеза. Для него характерна гематогенная диссеминация.
В зоне проникновения и размножения бактерий возникает специфический воспалительный очаг – инфекционная гранулема. Затем развивается специфический воспалительный процесс в региональных лимфатических узлах и наблюдается сенсибилизация организма - формируется первичный туберкулезный комплекс. Обычно первичный очаг имеет доброкачественное течение, он рассасывается, пораженный участок кальцинируется и рубцуется. Но бактерии полностью не уничтожаются. В первичном очаге и лимфатических узлах они могут сохраняться долгие годы и при неблагоприятных условиях может произойти активация возбудителя и генерализация процесса.
Из первичного туберкулезного комплекса микобактерии разносятся:
в результате чего образуются очаги в других органах и тканях и возникает диссеминированный легочный или внелегочный туберкулез.
Вторичный туберкулез возникает у ранее инфицированных людей, процесс, чаще всего, локализуется в каком-либо органе. Возникновение вторичного туберкулеза – результат активации старых эндогенных очагов или нового экзогенного заражения возбудителями туберкулеза (суперинфекция) вследствие тесного контакта с бактериовыделителем.
Различают 3 клинические формы заболевания: первичная туберкулезная интоксикация у детей и подростков, туберкулез органов дыхания, туберкулез других органов и систем.
Чаще всего возникает туберкулез органов дыхания (легких и внутригрудных лимфатических узлов). Он проявляется субфебрильной температурой тела, кашлем с мокротой, кровохарканьем, одышкой. Симптомов, характерных только для туберкулеза, нет.
В отличие от M. tuberculosis, M. bovis чаще поражает детей и вызывает такие внелегочные формы заболевания, как туберкулез периферических лимфатических узлов и мочеполовых органов, туберкулез костей и суставов, сопровождающиеся лекарственной устойчивостью к изониазиду.
Противотуберкулезный иммунитет.
Иммунитет нестерильный, что обусловлено длительной персистенцией L-форм бактерий в макроорганизме. Он появляется через 4-8 недель после попадания микробов в макроорганизм.
Микробиологическая диагностика.
Материалом для исследования служит мокрота.
Обязательными методами микробиологической диагностики туберкулеза являются бактериоскопическое и бактериологические исследования, биопроба и туберкулинодиагностика. Обнаружение в патологическом материале возбудителей является прямым доказательством активности инфекционного процесса.
Бактериоскопическое исследование. Из материала готовят мазки, окрашивают по Цилю–Нильсену и микроскопируют. В препаратах обнаруживают единичные или слипшиеся по 2-3 красные палочки, если в 1 мл мокроты их содержится не менее 10 4 -10 5 бактериальных клеток (предел метода). При получении отрицательных результатов прибегают к методам обогащения материала: гомогенизации и флотации.
Метод гомогенизации: к суточной порции мокроты добавляют равный объем 1% раствора едкого натра, флакон закрывают пробкой и встряхивают 10-15 мин, центрифугируют, нейтрализуют кислотой и из осадка готовят мазок.
Чаще применяют метод флотации: мокроту гомогенизируют и прогревают при 55 0 С 30 мин на водяной бане. Затем добавляют 1-2 мл ксилола, дистиллированную воду и повторно встряхивают в течение 10 мин. Оставляют стоять 25-30 мин при комнатной температуре. На поверхности образуется пена, состоящая из всплывших капелек ксилола с адсорбированными бактериями. Мазок готовят из пенообразного слоя, несколько раз наслаивая материал на стекло. Метод флотации на 10% повышает обнаружение микобактерий в патологическом материале.
Широкое распространение получил высокочувствительный метод люминесцентной микроскопии, основанный на способности липидов микобактерий воспринимать люминесцентные красители и светиться при облучении ультрафиолетовыми лучами.
Бактериологическое исследование является основным методом диагностики туберкулеза Исследуемый материал перед посевом в течение нескольких минут подвергают действию 10% серной кислоты или 4-6% едкого натра для освобождения от сопутствующей микрофлоры, затем тщательно встряхивают и центрифугируют. Осадок нейтрализуют и засевают в несколько пробирок со средой Левенштейна–Йенсена. Посевы инкубируют при 37 0 С 4-6 нед и более, просматривая посевы 1 раз в неделю. Выделенную культуру микобактерий туберкулеза дифференцируют от условно-патогенных микобактерий по морфологическим, тинкториальным, биохимическим свойствам и др.
Из биохимических свойств чаще всего определяют способность исследуемой культуры синтезировать никотиновую кислоту (ниациновая проба). Для определения ниацина к культуре микобактерий в жидкой питательной среде добавляют 1 мл КСN и 1 мл 5% раствора хлорамина. При наличии ниацина через несколько минут появляется ярко-желтая окраска. После учета результатов для нейтрализации КСN в пробирки добавляют 3-5 мл 10% гидрокарбоната натрия.
2.А. Для ускорения диагностики используют метод микрокультур Прайса. На нескольких предметных стеклах делают толстые мазки из исследуемого материала, высушивают, обрабатывают несколько минут 2-6% серной кислотой и нейтрализуют. Затем стекла опускают во флаконы с гемолизированной цитратной кровью в разведении 1/4-1/8 и ставят в термостат. Через 4-14 дней извлекают стекла, фиксируют препарат, окрашивают по Цилю–Нильсену и микроскопируют. Вирулентные штаммы образуют микрокультуры, имеющие вид кос или жгутов.
2.Б. Определение лекарственной устойчивости микобактерий проводят перед началом лечения, спустя 3 мес. и далее при продолжающемся выделении бактерий туберкулеза через каждые 6 мес. методом серийных разведений.
С этой целью по 0,1 мл взвеси микобактерий засевают в пробирки со средой Левенштейна–Йенсена, содержащей различные концентрации антибактериальных препаратов: 5, 10, 50 мкг/мл стрептомицина, 1, 5, 10, 25 мкг/мл тубазида и т.п. Результаты исследования учитывают по истечении определенного срока выращивания, достаточного для получения обильного роста в контрольных пробирках.
Устойчивость штамма выражается максимальной концентрацией антибактериального препарата (количество микрограммов в 1 мл питательной среды), при которой еще наблюдается рост, приближающийся к росту в контроле.
Биологический метод является наиболее надежным при выявлении микобактерий туберкулеза, он позволяет обнаружить от 1 до 5 микробных клеток в исследуемом материале. Исследуемый материал обрабатывают серной кислотой для освобождения от посторонней микрофлоры, нейтрализуют и вводят подкожно по 2-3 мл морской свинке и кролику с отрицательными туберкулиновыми реакциями. Через 4 мес., если животное не погибнет, его забивают и проводят микроскопическое исследование его органов. M. tuberculosis – высокопатогенны для морских свинок и малопатогенны для кроликов, M. bovis –высокопатогенны для кроликов.
5. Для экспресс-диагностики применяют реакцию иммунофлюоресценции (РИФ) с использованием видоспецифических моноклональных антител, иммуноферментный анализ (ИФА) и полимеразно-цепную реакцию (ПЦР). Эти методы направлены на обнаружение как антигенов возбудителей туберкулеза, так и антител к ним.
Препараты для лечения.
Международный союз борьбы с туберкулезом в связи с распространением в настоящее время множественно-резистентных штаммов предложил все противотуберкулезные препараты по степени их эффективности разделить на 3 группы:
группа А – наиболее эффективные – изониазид, рифампицин и их производные;
группа В – препараты средней эффективности – стрептомицин, канамицин, этионамид (пропионамид), этамбутол, пиразинамид, флоримицин, циклосерин, производные фторхинолонов; группа С – препараты малой эффективности – ПАСК, тибон (тиоацетозон).
В России препараты группы С в последнее время не применяются, а также получены препараты, превосходящие рифампицин по лечебным свойствам: рифапентин, рифабутин и комбинированные препараты: рифатер, рифанг.
Период лечения состоит из 2 этапов. Цель первого - подавить репликацию активно размножающейся бактериальной популяции, располагающейся в основном внеклеточно, добиться снижения ее численности. Цель второго этапа – долечивание в результате воздействия на оставшуюся бактериальную популяцию, в большинстве своем находящуюся внутриклеточно в виде персистирующих форм микобактерий.
Большинство больных перестают быть источником инфекции в течение 2 недель с начала соответстующей противотуберкулезной терапии.
Препараты для специфической профилактики.
Для специфической профилактики используют живую вакцину БЦЖ – BCG, полученную путем длительного культивирования M. bovis на картофельно-глицериновом агаре с добавлением бычьей желчи. Вакцинацию проводят новорожденным на 2-5 день в роддоме внутрикожно с последующей ревакцинацией согласно календарю прививок. Ревакцинацию проводят лицам с отрицательной туберкулиновой пробой с интервалом 5-7 лет до 30-летнего возраста.
Что такое коклюш? Причины возникновения, диагностику и методы лечения разберем в статье доктора Каминской Ольги Николаевны, инфекциониста со стажем в 21 год.
Над статьей доктора Каминской Ольги Николаевны работали литературный редактор Юлия Липовская , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина

Определение болезни. Причины заболевания
Коклюш (от франц. coqueluche) — острое инфекционное заболевание, вызываемое бактерией Bordetella pertussis. Клинически характеризуется респираторным синдромом (поражением верхних дыхательных путей) с приступообразным кашлем. Имеет характерное название "стодневный кашель", так как симптомы держатся длительно — 3-4 месяца [1] [2] [3] [4] [5] .

Этиология
Вид — Bordetella pertussis
Бактерия представляет собой мелкую палочку с закруглёнными концами. Она неподвижная, хорошо окрашивается анилиновыми красителями (при микроскопии данные красители окрашивают коклюшный микроб в красный цвет ) [6] [7] .
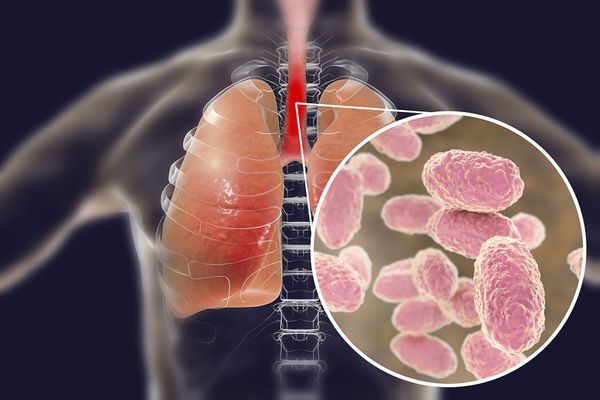
Строение Bordetella pertussis
Возбудитель коклюша (Bordetella pertussis) содержит чужеродные вещества (антигены), которые стимулируют образование в организме антител. Антигены, участвующие в реакции агглютинации (склеивания бактерий антителами) называются агглютиногенами , а антитела вызывающие этот процесс — агглютининами . А гглютиноген иначе называют фактором и обозначают цифрами от 1 до 14. Коклюшная палочка в своём строении имеет несколько таких факторов.
Именно по наличию в организме определённых факторов-агглютиногенов с помощью специальных лабораторных исследований возможно определить принадлежность микроба к данному виду. Схожее строение имеет Bordetella parapertussis, которая вызывает похожее заболевание. Отличие возможно только по лабораторным тестам.
Возбудитель неустойчив во внешней среде, поэтому посев нужно делать сразу после взятия материала. При высушивании, облучении ультрафиолетом, под действием дезинфицирующих веществ бактерия быстро погибает [4] [5] .
Эпидемиология
Заболевание коклюш является антропонозом, т. е. им болеют только люди. Источник инфекции — больные коклюшем, носители. В эпидемиологическом плане наиболее опасны бактериовыделители, которые не имеют жалоб и клинических симптомов, ведут активный образ жизни, но выделяют микроб во внешнюю среду, заражая окружающих.
Для коклюша характерен аэрозольный механизм передачи, т. е. заболевание передается воздушно-капельным путём, особенно часто заражение происходит при близком, семейном контакте. Чаще болеют дети дошкольного возраста.
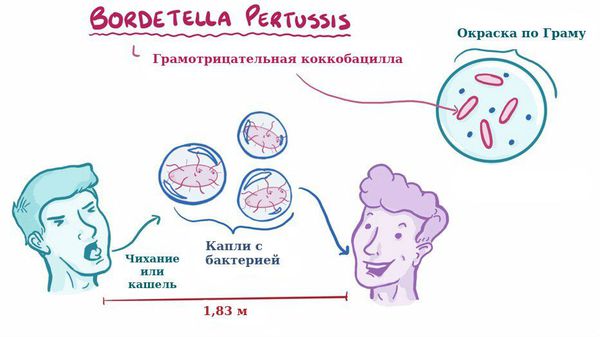
Отмечается высокая восприимчивость к инфекции, индекс контагиозности до 90 %, т. е из 100 человек, которые не болели коклюшем и не прививались, после контакта заболевает до 90 человек. В зимне-весенний период отмечается подъём заболеваемости.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы коклюша
Инкубационный период продолжается до 14 суток. В этот период пациент не предъявляет жалоб, но уже с конца данного периода становится опасен для окружающих, так как начинает выделять коклюшный микроб во внешнюю среду при кашле и чихании. Начало болезни постепенное без лихорадки с умеренно выраженной интоксикацией.
По мере развития заболевания появляются следующие синдромы:
- респираторный (кашель, скудный насморк без гнойного отделяемого);
- интоксикации — выражен умеренно, характеризуется кратковременной невысокой температурой. Высокая температура возможна при развитии осложнений (пневмонии).
Болезнь начинается с появления кашля на фоне слабой интоксикации и насморка. Интенсивность кашля постепенно нарастает, с 10-14 дня кашель становится мучительным, приступообразным с формированием характерных реприз с остановкой дыхания и затруднённым вздохом. Реприза представляет собой кашлевые толчки, сменяющиеся глубоким вдохом по типу "петушиного крика". В приступе кашля у больного синеет лицо, кончик языка при кашле направлен вверх, возможны кровоизлияния в кожу лица и склеры. В одном приступе может быть от 2 до 15 реприз. У детей приступы часто заканчиваются рвотой.
При тяжёлом течении с частотой реприз более 15 в сутки, большой частотой рвоты, связанной с кашлем, отмечается ухудшение физического состояния. Дети до года теряют в весе, начинают отставать в физическом и нервно-психическом развитии, теряют приобретённые навыки: перестают держать головку, переворачиваться, не сидят, хотя до развития заболевания данные навыки присутствовали.

При аускультации (выслушивании дыхания через фонендоскоп) выслушивается жёсткое дыхание, хрипов нет [4] [5] [6] .
Патогенез коклюша
Ворота инфекции — верхние дыхательные пути. Коклюшные палочки прикрепляются к слизистой дыхательных путей, вызывают воспаление без проникновения в кровоток. Коклюшная палочка не имеет факторов агрессии (ферментов), способных растворять клеточные мембраны, сосудистую стенку, поэтому её размножение происходит на поверхности бронха. На месте внедрения увеличивается секреция слизи, реснитчатый эпителий угнетается, формируются очаги некрозов (омертвения). Больше всего процесс затрагивает бронхи и бронхиолы.
В патогенезе судорожных приступов играет роль действие токсина коклюшной палочки. Токсин, попадая в кровоток, вызывает постоянное раздражение рецепторов бронхов, что приводит к перевозбуждению дыхательного центра. Также приступ может быть спровоцирован неинфекционными факторами, например холодным воздухом.
После перенесённого коклюша и вакцинации пожизненного иммунитета не формируется, он сохраняется до 5-6 лет, в дальнейшем возможны повторные заболевания.
Около 5 % случаев коклюша приходится на взрослых. Последние исследования показывают увеличение доли школьников среди заболевших коклюшем, что подтверждается результатами обследования длительно-кашляющих подростков на коклюш [4] [5] [6] [9] .
Классификация и стадии развития коклюша
Критерии тяжести протекания коклюша :
- лёгкая форма (до 15 реприз в сутки);
- средне-тяжёлая (15-25 реприз в сутки);
- тяжёлая (более 25 реприз в сутки) [7] .
По форме:
- Типичная форма коклюша — характерно наличие приступообразного кашля, этапность появления симптомов.
- Атипичная форма коклюша — характеризуется нетипичным покашливанием, отсутствием последовательной смены периодов болезни. Длительность кашля составляет до 50 дней, в среднем около 30 дней. Кашель носит сухой, навязчивый характер, наблюдается напряжение лица, чаще ночью с усилением на второй неделе от начала болезни. Иногда удаётся наблюдать появление единичных типичных приступов кашля при волнении ребёнка, во время еды или в связи с наслоением респираторной вирусной инфекции. Для этой формы характерно редкое повышение температуры и слабая выраженность катарального синдрома (воспаления) слизистых носа и зева [1][2][5][7] .
Клинические периоды (стадии) коклюша:
- Инкубационный период (3-14 дней) — симптомы не проявляются, пациент не предъявляет жалоб .
- Катаральный период (10-13 дней) — наблюдается клиническая картина, характерная для множества простудных заболеваний .
- Пароксизмальный, или спазматический период (1-6 недель) — проявления становятся более выраженными, пациента беспокоит мучительный приступообразный кашель.
- Период обратного развития, или реконвалесценции — приступы кашля становятся редкими , улучшается общее состояние. Этот период, в свою очередь, делят на ранний (развивается через 2-8 недель от начала клинических проявлений) и поздний (спустя 2-6 месяцев) [12] .
Осложнения коклюша
Наиболее частым осложнением является пневмония, которая может быть вызвана самой коклюшной палочкой или быть вторичной из-за активизации микрофлоры бронха.
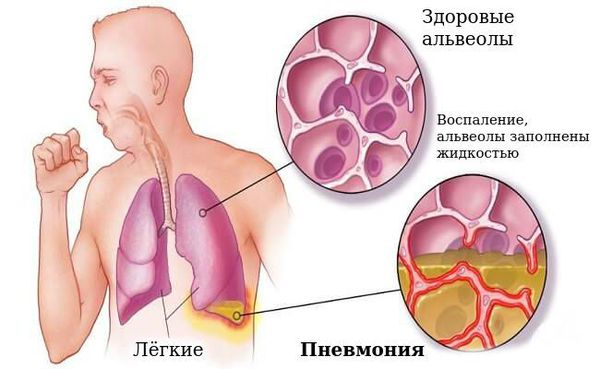
В период спазматического кашля возможны: остановка дыхания, ателектазы (спадение доли лёгкого), пупочная и паховая грыжи, энцефалопатия (нарушение поведения, расстройство внимания, у детей до года отставание в психомоторном развитии, беспокойный сон, раздражительность).
Данные осложнения чаще развиваются у грудных детей. У взрослых осложнения встречаются редко [5] [7] [9] .
Диагностика коклюша
К какому врачу обратиться при коклюше
При подозрении на коклюш следует обратиться к врачу-инфекционисту.
Лабораторная диагностика коклюша
К методам лабораторной диагностики относятся:
- Клинический анализ крови: при коклюше наблюдается лимфоцитарный лейкоцитоз, СОЭ (скорость оседания эритроцитов) повышена или в норме.
- Бактериальный посев с носоглотки (мазок) на коклюш.
- ПЦР диагностика (мазок с носоглотки).
- ИФА (иммуноферментный анализ) крови с определением маркеров проникновения инфекции — антител IgG и IgM, IgА к Bordetella pertussis. Исследование проводится двукратно с интервалом 10-14 дней, оценивается нарастание антител IgG (отвечают за устойчивый иммунитет к инфекции) в четыре раза в динамике. Наличие в крови IgM (первый ответ на инфекцию), IgА (обеспечивают местную защиту на уровне слизистых оболочек) к Bordetella pertussis является подтверждением диагноза [5][7][8][10] .
Дифференциальная диагностика
Длительный кашель может указывать не только на инфекционные заболевания, но и на патологии ЖКТ и других систем.
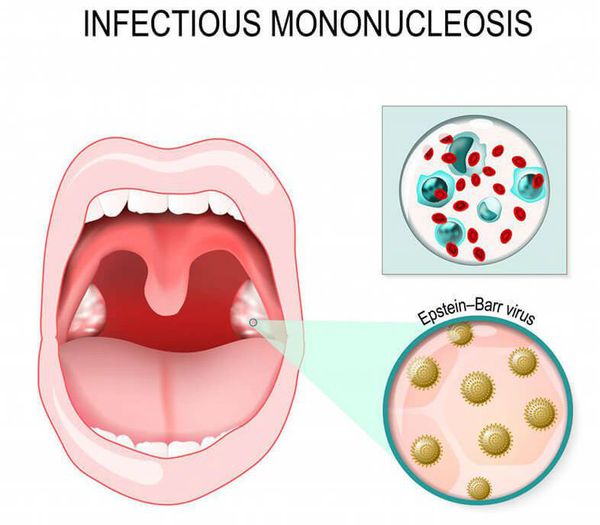
Инфекционный мононуклеоз может характеризоваться длительным кашлем из-за увеличения всех групп лимфоузлов, в том числе расположенных около бронха. Возникает синдром сдавления бронха, что вызывает длительный сухой кашель. Отличительная особенность — высокая и длительная лихорадка, кашель протекает без реприз. Диагноз подтверждается результатами обследования крови: в клиническом анализе крови на фоне повышения общего числа лейкоцитов с преобладанием лимфоцитов определяются специфичные клетки — мононуклеары, при серологическом исследовании крови определяются антитела класса IgM к вирусу Эбштейна — Барр.
Паракоклюш — заболевание, клинически не отличимое от коклюша. Вызывается схожей бактерией Bordetella parapertussis. Диагностика совпадает с таковой при коклюше. Возможно только лабораторное подтверждение: выделение Bordetella parapertussis при бактериологическом посеве со слизистой носоглотки, при ПЦР-исследовании, нарастание титров антител к Bordetella parapertussis при обследовании крови метом ИФА.
Туберкулёз — заражение туберкулёзной палочкой приводит к состоянию, для которого характерно поражение внутригрудных лимфоузлов (чаще у детей), лёгких (чаще у взрослых). В клинике преобладает длительный, навязчивый кашель, интоксикация, снижение массы тела. Репризы не характерны, необходимо дообследование у фтизиатра для исключения туберкулёза. Для уточнения диагноза применяют рентгенологические методы исследования лёгких, мультиспиральную компьютерную томографию (МСКТ) грудной клетки, учёт реакций туберкулиновых проб (реакция Манту, Диаскинтест), бактериологические методы исследования (посев мокроты на туберкулёзную палочку).
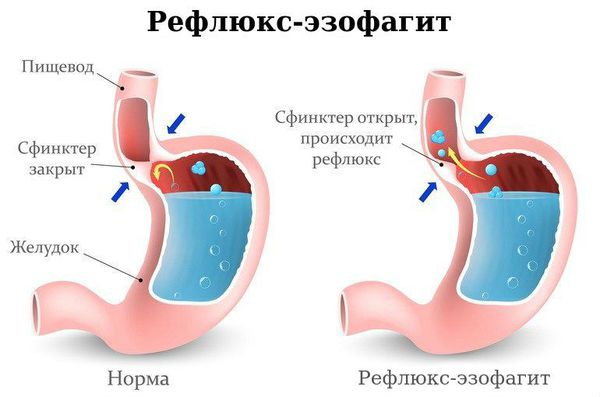
Рефлюкс-эзофагит — при данном состоянии возникает заброс кислого содержимого желудка в пищевод. Из-за близкого расположения пищевода и бронхов происходит раздражение последних и в клинике появляется кашель. Характерно появление кашля в положении лёжа, ночной кашель преобладает над дневным. Диагноз подтверждается проведением ультразвукового исследования желудка. Лечение рефлюкс-эзофагита проводит врач-гастроэнтеролог [5] [7] .
Дополнительные методы обследования: на рентгенограмме органов грудной клетки при неосложнённом коклюше отмечаются признаки усиления лёгочного рисунка: из-за отёка и воспаления на рентгеновском снимке тень лёгкого более выражена.
Лечение коклюша
В домашних условиях осуществляется лечение лёгких форм при условии отсутствия в семье непривитых детей.
Нужен ли постельный режим пациенту с коклюшем
Режим — домашний, постельный режим по самочувствию.
Когда необходимо лечение в стационаре
Тяжёлые формы подлежат госпитализации в инфекционный стационар. Показания для госпитализации: остановка дыхания, более 10 реприз в день, возраст до двух лет.
Диета при коклюше и общие рекомендации
Диета при коклюше — общий стол. Общие рекомендации: увлажнение воздуха (снижает раздражение рецепторов бронхов, уменьшает частоту реприз), витаминотерапия, исключение пассивного курения, проветривание и влажная уборка помещения.
Какие медикаменты и физиотерапевтические процедуры помогут при коклюше
В катаральный период показано применение антибактериальной терапии. Коклюшный микроб чувствителен к макропенам (азитромицин) и защищённым аминопенициллинам (амоксициллина клавуанат). В период спазматического кашля антибиотики малоэффективны, так как в этот период микроба уже нет в организме человека, клиника развивается на основании уже выделенного токсина.
Показаны ингаляции через небулайзер с гормонами (будесонид) [5] [6] [7] .

Как облегчить кашель при коклюше. Симптоматическая терапия
Облегчить кашель помогут препараты на основе кодеина или либексина, насморк — сосудосуживающие препараты в каплях или спрее.
Народные методы лечения коклюша
Народные методы не имеют доказанной эффективности, поэтому применение их может нанести вред здоровью. Отсутствие своевременного адекватного лечения коклюша, особенно у маленьких детей, опасно осложнениями — пневмонией и остановкой дыхания.
Прогноз. Профилактика
Прогноз обычно благоприятный. Симптомы коклюша нарастают в течение месяца, стихают за 2-4 месяца. Рецидивы связаны с наслоением ОРЗ, так как снова возникает раздражение слизистой бронха, усиливается кашель, учащаются репризы. На фоне лечения ОРЗ симптомы коклюша угасают.
Вакцинация против коклюша
Основным профилактическим мероприятием является вакцинация. Вакцинация позволяет сформировать иммунитет к коклюшу после введения в организм специальных иммунобиологических препаратов. Современные вакцины против коклюша входят в состав комплексных вакцин отечественного и зарубежного производства. В состав комплексных вакцин кроме коклюшного компонента может входить дифтерийный и столбнячный анатоксин, вакцина против гепатита В, гемофильной инфекции и полиомиелита (таблица 1).
В соответствии с Национальным календарём профилактических прививок вакцинация показана детям с трёх месяцев жизни. Курс прививок в первый год состоит из трёх вакцинаций с интервалом 45 дней. Дальнейшие прививки проводят на втором году жизни (через год от последней вакцинации). Вакцинацию против коклюша можно сочетать с другими прививками Национального календаря прививок: грипп, пневмококковая инфекция. Все вакцины, содержащие коклюшный компонент, взаимозаменяемы.
Таблица 1. Компоненты комплексных вакцин для профилактики коклюша
Комплексные вакцины имеют ограничение применения по возрасту пациента (таблица 2). У детей вакцинация от коклюша возможна до 4-6 лет. Длительность иммунного ответа после вакцинации составляет до 5-6 лет.
Читайте также:

