Дигоксиновая интоксикация на экг
Обновлено: 18.04.2024
Дигиталисная интоксикация - диагностика, лечение
Дигоксин широко используется в качестве препарата, подавляющего АВ-проводимость, для уменьшения частоты сокращений желудочков при фибрилляции предсердий (ФП). Однако применение дигок-сина с этой целью нередко оказывается неэффективным, если пациент ведет активный образ жизни.
Обычная доза составляет 0,25-0,375 мг/сут. Ряд факторов способствуют развитию дигиталисной интоксикации и служат основанием для уменьшения дозы. К таковым относятся: гипокалиемия, нарушение функции почек, возраст, дегидратация (часто - на фоне терапии диуретиками), прием верапамила или амиодарона.
Дигиталисная интоксикация встречается часто. Симптомы этого состояния обнаруживаются более чем у 10% госпитализированных пациентов, получающих дигоксин.
Дигиталисную интоксикацию можно заподозрить при наличии таких клинических симптомов, как анорексия, тошнота, рвота, диарея, нарушения ментального статуса, ксантопсия и нечеткость зрения. Однако ни один из этих симптомов не является специфичным для рассматриваемого состояния.
В частности, у больных с застойной сердечной недостаточностью желудочно-кишечные симптомы часто бывают вызваны непосредственно сердечной недостаточностью, а не дигоксином.

Дигиталисная интоксикация может вызвать развитие ряда нарушений сердечного ритма и проводимости. К таковым относятся предсердная тахикардия с АВ-блокадой, тахикардия из АВ-соединения, желудочковая экстрасистолия (часто - бигеминия), ЖТ, АВ-блокада I—III степени, медленный ритм желудочков на фоне фибрилляций предсердий (ФП) и синоатриальная блокада.
В недавнем большом исследовании, посвященном изучению антикоагулянтной терапии при фибрилляции предсердий (ФП), было обнаружено увеличение смертности среди пациентов, получавших дигоксин.
Дигоксин часто назначают с целью контроля частоты сокращений желудочков при фибрилляции предсердий (ФП). Если у такого больного пульс становится правильным, следует рассмотреть ряд возможностей. Во-первых, возможно, у пациента восстановился синусовый ритм. Во-вторых, причиной может быть аритмия, вызванная дигиталисной интоксикацией (например, появление предсердной тахикардии с АВ-блокадой, тахикардии из АВ-соединения или развитие полной АВ-блокады на фоне сохраняющейся фибрилляции предсердий (ФП)).
Без регистрации ЭКГ выяснить, чем именно в таких случаях обусловлено появление правильного ритма сердца, невозможно.
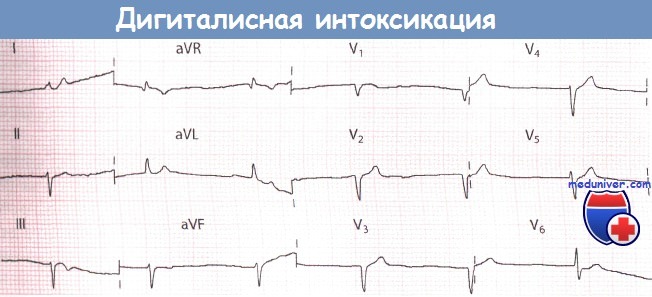
Ритм из АВ-соединения у пациента, получавшего дигоксин по поводу фибрилляции предсердий (ФП).
Содержание дигоксина в плазме крови 5,9 нмоль/л.
Можно определить содержание дигоксина в плазме крови, однако полученный результат необходимо интерпретировать в совокупности с клиническими данными. При уровне менее 1,5 нг/мл и при отсутствии гипокалиемии дигиталисная интоксикация маловероятна. При содержании дигоксина более 3,0 нг/мл интоксикация вполне вероятна.
Если же концентрация дигоксина в плазме крови составляет от 1,5 до 3,0 нг/мл, то вероятность дигиталисной интоксикации следует предположить, особенно при наличии у пациента свойственных этому состоянию симптомов или нарушений ритма и проводимости сердца, почечной дисфункции либо при предположительном использовании неоправданно высокой дозы препарата. Взятие пробы крови для определения концентрации дигоксина необходимо производить как минимум через 6 ч после последнего приема препарата.
Обычно все, что необходимо сделать, - это прекратить прием дигоксина на некоторое время и устранить гипокалиемию (при наличии таковой). При тяжелой дигиталисной интоксикации вводят специфические антитела к дигоксину, полученные у овцы.
При наличии АВ-блокады высокой степени может потребоваться временная ЭКС. Кардиоверсия на фоне дигиталисной интоксикации сопряжена с высоким риском. В безвыходной ситуации кардиоверсию необходимо начинать с разрядов малой энергии (5-10 Дж), постепенно увеличивая их мощность при необходимости, и ввести 75-100 мг лидокаина.

Видео фармакологические, побочные эффекты инотропов дигоксина, добутамина, милринона
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Ключевые слова: сердечные гликозиды, дигоксин, побочные эффекты, интоксикация, аритмия, Fab-фрагменты.
Для цитирования: Дядык А.И., Куглер Т.Е., Здиховская И.И., Ракитская И.В. Дигиталисная интоксикация: диагностика, лечебная тактика и профилактика. РМЖ. 2021;1:29-33.
Digitalis intoxication: diagnosis, management strategy, and prevention
A.I. Dyadyk , T.E. Kugler, I.I. Zdikhovskaya, I.V. Rakitskaya
M. Gorkiy Donetsk National Medical University, Donetsk, DPR
Current guidelines recommend prescribing cardiac glycosides with caution. However, considering their pharmacological properties and narrow therapeutic index, the rate of incorrect use of cardiac glycosides in clinical practice is still high. Digitalis toxicity develops at various serum concentrations of digoxin (generally, at concentrations > 2.0 ng/ml). Preventive strategies for digitalis toxicity should be based on both serum digoxin concentrations and its risk factors. Optimal doses of cardiac glycosides should be selected based on patient’s age, comorbidities, renal functions, and drug interactions. A wide spectrum of cardiac and non-cardiac manifestations of digitalis toxicity significantly hampers its diagnosis. The most common symptoms are irregular heartbeat and conduction abnormalities, nausea, vomiting, weakness, dizziness, headache, psychic disorders, and vision loss. The management strategy for digitalis toxicity is based on the severity of clinical signs. Severe life-threatening arrhythmias are a reason to prescribe anti-digoxin antibodies (Fab-fragments), which are, unfortunately, not readily available in Russian clinical practice.
Keywords: cardiac glycosides, digoxin, adverse effects, digitalis toxicity, arrhythmia, Fab-fragments.
For citation: Dyadyk A.I., Kugler T.E., Zdikhovskaya I.I., Rakitskaya I.V. et al. Digitalis intoxication: diagnosis, management strategy, and prevention. RMJ. 2021;1:29–33.

Памяти нашего Учителя
Введение
Сердечные гликозиды (СГ) продолжают широко применяться в клинической практике. В настоящее время в кардиологии в основном используется дигоксин, обладающий доказанной клинической эффективностью. В крупномасштабных рандомизированных контролируемых исследованиях последних лет (SENIORS [1], ROCKET-AF [2], ARISTOTLE AF NOAC [3]) приблизительно 30–40% пациентов с хронической сердечной недостаточностью (ХСН) и/или фибрилляцией предсердий (ФП) получали СГ в различных режимах терапии. Положительный эффект дигоксина может быть в большей степени связан с увеличением сократимости спиральных волокон миокарда, определяющих активную позднюю фазу опорожнения левого желудочка (ЛЖ) и активную раннюю фазу диастолического наполнения, чем со снижением ЧСС (особенно при синусовом ритме) [4].
Согласно рекомендациям Российского кардиологического общества (РКО) по диагностике и лечению острой декомпенсированной сердечной недостаточности и ХСН [1] дигоксин может применятьсяу больных ХСН с синусовым ритмом, несмотря на лечение ингибиторами ангионтензинпревращающего фермента,β-блокаторами и антагонистами альдостерона, для снижения риска госпитализации как по поводу как сердечной недостаточности, так и других причин (класс рекомендаций — IIb, уровень доказательности — B). Назначение дигоксина должно быть рассмотрено у больных ХСН II–IV функционального класса, с ФВ ЛЖ
Факторы риска развития дигиталисной интоксикации
Клиническая эффективность и безопасность дигоксина определяются рядом фармакокинетических параметров, включающих абсорбцию, распределение по органам и тканям и элиминацию путем биотрансформации и экскреции [23–25]. При одинаковых режимах дозирования дигоксина изменение сывороточной концентрации может наблюдаться у пожилых пациентов, при сниженной функции почек, сердечно-сосудистой патологии, электролитных нарушениях, одновременном приеме с некоторыми лекарственными препаратами. Отмечена повышенная чувствительность миокарда к токсическим эффектам СГ у больных с хроническим обструктивным заболеванием легких, особенно при развитии правожелудочковой сердечной недостаточности, гипоксемии и гиперкапнии. Сывороточные концентрации дигоксина снижаются при гипертиреозе и повышаются при гипотиреозе [16, 26–29].
Особенности фармакокинетики дигоксина
С целью профилактики ДтИ следует учитывать особенности фармакокинетики дигоксина при различных клинических ситуациях [28, 29]. Так, с возрастом наблюдается снижение скорости клубочковой фильтрации (СКФ), уменьшается скелетная мышечная масса, являющаяся основным депо СГ, что приводит к уменьшению объема распределения, а следовательно, к более высоким плазменным концентрациям [16]. Наличие коморбидности и полипрагмазии определяет необходимость снижения дозировок дигоксина у лиц пожилого возраста — обычно до 0,125 мг.
Фармакокинетика дигоксина существенно не меняется у больных гепатитами, циррозом печени и тучных больных в связи с низкой концентрацией в жировой ткани. Следовательно, при ожирении дозы дигоксина должны рассчитываться не на общую массу тела, а на мышечную [25, 30].
Взаимодействие с лекарственными препаратами
Представлены убедительные доказательства изменения плазменных концентраций дигоксина при комбинированном применении с другими лекарственными препаратами [26, 27, 29]. Снижение абсорбции дигоксина происходит при одновременном приеме с антацидами, холестирамином, сорбентами, метоклопрамидом, сульфасалазином, препаратами цитотоксического действия.
Повышение концентрации дигоксина в плазме происходит при назначении противоаритмических препаратов (хинидин, амиодарон, пропафенон, новокаинамид, верапамил), препаратов с холинергическими свойствами (атропин, метацин), ингибиторов ангиотензинпревращающего фермента. Применение нестероидных противовоспалительных препаратов сопряжено с риском снижения СКФ, что приводит к уменьшению почечной экскреции дигоксина на 20–30%, а следовательно, к повышению его плазменного уровня [26, 29, 31].
Комбинированное применение дигоксина с диуретиками повышает риск развития ДтИ вследствие присущих им побочных эффектов: гипокалиемии, гипомагниемии (петлевые и тиазидные диуретики), гиперкалиемии (калийсберегающие диуретики), гиперкальциемии (тиазидные диуретики), метаболического алкалоза (петлевые и тиазидные диуретики). В связи с этим у больных, получающих дигоксин и диуретическую терапию, необходимо контролировать плазменные уровни электролитов и электрокардиографические показатели [25–27].
Электролитные нарушения
С нарушениями баланса ионов К + , Na + , Mg 2+ и Са 2+ связано как изменение эффективности СГ, так и развитие ДтИ. Среди этих нарушений важное место занимают нарушения гомеостаза К + . В эксперименте и клинических исследованиях показано повышение риска развития ДтИ при гипокалиемии. Этот феномен обусловлен целым рядом факторов, включая снижение связывания CГ с Na + -К + -АТФазой сарколеммы, снижение содержания Na + -К + -АТФазных единиц в скелетной мускулатуре, непосредственное влияние гипокалиемии на формирование эктопических очагов в миокарде и нарушение проводимости. Электрофизиологические механизмы, обусловленные гипокалиемией, способствуют увеличению токсических эффектов СГ и существенно повышают риск развития аритмий [16].
В отличие от гипокалиемии, гиперкалиемия не ассоциируется с увеличением риска развития ДтИ. Повышение концентрации экстрацеллюлярного К + ведет к структурным изменениям Na + -К + -АТФазы, нарушающим связь с ней СГ. Кроме того, при гиперкалиемии наблюдается стимуляция активности Na + -К + -АТФазы. Повышение плазменных уровней К + (более 5,5 мэкв/л) стимулирует деполяризацию проводящей ткани сердца (особенно атриовентрикулярных соединений), результатом чего может быть снижение проводимости и развитие атриовентрикулярных блокад [26–28].
Ионам Са 2+ отводится важная роль в развитии ДтИ. Одним из факторов риска ДтИ является увеличение внутриклеточного Na + , что модифицирует Na + -Са 2+ обмен, в результате чего повышается внутриклеточное содержание Са 2+ , ведущее к замедлению процессов проведения [12]. Сказанное выше аргументирует необходимость определения плазменных уровней электролитов при использовании дигоксина [32].
Клинические проявления дигиталисной интоксикации
Широкий спектр проявлений ДтИ, как кардиальных, так и некардиальных, существенно затрудняет ее диагностику. По данным G. Ordog et al. (1987) [33], своевременная диагностика ДтИ осуществляется приблизительно в 20% случаев.
По результатам исследования М. Böhn et al. (1998) [34], при ДтИ кардиальные проявления имеют место в 67–80% случаев, желудочно-кишечные — в 20–25% случаев, неврологические — в 5–10% случаев. Нарушения сердечного ритма и проводимости нередко могут быть первыми (а иногда и единственными) проявлениями ДтИ.
I. See et al. (2014) [19] опубликовали детальный анализ данных 5165 больных, госпитализированных в отделения интенсивной терапии с 2005 по 2010 г. в США в связи с побочными эффектами лекарственных препаратов. Среди них был выявлен 441 случай ДтИ. Большинство составили женщины (67,8% [95% ДИ 62,9–72,6%]), лица ≥70 лет (79,1% [95% ДИ 73,5–84,7%]). Диагноз ДтИ был установлен в 5,9% случаев (95% ДИ 4,0–7,9%) госпитализаций пациентов ≥85 лет. Уровень сывороточной концентрации дигоксина ≥2,0 нг/мл имел место в 95,8% случаев. Эти данные дают реальное представление о частоте и тяжести ДтИ, ее структуре и факторах риска развития в клинической практике (табл. 1).
![Таблица 1. Частота клинических проявлений дигиталисной интоксикации [19]](https://www.rmj.ru/upload/medialibrary/69d/29-1.jpg)
Кардиальные симптомы
Токсическое влияние СГ на кардиальные электрофизиологические процессы — наиболее частое и серьезное проявление ДтИ. Практически все летальные случаи ДтИ обусловлены тяжелыми нарушениями ритма и проводимости, которые не носят специфический характер, в связи с чем установление их этиологии нередко представляет существенные трудности.
Аритмогенные эффекты СГ являются комплексными и недостаточно изученными. К механизмам их развития относят постдеполяризационные потенциалы, усиленную диастолическую реполяризацию и механизмы re-entry. Важное место также отводится внутриклеточной перегрузке Са 2+ [16, 18].
В зависимости от генеза выделяют две группы аритмий, развивающихся при ДтИ [25, 26]:
аритмии, обусловленные преимущественно повышением парасимпатической активности (синусовая брадикардия, синоатриальные и атриовентрикулярные блокады, узловой ритм, а также частота желудочковых комплексов менее 50 в минуту при ФП);
аритмии, обусловленные повышением эктопической активности (предсердная и желудочковая экстрасистолия, узловая тахикардия, желудочковая тахикардия и фибрилляция желудочков).
В ряде случаев усиленная эктопия сочетается с повышенным вагусным тонусом, что проявляется предсердной тахикардией с атриовентрикулярной блокадой или атриовентрикулярной тахикардией с атриовентрикулярной блокадой. Сочетание пароксизмальной предсердной тахикардии с атриовентрикулярной блокадой 2:1 считается классическим типом аритмии при ДтИ [19, 26, 35].
Наиболее частым проявлением ДтИ является развитие желудочковой эктопии, что проявляется полиморфной желудочковой экстрасистолией как с фиксированными, так и с разными интервалами сцепления. Желудочковая экстрасистолия часто носит характер бигеминии. Проявлениями ДтИ также могут быть пробежки желудочковой тахикардии (3 и более последовательных желудочковых комплекса). Характерной считается ее редкая форма — двунаправленная (или бифасцикулярная) желудочковая тахикардия. При ДтИ возможно также развитие фибрилляции желудочков [34, 35].
Некардиальные симптомы
Некардиальные симптомы ДтИ многообразны и неспецифичны, плохо коррелируют с сывороточными уровнями дигоксина и обычно не носят жизнеопасный характер. Среди них превалируют симптомы со стороны ЖКТ, ЦНС и зрительного аппарата [19, 26–28]. Аллергические реакции (кожная сыпь, эозинофилия, лихорадка) при приеме СГ наблюдаются редко.
Частыми и нередко ранними проявлениями ДтИ (до 80% случаев) являются анорексия, тошнота и рвота, имеющие центральное происхождение. Довольно часто наблюдается абдоминальная боль и диарея. Практически у всех больных с ДтИ развивается слабость, недомогание, снижение толерантности к физической нагрузке и головная боль. В 2/3 случаев наблюдаются различные психические нарушения, включающие раздражительность, нервозность, спутанность сознания, реже — дезориентацию, галлюцинации и психоз [17, 29, 31]. Нарушения зрения включают изменение цветовосприятия, ретробульбарный неврит и глазной паралич [37].
Лечебная тактика при дигиталисной интоксикации
Характер лечебных мероприятий при ДтИ и их эффективность определяются целым рядом факторов, включающих своевременную диагностику, установление тяжести состояния, суммарного количества принятого препарата и времени приема последней дозы, наличие нарушений электролитного баланса, функции почек, а также взаимодействия СГ с другими лекарственными препаратами [38–41]. Так, при ДтИ, проявляющейся синусовой брадикардией, атриовентрикулярной блокадой 1-й степени, редкими желудочковыми или предсердными экстрасистолами, достаточно временно отменить СГ, проводить мониторинг ЭКГ и АД. В последующем необходим подбор адекватных дозировок дигоксина для предотвращения повторных эпизодов ДтИ [41, 42].
В то же время серьезные жизнеопасные нарушения сердечного ритма и проводимости требуют немедленного проведения лечебных мероприятий. Так, при выраженной синусовой брадикардии, брадиаритмии при ФП или атриовентрикулярной блокаде 2-й степени применение атропина нередко обеспечивает хороший клинический эффект. При отсутствии эффекта от атропина, а также в случаях более тяжелой дисфункции синусового узла с атриовентрикулярной блокадой 3-й степени необходима установка кардио-стимулятора. Это может быть как временной мерой — в период острой борьбы с опасными для жизни нарушениями сердечного ритма, так и постоянной мерой — при сохраняющейся высокой степени блокады [16, 18, 29].
Развитие тяжелых жизнеопасных аритмий служит основанием для назначения специальных антидигоксиновых фрагментов антител (Fab-фрагментов). До назначения Fab-фрагментов или в ходе их применения необходимо срочное проведение других лечебных мероприятий, включающих коррекцию калиевого и/или магниевого гомеостаза и/или назначение противоаритмических препаратов (новокаинамид, пропафенон, лидокаин, амиодарон) [38, 39, 43].
Fab-фрагменты связываются с внутрисосудистым дигоксином, а также с дигоксином, находящимся в интерстициальном пространстве, куда он поступает путем диффузии. В результате этого происходит снижение концентрации свободного дигоксина во внеклеточном пространстве почти до нулевых уровней. Устанавливаемый при этом концентрационный градиент способствует выходу дигоксина из тканей и быстрому соединению с Fab-фрагментами. Благодаря этому наблюдается заметное повышение суммарной концентрации внеклеточного дигоксина, являющегося фармакологически неактивным, т. к. он находится в связанном состоянии с Fab-фрагментами. Связанный с Fab-фрагментами дигоксин элиминируется преимущественно почками. Таким образом, Fab-фрагменты антидигоксиновых антител быстро и эффективно устраняют проявления ДтИ [21, 39, 43]. По мнению E. Antman et al. (1990) [44], продолжение дигиталисной терапии возможно через 7 дней после устранения ДтИ и коррекции дозировок дигоксина. Гемодиализ и перитонеальный диализ не способны существенно элиминировать дигоксин из организма, т. к. он находится в связанном состоянии в различных (прежде всего в мышечных) тканях [45].
Заключение
Подходы к снижению частоты развития и тяжести клинических проявлений ДтИ должны базироваться на комплексе факторов, включающих знание фармакологических характеристик СГ, показаний и противопоказаний к их применению. Быстрая дигитализация должна применяться только в случаях развития жизнеопасных суправентрикулярных аритмий, когда использование других лекарственных средств противопоказано или неэффективно [46]. Кроме того, важное место в профилактике ДтИ отводится определению сывороточных концентраций дигоксина. Клиницистам следует рассматривать применение дигоксина с концентрацией в плазме не более 1,1 нг/мл (0,25 мг/сут и менее). Выбор дозы дигоксина должен осуществляться с учетом факторов риска развития ДтИ, т. е. особенностей кардиальной патологии, возраста, мышечной и жировой массы тела больного, сопутствующих заболеваний, состояния функции почек, а также возможного взаимодействия с другими лекарственными препаратами.
Для цитирования: Недоступ А.В., Благова О.В. Современная тактика медикаментозной урежающей ритм терапии при мерцательной аритмии. РМЖ. 2003;21:1168.
ММА имени И.М. Сеченова
М ерцательная аритмия (МА) является одним из наиболее тяжелых и распространенных нарушений сердечного ритма, встречается у 0,4% популяции в целом (М.С. Кушаковский, 1999) и более чем у 5% людей старше 69 лет (Braunwald, 1996). У подавляющего большинства МА приводит к появлению (или усугублению) сердечной недостаточности, которая, помимо исчезновения предсердной систолы, обусловлена собственно тахиаритмией, т.е. двумя слагаемыми: тахикардией и аритмией работы сердца (непродуктивные – слишком длинные и слишком короткие – диастолические паузы). При лечении МА общепринятой является необходимость уредить работу сердца (вторая составляющая – собственно аритмия – обычно, к сожалению, не учитывается). Известно, что урежение ритма сердца, действительно, сопровождается заметным уменьшением признаков СН. Имеются даже исследования (PIAF, 2000; AFFIRM, 2002), в которых показано, что с учетом таких конечных точек, как частота инсультов, инфарктов, тромбоэмболических и геморрагических осложнений, смертность, а также качество жизни, эффективное консервативное лечение МА (а это, в первую очередь, урежающая ритм терапия) не уступает тактике восстановления и сохранения синусового ритма. Однако эти данные получены на достаточно конкретной группе больных (пожилые люди со снижением сократительной функции сердца, с заведомо плохими шансами на стабильное поддержание синусового ритма и повышенным риском развития осложнений основного заболевания – распространенного атеросклероза и антиаритмической терапии), и их нельзя распространять на весь массив больных, страдающих МА.
Для урежения ритма при МА используют прежде всего препараты наперстянки, как наиболее эффективные и, казалось бы, достаточно изученные. Кроме того, применяются b -блокаторы, блокаторы кальциевых каналов, реже – препараты III класса антиаритмиков (амиодарон, d,l–соталол). В настоящее время некоторые авторы считают, что возможна даже монотерапия b -блокаторами или антагонистами кальция, как наиболее жесткими средствами урежения ритма. Чаще их все же рекомендуют добавлять к дигиталисным препаратам при недостаточном урежающем эффекте последних. При этом учитывают лучшую по сравнению с наперстянкой способность b -блокаторов и антагонистов кальция урежать ритм не только в покое, но и при физической нагрузке, а также возможность с помощью такой комбинированной терапии назначать меньшие дозы сердечных гликозидов с соответственно меньшим риском получить дигиталисную интоксикацию.
Подбор препаратов производят эмпирически, основываясь на существующих на сегодняшний день представлениях, что единственным патогенетическим механизмом урежающего действия этих средств является торможение проведения волн ff через атрио–вентрикулярную (АВ) систему (влияние на степень аритмии ритма сердца, как было сказано выше, вообще не учитывается).
К настоящему времени нами получены данные, позволяющие дополнить существующие представления о механизмах урежающего действия наперстянки и других препаратов. Начало этих работ было положено нами (А.В. Недоступ, Э.А. Богданова, А.А. Платонова) в середине 70–х годов [1–4] и продолжено (в соавт. с О.В. Благовой) в последние годы [5–9]. В соответствии с этим стал возможен более объективный подход к тактике урежающей ритм терапии при МА. Ниже приводим перечень новых положений, которые следует учитывать при урежающей ритм терапии у больных с МА.
3. Урежение желудочкового ритма у больных с МА под воздействием b -блокаторов и блокаторов кальциевых каналов достигается лишь благодаря их тормозящему эффекту на АВ проводимость (более сильному у b -блокаторов, которые дополнительно усиливают скрытое проведение через АВ соединение) – при этом отмечается значительное нарастание минимального интервала RR (RRmin), прямо отражающего при МА рефрактерность АВ узла. На предсердную активность эти препараты не влияют.
4. Антиаритмики III класса (амиодарон, d,l–соталол) урежают волны ff, вплоть до трансформации мерцания предсердий в трепетание, что облегчает их проведение через АВ систему, а с другой стороны, тормозят АВ проведение. Благодаря этим двум противонаправленным процессам урежение желудочкового ритма под воздействием этих препаратов умеренно выражено (сильнее – при назначении d,l–соталола ввиду его b -блокирующего действия, приводящего не только к возрастанию рефрактерности АВ–соединения, но и к усилению скрытого проведения в нем).
Из перечисленного выше при начале терапии МА очевидна необходимость учета исходных данных не только о частоте (и структуре) желудочкового ритма, но и о частоте волн ff. Ориентировочные данные о ней можно получить уже при анализе обычной ЭКГ в отведении V1 где хорошо видны волны мерцания. Период волн ff 0,15–0,20 с соответствует при записи со скоростью 25 мм/с ширине волн 3,5–5,0 мм. Точные данные можно получить с помощью специальной компьютерной программы, созданной для работы в среде Matlab 5,3 и позволяющей проводить анализ ЭКГ высокого разрешения в ортогональных отведениях по Франку (X, Y, Z). С помощью этой программы можно получить периодограмму волн ff, построить автокорреляционную функцию периодов волн ff, гистограмму интервалов RR, кардиоинтервалограмму и скатерограмму интервалов RR, рассчитать статистические параметры вариабельности желудочкового ритма.
Наиболее общие принципы назначения урежающих ритм препаратов в зависимости от характера предсердной активности и желудочкового ритма таковы:
На рисунке 1 представлен алгоритм индивидуального подбора урежающей терапии при постоянной форме МА в зависимости от ее исходных параметров. Прокомментируем этот алгоритм.
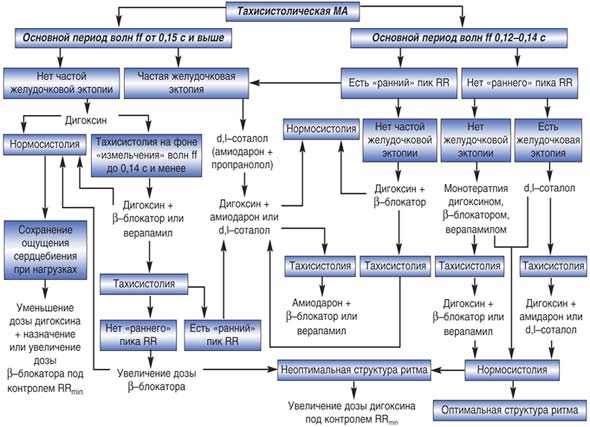
Рис. 1. Алгоритм подбора урежающей ритм терапии в зависимости от исходных параметров мерцательной аритмии
Как видно, при подборе терапии больным с тахисистолической формой МА прежде всего следует определить исходную величину периода волн ff.
А. При наличии крупных и средних волн ff (от 0,15 с) и отсутствии частой желудочковой экстрасистолии назначают дигоксин (средний темп дигитализации – 0,5 мг в сутки). При достижении нормосистолии (что сопровождается уменьшением периода волн ff, т. е. их учащением) и хорошем субъективном состоянии цель лечения достигнута. Если (что бывает чаще) сохраняется ощущение сердцебиения при нагрузках, к дигоксину добавляют b -блокатор (предварительно снизив дозу дигоксина), контролируя по динамике минимального интервала RR рефрактерность АВ–узла (RRmin должен находиться в пределах 50 мс и менее).
Если на фоне лечения дигоксином произошло уменьшение периода волн ff до 0,14 с и ниже, но сохраняется тахисистолия, к дигоксину (не уменьшая его дозы) добавляют также b -блокатор или верапамил, после чего можно получить хороший результат.
Этими вариантами обычно исчерпываются ситуации, с которыми сталкивается врач, начинающий терапию при исходных волнах ff крупных и средних (0,15–0,20 с.) периодов (и, соответственно, небольшой и средней частоте предсердной активности).
1) для поддержания высокой частоты волн ff (особенно при одновременном назначении антиаритмиков III класса);
2) для оптимизации структуры ритма;
3) для достижения кардиотонического эффекта.
Как видно из приведенных комментариев, несмотря на кажущуюся сложность алгоритма, количество возможных исходных вариантов МА и сопутствующих нарушений ритма не столь велико и поддается терапии в рамках более или менее стандартных правил.
Мы надеемся, что приведенные нами новые данные о механизме действия наперстянки при МА, как и другие наблюдения, лежащие в основе приведенных выше рекомендаций, послужат еще одной ступенью на пути оптимизации и научного подхода к терапевтической тактике при урежающей ритм терапии у больных с МА.
1. Егоров Д.Ф., Лещинский А.А., Недоступ А.В., Тюлькина Е.Е. Мерцательная аритмия (стратегия и тактика лечения на пороге XXI века). – Ижевск: Алфавит, 1998. – 413 с.
2. Недоступ А.В., Богданова Э.А., Михновский Е.И. Анализ структуры сердечного ритма при мерцании предсердий с помощью специализированной ЭВМ. Кардиология, 1975, №1: с.64–69.
3. Недоступ А.В., Богданова Э.А., Платонова А.А. и др.: Анализ структуры сердечного ритма при дигиталисной терапии больных с мерцательной аритмией. Кардиология, 1977, №4: с. 85–90.
4. Недоступ А.В., Богданова Э.А., Платонова А.А. Изучение процесса фибрилляции предсердий в клинической практике с применением статистических методов анализа. Кардиология, 1980, №10: с. 73–78.
ЭКГ при передозировке гликозидов. Дифференциация передозировки сердечных гликозидов
На ЭКГ 17/II предсердий с брадиаритмией желудочков (около 50 в 1 мин.) и альтернаций желудочкового комплекса. Сегмент RS - TV5 значительно смещен вниз и переходит в асимметричный отрицательный зубец Т. Развитие мерцательной брадиаритмии с выраженной альтернацией QRS на фоне продолжающейся терапии дигоксином следует расценить как выраженную гликозидную интоксикацию миокарда (сочетание мерцательной аритмии с А - V блокадой высокой степени).
На ЭКГ, снятой 21/II, через 4 дня после отмены дигоксина, синусовый ритм (первые три цикла) с замедлением А - V проводимости переходит, вероятно, вследствие неполной СА блокады 2:1 в А - V диссоциацию с синусовой брадиаритмией предсердий и А - V ритмом желудочковых сокращений. Последний цикл, вероятно, синусовый захват. Отмена гликозида привела к восстановлению синусового ритма. Однако угнетение синусового автоматизма еще выражено, что обусловило проявление эктопического автоматизма А - V соединения (диссоциация с интерференцией).
На ЭКГ 4/III вновь установился синусовый ритм, 63—67 в 1 мин. Р - Q = 0,24 — 0,25 сек. Сегмент RS - Т, опущен меньше, чем на первой кривой, и форма его не характерна для действия гликозидов. Зубец Т положительный. Интервал Q - Т = 0,38 сек. (нормальный). Характеристики интервала Q - Т, сегмента RS - Т и зубца Т на последней ЭКГ позволяют исключить влияние гликозидов, тем более что больная не принимает дигоксина уже более 2 недель. В связи с этим замедление А - V проводимости не следует рассматривать как результат передозировки гликозидов.
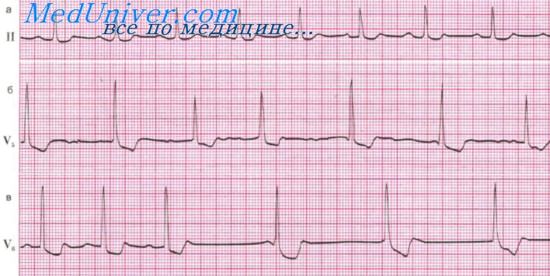
Заключение. Мерцательная аритмия, тахисистолическая форма. Гипертрофия миокарда левого желудочка. Признаки передозировки гликозидов: единичная желудочковая экстрасистола, выраженная инверсия зубца Т, тахиаритмия на фоне характерного для действия гликозидов значительного смещения сегмента RS - Т. увеличенный зубец U.
Сердечные гликозиды при СН. Дигоксин и дигитализация при сердечной недостаточности
При назначении сердечных гликозидов необходимо выбрать препарат и начальную дозу для достижения дозы насыщения, подобрать оптимальную поддерживающую, разработать тактику замены препарата после операции, определить длительность лечения.
В настоящее время для лечения используются порошок листьев наперстянки, а также чистые кристаллические гликозиды: изоланид, дигоксин, дигитоксин. Большинство кардиологов отдают предпочтение чистым глюкозидам, которые точно дозируются, отличаются быстрым действием и обладают высокой степенью элиминации.
Применение порошка дигиталиса перед операцией надо признать менее целесообразным, чем чистых гликозидов, учитывая его отрицательные свойства: трудность дозировки, высокие кумулятивные свойства. Поэтому по возможности мы назначаем детям чистые глюкозиды.
Дигоксин выпускается в таблетках по 0,25 мг, в растворе (1 мл=1 мг) и ампулах, содержащих 0,5 мг, которые можно применять внутривенно и внутримышечно. Необходимо отметить, что раствор дигоксина, применяемый внутрь, обладает очень высокой активностью (0,2 мг в 1 капле). Поэтому следует назначать его в таблетках и в инъекциях.

Ритм из АВ-соединения у пациента, получавшего дигоксин по поводу фибрилляции предсердий (ФП).
Содержание дигоксина в плазме крови 5,9 нмоль/л.
Дигоксин обладает хорошей всасываемостью (по сравнению с изоланидом выше на 50—70%), быстрым действием и высокой степенью элиминации, поэтому опасность кумуляции меньше, чем при применении порошка дигиталиса. Изоланид по своей эффективности уступает дигоксину, хотя, по данным П. Г. Кишш (1962), Сороди и Пинтер, примененный внутримышечно и внутривенно, он обладает такой же эффективностью, как и дигоксин.
В настоящее время различают два метода дигитализации: быстрый, при котором полная терапевтическая доза вводится в течение суток или одномоментно, и медленный, когда доза насыщения вводится в течение нескольких дней (Б. Е. Вотчал, Н. И. Никифорова, 1951; П. Г. Кишш; Taussig, Engle, 1964, и др.). При необходимости быстрой дигитализации большинство авторов отдают предпочтение чистым глюкозидам.
У детей раннего возраста Taussig (1957) и другие рекомендуют для дигиталиса следующие дозы насыщения: от 30 до 45 мг/кг, в редких случаях (при пароксизмальной тахикардии) до 60;: поддерживающие дозы составляют Vio дозы насыщения в сутки; П. Г. Кишш применяет 25—30 мг/кг веса. Для дигоксина Taussig рекомендует дозу насыщения, равную 0,05—0,075 мг/кг веса, поддерживающую — половине начальной дозы; соответственно 0,03—0,04 и 1/4 дозы насыщения; парентерально она предлагает дозу 0,02-0,03 мг/кг веса с поддерживающей дозой, равной 1/5 дозы насыщения.
М. П. Чернова считает, что при назначении дозы сердечных глюкозидов следует учитывать степень нарушения кровообращения.
Мы применяем дигоксин per os из расчета 0,05—0,06 мг/кг веса, поддерживающая доза составляет 1/3 дозы насыщения. Для изоланида большинство авторов рекомендуют дозу насыщения 0,02—0,03 мг/кг веса, поддерживающая равна 1/2—1/3 дозы насыщения.
При применении сердечных глюкозидов необходимы строгое наблюдение и электрокардиографический контроль. Эффект лечения выражается в уменьшении одышки, тахикардии, размеров печени, увеличении диуреза, уменьшении отеков. На ЭКГ отмечаются умеренное урежение сердечных сокращений, умеренное удлинение интервала Р—Q, снижение зубца Т, укорочение интервала Q—Т. Длительность лечения сердечными гликозидами строго индивидуальна.
Читайте также:

