Дисбактериоз кишечника вызванный синегнойной палочкой
Обновлено: 15.04.2024
Изучение микрофлоры кишечника началось в 1886 г., когда F. Escherich описал кишечную палочку (Bacterium coli communae). В 1908 году Нобелевский лауреат русский ученый Илья Ильич Мечников доказал необходимость кишечных бактерий для здоровья и долголетия. К
Изучение микрофлоры кишечника началось в 1886 г., когда F. Escherich описал кишечную палочку (Bacterium coli communae). В 1908 году Нобелевский лауреат русский ученый Илья Ильич Мечников доказал необходимость кишечных бактерий для здоровья и долголетия. К настоящему времени в кишечнике здорового человека установлено наличие 500 видов микробов. Нормальная микробная флора является одним из барьеров на пути бактерий, попадающих в кишечник. Она стимулирует иммунную защиту, увеличивает секрецию IgA в просвет кишки. Кишечные палочки, энтерококки, бифидобактерии, ацидофильные палочки обладают антагонистическими свойствами и способны подавлять рост патогенных микроорганизмов. Нарушение состава микрофлоры приводит к снижению сопротивляемости организма кишечным инфекциям.
Различают мукоидную микрофлору (М-микрофлора) — микроорганизмы, ассоциированные со слизистой оболочкой кишечника, и полостную микрофлору (П-микрофлору) — микроорганизмы, локализующиеся в просвете кишечника.
По отношению к макроорганизму представителей кишечного биоценоза делят на 4 группы:
облигатная микрофлора (основная микрофлора кишечника — бифидобактерии, лактобациллы, нормальные кишечные палочки, пропионобактерии, пептострептококки, энтерококки);
факультативная (условно-патогенные и сапрофитные микроорганизмы — бактероиды, стафилококки, стрептококки, пептококки, дрожжеподобные грибы, вейонеллы, фузобактерии, бациллы);
транзиторная (случайные микроорганизмы, не способные к длительному пребыванию в организме, — флавобактерии, псевдомонады);
При утилизации микробами неперевариваемых углеводов (клетчатки) образуются короткоцепочечные жирные кислоты. Они обеспечивают клетки кишки энергоносителями, улучшая трофику слизистой оболочки. Недостаточное количество клетчатки в диете ведет к снижению синтеза короткоцепочечных жирных кислот. В результате возникают дистрофические изменения эпителия и повышается проницаемость кишечного барьера для антигенов пищевого и микробного происхождения.
Под влиянием микробных ферментов в подвздошной кишке происходит деконъюгация желчных кислот (ЖК) и преобразование первичных ЖК во вторичные ЖК. В физиологических условиях 80–95% ЖК реабсорбируется, остальные выделяются с калом в виде метаболитов. Последние способствуют формированию каловых масс, тормозят всасывание воды, препятствуя излишней дегидратации кала. Избыточное бактериальное обсеменение тонкой кишки ведет к преждевременной деконъюгации ЖК и секреторной диарее.
Таким образом, морфологическое и функциональное состояние кишечника зависит от состава его микрофлоры.
В тощей кишке здоровых людей находится до 100 000 бактерий в 1 мл содержимого. Основную часть их составляют стрептококки, стафилококки, молочнокислые палочки. В дистальном отделе подвздошной кишки количество микробов увеличивается за счет энтерококков, кишечной палочки, бактероидов и анаэробных бактерий.
Микробный состав кала не отражает полную картину кишечного биоценоза, не дает оперативной информации о составе микроорганизмов в кишечнике. На практике учитываются данные лишь о 15–20 видах микробов, содержащихся в кале. Обычно исследуют количество бифидобактерий, лактобацилл, энтеробактерий, кишечных палочек, протея, энтерококка, золотистого стафилококка, синегнойной палочки и кандид.
Степень тяжести дисбиоза определяется степенью снижения бифидобактерий и других облигатных микроорганизмов и повышения числа условно-патогенных и патогенных видов.
I степень — снижение количества облигатных представителей (бифидобактерий и/или лактобацилл) на 1–2 порядка, без увеличения условно-патогенной микрофлоры (УПМ), нарастание количества УПМ при нормальном числе бифидобактерий. II степень — умеренное или значительное снижение числа бифидобактерий, сочетающееся с выраженными изменениями аэробной микрофлоры (редукция лактобацилл, появление измененных форм кишечной палочки, УПМ в высоких количествах). III степень — большое количество УПМ как одного вида, так и в ассоциациях, выделение патогенных микроорганизмов (Мехтиев С. Н., Гриневич В. Б., Захаренко С. М.).
В клинике дисбиоза выделяют следующие ключевые синдромы:
интестинальный синдром (вздутие живота, урчание кишечника, склонность к запорам или жидкий стул с непереваренными остатками пищи);
вторичный синдром мальабсорбции (упорная диарея с нарушением всасывания моносахаридов, электролитов),
Новые подходы в диагностике дисбиоза
Альтернативу рутинным бактериологическим исследованиям составляют химические методы дифференциации микроорганизмов и, в частности, газовая хроматография (ГХ) в сочетании с масс-спектрометрией (ГХ-МС). Метод основан на определении компонентов бактериальных клеток, появляющихся в результате их естественного отмирания или атаки иммунной системы. В качестве маркеров используют минорные липидные компоненты мембран микробов. По их содержанию можно в течение нескольких часов определить до 170 видов бактерий и грибов в различных биосредах.
Почти 50% биомассы пристеночной микрофлоры составляют актиномицеты, занимающие промежуточное положение между бактериями и грибами. Около 25% микробной флоры представлено аэробными кокками (стафилококки, стрептококки, энтерококки и коринеформные бактерии). Число бифидо- и лактобацилл колеблется от 20 до 30%. Другие анаэробы (пептострептококки, бактероиды, клостридии, пропионобактерии) составляют около 10% в тонкой и до 20% в толстой кишке. На долю энтеробактерий приходится 1% от суммарной численности микрофлоры слизистой оболочки.
До 90–95% микробов толстой кишки составляют анаэробы (бифидобактерии и бактероиды) и только 5–10% всех бактерий — строгая аэробная и факультативная флора (молочнокислые и кишечные палочки, энтерококки, стафилококки, грибы, протей).
Свойства микробов, населяющих кишечник, не всегда учитываются при назначении антибиотиков. Антибактериальные препараты подавляют рост не только патогенных микроорганизмов, но и нормальную микрофлору. В результате размножаются сапрофитные микробы с высокой устойчивостью к лекарственным препаратам, приобретающие патогенные свойства.
Диарея, ассоциированная с применением антибиотиков
У больных, получающих антибактериальную терапию, может развиваться диарея, вызванная дисбиозом кишечника (ААД — антибиотик-ассоциированная диарея). Частота такой диареи колеблется в пределах 5–25%. Причиной ее является снижение количества микробов, чувствительных к антибиотику, и появление резистентных штаммов, отсутствующих в норме. Наиболее известным представителем таких микроорганизмов является патогенный штамм Clostridium difficile (Cl. difficile), но причиной диареи, ассоциированной с антибиотиками, могут быть и другие микробы, способные усиливать секрецию ионов и воды, повреждать стенку кишки. Это стафилококки, протей, дрожжевые грибы, энтерококки, синегнойная палочка, клебсиелла. По типу диареи ААД обычно относят к секреторному и воспалительному типам.
Антибиотик-ассоциированную диарею наиболее часто вызывают линкомицин, ампициллин, клиндамицин, бензилпенициллин, цефалоспорины, тетрациклины, эритромицин. Способ введения антибиотика не имеет большого значения. При приеме внутрь помимо эрадикации микроорганизмов происходит воздействие антибиотика на слизистую оболочку тонкой кишки. При парентеральном введении антибиотики воздействуют на биоценоз кишечника, выделяясь со слюной, желчью, секретами тонкой и толстой кишок.
Симптомы ААД у большинства больных обычно появляются во время лечения, а у 30% — в пределах 7–10 дней после его прекращения.
Этиологическим фактором ААД большинство исследователей считают клостридии, в частности Cl. difficile. Среди взрослого населения уровень ее носительства низкий и равен 2–3%. Условиями размножения Cl. difficile являются анаэробная среда и угнетение нормальной микрофлоры кишечника.
Клинические проявления ААД варьируют от легкой диареи до тяжелого псевдомембранозного колита (ПМК). ПМК — острое заболевание кишечника, являющееся осложнением антибактериальной терапии. Установлено, что его вызывает Cl. difficile.
Симптоматика
Основным симптомом ААД является обильная водянистая диарея, началу которой предшествует назначение антибиотиков в течение нескольких дней и более. Затем появляются схваткообразные боли в животе, стихающие после стула. В случаях, когда возникает лихорадка, в крови нарастает лейкоцитоз, а в кале появляются лейкоциты, нужно заподозрить ПМК.
После отмены антибиотика у ряда больных симптомы быстро исчезают. При ПМК, несмотря на прекращение антибиотикотерапии, в большинстве случаев частота стула растет, появляются дегидратация и гипопротеинемия. В тяжелых случаях быстро наступает обезвоживание, развиваются токсическое расширение и перфорация толстой кишки, возможен летальный исход.
Диагноз
Диагноз ААД устанавливают на основании связи диареи с применением антибиотиков. Диагноз ПМК подтверждается бактериологическим исследованием кала и определением в нем токсина Cl. difficile. Частота обнаружения токсина в кале больных с ААД не превышает 15%.
У больных диареей, ассоциированной с Cl. difficile, наблюдается значительный лейкоцитоз. Имеются данные, что у больных с лейкоцитозом 15800 и выше высока вероятность развития ПМК, вызванного Cl. difficile. Это объясняется тем, что токсин А, выделяемый Cl. difficile, вызывает воспаление, секрецию жидкости, лихорадку и судороги. Поэтому у всех больных с ААД, протекающей с интоксикацией и лейкоцитозом 15800 и выше, следует считать причиной диареи Cl. difficile.
Парфенов А. И., Осипов Г. А., Богомолов П. О применили метод ГХ-МС для оценки состава микробной флоры тонкой кишки у 30 больных ААД и установили, что диарея может быть связана не только с инфекционным агентом (Cl. difficile), но с существенным изменением нормальной микрофлоры в сторону увеличения численности от 7 до 30 из 50 контролируемых микроорганизмов. При этом общая колонизация тонкой кишки увеличивается в 2–5 раз по сравнению с нормой.
У больных ААД чаще всего морфологические изменения толстой кишки отсутствуют. В тяжелых случаях при эндоскопии выявляют 3 типа изменений: 1) катаральное воспаление (отек и гиперемия) слизистой оболочки; 2) эрозивно-геморрагическое поражение; 3) псевдомембранозное поражение.
Дифференциальный диагноз
Связь диареи с антибиотикотерапией обычно не создает трудностей в диагностике ААД. В тяжелых случаях картина ПМК может напоминать холеру или фульминантную форму язвенного колита, болезнь Крона. Однако для последних характерна более или менее выраженная кровавая диарея, нехарактерная для ПМК. Тем не менее возможность развития эрозивно-геморрагических изменений слизистой оболочки при ААД не исключает появления кровянистых выделений из прямой кишки у некоторых больных.
Лечение ААД
Этиотропной терапией ААД и ПМК, вызванных Cl. difficile, большинство авторов считает назначение ванкомицина и метронидазола (трихопола, метрогила).
Немедленно отменяют антибиотик, вызвавший диарею. Назначают ванкомицин в начальной дозе 125 мг внутрь 4 раза в сутки, при необходимости дозу увеличивают до 500 мг 4 раза в сутки. Лечение продолжают в течение 7–10 сут. Метронидазол дают по 0,5 г внутрь 2 раза в сутки (или по 0,25 г 4 раза в сутки).
Применяют также бацитрацин по 25 тыс. ME внутрь 4 раза в сутки. Лечение проводят в течение 7–10 сут. Бацитрацин почти не всасывается, в связи с чем в толстой кишке создается высокая концентрация препарата. При обезвоживании применяют инфузионную терапию и оральную регидратацию (Регидрон, Цитроглюкосолан). Для связывания токсина А назначают Холестирамин.
Поскольку количество микробов, обеспечивающих лечебный эффект, на несколько порядков превышает дозы обычных бакпрепаратов, обсуждается вопрос о локальной доставке пробиотиков в кишечник. Это можно делать с помощью клизм на основе солевых растворов, через назодуоденальный зонд или колоноскоп. Привлекает внимание последний способ, т. к. как при этом пробиотики вводятся непосредственно в проксимальный отдел ободочной кишки.
Линекс содержит молочнокислые бактерии, резистентные к действию антибиотиков. Взрослым и детям старше 12 лет назначают по 2 капсулы 3 раза/сут после еды, запивая небольшим количеством жидкости. Длительность лечения составляет в среднем 1–2 мес. При применении препарата в рекомендуемых дозах побочное действие не отмечено. Противопоказания — повышенная чувствительность к компонентам препарата или молочным продуктам. Проведенные исследования не выявили наличия у Линекса тератогенного действия, не сообщалось об отрицательном влиянии препарата при беременности и в период лактации. Для сохранения жизнеспособности компонентов препарата не рекомендуется запивать Линекс горячими напитками, следует воздерживаться от употребления алкоголя.
Клинические проявления аллергии на молочнокислые бактерии сходны с проявлениями аллергии на молочные продукты, поэтому при появлении симптомов аллергии прием препарата следует прекратить для выяснения ее причин. О случаях передозировки Линекса не сообщалось. Не отмечено его нежелательного взаимодействия с другими препаратами. Состав препарата Линекс позволяет принимать его одновременно с антибактериальными средствами.
Для симптоматического лечения диареи применяются также: адсорбент аттапульгит, по 1,2–1,5 г после каждого жидкого стула; лоперамид, 2–4 мг внутрь после каждой дефекации (не более 8 мг/сут); дифеноксилат/атропин (Ломотил), 5 мг внутрь 4 раза в сутки до прекращения поноса; настойка белладонны, 5–10 капель внутрь 3 раза в сутки перед едой; гиосциамин (Левсин) 0,125 мг под язык по мере необходимости или по 0,375 мг внутрь 2 раза в сутки; спазмолитик дицикловерин, 20 мг внутрь 4 раза в сутки; кодеин, 30 мг внутрь 2–4 раза в сутки; октреотид (100–600 мг/сут п/к в 2–4 приема) — синтетический аналог соматостатина; энтеросорбенты (Смекта, Эспумизан).
Лечение собственно дисбиоза
Стандартная терапия дисбиоза нацелена на устранение избыточного бактериального обсеменения тонкой кишки, восстановление нормальной микрофлоры, улучшение кишечного пищеварения и всасывания, восстановление моторики кишечника и повышение иммунореактивности организма.
Антибактериальные препараты применяют по показаниям для подавления роста патогенной микрофлоры в тонкой кишке. Обычно назначают антибиотики из группы фторхинолонов, пенициллинов, цефалоспорины, тетрациклины или метронидазол. Препараты принимают внутрь в обычных дозах в течение 7–10 дней.
Оптимальным является использование средств, оказывающих минимальное влияние на симбионтную микрофлору и подавляющих рост протея, стафилококков, дрожжевых грибов и других агрессивных штаммов. К ним относятся антисептики: Интетрикс, Энтерол, Бактисубтил, Нифуроксазид и др. При тяжелых формах стафилококкового дисбиоза применяют антибиотики: офлоксацин, оксациллин, амоксициллин. Их назначают на срок 10–14 дней. В случае появления в кале или кишечном соке грибов показано применение натамицина, флуконазола и иных микостатиков.
Бактериальные препараты (пробиотики) можно назначать без предварительной антибактериальной терапии или после нее. Применяют Бифидумбактерин, Пробифор, Бификол, Лактобактерин, Линекс, Бифиформ, Нормофлорины Л, Д, Б, Полибактерин, Наринэ, Аципол, Нутролин В, Тревис.
Еще один способ лечения дисбиоза — воздействие на патогенную микробную флору продуктами метаболизма нормальных микроорганизмов (пребиотиками). Один из таких препаратов — Хилак-форте, стерильный концентрат продуктов обмена веществ нормальной микрофлоры: молочная кислота, лактоза, аминокислоты и жирные кислоты. Эти вещества способствуют восстановлению биологической среды в кишечнике, необходимой для существования нормальной микрофлоры, подавляют рост патогенных бактерий, улучшают трофику и функцию эпителиоцитов и колоноцитов. Один миллилитр препарата содержит биологически активные вещества 100 миллиардов нормальных микроорганизмов. Хилак-форте назначают по 60 капель 3 раза в день на срок 4 нед в сочетании с антибактериальными препаратами или после их применения.
Кроме того, применяется сироп лактулозы (Дюфалак, Порталак), подкисляющий кишечный сок и угнетающий рост патогенной микрофлоры. Активное вещество — синтетический дисахарид, который не гидролизуется в тонкой кишке и поступает в ободочную кишку в неизмененном виде, где расщепляется под действием флоры толстой кишки с образованием низкомолекулярных органических кислот, что приводит к снижению рН содержимого кишечника.
Под действием препарата увеличивается поглощение аммиака толстой кишкой и выведение его из организма, стимулируется рост ацидофильных бактерий (в т. ч. лактобактерий), подавляется размножение протеолитических бактерий и уменьшается образование азотсодержащих токсических веществ. Клинический эффект наступает через 2 дня лечения. Препарат в форме сиропа для приема внутрь назначают взрослым в дозе 15–45 мл/сут, поддерживающая доза равна 10–25 мл/сут. Препарат следует принимать 1 раз/сут утром во время еды, с водой, любой другой жидкостью или пищей.
Побочное действие со стороны пищеварительной системы: в первые дни — метеоризм (проходящий самостоятельно через 2 дня); при длительном применении в высоких дозах возможны боли в области живота, диарея. Противопоказания: галактоземия; непроходимость кишечника; повышенная чувствительность к компонентам препарата. Лактулозу можно применять при беременности и в период лактации по показаниям. Препарат следует с осторожностью назначать больным сахарным диабетом.
Из других пребиотиков нужно отметить кальция пантотенат (участвует в процессах ацетилирования и окисления в клетках, углеводном и жировом обмене, синтезе ацетилхолина, утилизируется бифидобактериями и способствует увеличению их массы), аминометилбензойную кислоту (Памба, Амбен) — ингибитор фибринолиза, подавляет протеолитические ферменты условно-патогенных бактерий, стимулируя рост нормальной микрофлоры, лизоцим (обладает бифидогенным, иммуномодулирующим, противовоспалительным действием, улучшает пищеварение, подавляет патогенную флору).
В лечении дисбиоза рекомендуется использовать фитопрепараты. Они являются кишечными антисептиками, подавляют патогенную и сохраняют сапрофитную микрофлору. Фитосборы нормализуют аппетит, улучшают пищеварение, моторику кишечника, оказывают противомикробное и иммуномодулирующее действие, способствуют регенерации слизистой оболочки. Выраженный бактерицидный эффект дают зверобой, календула, эвкалипт, тысячелистник, лапчатка, шалфей, душица, брусника, подорожник. Иммунокорригирующее действие оказывают крапива, мелисса, мать-и-мачеха, подорожник, фиалка трехцветная, череда. Богаты витаминами брусника, крапива, малина, смородина, рябина, шиповник.
Больным с нарушенным полостным пищеварением назначают панкреатические ферменты (Креон, Панцитрат). С целью улучшения функции всасывания используют Эссенциале форте Н, лоперамид (Имодиум) и тримебутин.
Для повышения реактивности организма ослабленным больным при тяжелом дисбиозе целесообразно назначать Анаферон, Иммунал, Ликопид и другие иммуномодуляторы. Курс лечения должен продолжаться в среднем 4 нед. Одновременно назначают витаминно-минеральные комплексы (Витаминерал, Алфавит и др.).
По вопросам литературы обращайтесь в редакцию.
В. В. Скворцов, доктор медицинских наук
ВолГМУ, Волгоград
МКБ-10
B96.5 Pseudomonas (aeruginosa) (mallei) (pseudomallei) как причина болезней, классифицированных в других рубриках
Общие сведения
Синегнойная инфекция впервые была описана в 1850 году французским хирургом Седилем. В 1882-м французскому военному фармацевту Жессару удалось выделить чистую культуру возбудителя, а в 1916 году стала известна эпидемиология данного заболевания. Болезнь распространена повсеместно, бактерий обнаруживают в почве, воде и на растениях. Четкая сезонность отсутствует. В стационарах излюбленной локализацией считается физиотерапевтическое и реанимационное оборудование. Группами риска являются недоношенные новорожденные, дети до 3-х месяцев, пожилые, пациенты отделений гемодиализа, химиотерапии, нейрохирургии и реанимации, больные с муковисцидозом и иммуносупрессией.

Причины
Возбудитель заболевания – синегнойная палочка (Pseudomonas aeruginosa) и её штаммы, представляет собой условно-патогенный микроорганизм, способный вызывать поражение только при отсутствии адекватного ответа иммунной системы. Источником инфекции служат больные люди и животные, бактерионосители, преимущественная локализация микроорганизма – кожа, кишечник. Заражение происходит воздушно-капельным и пищевым путем. Путь инфицирования при госпитальном заражении чаще контактный – через нестерильный инструментарий, руки медицинского персонала и предметы ухода за больными. Бактерия погибает при кипячении, во время автоклавирования, а также при воздействии 3% перекиси водорода и хлорсодержащих дезинфектантов.
Патогенез
При попадании микробов на поврежденную кожу или слизистую оболочку возникает массивная деструкция тканей, обусловленная воздействием экзотоксинов и продуцируемых бактериями веществ. В норме слизистая организма способна нивелировать воздействие синегнойной палочки ввиду мукоцилиарного клиренса и механического барьера. Привлечение нейтрофилов и активный фагоцитоз усиливают образование множества антибактериальных цитокинов, ферментов и свободных радикалов, служат активаторами системы комплемента и других звеньев гуморального иммунитета.
От 33 до 83% штаммов синегнойной палочки имеют эволюционно обусловленный механизм защиты от иммунной системы – образование биопленок, состоящих из скопления пораженных клеток и внеклеточного матрикса, включающего фибрин, секреторное отделяемое слизистых, альгинат, полисахариды и липиды. Известно, что бактерии лизируют нейтрофилы, усиливая рост собственных биопленок.
Классификация
Поражения, вызываемые синегнойной палочкой, можно условно разделить на местные и генерализованные (септические). Некоторые виды, в том числе инфекции ЦНС, сердца и средостения развиваются вследствие диссеминации возбудителя. В зависимости от топологии воспалительного очага различают следующие формы синегнойной инфекции:
- Инфекция респираторного тракта. Пациенты, находящиеся на длительной искусственной вентиляции легких, в 30% случаев переносят трахеобронхит и в 24% – пневмонию синегнойной этиологии.
- Инфекция ЛОР-органов. Синуситы развивается редко, при этом до 40% хронических средних отитов приходится на долю синегнойной палочки.
- Инфекция ЖКТ. Проявляется в виде тяжелой диареи, нередко с летальным исходом среди детей до года. С возбудителем связывают около 16% послеоперационных перитонитов.
- Инфекция глаз. Связана с длительным применением контаминированных контактных линз и глазных капель, часто приводит к панофтальмиту.
- Инфекция мочевой системы. Наиболее вероятно развитие катетер-ассоциированного острого пиелонефрита. С данным возбудителем связывают до 13% случаев острого простатита.
- Инфекция кожи. Возникает после пребывания в бассейне со сниженной концентрацией дезинфицирующих средств, может поражать ногти, подкожную клетчатку, мышечные фасции с формированием некрозов.
- Раневая инфекция. Составляет до 10% всех боевых инфекционных осложнений, становится причиной около 30% гнойных процессов при ожоговой болезни. Считается поддерживающим фактором формирования трофических язв.
Симптомы синегнойной инфекции
Инкубационный период патологии крайне вариабелен, может составлять от нескольких суток до десятилетий, поскольку микроорганизм является одним из условно-патогенных компонентов микрофлоры человека. Клинические проявления зависят от пораженного органа. У взрослых при инвазии пищеварительного тракта первыми симптомами являются лихорадка (не более 38,5° C), снижение аппетита, озноб, слабость, тошнота, реже рвота, вздутие и болезненность живота, частый кашицеобразный стул с кровью и слизью.
Маленькие дети при поражении ЖКТ становятся вялыми, сонливыми, отказываются от еды и питья, срыгивают, гастроэнтероколит протекает с высоким риском кишечного кровотечения. Синегнойная патология ЛОР-органов проявляется лихорадкой 37,5° C и выше, резкой болью в ухе, снижением слуха, желто-зеленым обильным отделяемым, иногда с примесью крови. Поражение дыхательного тракта протекает в форме пневмонии – с повышением температуры тела более 38° C, нарастающей одышкой, кашлем с обильной слизисто-гнойной мокротой.
Псевдомонадная инфекция мочевыводящей системы характеризуется лихорадкой, болями в пояснице, частыми болезненными мочеиспусканиями, чувством неполного опорожнения мочевого пузыря, изменением цвета и запаха мочи. Глазные симптомы инвазии синегнойной палочки чаще выявляются в области одного глазного яблока, начинаются с появления рези, болей, чувства жжения, инородного тела, слезотечения, светобоязни и слизисто-гнойного обильного отделяемого. В дальнейшем может возникать снижение и помутнение зрения.
Поражение кожи проявляется высыпаниями в виде пятен и гнойничковых элементов по всему телу, включая сыпь на ладонях, подошвах и в носоглотке, увеличением лимфоузлов, постоянными головными болями (так называемая головная боль пловцов), зеленой окраской одной, реже двух ногтевых пластин, образованием болезненных уплотнений в подкожно-жировой клетчатке. Раневая инфекция возбудителя сопровождается появлением сине-зеленого гнойного отделяемого и гнойно-геморрагических корочек, увеличением зоны покраснения вокруг раны.
Осложнения
Мультисистемность и клиническое разнообразие симптомов синегнойной инфекции отражается на количестве осложнений данного состояния. К наиболее частым негативным последствиям относят генерализацию инфекционного процесса, инфекционно-токсический шок, у грудных детей – некротический колит. Высока вероятность абсцедирования и гангренозных изменений. Вялотекущее течение инфекции на слизистых уха, ротоглотки, носа, конъюнктивы и легких приводит к хронизации воспалительного процесса, формированию мезотимпанита, бронхоэктазов, ползучей язвы роговицы, частичной или полной глухоты, односторонней слепоты.
Диагностика
Диагноз выставляется на основании данных, полученных в ходе консультации инфекциониста. При возникновении обширных гнойных поражений обязательна консультация хирурга, по показаниям приглашаются другие профильные специалисты. Наиболее распространенными диагностическими методами подтверждения псевдомонадной этиологии болезни являются следующие инструментальные и лабораторные исследования:
- Физикальное обследование. При объективном осмотре обращают внимание на цвет раневого отделяемого, наличие сыпи. Поражение наружного уха, глаз проявляется гиперемией, обильным слизисто-гнойным отделяемым. В легких при пневмонии выслушивается ослабление дыхания, при перкуссии – притупление звука. В случае гастроэнтероколита обнаруживается болезненность по ходу кишечника, урчание; обязательно проводится визуальная оценка испражнений.
- Лабораторные исследования. Общеклинический анализ крови свидетельствует о наличии лейкоцитоза, палочкоядерного сдвига влево, ускорения СОЭ. В биохимических параметрах наблюдается увеличение АЛТ, АСТ, СРБ, снижение общего белка, гипоальбуминемия. В общем анализе мочи возможна протеинурия, гематурия. Анализ мокроты подтверждает большое число бактерий и лейкоцитов. В ликворограмме при поражениях головного мозга выявляется нейтрофильный плеоцитоз, клеточно-белковая диссоциация.
- Выявление инфекционных агентов. Золотым стандартом является бактериологическое исследование, осуществляемое в современных условиях методом масс-спектрометрии с обязательным определением антибактериальной чувствительности бактерии. Обнаружение возбудителя возможно с помощью ПЦР биологического материала из патологического очага. Серологическая диагностика (ИФА) выполняется неоднократно с промежутком не менее 10-14 суток для детекции роста титра антител.
- Инструментальные методики. Рентгенография органов грудной клетки, реже МРТ или КТ проводится с целью верификации легочных поражений, дифференциального диагноза. УЗИ органов брюшной полости, мочеполовой системы, мягких тканей, костей и забрюшинного пространства позволяет установить первичный очаг воспаления. Эхо-КГ показана при подозрении на инфекционный эндокардит. Колоноскопия, ФГДС назначаются с целью исключения новообразований пищеварительного тракта.
Дифференциальная диагностика синегнойной инфекции сложна ввиду многообразия клинических форм болезни. Наиболее распространенные поражения желудочно-кишечной системы дифференцируют с сальмонеллезом, шигеллезом и псевдомембранозным колитом. Кожные проявления отличают от гнойно-некротических поражений стрептококковой и стафилококковой этиологии. Инфекции дыхательной системы могут напоминать казеозную пневмонию при туберкулезе, саркоидоз, бактериальные воспаления легких. Причинами сепсиса могут быть различные вирусы, бактерии и грибы.
Лечение синегнойной инфекции
Стационарное лечение рекомендуется пациентам с органными поражениями, среднетяжелым и тяжелым течением болезни. Больные с нозокомиальной синегнойной инфекцией продолжают лечение в том отделении, где находились до манифестации инфекционного процесса, с обязательным проведением всех противоэпидемических мероприятий и санацией аппаратуры. Постельный режим необходим до устойчивого купирования лихорадки в течение 3-5 дней, его продолжительность зависит от степени инвазии, наличия осложнений и декомпенсации сопутствующих болезней. Специальная диета не разработана, рекомендован прием пищи с достаточным количеством белка, адекватный питьевой режим.
Средствами борьбы с инфекцией считаются гипериммунная антисинегнойная донорская плазма и противосинегнойный гамма-глобулин, Перечисленные препараты применяются реже в связи с возможным развитием сывороточной болезни, показаны при вялотекущем воспалительном процессе. Симптоматическое лечение включает дезинтоксикационную терапию, противовоспалительные и жаропонижающие средства. Хирургическое вмешательство необходимо при локализованных и разлитых гнойных процессах, заключается во вскрытии и дренировании гнойников, реже – ампутации конечности. Допускается местное применение раствора перекиси водорода, мазей с антибиотиками.
Прогноз и профилактика
Специфическая профилактика (поливалентная вакцина) показана медицинским работникам, ожоговым больным, пациентам с открытыми переломами и глубокими ранами, лицам с иммунным дефицитом, людям старческого возраста. Неспецифические меры сводятся к строгому соблюдению правил обработки медицинских инструментов и оборудования, контролю контаминации синегнойной палочкой персонала. Важны общеукрепляющие методы – закаливание, нормальный сон, полноценная еда, прогулки, физическая активность, неукоснительное соблюдение личной гигиены и своевременная санация гнойных очагов.
1. Pseudomonas aeruginosa: патогенность, патогенез и патология / Лазарева А.В., Чеботарь И.В.// Клиническая микробиология и антимикробная химиотерапия – 2015 – Т.17, №3.
3. Эпидемиология и профилактика синегнойной инфекции. Федеральные клинические рекомендации / Егорова О.Н., Брусина Е.Б. и др. – 2014.
Что понимают под дисбактериозом? Какие методы диагностики являются современными и достоверными? Какие лекарственные препараты применяются при дисбактериозе? Вкишечнике человека находится свыше 500 различных видов микробов, общее количество которых
Что понимают под дисбактериозом?
Какие методы диагностики являются современными и достоверными?
Какие лекарственные препараты применяются при дисбактериозе?
Вкишечнике человека находится свыше 500 различных видов микробов, общее количество которых достигает 10 14 , что на порядок выше общей численности клеточного состава человеческого организма. Количество микроорганизмов увеличивается в дистальном направлении, и в толстой кишке в 1 г кала содержится 10 11 бактерий, что составляет 30% сухого остатка кишечного содержимого.
Нормальная микробная флора кишечника
В тощей кишке здоровых людей находится до 10 5 бактерий в 1 мл кишечного содержимого. Основную массу этих бактерий составляют стрептококки, стафилококки, молочнокислые палочки, другие грамположительные аэробные бактерии и грибы. В дистальном отделе подвздошной кишки количество микробов увеличивается до 10 7 –10 8 , в первую очередь за счет энтерококков, кишечной палочки, бактероидов и анаэробных бактерий. Недавно нами было установлено, что концентрация пристеночной микрофлоры тощей кишки на 6 порядков выше, чем в ее полости, и составляет 10 11 кл/мл. Около 50% биомассы пристеночной микрофлоры составляют актиномицеты, примерно 25% — аэробные кокки (стафилококки, стрептококки, энтерококки и коринеформные бактерии), от 20 до 30% приходится на бифидобактерии и лактобациллы.
Количество анаэробов (пептострептококки, бактероиды, клостридии, пропионобактерии) составляет около 10% в тонкой и до 20% в толстой кишке. На долю энтеробактерий приходится 1% от суммарной микрофлоры слизистой оболочки.
До 90-95% микробов в толстой кишке составляют анаэробы (бифидобактерии и бактероиды), и только 5-10% всех бактерий приходится на строгую аэробную и факультативную флору (молочнокислые и кишечные палочки, энтерококки, стафилококки, грибы, протей).
Кишечные палочки, энтерококки, бифидобактерии и ацидофильные палочки обладают выраженными антагонистическими свойствами. В условиях нормально функционирующего кишечника они способны подавлять рост несвойственных нормальной микрофлоре микроорганизмов.
Площадь внутренней поверхности кишечника составляет около 200 м 2 . Она надежно защищена от проникновения пищевых антигенов, микробов и вирусов. Важную роль в организации этой защиты играет иммунная система организма. Около 85% лимфатической ткани человека сосредоточено в стенке кишечника, где продуцируется секреторный IgA. Кишечная микрофлора стимулирует иммунную защиту. Кишечные антигены и токсины кишечных микробов значительно увеличивают секрецию IgA в просвет кишки.
Расщепление непереваренных пищевых веществ в толстой кишке осуществляется ферментами бактерий, при этом образуются разнообразные амины, фенолы, органические кислоты и другие соединения. Токсические продукты микробного метаболизма (кадаверин, гистамин и другие амины) выводятся с мочой и в норме не оказывают влияния на организм. При утилизации микробами неперевариваемых углеводов (клетчатки) образуются короткоцепочечные жирные кислоты. Они обеспечивают клетки кишки энергоносителями и, следовательно, улучшают трофику слизистой оболочки. При дефиците клетчатки может нарушаться проницаемость кишечного барьера вследствие дефицита короткоцепочечных жирных кислот. В результате кишечные микробы могут проникать в кровь.
Под влиянием микробных ферментов в дистальных отделах подвздошной кишки происходит деконъюгация желчных кислот и преобразование первичных желчных кислот во вторичные. В физиологических условиях от 80 до 95% желчных кислот реабсорбируется, остальные выделяются с фекалиями в виде бактериальных метаболитов. Последние способствуют нормальному формированию каловых масс: тормозят всасывание воды и тем самым препятствуют излишней дегидратации кала.
Дисбактериоз
В понятие дисбактериоза кишечника входит избыточное микробное обсеменение тонкой кишки и изменение микробного состава толстой кишки. Нарушение микробиоценоза происходит в той или иной степени у большинства больных с патологией кишечника и других органов пищеварения. Следовательно, дисбактериоз является бактериологическим понятием. Он может рассматриваться как одно из проявлений или осложнение заболевания, но не самостоятельная нозологическая форма.
Крайней степенью дисбактериоза кишечника является появление бактерий желудочно-кишечного тракта в крови (бактериемия) или даже развитие сепсиса.
Состав микрофлоры кишечника нарушается при болезнях кишечника и других органов пищеварения, лечении антибиотиками и иммунодепрессантами, воздействиях вредных факторов внешней среды.
Клинические проявления дисбактериоза зависят от локализации дисбиотических изменений.
Дисбактериоз тонкой кишки
При дисбактериозе тонкой кишки численность одних микробов в слизистой оболочке тонкой кишки увеличена, а других уменьшена. Отмечается увеличение Eubacterium (в 30 раз), α-стрептококков (в 25 раз), энтерококков (в 10 раз), кандид (в 15 раз), появление бактерий рода Acinetobacter и вирусов герпеса. Уменьшается от 2 до 30 раз количество большинства анаэробов, актиномицетов, клебсиелл и других микроорганизмов, являющихся естественными обитателями кишечника.
Причиной дисбактериоза могут быть: а) избыточное поступление микроорганизмов в тонкую кишку при ахилии и нарушении функции илеоцекального клапана; б) благоприятные условия для развития патологических микроорганизмов в случаях нарушения кишечного пищеварения и всасывания, развития иммунодефицита и нарушений проходимости кишечника.
Повышенная пролиферация микробов в тонкой кишке приводит к преждевременной деконъюгации желчных кислот и потере их с калом. Избыток желчных кислот усиливает моторику толстой кишки и вызывает диарею и стеаторею, а дефицит желчных кислот приводит к нарушению всасывания жирорастворимых витаминов и развитию желчнокаменной болезни.
Бактериальные токсины и метаболиты, например фенолы и биогенные амины, могут связывать витамин В12.
Некоторые микроорганизмы обладают цитотоксическим действием и повреждают эпителий тонкой кишки. Это ведет к уменьшению высоты ворсинок и углублению крипт. При электронной микроскопии выявляется дегенерация микроворсинок, митохондрий и эндоплазматической сети.
Дисбактериоз толстой кишки
Состав микрофлоры толстой кишки может меняться под влиянием различных факторов и неблагоприятных воздействий, ослабляющих защитные механизмы организма (экстремальные климатогеографические условия, загрязнение биосферы промышленными отходами и различными химическими веществами, инфекционные заболевания, болезни органов пищеварения, неполноценное питание, ионизирующая радиация).
В развитии дисбактериоза толстой кишки большую роль играют ятрогенные факторы: применение антибиотиков и сульфаниламидов, иммунодепрессантов, стероидных гормонов, рентгенотерапия, хирургические вмешательства. Антибактериальные препараты значительно подавляют не только патогенную микробную флору, но и рост нормальной микрофлоры в толстой кишке. В результате размножаются микробы, попавшие извне, или эндогенные виды, устойчивые к лекарственным препаратам (стафилококки, протей, дрожжевые грибы, энтерококки, синегнойная палочка).
Клинические особенности дисбактериоза
Клинические проявления чрезмерного роста микроорганизмов в тонкой кишке могут полностью отсутствовать, выступать в качестве одного из патогенетических факторов хронической рецидивирующей диареи, а при некоторых болезнях, например, дивертикулезе тонкой кишки, частичной кишечной непроходимости или после хирургических операций на желудке и кишечнике, приводить к тяжелой диарее, стеаторее и В 12 -дефицитной анемии.
Особенностей клинического течения заболевания у больных с различными вариантами дисбактериоза толстой кишки, по данным бактериологических анализов кала, в большинстве случаев установить не удается. Можно отметить, что больные хроническими заболеваниями кишечника чаще инфицируются острыми кишечными инфекциями по сравнению со здоровыми. Вероятно, это связано со снижением у них антагонистических свойств нормальной микрофлоры кишечника и, прежде всего, частым отсутствием бифидобактерий.
Особенно большую опасность представляет псевдомембранозный колит, развивающийся у некоторых больных, длительно лечившихся антибиотиками широкого спектра действия. Этот тяжелый вариант дисбактериоза вызывается токсинами, выделяемыми синегнойной палочкой Clostridium difficile, которая размножается в кишечнике при угнетении нормальной микробной флоры.
Очень редко наблюдается молниеносное течение псевдомембранозного колита, напоминающее холеру. Обезвоживание развивается в течение нескольких часов и заканчивается летальным исходом.
Таким образом, оценка клинической значимости дисбиотических изменений должна основываться прежде всего на клинических проявлениях, а не только на результатах исследования микрофлоры кала.
Методы диагностики
Диагностика дисбактериоза представляет собой сложную и трудоемкую задачу. Для диагностики дисбактериоза тонкой кишки применяют посев сока тонкой кишки, полученного с помощью стерильного зонда. Дисбактериоз толстой кишки выявляют с помощью бактериологических исследований кала.
Микробная флора образует большое количество газов, в том числе водорода. Это явление используют для диагностики дисбактериоза. Концентрация водорода в выдыхаемом воздухе натощак находится в прямой зависимости от выраженности бактериального обсеменения тонкой кишки. У больных с заболеваниями кишечника, протекающими с хронической рецидивирующей диареей и бактериальным обсеменением тонкой кишки, концентрация водорода в выдыхаемом воздухе значительно превышает 15 ppm.
Для диагностики дисбактериоза применяют также нагрузку лактулозой. В норме лактулоза не расщепляется в тонкой кишке и метаболизируется микробной флорой толстой кишки. В результате количество водорода в выдыхаемом воздухе повышается (рис. 1).
Наиболее частыми бактериологическими признаками дисбактериоза толстой кишки являются отсутствие основных бактериальных симбионтов — бифидобактерий и уменьшение количества молочнокислых палочек. Увеличивается количество кишечных палочек, энтерококков, клостридий, стафилококков, дрожжеподобных грибов и протея. У отдельных бактериальных симбионтов появляются патологические формы. К ним относятся гемолизирующая флора, кишечные палочки со слабо выраженными ферментативными свойствами, энтеропатогенные кишечные палочки и т. д.
Углубленное изучение микробиоценоза показало, что традиционные методы не позволяют получить истинную информацию о состоянии микрофлоры кишечника. Из 500 известных видов микробов в целях диагностики обычно изучаются лишь 10-20 микроорганизмов. Важно, в каком отделе — в тощей, подвздошной или толстой кишках — исследуется микробный состав. Поэтому перспективы разработки клинических проблем дисбактериоза в настоящее время связывают с применением химических методов дифференциации микроорганизмов, позволяющих получить универсальную информацию о состоянии микробиоценоза. Наиболее широко для этих целей используются газовая хроматография (ГХ) и газовая хроматография в сочетании с масс-спектрометрией (ГХ-МС). Этот метод позволяет получить уникальную информацию о составе мономерных химических компонентов микробной клетки и метаболитов. Маркеры такого рода могут быть определены и использованы для детектирования микроорганизмов. Главным преимуществом и принципиальным отличием этого метода от бактериологических является возможность количественного определения более 170 таксонов клинически значимых микроорганизмов в различных средах организма. При этом результаты исследования могут быть получены в течение нескольких часов.
Проведенные нами исследования микробиоценоза в крови и биоптатов слизистой оболочки тонкой и толстой кишок у больных с синдромом раздраженного кишечника позволили обнаружить отклонения от нормы до 30-кратного увеличения или уменьшения многих компонентов. Существует возможность оценки изменений микрофлоры кишечника на основании данных анализа крови методом ГХ-МС-микробных маркеров.
Лечение
Лечение дисбактериоза должно быть комплексным (схема) и включать в себя следующие мероприятия:
- устранение избыточного бактериального обсеменения тонкой кишки;
- восстановление нормальной микробной флоры толстой кишки;
- улучшение кишечного пищеварения и всасывания;
- восстановление нарушенной моторики кишечника;
- стимулирование реактивности организма.
Антибактериальные препараты
Антибактериальные препараты необходимы в первую очередь для подавления избыточного роста микробной флоры в тонкой кишке. Наиболее широко применяются антибиотики из группы тетрациклинов, пенициллинов, цефалоспорины, хинолоны (таривид, нитроксолин) и метронидазол.
Однако антибиотики широкого спектра действия в значительной степени нарушают эубиоз в толстой кишке. Поэтому они должны применяться только при заболеваниях, сопровождающихся нарушениями всасывания и моторики кишечника, при которых, как правило, отмечается выраженный рост микробной флоры в просвете тонкой кишки.
Антибиотики назначают внутрь в обычных дозах в течение 7–10 дней.
При заболеваниях, сопровождающихся дисбактериозом толстой кишки, лечение лучше проводить препаратами, которые оказывают минимальное влияние на симбионтную микробную флору и подавляют рост протея, стафилококков, дрожжевых грибов и других агрессивных штаммов микробов. К ним относятся антисептики: интетрикс, эрсефурил, нитроксолин, фуразолидон и др.
При тяжелых формах стафилококкового дисбактериоза применяют антибиотики: таривид, палин, метронидазол (трихопол), а также бисептол-480, невиграмон.
Антибактериальные препараты назначают в течение 10–14 дней. В случае появления в кале или кишечном соке грибов показано применение нистатина или леворина.
У всех больных с диареей, ассоциированной с антибиотиками, протекающей с интоксикацией и лейкоцитозом, возникновение острой диареи следует связывать с Cl. difficile.
В этом случае срочно делают посев кала на Cl. difficile и назначают ванкомицин по 125 мг внутрь 4 раза в сутки; при необходимости доза может быть увеличена до 500 мг 4 раза в день. Лечение продолжают в течение 7-10 суток. Эффективен также метронидазол в дозе 500 мг внутрь 2 раза в сутки, бацитрацин по 25 000 МЕ внутрь 4 раза в сутки. Бацитрацин почти не всасывается, в связи с чем в толстой кишке можно создать более высокую концентрацию препарата. При обезвоживании применяют адекватную инфузионную терапию для коррекции водно-электролитного баланса. Для связывания токсина Cl. difficile используют холестирамин (квестран).
Бактериальные препараты
Живые культуры нормальной микробной флоры выживают в кишечнике человека от 1 до 10% от общей дозы и способны в какой-то мере выполнять физиологическую функцию нормальной микробной флоры. Бактериальные препараты можно назначать без предварительной антибактериальной терапии или после нее. Применяют бифидумбактерин, бификол, лактобактерин, бактисубтил, линекс, энтерол и др. Курс лечения длится 1-2 месяца.
Возможен еще один способ устранения дисбактериоза — воздействие на патогенную микробную флору продуктами метаболизма нормальных микроорганизмов. К таким препаратам относится хилак форте. Он создан 50 лет назад и до настоящего времени применяется для лечения больных с патологией кишечника. Хилак форте представляет собой стерильный концентрат продуктов обмена веществ нормальной микрофлоры кишечника: молочной кислоты, лактозы, аминокислот и жирных кислот. Эти вещества способствуют восстановлению в кишечнике биологической среды, необходимой для существования нормальной микрофлоры, и подавляют рост патогенных бактерий. Возможно, продукты метаболизма улучшают трофику и функцию эпителиоцитов и колоноцитов. 1 мл препарата соответствует биосинтетическим активным веществам 100 млрд. нормальных микроорганизмов. Хилак форте назначают по 40–60 капель 3 раза в день на срок до 4 недель в сочетании с препаратами антибактериального действия или после их применения.
Регуляторы пищеварения и моторики кишечника
У больных с нарушением полостного пищеварения применяют креон, панцитрат и другие панкреатические ферменты. С целью улучшения функции всасывания назначают эссенциале, легалон или карсил, т. к. они стабилизируют мембраны кишечного эпителия. Пропульсивную функцию кишечника улучшают имодиум (лоперамид) и тримебутин (дебридат).
Стимуляторы реактивности организма
Для повышения реактивности организма ослабленным больным целесообразно применять тактивин, тималин, тимоген, иммунал, иммунофан и другие иммуностимулирующие средства. Курс лечения должен составлять в среднем 4 недели. Одновременно назначаются витамины.
Профилактика дисбактериоза
Первичная профилактика дисбактериоза представляет очень сложную задачу. Ее решение связано с общими профилактическими проблемами: улучшением экологии, рациональным питанием, улучшением благосостояния и прочими многочисленными факторами внешней и внутренней среды.
Вторичная профилактика предполагает рациональное применение антибиотиков и других медикаментов, нарушающих эубиоз, своевременное и оптимальное лечение болезней органов пищеварения, сопровождающихся нарушением микробиоценоза.
Значит провести лечение (с учётом чувствительности) + повышение защитных сил организма (санация очагов возможной ЛОР-патологии, местные и системные средства повышения иммунитета) с учётом индивидуальных особенностей.


Здоавствуйте! Важно знать, в каком она количестве. Отслеживать. В случае уменьшения их титров в мазках и отсутствии клинической картины, можно обойтись только санацией местных очагов и не давать системного антибиотика. Важно также укреплять иммунную систему(богатое витаминами и минералами питание, поливитамины, прогулки на свежем воздухе и пр.).

Зависит от титров, т.е. количества. Скажу вам честно, от нее сложно избавиться. Поэтому делай все так, как предлагают врачи.



Здравствуйте. Это низкий титр, при нем не показан системный антибиотик. Можно орошать глотку Диоксидином 0,5%. Ампулу развести в 100мл воды, перелить в бутылку с насадкой (например из-под мирамистина) орошать по 3впрыска 3 раза в день, после еды 10 дней. Если есть ультрафиолетовый облучатель Солнышко, кварцуйтесь. Иммудон (если ребенку есть 3года) 6 таблеток в день рассасывать 20 дней.

То же хотела ниписать по поводу Диоксидина. Это местный антибиотик широкого спектра. Единственное проверьте на отсутствие аллергии перед применением. Можно нанести на предплечье разведенный раствор.
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Врага, как известно, надо знать в лицо. Просторы интернета принесли вот такое симпатичное фото нашего противника.
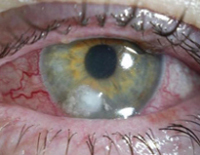
Данного возбудителя невозможно перепутать ни с чем, особенно, когда процесс зашел далеко. Практически все отделение будет в курсе наличия такого больного из-за непередаваемого аромата, разносящегося из его пораженных областей.
Pseudomonas aeruginosa бывает дикой, ее нам приносят пациенты из внешнего мира и нашей, госпитальной, которая живет внутри больничных отделений (чаще хирургических и реанимационных) и вызывает тот самый суеверный ужас практически у всех, обремененных медицинским образованием.
Синегнойная палочка является вольным жителем тех мест, где тепло и влажно. Она живет в прудах (дикая), в раковинах, в банках с фурацилином и другими дезенфектантами, диализных жидкостях и наркозных аппаратах в стационарах.
А потому, если в отделение что-то такое выросло, борьба с синегнойной инфекцией должна начинаться со смены сантехники (старой на новую) и линолеума вокруг раковины. С отказа от фурацилина, со сроком изготовления более суток и с просушивания трубок аппаратуры для вентиляции легких.
Больной у нас тоже теплый и, как и любой человек, на 70% состоит из воды. А еще у него множество вольных открытых пространства – мокнущие раневые поверхности, ожоговые раны, свищевые ходы, пролежни, цистостомы, трахеостомы, катетеры. То есть все те условия, которые палочка очень любит. А еще теплой и влажной поверхностью у нас является роговица глаза и если промедлить с лечением – этот самый глаз можно потерять за несколько часов.
- Гангренозную пневмонию
- Эмпиему
- Наружный отит
- Инфекции глаз (особенно после травм и хирургических вмешательств)
- Фурункулез (после горячих ванн)
- Септицемию
- Эндокардит
- Менингит
- Часто инфицирует ожоговые поверхности, свищевые ходы, изъязвленные пролежни.
Синегнойная инфекция развивается чаще всего на фоне иммуносупрессии или массированной антимикробной терапии, так как сам возбудитель природно устойчив абсолютному большинству антибактериальных препаратов, а массовая гибель конкурентов, дает ей селективное преимущество. Кстати, основными препаратами, селектирующими в отделениях Pseudomonas aeruginosa являются цефалоспорины третьего и четвертого поколений.
- на руках
- на общих полотенцах в ординаторских, процедурных и манипуляционных (многоразовых)
- на фонендоскопах
- на мобильных телефонах
- на авторучках, которые у нас торчат из карманов и т.д.
И достаточно в отделении появиться одному пациенту с этим возбудителем, а персоналу забыть о путях распространения – к вечеру все 100% пациентов будут обсеменены этим возбудителем. А дальше как повезет… пациентам…
Если инфицирование все-таки произошло, и у пациента возникла синегнойная инфекция, чем же мы будем ее лечить?
В этом списке нет цефоперазона и цефоперазона/сульбактама, о которых нам с института говорят, что они антисинегнойные. Дело в том, что единственным действительно антисинегнойным цефалоспорином является цефтазидим, а данные о якобы высокой чувствительности к цефоперазону и цефоперазону сульбактаму существуют только в России, так как нет ни одной рекомендации по использованию этих препаратов ни в США, ни на medscape.com, ни на EUCAST. Более того, эти источники не дают даже критериев определения чувствительности Pseudomonas aeruginosa к этим препаратам. И откуда взялись наши российские выводы о высокой чувствительности вообще не понятно. Более того, комбинация Цефоперазон/сульбактам существует только в 2-х странах – России и Турции. FDA в свое время очень быстро отменила его регистрацию.
Цефалоспорин третьего поколения. Препарат с явной и очень высокой антисинегнойной активностью. Первые несколько лет после появления он был самым мощным препаратом против грам(-) флоры. Однако в связи с увеличением количества как госпитальных, так и внебольничных беталактамаз расширенного спектра (БЛРС), его значение было пересмотрено и сейчас он используется в качестве индикатора для выявления БЛРС у грам(-) бактерий. Проще говоря, если кишечная палочка или клебсиелла устойчивы к цефтаздиму, то любой, сколь угодно большой диаметр зоны на чашке Петри вокруг диска с цефотаксимом или цефтриаксоном в расчет уже не принимаются.
Если антибиотикограммы еще нет, но есть пациент предлеченный цефтазидимом без эффекта, то не нужно выбирать ему препарат среди III генерации цефалоспоринов, по причине того, что использование их будет бесполезным, при этом, если пациента с грамотрицательной инфекцией лечили цефалоспоринами 2-3-й генерации, то вполне допустима терапия цефтазидимом, потому что, во-первых, он активен против синегнойки, а во вторых бета-лактамаза цефуроксимаза, рушит все цефалоспорины, но не цефтазидим.
Еще одной особенностью цефтазидима является его возможность создавать высокие концентрации в ликворе, проникая через гематоэнцефалический барьер, поэтому его используют для лечения менингитов, вызванных грамотрицательной микрофлорой, при условии чувствительности к нему возбудителей.
3. Карбопенемы обладают антисинегнойной активностью, но она слабее чем у цефтазидима и анисинегнойными они стали только из-за того, что существует Эртапенем, у которого нет никакой антисинегнойной активности. Да, применять можно, но только в комбинации с другими антисинегнойными препаратами.
4. Амикацин, как и все аминогликозиды, обладает более мощным бактерицидным действием, чем бета-лактамы и минимальным количеством аллергических реакций. Но он должен нами рассматриваться, как и другие антисинегнойные препараты, как препарат резерва и не использоваться широко в стационаре. Другие аминогликозиды прекрасно отработают Гр (-) флору и без него, нам важно сохранить чувствительность нашей, местной синегнойки к нему как можно дольше.
Дозируем амикацин, как вы помните, на килограмм массы тела и детям и взрослым и обязательно с учетом клиренса креатинина. (подробнее о дозировании смотрите обзорную статью по аминогликозидам, которая располагается по этой ссылке /vracham/Informatsiya-dlya-spetsialistov/Antibiotikoterapiya/Obzory-antibiotikov-razlichnyh-grupp/Obzory-antibiotikov-razlichnyh-grupp_411.html)
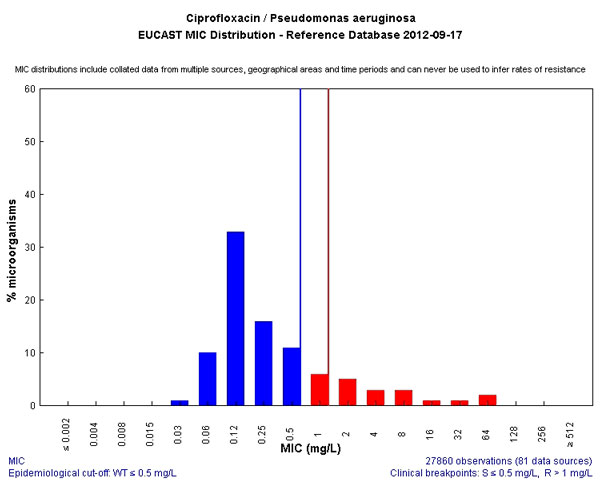
И, к сожалению, препарат, который нам скоро уничтожат коллеги из поликлинического звена, потому что назначают его направо и налево. Да и в стационарах коллеги грешат его необоснованным назначением, так как он относительно дешев и более чем доступен из-за огромного количества дженериков. Как результат, нам уже приходится использовать дозировки не 400 мг в сутки, а 800-1200 мг. И, слава богу, что механизм резистентности нам это еще позволяет. Является одним из самых безопасных антисинегнойных препаратов, а потому беречь его мы должны как самое дорогое.
Он может использоваться в стационаре в случаях не синегнойной инфекции только тогда, когда другим способом помочь пациенту невозможно.
Это препарат такого же глубокого резерва как амикацин. И может использоваться только под контролем клинического фармаколога в отличие от других фторхинолонов.
И один из самых страшных моих, и не только моих, кошмаров – это панрезистентная синегнойная палочка. Это та палочка которая устойчива абсолютно ко всем известным на данный момент антимикробным средствам и здесь мы совершенно бессильны. А потому наша основная цель состоит в том, чтобы не дать ей у нас в стационаре появиться. Для этого требуется соблюдать несложные правила асептики, а именно, мыть и обрабатывать руки после каждого пациента, менять перчатки, обрабатывать фонендоскопы и к пациентам с гнойным воспалением не заходить с мобильниками и чем либо еще, что мы можем схватить руками, сами того не замечая. Ну и никаких общих полотенец в ординаторских и сестренских.
Читайте также:

