Дисбактериоз при повышенной кислотности желудка
Обновлено: 18.04.2024
Что понимают под дисбактериозом? Какие методы диагностики являются современными и достоверными? Какие лекарственные препараты применяются при дисбактериозе? Вкишечнике человека находится свыше 500 различных видов микробов, общее количество которых
Что понимают под дисбактериозом?
Какие методы диагностики являются современными и достоверными?
Какие лекарственные препараты применяются при дисбактериозе?
Вкишечнике человека находится свыше 500 различных видов микробов, общее количество которых достигает 10 14 , что на порядок выше общей численности клеточного состава человеческого организма. Количество микроорганизмов увеличивается в дистальном направлении, и в толстой кишке в 1 г кала содержится 10 11 бактерий, что составляет 30% сухого остатка кишечного содержимого.
Нормальная микробная флора кишечника
В тощей кишке здоровых людей находится до 10 5 бактерий в 1 мл кишечного содержимого. Основную массу этих бактерий составляют стрептококки, стафилококки, молочнокислые палочки, другие грамположительные аэробные бактерии и грибы. В дистальном отделе подвздошной кишки количество микробов увеличивается до 10 7 –10 8 , в первую очередь за счет энтерококков, кишечной палочки, бактероидов и анаэробных бактерий. Недавно нами было установлено, что концентрация пристеночной микрофлоры тощей кишки на 6 порядков выше, чем в ее полости, и составляет 10 11 кл/мл. Около 50% биомассы пристеночной микрофлоры составляют актиномицеты, примерно 25% — аэробные кокки (стафилококки, стрептококки, энтерококки и коринеформные бактерии), от 20 до 30% приходится на бифидобактерии и лактобациллы.
Количество анаэробов (пептострептококки, бактероиды, клостридии, пропионобактерии) составляет около 10% в тонкой и до 20% в толстой кишке. На долю энтеробактерий приходится 1% от суммарной микрофлоры слизистой оболочки.
До 90-95% микробов в толстой кишке составляют анаэробы (бифидобактерии и бактероиды), и только 5-10% всех бактерий приходится на строгую аэробную и факультативную флору (молочнокислые и кишечные палочки, энтерококки, стафилококки, грибы, протей).
Кишечные палочки, энтерококки, бифидобактерии и ацидофильные палочки обладают выраженными антагонистическими свойствами. В условиях нормально функционирующего кишечника они способны подавлять рост несвойственных нормальной микрофлоре микроорганизмов.
Площадь внутренней поверхности кишечника составляет около 200 м 2 . Она надежно защищена от проникновения пищевых антигенов, микробов и вирусов. Важную роль в организации этой защиты играет иммунная система организма. Около 85% лимфатической ткани человека сосредоточено в стенке кишечника, где продуцируется секреторный IgA. Кишечная микрофлора стимулирует иммунную защиту. Кишечные антигены и токсины кишечных микробов значительно увеличивают секрецию IgA в просвет кишки.
Расщепление непереваренных пищевых веществ в толстой кишке осуществляется ферментами бактерий, при этом образуются разнообразные амины, фенолы, органические кислоты и другие соединения. Токсические продукты микробного метаболизма (кадаверин, гистамин и другие амины) выводятся с мочой и в норме не оказывают влияния на организм. При утилизации микробами неперевариваемых углеводов (клетчатки) образуются короткоцепочечные жирные кислоты. Они обеспечивают клетки кишки энергоносителями и, следовательно, улучшают трофику слизистой оболочки. При дефиците клетчатки может нарушаться проницаемость кишечного барьера вследствие дефицита короткоцепочечных жирных кислот. В результате кишечные микробы могут проникать в кровь.
Под влиянием микробных ферментов в дистальных отделах подвздошной кишки происходит деконъюгация желчных кислот и преобразование первичных желчных кислот во вторичные. В физиологических условиях от 80 до 95% желчных кислот реабсорбируется, остальные выделяются с фекалиями в виде бактериальных метаболитов. Последние способствуют нормальному формированию каловых масс: тормозят всасывание воды и тем самым препятствуют излишней дегидратации кала.
Дисбактериоз
В понятие дисбактериоза кишечника входит избыточное микробное обсеменение тонкой кишки и изменение микробного состава толстой кишки. Нарушение микробиоценоза происходит в той или иной степени у большинства больных с патологией кишечника и других органов пищеварения. Следовательно, дисбактериоз является бактериологическим понятием. Он может рассматриваться как одно из проявлений или осложнение заболевания, но не самостоятельная нозологическая форма.
Крайней степенью дисбактериоза кишечника является появление бактерий желудочно-кишечного тракта в крови (бактериемия) или даже развитие сепсиса.
Состав микрофлоры кишечника нарушается при болезнях кишечника и других органов пищеварения, лечении антибиотиками и иммунодепрессантами, воздействиях вредных факторов внешней среды.
Клинические проявления дисбактериоза зависят от локализации дисбиотических изменений.
Дисбактериоз тонкой кишки
При дисбактериозе тонкой кишки численность одних микробов в слизистой оболочке тонкой кишки увеличена, а других уменьшена. Отмечается увеличение Eubacterium (в 30 раз), α-стрептококков (в 25 раз), энтерококков (в 10 раз), кандид (в 15 раз), появление бактерий рода Acinetobacter и вирусов герпеса. Уменьшается от 2 до 30 раз количество большинства анаэробов, актиномицетов, клебсиелл и других микроорганизмов, являющихся естественными обитателями кишечника.
Причиной дисбактериоза могут быть: а) избыточное поступление микроорганизмов в тонкую кишку при ахилии и нарушении функции илеоцекального клапана; б) благоприятные условия для развития патологических микроорганизмов в случаях нарушения кишечного пищеварения и всасывания, развития иммунодефицита и нарушений проходимости кишечника.
Повышенная пролиферация микробов в тонкой кишке приводит к преждевременной деконъюгации желчных кислот и потере их с калом. Избыток желчных кислот усиливает моторику толстой кишки и вызывает диарею и стеаторею, а дефицит желчных кислот приводит к нарушению всасывания жирорастворимых витаминов и развитию желчнокаменной болезни.
Бактериальные токсины и метаболиты, например фенолы и биогенные амины, могут связывать витамин В12.
Некоторые микроорганизмы обладают цитотоксическим действием и повреждают эпителий тонкой кишки. Это ведет к уменьшению высоты ворсинок и углублению крипт. При электронной микроскопии выявляется дегенерация микроворсинок, митохондрий и эндоплазматической сети.
Дисбактериоз толстой кишки
Состав микрофлоры толстой кишки может меняться под влиянием различных факторов и неблагоприятных воздействий, ослабляющих защитные механизмы организма (экстремальные климатогеографические условия, загрязнение биосферы промышленными отходами и различными химическими веществами, инфекционные заболевания, болезни органов пищеварения, неполноценное питание, ионизирующая радиация).
В развитии дисбактериоза толстой кишки большую роль играют ятрогенные факторы: применение антибиотиков и сульфаниламидов, иммунодепрессантов, стероидных гормонов, рентгенотерапия, хирургические вмешательства. Антибактериальные препараты значительно подавляют не только патогенную микробную флору, но и рост нормальной микрофлоры в толстой кишке. В результате размножаются микробы, попавшие извне, или эндогенные виды, устойчивые к лекарственным препаратам (стафилококки, протей, дрожжевые грибы, энтерококки, синегнойная палочка).
Клинические особенности дисбактериоза
Клинические проявления чрезмерного роста микроорганизмов в тонкой кишке могут полностью отсутствовать, выступать в качестве одного из патогенетических факторов хронической рецидивирующей диареи, а при некоторых болезнях, например, дивертикулезе тонкой кишки, частичной кишечной непроходимости или после хирургических операций на желудке и кишечнике, приводить к тяжелой диарее, стеаторее и В 12 -дефицитной анемии.
Особенностей клинического течения заболевания у больных с различными вариантами дисбактериоза толстой кишки, по данным бактериологических анализов кала, в большинстве случаев установить не удается. Можно отметить, что больные хроническими заболеваниями кишечника чаще инфицируются острыми кишечными инфекциями по сравнению со здоровыми. Вероятно, это связано со снижением у них антагонистических свойств нормальной микрофлоры кишечника и, прежде всего, частым отсутствием бифидобактерий.
Особенно большую опасность представляет псевдомембранозный колит, развивающийся у некоторых больных, длительно лечившихся антибиотиками широкого спектра действия. Этот тяжелый вариант дисбактериоза вызывается токсинами, выделяемыми синегнойной палочкой Clostridium difficile, которая размножается в кишечнике при угнетении нормальной микробной флоры.
Очень редко наблюдается молниеносное течение псевдомембранозного колита, напоминающее холеру. Обезвоживание развивается в течение нескольких часов и заканчивается летальным исходом.
Таким образом, оценка клинической значимости дисбиотических изменений должна основываться прежде всего на клинических проявлениях, а не только на результатах исследования микрофлоры кала.
Методы диагностики
Диагностика дисбактериоза представляет собой сложную и трудоемкую задачу. Для диагностики дисбактериоза тонкой кишки применяют посев сока тонкой кишки, полученного с помощью стерильного зонда. Дисбактериоз толстой кишки выявляют с помощью бактериологических исследований кала.
Микробная флора образует большое количество газов, в том числе водорода. Это явление используют для диагностики дисбактериоза. Концентрация водорода в выдыхаемом воздухе натощак находится в прямой зависимости от выраженности бактериального обсеменения тонкой кишки. У больных с заболеваниями кишечника, протекающими с хронической рецидивирующей диареей и бактериальным обсеменением тонкой кишки, концентрация водорода в выдыхаемом воздухе значительно превышает 15 ppm.
Для диагностики дисбактериоза применяют также нагрузку лактулозой. В норме лактулоза не расщепляется в тонкой кишке и метаболизируется микробной флорой толстой кишки. В результате количество водорода в выдыхаемом воздухе повышается (рис. 1).
Наиболее частыми бактериологическими признаками дисбактериоза толстой кишки являются отсутствие основных бактериальных симбионтов — бифидобактерий и уменьшение количества молочнокислых палочек. Увеличивается количество кишечных палочек, энтерококков, клостридий, стафилококков, дрожжеподобных грибов и протея. У отдельных бактериальных симбионтов появляются патологические формы. К ним относятся гемолизирующая флора, кишечные палочки со слабо выраженными ферментативными свойствами, энтеропатогенные кишечные палочки и т. д.
Углубленное изучение микробиоценоза показало, что традиционные методы не позволяют получить истинную информацию о состоянии микрофлоры кишечника. Из 500 известных видов микробов в целях диагностики обычно изучаются лишь 10-20 микроорганизмов. Важно, в каком отделе — в тощей, подвздошной или толстой кишках — исследуется микробный состав. Поэтому перспективы разработки клинических проблем дисбактериоза в настоящее время связывают с применением химических методов дифференциации микроорганизмов, позволяющих получить универсальную информацию о состоянии микробиоценоза. Наиболее широко для этих целей используются газовая хроматография (ГХ) и газовая хроматография в сочетании с масс-спектрометрией (ГХ-МС). Этот метод позволяет получить уникальную информацию о составе мономерных химических компонентов микробной клетки и метаболитов. Маркеры такого рода могут быть определены и использованы для детектирования микроорганизмов. Главным преимуществом и принципиальным отличием этого метода от бактериологических является возможность количественного определения более 170 таксонов клинически значимых микроорганизмов в различных средах организма. При этом результаты исследования могут быть получены в течение нескольких часов.
Проведенные нами исследования микробиоценоза в крови и биоптатов слизистой оболочки тонкой и толстой кишок у больных с синдромом раздраженного кишечника позволили обнаружить отклонения от нормы до 30-кратного увеличения или уменьшения многих компонентов. Существует возможность оценки изменений микрофлоры кишечника на основании данных анализа крови методом ГХ-МС-микробных маркеров.
Лечение
Лечение дисбактериоза должно быть комплексным (схема) и включать в себя следующие мероприятия:
- устранение избыточного бактериального обсеменения тонкой кишки;
- восстановление нормальной микробной флоры толстой кишки;
- улучшение кишечного пищеварения и всасывания;
- восстановление нарушенной моторики кишечника;
- стимулирование реактивности организма.
Антибактериальные препараты
Антибактериальные препараты необходимы в первую очередь для подавления избыточного роста микробной флоры в тонкой кишке. Наиболее широко применяются антибиотики из группы тетрациклинов, пенициллинов, цефалоспорины, хинолоны (таривид, нитроксолин) и метронидазол.
Однако антибиотики широкого спектра действия в значительной степени нарушают эубиоз в толстой кишке. Поэтому они должны применяться только при заболеваниях, сопровождающихся нарушениями всасывания и моторики кишечника, при которых, как правило, отмечается выраженный рост микробной флоры в просвете тонкой кишки.
Антибиотики назначают внутрь в обычных дозах в течение 7–10 дней.
При заболеваниях, сопровождающихся дисбактериозом толстой кишки, лечение лучше проводить препаратами, которые оказывают минимальное влияние на симбионтную микробную флору и подавляют рост протея, стафилококков, дрожжевых грибов и других агрессивных штаммов микробов. К ним относятся антисептики: интетрикс, эрсефурил, нитроксолин, фуразолидон и др.
При тяжелых формах стафилококкового дисбактериоза применяют антибиотики: таривид, палин, метронидазол (трихопол), а также бисептол-480, невиграмон.
Антибактериальные препараты назначают в течение 10–14 дней. В случае появления в кале или кишечном соке грибов показано применение нистатина или леворина.
У всех больных с диареей, ассоциированной с антибиотиками, протекающей с интоксикацией и лейкоцитозом, возникновение острой диареи следует связывать с Cl. difficile.
В этом случае срочно делают посев кала на Cl. difficile и назначают ванкомицин по 125 мг внутрь 4 раза в сутки; при необходимости доза может быть увеличена до 500 мг 4 раза в день. Лечение продолжают в течение 7-10 суток. Эффективен также метронидазол в дозе 500 мг внутрь 2 раза в сутки, бацитрацин по 25 000 МЕ внутрь 4 раза в сутки. Бацитрацин почти не всасывается, в связи с чем в толстой кишке можно создать более высокую концентрацию препарата. При обезвоживании применяют адекватную инфузионную терапию для коррекции водно-электролитного баланса. Для связывания токсина Cl. difficile используют холестирамин (квестран).
Бактериальные препараты
Живые культуры нормальной микробной флоры выживают в кишечнике человека от 1 до 10% от общей дозы и способны в какой-то мере выполнять физиологическую функцию нормальной микробной флоры. Бактериальные препараты можно назначать без предварительной антибактериальной терапии или после нее. Применяют бифидумбактерин, бификол, лактобактерин, бактисубтил, линекс, энтерол и др. Курс лечения длится 1-2 месяца.
Возможен еще один способ устранения дисбактериоза — воздействие на патогенную микробную флору продуктами метаболизма нормальных микроорганизмов. К таким препаратам относится хилак форте. Он создан 50 лет назад и до настоящего времени применяется для лечения больных с патологией кишечника. Хилак форте представляет собой стерильный концентрат продуктов обмена веществ нормальной микрофлоры кишечника: молочной кислоты, лактозы, аминокислот и жирных кислот. Эти вещества способствуют восстановлению в кишечнике биологической среды, необходимой для существования нормальной микрофлоры, и подавляют рост патогенных бактерий. Возможно, продукты метаболизма улучшают трофику и функцию эпителиоцитов и колоноцитов. 1 мл препарата соответствует биосинтетическим активным веществам 100 млрд. нормальных микроорганизмов. Хилак форте назначают по 40–60 капель 3 раза в день на срок до 4 недель в сочетании с препаратами антибактериального действия или после их применения.
Регуляторы пищеварения и моторики кишечника
У больных с нарушением полостного пищеварения применяют креон, панцитрат и другие панкреатические ферменты. С целью улучшения функции всасывания назначают эссенциале, легалон или карсил, т. к. они стабилизируют мембраны кишечного эпителия. Пропульсивную функцию кишечника улучшают имодиум (лоперамид) и тримебутин (дебридат).
Стимуляторы реактивности организма
Для повышения реактивности организма ослабленным больным целесообразно применять тактивин, тималин, тимоген, иммунал, иммунофан и другие иммуностимулирующие средства. Курс лечения должен составлять в среднем 4 недели. Одновременно назначаются витамины.
Профилактика дисбактериоза
Первичная профилактика дисбактериоза представляет очень сложную задачу. Ее решение связано с общими профилактическими проблемами: улучшением экологии, рациональным питанием, улучшением благосостояния и прочими многочисленными факторами внешней и внутренней среды.
Вторичная профилактика предполагает рациональное применение антибиотиков и других медикаментов, нарушающих эубиоз, своевременное и оптимальное лечение болезней органов пищеварения, сопровождающихся нарушением микробиоценоза.
Заболевания органов пищеварительной системы во многом связаны с особенностями пищевого поведения. Отсутствие режима питания, неадекватные диеты, агрессивная пища, голодание наряду с перееданием - все это приводит к неблагоприятным последствиям. В группе особого риска пациенты с осложненным гастроэнтерологическим анамнезом, лица, употребляющие алкогольные напитки, курильщики. К лечению расстройств пищевого поведения подключаются психотерапевты, гастроэнтерологи, терапевты, диетологи.
Под агрессивной пищей понимают консервацию, копчености, пряности, соленья, маринады. В этот список входят промышленные соусы, сдоба, жирное мясо, фастфуд и другие. Неправильное питание и неумеренность в еде приводят к заболеваниям органов ЖКТ, снижению функции желудка и кишечника, общесоматические расстройства.
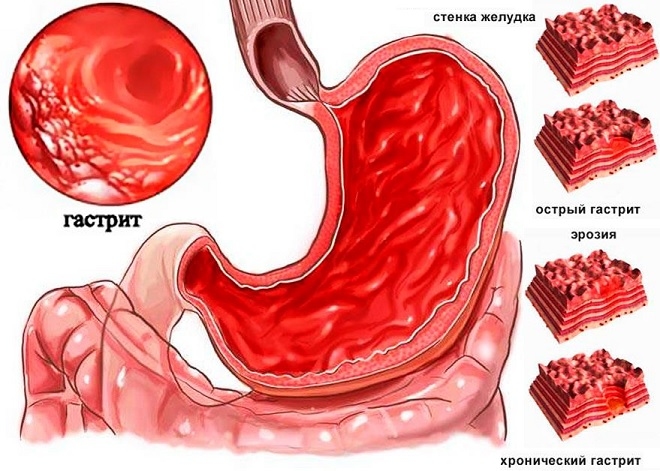
Хронический гастрит
Хронический гастрит развивается, преимущественно, при отсутствии пищевой дисциплины. Половина населения планеты страдают от гастрита. Важное клиническое значение имеет кислотность желудочного сока и уровень его секреции. При пониженной секреции патология сопровождается снижением аппетита, горечью во рту, позывами к рвоте сразу после приема пищи (чаще всего после переедания). При повышенной секреции болезнь характеризуется болью и дискомфортом в эпигастрии, тошнотой, болевым синдромом в области поджелудочной железы.
Лечение комплексное, включает коррекцию образа жизни, питания. С целью симптоматической терапии назначают антацидные, обволакивающие препараты, обезболивающие. Важно не заниматься самолечением, а пройти обследовать и подобрать индивидуальную схему терапии с учетом клинического анамнеза больного.
Гастрит часто осложняется язвенной болезнью, профузными кровотечениями или геморрагическим шоком при эрозивном поражении. При флегмонозном гастрите есть вероятность перфорации стенок органа, деформации желудка, образования свищевых ходов. При недостатке фактора Касла у 90% всех больных хроническим гастритом развивается мегалобластная анемия. При длительном течении патологического процесса есть риск озлокачествления слизистого эпителия и образования аденокарциномы.
Кишечный дисбактериоз
Дисбактериоз кишечника или кишечный симбиоз - патологическое состояние микрофлоры кишечника, обусловленное с нарушением видового состава бактерий. При дисбактериозе условно-патогенная микрофлора меняет численный состав в сторону патогенной, что сопровождается диареей, метеоризмом, отделением зловонных газов, снижением аппетита, зудом в анусе из-за частых дефекаций. Нередко при дисбактериозе в каловых массах появляется скрытая кровь (выявляется лабораторно), кровяные прожилки, которые можно рассмотреть. Появление симптома требует срочной коррекции, чтобы исключить развитие более серьезных осложнений.
С целью лечения назначают бифидобактерии, кисломолочные продукты, лактобактерии. Спустя 1-2 недели стул восстанавливается, состояние нормализуется. Коррегируют и питание. Легкие формы дисбактериоза можно вылечить питанием: кисломолочными продуктами, сбалансированным рационом, обогащением питания клетчаткой, свежими овощами, фруктами.
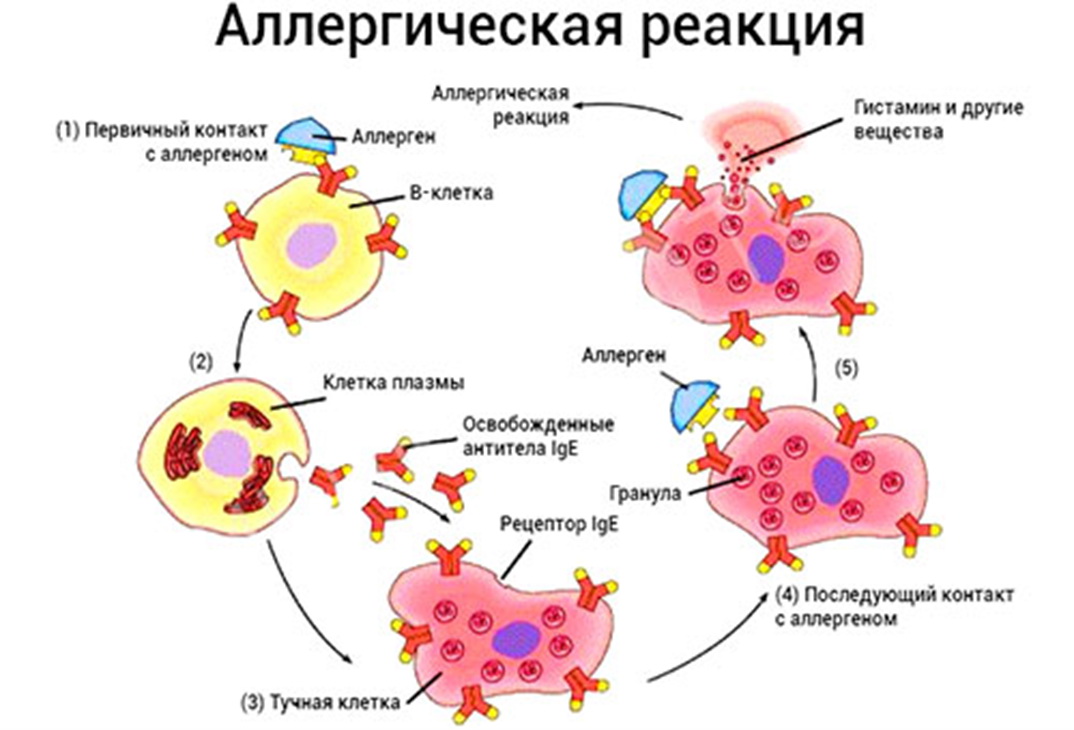
Аллергические реакции
Аллергией на пищу страдают более 12% взрослых и почти 35-40% детей. Увеличение статистики связано с ухудшением экологической ситуации, употреблением в пищу консервации, красителей, стабилизаторов, эмульгаторов. Аллергические реакции встречаются при употреблении промышленных продуктов питания. При отягощенном аллергоанамнезе следует уделить внимание качеству и видовому составу пищи. Чаще всего аллергия развивается на клубнику, томаты, цитрусовые, цельное молоко, какао и шоколад.
Головные боли
Частые головные боли, в том числе мигренеподобные, развиваются в результате негативного воздействия пищи. Одним из провокаторов головной боли является тирамин, который содержится в сырах и кисломолочной продукции, слабосоленой, соленой и маринованной рыбе, шоколаде, копченом мясе, колбасных продуктов.
Вызвать головную боль может и глютамат натрия - усилитель вкуса, который входит в соевый соус и блюда китайской, японской кухни. Если головные боли возникают сразу или через некоторое время после приема пищи, то можно подозревать некоторые пищевые ингредиенты.
Появление признаков пищевых расстройств и симптомов заболеваний органов ЖКТ требует обращения к доктору гастроэнтерологу. В нашей клинике А2МЕД в Симферополе пациенты могут пройти полный комплекс обследований, получить консультацию опытного диетолога. Коррекция рациона и навык правильного выбора еды для всей семьи - залог здоровья на долгие годы.
Главной опасностью увеличения секреторной функции желудка, является развитие воспалительного процесса в слизистой оболочке органа, с последующим её повреждением и развитием структурных дефектов. Изменение pН желудочной среды всегда сопровождается клинической симптоматикой, выраженность которой зависит от тяжести воспалительного процесса и характера структурно-функциональных нарушений.
Общая информация
В 80% случаев, причиной развития воспалительного процесса с повышенной кислотностью желудка, является микроорганизм Хеликобактер Пилори, которая нарушает естественные защитные свойства желудка и приводит к повреждению эпителия органа. Гастрит с повышенной кислотностью может развиваться у людей независимо от возраста, в том числе у детей.
К другим факторам, предрасполагающим к развитию данного состояния, можно отнести:
- Регулярное воздействие стресса на организм.
- Нерациональное питание, преобладание в рационе жареной и жирной пищи, а также блюд, приготовленных во фритюре.
- Злоупотребление так называемыми перекусами.
- Длительное или бесконтрольное использование препаратов из группы нестероидных противовоспалительных средств. Частое употребление слишком горячей или слишком холодной пищи. Кроме того, высокая предрасположенность к развитию гиперацидного гастрита имеется у людей с заболеваниями щитовидной железы, сахарным диабетом и подагрой.
Чем опасна повышенная кислотность
Желудочный сок содержит соляную кислоту, которая необходима для расщепления компонентов пищи. Для того чтобы кислотная среда не повреждала стенки желудка, вырабатывается защитная слизь. При повышенной кислотности желудка наблюдается разрушение слизистого защитного слоя, с последующим формированием воспалительного процесса, образованием эрозий и язв.
Клинические симптомы
Воспалительное поражение органа с увеличением секреции желудочного сока чаще обостряется в период межсезонья, в осенние или весенние месяцы. К симптомам повышенной кислотности желудка можно отнести:
- Тянущая или схваткообразная боль в подложечной области, которая чаще усиливается после приема пищи. При остром течении воспалительного процесса, боль может сопровождаться рвотой, которая приносит временное облегчение.
- Изжога, которая вызвана забросом кислотного содержимого желудка в пищевод. . . или диареи.
К другим симптомам повышенной кислотности желудка при гастрите относится слабость, головокружение, повышенная потливость, избыточное газообразование в кишечнике (метеоризм), усиленное слюноотделение, повышение или снижение аппетита, появление белого или серого налёта на поверхности языка. Пониженная кислотность желудка сопровождается такими симптомами, как уменьшение аппетита, ощущение тяжести в эпигастрии, отрыжка тухлым.
Диагностика
Одним из ключевых методов как определить кислотность желудка, является проведение дыхательного уреазного теста на выявление бактерии Хеликобактер Пилори. Также, выполняется ПЦР и ИФА исследования, направленные на выявление антител к данному микроорганизму. К другим обязательным методам исследования при подозрении на гастрит с повышенной кислотностью, относят:
- Эндоскопическое исследование желудка (гастроскопия).С помощью данного метода оценивается состояние желудка, пищевода и двенадцатиперстной кишки. При необходимости, во время обследования, ведется забор фрагментов слизистой оболочки (биопсия).
- Внутрижелудочная pН-метрия. Для проведения исследования используется pН-метрический трансназальный зонд, который соединён с автономным регистрирующим блоком. Если показатели pН желудочного содержимого составляют менее 1,5 единиц, то диагноз гиперацидного гастрита подтверждается.
В качестве вспомогательных методов обследования может быть назначено ультразвуковое исследование органов брюшной полости.
Лечение
Информацию о том, как снизить кислотность желудка необходимо получить у врача гастроэнтеролога. Любые варианты самолечения в домашних условиях с использованием подручных средств, являются не только малоэффективными, но и могут привести к развитию осложнений. При симптомах гастрита с повышенной кислотностью, диета и лечение предусматривает исключение из рациона жареной и жирной пищи, копченостей, фаст-фуда, алкоголя, мясных, рыбных и овощных консервов, специй, приправ, соусов. Питаться следует дробно, небольшими порциями, 4-5 раз в день. Блюда необходимо готовить преимущественно на пару или путем отваривания. При повышенной кислотности желудка назначается диета № 1 по Певзнеру.
При симптомах гастрита с пониженной кислотностью, лечение и диета включают рецепты блюд, стимулирующих кислотообразующую функцию желудка.
Для лечения повышенной кислотности желудка, традиционная медицина использует такие группы фармацевтических средств:
- Антибактериальные препараты, которые эффективны при гиперацидном гастрите, спровоцированном бактерией Хеликобактер Пилори.
- Обволакивающие средства.
- Ингибиторы протонной помпы.
- Антациды.
- Н2 гистаминовые блокаторы.
- Препараты висмута.
Для поддержания нормальной кислотности желудочного сока, важно сохранять баланс нормальной желудочной микрофлоры. С этой целью, рекомендовано использовать метапребиотики, которые содержат натуральный питательный субстрат для желудочных и кишечных бактерий. Метапребиотик Стимбифид Плюс помогает не только восстановить баланс нормальной желудочной и кишечной микробиоты, но и способствует эрадикации (уничтожению) Хеликобактер Пилори. Также, компоненты метапребиотика ускоряют процесс восстановления желудочного эпителия.
Профилактика
Уменьшить до минимума вероятность развития гиперацидного гастрита можно только при условии соблюдения профилактических мер. Если у человека имеется склонность к избыточной секреции желудочного сока, то ему необходимо придерживаться диетических рекомендаций, не злоупотреблять жареной и жирной пищей, отказаться от употребления алкоголя и фаст-фуда. Незаменимым помощником в сохранении здоровья желудка, является метапребиотик Стимбифид Плюс, который нормализует баланс желудочной микрофлоры и защищает эпителий органа от агрессивного воздействия соляной кислоты.
Оба заболевания относятся к патологиям пищеварительной системы и характеризуются развитием воспалительного процесса. При гастрите воспалительный процесс развивается в слизистой оболочке желудка. Это состояние может протекать как в острой, так и хронической форме, с сохраненной, повышенной или пониженной кислотностью желудочного сока. При панкреатите воспалительный процесс локализуется в поджелудочной железе. По аналогии с гастритом, панкреатит может протекать в хронической или острой форме. Синонимом острого панкреатита является панкреонекроз. Оба заболевания несут прямую угрозу не только для здоровья но и для жизни человека.
Симптомы
Для того чтобы дифференцировать два заболевания важно ориентироваться в симптомах гастрита и панкреатита. Воспалительное поражение слизистой оболочки желудка сопровождается набором таких клинических признаков:
- Периодически возникающая боль в подложечной области, которая усиливается после приёма пищи и в ночное время суток. Характерны также голодные боли в желудке.
- Дискомфорт и боль в левой части живота.
- Отрыжка с привкусом кислого или с характерным неприятным запахом.
- Хронические запоры или диарея.
- Частичная или полная утрата аппетита.
- Повышенное газообразование в кишечнике (метеоризм).
К дополнительным симптомам гастрита желудка относится общая слабость, бледность кожных покровов и снижение работоспособности.
Распознать панкреатит поджелудочной железы можно по таким характерным симптомам:
- Тянущая или острая боль в левом подреберье, которая имеет опоясывающий характер.
- Тошнота и рвота, не приносящая облегчение. в виде диареи, при этом испражнения могут содержать частицы непереваренной пищи или иметь вкрапления жировых капель (стеаторея).
- Утрата аппетита.
При хроническом панкреатите нарушается весь процесс переваривания пищи, так как поджелудочная железа перестает вырабатывать необходимое количество пищеварительных ферментов. В медицинской терминологии это состояние именуется “диспепсия”.
Осложнения гастрита и панкреатита
При воспалительном поражении слизистой оболочки желудка характер осложнений зависит от типа самого гастрита. При воспалении с повышенной кислотностью, основным осложнением является язвенная болезнь желудка и двенадцатиперстной кишки, которая при запущенном течении чревата перфорацией и развитием желудочного кровотечения. Гастрит с пониженной кислотностью чреват развитием онкологии желудка. Если говорить об осложнениях воспалительного процесса в поджелудочной железе, то наиболее опасен острый панкреатит или панкреонекроз. Это тяжелое состояние вызвано отмиранием ткани поджелудочной железы. При отсутствии своевременной квалифицированной помощи, панкреонекроз в 90% случаев заканчивается летальным исходом.
Диагностика и лечение
Несмотря на то, что оба заболевания относятся к патологиям пищеварительной системы, их диагностика и лечение имеют принципиальные различия. Наиболее информативным методом диагностики гастрита, является эзофагогастродуоденоскопия, позволяющая выявить минимальные изменения в слизистой оболочке желудка. Дополнительно используется pH-метрия желудочного сока, анализ жалоб пациента и общий клинический анализ крови, позволяющий обнаружить скрытое воспаление. Для диагностики хронического панкреатита используются такие методы обследования:
- ультразвуковое обследование поджелудочной железы;
- биохимический анализ крови на уровень альфа-амилазы и липазы;
- иммуноферментный анализ каловых масс на панкреатическую эластазу-1;
- магнитно-резонансная томография поджелудочной железы;
- ретроградная холангиопанкреатография.
Для лечения гастрита используются препараты, нормализующие кислотообразующую функцию желудка, антациды, H2 гистаминовые блокаторы, обволакивающие средства, ингибиторы протонной помпы. Диета при гастрите и панкреатите не может быть одинаковой. Если гастрит протекает с повышенной кислотностью, то назначается лечебная диета — стол № 1 по Певзнеру. Для лечения поджелудочной железы при хроническом панкреатите назначаются обезболивающие препараты, капельное введение растворов электролитов, ингибиторы H2 гистаминовых рецепторов, ферментативные средства, антибиотики. Питание при панкреатите должно быть максимально щадящим. Назначается стол № 5 по Певзнеру. Острая форма панкреатита не лечится в амбулаторных условиях. Таким пациентам необходима экстренная госпитализация.
Клинически доказанным эффектом в поддержании здоровья всей пищеварительной системы, обладает метапребиотик Стимбифид Плюс. Комбинированное средство нормализует баланс желудочной и кишечной микрофлоры, ускоряет процесс естественного восстановления слизистой оболочки и благоприятно влияет на все звенья пищеварения. Стимбифид Плюс содержит только натуральные компоненты, на 100% безопасные для организма.
Гастроэзофагеальная рефлюксная болезнь (ГЭРБ) сопровождается развитием воспалительного процесса в нижних отделах пищевода. Главной причиной развития гастроэзофагита является хронический заброс (рефлюкс) желудочного содержимого в пищевод. В отличие от желудка, стенки которого покрыты специальным защитным слизистым слоем, стенки пищевода не имеют подобной защиты и максимально уязвимы перед воздействием соляной кислоты, содержащейся в желудочном соке. Рефлюксная болезнь желудка опасна тем, что хроническое раздражение слизистой оболочки пищевода желудочным содержимым, может со временем приводить к формированию онкологии пищевода.
Причины развития и предрасполагающие факторы
Гастроэзофагеальный рефлюкс относится к наиболее распространенным патологиям пищеварительной системы, которые потенциально могут провоцировать эрозивно-язвенное поражение слизистой оболочки пищевода и развитие онкологии органа. Для заболевания свойственно хроническое течение, при этом существенно ухудшается качество жизни человека с ГЭРБ, вплоть до частичной утраты трудоспособности. К предрасполагающим факторам развития данного заболевания, можно отнести:
- нарушение моторной функции верхних отделов пищеварительной системы;
- повышенная кислотность желудка и наличие хронического гастрита;
- нарушение процесса эвакуации пища из пищевода в желудок;
- табакокурение и злоупотребление алкоголем;
- постоянное воздействие стрессового фактора;
- беременность;
- ожирение;
- наличие диафрагмальных грыж;
- прием отдельных групп лекарственных медикаментов (нестероидные противовоспалительные средства, бета-адреноблокаторы, блокаторы кальциевых каналов, нитраты, антихолинергические средства).
В 80% случаев, хронический заброс желудочного содержимого в пищевод происходит по причине слабости нижнего пищеводного сфинктера. При нормальном тонусе сфинктера исключена вероятность обратного заброса (рефлюкса) пищевого комка.
Клинические симптомы
Для гастроэзофагеального рефлюкса характерны типичные симптомы, при возникновении которых не рекомендовано откладывать визит к гастроэнтерологу. К таким симптомам можно отнести:
Регулярно возникающая изжога (чаще 2-х раз в неделю). Усиление изжоги наблюдаются после приема пищи, особенно при наклонах туловища и в положении лёжа.
- Постоянная отрыжка после еды с кислым привкусом.
- Нарушение процесса глотания.
- Тошнота и рвота.
Нередко, гастроэзофагеальная рефлюксная болезнь протекает нетипично, и сопровождается болью за грудиной, дискомфортом и тяжестью в животе после приёма пищи, повышенным слюноотделением (особенно в ночное время суток), охриплостью голоса, неприятным запахом изо рта, сухим кашлем и частыми эпизодами бронхоспазма. Не исключено и бессимптомное течение ГЭРБ, но такой вариант патологии является наиболее опасным для здоровья человека.
Методы диагностики
Основным, и наиболее точным методом выявления гастроэзофагеальной рефлюксной болезни, является эзофагогастродуоденоскопия. Эта методика представляет собой эндоскопическое исследование слизистой оболочки пищевода с помощью специального зонда, на конце которого располагается камера. Информация с камеры передается на монитор и оценивается врачом в режиме реального времени. Во время исследования можно выявить очаги воспалительного процесса на слизистой оболочке, наличие эрозий и язв, пищеводные грыжи, полипы, стриктуры, а также очаги злокачественного перерождения.
Для оценки сократительной способности нижнего пищеводного сфинктера используется такое функциональное исследование, как манометрия. При подозрении на такое заболевание, как пищевод Баррета, рекомендовано выполнить гастроскопию с забором фрагментов слизистой оболочки (биопсией). Менее часто, в диагностике ГЭРБ используется методика рентгенографии. Эта диагностическая процедура не позволяет выявить патологические изменения в слизистой оболочке пищевода, за исключением язв и грыж.
Лечение
Немедикаментозное лечение признаков и симптомов рефлюкс-эзофагита включает комплекс мероприятий по нормализации массы тела, рациональное дробное питание, временный или полный отказ от употребления жареной и жирной пищи, цитрусовых, кофе, специй и приправ, соусов, алкоголя. После приема пищи категорически запрещено выполнять наклоны туловища и находиться в положении лёжа. Медикаментозная терапия данного заболевания, включает прием антацидных препаратов, обволакивающих средств, H2 гистаминовых блокаторов и ингибиторов протонной помпы. При неэффективности консервативной терапии, назначается оперативное вмешательство, цель которого — ушивание нижнего пищеводного сфинктера.
С лечебно-профилактической целью рекомендован прием метапребиотика Стимбифид Плюс, который имеет трёхкомпонентный состав. Эффект метапребиотика обусловлен содержанием фруктополисахаридов, лактата кальция и фруктоолигосахаридов. Эти компоненты по отдельности и в совокупности стимулируют рост собственной кишечной и желудочной микрофлоры человека, нормализуют пищеварения, уменьшают интенсивность воспалительного процесса в пищеводе при ГЭРБ, положительно влияют на кислотность желудка и усиливают защитные свойства ЖКТ. Оценить преимущества метапребиотика по сравнению с пробиотиками и пребиотиками, поможет сравнительная таблица.
Профилактика
При врожденной слабости нижнего пищеводного сфинктера, человек автоматически попадает в группу риска по развитию ГЭРБ. При наличии факторов риска, рекомендовано отказаться от употребления алкоголя и табакокурения, минимизировать или полностью исключить жареную пищу из рациона, избегать подъема тяжестей и наклонов туловища непосредственно после приема пищи.
При соблюдении режима и правильных пищевых привычках, прогноз относительно выздоровления является благоприятным.
Читайте также:

