Дизентерия антропоноз или зооноз
Обновлено: 22.04.2024
Доступность статистической информации о заболеваемости острыми кишечными инфекциями (ОКИ) в Российской Федерации не улучшается.
Доступность статистической информации о заболеваемости острыми кишечными инфекциями (ОКИ) в Российской Федерации не улучшается. Сложности в получении объективной информации о фактической этиологической структуре ОКИ ведут к тому, что практические врачи ориентируются в большинстве случаев на собственный опыт и региональные данные. Активное внедрение в практическую деятельность стационаров страховой медицины требует максимального снижения стоимости обследования и лечения пациентов и, как следствие, ведет к упрощению диагностики, зачастую в ущерб ее качеству, а также применению препаратов преимущественно отечественного производства.
Ежегодно в США патогенные микроорганизмы, передающиеся пищевым путем, вызывают около 76 млн случаев кишечных инфекций, в том числе 325 000 больных госпитализируется и 5 000 умирает. Только число случаев шигеллеза по оценкам экспертов составляет около 450 000, из них около 6 000 госпитализируется; а инфекции, вызванной норовирусами, — около 23 млн., из которых почти 40% связано с пищевым путем передачи. Число же официально регистрируемых случаев ОКИ в Российской Федерации в десятки раз меньше и не превышает 700 000 в год.
Немаловажной проблемой диагностики кишечных инфекций является формальный подход не только к назначению диагностических исследований, но и к оценке их результатов. Так, например, проведенный нами анализ 1522 историй болезни пациентов гражданских и военных стационаров, перенесших ОКИ в 2003–2006 гг., показал, что при поступлении их в стационар осмотр стула не проводился или данные о результатах осмотра отсутствуют в 31,4% историй болезни при легком течении заболевания, 16,6% — средней степени тяжести и 42,7% при тяжелом течении. Отсутствие патологических примесей в испражнениях отмечено у 32,8% больных с легким течением кишечной инфекции, 21,9% — среднетяжелым и даже у 6,1% — тяжелым.
Копрологические исследования чаще всего не проводятся при тяжелом течении болезни — 36,14%, в то время как при легком течении и средней степени тяжести болезни таких случаев было достоверно меньше — 11,06% и 5,78% соответственно (p > 0,001). При копрологическом исследовании патологических изменений в копрограмме не обнаружено в среднем у 29,83% больных при легкой степени тяжести кишечной инфекции, 11,02% — средней и 7,84% тяжелой. В то же время, несмотря на выявление копрологических признаков колита у 13,6% пациентов с острым гастроэнтеритом и у 25,5% острым энтеритом, изменения в окончательный диагноз внесены не были. А в тех случаях, когда в диагнозе отмечено наличие колита, копрологические признаки отсутствовали у 50,6% больных острым гастроэнтероколитом 46,1% — острым энтероколитом.
Диагностические посевы испражнений выполнялись у 49,0% пациентов двукратно, 23,5% — трехкратно и 17,0% — однократно. С увеличением степени тяжести эпизода ОКИ увеличивалась доля пациентов, у которых диагностические исследования проводились однократно. Так, при легком течении заболевания в 57,5% случаев выполнены три и более диагностических посева испражнений для выявления патогенной микрофлоры и всего лишь в 18,8% случаев исследования выполнялись однократно. При средней степени тяжести инфекции трехкратные посевы проведены в 19,9%, а однократные — в 15,6% случаев, в то время как у 64,5% больных выполнено два посева. При тяжелом течении заболевания в 44,4% случаев микробиологические исследования выполнены лишь один раз. Вместе с тем серологические исследования с целью установления этиологии заболевания проводятся чаще при тяжелом течении болезни — 58,54%, чем при среднетяжелом — 25,2% и легком — 19,22% (p < 0,001). В абсолютном большинстве случаев диагностические серологические тесты выполняются однократно — 70,9%. Несмотря на то, что чаще всего этот вид обследования назначается при тяжелом течении заболевания, именно в этих случаях у 85,1% больных исследования проводятся однократно.
Дополнительные микробиологические исследования для выявления этиологического агента данного эпизода диареи проводились у небольшого числа пациентов. Так, посев кала для выявления иерсиний (Yersinia enterocolitica и Y. pseudotuberculosis) выполнен у 2,3% обследованных больных, посевы крови — у 15,1%, желчи — 0,1%, рвотных масс — 0,5%. Исследование кала на ротавирусы проведено у 21,0% пациентов, исследование кала на дисбактериоз — 1,0%.
Абсолютное большинство больных ОКИ получают антибактериальные препараты: так, при легком течении заболевания этиотропная терапия проводилась у 84,9% пациентов, среднетяжелом — 90,8% и тяжелом — 93,9%, только один антибиотик получали 54,7% пациентов. Чем тяжелее протекало заболевание, тем реже этиотропное лечение проводилось в режиме монотерапии — 70,6% при легкой степени тяжести, средней — 68,6% и тяжелой — 29,1%. При этом в военных стационарах монотерапия проводилась почти в два раза чаще, чем в гражданских, — 72,8% против 42,3%.
Чаще всего при ОКИ назначались фторхинолоны — 56,5% от всех назначений антимикробных средств, в том числе ципрофлоксацин — 44,7%, офлоксацин — 8,7% и норфлоксацин — 3,1%. Продолжают применять аминогликозиды: так, 22,3% всех назначений составил гентамицин; доля нитрофуранов не превышает 10% — фуразолидона — 4,7%, Фталазола — 2,9% и Фурадонина — 1,8%, а доля хлорамфеникола составила 3,4%. Повторные курсы этиотропной терапии назначались чаще всего при тяжелом течении инфекции — 15,9% и существенно реже при легкой — 3,7% (p < 0,001) и средней степени тяжести — 6,2% (p < 0,01).
В случае установления этиологии эпизода ОКИ трудностей с выбором этиотропной терапии в большинстве случаев не возникает. При острой дизентерии и сальмонеллезе выбор более чем в половине случаев осуществляют в пользу фторхинолонов. Однако в Российской Федерации доля случаев ОКИ установленной этиологии составляла в 2007 году 34,19%. В свободном доступе имеется информация о заболеваемости по следующим группам; брюшной тиф и другие сальмонеллезные инфекции; бактериальная дизентерия (шигеллез); энтеровирусные инфекции, псевдотуберкулез, ОКИ, вызванные установленными бактериальными, вирусными возбудителями, а также пищевые токсикоинфекции установленной этиологии; ОКИ, вызванные неустановленными инфекционными возбудителями, пищевые токсикоинфекции неустановленной этиологии.
С какими же еще микроорганизмами и простейшими могут быть связаны эпизоды кишечной инфекции? Так, например, в США около 50% пищевых вспышек острого гастроэнтерита связаны с норовирусами, ежегодно регистрируются случаи других вирусных инфекций, в том числе ротавирусной, астровирусной и др., а также заболевания, вызванные патогенными эшерихиями, кампилобактерами, листериями, криптоспоридиями, циклоспорами и др. К сожалению, в Российской Федерации получить информацию по ряду возбудителей не представляется возможным.
С точки зрения необходимости проведения этиотропной терапии и выбора конкретного этиотропного средства наибольший интерес представляет группа ОКИ неуточненной природы, протекающих с картиной поражения тонкой и одновременно толстой кишки — чаще всего это острый гастроэнтероколит и острый энтероколит. В связи с возможной бактериальной этиологией таких случаев актуальным становится определение возможного перечня антимикробных средств, активных в отношении прежде всего грамотрицательных микроорганизмов. Помимо фторхинолонов в эту группу входят цефалоспорины III поколения, прежде всего цефтриаксон, а также макролиды (азитромицин, эритромицин). В России активно применяются препараты нитрофуранового ряда, хотя в зарубежных рекомендациях кроме ко-тримоксазола другие средства не рекомендуются.
Сомнений в целесообразности выбора фторхинолонов в такой ситуации нет, но выбор альтернативного средства представляет определенные трудности. В таких случаях требуется, с одной стороны, широкий спектр активности препарата при достаточной безопасности его применения. С другой стороны, при отсутствии транслокации возбудителя из кишечника в абсолютном большинстве случаев целесообразно применение препаратов с преимущественно местным характером действия, т. е. плохо всасывающихся или невсасывающихся.
Среди невсасывающихся в желудочно-кишечном тракте антимикробных препаратов наиболее известны ванкомицин, неомицин, полимиксин М и нифуроксазид. К замедленно всасывающимся относятся тетрациклины (хлортетрациклин) и хлорамфеникол; к ограниченно всасывающимся — ампициллин. Высокие концентрации антибиотика в кишечнике могут создаваться за счет секреции с желчью и/или желудочным соком, к таким средствам относятся фторхинолоны (норфлоксацин, ципрофлоксацин), нитрофураны (фуразолидон), тетрациклины (доксициклин) и метронидазол. В связи с высоким уровнем резистентности микрофлоры, низким уровнем безопасности и высокой частотой нежелательных лекарственных реакций и взаимодействий неомицин, полимиксин М, хлортетрациклин и доксициклин, а также левомицетин и ампициллин при ОКИ имеют лишь исторический интерес. Ванкомицин и метронидазол имеют ограниченное применение — преимущественно для лечения Clostridium difficile — ассоциированных заболеваний.
Фуразолидон продолжают применять при лечении кишечных инфекции и в настоящее время, хотя он и обладает достаточно узким спектром безопасности и почти полностью метаболизируется в печени, создавая дополнительную нагрузку на детоксицирующие системы. Более безопасными являются новые нитрофураны — нифурател (Макмирор) и нифуроксазид (Эрсефурил, Энтерофурил). Первый после приема быстро абсорбируется из ЖКТ и также подвергается биотрансформации в печени и в мышечной ткани, полностью выводится с мочой (30–50% в неизмененном виде). Нифуроксазид практически не всасывается, менее токсичен по сравнению с фуразолидоном и создает более высокие концентрации в кишечнике. Вместе с тем ряд фармакокинетических параметров для нитрофуранов изучен недостаточно, в том числе вопросы проникновения через гистогематические барьеры, в частности через плацентарный барьер и т. д. (Падейская Е. Н., 2004).
Возможной альтернативой фторхинолонам при неинвазивных диареях может рассматриваться новый для отечественного рынка препарат — рифаксимин (Альфа Нормикс), являющийся полусинтетическим производным рифамицина SV. Фармакокинетические исследования рифаксимина выполнены на здоровых добровольцах (Descombe J. J. et al., 1994; Исследование FDA, 2004), а также на пациентах с язвенным колитом (Rizzello F. et al., 1998; Gionchetti P. et al., 1999), пациентах с печеночной энцефалопатией (Исследование FDA, 2004) и при экспериментально индуцированном шигеллезе (Taylor D. N. et al., 2003; Исследование FDA, 2004). Так, установлено, что при оральном приеме 400 мг рифаксимина натощак здоровыми волонтерами концентрация препарата в крови была ниже минимального определяемого предела 2,5 нг/мл в 50% случаев. Пиковые концентрации рифаксимина в плазме после 3-й и 9-й последовательных доз при экспериментальном шигеллезе составляли 0,81–3,4 нг/мл в первый день и 0,68–2,26 нг/мл на третий. При язвенном колите назначение рифаксимина в дозе 400 мг приводило к выделению с мочой около 0,009% полученной дозы, т. е. практически того же количества, что и у здоровых добровольцев.
Немаловажным является тот факт, что при применении в стандартных суточных дозах концентрация препарата в кале составляет 4000–8000 мкг/г, что в 160–250 раз превышает МПК90 для различных бактериальных энтеропатогенных агентов. Благодаря столь высоким концентрациям препарат эффективно подавляет жизнедеятельность таких аэробных бактерий, как Escherichia coli, Shigella spp., Salmonella spp., Yersinia enterocolica, Proteus spp., Vibrio cholerae, а также анаэробов — Clostridium perfrigens, C. difficile, Peptococcus spp., Peptostreptococcus spp., Bacteroides fragilis, Bacteroides spp. и Helicobacter pylori.
Как и другие представители семейства рифамицина, рифаксимин является специфическим ингибитором РНК-синтетазы путем подавления бета-подгруппы ДНК-зависимой РНК-полимеразы за счет нарушения обмена ионов магния. Формирование резистентности к рифаксимину связано с хромосомными изменениями, в отличие от плазмидно-опосредованной устойчивости к аминогликозидам (неомицин или бацитрацин). Частота подобных мутаций выше у грамположительных кокков, чем у грамотрицательных энтеробактерий. В отличие от плазмидного механизма формирования резистентности хромосомный характер устойчивости микрофлоры к рифаксимину имеет меньшую частоту возникновения и ведет к формированию менее жизнеспособных штаммов, самостоятельно элиминирующихся из кишечника в течение нескольких недель после завершения приема препарата. Кроме того, в исследованиях DuPont H.L. и Jiang Z.D.было показано, что грамположительные (в частности, энтерококки) и грамотрицательные (например, E. coli) микроорганизмы при коротких курсах терапии — 3–5 дней — не изменяют чувствительность к рифаксимину.
Низкие сывороточные концентрации рифаксимина обеспечивают минимальное влияние на механизмы метаболизма ксенобиотиков, но, помимо этого, Альфа Нормикс не подавляет человеческие печеночные изоферменты цитохрома Р450, 1A2, 2A6, 2B6, 2C9, 2C19, 2D6, 2E1 и 3A4 и, кроме того, имеет структурное сходство с лигандами, активирующими pregnane X receptor gene (PXR), что способствует частичному усилению метаболизма других ксенобиотиков.
Важным свойством антибиотиков является наличие или отсутствие взаимодействия с другими лекарственными средствами. Так, рифаксимин, в отличие от рифампицина, например, не изменяет фармакокинетику этинилэстрадиола и норгестимата, бензодиазепинов, противомалярийных средств и др.
Рифаксимин (Альфа Нормикс) может применяться и в лечебных, и в профилактических целях, основным показанием для него являются диареи путешественников. При этом терапевтическая эффективность рифаксимина сопоставима с эффективностью ципрофлоксацина. Так, по данным DuPont H. L. и соавт. (1999) при назначении рифаксимина в дозе 400 мг два раза в сутки и ципрофлоксацина в дозе 500 мг дважды в сутки в течение трех дней не выявлено достоверных различий переносимости препаратов, а время от начала лечения до последнего неоформленного стула было сравнимым в обеих группах, медиана составила 27,3 часа и 26 часов в группах рифаксимина и ципрофлоксацина соответственно (р = 0,334).
Одним из возможных направлений повышения эффективности терапии диареи путешественников является применение антиперистальтических препаратов одновременно с антибиотиком. Так, ранее было показано, что одновременное назначение азитромицина и лоперамида позволяет сократить продолжительность диареи с 34 часов до 11 часов (p = 0,0002) по сравнению с монотерапией азитромицином. Аналогичные данные были получены Dupont H. L. и соавт. (2007) при сравнении эффективности комбинированной терапии рифаксимином и лоперамидом. Среднее время от начала терапии до последнего неоформленного стула при назначении рифаксимина по 200 мг 3 раза в сутки в течение трех дней составило 32,5 ± 4,14 ч, в то время как при лечении рифаксимином одновременно с лоперамидом в дозе 4 мг первый прием и затем по 2 мг после каждого неоформленного стула — 27,3 ± 4,13 ч, а при лечении только лоперамидом по такой же схеме — 69 ± 4,11 ч (р = 0,0019). Средняя частота стула при комбинированной терапии рифаксимином–лоперамидом составила 3,99 ± 4,28 по сравнению с монотерапией рифаксимином — 6,23 ± 6,90 (р = 0,004), только лоперамидом — 6,72 ± 6,93 (р = 0,002).
Профилактическое действие рифаксимина изучалось и при шигеллезе. Так, Taylor D. N. с соавторами (2004) в экспериментальном исследовании показали, что после приема 4 доз рифаксимина, назначаемого по 200 мг 3 раза в день, при инфицировании добровольцев Shigella flexneri 2a (в дозе 1000–1500 КОЕ) клиническая картина острой дизентерии не развивалась и колонизации кишечника возбудителем не происходило. В то время как у добровольцев, получавших плацебо, в 60% случаев развивалась диарея, в т. ч. у 10% полная картина острой дизентерии, а у 50% шигеллы продолжительное время колонизировали толстую кишку (р = 0,001 по критерию Фишера).
Таким образом, рифаксимин (Альфа Нормикс) является неабсорбируемым антибиотиком местного действия с широким спектром антимикробной активности, хорошей переносимостью и безопасностью. Показана высокая клиническая и микробиологическая эффективность препарата при диареях путешественников и нетяжелом шигеллезе. Определенный интерес представляют данные об активности Альфа Нормикса в отношении простейших с точки зрения применения препарата при бактериально-протозойных инвазиях.
Таким образом, практическая деятельность инфекционистов не в полной мере соответствует официальной доктрине лечения ОКИ, излагаемой в учебниках для медицинских ВУЗов и руководствах по инфекционным болезням, приказах, методических рекомендациях и указаниях. Чем тяжелее протекает данный эпизод диарейной инфекции, тем реже в полном объеме выполняются рекомендованные диагностические исследования, тем чаще применяется комбинированная этиотропная терапия. Чаще всего для лечения ОКИ инфекций применяют три группы антимикробных препаратов — фторхинолоны, аминогликозиды и нитрофураны. Появление на отечественном рынке невсасывающегося антибиотика рифаксимина (Альфа Нормикс), эффективного при лечении прежде всего неинвазивных и нетяжелых инвазивных диарей, позволяет оптимизировать выбор этиотропных средств при ОКИ, прежде всего неустановленной природы.
С. М. Захаренко, доктор медицинских наук, профессор ВМА им. С. М. Кирова, Санкт-Петербург
Что такое дизентерия? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, инфекциониста со стажем в 14 лет.
Над статьей доктора Александрова Павла Андреевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Шигеллёзы, или дизентерия — это группа острых/хронических заболеваний, вызываемых бактериями рода Шигелла, которые поражают желудочно-кишечный тракт (преимущественно дистальный отдел толстой кишки). Манифестные формы (клиническая картина) дизентерии: синдром общей инфекционной интоксикации, синдром поражения желудочно-кишечного тракта (дистальный колит), синдром обезвоживания. При отсутствии адекватного лечения приводит к серьёзным осложнениям и хронизации.
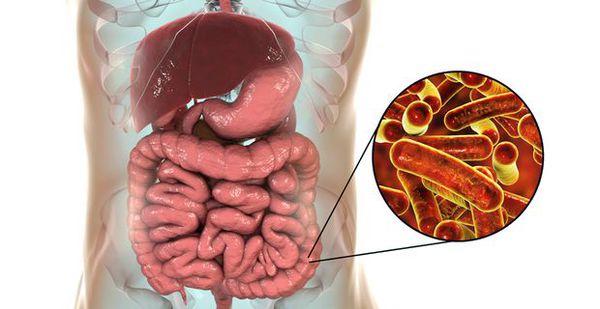
Возбудитель дизентерии
семейство — кишечные бактерии (Enterobacteriaceae)
род — Шигелла (Shigella)
виды — 4 основных:
- Dysenteriae (серовары — шигелла Григорьева-Шига, Штутцера-Шмитца, Ларджа-Сакса);
- Flexneri (Флекснера);
- Boydii (Боудии);
- Sonnei (Зонне).
Являются факультативно-анаэробными (способны существовать как при наличии, так и при отсутствии кислорода), граммотрицательными, неподвижными палочками. Хорошо растут на обычных питательных средах.
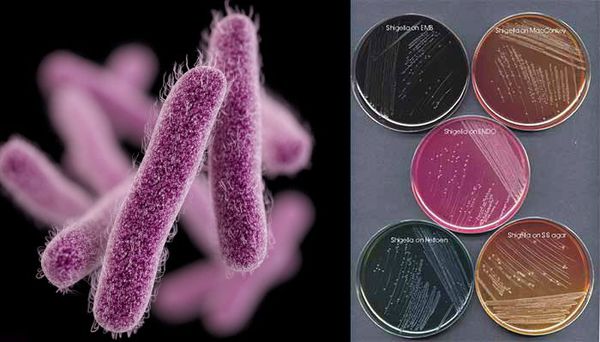
Имеют О-антиген (серологическая специфичность) и К-антиген (оболочечная структура). Клеточная стенка частично состоит из эндотоксина (липополисахарида), высвобождающегося при гибели микроорганизма. Бактерии вида Shigella Dysenteriae серовара Григорьева-Шига продуцируют высокоактивный цитотоксин, который нарушает синтез белка рибосомами клеток кишечного эпителия. Цитотоксин в совокупности с энтеротоксином (усиливающим секрецию жидкости и солей в просвет кишки) и нейротоксином (оказывающим нейротоксическое действие на сплетения Ауэрбаха) образует экзотоксином — токсин, выделяемый в процессе жизнедеятельности шигелл (Цитотоксин + энтеротоксин + нейротоксин = экзотоксин). Также у данной группы микроорганизмов происходит выделение гемолизинов — веществ, разрушающих эндотелий капилляров и вызывающий ишемию в тканях кишечника).
Факторы патогенности шигелл (механизм приспособления бактерий):
- адгезия (прикрепление к слизистой оболочке кишечника);
- инвазия (проникновение в эпителиальные клетки слизистой оболочки толстого кишечника);
- токсинообразование;
- внутриклеточное размножение.
Тинкториальные свойства (особенности микроорганизмов при окрашивании): быстро изменяют чувствительность к антибактериальным препаратам. Характерна высокая выживаемость во внешней среде (в воде, почве и пище при комнатной температуре сохраняются до 14 дней, в канализационных стоках — до 30 дней, при благоприятных условиях могут быть жизнеспособны до 4 месяцев). Способны к размножению в пищевых продуктах. При воздействии УФО (ультрафиолетового облучения) погибают за 10 минут, в 1% феноле — за 30 минут, при кипячении — мгновенно.
Интересная особенность: чем выше ферментативная активность возбудителя дизентерии, тем ниже вирулентность (минимальная доза возбудителя, способная заразить человека) и наоборот. [3] [6]
Эпидемиология
Антропоноз (повсеместное распространение).
Источник инфекции — человек (больной, носитель и лица с субклинической формой заболевания).
Минимальная инфицирующая доза для бактерии Григорьева-Шига — 10 микробных тел в 1 грамме вещества, для Флекснера — 10 2 бактерий, для Зонне — от 10 7 .
Длительное время в РФ превалировали случаи заражения, вызванные шигеллой Флекснера 2а, однако в настоящее время ввиду широкого развития туризма длительного преобладания какой-либо формы нет.
Механизм передачи — фекально-оральный (пищевой, водный, контактно-бытовой), из них преимущественно:
- Григорьева-Шига (контактно-бытовой путь);
- Зонне (с молоком и молочными продуктами);
- Флекснера (водный путь);
- Дизентериа (пищевой путь).
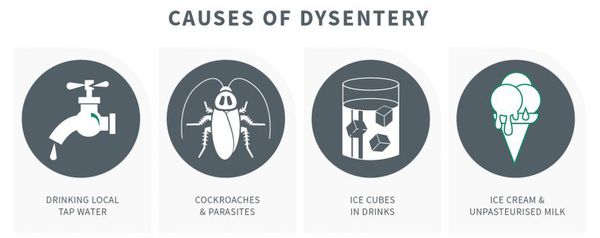
Наибольшую опасность представляют работники питания и водоснабжения. Больные заразны с начала болезни (конца инкубационного периода) и до трёх недель болезни.
Иммунитет непродолжителен и моноспецифичен (вырабатывается только к одному серотипу, который вызвал заболевание). [1] [4] [5]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы дизентерии
Инкубационный период — от 1 до 7 дней.
Начало заболевания острое (развитие основных синдромов наблюдается в первые сутки заболевания), характерна лихорадка постоянного типа.
Дизентерия представляет собой острую кишечную инфекцию, вызываемую бактериями рода Shigella, характеризующуюся преимущественной локализацией патологического процесса в слизистой оболочке толстого кишечника. Дизентерия передается фекально-оральным путем (пищевым или водным). Клинически у больного дизентерией наблюдается диарея, боли в животе, тенезмы, интоксикационный синдром (слабость, разбитость, тошнота). Диагноз дизентерии устанавливают при выделении возбудителя из испражнений пациента, при дизентерии Григорьева-Шиги – из крови. Лечение проводится преимущественно амбулаторно и заключается в регидратации, антибактериальной и дезинтоксикационной терапии.
Общие сведения
Дизентерия представляет собой острую кишечную инфекцию, вызываемую бактериями рода Shigella, характеризующуюся преимущественной локализацией патологического процесса в слизистой оболочке толстого кишечника.
Характеристика возбудителя
Возбудители дизентерии – шигеллы, в настоящее время представлены четырьмя видами (S. dysenteriae, S.flexneri, S. boydii, S. Sonnei), каждый из которых (за исключением шигеллы Зонне) в свою очередь подразделяется на серовары, которых в настоящее время насчитывается более пятидесяти. Популяция S. Sonnei однородна по антигенному составу, но различается по способности продуцировать различные ферменты. Шигеллы – неподвижные грамотрицательные палочки, спор не образуют, хорошо размножатся на питательных средах, во внешней среде обычно малоустойчивы.
Оптимальная температурная среда для шигелл - 37 °С, палочки Зонне способны к размножению при температуре 10-15 °С, могут образовывать колонии в молоке и молочных продуктах, могут длительно сохранять жизнеспособность в воде (как и шигеллы Флекснера), устойчивы к действию антибактериальных средств. Шигеллы быстро погибают при нагревании: мгновенно - при кипячении, через 10 минут - при температуре более 60 градусов.
Резервуаром и источником дизентерии является человек - больной или бессимптомный носитель. Наибольшее эпидемиологическое значение имеют больные с легкой или стертой формой дизентерии, в особенности, имеющие отношение к пищевой промышленности и учреждениям общественного питания. Шигеллы выделяются из организма зараженного человека, начиная с первых дней клинической симптоматики, заразность сохраняется в течение 7-10 дней, после чего следует период реконвалесценции, в который, однако, также не исключено выделение бактерий (иногда может продолжаться несколько недель и месяцев).
Дизентерия Флекснера наиболее склонна к переходу в хроническую форму, наименьшая тенденция к хронизации отмечается при инфекции, вызванной бактериями Зонне. Дизентерия передается с помощью фекально-орального механизма преимущественно пищевым (дизентерия Зонне) или водным (дизентерия Флекснера) путем. При передаче дизентерии Григорьева-Шиги реализуется преимущественно контактно-бытовой путь передачи.
Люди обладают высокой естественной восприимчивостью к инфекции, после перенесения дизентерии формируется нестойкий типоспецифический иммунитет. Переболевшие дизентерией Флекснера могут сохранять постинфекционный иммунитет, предохраняющий от повторного заболевания в течение нескольких лет.
Патогенез дизентерии
Шигеллы попадают с пищей или водой в пищеварительную систему (частично погибая под воздействием кислого содержимого желудка и нормального биоценоза кишечника) и достигают толстой кишки, частично внедряясь в её слизистую оболочку и вызывая воспалительною реакцию. Пораженная шигеллами слизистая склонна к образованию участков эрозий, язв, кровоизлияний. Выделяемые бактериями токсины нарушают пищеварение, а также присутствие шигелл разрушает естественный биобаланс кишечной флоры.
Классификация
В настоящее время применяется клиническая классификация дизентерии. Выделяют ее острую форму (различается по преимущественной симптоматике на типичную колитическую и атипичную гатроэнтеритическую), хроническую дизентерию (рецидивирующую и непрерывную) и бактериовыделение (реконвалесцентное или субклиническое).
Симптомы дизентерии
Острая дизентерия в гастроэнтеритическом варианте характеризуется коротким инкубационным периодом (6-8 часов) и преимущественно энтеральными признаками на фоне общеинтоксикационного синдрома: тошнотой, многократной рвотой. Течение напоминает таковое при сальмонеллезе или токсикоинфекции. Боль при этой форме дизентерии локализуется в эпигастральной области и вокруг пупка, имеет схваткообразный характер, стул жидкий и обильный, патологические примеси отсутствуют, при интенсивной потере жидкости может отмечаться дегидратационный синдром. Симптоматика гастроэнтеритической формы бурная, но кратковременная.
Первоначально гастроэнтероколитическая дизентерия также напоминает по своему течению пищевую токсикоинфекцию, в последующем начинает присоединяться колитическая симптоматика: слизь и кровянистые прожилки в каловых массах. Тяжесть течения гастроэнтероколитической формы определяется выраженностью дегидратации.
Дизентерия стертого течения на сегодняшний день возникает довольно часто. Отмечается дискомфорт, умеренная болезненность в животе, кашицеобразный стул 1-2 раза в день, в основном без примесей, гипертермия и интоксикация отсутствуют (либо крайне незначительна). Дизентерия, продолжающаяся более трех месяцев, признается хронической. В настоящее время случаи хронической дизентерии в развитых странах кране редки. Рецидивирующий вариант представляет собой периодические эпизоды клинической картины острой дизентерии, перемежающиеся периодами ремиссии, когда больные чувствуют себя относительно благополучно.
Непрерывная хроническая дизентерия ведет к развитию тяжелых нарушений пищеварения, органических изменений слизистой оболочки кишечной стенки. Интоксикационная симптоматика при непрерывной хронической дизентерии обычно отсутствует, имеет место постоянная ежедневная диарея, испражнения кашицеобразные, могут иметь зеленоватый оттенок. Хронические нарушения всасывания ведут к снижению массы тела, гиповитаминозам, развитию синдрома мальабсорбции. Реконвалесцентное бактериовыделение обычно наблюдается после перенесения острой инфекции, субклиническое - бывает при перенесении дизентерии в стертой форме.
Осложнения
Осложнения при современном уровне медицинской помощи встречаются крайне редко, преимущественно в случае тяжело протекающей дизентерии Григорьева-Шиги. Эта форма инфекции может осложниться инфекционно-токсическим шоком, перфорацией кишечника, перитонитом. Кроме того, вероятно развитие парезов кишечника.
Дизентерия с интенсивной длительной диареей может осложниться геморроем, анальной трещиной, выпадением прямой кишки. Во многих случаях дизентерия способствует развитию дисбактериоза.
Диагностика
Максимально специфична бактериологическая диагностика. Выделение возбудителя обычно производят из испражнений, а в случае дизентерии Григорьева-Шиги – из крови. Поскольку нарастание титра специфических антител происходит довольно медленно, методы серологической диагностики (РНГА) имеют ретроспективное значение. Все больше в лабораторную практику диагностирования дизентерии входит выявление антигенов шигелл в испражнениях (обычно производят с помощью РКА, РЛА, ИФА и РНГА с антительным диагностикумом), реакция связывания комплимента и агрегатгемаглютинации.
В качестве общих диагностических мер применяют различные лабораторные методики для определения степени тяжести и распространенности процесса, выявления метаболических нарушений. Проводят анализ кала на дисбактериоз и копрограмму. Эндоскопическое исследование (ректороманоскопия) нередко может дать необходимую информацию для дифференциального диагноза в сомнительных случаях. С этой же целью пациентам с дизентерией, в зависимости от ее клинической формы, может понадобиться консультация гастроэнтеролога или проктолога.
Лечение дизентерии
Легкие формы дизентерии лечатся амбулаторно, стационарное лечение показано лицам с тяжело протекающей инфекцией, осложненными формами. Также госпитализируют больных по эпидемиологическим показаниям, в старческом возрасте, имеющих сопутствующие хронические заболевания, и детей первого года жизни. Пациентам назначают постельный режим при лихорадке и интоксикации, диетическое питание (в острый период – диета №4, при стихании диареи – стол №13).
Этиотропная терапия острой дизентерии заключается в назначении 5-7-дневного курса антибактериальных средств (антибиотики фторхинолонового, тетрациклинового ряда, ампициллина, котримоксазола, цефалоспоринов). Антибиотики назначают при тяжелых и среднетяжелых формах. С учетом способности антибактериальных препаратов усугублять дисбактериоз, в комплексе применяют эубиотики курсом в течение 3-4 недель.
При необходимости производится дезинтоксикационная терапия (в зависимости от тяжести дезинтоксикации препараты назначают орально или парентерально). Коррекцию нарушений всасывания производят с помощью ферментных препаратов (панкреатин, липаза, амилаза, протеаза). По показаниям назначают иммуномодуляторы, спазмолитики, вяжущие средства, энтеросорбенты.
Для ускорения регенеративных процессов и улучшения состояния слизистой в период реконвалесценции рекомендованы микроклизмы с настоем эвкалипта и ромашки, маслом шиповника и облепихи, винилина. Хроническая форма дизентерии лечится так же, как и острая, но антибиотикотерапия обычно менее эффективна. Рекомендовано назначение лечебных клизм, физиотерапевтическое лечение, бактериальные средства для восстановления нормальной микрофлоры кишечника.
Прогноз и профилактика
Прогноз преимущественно благоприятный, при своевременном комплексном лечении острых форм дизентерии хронизация процесса крайне редка. В некоторых случаях после перенесения инфекции могут сохраниться остаточные функциональные нарушения работы толстого кишечника (постдизентерийный колит).
Общие меры профилактики дизентерии подразумевают соблюдение санитарно-гигиенических норм в быту, в пищевом производстве и на предприятиях общественного питания, контроль за состоянием водных источников, очистку канализационных отходов (в особенности дезинфекция сточных вод лечебных учреждений).
Больных дизентерией выписывают из стационара не ранее, чем спустя три дня после клинического выздоровления при отрицательном однократном бактериологическом тесте (забор материала для бактериологического исследования производится не ранее 2 дня после окончания лечения). Работники пищевой промышленности и другие лица, приравненные к ним, подлежат выписке после двукратного отрицательного результата бактериологического анализа.
Этиология. С 1930 г. бациллы, выделяемые от больных дизентерией, официально были объединены в род Shigella, семейство Enterobacteriaceae. Идентификация шигелл осуществляется по их биохимическим и антигенным свойствам (О — антигенам), в соответствии с чем выделяют четыре группы шигелл (см. таблицу 1).
По своим морфологическим свойствам шигеллы представляют собой неподвижные, грамотрицательные бактерии. Общим и важнейшим свойством всех представителей рода Shigella является инвазивность, т. е. способность бактерий к инвазии в эпителиальные клетки кишечника с последующим размножением и паразитированием в них. Различные виды шигелл сильно отличаются по своим исходным биологическим свойствам, что, собственно, и определяет степень их вирулентности и патогенности для человека. Наиболее высокой вирулентностью обладают Sh. dysenteriae 1, что обусловлено прежде всего их способностью продуцировать один из мощнейших природных токсинов — Шига-токсин. Некоторые другие виды шигелл также способны продуцировать шига-подобные токсины, но с существенно более низкой активностью. Исключительно высокие вирулентные свойства Sh. dysenteriae 1 определяют крайне низкую инфицирующую дозу, которая составляет всего десятки или сотни микробных клеток. Для других видов шигелл инфицирующая доза определяется на один-два порядка выше.
Шигеллы относительно устойчивы к факторам внешней среды и способны длительно сохраняться на предметах домашнего обихода, в воде они сохраняют свою жизнеспособность до двух-трех недель, а в высушенном и замороженном состоянии — до нескольких месяцев. Высокие же температуры, наоборот, способствуют быстрой их гибели: при температуре +60°С — в течение 10 мин, а при кипячении — мгновенно. Достаточно высокую чувствительность шигеллы проявляют к дезинфицирующим средствам, ультрафиолетовым и прямым солнечным лучам.
Несмотря на разнообразие возбудителей шигеллезов, наибольшее эпидемическое значение для большинства стран мира имеют Sh. flexneri и Sh. sonnei. Хотя шигеллы распространены повсеместно (антропонозная инфекция), наиболее высокие показатели заболеваемости регистрируются в странах и регионах с низкой санитарией и высокой плотностью населения, что существенно облегчает возможность передачи возбудителя от человека к человеку. По расчетным данным, ежегодно в мире регистрируется около 140 млн случаев заболеваний шигеллезами. Восприимчивость к шигеллезной инфекции у лиц разных возрастных групп неодинакова. Наиболее восприимчивы к ним дети до двух-трех лет.
Патогенез. Основу патогенеза инфекционных заболеваний составляют особенности и характер взаимодействия микробов не только с клетками макроорганизма, но и с неспецифическими и специфическими защитными системами организма.
Шигеллы обладают достаточно выраженными вирулентными свойствами, вследствие чего заболевание может развиваться и при невысокой инфицирующей дозе (в сравнении с такими энтеропатогенными бактериями, как сальмонеллы и кишечные палочки). Благодаря относительной резистентности к действию желудочного сока и желчных кислот, шигеллы, не теряя своей вирулентности, проходят через желудочный барьер и проксимальные отделы тонкой кишки. В патогенезе заболевания выделяют тонко- и толстокишечные фазы, степень выраженности которых в конечном итоге и определяет вариант течения заболевания. У больных с типичным, колитическим вариантом острой дизентерии, тонкокишечная фаза клинически вообще не манифестируется, и заболевание изначально проявляется поражением дистального отдела толстой кишки. Тонкокишечная фаза обычно бывает непродолжительной и ограничивается двумя-тремя днями. Первичная транслокация шигелл через эпителиальный барьер осуществляется специализированными М-клетками, способными транспортировать как сами бактерии, так и их антигены в лимфатические образования кишечника (фолликулы, Пейеровы бляшки) с последующим их проникновением в эпителиальные клетки и резидентные макрофаги. Высвобождаемые в процессе транслокации шигелл токсические субстанции (экзо- и эндотоксины, энтеротоксины и т. д.) инициируют развитие синдрома интоксикации [3], который при шигеллезах всегда предшествует развитию диарейного синдрома.
Ключевым фактором вирулентности шигелл является их инвазивность, т. е. способность к внутриклеточному проникновению, размножению и паразитированию в клетках слизистой оболочки толстой кишки (преимущественно в дистальном отделе) и резидентных макрофагах собственной пластинки (см. рисунок 1). Посредством макроцитопиноза шигеллы проникают в цитоплазму эпителиальных клеток, где очень быстро лизируют фагосомальную мембрану, что приводит к повреждению клеток и их гибели. Последующее распространение шигелл происходит через базолатеральные мембраны эпителиальных клеток. Повреждение и разрушение эпителиальных клеток сопровождаются развитием воспалительной инфильтрации полиморфно-ядерными лейкоцитами собственной пластинки, формированием язв и эрозий слизистой оболочки толстой кишки, что клинически проявляется развитием диареи экссудативного типа. Способность к инвазии и внутриклеточному размножению шигелл кодируется генетическими механизмами, экспрессия которых происходит только в условиях in vivo. Несмотря на инвазивность, шигеллы не способны к глубокому распространению, в силу чего системной диссеминации возбудителя при шигеллезах, как правило, не происходит (за исключением Sh. dysenteriae 1).
Моторика кишечника является важным защитным механизмом, ограничивающим и препятствующим прикреплению и инвазии шигелл к эпителиальным клеткам, что наглядно демонстрируют затягивание и утяжеление инфекционного процесса у лиц, получающих препараты, подавляющие моторику кишечника.
Наблюдаемые у больных с шигеллезами дисбиотические изменения в составе нормальной микрофлоры толстого кишечника оказывают существенное влияние на скорость репарации слизистой в стадии реконвалесценции и восстановление функциональной активности кишечника.
После перенесенного заболевания у больных формируется непродолжительный (до одного года) типо- и видоспецифический иммунитет, в силу чего возможно реинфицирование.
Клиника. Клиническая картина шигеллезов весьма вариабельна, что нашло свое отражение в применяемой клинической классификации заболевания (см. таблицу 2). Хотя считается, что Sh. sonnei, как менее вирулентные штаммы шигелл, чаще вызывают более легкие формы заболевания, следует помнить, что этиология шигеллеза лишь предопределяет, но не определяет особенностей течения заболевания у конкретных больных (по форме, варианту и тяжести течения).
Хроническая форма дизентерии в настоящее время встречается достаточно редко и, по данным литературы, не превышает в 1-2% случаев, хотя существует мнение, что столь низкий ее удельный вес может быть обусловлен недостаточно разработанными критериями диагностики. Значительно чаще врачи в своей практической деятельности встречаются с острыми формами шигеллезов, которые и представляют наибольший интерес в плане адекватной оценки выявляемой у больного клинической картины заболевания, полноты обследования, правильности и своевременности проводимой терапии.
Инкубационный период при шигеллезах может варьировать от 8—12 ч (при гастроэнтеритическом варианте) до пяти дней (при колитическом варианте заболевания), составляя, в среднем, два–три дня.
Если примесь слизи в стуле является типичным признаком острой дизентерии, то кровь может присутствовать в микроскопических количествах и обнаруживаться только при копроцитоскопическом исследовании. Визуализируемая примесь крови в стуле определяется в виде прожилок. При более тяжелом течении заболевания дефекация может заканчиваться выделением небольшого количества слизи с прожилками крови.
Критериями тяжести течения колитического варианта острой дизентерии являются выраженность интоксикационного синдрома и характер поражения дистального отдела слизистой толстого кишечника (см. таблицу 3). Выраженного обезвоживания у больных при колитическом варианте острой дизентерии не выявляется ввиду отсутствия рвоты и скудного характера стула.
Гастроэнтероколитический вариант дизентерии также характеризуется острым началом заболевания: с озноба, лихорадки, головной боли и одновременным появлением синдрома гастроэнтерита — спастических болей в эпигастральной области, тошноты, рвоты, жидкого водянистого стула. Клинические признаки колита в первые сутки заболевания, как правило, отсутствуют и появляются лишь спустя один—три дня, что соответствует патоморфологическим этапам поражения слизистой желудочно-кишечного тракта. В зависимости от кратности рвоты и интенсивности диарейного синдрома, у больных достаточно рано выявляются признаки обезвоживания организма (сухость слизистых ротоглотки, бледность кожных покровов и цианоз, заостренные черты лица, снижение артериального давления, олигоурия и др.). С момента распространения патологического процесса на слизистую толстого кишечника проявления гастроэнтерита постепенно купируются: рвота прекращается, уменьшается объем испражнений, в стуле появляются патологические примеси (слизь и кровь). В зависимости от характера поражения слизистой дистального отдела толстой кишки, больные могут отмечать появление тенезмов и ложных позывов. При пальпации живота в первые дни заболевания отмечается урчание по ходу толстого кишечника, а в последующие дни появляется и нарастает болезненность и спазм сигмовидной кишки.
Тяжесть течения гастроэнтероколитического варианта дизентерии определяется на основании выраженности интоксикации и обезвоживания организма. В большинстве случаев оно не превышает II-III степени.
Редким вариантом течения острой дизентерии является гастроэнтеритический, характеризующийся большим сходством с пищевыми токсикоинфекциями.
Осложнения. Хотя наиболее высок риск развития осложнений у больных дизентерией, вызванной Sh. dysenteriae 1, на современном этапе прослеживается отчетливая тенденция к увеличению тяжелых форм дизентерии, обусловленных другими видами шигелл (в частности, Sh. flexneri), что, соответственно, отражается и на возможности развития осложнений. К числу наиболее грозных осложнений относятся: инфекционно-токсический шок; перфорация кишечника с развитием перитонита; энцефалический синдром (синдром фатальной энцефалопатии или синдром Ekiri), который преимущественно развивается у детей и иммунокомпрометированных пациентов при дизентерии, обусловленной Sh. sonnei или Sh. flexneri; бактериемия, выявляющаяся при дизентерии Sh. dysenteriae 1 в 8% случаев и крайне редко — при инфицировании другими видами шигелл (у детей до года, ослабленных, истощенных и иммунокомпрометированных пациентов); гемолитико-уремический синдром, развивающийся через неделю от начала заболевания и характеризующийся микроангиопатической гемолитической анемией, тромбоцитопенией и острой почечной недостаточностью. Нередко у больных могут развиваться осложнения, связанные с активизацией вторичной микрофлоры: пневмонии, отиты, инфекции мочевыводящих путей и др. К числу редких, но вероятных осложнений относятся реактивный артрит и синдром Рейтера (около 2% заболевших, экспрессирующих HLA-B27). В последние годы обсуждается возможная роль шигеллезов в формировании синдрома раздраженного кишечника.
Диагностика и дифференциальная диагностика. Специфическая диагностика шигеллезов основана на выделении и идентификации шигелл из испражнений больного и проведения серологических и/или иммунологических исследований, направленных на обнаружение антигенов шигелл или антител к ним. Без лабораторного подтверждения диагноз дизентерии может быть установлен только при типичной клинической картине.
Хотя диагностическая ценность эндоскопического исследования толстой кишки (ректороманоскопия и фиброколоноскопия) у больных с подозрением на шигеллезы ограничена, полученная при ее проведении информация позволяет: а) объективно оценить характер поражения слизистой толстой кишки; б) проводить дифференциальную диагностику и в) контролировать эффективность проводимой терапии.
В зависимости от характера поражения выделяют следующие варианты проктосигмоидита: катаральный, катарально-геморрагический, эрозивный, эрозивно-язвенный и фибринозный, которые, как правило, соответствуют тяжести течения заболевания.
При проведении дифференциальной диагностики в первую очередь необходимо исключить другие острые кишечные инфекционные заболевания, для которых типично развитие экссудативной диареи, а именно энтероинвазивные эшерихиозы, сальмонеллез, иерсиниоз (Y. enterocolitica), кампилобактериоз (Campylobacter jejuni), инфекция Clostridium difficile и амебиаз (протозойное заболевание, обусловленные Entamoeba histolytica). Кроме этого, необходимо помнить, что под маской шигеллезов могут дебютировать такие заболевания, как неспецифический язвенный колит и болезнь Крона.
Лечение. Лечение больных дизентерией может осуществляться не только в условиях специализированного инфекционного отделения, но и амбулаторно, что определяется клиническими и эпидемиологическими показаниями. В первую очередь следует госпитализировать пациентов со среднетяжелыми и тяжелыми формами заболевания, при затяжном и хроническом течении — пациентов с тяжелыми сопутствующими заболеваниями, детей до одного года и пожилых, а также лиц, представляющих эпидемическую опасность (независимо от варианта и тяжести течения заболевания) — работников пищевых предприятий и лиц, к ним приравненных.
Учитывая характер поражения слизистой кишечника, пациенты с дизентерией, особенно в острый период болезни, нуждаются в строгом соблюдении лечебного питания. Из рациона следует исключить любые продукты, оказывающие раздражающее (механическое, химическое и др.) действие. Ввиду формирующейся у больных недостаточности лактозы, из диеты исключается цельное молоко. Расширение диеты осуществляют постепенно, только по мере выздоровления больного. И все же переход на обычное питание следует осуществлять не ранее полного выздоровления, характеризующееся репарацией слизистой (см. таблицу 3).
Поскольку антибактериальная терапия всегда рекомендовалась для лечения больных дизентерией, серьезную проблему на сегодняшний день представляет формирование у шигелл резистентности к антимикробным препаратам, особенно в тех странах, где осуществляется их безрецептурная продажа и самолечение [5]. Недавно проведенные в нашей стране исследования [6] подтвердили высокую частоту резистентности у Sh. flexneri и Sh. sonnei к цефотаксиму (96,6 и 94,2%, соответственно), тетрациклину (97,7 и 92,8%), левомицетину (93,2 и 50,7%), ампициллину (95,5 и 26,1) и ампициллину/сульбактаму (95,5 и 23,2%). Резистентность не была выявлена лишь к ципрофлоксацину, норфлоксацину и налидиксовой кислоте.
Выбор антимикробного препарата и схема его применения у больных дизентерией определяются вариантом и тяжестью течения заболевания. При гастроэнтеритическом варианте антимикробная терапия не показана и больным назначают лишь патогенетическую терапию. При легком течении колитического и гастроэнтероколитического вариантов дизентерии больным целесообразно назначать фуразолидон по 0,1 г четыре раза в день или налидиксовую кислоту (невиграмон) по 0,5-1,0 г четыре раза в день в течение трех—пяти дней. Наиболее эффективными средствами для лечения больных со среднетяжелым и тяжелым течением дизентерии являются препараты фторхинолонового ряда (ципрофлоксацин, норфлоксацин и др.), цефалоспорины III поколения (цефотаксим), которые назначают в общетерапевтических дозах в течение пяти—семи дней. При тяжелом течении может проводиться комбинированная антибактериальная терапия (фторхинолоны и аминогликозиды; цефалоспорины и аминогликозиды).
Кроме антибактериальной терапии важное место в лечении больных дизентерией занимает патогенетическое лечение, включающее проведение дезинтоксикации и регидратации. В острый период заболевания больным целесообразно назначать десмол и смекту, обладающие противовоспалительным и мембраностабилизирующим действием на слизистую кишечника. После купирования интоксикационного синдрома больным показаны препараты, нормализующие процессы пищеварения и всасывания (дигестал, мезим-форте, панзинорм, фестал, холензим, ораза и др.). Коррекцию микробиоценоза кишечника следует проводить только в периоде реконвалесценции, когда купирована островоспалительная реакция. В этот же период больным показаны физиотерапевтические процедуры, ускоряющие процесс репарации слизистой толстого кишечника.
Литература
В. А. Малов, доктор медицинских наук, профессор
А. Н. Горобченко, кандидат медицинских наук
ММА им. И.М. Сеченова
Инфекционные болезни включают обширную группу заболеваний, вызываемых специфическими патогенными (болезнетворными) возбудителями и передаваемых от зараженного индивидуума к здоровому. Особенностями инфекционных болезней служат их контагиозность (заразность), способность к массовому эпидемическому распространению, цикличность течения и образование постинфекционного иммунитета. Однако эти особенности у разных инфекционных болезней выражены в различной степени.
Септикопиемия – это форма (фаза) течения сепсиса, для которой характерно появление пиемических метастатических очагов в различных органах вследствие гематогенного заноса инфекции. Протекает с явлениями выраженной интоксикации, усугубляющейся образованием абсцессов в мягких тканях, печени, развитием абсцедирующей пневмонии, гнойного менингита, остеомиелита, эндомиокардита и др. Диагностируется по результатам клинической картины, инструментальной визуализации (обнаружение абсцессов по данным УЗИ, МРТ), выявления бактериемии. Лечение сочетает массивную антибиотикотерапию, инфузионную терапию с хирургическим удалением гнойных очагов. .
Сибирская язва является острым, особо опасным инфекционным заболеванием, возникающим у человека и животных при заражении Bacillus anthracis, протекающим с формированием на коже специфических карбункулов, либо в септической форме. Источником инфекции являются дикие животные и скот, заражение происходит контактным путем. Инкубационный период сибирской язвы в среднем составляет 3-5 дней. Диагностика осуществляется в 3 этапа: микроскопия мокроты или отделяемого кожных элементов, бакпосев, биопробы на лабораторных животных. Лечение сибирской язвы осуществляется пенициллинами. При кожной форме оно сочетается с местным лечением язв и карбункулов. .
Сигуатера – это заболевание, возникающее при употреблении в пищу некоторых видов рифовых рыб. Самыми частыми симптомами являются неврологические проявления, такие как парестезии лица, конечностей, галлюцинации, головная боль, потеря сознания, бред. Нередки нейропсихологические, сердечно-сосудистые, желудочно-кишечные нарушения. Диагностика заключается в обнаружении токсина в еде, характерных симптомах болезни. Лечение патогенетическое и симптоматическое; этиотропная терапия сигуатеры не разработана, лечебные меры направлены на дезинтоксикацию организма. .
Скарлатина представляет собой острую инфекцию с преимущественным поражением ротоглотки, выраженной интоксикацией и характерной экзантемой. Возбудителем скарлатины является стрептококк группы А, который передается от больного контактным или воздушно-капельным путем. Клиника скарлатины включает общую интоксикацию и лихорадку, скарлатинозную ангину, регионарный лимфаденит, малиновый язык, мелкоточечную сыпь с последующим мелкочешуйчатым шелушением на коже. Диагностика скарлатины осуществляется на основании наличия типичных клинических симптомов. .
Содоку – заболевание группы спирохетозов, развивающееся при укусе мышевидных грызунов, протекающее с рецидивирующей лихорадкой и кожными проявлениями. Симптомы содоку включают первичный аффект (инфильтрат с изъявлением в месте укуса, лимфангит), а также повторяющиеся приступы лихорадки, полиморфную сыпь, регионарный лимфаденит. Методами специфической диагностики содоку служат микроскопия толстой капли крови и мазка из первичного аффекта, бактериологический посев, серологические реакции, биологическая проба. Возбудитель содоку чувствителен к назначению пенициллинов, тетрациклинов, цефалоспоринов, макролидов. .
Сонная болезнь – протозооз, возбудителем которого выступают простейшие рода Trypanosoma, а переносчиками - кровососущие мухи цеце. Симптоматика сонной болезни характеризуется образованием на месте укуса первичного аффекта (трипаносомного шанкра), волнообразной лихорадкой, лимфаденитом, кожными высыпаниями, местными отеками, нарастающей сонливостью, параличами, психическими расстройствами, комой. Диагностика сонной болезни основана на обнаружении трипаносом в биологическом материале (пунктате шанкра, лимфоузлов, крови, спинномозговой жидкости). Терапия сонной болезни проводится препаратами пентамидин, сурамин, меларсопрол, эфлорнитин. .
СПИД – это стадия хронического инфекционного заболевания, вызванного вирусом иммунодефицита человека. Проявления болезни вызваны прогрессирующим снижением иммунных сил организма, часто носят генерализованный характер и вызываются условно-патогенной флорой. Диагностика СПИДа направлена на определение наличия и количества ВИЧ в крови человека, антител к вирусу, числа иммунокомпетентных клеток. Лечение направлено на подавление размножения возбудителя с помощью этиотропных противовирусных средств, элиминацию микроорганизмов, провоцирующих вторичные патологии (грибков, бактерий, вирусов и других). .
Споротрихоз – это хроническое грибковое поражение организма с типичными кожными проявлениями. Могут наблюдаться изолированный легочный, костно-суставной и генерализованный (с вовлечением всех органов и систем) варианты болезни. Обычно патология сопровождается высыпаниями на коже и слизистых, лихорадкой различной степени выраженности. Диагностика предусматривает обнаружение грибка с помощью лабораторных методик, рентгенологические исследования. Лечение длительное с применением этиотропных противогрибковых средств и препаратов йода, в некоторых случаях – хирургического пособия, а также местной и симптоматической терапии. .
Столбняк - это инфекционное заболевание, вызываемое бактерией Clostridium tetani, с острым характером течения и преимущественным поражением нервной системы. Споры возбудителя столбняка могут длительное время сохраняться в почве, воде и на любых предметах. Заражение человека происходит при проникновении клостридий через поврежденную кожу или слизистые. Основу клинической картины столбняка составляют тонические судороги мышц конечностей и туловища, нарастающее мышечное напряжение, опистатонус. Наиболее критическими считаются 10-14 день заболевания. Высока вероятность смертельного исхода. .
Стрептококковые инфекции – группа заболеваний, включающая инфекции, вызываемые стрептококковой флорой разных видов и проявляющихся в виде поражения дыхательных путей и кожных покровов. К стрептококковым инфекциям относят стрептококковое импетиго, стрептодермию, стрептококковый васкулит, ревматизм, гломерулонефрит, рожу, ангину, скарлатину и другие заболевания. Стрептококковые инфекции опасны склонностью к развитию постинфекционных осложнений со стороны различных органов и систем. Поэтому диагностика включает не только выявление возбудителя, но и инструментальное обследование сердечно-сосудистой, дыхательной и мочевыделительной систем. .
Стронгилоидоз – инвазия круглыми гельминтами - кишечными угрицами, протекающая с аллергическим и гастроинтестинальным синдромами. Манифестное течение стронгилоидоза сопровождается зудящими кожными высыпаниями, кашлем с астматическим компонентом, тошнотой, рвотой, диареей, миалгиями, артралгиями, гепатоспленомегалией, желтушностью кожи и склер. Диагноз стронгилоидоза подтверждается с помощью обнаружения личинок глистов в кале или дуоденальном содержимом, а также антител к гельминту в крови. Лечение стронгилоидоза осуществляется противогельминтными препаратами (тиабендазол, ивермектин). .
Сыпной тиф – риккетсиоз, протекающий с деструктивными изменениями эндотелия сосудов и развитием генерализованного тромбоваскулита. Основные проявления сыпного тифа связаны с риккетсиемией и специфическими изменениями сосудов. Они включают в себя интоксикацию, лихорадку, тифозный статус, розеолезно-петехиальную сыпь. В числе осложнений сыпного тифа – тромбозы, миокардиты, менингоэнцефалиты. Подтверждению диагноза способствует проведение лабораторных проб (РНГА, РНИФ, ИФА). Этиотропная терапия сыпного тифа осуществляется антибиотиками группы тетрациклинов или хлорамфениколом; показана активная дезинтоксикация, симптоматическое лечение. .
Тениаринхоз - паразитарное заболевание из группы биогельминтозов, проявляющееся симптомами поражения пищеварительного тракта и токсико-аллергическими реакциями. При тениаринхозе наблюдаются тошнота, абдоминальные боли, неустойчивый стул, резкое повышение аппетита и потеря веса, самостоятельное выползание члеников паразита через анус, астеновегетативный и невротический синдромы, крапивница. Диагноз тениаринхоза основан на данных анамнеза, копроовоскопии, перианально-ректального соскоба, рентгенографии тонкого кишечника. Лечение тениаринхоза заключается в приеме противогельминтных препаратов (никлозамид, празиквантел). .
Тениоз – гельминтоз, обусловленный паразитированием в тонком кишечнике свиного цепня и характеризующийся признаками расстройства пищеварения и астено-невротическими проявлениями. Течение тениоза сопровождается снижением аппетита, болями в животе, тошнотой, рвотой, нарушением стула, головокружением и головными болями, расстройством сна, обморочными состояниями. Опасным осложнением тениоза может явиться цистицеркоз глаз и мозга. Диагноз тениоза выставляется на основании обнаружения члеников свиного цепня в испражнениях или перианальном соскобе. В качестве специфических противогельминтных препаратов используются никлозамид, празиквантел и др. .
Токсокароз – это хроническое инфекционное заболевание, вызываемое личинками круглого червя токсокары. Для инвазии характерна лихорадка, рецидивирующие высыпания и увеличение размеров печени. Патология сопровождается поражением глазных яблок и внутренних органов: сердца, головного мозга, легких. Диагностика заключается в обнаружении специфических антител к возбудителю. Лечение этиотропное (антигельминтные препараты), также применяются средства симптоматической терапии, в некоторых случаях производятся хирургические вмешательства. .
Токсоплазмоз - зоонозная протозойная инфекция, имеющая длительное течение и приводящая к поражению нервной, лимфатической, зрительной, мышечной систем, миокарда, печени, селезенки. Острый токсоплазмоз протекает с лихорадочно-интоксикационным синдромом, лимфаденопатией, гепатоспленомегалией, кожными высыпаниями; в тяжелых случаях – с развитием миокардита, энцефалита, энцефаломиелита. Диагноз токсоплазмоза устанавливается с помощью бактериологического посева, ПЦР, ИФА. Лечение токсоплазмоза включает прием этиотропных антипаразитарных препаратов, десенсибилизирующих, общеукрепляющих средств, иммунотерапию токсоплазмином. .
ТОРС – это воспалительная патология легочной ткани вирусной этиологии. Характеризуется нарастающей тяжелой дыхательной недостаточностью вследствие респираторного дистресс-синдрома. Клиническая картина также включает в себя лихорадку, сухой кашель, выраженную одышку. Диагностика осуществляется с помощью молекулярно-генетических методов (выявление возбудителя) и серологических исследований (поиск антител). Лечение заболевания преимущественно патогенетическое и симптоматическое, этиотропного препарата с доказанной вирулицидной эффективностью в настоящее время не разработано. .
Трихинеллез – это острая инфекция, вызываемая круглыми червями. Характерными симптомами являются разнообразные аллергические реакции и сильные боли в мышцах. Нередко наблюдается отечный синдром и лихорадка. Диагностика трихинеллеза включает в себя серологические методики и обнаружение возбудителя в биоптатах пораженной мышечной ткани. Этиотропные методы лечения предполагают применение антигельминтных препаратов, симптоматическая терапия должна быть направлена на купирование аллергических реакций и отеков, дезинтоксикацию, коррекцию белковых и электролитных нарушений. .
Трихоцефалез – кишечная инвазия, вызываемая паразитированием круглого гельминта – власоглава и протекающая с преимущественным нарушением функции пищеварительного тракта и нервной системы. Дисфункция ЖКТ при трихоцефалезе характеризуется снижением аппетита, слюнотечением, тошнотой, рвотой, болями в животе, поносами или запорами; поражение ЦНС приводит к головным болям, головокружению, нарушению сна, иногда – обморокам и судорогам. Трихоцефалез диагностируется на основании обнаружения яиц власоглава в кале или взрослых гельминтов в просвете кишечника с помощью эндоскопии. Лечение трихоцефалеза проводится антигельминтными препаратами (албендазол, мебендазол, карбендацим и др.). .
Инфекционные болезни
Инфекционные болезни включают обширную группу заболеваний, вызываемых специфическими патогенными (болезнетворными) возбудителями и передаваемых от зараженного индивидуума к здоровому. Особенностями инфекционных болезней служат их контагиозность (заразность), способность к массовому эпидемическому распространению, цикличность течения и образование постинфекционного иммунитета. Однако эти особенности у разных инфекционных болезней выражены в различной степени.
Инфекционные болезни развиваются в результате сложного биологического процесса взаимодействия патогенного микроорганизма с восприимчивым макроорганизмом в определенных условиях. В развитии инфекционных болезней выделяют несколько периодов: инкубационный (скрытый), продромальный (период предвестников), период развития клинических проявлений, период исхода заболевания. Исход инфекционного процесса может развиваться по нескольким вариантам: реконвалесценция (выздоровление), летальность, бактерионосительство, переход в хроническую форму.
Инфекционные болезни составляют от 20 до 40% в общей структуре заболеваний человека. Изучением, лечением и профилактикой инфекций занимаются многие медицинские и микробиологические дисциплины: собственно инфекционные болезни, эпидемиология, венерология, урология, гинекология, терапия, фтизиатрия, отоларингология, иммунология, вирусология и др.
Число известных науке инфекционных болезней постоянно увеличивается и насчитывает в настоящее время более 1200 единиц. За свою жизнь человек контактирует с огромным количеством микроорганизмов, однако вызвать инфекционные процессы способна лишь 1/30000 часть этого сообщества. Свойствами патогенности обладают вирусы, риккетсии, бактерии, грибки.
В зависимости от места преимущественной локализации процесса и определенного механизма передачи инфекционные болезни делятся на кишечные (дизентерия, холера, сальмонеллез, эшерихиоз, паратифы А и В, брюшной тиф, пищевые токсикоинфекции); инфекции дыхательных путей (ОРВИ, грипп, ветряная оспа, корь, микоплазменная респираторная инфекция); наружных покровов (рожа, сибирская язва, чесотка); кровяные инфекции (ВИЧ-инфекция, малярия, желтая лихорадка, возвратный и сыпной тиф); инфекции с множественными путями передачи (энтеровирусные инфекции, инфекционный мононуклеоз).
По природе возбудителя различают инфекционные болезни: вирусные (вирусные гепатиты А, В, D, Е и С, грипп, краснуха, корь, цитомегаловирусная и герпетическая инфекции, ВИЧ-инфекция, менингококковая инфекция, геморрагические лихорадки); бактериальные (стафилококковая и стрептококковая инфекция, холера, сальмонеллез, чума, дизентерия); протозойные (малярия, трихомониаз, амебиаз); микозы или грибковые инфекции (аспергиллез, кандидоз, эпидермофития, криптококкоз).
Инфекционные болезни подразделяются на антропонозные и зоонозные. К антропонозам относят инфекции, свойственные исключительно людям и передающиеся от человека к человеку (натуральная оспа, дифтерия, брюшной тиф, корь, дизентерия, холера и др.). Зоонозы являются болезнями животных, которыми могут заразиться и люди (ящур, сибирская язва, бешенство, туляремия, чума, листериоз, лептоспироз, бруцеллез).
Заболевания, вызываемые возбудителями животного происхождения – паразитами (клещами, насекомыми, простейшими), называются инвазионными или паразитарными.
Среди инфекционных болезней выделяют группу особо опасных (карантинных) инфекций с высокой степенью заразности, склонностью к быстрому распространению, тяжелому эпидемическому течению и высоким риском летального исхода в кратчайшие сроки от момента заражения. К особо опасным инфекциям Всемирной организацией здравоохранения отнесены чума, натуральная оспа (считается искорененной в мире с 1980 года), холера, желтая лихорадка (и сходные с ней по эпидемиологии лихорадки Марбург и Эбола). В нашей стране к особо опасным инфекциям также причислены туляремия и сибирская язва.
Лечение пациентов с инфекционными болезнями проводится в специализированных стационарах или отделениях, в легких случаях – в домашних условиях. Обязательным условием успешного лечения инфекций является соблюдение строгого противоэпидемического режима. Профилактикой большинства инфекционных болезней является соблюдение санитарно-гигиенических правил и специфическая иммунизация.
Читайте также:

