Для диагностики урогенитального трихомониаза используют
Обновлено: 25.04.2024
Материалом для паразитологических исследований у женщин служит отделяемое из цервикального канала, смыв из влагалища и осадок мочи; у мужчин — отделяемое из уретры, центрифугат свежевыпущенной мочи, секрет предстательной железы и эякулят.
Накануне обследования женщинам в течение суток не рекомендуется делать спринцеваний. Материал для анализа берется у них со слизистой заднего свода влагалища. В некоторых случаях исследуется отделяемое из цервикального канала.
Мужчинам перед обследованием предлагается в течение 3-4 ч воздерживаться от мочеиспусканий. Материал из уретры у них забирается с глубины 5-7 см специальным зондом или ложкой Фолькмана. Исследуется также секрет предстательной железы и эякулят. Если речь идет о хронической трихомонаднои инвазии, накануне исследования рекомендуется сделать провокацию гоновакциной, пирогеналом или неспецифическую (алкогольную).
1.1. Диагностика мочеполового трихомониаза
Диагностика мочеполового трихомониаза проводится путем микроскопии нативных препаратов, а также мазков, окрашенных метиленовым синим, по Романовскому-Гимзе и по модифицированному способу Грама. Для обнаружения трихомонад в нативных препаратах исследуется эякулят, секрет предстательной железы и осадок мочи у мужчин и смыв из влагалища у женщин.
Исследование нативных препаратов
Нативные препараты готовятся и исследуются сразу же после взятия материала. Если это невозможно, материал помещается в питательную среду, обеспечивающую кратковременное сохранение трихомонад, из расчета 1 мл исследуемого материала на 5 мл среды. Материал должен быть доставлен в лабораторию в теплом виде, сроки доставки материала не должны превышать 2 часов.
Для приготовления препарата на предметное стекло наносится капля теплого изотонического раствора хлорида натрия или раствора Рингера-Локка, с которой смешивается исследуемый материал. Взвесь накрывается покровным стеклом и микроскопируется при увеличении объектива 40 и окуляра 7 или 10.
При изучении нативного препарата особое внимание обращается на размеры и форму трихомонад, характер их движения, внутреннее содержимое клеток. В типичных случаях трихомонады обнаруживаются в виде подвижных образований грушевидной, реже овальной формы, размером в среднем от 13 до 17мкм. Характер их движений толчкообразный. Иногда удается заметить движение свободных жгутиков. Ядра трихомонад чаще не обнаруживаются или плохо различимы. Цитоплазма трихомонад обычно зернистая, чаще вакуолизирована.
Размеры лейкоцитов, имеющих округлую, реже овальную форму, как правило, не превышают 10 мкм. Цитоплазма лейкоцитов прозрачна, зернистость обычно не отмечается или слабо выражена. Сегментоядерные нейтрофилы обычно содержат хорошо различимое сегментированное ядро.
Голые ядра эпителиоцитов отличаются от трихомонад относительно толстой оболочкой (кариолеммой) и иным характером зернистости (отдельные глыбки хроматина). В клетках молодого эпителия, даже если они по размерам соответствуют трихомонадам и обладают зернистостью, всегда прослеживается четко различимое округлое или овальное ядро.
В некоторых случаях обнаруживаются амебоидные формы Т. vaginalis, длина тела которых достигала 30 мкм, а также атипично делящиеся (почкующиеся) клетки. Основными дифференциально-диагностическими критериями, отличающими атипичных трихомонад от клеток эпителия и лейкоцитов, служат наличие в цитоплазме этих простейших выраженной зернистости и вакуолей, а также отсутствие хорошо различимого ядра. Кроме того, они значительно крупнее, чем наиболее часто встречающиеся форменные элементы — сегментоядерные нейтрофилы. По размеру такие трихомонады могут быть сопоставимы с моноцитами, которые, в отличие от них, имеют четко выраженное ядро и никогда не встречаются в значительных концентрациях (несколько клеток в каждом поле зрения). При отсутствии типичных форм клеток трихомонад диагноз трихомониаза может считаться лишь предположительным и должен подтверждаться другими методами.
Окраска метиленовым синим
Готовится 1% водный раствор метиленового синего. Высушенный на воздухе мазок фиксируется в течение 3 мин 96% этиловым спиртом, высушивается, после чего на него наносили на 1 мин раствор метиленового синего. Оставшийся краситель осторожно смывается слабой струей холодной воды и мазок высушивается.
Трихомонады в препарате имеют округлую или овальную форму, с интенсивно окрашенными в синий цвет ядрами; цитоплазма клеток светло-синяя, с нежной сетчатой структурой, вакуоли — бесцветны.
Окраска по Романовскому-Гимзе
Высушенный на воздухе мазок фиксируется смесью Никифорова (абсолютный этиловый спирт и эфир в соотношении 1:1). Раствор краски Романовского (азур-эозин) перед употреблением разводится дистиллированной водой в соотношении 0,3 мл на 10 мл воды и пипеткой наносится на горизонтально расположенные препараты на 30-40 минут. Затем они быстро промываются водой и высушиваются.
В окрашенных препаратах трихомонады имеют эксцентрично расположенное овальное пурпурно-фиолетовое ядро. Цитоплазма клеток окрашивается в светло-синий цвет, вакуоли остаются бесцветными, оболочка клеток четко заметна.
Окраска по модифицированному способу Грама
Для окраски используются следующие реактивы:
- 1% раствор генцианвиолета (1 г генцианвиолета растворяется в 100 мл кипящей дистиллированной воды, полученный раствор пропускается в горячем виде через бумажный фильтр).
- Водный раствор Люголя (2 г калия йодида растворяется в 300 мл дистиллированной воды, к полученному раствору добавляется 1 г чистого йода, после чего раствор фильтруется через бумажный фильтр).
- 3,96% этиловый спирт.
- 1% водный раствор нейтрального красного (1 г нейтрального красного растворяется в 100 мл дистиллированной воды и пропускается через бумажный фильтр).
Препарат накрывается полоской фильтровальной бумаги и заливается раствором генцианвиолета на 1-2 мин, после чего бумага снимается, препарат осторожно промывается водопроводной водой и на несколько секунд заливается раствором Люголя (до почернения мазка). Остаток раствора смывается, препарат обесцвечивается в 96% этиловом спирте до тех пор, пока с тонких участков препарата перестают стекать фиолетовые струйки. После смывания спирта водой препарат сразу же докрашивается в течение 3 мин раствором нейтрального красного, затем тщательно промывается и высушивается.
При микроскопии окрашенных мазков ядра клеток Т. vaginalis окрашиваются в фиолетовый цвет, цитоплазма — в красно-оранжевый цвет разной интенсивности. Метод окраски по Граму позволяет также диагностировать гонорею. В некоторых случаях для подтверждения диагноза трихомониаза используется ПЦР и культуральный метод.
Культуральный метод
Нами Т. vaginalis выращивается на питательной среде СДС-199 М (Захаркив Ю. Ф. и др., 1998), которая имеет следующий состав:
- 100 мл солевого раствора (натрия хлорида 6,5 г, калия хлорида 0,14 г, кальция хлорида 0,12 г, натрия бикарбоната 0,2 г, 0,5 мл 0,2% раствора метиленового синего, дистиллированной воды до 1 л);
- 20 мл среды 199;
- 450 мг солянокислого цистеина;
- 30 мл сыворотки крови эмбрионов телят (без консерванта);
- 10 мл 20% раствора мальтозы;
- тиамина хлорида 5% и пиридоксина гидрохлорида 5% по 0,25 мл и аскорбиновой кислоты 5% — 0,5 мл на 100 мл среды;
- ампициллина натриевой соли 125 000 ЕД и гентамицина 40 000 ЕД на 100 мл среды.
Солевой раствор автоклавируется при 120°С в течение 30 минут, остальные ингредиенты добавляются стерильно после охлаждения среды. Антибиотики и витамины добавляются в питательную среду непосредственно перед использованием. Среда должна быть светло-зеленого цвета, прозрачной; показатель рН среды должен составлять 5,5-6,0.
Питательная среда объемом 4,5 мл помещается в стерильные пробирки и заливается слоем стерильного вазелинового масла толщиной 5 мм для создания анаэробных условий культивирования трихомонад. Посев производится пастеровской пипеткой путем помещения 0,5-1,0 мл исследуемого материала на дно пробирок.
Микроскопическое исследование производится через 48 и 96 часов после посева. При положительных результатах трихомонады дают придонный рост в виде плотного беловатого осадка, из которого пастеровской пипеткой берется материал для микроскопического исследования.
2. Определение чувствительности Trichomonas vaginalis к метронидазолу
В 1962 году S. Squires and J. A. Fadzean для определения чувствительности Т. vaginalis предложили метод серийных разведений метронидазола в жидкой питательной среде в анаэробных условиях. В качестве критерия оценки чувствительности они использовали минимальную ингибирующую концентрацию (MIC), под которой понимали наименьшую концентрацию препарата, вызывающую иммобилизацию у 100% клеток трихомонад. С помощью указанной методики авторам удалось показать, что все изученные ими штаммы Т. vaginalis, выделенные от больных трихомониазом, были чувствительны к метронидазолу в диапазоне концентраций препарата от 0,25 до 1 мкг/мл.
В 90-х гг. появились работы, свидетельствующие о возникновении и распространении штаммов Т. vaginalis, устойчивых к значительно более высоким концентрациям метронидазола: 50 мкг/мл (Borchardt К. А. et al, 1995), 32 мкг/мл (Debbia E. A. et al., 1996) и даже 250 мкг/мл (Таги Meri I. Т. et al., 1999). Тогда же было обосновано положение о том, что чувствительными к действию метронидазола в анаэробных условиях штаммами Т. vaginalis следует считать лишь те, для которых паразитоцидный эффект препарата наблюдается в концентрации более чем 15 мкг/мл (Muller M. et al., 1986, 1988; Тага Meri I. Т. et al., 1999). Процент резистентных к метронидазолу штаммов Т. vaginalis, выделенных в эти годы от больных трихомониазом, колебался от 5% (Narcisi Е. М., Secor W. Е., 1996) до 20% (Du Bouchet L. et al., 1997).
2.1. Определение чувствительности Trichomonas vaginalis к антипротозойным препаратам in vitro при использовании критерия иммобилизации трихомонад
Чувствительность штаммов Т. vaginalis к метронидазолу определяется с помощью метода серийных разведений препарата в питательной среде СДС-199 М. При использовании критерия оценки чувствительности штаммы Т. vaginalis, используемые для исследования, должны содержать не менее 90% подвижных клеток.
Среда заливается по 4,0 мл в стерильные пробирки, затем в них вносится 0,5 мл раствора, содержащего разные концентрации метронидазола (или другого антипротозойного препарата): от 0,25 до 1000 мкг/мл (1 мг/мл).
После этого в пробирки вносится 0,5 мл культуры возбудителя с заранее определенной концентрацией клеток (кл./мл). Контролем служит среда без препарата. Затем для создания анаэробных условий, необходимых для культивирования Т. vaginalis, в пробирки со средой вносится вазелиновое масло (толщина слоя — 0,5 мм). Пробирки с исследуемым материалом инкубируются в термостате при t = 37°С. Учет результатов производится через 48 и 96 часов после посева.
Чувствительность трихомонад к метронидазолу оценивается путем определения минимальной ингибирующей концентрации (MIC), вызывающей иммобилизацию всех клеток Т. vaginalis. К лекарственно-устойчивым относятся штаммы, у которых иммобилизация обнаруживается при концентрациях метронидазола (или другого антипротозойного препарата), превышающих 15 мкг/мл.
2.2. Определение чувствительности Trichomonas vaginalis к антипротозойным средствам in vitro при использовании критерия лизиса трихомонад при терапевтически эффективных концентрациях препаратов
В связи с широким распространением штаммов Т. vaginalis, устойчивых к метронидазолу, особенно среди больных хроническим мочеполовым трихомониазом, а также высокой частотой встречаемости амастиготных клеток, мы предлагаем оценивать чувствительность трихомонад к широкому спектру антипротозойных препаратов (производным 5-нитроимидазола пролонгированного типа действия (тинидазол, ниморазол, орнидазол и секнидазол), 4-аминохинолина (хлорохин, син. делагил) и нитрофурана (нифуратель, син. макмирор)) на основе оценки лизиса клеток трихомонад.
К высокоустойчивым (RIII) относятся штаммы, концентрация клеток которых в опытных пробирках с антипротозойным препаратом составляла не менее 50% по сравнению с контролем; к умеренно устойчивым (RII) — от 25 до 50%, к низкоустойчивым (RI) — менее 25%. Воздействие препарата считается оптимальным при лизисе всех клеток трихомонад; в этом случае штамм относится к чувствительным (S). По нашему мнению, именно такой подход позволяет подобрать препарат или комбинацию препаратов для назначения рациональной схемы этиотропной терапии.
2.3. Определение чувствительности Trichomonas vaginalis к метронидазолу in vivo и текущий контроль эффективности этиотропной терапии
Определение чувствительности Т. vaginalis к метронидазолу in vivo проводится с помощью метода, основанного на установлении сроков исчезновения паразитов из исследуемого материала у больных трихомониазом на фоне этиотропной терапии. Паразитологические исследования материала проводят на 1,3, 5 и 7-й дни с момента начала лечения. Лекарственно-чувствительными считаются штаммы, которые перестают выделяться от больных на 2-5-е сутки с момента начала этиотропной терапии.
Что такое трихомониаз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Агапова Сергея Анатольевича, венеролога со стажем в 39 лет.
Над статьей доктора Агапова Сергея Анатольевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов
Определение болезни. Причины заболевания
Урогенитальный трихомониаз — это передающаяся половым путём инфекция мочеполовой системы, вызванная влагалищной трихомонадой (Trichomonas vaginalis).
Насколько распространён трихомониаз
Что такое трихомониаз, трихомонады и их виды
Причиной заболевания является инфицирование мочеполовых органов влагалищной трихомонадой — одноклеточным жгутиковым простейшим организмом изменчивой формы, который в естественных условиях может существовать и размножаться только в организме человека. Помимо вагинальной трихомонады у человека могут паразитировать ещё два вида — кишечная трихомонада (Pentatrichomonas hominis) и ротовая (Trichomonas tenax), однако их роль в возникновении заболеваний мочеполовой системы не установлена.
Трихомонада, так как не образует цист и других устойчивых форм, быстро погибает во внешней среде вследствие высыхания, легко разрушается при кипячении, воздействии антисептиков и этилового спирта. Однако может сохранять некоторое время жизнеспособность во влажной среде. Исследованиями установлено, что трихомонады могут выживать до 45 минут на сидениях унитазов, нижнем белье и в воде ванны. [3]
Как можно заразиться трихомониазом
Пути передачи инфекции:
Факторами риска являются:
- случайные половые связи;
- половой контакт, незащищённый барьерной контрацепцией (презервативом);
- злоупотребление алкоголем и наркомания; [7]
- атрофия шейки матки — вследствие снижения защитных свойств из-за уменьшения эстрогенов в тканях; [8]
- наличие других половых инфекций, таких как ВИЧ-инфекция, бактериальный вагиноз, вульвовагинальный кандидоз, генитальный герпес, хламидиоз. [9]
Защищает ли презерватив от трихомониаза
Использование презервативов снижает вероятность заражения. Однако микроорганизмы могут попасть на области, не закрытые ими, поэтому презервативы не могут полностью защитить от трихомониаза [52] .
Передаётся ли трихомониаз во время орального секса
Микроорганизмы способны поражать различные части тела, например, руки или рот. Оральный секс с инфицированным партнёром может привести к заражению трихомониазом ротовой полости [52] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы трихомониаза
Чаще трихомониаз диагностируется у женщин, чем у мужчин. У 10-30 % женщин и у 45-50 % мужчин отмечается асимптомное течение заболевания . [10]
Симптомы трихомониаза у женщин
У женщин трихомонады преимущественно поражают влагалище, откуда они могут проникать в уретру, бартолиновы железы, мочевой пузырь и канал шейки матки. В редких случаях трихомонады паразитируют в полости матки, маточных трубах, почечных лоханках и прямой кишке. [11]
Основными симптомами трихомониаза у женщин являются:
Редкими проявлениями трихомониаза у женщин являются:
- макулярный кольпит (клубничный цервикс) — кровоизлияния в слизистую влагалища и шейку матки, напоминающее ягоду клубники; [12]
- эрозивно-язвенные поражения вульвы и преддверия влагалища. [13]
Симптомы трихомониаза у мужчин
У мужчин трихомонады поражают слизистую оболочку мочеиспускательного канала, нередко проникая в уретральные железы и лакуны. Ввиду неблагоприятных условий для существования в мужской уретре трихомонад, заболевание часто носит транзиторный (временный) характер. Этим же объясняется и большой процент асимптомных форм трихомониаза у мужчин. [14]
Основными симптомами трихомониаза у мужчин являются:
Редким проявлением трихомониаза у мужчин является баланопостит (воспаление головки и крайней плоти полового члена). Описаны его эрозивно-язвенные формы. [15]
Патогенез трихомониаза
Проникая в урогенитальный тракт человека, трихомонады прикрепляются к эпителиальным клеткам, что приводит к повреждению и воспалительной реакции клеток эпителия. В этой реакции важное значение имеет адгезин — белок, продуцируемый паразитом. [16]
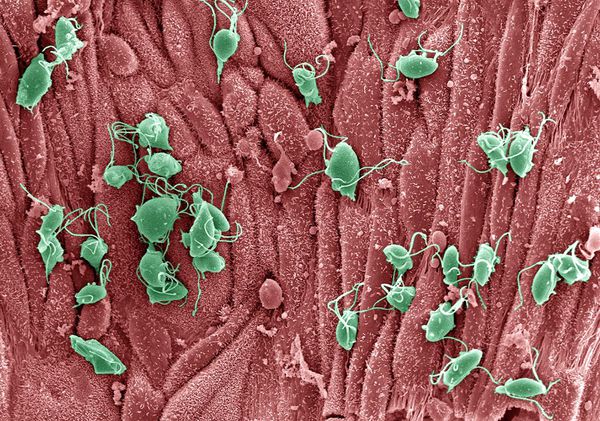
Трихомонады выделяют многочисленные протеолитические ферменты, которые участвуют в цитотоксичности, гемолизе (разрушении эритроцитов и выделении гемоглобина) и уклонении от иммунных реакций. Ферменты находятся во влагалищных выделениях инфицированных женщин вместе с антителами, которые их распознают. Важную роль играет фермент муциназа, который значительно облегчает проникновение трихомонад в слизистые оболочки. [17]
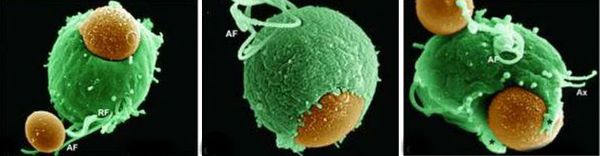
Трихомонадная инфекция вызывает клеточный, гуморальный и секреторный иммунные ответы. Однако эти реакции не способны защитить пациентов от реинфекции, поэтому повторное инфицирование встречается часто. Антитела и компоненты комплемента, присутствующие в сыворотке крови и секрете половых желез у некоторых больных, могут воздействовать на паразита путём стимуляции нейтрофилов, которые способствуют уничтожению трихомонад через классическую систему комплемента. Также антитела могут блокировать адгезию (прилипание) паразита к поверхности слизистой оболочки. [21]
Классификация и стадии развития трихомониаза
По Международной классификации болезней 10-го пересмотра трихомониаз разделяют на:
A59.0 Урогенитальный трихомониаз;
- Бели (вагинальные выделения), вызванные Trichomonas vaginalis; (N51.0), вызванный Trichomonas vaginalis;
A59.8 Трихомониаз других локализаций;
A59.9 Трихомониаз неуточнённый.
Стадии заболевания
После скрытого (инкубационного) периода, продолжающегося от 4 до 28 дней с момента заражения, приблизительно у 40-50% мужчин появляются признаки уретрита в виде слизистых выделений из уретры, а у 70-90% женщин — признаки вульвовагинита, характеризующегося зудом, жжением и наличием обильных мутных выделений из влагалища. [10] В остальных случаях болезнь протекает первоначально бессимптомно. В дальнейшем, если вовремя не получено лечение, развитие заболевания происходит по следующим сценариям:
- Длительное бессимптомное носительство, при котором нет никаких субъективных и объективных симптомов.
- Длительное рецидивирующее течение, при котором симптомы заболевания могут временно возобновляться и самопроизвольно исчезать.
- Ранее развитие осложнений может возникать как при течении заболевания с клиническими симптомами, так и при бессимптомном течении.
- Позднее развитие осложнений возникает при длительно текущем бессимптомном или хроническом рецидивирующем процессе.
Осложнения трихомониаза
В отличии от других половых инфекций – хламидийной и гонококковой — осложнения при трихомониазе встречаются гораздо реже.
Осложнения у мужчин
Эпидидимит — воспаление придатка яичка, очень редкое осложнение трихомонадной инфекции. Чаще всего это хронический процесс, хотя встречаются описания острых форм. [22]
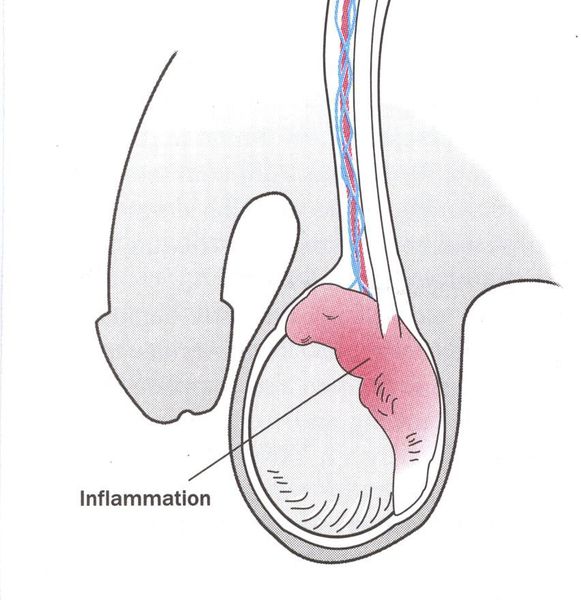
Редким осложнением трихомониаза является простатит. Сообщается о нескольких случаях хронического простатита, вызванного трихомонадной инфекцией. [23]
Нарушение фертильности. Проведенные исследования показывают негативное воздействие трихомонад на сперматозоиды мужчин в виде снижения их подвижности. [24]
Сообщается также о случае трихомонадного двухстороннего конъюнктивита. [31]
Осложнения у женщин
Воспалительные заболевания малого таза, вызванные вагинальной трихомонадной инфекцией, являющиеся причиной трубного бесплодия и синдрома хронической абдоминальной боли, описаны, в основном, у ВИЧ-позитивных женщин. [25]
Проведённые исследования указывают на повышенный риск преждевременных родов, рождения ребёнка с низким весом у инфицированных влагалищной трихомонадой женщин. [26]
Также трихомонадная инфекция в 2-3 раза увеличивает риск заражения ВИЧ. [32]
Очень редким осложнением трихомониаза является цистит. В медицинской литературе описано всего несколько случаев. [33]
Прочие осложнения
Сообщалось о паранефральном абсцессе [27] , абсцессе головного мозга [28] у новорождённого, абсцессе срединного шва полового члена [29] у мужчины, вызванных вагинальной трихомонадой.
Описаны случаи неонатальной трихомонадной пневмонии у новорождённых, успешно вылеченных метронидазолом. [30]
Диагностика трихомониаза
Для диагностики трихомониаза применяются микроскопические, цитологические, бактериологические, молекулярные лабораторные тесты и инструментальные методы обследования.
Показаниями для диагностики трихомониаза являются [2] :
- наличие признаков воспалительного процесса мочеполовых органов;
- беременность (при постановке на учёт по поводу беременности, при сроке беременности 27-30 недель и 36-40 недель, при поступлении на роды без документов о результатах обследования на половые инфекции);
- предстоящие оперативные вмешательства на половых органах и органах малого таза;
- бесплодие и выкидыши в анамнезе;
- половые контакты с больными половыми инфекциями;
- сексуальное насилие.
Микроскопическое исследование
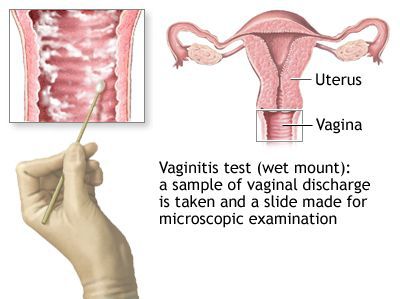
Микроскопия окрашенного препарата (окраска по Романовскому, Папаниколау) не рекомендуется из-за субъективизма при интерпретации результатов исследования. [2]
Культуральное исследование
Молекулярно-биологические методы
Материалом для исследования методом ПЦР при диагностике трихомониаза являются:
- у женщин: выделения из уретры, канала шейки матки, влагалища, первая порция мочи);
- у мужчин: выделения или соскоб из уретры, первая порция мочи, секрет предстательной железы, в редких случаях — сперма. [2]
Требования для получения достоверных результатов исследования:
- Забор материала должен осуществляться не ранее чем через месяц после полученного лечения.
- При отсутствии или скудных выделениях из уретры забор материала должен проводиться через 2-3 часа после последнего мочеиспускания, а при наличии обильных выделений — через 10-15 минут после мочеиспускания.
- Во время менструации забор материала для исследования проводить запрещается.
- Должны быть соблюдены сроки и условия доставки образцов в лабораторию.
Серологическое исследование
Метод иммуноферментного анализа (ИФА) для обнаружения антител классов IgA, IgM и IgG к антигенам T. vaginalis применять не допустимо. [2]
Применение биологических (парентеральное введение пирогенала, гоновакцины), химических (внутриуретральное введение растворов серебра) и алиментарных провокаций (приём алкоголя и острой пищи) с целью повышения выявляемости трихомонад при проведении лабораторных тестов нецелесообразно, так как эффективность этого метода не доказана. [2]
Лечение трихомониаза
Многочисленными исследованиями и клиническими испытаниями было установлено, что наиболее эффективными препаратами для лечения трихомониаза являются препараты группы 5-нитроимидазолов, а среди них — метронидазол, тинидазол и орнидазол.
Современными отечественными и зарубежными руководствами предложены следующие схемы лечения этими препаратами.
Метронидазол (Трихопол, Метрогил, Флагил) — эффективность его применения составляет 90-95%.
Для неосложнённых форм заболевания: 500 мг перорально 2 раза в сутки в течение 7 дней [36] или 2,0 г перорально однократно. [37]
Для осложнённых форм: 500 мг перорально 3 раза в сутки в течение 7 дней или 2,0 г внутрь 1 раз в сутки в течение 5 дней. [38]
Для беременных: 2,0 г однократно (лечение проводится не ранее II триместра беременности). [39]
Для детей: 10 мг на кг массы тела перорально 3 раза в сутки в течение 5 дней. [40]
Тинидазол (Фазижин, Тиниба) — эффективность применения составляет 86-100%.
Для неосложнённых форм заболевания: 500 мг перорально 2 раза в сутки в течение 5 дней или 2,0 г перорально однократно. [35]
Для осложнённых форм: 2,0 г перорально 1 раз в сутки в течение 3 дней. [37]
Орнидазол (Тиберал, Гайро, Дазолик) — эффективность применения составляет 90-100%.
Для неосложнённых форм заболевания: 500 мг перорально 2 раза в сутки в течение 5 дней [41] или 1,5 г перорально однократно. [42]
Для осложнённых форм: 500 мг перорально 2 раза в сутки в течение 10 дней. [38]
Для детей: 25 мг на кг массы тела перорально 1 раз в сутки в течение 5 дней. [39]
Другие препараты из группы 5-нитроимидазолов — менее распространены и изучены, чем вышеизложенные препараты, однако применяются в клинической практике:
- Тенонитрозол (Атрикан) — 250 мг перорально 2 раза в день в течение 4 дней; [43]
- Ниморазол (Наксоджин) — схемы применения при неосложнённом трихомониазе: 2,0 г перорально однократно или 1,0 г перорально через каждые 12 часов – три приёма, или 250 мг перорально 2 раза в день в течение 6 дней. [44]
- Секнидазол (Тагера) — 2,0 г перорально однократно (эффективность 97%). [45]
Причины неудач в лечении
В 5 % случаев трихомонады устойчивы (резистентны) к перечисленным препаратам [46] . Центры по контролю за заболеваемостью (США) в таких случаях рекомендуют увеличить дозировку и длительность применения медикаментов [47] : Метронидазол — 2,0 г перорально однократно в сутки в течении 7 дней или Тинидазол 2,0 г перорально однократно в сутки в течении 7 дней.
Дисульфирам-подобная реакция на препараты
Нитроимидазолы блокируют и снижают выработку фермента алкоголь-дегидрогеназы, что приводит к повышению уровня и накапливанию токсического ацетальдегида в крови. При приёме алкоголя в любых концентрациях во время лечения препаратами, входящими в группу нитроимидазолов, через 10-20 минут возникает реакция в виде тошноты, рвоты, головной боли, затруднения дыхания, судорог. Длительность её составляет несколько часов. Реакция наблюдается при приёме метронидазола, тинидазола [48] и орнидазола [49] .
Помимо исключения алкоголя, рекомендаций по изменению привычек или особенностям питания при лечении трихомониаза нет.
Установление излеченности трихомонадной инфекции
Проводится через две недели после окончания лечения микроскопией и культуральным посевом и через 4 недели методом ПЦР. При отрицательных результатах лабораторных тестов пациенты дальнейшему наблюдению не подлежат. [2]
Можно ли заниматься сексом при трихомониазе
Заниматься сексом можно через 7-10 дней после завершения лечения трихомониаза. Примерно каждый пятый выздоровевший заражается вновь в течение трёх месяцев после окончания лечения. Чтобы избежать повторного заражения, лечение должны пройти все сексуальные партнеры. Если симптомы возникли снова, нужно пройти повторное обследование [52] .
Прогноз. Профилактика
Прогноз при раннем выявлении и вовремя начатом лечении благоприятный. При неосложнённых формах трихомонадной инфекции после однократного курса выздоровление составляет 95-100%. Лица с осложнёнными формами и метронидазол-устойчивыми формами заболевания после проведённого лечения должны находиться под динамическим наблюдением.
Половые партнёры больных трихомониазом должны быть пролечены независимо от результатов их обследования на наличие трихомонад.
Самой эффективной мерой профилактики является использование презервативов при случайных половых контактах.
Ввиду бессимптомного течения инфекции лицам, имеющим несколько половых партнёров в год или случайные половые связи, рекомендовано ежегодное обследование на наличие трихомонад.
В настоящее время вакцины, предотвращающей заражение трихомониазом, не создано. В 80-е годы прошлого века была создана коммерческая вакцина Солкотриховак, состоящая из лиофилизата Lactobacillus acidophilus, которая по утверждению фирмы-производителя оказывает положительный эффект при рецидивирующем трихомониазе и бактериальном вагинозе. [50] Однако последующими исследованиями предположение о том, что защитный механизм действия вакцины связан на антигенном сходстве применяемых штаммов лактобацилл и вагинальной трихомонады, было отвергнуто. [51]
Урогенитальный трихомониаз — инфекция, передаваемая половым путем, возбудителем которой является Trichomonas vaginalis.
Классификация
A59.0 Урогенитальный трихомониаз
A59.8 Трихомониаз других локализаций
Этиология и патогенез
Trichomonas vaginalis - жгутиковый простейший одноклеточный паразит, вызывающий поражение урогенитального тракта человека.
Урогенитальный трихомониаз является одной из наиболее распространенных инфекций, передаваемых половым путем (ИППП). В структуре всех ИППП трихомониаз занимает одно из первых мест у лиц, обратившихся за специализированной дерматовенерологической, акушерско–гинекологической и урологической помощью по поводу инфекционно–воспалительных заболеваний урогенитального тракта. В Российской Федерации за последние годы отмечается снижение показателей заболеваемости урогенитальным трихомониазом, однако они остаются достаточно высокими; в 2014 году уровень заболеваемости составил 71,1 случай на 100000 населения: у лиц в возрасте от 0 до 14 лет – 1,0 случай на 100000 населения, у лиц в возрасте 15-17 лет - 51,0 случай на 100000 населения, у лиц в возрасте старше 18 лет - 85,9 случаев на 100000 населения.
Клиническая картина
Cимптомы, течение
- контактно-бытовой (в исключительных случаях девочки младшего возраста могут инфицироваться при нарушении правил личной гигиены и ухода за детьми).
КЛИНИЧЕСКАЯ КАРТИНА
У 20-40% больных отмечается субъективно асимптомное течение урогенитального трихомониаза.
Женщины
При наличии клинических проявлений могут быть следующие субъективные симптомы:
- выделения из половых путей серо-желтого цвета, нередко – пенистые, с неприятным запахом;
- зуд, жжение в области половых органов;
- болезненность во время половых контактов (диспареуния);
- зуд, жжение, болезненность при мочеиспускании (дизурия);
- дискомфорт и/или боль в нижней части живота.
- гиперемия и отечность слизистой оболочки вульвы, влагалища;
- серо-желтые, жидкие пенистые вагинальные выделения с неприятным запахом;
- эрозивно-язвенные поражения слизистой оболочки половых органов, кожи внутренней поверхности бедер;
К основным осложнениям трихомонадной инфекции у женщин относятся: воспалительные заболевания органов малого таза (сальпингоофорит, эндометрит), цистит. Урогенитальный трихомониаз может неблагоприятно влиять на беременность и ее исход.
При наличии клинических проявлений могут быть следующие субъективные симптомы:
- слизистые выделения из уретры;
- зуд, жжение в области уретры;
- боль в промежности с иррадиацией в прямую кишку;
- болезненность во время половых контактов (диспареуния);
- зуд, жжение, болезненность при мочеиспускании (дизурия);
- эрозивно-язвенные высыпания на коже головки полового члена;
- боли в промежности с иррадиацией в прямую кишку.
- гиперемия и отечность в области наружного отверстия уретры;
- скудные или умеренные слизистые уретральные выделения;
- эрозивно-язвенные высыпания на коже головки полового члена.
К основным осложнениям трихомонадной инфекции у мужчин относятся простатит и везикулит.
Диагностика
- лицам с клиническими и/или лабораторными признаками воспалительного процесса органов урогенитального тракта и репродуктивной системы;
- при предгравидарном обследовании;
- при обследовании женщин во время беременности (троекратно: при постановке на учет по поводу беременности, при сроке беременности 27-30 недель и 36-40 недель);
- беременным, поступающим на роды без документов о результатах обследования на ИППП;
- при предстоящих оперативных (инвазивных) манипуляциях на половых органах и органах малого таза;
- лицам с перинатальными потерями и бесплодием в анамнезе;
- половым партнёрам больных ИППП;
- лицам, перенесшим сексуальное насилие.
При неустановленном источнике инфицирования рекомендуется провести повторное серологическое исследование на сифилис через 3 месяца, на ВИЧ, гепатиты В и С - через 3-6-9 месяцев.
Клиническим материалом для лабораторных исследований является:
- у женщин: отделяемое (соскоб) уретры, цервикального канала, влагалища, первая порция свободно выпущенной мочи (при исследовании молекулярно-биологическими методами);
- у мужчин: отделяемое (соскоб) уретры, первая порция свободно выпущенной мочи (при исследовании молекулярно-биологическими методами); при наличии показаний - секрет предстательной железы;
- у детей и у женщин, не имевших в анамнезе половых контактов с пенетрацией – отделяемое уретры, задней ямки преддверия влагалища, влагалища; при осмотре с использованием детских гинекологических зеркал – отделяемое цервикального канала.
Для получения достоверных результатов лабораторных исследований необходимо соблюдение ряда требований, к которым относятся:
1. сроки получения клинического материала с учетом применения противопротозоидных лекарственных препаратов: для идентификации T. vaginalis культуральным методом или методом амплификации РНК (NASBA) – не ранее, чем через 14 дней после окончания приема препаратов, методами амплификации ДНК (ПЦР, ПЦР в режиме реального времени) - не ранее, чем через месяц после окончания приема препаратов;
2. получение клинического материала из уретры не ранее, чем через 3 часа после последнего мочеиспускания, при наличии обильных уретральных выделений – через 15 - 20 минут после мочеиспускания;
3. получение клинического материала из цервикального канала и влагалища вне менструации;
4. соблюдение условий доставки образцов в лабораторию.
С позиций доказательной медицины применение биологических, химических и алиментарных провокаций с целью повышения эффективности диагностики урогенитального трихомониаза нецелесообразно.
Другие методы лабораторных исследований, в том числе, прямую иммунофлюоресценцию (ПИФ) и иммуноферментный анализ (ИФА) для обнаружения антител к T.vaginalis использовать для диагностики трихомонадной инфекции недопустимо.
Консультации других специалистов рекомендованы по показаниям в следующих случаях:
- акушера-гинеколога - при вовлечении в воспалительный процесс органов малого таза, при ведении беременных, больных урогенитальным трихомониазом;
- уролога - с целью диагностики возможных осложнений со стороны репродуктивной системы, при длительном течении и неэффективности ранее проводимой терапии простатита, везикулита.
Дифференциальный диагноз
Дифференциальную диагностику трихомониаза следует проводить с другими урогенитальными заболеваниями, обусловленными патогенными (N. gonorrhoeae, C. trachomatis, M. genitalium) и условно-патогенными микроорганизмами (грибами рода Candida, микроорганизмами, ассоциированными с бактериальным вагинозом, генитальными микоплазмами), вирусами (вирусом простого герпеса), а также аллергическими вульвовагинитами и баланопоститами.
Лечение
Показания к проведению лечения
Показанием к проведению лечения является идентификация T. vaginalis при микроскопическом исследовании нативного препарата и/или культуральном исследовании и/или исследовании молекулярно-биологическими методами, у пациента либо у его полового партнера.
Одновременное лечение половых партнеров является обязательным.
Цели лечения
- предотвращение развития осложнений;
- предупреждение инфицирования других лиц.
Общие замечания по терапии
Единственным классом препаратов, рекомендуемым для лечения урогенитального трихомониаза, являются 5-нитроимидазолы, к которым чувствительны большинство штаммов T. vaginalis. В рандомизированных контролируемых исследованиях показано, что рекомендуемые режимы приема метронидазола позволяют достичь клинического выздоровления и эрадикации возбудителя у 90%–95% больных, приема тинидазола - у 86%–100% больных 3.
Во избежание развития тяжелых побочных реакций (дисульфирамоподобная реакция) пациентов следует предупреждать о необходимости избегать приема алкоголя и содержащих его продуктов как в ходе терапии метронидазолом и тинидазолом, так и в течение 24 часов после его окончания.
При непереносимости перорального метронидазола его интравагинальное назначение также противопоказано.
Врач должен рекомендовать пациенту в период лечения и диспансерного наблюдения воздержаться от половых контактов или использовать барьерные методы контрацепции до установления излеченности.
Показания к госпитализации
Схемы лечения
Рекомендованные схемы лечения
- метронидазол 500 мг перорально 2 раза в сутки в течение 7 дней (А) 4
или
- орнидазол 500 мг перорально 2 раза в сутки в течение 5 дней (В) [6,7]
или
- тинидазол 500 мг перорально 2 раза в сутки в течение 5 дней (А) [2, 8, 9]
Альтернативные схемы лечения:
- метронидазол 2,0 г перорально однократно (А) 11
или
- орнидазол 1,5 г перорально однократно (В) [13, 14]
или
- тинидазол 2,0 г перорально однократно (А) [2, 8, 9, 12, 14].
Лечение осложненного и рецидивирующего трихомониаза
- метронидазол 500 мг перорально 3 раза в сутки в течение 7 дней или 2,0 г внутрь 1 раз в сутки в течение 5 дней (D) [15]
или
- орнидазол 500 мг перорально 2 раза в сутки в течение 10 дней (D) [15]
или
- тинидазол 2,0 г перорально 1 раз в сутки в течение 3 дней (D) (D) [15].
При лечении осложненных форм урогенитального трихомониаза возможно одновременное применение местнодействующих протистоцидных препаратов:
- метронидазол, вагинальная таблетка 500 мг 1 раз в сутки в течение 6 дней (D) [15]
или
- метронидазол, гель 0,75% 5 г интравагинально 1 раз в сутки в течение 5 дней (D) [15].
Особые ситуации
Лечение беременных, больных урогенитальным трихомониазом, осуществляется не ранее II триместра беременности по схеме:
- метронидазол 2,0 г однократно (А) 16.
Лечение детей
- метронидазол 10 мг на кг массы тела перорально 3 раза в сутки в течение 5 дней (D) [15, 18]
или
- орнидазол 25 мг на кг массы тела перорально 1 раз в сутки в течение 5 дней (D) [13, 16].
Требования к результатам лечения
Установление излеченности трихомонадной инфекции на основании микроскопического исследования нативного препарата, культурального метода исследования и методов амплификации РНК (NASBA) проводится через 14 дней после окончания лечения, на основании методов амплификации ДНК (ПЦР, ПЦР в реальном времени) - не ранее, чем через месяц после окончания лечения.
При отрицательных результатах обследования пациенты дальнейшему наблюдению не подлежат.
– назначение иных препаратов или курсовых методик лечения (см. Лечение осложненного, рецидивирующего трихомониаза).
Резюме. Лабораторная диагностика трихомониаза - обязательная составляющая при постановке диагноза урогенитальный трихомоноз. Обзор освещает диагностические методы, направленные на выявление простейшего, антигенов T.vaginalis, специфических антител и ДНК возбудителя. Отражены существующие проблемы в интерпретации результатов и сведения об эффективности применения того или иного метода в алгоритме обследования пациентов.
Ключевые слова: лабораторная диагностика, урогенитальный трихомониаз.
The laboratory diagnostic of genitourinary trichomoniasis (literature review)
Abstract. The laboratory diagnostics of trichomoniasis is strongly recommended for the diagnosis confirmation. Current review summarizes diagnostic methods directed to identification by morphology of protozoa, by antigenic properties of T.vaginalis, by specific antibodies and by the pathogen DNA detection. Overview reflects the existing problems in the interpretation of results and information about the efficacy of each method in the patient's examination algorithm.
Key words: laboratory diagnostics, urogenital trichomoniasis.
Трихомониаз в структуре ИППП
Одно из центральных мест в структуре заболеваемости инфекциями, передающимися половым путем, занимает трихомоноз. Он широко распространен в странах Африки, Южной и Юго-Восточной Азии, а также в странах с большим притоком эмигрантов. В последние годы продолжается положительная тенденция к снижению уровня заболеваемости трихомонозом, однако отмечается рост скрытых и малосимптомных форм инфекции, затрудняющих своевременную диагностику трихомониаза и лечение [7,11].
Особенно распространен трихомоноз среди женщин [33], однако вопрос о значении T.vaginalis в патологии беременности остается открытым из-за противоречивости информации по этому вопросу [23,26]. Клиническая картина урогенитального трихомоноза характеризуется отсутствием специфических признаков и примерно у 50 % инфицированных трихомонозом имеет место бессимптомный характер течения заболевания, т.е. возможно трихомонадоносительство [49]. Недовыявление трихомонад - причина неконтролируемого их распространения среди сексуально активного населения. В результате это приводит к развитию хронических орхоэпидидимитов и простатитов у мужчин, а также хронических аднекситов у женщин, что в итоге может служить причиной бесплодия, невынашивания беременности, патологии новорожденных [25,29].
Трихомоноз имеет важное медицинское, социальное и экономическое значение не только из-за высокой распространенности инфекции, но и из-за доказанной роли T.vaginalis как кофактора ВИЧ-инфекции и рака шейки матки [33].
Сравнительный анализ лабораторных методов диагностики трихомониаза
Диагностика урогенитального трихомониаза основывается на обнаружении в исследуемом материале T.vaginalis. Диагноз не может быть поставлен исключительно на основании клинической картины, поскольку патогномоничные симптомы встречаются только у 2 % пациенток. Ещё в 1980 году были представлены результаты, свидетельствующие о том, что если диагноз трихомоноза устанавливать только на основании клинической картины, то 88 % инфицированных T.vaginalis женщин будет дан ложноотрицательный результат, а у 29 % неинфицированных диагноз был бы поставлен ошибочно [27]. В связи с тем, что клинические симптомы зачастую не отражают реальной картины заболевания, в обязательном порядке необходимо применение лабораторных методов диагностики трихомониаза, причем актуальна задача своевременного проведения исследования.
До настоящего времени в соответствии с протоколом ведения больных урогенитальным трихомониазом [14] основными методами обнаружения трихомонад являются микроскопический и культуральный, т.е. прямая идентификация возбудителя в мазке либо при культивировании на питательной среде. Но сложилась парадоксальная ситуация: при высоком уровне заболеваемости трихомонозом в России отсутствует производственный выпуск стандартных, разрешенных к применению препаратов и питательных сред для диагностики трихомониаза. В практике используют зарубежные среды, что влияет на стоимость исследования, или приготовленные по прописям в лабораториях, что влияет на воспроизводимость и достоверность получаемых результатов.
Диагностика трихомониаза существенно осложнилась в последние годы в связи с распространенностью нетипичных округлых форм T.vaginalis, обнаруживаемых при световой микроскопии витальных препаратов [3].
Роль микроскопического метода при постановке диагноза
Исторически микроскопия - это первый метод в лабораторной диагностике трихомоноза. Его использование экономически целесообразно в силу простоты и возможности одновременного просмотра мазка и на другие возбудители. Микроскопия может производиться в нативном препарате или в препарате, окрашенном по различным методикам. Нативный препарат необходимо исследовать в течение 10 минут после забора материала, поскольку утрачивается подвижность возбудителя, клетка округляется и получение однозначного результата затрудняется [30]. В положительных случаях микроскопии нативного препарата трихомонады обнаруживаются в виде грушевидной, овальной или округлой формы по величине несколько превосходящей лейкоциты [5]. Для подвижных форм характерны толчкообразные движения за счет жгутиков и ундулирующей мембраны, которые особенно хорошо видны при исследовании в микроскопе с темнопольным конденсором. Необходимо отличать подвижность T.vaginalis от подвижных жгутиковых представителей семейства Bodonidae. Подвижные бактерии, прикрепленные к лейкоцитам и создающие ложное впечатление движения, также вероятно ошибочно идентифицировать как крупную трихомонаду.
Микроскопия окрашенных препаратов несколько повышает процент выявления трихомонад по сравнению с нативными препаратами в силу того, что учитываются не только типичные жгутиковые, но и амастиготные формы. Кроме того окрашенные препараты можно использовать для косвенной оценки воспалительного процесса - скопление лейкоцитов на клетках плоского эпителия или вокруг них. Еще один косвенный признак урогенитального трихомоноза - наличие большого количества слизи в исследуемом материале [6]. Правда, с увеличением количества лейкоцитов в отделяемом из уретры у мужчин больных урогенитальным трихомонозом, вероятность получения ложноположительных результатов культуральным и микроскопическим методами увеличивается [12].
В препаратах, окрашенных метиленовым синим, трихомонады наблюдаются в виде округлой или овальной формы, расположенные в слизи между клеточными элементами. Четко просматривается оболочка паразитов, эксцентрично расположенное ядро, интенсивно окрашенное в синий цвет, протоплазма - светло-синяя, вакуоли - бесцветные. При таком способе окраски трихомонады имеют характерный вид и хорошо распознаются [8]. Для более детального просмотра клетки и выявления хорошо идентифицируемых жгутиков следует использовать дифференциальные методы окраски по Романовскому-Гимзе, Лейшману.
В целом микроскопия нативного препарата считается высокоспецифичным тестом (99,8 %), но имеет низкую чувствительность - от 38 % до 82 %. [1,10 ,17,48]. Во многом это связано с высокой долей субъективизма при визуальной оценке результатов.
Питательные среды для культурального исследования
В связи с низкой чувствительностью микроскопического метода и в соответствии с протоколом ведения больных урогенитльным трихомониазом [14] идентификацию T.vaginalis следует проводить культуральным методом, считающимся, по мнению большинства исследователей, "золотым стандартом".
Первое in vitro культивирование T.vaginalis было проведено в 1915 г [36]. С тех пор разработаны разные варианты жидких и полужидких питательных сред для диагностики трихомониаза: среда Джонсона-Трасселя (СPLM), Даймонд среда, модифицированная Даймонд среда с добавлением тиогликолята натрия, среда Купферберг STS, среда Купферберг Difco, среда InPouch TV, среда TYM.
Известна попытка создания бессывороточной питательной среды для культивирования трихомонад [35]. Была предложена синтетическая питательная среда, в которой лошадиная сыворотка была заменена на бычий сывороточный альбумин и холестерин, совместно либо с глицериновыми жирными кислотами, либо со смесью жирных кислот. Однако на такой модифицированной среде скорость роста и урожай T.vaginalis были низкими.
В 70-80-х годах прошлого века в отделе микробиологии ЦНИИКВИ была разработана модифицированная среда Джонсона-Трасселя - среда СКДС [5]. В состав этой среды входят: смесь гидролизата казеина и гидролизина или аминопептида, отходы фармацевтической промышленности при изготовлении лизоцима, ферментативный гидролизат биомассы микроорганизмов, а также экстракт кормовых дрожжей. Коммерчески среда СКДС не выпускается.
В настоящее время отечественные производители выпускают следующие готовые питательные среды: питательная среда для выявления влагалищных трихомонад (ООО "Диагност-Мед", г. Омск), основа питательной среды для культивирования трихомонад (НПО "Микроген", г. Махачкала) и питательная среда СВТ для визуальной диагностики трихомониаза (НИИЭМ имени Пастера, г. Санкт-Петербург).
Исследования, посвященные сравнению питательных сред, немногочисленны. Так, в США в 1989 г. были проведены сравнительные испытания питательных сред, используемых для культивирования T.vaginalis. В качестве посевного материала они использовали клинические образцы вагинальных секретов от больных трихомонозом [43]. Частота обнаружения на разных питательных средах была следующей: Даймонд среда (93,9 %), модифицированная Даймонд среда с добавлением тиогликолята натрия (92,3 %), среда Купферберг STS (38,5 %) и среда Купферберг Difco (49,2 %). Были отмечены высокие ростовые свойства питательной среды Даймонд и положительный эффект добавления. Авторы, однако, указывают на низкую селективность исследованных питательных сред в отношении дрожжеподобных грибов (в 32 % случаев наблюдался рост дрожжеподобных грибов).
В Англии в 1997 г было проведено сравнительное исследование чувствительности питательных сред InPouch TV, Diamond и Джонсона-Трасселя [21]. В 4 мл каждой из трех сред добавляли по 30 мкл инокулюма. Результат оценивали на первые, вторые и четвертые сутки. Было показано, что наибольшей чувствительностью обладает питательная среда InPouch TV (87 %) по сравнению с Diamond (60 %) и Джонсона-Трасселя (57 %).
Культуральная диагностика трихомониаза напрямую зависит от выпускаемых питательных сред. В оптимальном алгоритме лабораторной диагностики обязательной ступенью должно быть культуральное исследование, причем с использованием качественных стандартизированных питательных сред [9]. Этот вывод подтверждается исследованиями, проведенными в 1990 г в ЦНИКВИ [2], которые показали, что подавляющее число больных трихомонозом (72,8 %), как среди женщин, так и среди мужчин, были выявлены при использовании культурального метода.
Методы, основанные на выявлении антигенов
Использование иммунохимических методов обнаружения антигенов возбудителя, таких как иммуноферментный анализ (ИФА) и реакция иммунофлуоресценции (РИФ), особенно актуально в случаях невозможности проведения культурального исследования или при расхождении результатов культурального и микроскопического методов.
Было показано, что чувствительность РИФ ниже, чем культурального исследования, но выше микроскопии нативного препарата [44]. Однако эта во многом субъективная методика к тому же требует отдельной обработки каждого мазка и люминесцентного микроскопа. Одновременная обработка всех проб в планшете и автоматическая детекция цветовых продуктов ферментативной реакции исправили некоторые основные недостатки РИФ.
В работах 80-х годов ИФА давал соизмеримый с культуральным методом процент положительных результатов. Однако авторы указывали, что из-за очевидной гетерогенности изолятов T.vaginalis при описываемых ими условиях ни один из них не имеет моноклональных антител, способных связываться с антигенами в клинических образцах [31,47]. Использование в качестве антигена отдельных иммуногенных белков для получения моноклональных антител несколько изменило сложившееся представление, и была продемонстрирована возможность обнаружения почти 90 % из протестированных клинических изолятов с положительным ответом.
Кроме того, явное преимущество этого метода перед методом "золотого стандарта" - это отсутствие строгих температурных требований. Авторы отмечают, что, возможно, важным звеном в получении достоверного результата служит процедура получения клинического материала, и важно использовать для образца буферный раствор, вследствие того, что помещение организма в фосфатно-солевой буферный раствор позволяет ему освобождать антигенную детерминанту, необходимую для связывания с антителом. Из этого следует, что ранее приписываемая гетерогенность T.vaginalis может быть обусловлена недоступностью антигенных детерминант для антитела, а не отсутствием антигена на поверхности трихомонады [34].
Стоит подчеркнуть, что в России отсутствуют коммерческие разрешенные к применению ИФА и РИФ тест-системы для диагностики трихомониаза.
Диагностическая ценность серологического метода
Изучением иммунологии трихомоноза занимаются уже долгое время [3]. В литературе мало информации о природе иммунного ответа при трихомонозе, неизвестно влияние макро и микроорганизмов на наличие или отсутствие симптомов. Однако понятно, что природа этого механизма неоднозначна и многообразна [20].
Большая часть противотрихомонадных антител принадлежит к IgG-классу [37]. Тем не менее, в сыворотках больных женщин выявляют повышенное содержание специфических IgM, и IgA антител, а при остром трихомонозе в вагинальных смывах отмечается увеличение IgA [28]. Для определения противотрихомонадных антител у пациентов в разные годы пытались использовать реакцию связывания комплимента (РСК) [18], внутрикожную пробу [8], реакцию пассивной гемагглютинации (РПГА) [32, 37, 38], реакцию непрямой иммунофлуоресценции (РНИФ) [13].
В 1981 году для серодиагностики трихомоноза впервые был использован метод иммуноферментного анализа (ИФА). При использовании в качестве "подложки" цельноклеточного антигена чувствительность составила всего 80,4 % [45]. Позднее были предприняты попытки использовать в качестве антигена цистеиновые протеиназы T.vaginalis, поскольку предполагается, что они вовлечены в патогенез. Специфичность в этом случае составила 100 %, однако чувствительность не превысила 90 % [20, 46].
В России подобных работ не проводилось, и, по мнению наших исследователей, чувствительность метода составляет чуть более 30 %, и его использование может быть рекомендовано только в качестве вспомогательного теста [16]. Низкая эффективность серологических методов в диагностике трихомониаза связана также с тем, что антитрихомонадные антитела могут циркулировать в сыворотке крови в течение длительного времени после лечения, а значит, практически невозможно дифференцировать текущую и пролеченную формы заболевания [19].
Методы, основанные на выявлении нуклеиновых кислот. Методы генодиагностики на основе определения специфических нуклеотидных последовательностей (мишеней) ДНК возбудителя появились сравнительно недавно. Уже в 1992 Riley D. E. впервые сообщил об использовании ПЦР в диагностике трихомоноза [41]. В работе было показано, что этот метод при использовании электрофоретического способа регистрации результатов помогает выявлять от 10 до 100 трихомонад в исследуемом материале.
Чувствительность и специфичность ПЦР во многом обусловлена правильным выбором мишеней для амплификации [42]. В наибольшей степени исследованные локусы в геномах простейших - это гены рибосомальных РНК, отличающиеся мультикопийностью (254 копии 18S рРНК/на клетку T.vaginalis) [22]. Наряду с геном 18S pРНК исследован ген бета-тубулина T.vaginalis. Использование праймеров из этого гена обеспечивало чувствительность равную 98 % в сравнении с культуральным методом системы InPouch [39]. Вместе с тем, оценивая эффективность праймеров, следует учитывать генетически обусловленную внутривидовую вариабельность Т.vaginalis. Сравнение пяти наборов диагностических праймеров показало, что чувствительность ПЦР, в первую очередь, зависит от выбора праймеров и, в меньшей степени, от способа регистрации результата: иммуноферментный метод детекции продуктов ПЦР показал лучший результат, чем электрофорез в геле [24].
Согласно современным представлениям, применение метода ПЦР оправдано при диагностике латентного течения трихомоноза, для выявления Т.vaginalis при микст-инфекции урогенитального тракта, при скрининговых исследованиях (в комплексе с микроскопическим методом), а также для контроля качества микроскопического исследования. В целом, эффективность диагностики существенно повышается при использовании ПЦР в сочетании с культуральным и/или микроскопическими методами исследования.
Заключение
Из-за отсутствия четкой клинической картины при хронических и стертых формах трихомоноза только лабораторные методы выявляют этиологический агент и устанавливают диагноз заболевания. В лабораторной диагностике острого трихомоноза при наличии в исследуемом материале типичных форм паразитов микробиологические методы дают однозначно интерпретируемые результаты, тогда как хронический трихомоноз, обусловленный неподвижными округлыми трихомонадами, представляет определенные трудности и требует использования комплекса лабораторных методов. Отметим, что, при очевидных преимуществах ПЦР, основным референс методом остается культуральное исследование.
Читайте также:

