Для обнаружения риккетсий применяют окраску
Обновлено: 23.04.2024
Общая характеристика патогенных риккетсий, биохимические свойства. Возбудитель Ку-риккетсиоза, основные симптомы и патологоанатомические изменения. Возбудитель риккетсиозного кератоконъюнктивита крупного рогатого скота. Возбудитель эперитрозооноза свиней.
| Рубрика | Сельское, лесное хозяйство и землепользование |
| Вид | курсовая работа |
| Язык | русский |
| Дата добавления | 15.05.2012 |
| Размер файла | 58,4 K |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Министерство сельского хозяйства и продовольствия Республики Беларусь
Витебская государственная академия ветеринарной медицины
Кафедра микробиологии и вирусологии
Курсовая работа на тему:
Лабораторная диагностика риккетсиозов сельскохозяйственных животных
Общая характеристика патогенных риккетсий
Риккетсиозы - группа заболеваний многих видов животных и человека, вызываемые внутриклеточными паразитами (риккетсиями), которые передаются в основном трансмиссивно и проявляются у животных лихорадками, пневмониями, ринитами, абортами и послеродовыми эндометритами, а также поражением лимфатической системы и форменных элементов крови.
Риккетсии названы в честь американского микробиолога Говарда Тейлора Риккетса, открывшего в 1909 году возбудителя одного из риккетсиозов - пятнистую лихорадку Скалистых гор и погибшего при его исследовании (1910).
Риккетсии довольно многочисленная группа, представленная патогенными и непатогенными видами. Патогенных видов значительно меньше. В природе риккетсии обитают преимущественно в организме насекомых (вшей, блох, клещей), а также грызунов, диких и сельскохозяйственных животных.
В настоящее время риккетсии классифицируются, согласно Определителя бактерий Берджи (1984; 1994) следующим образом:
Секция 9. Rickettsii et Chlamydii. Риккетсии и хламидии.
Порядок I. Rickettsiales.
Сем. Rickettsiaceae Сем. Bartonellaceae Сем. Anaplasmataceae
Род 1 Rickettsia Род 1 Bartonella Род 1 Anaplasma
Род 2 Rochalimaea Род 2 Grahamella Род 2 Aegyptianella
Род 3 Coxiella Род 3 Haemobartonella
Род 4 Ehrlichia Род 4 Eperhytrozoon
Род 6 Neoriсkettsia
Род 7 Wolbachia
Род 8 Rickettsiella
Ниже приведены основные патогенные роды и виды риккетсий:
Род 1 Rickettsia
Вид R.conjunctivae - возбудитель риккетсиозного кератоконъюнктивита крупного рогатого скота
Вид R. prowacheki - возбудитель эпидемического сыпного тифа
Всего шестнадцать видов
Вид C. burnetii - возбудитель Ку-лихорадки (Ку-риккетсиоза)
Род 4 Ehrlichia
Вид E. canis - возбудитель эрлихиоза собак (эрлихиозного (Rickettsia canis) моноцитоза)
Вид E. phagocytophila - возбудитель эрлихиоза жвачных и всеядных (E. bovis, E. ovis) (эрлихиозного моноцитоза, риккетсиозного моноцитоза)
Вид E. egui - возбудитель эрлихиоза лошадей
Вид E. senetsee - возбудитель лихорадки долины реки Пото- (E. risticii) мак (эрлихиозного колита, моноцитарного эрлихиоза, синдрома диареи лошадей)
Вид C. ruminantium - возбудитель риккетсиозного гидроперикардита (коудриоза, инфекционного гидроперикардита, сердечной водянки крупного и мелкого рогатого скота)
Род 6 Neorikettsia
Вид N. helminthoeca - возбудитель неориккетсиоза (эрлихиоза) собак
Род 7 Wolbachia
Вид W. melophagi
Вид W. persise - возбудители болезней насекомых
Вид W. pipientis
Род 2 Grachamella
Вид G. peromysci - возбудитель болезни грызунов
Вид G. talpae - возбудитель болезни кроликов
Род 1 Anaplasma
Вид A. centrale - возбудитель анаплазмоза крупного рогатого скота
Вид A. marginale
Вид A. ovis - возбудитель анаплазмоза овец и коз
Роз 3 Haemobartonella
Вид H. felis - возбудители заболеваний собак, кошек,
Вид H. muris диких грызунов
Род 4 Eperythrozoon
Вид E. ovis - возбудитель эперитрозооноза овец
Вид E. suis - возбудитель эперитрозооноза свиней
Вид E. wenyonii - возбудитель эперитрозооноза крупного рогатого скота
Согласно 9-го издания (1994) “Определителя бактерий Берджи” в 2-х томах риккетсии также оставлены в группе (секции) 9 “Риккетсии и хламидии”, в которой упразднена таксономическая категория “триба”, остальные таксономические категории - семейства, роды и виды - остались без изменений.
В соответствии с родовой, видовой принадлежностью большую часть патогенных риккетсий подразделяют на группы заболеваний: заболевания вызываемые эрлихиями - эрлихиозы, коудриями - коудриозы, неориккетсиями - неориккетсиозы, анаплазмами - анаплазмозы, бартонеллами - бартонеллезы и т.д.
В настоящее время наибольшую актуальность имеют возбудители: Ку-лихорадки - C. burnetti, риккетсиозного кератоконъюнктивита - R. сonjunctivae, анаплазмоза крупного рогатого скота - A. centrale, A. marginalae и анаплазмоза овец и коз A. ovis.
Морфологические свойства
Строение риккетсий аналогично строению прочих бактерий. У риккетсий выделяют оболочку, цитоплазму и зернистые включения. Ядерная структура представлена зернышками (от 1-2 до 4). В клетках выявляют ДНК и РНК.
Риккетсии полиморфны. Все многообразие их форм может быть сведено к четырем основным морфологическим типам (по П.Ф. Здродовскому, 1972), (рис. 1, приложение 1):
Тип а. Кокковидные, монозернистые риккетсии, размер 0,3-1 мкм (чаще 0,5 мкм) в диаметре, это наиболее патогенный тип, типичны для интенсивного размножения возбудителя в клетках (рис 1 а);
Тип в. Палочковидные, биполярные (гантелевидные), размер: ширина 0,3 мкм, длина 1-1,5 мкм (также выделяются при активном развитии риккетсиоза) (рис. 1 в).
Тип с. Бациллярные, удлиненные, обычно изогнутой формы, размер: в ширину 0,3-1 мкм, в длину 3-4 мкм (выделяются в начальном периоде болезни, слабовирулентные, часто бизернистые палочки, иногда могут включать по 4 зернышка парно расположенных на полюсах) (рис. 1 с).
Тип d. Нитевидные, полизернистые риккетсии имеют вид длинных причудливо прогнутых нитей, размер: ширина 0,3-1 мкм, длина 10-40 мкм и более; (их выделение также характерно для начальных стадий инфекции - показатель раннего умеренного риккетсиоза) (рис. 1,d).
Встречаются также очень мелкие до 0,2 мкм, проходящие через бактериальные фильтры и невидимые в обычном световом микроскопе формы, которые являются ранней стадией внутриклеточной репродукции возбудителя болезни.
Риккетсии неподвижны, спор и капсул не образуют.
Риккетсии размножаются как и бактерии простым поперечным делением. Выделяют 2 типа деления:
обычное деление кокковидных а - и в - форм с образованием гомогенных популяций;
размножение дроблением нитевидных d - форм с последующим образованием популяций, состоящих из клеток а - и в - типов.
Тинкториальные свойства
Риккетсии окрашиваются грамотрицательно.
Кокковидные формы риккетсий окрашиваются по Романовскому-Гимзе и Цилю-Нильсону в красный цвет, палочковидные и нитевидные в красно-голубой (зерна-гранулы красные, цитоплазма между ними голубая), по Здродовскому - в красный цвет (рис. 2, приложение 2).
Окраска по методу Романовского-Гимзе является классической для выявления риккетсий внутри и вне клеток.
В случае необходимости окрашенные препараты можно дополнительно дифференцировать слабым раствором 0,5 % лимонной кислоты в результате чего улучшается контрастность окраски риккетсий в отношении общего фона.
Чаще используют холодный метод. При этом цитоплазма риккетсий окрашивается в фиолетовый или голубой цвет, а ядерные гранулы в красный.
Окраска риккетсий по Романовскому-Гимзе даёт хорошие результаты лишь при соблюдении определенных требований (надежная фиксация препарата, хорошее качество краски, требуемая рН воды, достаточно длительная окраска).
Для текущей работы метод мало пригоден, так как требует длительного времени.
Чаще в практике используют методы дифференциальной окраски фуксином и метиленовым синим, это методы окраски по Здродовскому и Маккиавелло. Суть окраски этими методами заключается в том, что риккетсии имеют известную кислотоустойчивость. После окраски препаратов фуксином, их дифференцируют кислотой и докрашивают метиленовым синим. В итоге риккетсии сохраняют окраску фуксина, а тканевые элементы, окрашиваются в контрастный синий или голубой цвет.
Техника окраски по методу П.Ф. Здродовского: данный метод является облегченной модификацией способа Циля-Нильсена (обычный карболовый фуксин Циля - основной фуксин 1 г, фенол 5 г, спирт 10 мл, дистиллированная вода 100 мл) разводят в соотношении 10-15 капель на 10 мл дважды дистиллированной воды или фосфатного буфера при рН 7,4. Препарат, сделанный тонким слоем, высушивают на воздухе и фиксируют над пламенем, окрашивают разведенным фуксином 5 минут. Затем промывают водой, быстро (2-3 сек) дифференцируют погружением в ванночку с кислотой (0,5 % лимонной или 0,15 % уксусной, либо 0,01% соляной и др.), промывают водой и докрашивают 10 секунд 0,5 % водным раствором метиленовой сини, промывают, подсушивают фильтровальной бумагой. Риккетсии окрашиваются в рубиново-красный цвет, клеточные элементы - в голубой (протоплазмы) или синий (ядро) цвет.
Техника окраски по методу Маккиавелло: подсушенный препарат фиксируют пламенем спиртовки, окрашивают через фильтровальную бумагу фуксином (0,25 % щелочной раствор основного фуксина, рН 7,2-7,4) 4 минуты, промывают водой, погружают в 0,25 % раствор лимонной кислоты по 1-3 секунды, окрашивают 0,5 % водным раствором метиленовой сини, промывают, подсушивают фильтровальной бумагой. Риккетсии окрашиваются в красный цвет на синем фоне (рис. 3).
Культуральные и биохимические свойства
Патогенным риккетсиям свойственнен внутриклеточный паразитизм. Риккетсии не культивируются на обычных питательных средах. Их репродуцируют на развивающихся куриных эмбрионах (РКЭ), в культуре клеток или в организме лабораторных животных.
Риккетсии - аэробы, поглощают О2 и выделяют СО2, образуют гемолизины, активно окисляют глутаминовую кислоту, выделяя углекислый газ, но индифферентны к глюкозе, образуют эндотоксины, сходные в иммунологических реакциях с бактериальными токсинами, но будучи связанными с риккетсиями в окружающую среду не выделяются.
Токсинообразование
Патогенные риккетсии образуют токсические вещества, играющие важную роль в патогенезе риккетсиозов. От бактериальных токсинов их отличает неотделимость от микробных клеток и их чрезвычайная неустойчивость. Эндотоксины сходны в иммунологических реакциях с бактериальными токсинами, но будучи связаны с риккетсиями, в окружающую среду не выделяются. В то же время они не тождественны эндотоксинам, так как термолабильны (белки) и неустойчивы к действию формалина (при иннактивации сохраняют свои иммуногенные свойства). Всем патогенным видам присущи гемолитические свойства.
Устойчивость
Выживаемость в жидких средах зависит от их свойства, рН и ТоС, лучше сохраняются в белковых средах с нейтральной или слабощелочной рН. Так, Coxiella burnetii сохраняется в молоке при 4оС до 2-х месяцев. В высушеном состоянии сохраняются дольше на различных субсиратах (фекалии вшей) до 1 - 3 лет.
Во внешней среде устойчивость риккетсий (кроме C. burnetii) невысокая. Нагревание во влажной среде до 50-60 0С обеспечивает гибель риккетсий через 5-30 мин, при 70 0С - через 1-3 мин. Риккетсии Бернета (возбудитель Ку-лихорадки) выдерживают длительное (30-90 мин) нагревание при 60-63 0С и полностью погибают только при кипячении. Низкие температуры не убивают, а консервируют риккетсий. Консервируются при минус 20-70 0С, в замороженном состоянии длительное время сохраняют жизнеспособность и вирулентные свойства.
При воздействии на риккетсий различных дезосредств в обычных концентрациях (3-5 % фенол, 2 % хлорамин, 2 % формальдегид, 10 % перекись водорода, 10 % гидроокись натрия), их гибель наступает через 5 мин, а 1 % раствор хлорной извести убивает риккетсий через 1 минуту.
Риккетсии чувствительны к тетрациклину, дибиомицину, синтомицину, левомицетину и сульфаниламидам.
Лиофилизация обеспечивает длительное сохранение (годами).
Патогенность
Патогенность риккетсий определяется их способностью проникать в чувствительные к ним клетки, где происходит их размножение, синтезировать токсин, действие которого проявляется лишь при жизни микроорганизмов. Токсин не секретируется как истинные экзотоксины и не вызывает интоксикацию организма после гибели возбудителя, как эндотоксины. Он термолабилен, разрушается при нагревании микробной суспензии до 600С. внутривенное введение взвеси живых риккетсий белым мышам, вызывает острую интоксикацию и смерть животных через 2-24 часа.
Риккетсиям свойственна изменчивость проявляющаяся снижением и утратой вирулентности с сохранением иммуногенных свойств, что используют при изготовлении живых авирулентных вакцин.
Дифференциация риккетсий от вирусов и прокариотных микроорганизмов
Риккетсии схожи как с вирусами, так и с бактериями, но существует ряд отличительных особенностей.
Сходство с прокариотными микроорганизмами:
риккетсии имеют трехслойную клеточную стенку;
содержат два типа нуклеиновых кислот, рибосомы и систему дыхания сходную с прокариотами;
окрашиваются анилиновыми красителями;
чувствительны к антибиотикам тетрациклинового ряда, сульфаниламидам, а некоторые виды (N. hilminthoeca) к широкому спектру антибиотиков.
Сходство с вирусами:
риккетсии облигатные внутриклеточные паразиты;
самые мелкие формы риккетсий обладают фильтруемостью через бактериальные фильтры;
риккетсии способны культивироваться только в живой клетке (РКЭ, КК, организме лабораторных животных);
Диагностика риккетсиозов. Лабораторное выявление риккетсиозов
Риккетсии по своим морфологическим и биологическим свойствам занимают промежуточное положение между бактериями (видны в обычный микроскоп при специальных методах окраски) и вирусами (они также не способны, за редким исключением, к размножению вне клеток хозяина). Лабораторная диагностика сводится к тем же методам индикации их в биологических жидкостях и в тканях органов, поражаемых при риккетсиозах, как и при вирусных инфекциях.
Кроме метода Романовского, используют методы импрегнации серебром по М.А. Морозову, окраску по Маккиавелло в модификации П.Ф. Здродовского и др.

Для серологической диагностики риккетсиозов применяют те же методы, что для диагностики бактериальных и вирусных инфекций с некоторой их модификацией. В клинической практике применяют реакцию агглютинации, РСК, РГА. Кроме того, для специальных исследований используют реакцию нейтрализации токсического действия риккетсии, реакцию опсонизации и др. В лабораторной диагностике риккетсиозов важное место занимают люминесцентная микроскопия и люминисцентно-серологичский метод, а также электронная микроскопия.
По аналогии с бруцеллезом и туляремией с определенным успехом стали применять аллергодиагностику лихорадки Ку, используемую при широких эпидемиологических обследованиях животных для выявления среди них источников инфекций. В клинической практике внутрикожная проба с аллергеном риккетсии Бернетта для диагностики лихорадки Ку имеет ограниченное применение. С ее помощью установлено, что специфическая аллергия выявляется на 1-й неделе болезни и сохраняется у переболевших до 4 лет. Другой важной особенностью лихорадки Ку является позднее образование у больных специфических антител.
У некоторых они появляются только к 4-6-й неделе от начала болезни. Применяемая в этих случаях РСК имеет ретроспективное диагностическое значение, но ее выполнение необходимо для точной верификации диагноза лихорадки Ку.
В научно-исследовательской работе выделение чистых культур риккетсий осуществляется с помощью тех же методов, что и при выделении вирусов, с той лишь разницей, что при риккетсиозах есть свои дополнительные методы, например, получение штаммов риккетсий на вшах (выделение возбудителя сыпного тифа). Идентификацию выделенных штаммов риккетсий проводят морфологическим методом и в эксперименте на животных. Экспериментальной моделью воспроизведения риккетсиозной инфекции служат морские свинки - самцы.
При внутрибрюшном заражении развивается скротальный феномен (опухоль и отек яичек), откуда можно получить материал, содержащий риккетсий. При заражении морских свинок R. prowazeki, R. moosen, D Siberians, D. murinus инфекция протекает доброкачественно. Смертельный исход у морских свинок наблюдается при заражении R tsutsugamushi, R.burnetti; при других возбудителях погибают и белые мыши.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
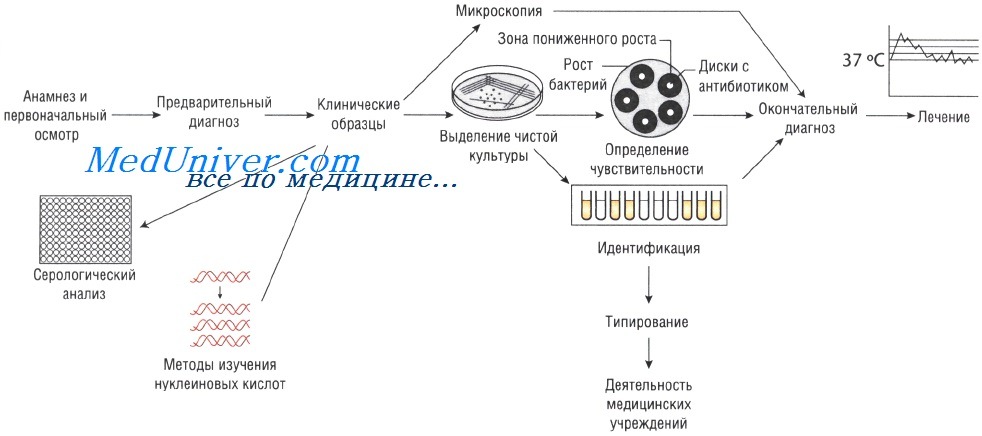
Лабораторные исследования при инфекционных заболеваниях. Методы
Отбор проб для анализа при инфекционных заболеваниях. Для микробиологического исследования может быть отобрана любая ткань или физиологическая жидкость организма.
Выделение чистой культуры способствует увеличению количества бактерий и их точной идентификации. Для этого используют питательные среды. Если в образце присутствует нормальная микрофлора, то применяют избирательные (селективные) среды, позволяющие создать условия, неблагоприятные для роста непатогенных микроорганизмов и способствующие росту патогенной микрофлоры.
Для получения точных результатов следует выбрать оптимальный метод отбора проб и подойти к этому процессу с должной аккуратностью. При несоблюдении правил асептики контаминация проб крови микроорганизмами извне может привести к назначению неправильного лечения.
Большинство бактерий не способны существовать вне организма хозяина: облигатные анаэробы погибают под действием кислорода воздуха, а некоторые возбудители очень чувствительны к высыханию (Neisseria gonorrhoeae). Именно поэтому анализируемые образцы сразу после отбора должны быть помещены на подходящие среды или посеяны на среды для транспортировки.
Лабораторные методы исследования при инфекционных заболеваниях
Образцы могут быть проанализированы невооружённым глазом (например, для определения взрослых гельминтов в фекалиях или крови в мокроте). Микроскопия — быстрый и недорогой метод исследования, но требует высокого технического мастерства, характеризуется низкой чувствительностью: для точного определения необходимо присутствие большого количества возбудителей.
Кроме того, очень часто условно-патогенные микроорганизмы принимают за патогенные, что связано с недостаточной специфичностью метода.
Для определения возбудителя могут быть использованы различные красители (например, аурамин или окрашивание по Цилю—Нильсену для идентификации микобактерий). Уротропиновый серебряный окрашивает хитин клеточной стенки грибов и Pneumocystis jiroveci. Краситель Гимза применяют для окрашивания возбудителей малярии, лейшманий и других паразитов.
В основе иммунофлюоресцентного метода лежит применение специфических антител, помеченных флюоресцентными маркёрами. Микроскопию осуществляют в ультрафиолетовом свете, при этом возбудитель и связанные с ним антитела светятся ярко-зелёным цветом.
Лабораторные исследования при инфекционных заболеваниях
Выделение чистой культуры возбудителя при инфекционных заболеваниях
Иногда, даже при выраженных клинических симптомах, возбудитель может присутствовать в очаге инфекции в количестве, недостаточном для микроскопического определения. В этом случае выделение чистой культуры позволяет увеличить численность микроорганизмов в исследуемом субстрате.
Существует два способа выращивания микроорганизмов: на жидких (увеличивается количество возбудителей) и твёрдых (исследуют отдельные колонии, в том числе и на чувствительность к антибиотикам) питательных средах. Большинство возбудителей инфекций человека достаточно требовательны к условиям культивирования. Именно поэтому питательные среды для их выращивания должны содержать белки, сахарозу и нуклеиновые кислоты (присутствующие в крови и сыворотке).
Кроме того, необходимо поддерживать соответствующий газовый состав: для культивирования анаэробов необходимо отсутствие кислорода, в то время как для облигатных аэробов (Bordetella pertussis) — наоборот. Оптимальная температура выращивания большинства патогенных микроорганизмов составляет 37 °С; культивирование некоторых фибов осуществляют при 30 С.
Идентификация возбудителя инфекционного заболевания
Симптомы заболеваний зависят от вида возбудителей, вызвавших их. Именно поэтому идентификация микроорганизма позволяет предположить клиническую картину вызываемого им заболевания (например, симптомы инфекции, вызванной Vibrio cholerae, отличны от таковых при заражении Shigella sonnei). Большое значение имеет выделение Neisseria meningitidis именно из спинномозговой жидкости. Идентификация микроорганизмов основана на:
• изучении морфологических свойств их колоний в агаре;
• различной окраске по Граму;
• способности возбудителей к образованию спор;
• изучении биохимических свойств (каталазный или коагулазный тесты).
Точное определение штамма обычно зависит от результатов биохимического анализа (например, уреазный тест) или обнаружения продуктов жизнедеятельности бактерий (индол). Возбудителей, которые не могут быть выращены на питательных средах, идентифицируют при помощи молекулярно-генетического метода ДНК и секвенирования (например, Trophyrema whippelii).

Определение чувствительности возбудителя инфекционного заболевания к антибиотикам
Если для эрадикации микроорганизмов достаточно стандартной дозы антимикробного препарата, то их считают чувствительными, если необходимо увеличение дозы лекарственного средства — относительно устойчивыми. Абсолютно устойчивыми (резистентными) называют возбудителей, в отношении которых антибиотикотерапия неэффективна. Существует широкий спектр различных методов определения чувствительности к антимикробным препаратам.
Методы Британской ассоциации антимикробной химиотерапии (British Society of Antimicrobial Chemotherapy — BSAQ и Института клинических лабораторных стандартов (Clinical Laboratory Standards Institute — С LSI) основаны на определении диаметра зоны слабого роста микроорганизмов на твёрдой питательной среде при применении антимикробного препарата.
Минимальную подавляющую концентрацию антибиотика измеряют с помощью Е-теста, растворения препарата в питательном бульоне или нанесения его на плотный агар. В последнем случае на засеянный исследуемыми микроорганизмами агар наносят бумажные диски, пропитанные различными антибиотиками (метод бумажных дисков).
Уровень чувствительности зависит от диаметра зоны пониженного роста бактерий. Однако тестирование in vitro предоставляет лишь приблизительные данные, так как в клинической практике многое зависит от состояния больного.

Серологический анализ при инфекционном заболевании
Различные виды инфекций можно идентифицировать с помощью определения иммунного ответа, возникающего при внедрении возбудителя. Для этого существует большое количество различных методов: реакция агглютинации (РА), реакция связывания комплемента (РСК), реакция нейтрализации (РН) и иммуноферментный анализ (ИФА). Диагноз устанавливают на основании:
• определения уровня антител (IgM) в ответ на попадание в организм чужеродного белка (антигена);
• определения антигена.
Молекулярный анализ при инфекционном заболевании
Южный блоттинг и метод гибридизации нуклеиновых кислот. Методы основаны на связывании меченой ДНК с анализируемым образцом, при условии, что он имеет определённую последовательность аминокислот. Связанный комплекс определяют по активности метки. Это достаточно быстрый и надёжный способ, который, тем не менее, уступает по чувствительности молекулярно-генетическим методам.

Метод молекулярно-генетический (NAAT)
Для диагностики инфекционных заболеваний используют несколько молекулярно-генетических методов. Механизм выделения патогенной ДНК или РНК в количестве, достаточном для постановки диагноза, для каждого метода индивидуален. Так, при молекулярно-генетическом методе ДНК возбудителя разделяют на отдельные цепи, затем синтезируют праймеры для связывания с целевыми последовательностями. Образование новой ДНК катализирует полимераза.
Основное преимущество — достижение результата даже при наличии всего лишь одной копии ДНК. Благодаря автоматизированным системам и большому выбору специальных наборов эти методы стали доступны большинству диагностических лабораторий. Новые аппараты способны выдавать результат в режиме реального времени. Генетические методы позволяют идентифицировать микроорганизмы, выращивание которых отличается сложностью или сопряжено с риском для человека (например, Mycobacterium tuberculosis и Chlamydia trachomatis).
Кроме того, их можно использовать для определения генов, кодирующих устойчивость к действию антибиотиков (например, мутационный ген rpoВ, обеспечивающий устойчивость М. tuberculosis к рифампицину). Это позволяет заранее выбрать альтернативный путь лечения инфекционных заболеваний.
Иногда необходимо проводить типирование микроорганизмов в случае их распространения в больницах или в окружающей (внебольничной) среде.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
20 2) форму наподобие буквы S
3) образует мицелий
4) редкие неравномерные глубокие завитки
14. ЖИЗНЕННЫЙ ЦИКЛ РАЗВИТИЯ ИМЕЮТ
1) грибы
2) вирусы
3) риккетсии
4) хламидии
15. ЯДЕРНАЯ МЕМБРАНА ПРОСТЕЙШИХ НАЗЫВАЕТСЯ
1) ламина
2) пелликула
3) кинетида
4) ризоподия
ТЕСТОВЫЕ ЗАДАНИЯ К ЛАБОРАТОРНОМУ ЗАНЯТИЮ ПО ПО ТЕМЕ
«СТРУКТУРА КЛЕТОЧНЫХ ФОРМ МИКРООРГАНИЗМОВ (ГРИБОВ,
ПРОСТЕЙШИХ, СПИРОХЕТ, РИККЕТСИЙ, ХЛАМИДИЙ, МИКОПЛАЗМ)
Вариант 3
Выберите верное
1.ПРОСТЕЙШИЕ ЯВЛЯЮТСЯ
1) эукариотами
2) прокариотами
3) мопопотентными
4) внутриклеточными паразитами
2.ЛЕПТОСПИРЫ ИМЕЮТ СЛЕДУЮЩИЕ МОРФОЛОГИЧЕСКИЕ ОСОБЕННОСТИ:
1) равномерные мелкие завитки
2) форму наподобие буквы S
3) образует мицелий
4) редкие неравномерные глубокие завитки
3. ЖИЗНЕННЫЙ ЦИКЛ РАЗВИТИЯ ИМЕЮТ
1) грибы
2) вирусы
3) риккетсии
4) хламидии
4. ЯДЕРНАЯ МЕМБРАНА ПРОСТЕЙШИХ НАЗЫВАЕТСЯ
1) ламина
2) пелликула
3) кинетида
4) ризоподия
5.АКТИНОМИЦЕТЫ ХАРАКТЕРИЗУЮТСЯ:
1)присутствием стеролов в составе мембраны
2)способностью к внутриклеточному паразитизму
3)отсутствием клеточной стенки
4)способностью образовывать мицелий
6. МИКРОСКОПИЧЕСКИЕ ГРИБЫ ХАРАКТЕРИЗУЮТСЯ:
1) полиморфизмом
2) мономорфностью
3) диморфностью
4) гифальностью
24 10.ГЕНОМ ВИРУСА ВСТРОЕННЫЙ ВНУТРЬ КЛЕТОЧНОГО, НАЗЫВАЕТСЯ:
1)линейным
2)кольцевым
3)провирусным
4)фрагментарным
11.ДЛЯВИРУСОВ ХАРАКТЕРНО:
1) синтез экзотоксинов
2) наличие нескольких типов нуклеиновой кислоты
3) факультативный паразитизм
4) дизъюнктивный способ репродукции
12.БАКТЕРИОФАГ ЭТО
1) клетка
2) бактерия
3) вирус
4) простейшее
13.В ЗАВИСИМОСТИ ОТ ФОРМЫ БАКТЕРИОФАГИ БЫВАЮТ
1) нитевидные
2) кубические
3) с отростком
4) все перечисленное
14. В ЗАВИСИМОСТИ ОТ ТИПА ВЗАИМОДЕЙСТВИЯ ВИРУСОВ С
КЛЕТКОЙ РАЗЛИЧАЮТ ИНФЕКЦИЮ
1) умеренную
2) интегративную
3) свободную
4) лизогенную
15.КАПСИДНЫЕ БЕЛКИ ХАРАКТЕРИЗУЮТСЯ
1) устойчивостью к протеолитическим ферментам
2) способностью к самосборке
3) специфичностью
4) всем перечисленным
ТЕСТОВЫЕ ЗАДАНИЯ К ЛАБОРАТОРНОМУ ЗАНЯТИЮ ПО ТЕМЕ
" МОРФОЛОГИЯ ВИРУСОВ И БАКТЕРИОФАГОВ. СПОСОБЫ ВЫЯВЛЕНИЯ "
Вариант 2
Выберите верное
1.ПОРЯДОК РАСПОЛОЖЕНИЯ КАПСОМЕРОВ У ВИРУСОВ НАЗЫВАЕТСЯ
1) симметрией
2) презентацией
3) капсидом
4) суперкапсидом
2.КАПСИДНЫЕ БЕЛКИ ХАРАКТЕРИЗУЮТСЯ
1) устойчивостью к протеолитическим ферментам
2) способностью к самосборке
3) специфичностью
4) всем перечисленным
3.СУПЕРКАПСИД ВИРУСА ПРЕДСТАВЛЕН:
1)фосфолипидной мембраной со встроенными гликопротеинами
2)фосфолипидной мембраной, лишенной белковых компонентов
25 3) белками отличными от мембраны клетки
4) гликопротеинами
4. ПРОНИКНОВЕНИЕ ВИРУСА В КЛЕТКУ ОСУЩЕСТВЛЯЕТСЯ ПУТЕМ
1) адсорбции
2) рецепторного эндоцитоза
3) воздействия клеточных липаз
4) активного транспорта
5. ДЛЯВИРУСОВ ХАРАКТЕРНО:
1) синтез экзотоксинов
2) наличие нескольких типов нуклеиновой кислоты
3) факультативный паразитизм
4) дизъюнктивный способ репродукции
6. ГЕНОМ ВИРУСА ВСТРОЕННЫЙ ВНУТРЬ КЛЕТОЧНОГО НАЗЫВАЕТСЯ:
1)линейным
2)кольцевым
3)провирусным
4)фрагментарным
7. ДЛЯ ИЗУЧЕНИЯ СТРОЕНИЯ ВИРУСОВ ИСПОЛЬЗУЕТСЯ:
1)темнопольная микроскопия
2)фазово-контрастная микроскопия
3)электронная микроскопия
4)микроскопия в затемненном поле
8.
К МЕТОДАМ ИНДИКАЦИИ ВИРУСОВ ОТНОСИТСЯ РЕАКЦИЯ
1) иммунодиффузии
2) бляшкообразования
3) иммунофлюоресценции
4) нейтрализации
9.
ЦИТОПАТИЧЕСКОЕ ДЕЙСТВИЕ В ВИДЕ
ТЕЛЕЦ ПАШЕНА
ОБНАРУЖИВАЕТСЯ ПРИ
1) бешенстве
2) ветряной оспе
3) натуральной оспе
4) краснухе
10.
КУЛЬТУРЫ КЛЕТОК ВЫРАЩИВАЮТ НА СРЕДЕ
1) Левенштейна-Иенсена
2) Леффлера
3) Эндо
4) 199 11.
ЭНДОТОКСИН ВИРУСОВ ПО ХИМИЧЕСКОЙ ПРИРОДЕ ЯВЛЯЕТСЯ
1) белок
2) липополисахарид
3) гликопротеид
4) фосфолипид
12. В ЗАВИСИМОСТИ ОТ ТИПА ВЗАИМОДЕЙСТВИЯ ВИРУСОВ С
КЛЕТКОЙ РАЗЛИЧАЮТ ИНФЕКЦИЮ
1) умеренную
2) интегративную
3) свободную
4) лизогенную
13.ВЕЛИЧИНУ ВИРУСОВ ВЫРАЖАЮТ В
1) ангстремах
2) нанометрах
26 3) микрометрах
4) миллиметрах
14. ВИРИОН ВЫПОЛНЯЕТ ФУНКЦИЮ:
1) сохранения вируса во внешней среде
2) перенос генома в клетку
3) репродукции вируса
4) созревания вируса
15. ВИРУСНЫЕ ШИПЫ РАСПОЛАГАЮТСЯ ТРАНСМЕМБРАННО И ОТВЕЧАЮТ ЗА
1) прикрепление к клетке
2) проникновение в клетку
3) антигенные свойства
4) все перечисленное
ТЕСТОВЫЕ ЗАДАНИЯ К ЛАБОРАТОРНОМУ ЗАНЯТИЮ ПО ТЕМЕ
" МОРФОЛОГИЯ ВИРУСОВ И БАКТЕРИОФАГОВ. СПОСОБЫ ВЫЯВЛЕНИЯ "
Вариант 3
Выберите верное
1. В ЗАВИСИМОСТИ ОТ ТИПА ВЗАИМОДЕЙСТВИЯ ВИРУСОВ С
КЛЕТКОЙ РАЗЛИЧАЮТ ИНФЕКЦИЮ
1) умеренную
2) интегративную
3) свободную
4) лизогенную
2.ДЛЯ ВИРУСОВ СО СПИРАЛЬНЫМ ТИПОМ СИМЕТРИИ ХАРАКТЕРНО
1) прочность структуры
2) большое число протомеров
3) палочковидный нуклеокапсид
4) все перечисленное
3.
ВИРУСЫ С КУБИЧЕСКИМ ТИПОМ СИММЕТРИИ ХАРАКТЕРИЗУЮТСЯ
1) призматическими капсомерами
2) вытянутой формой
3) большим расходом белка
4) большей прочностью капсида
4.К НЕСТРУКТУРНЫМ БЕЛКАМ ВИРУСА ОТНОСЯТ:
1) капсидные белки
2) геномные ферменты
3) матриксные белки
4) регуляторные белки
5.ВИРУСНЫЕ ШИПЫ РАСПОЛАГАЮТСЯ ТРАНСМЕМБРАННО И ОТВЕЧАЮТ ЗА
1) прикрепление к клетке
2) проникновение в клетку
3) антигенные свойства
4) все перечисленное
6.
К МЕТОДАМ ИНДИКАЦИИ ВИРУСОВ ОТНОСИТСЯ РЕАКЦИЯ
1) иммунодиффузии
2) бляшкообразования
3) иммунофлюоресценции
4) нейтрализации
7. ВИРУСЫ ХАРАКТЕРИЗУЮТСЯ
27 1) клеточной формой строения
2) органной формой строения
3) организменная форма строения
4) неклеточной формой строения
8.ГЕНЕТИЧЕСКИЙ АППАРАТ БАКТЕРИОФАГОВ ЧАЩЕ ПРЕДСТАВЛЕН
1) двунитчатой дезоксирибонуклеиновой кислотой
2) однонитчатой дезоксирибонуклеиновой кислотой
3) рибонуклеиновой кислотой
4) рибонуклеиновой и дезоксирибонуклеиновой кислотой
9.ПОРЯДОК РАСПОЛОЖЕНИЯ КАПСОМЕРОВ У ВИРУСОВ НАЗЫВАЕТСЯ
1) симметрией
2) презентацией
3) капсидом
4) суперкапсидом
10. ГЕНОМ ВИРУСА ВСТРОЕННЫЙ ВНУТРЬ КЛЕТОЧНОГО НАЗЫВАЕТСЯ:
1)линейным
2)кольцевым
3)провирусным
4)фрагментарным
11. ПЕРВООТКРЫВАТЕЛЕМ ВИРУСОВ СЧИТАЕТСЯ
1) Р.Кох
2) ААСмородинцев
3) Д.И.Ивановский
4) А.Флеминг
12.ВЕЛИЧИНУ ВИРУСОВ ВЫРАЖАЮТ В
1) микрометрах
2) ангстремах
3) сантиметрах
4) нанометрах
13.ПРОНИКНОВЕНИЕ ВИРУСА В КЛЕТКУ ОСУЩЕСТВЛЯЕТСЯ ПУТЕМ
1) адсорбции
2) рецепторного эндоцитоза
3) воздействия клеточных липаз
4) активного транспорта
14. СУПЕРКАПСИД ВИРУСА ПРЕДСТАВЛЕН:
1)фосфолипидной мембраной со встроенными гликопротеинами
2)фосфолипидной мембраной, лишенной белковых компонентов
3) белками отличными от мембраны клетки
4) гликопротеинами
15. В ЗАВИСИМОСТИ ОТ ФОРМЫ БАКТЕРИОФАГИ БЫВАЮТ
1) нитевидные
2) кубические
3) с отростком
4) все перечисленное
Диагностика риккетсиозов. Лабораторное выявление риккетсиозов
Риккетсии по своим морфологическим и биологическим свойствам занимают промежуточное положение между бактериями (видны в обычный микроскоп при специальных методах окраски) и вирусами (они также не способны, за редким исключением, к размножению вне клеток хозяина). Лабораторная диагностика сводится к тем же методам индикации их в биологических жидкостях и в тканях органов, поражаемых при риккетсиозах, как и при вирусных инфекциях.
Кроме метода Романовского, используют методы импрегнации серебром по М.А. Морозову, окраску по Маккиавелло в модификации П.Ф. Здродовского и др.

Для серологической диагностики риккетсиозов применяют те же методы, что для диагностики бактериальных и вирусных инфекций с некоторой их модификацией. В клинической практике применяют реакцию агглютинации, РСК, РГА. Кроме того, для специальных исследований используют реакцию нейтрализации токсического действия риккетсии, реакцию опсонизации и др. В лабораторной диагностике риккетсиозов важное место занимают люминесцентная микроскопия и люминисцентно-серологичский метод, а также электронная микроскопия.
По аналогии с бруцеллезом и туляремией с определенным успехом стали применять аллергодиагностику лихорадки Ку, используемую при широких эпидемиологических обследованиях животных для выявления среди них источников инфекций. В клинической практике внутрикожная проба с аллергеном риккетсии Бернетта для диагностики лихорадки Ку имеет ограниченное применение. С ее помощью установлено, что специфическая аллергия выявляется на 1-й неделе болезни и сохраняется у переболевших до 4 лет. Другой важной особенностью лихорадки Ку является позднее образование у больных специфических антител.
У некоторых они появляются только к 4-6-й неделе от начала болезни. Применяемая в этих случаях РСК имеет ретроспективное диагностическое значение, но ее выполнение необходимо для точной верификации диагноза лихорадки Ку.
В научно-исследовательской работе выделение чистых культур риккетсий осуществляется с помощью тех же методов, что и при выделении вирусов, с той лишь разницей, что при риккетсиозах есть свои дополнительные методы, например, получение штаммов риккетсий на вшах (выделение возбудителя сыпного тифа). Идентификацию выделенных штаммов риккетсий проводят морфологическим методом и в эксперименте на животных. Экспериментальной моделью воспроизведения риккетсиозной инфекции служат морские свинки - самцы.
При внутрибрюшном заражении развивается скротальный феномен (опухоль и отек яичек), откуда можно получить материал, содержащий риккетсий. При заражении морских свинок R. prowazeki, R. moosen, D Siberians, D. murinus инфекция протекает доброкачественно. Смертельный исход у морских свинок наблюдается при заражении R tsutsugamushi, R.burnetti; при других возбудителях погибают и белые мыши.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

