Для выделения гонококков используют
Обновлено: 23.04.2024
Медицинская микробиология:
Микробиологическая диагностика гонококка (N. gonorrhoeae)
Независимо от органа для взятия материала на бактериологическое исследование используют специальные тампоны промышленного производства или самостоятельно приготовленные из ваты, импрегнированные 1% взвесью активированного угля.
Гной из уретры берут через 3 ч после мочеиспускания путем надавливания на головку полового члена (у мужчин), используя бактериологическую петлю или тампон, либо ложечку Фолькмана (у женщин). Окружающие ткани перед этим протирают сухим марлевым тампоном. Из шеечного канала, глаза, ротоглотки, материал берут тампоном. Для взятия пробы из прямой кишки тампон вводят в анус на глубину 3 см и в течение 10 с круговыми движениями снимают содержимое слизистой оболочки. В случае загрязнения тампона фекалиями используют новый тампон. Для взятия соскоба со слизистой оболочки прямой кишки используют ложечку Фолькмана.
При наличии гноя или экссудата в материале из уретры, шейки матки, глаза гной предварительно микроскопируют. В этом случае материал берут дважды и для мазков используют первую порцию. Каплю гноя из уретры сразу после взятия наносят на предметное стекло и растирают другим стеклом или бактериологической петлей. Так же готовят мазки из отделяемого шеечного канала и глаза, используя тампон, которым брался материал. Из каждого образца готовят по два мазка. Высушенные на воздухе мазки фиксируют спиртом, окрашивают 1%-ным водным раствором метиленового синего и по Граму, после чего микроскопируют с иммерсией. В мазках из гноя гонококки расположены внутри и вне фагоцитов в виде кучек, пар и отдельных кокков.
В случае выявления типичных грамотрицательных виутриклеточно расположенных диплококков выдается ответ об обнаружении микроорганизмов, морфологически сходных с гонококком.
Независимо от результатов бактериоскопического исследования, обязательным является бактериологическое исследование — посев и изучение культуры гонококка. Для посева материала из уретры, шейки матки и глаза материал берут повторно, новыми тампонами. Материал из ротоглотки, прямой кишки, влагалища не микроскопируют, а сразу подвергают культуральному исследованию.
Питательные среды для посевов материала, содержащего гонококк, должны соответствовать его высоким требованиям к условиям культивирования. Приготовленные для посевов среды должны быть свежими (сделаны не ранее, чем за 24-48 ч до использования). Перед посевом их необходимо прогреть в термостате. Среды с посевами могут находиться при комнатной температуре в течение минимального срока, термостат должен быть четко отрегулирован на 36-37 °С.
При бактериологическом исследовании на гонококк следует помнить, что он обитает в открытых полостях человеческого тела, заселенных нормальной флорой. Среди ее представителей могут быть родственные гонококку нейссерии — комменсалы слизистых оболочек урогенитального тракта и даже менингококк. Что касается содержимого ротоглотки, то там обязательно имеются нейссерии, а в 5-10% случаев встречается менингококк. Учитывая морфологическое сходство многих видов нейссерий друг с другом, желательно доводить исследование до этапов выделения и изучения чистой культуры, а при экстрагенитальной гонорее -- обязательно.
Первый день. Взятый для посевов материал немедленно высевают на питательную среду. При невозможности сделать посев непосредственно после взятия материала тампоны погружают в пробирку с полужидкой транспортной средой, содержащей 0,1% тиогликолевой кислоты (среды Стюарта, Эймиса;). Погруженные в среду тампоны могут сохраняться в холодильнике, но должны быть доставлены в лабораторию не позднее, чем через 6 ч после взятия материала. От губительного действия холода гонококк защищен коллоидной средой; при этом подавляется размножение посторонней флоры.
В лаборатории материал засевают в 2 пробирки со скошенным агаром специального состава для гонококка. Засеянные среды помещают в термостат, желательно в контейнере, содержащем 5-7% CO2.
Второй день. Через 24 ч инкубации изучают появившийся бактериальный рост. Если роста подозрительных колоний нет, посевы сохраняют в термостате еще двое-трое суток. На скошенном агаре вырастает смешанная культура содержащая микрофлору слизистой оболочки уретры (или других открытых полостей) и, возможно, гонококк. На участок скопления колоний, подозрительных на гонококковые, наносят каплю реактива на оксидазу (1%-ный раствор парадиметилфенилендиамина) или ставят тест с коммерческой индикаторной бумажкой. Если происходит изменение цвета индикатора, сходные колонии захватывают петлей для приготовления препарата-мазка, окрашенного по Граму. Окраску по Граму лучше производить в модификации Калины, так как при этом грамотрицательные бактерии более четко дифференцируются. Метод особенно пригоден при окраске культур, а не мазков гноя. Обнаружение в смешанной культуре грамотрицательных оксидазоположительных кокков позволяет с большой долей вероятности констатировать присутствие гонококка. На этом этапе, при остром уретрите и цервиците, может быть выдан окончательный ответ об обнаружении микроорганизма, сходного с гонококком, или об отсутствии такового.
В сомнительных случаях, а также при экстрагенитальной гонорее, хронической гонорее и гонорее у детей обязательно выделение подозрительной на гонококк нейссерии в чистой культуре и ее идентификация. Для этого смешанную культуру рассевают в чашке Петри с агаровой средой, пригодной для выделения и культивирования гонококка. Посевы инкубируют в присутствии 5-7% СO2.
Третий день. Если на второй день исследования был сделан рассев смешанной культуры с целью выделения гонококка в чистой культуре, то исследование продолжается. Просматривают рассев в чашке Петри, отбирают подозрительные на гонококк колонии и несколько из них отсевают в пробирки со скошенной агаровой средой для гонококка.
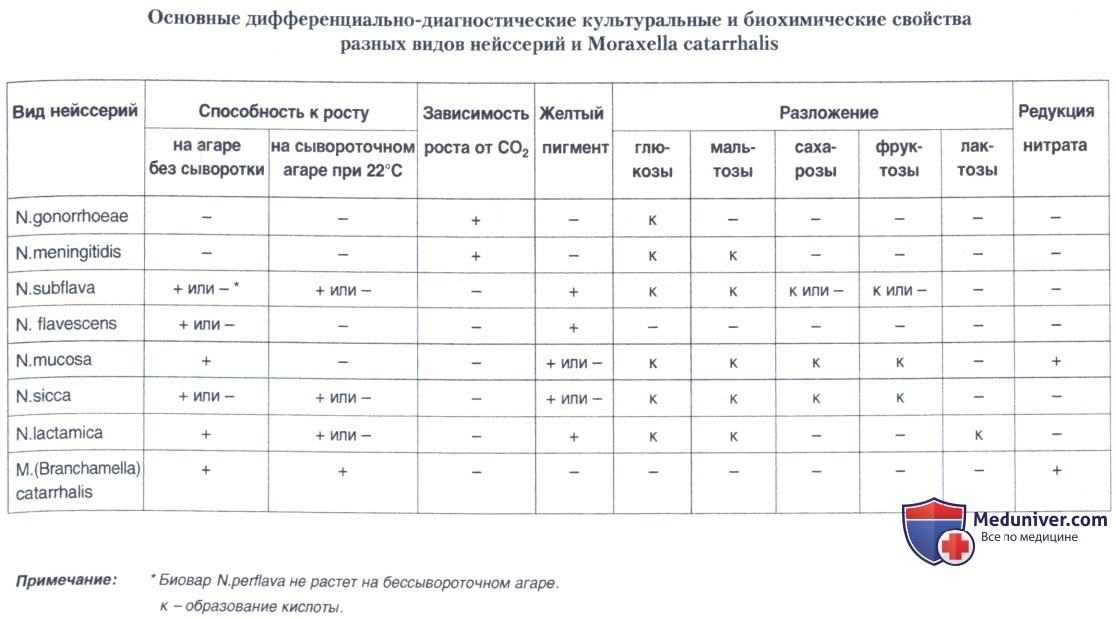
Пятый день. Учитывают результаты посева изучаемой культуры на средах с углеводами. Гонококк, в отличие от беспигментных нейссерий и сходной с ними Moraxella catarrhalis, разлагает только глюкозу с образованием кислот без газа.
Выделенная чистая культура, содержащая грамотрицательные, морфологически сходные с нейссериями кокки, не образующая пигмента, имеющая характерные признаки колоний, обладающая оксидазой, разлагающая только глюкозу без газа, может быть идентифицирована как гонококк.
Таким образом, описанный процесс выделения и идентификации гонококка занимает 5 сут. и более, так как на некоторых этапах не всегда удается получить хорошо выраженный рост через 24 ч; посевы держат в термостате по 2-3 сут.
Для выделения чистой культуры гонококка можно делать прямой посев материала непосредственно после взятия или с транспортной среды в чашки Петри с плотной селективной средой, минуя этап получения и изучения смешанной культуры. Для этого к специальной агаровой среде добавляют антибиотики, подавляющие сопутствующую флору (кроме нейссерий). Селективные среды с антибиотиками можно приготовить на любой питательной основе, пригодной для гонококка, — собственного приготовления или сухой коммерческой с последующими биодобавками, а также с антибиотиками. Отечественные авторы рекомендуют добавлять линкомицин — 2 мкг/мл (для подавления грамположительных кокков) и полимиксин М — 20 ЕД/мл (для подавления кишечной флоры), а при исследовании материала из ротоглотки — еще и 1% оротовой кислоты.
ВОЗ рекомендует в качестве образца селективной среды для выделения гонококка среду Тэйер-Мартина, содержащую в качестве ингибиторов роста грамиоложительных кокков и энтеробактерий соответственно ванкомицин и колистин, а для подавления роста грибов — нистатин. При посеве ректального материала для подавления роста протея к среде добавляют еще и триметоприм (5 мкг/мл). По рекомендации ВОЗ, любой материал при подозрении на гонорею засевается прямо в чашки Петри с селективной агаровой средой с обязательным выделением чистой культуры во всех случаях.
Для определения чувствительности к антибиотикам чистую культуру гонококка выделяют во всех случаях.
Хранение культур гонококка. Наиболее надежным способом сохранения гонококковой культуры является лиофильное высушивание. Допустимо хранение культур на полужидких средах с тиогликолевой кислотой для транспортировки и сохранения материала.
а) Определение чувствительности гонококка к антибактериальным препаратам. Чувствительность гонококка к антибактериальным препаратам рекомендуется определять в специализированных лабораториях в целях получения стандартных результатов.
Чувствительность гонококка определяют только на агаровых средах методом дисков или серийных разведений. Для получения стандартных и сравнимых результатов в качестве основы используют сухую коммерческую среду GG-агар (Difco). Вместо нестандартных биодобавок к расплавленному и остуженному до 50°С агару стерильно добавляют 1% (по объему) специального раствора, содержащего аминокислоты, глюкозу, витамины группы В и другие стимуляторы роста.
Среду разливают по чашкам Петри и испытывают чувствительность культуры общепринятым методом, используя для контроля референтный штамм гонококка (АТСС 4926). При применении метода дисков следует помнить, что диаметры зон задержки роста чувствительных штаммов гонококка для разных антибиотиков неодинаковы. Например, для бензилпенициллина зона подавления роста равна минимум 26-34 см, а для цефтриаксона — 39-51 см. Сходные различия в величинах МПК отмечены и при определении чувствительности методом серийных разведений. Поэтому при учете результатов необходимо пользоваться специальными таблицами с указанием зон ингибиции роста для всех современных препаратов.
б) Методы экспресс-диагностики. Перспективно применение ПЦР. Однако она дает ложноположительные результаты в течение первых 20 дней после излечения от гонореи.
Методы серологической диагностики не оправдали себя, что связано с высокой частотой изменчивости антигенов гонококка.
в) Лечение и профилактика. Для лечения гонореи используют антибиотики — цефалоспорины III поколения, фторхинолоны, спектиномицин.
Для профилактики бленнореи всем новорожденным вносят на конъюнктиву обоих глаз 1% раствор азотнокислого серебра (AgNO3). Вышеописанная антигенная пластичность гонококка и его сложные взаимоотношения с иммунной системой человека не позволяют надеяться на разработку полноценной вакцины против гонореи в ближайшие годы. Следовательно, воздействие на эпидемический процесс путем создания невосприимчивости населения к этой инфекции пока невозможно. Повлиять на механизм передачи (прямой половой контакт) органы здравоохранения также не в силах. Остается единственный реальный путь борьбы с распространением гонореи — воздействие на источники инфекции. Определенных успехов в снижении заболеваемости можно достичь путем максимально полного выявления больных (в том числе латентными формами) и обследования их половых партнеров с последующим лечением эффективными препаратами. Эта проблема может быть решена средствами современной микробиологической диагностики.
Классический метод выявления урогенитальных микоплазм – культуральный метод, позволяющий не только обнаружить возбудителя, но и оценить их количественное содержание в исследуемом материале [9,31,37]. Для культивирования используют жидкие, полужидкие (0,3 % агар) и плотные (1,3 % агар) питательные среды. В лабораторной диагностике применяют, как правило, первый и третий варианты. Питательную основу сред составляют пептоны и перевары (например, ферментативный перевар из бычьих сердец). Кроме высококачественной белковой основы, среды для микоплазм должны содержать ряд добавок, играющих роль факторов роста. Для всех видов микоплазм и уреаплазм необходимы стеролы (холестерин и его производные) и жирные кислоты. Микоплазмы нуждаются также в фосфолипидах, гликолипидах и фосфогликолипидах. В жидкие питательные среды для выявления M. Hominis добавляют аргинин, для выявления Ureaplasma spp. – мочевину [5,33]. Эти субстраты при внутриклеточной ферментации приводят к образованию аммиака, что защелачивает питательную среду и визуально фиксируется по изменению цвета pH-индикатора. В плотные питательные среды в качестве дифференцирующего субстрата для визуального обнаружения микоплазм включают сульфат марганца. Рост на этих средах сопровождается образованием оксида марганца, окрашивающего колонии Ureaplasma spp. в коричневый цвет, в то время как колонии M. Hominis остаются бесцветными. Количественную оценку концентрации возбудителей осуществляют путем раститровки биологического материала в жидких или плотных питательных средах [26,62].

Набор дисков для определения чувствительности к противомикробным препаратам - 1 (НД-ПМП-1)

Набор реагентов "Диагностикум эритроцитарный коревой антигенный сухой для реакции пассивной гемагглютинации (РПГА)"




Набор реагентов для определения чувствительности Trichomonas vaginalis к антипротозойным препаратам (СВТ-АЧ)


Набор реагентов для одновременного выявления Ureaplasma urealyticum и Mycoplasma hominis (УРЕА/МИКО-СКРИН-2)

Набор реагентов для одновременного выявления и определения антибиотикочув-
ствительности Ureaplasma urealyticum и Mycoplasma hominis (УРЕА/МИКО-СКРИН-АЧ)
Лабораторная диагностика гонореи проводится при помощи бактериоскопического и бактериологического анализа, реже используется серологический и иммуноферментный метод.
Гонорея – инфекционное заболевание, возбудителем которого является гонококк. Впервые гонококки были описаны немецким дерматовенерологом Альбертом Нейссером. Отсюда возбудители гонореи получили название Neisseria gonorrhoeae.
Морфология
Гонококки являются диплококками бобовидной формы и внешне напоминают кофейные зерна. Гонококки - грамотрицательные бактерии, при окрашивании по методу Грама они приобретают красный цвет. Под воздействием внешней среды (химических препаратов, лекарств) гонококки могут менять размеры и форму, становиться грамположительными. Способность гонококков менять свойства часто осложняет диагностику гонореи.

Культуральные свойства
Гонококки хорошо размножаются в жидких питательных средах и на плотных средах с рH от 7,2 до7,4 единиц, содержащих нативный человеческий белок (асцитную жидкость, кровь, сыворотку крови). Культивирование гонококков происходит при температуре 37 градусов Цельсия в атмосфере, содержащей 3 – 5 % углекислого газа. При дальнейшем культивировании потребность в углекислом газе отпадает.
Устойчивость во внешней среде
Во внешней среде гонококки малоустойчивы. На них пагубно влияет повышение и понижение температуры, высыхание, прямые солнечные лучи. Бактерии погибают при самых малых концентрациях дезинфицирующих средств. Но во влажной среде, например, в гное, на грязном белье они могут сохранять свою жизнеспособность до 24 часов.
Эпидемиология
Гонорея – антропогенное заболевание, передаётся только от человека к человеку. Гонорея не переносится животными. Инфекция распространяется при половых контактах, очень редко бытовыми способами, например, через грязное белье. Заболеванию подвержены люди, часто меняющие половых партнёров (девиантные, асоциальные слои населения). Заражение начинается с момента полового контакта с носителем инфекции, инкубационный период длится от одного дня до одного месяца, обычно около недели. У 70 % женщин и 10 % мужчин заболевание проходит бессимптомно.
Диагностика гонореи
Своевременная диагностика венерического заболевания позволяет остановить распространение инфекции по организму и безотлагательно начать лечение. В России порядок проведения диагностики гонореи регламентирован приказом Министерства здравоохранения РФ от 20.08.2003 № 415 и заключается в обязательном осуществлении бактериоскопического исследования с последующим бактериологическим подтверждением, которые помогают быстро определить наличие инфекции.
Бактериоскопический анализ
Бактериоскопический анализ применяют с целью изучения морфологических свойств возбудителя. Из клинического материала (например, отделяемого поражённой слизистой оболочки уретры или цервикального канала) готовят мазок, который фиксируют на стекле и окрашивают анилиновыми красителями по методу Грама.
Отдел новых технологий ФБУН НИИ эпидемиологии и микробиологии имени Пастера для проведения бактериоскопического исследования выпускает наборы реагентов для окраски по Граму в трёх разных вариантах.
- В состав комплекта № 1 входит фуксин Циля, окрашивающий гонококки в розовый цвет.
- В комплекте № 2 фуксин Циля заменен на водный раствор нейтрального красного, в результате чего грамотрицательные бактерии приобретают ярко-оранжевый цвет и хорошо видны на контрасте с фиолетовой окраской грамположительных бактерий.
- Наибольшую контрастность получают при применении комплекта № 3, в котором используются в качестве красителей бриллиантовый зеленый и сафранин. Грамположительные микроорганизмы приобретают зеленый цвет, а грамотрицательные – красный.

Бактериоскопический метод имеет следующие недостатки:
- необходима высокая концентрация бактерий в исследуемом материале, не менее 10 9 КОЕ/мл, в противном случае гонококки могут быть не выявлены;
- при ошибках в технике окрашивания бактерии могут повести себя нетипичным образом и окраситься в другие цвета;
- гонококки полиморфны – они могут менять размеры и окраску под воздействием различных препаратов.
Бактериологический анализ
Для эффективной диагностики гонореи бактериоскопический анализ дополняют бактериологическим анализом, при котором исследуемый материал высевают на питательные среды для получения чистых культур возбудителя.
Отдел новых технологий ФБУН НИИ эпидемиологии и микробиологии имени Пастера выпускает набор реагентов для выделения гонококков культуральным методом - набор "СВГ". В состав набора входит основа питательной среды и лиофильно высушенная селективная и ростовая добавка. Добавка содержит необходимые для роста гонококков белки, свойственные организму человека, углеводы, аминокислоты, витамины и прочие соединения.
Селективный компонент в виде комплекса антибиотиков подавляет рост посторонней микрофлоры. Благодаря селективному компоненту на питательной среде, выпускаемой Отделом новых технологий, образуются только колонии гонококков, которые очень легко визуально обнаружить.
Бактериологическое исследование завершают проведением бактериоскопии мазков, приготовленных из выросших колоний. Также для контроля морфологии возбудителя проводят тесты для обнаружения цитохромоксидазы (оксидазный тест) и бета-лактомазы – ферментов, продуцируемых гоноккоками.
Отдел новых технологий ФБУН НИИ эпидемиологии и микробиологии имени Пастера выпускает два набора реагентов, которые обнаруживают цитохромоксидазу по методу Эрлиха и по методу Ковача. Из этих реагентов готовят рабочие растворы. Растворами обрабатывают выросшие колонии. При взаимодействии реактива Эрлиха и цитохромоксидазы колонии гонококков окрашиваются в синий цвет, при использовании реактива Ковача – в красный.
Также мы предлагаем наборы реагентов для экспресс-определения бета-лактамазы, продуцируемой гонококками. Обнаружение в исследуемом материале бета-лактамазы свидетельствует о резистентности выделенных гонококков к пенициллинам, к цефалоспоринам.
Преимущества препаратов для диагностики гонореи, выпускаемых Отделом новых технологий ФБУН НИИ эпидемиологии и микробиологии имени Пастера:
Медицинская микробиология:
Среды для выделения, культивирования и идентификации гонококка
Гонококк относится к трудно культивируемым бактериям. Для его выращивания требуются питательные основы, богатые аминокислотами и ростовыми факторами, также обязательно добавление крови, нормальной сыворотки или куриного желтка. Культивирование происходит при высокой влажности (что достигается использованием свежеприготовленных сред) и повышенной концентрации CO2 (5-10%) в атмосфере. В качестве питательной основы сред для гонококка рекомендован МПА, приготовленный на мясной воде с использованием мяса кролика или бычьих сердец, pH 7,3±0,1.
Возможно применение сухих коммерческих питательных основ (например, GC-агар, агар Мюллера-Хинтона и др.) с добавлением 20% нормальной сыворотки или 5% свежей крови.
а) Приготовление ватных тампонов для взятия материала на гонококк. Ватные тампоны на деревянных палочках или стержнях из нержавеющей стали (диаметром около 2,0 мм), вмонтированные в ватные пробки, окунают в фосфатный буфер (pH 7,4), кипятят в нем в течение 20 мин, после чего импрегнируют в течение 24 ч 1%-ной водной суспензией тонко измельченного активированного угля. После этого тампоны высушивают, вставляют в бактериологические пробирки диаметром, равным диаметру пробирок с транспортной средой, и стерилизуют в автоклаве при 121°С 20 мин.
б) Среда для хранения и транспортировки гонококка (среда Стюарта). Готовят две смеси.
Смесь №1:
Агар — 3,0 г
Вода дистиллированная — 1000,0 мл
Смесь нагревают до полного растворения агара.
Смесь №2:
Кислота тиогликолевая — 2,0 мл
Натрия гидроксид NaOH 1М раствор — 12,0 мл
Натрия фосфата однозамещенного (NaH2PO4*2H2O)
20%-ный раствор — 100,0 мл
Хлористого кальция (CaCl2) 1%-ный раствор — 20,0 мл
Вода дистиллированная — 900,0 мл
К смеси №1 добавляют смесь №2, доводят pH до 7,3-7,4. Полужидкую агаровую среду разливают в стерильные пробирки по 10,0 мл и стерилизуют текучим паром в течение 60 мин.
Готовую среду сохраняют в холодильнике не более суток. Применяют для транспортировки патологического материала, взятого непосредственно, на ватном тампоне, импрегнированном углем, погруженном в среду. При доставке в лабораторию тампоном производят посев на плотные среды.
в) Среда для транспортировки проб материала, исследуемого на гонококк или менингококковое носительство (среда Эймиса [Amies]). Среда содержит тиогликолят (натриевую соль меркаптоацетиловой кислоты) в качестве редуцирующего агента. При применении среды Эймиса используют обыкновенные ватные или дакроновые тампоны, не импрегнированные углем.
Состав:
Натрия хлорид (NaCl) — 3,0
Калия хлорид (KCl) — 0,2
Фосфат натрия двузамещенный (безводный) (Na2HPO/i) — 1,15 или Na2HPO4*12H2O — 2,9
Фосфат калия однозамещенный (KH2PO4) — 0,2
Натрия тиогликолят — 1,0
Кальция хлорид (CaCl2), 1%-ный раствор — 10,0 мл
Магния хлорид (MgCl2*6H2O), 1% -ный раствор — 10,0 мл
Уголь фармацевтический нейтральный — 10,0
Агар — 4,0
Вода дистиллированная — 1000,0 мл
Вначале растворяют агар в воде при подогревании. Затем в горячий раствор последовательно вносят все перечисленные ингредиенты, кроме угля. После тщательного перемешивания и полного растворения добавляют уголь. Среду быстро разливают по 6,0 мл и автоклавируют при 112°С 20 мин. После автоклавирования, прежде чем дать среде застыть, пробирки несколько раз опрокидывают для равномерного распределения угля, после чего, в случае надобности, заменяют пробки. Среду хранят в холодильнике.
г) Основа питательных сред лабораторного приготовления для выделения и культивирования гонококка (среда ЦКВИ). Питательной основой является мясопептонный агар (МПА), приготовляемый следующим образом. Готовят мясную воду: фарш из мяса кролика или бычьих сердец заливают водой (1 часть фарша и 2 части водопроводной воды) и оставляют на одни сутки при +4°С. Затем смесь кипятят 10 мин, охлаждают и фильтруют через марлю. К фильтрату добавляют 1% сухого коммерческого пептона, 0,5% натрия хлорида (NaCl) и 2% агара. pH смеси 7,4-7,6. Далее среду доводят до кипения (при помешивании), фильтруют через ватно-марлевый фильтр и мерно разливают в стерильные флаконы. Стерилизуют при 112°С 20 мин. Основу хранят в холодильнике.
д) Варианты готовых питательных сред для выделения и культивирования гонококка. Перед использованием, независимо от выбранного варианта, питательную основу расплавляют, остужают до 50-45°С и вносят в нее 20% нормальной сыворотки лошади или крупного рогатого скота, а также следующие биодобавки (на 100,0 мл питательной основы):
Вариант 1. Гидролизат казеина для парентерального белкового питания — 2,0;
Стерильный аутолизат дрожжей (или 1,5%-ный раствор ЭКД) — 2,0 мл
Вариант 2. 5%-ный раствор Гемогидролизата — 2,0 мл
Стерильный аутолизат дрожжей (или 1,5%-ный раствор ЭКД) — 2,0 мл
Вариант 3. Среда 199 для культур тканей (без антибиотиков) — 2,0 мл
Стерильный аутолизат дрожжей (или 1,5%-ный раствор ЭКД) — 2,0 мл
Вариант 4. Желток куриного яйца — 10,0 мл
Основу хорошо перемешивают с биодобавками, разливают в чашки Петри или в пробирки (скашивают!). Хранят в холодильнике не более 4-5 дней.
е) Селективная среда Тейера-Мартина для выделения гонококка из патологического материала, рекомендованная ВОЗ. В качестве основы используют сухую коммерческую среду GC-arap, или агар Мюллера-Хинтона, или питательную основу ЦКВИ, или любую пригодную для гонококка агаровую питательную основу.
К готовой питательной основе, расплавленной и охлажденной до 50-45°С, стерильно добавляют 20% нормальной лошадиной сыворотки или плазмы либо 5% дефибринированной крови. В качестве ингибиторов посторонней флоры в среду вносят растворы антибиотиков — ванкомицина (в конечном содержании 3 мкг/мл), колистина (10,0 мкг/мл) и нистатина (12,5 мкг/мл). Иногда смесь трех антибиотиков выпускается фирмами в виде отдельной добавки VCN (см. ниже).
Среду разливают в чашки Петри для посева нативного материала или смешанной культуры, содержащей гонококк.
ж) Селективная среда для выделения гонококка при экстрагенитальной гонорее. Селективная среда применяется для первичного посева материала с целью выделения чистой культуры гонококка при экстрагенитальной гонорее (миндалин, глотки, прямой кишки). К одному из вариантов МПА, обогащенного для гонококка, добавляют антибиотики (полимиксина М сульфата — 20 ЕД/мл и линкомицина гидрохлорида — 2,0 мкг/мл). Готовую селективную среду разливают в чашки Петри. Среды с антибиотиками используют обязательно одновременно со средой без антибиотиков (одним из обогащенных вариантов МПА).
з) Среда Тейера-Мартина для выращивания N. gonorrhoeae из клинического материала (сухая), HiMedia, Thayer Martin Medium Base. Основу среды Тейера-Мартина с добавками используют для выделения N. gonorrhoeae из клинического материала.
Состав, г/л:
Пептон специальный — 23,0
Крахмал — 1,01
Натрия хлорид — 5,0
Агар — 1,0
pH 7,2±0,2
1. Сухую основную среду в количестве 21,0 г суспензируют в 250,0 мл дистиллированной воды. Среду кипятят до полного растворения.
2. Одновременно с основной средой готовят раствор гемоглобина. Haemoglobin Powder, Soluble (HiMedia, ED 022) представляет собой специально приготовленный порошок гемоглобина, сохраняющего активность после стерилизации. Для этого в 5,0 г порошка гемоглобина при постоянном помешивании медленно вливают 250,0 мл дистиллированной воды для получения однородной массы 2%-ного раствора гемоглобина.
Основу среды и раствор гемоглобина стерилизуют раздельно при 121°С в течение 15 мин. Затем оба компонента охлаждают до 45-50°С и соединяют, соблюдая правила асептики.
Состав, мг:
1. Состав FD 025 на флакон (на 500,0 мл среды)
Витамин В12 — 0,1
L-глутамин — 100,0
Аденин SO4 — 10,0
Гуанин HCl — 0,3
Р-аминобензойная кислота — 0,13
L-цистин — 11,0
НАД (кофермент) — 2,5
Кокарбоксилаза — 1,0
Железа нитрат — 0,2
Тиамин HCl — 0,03
Цистеин HCl — 259,0
Декстроза — 1,0
2. Жидкость для регидратации (на 500,0 мл среды):
Декстроза — 1,0
Вода дистиллированная — 10,0
Растворяют содержимое части 1 в 10,0 мл жидкости для регидратации, стерилизуют при 121°С в течение 15 мин. После стерилизации раствор остужают до 50°С и добавляют к среде Тейера- Мартина.
Для выделения N. gonorrhoeae из урогенитального тракта, где, кроме него, присутствует обычно множество других бактерий и грибов, в среду для придания ей селективности вносят добавку VCN, состоящую из комплекса антибиотиков "VCN Supplement" (HiMedia).
Состав добавки VCN (на 500,0 мл среды):
Ванкомицин — 1,5 мг
Колистин метан сульфонат — 3,75 мг
Нистатин — 6250 ЕД
Комплекс перечисленных антибиотиков регидрируют в 10,0 мл дистиллированной воды и вливают в растопленную и охлажденную до 45-50°С среду при тщательном перемешивании, чтобы внесенные в нее антибиотики распределились равномерно. Дальнейшее повышение селективности среды может быть достигнуто внесением в нее триметоприма в дозе 2,5 мг на 500,0 мл среды.
и) Среды с углеводами для дифференциации гонококка и других нейссерий. Используется желточный МПА (вариант 4, но без сыворотки), содержащий 1% одного из углеводов (глюкоза, мальтоза, сахароза, фруктоза, лактоза) и индикатор феноловый красный, в чашках Петри. Разложение углевода до кислот сопровождается пожелтением среды вокруг роста культуры.
Приготовление среды. К 100,0 мл расплавленного питательного агара для гонококка, охлажденного до 45-50°С, добавляют смесь, состоящую из 15,0 мл желтка, раствора 1,5 г одного из углеводов в 2,0 мл дистиллированной воды (этот раствор простерилизован в кипящей водяной бане 15 мин) и 6,0 мл 0,2%-ного водного раствора водорастворимого фенолового красного.
Приготовление раствора индикатора. 2,0 г водорастворимого фенолового красного разводят в 1000,0 мл дистиллированной воды, доводят pH до 7,8 (при помощи 20%-ного раствора гидроксида натрия — NaOH). Раствор стерилизуют в автоклаве при 121 °С в течение 20 мин.
После перемешивания среды разливают в 5 чашек Петри (по числу углеводов). Засеянные испытуемыми культурами среды инкубируют при 37°С в эксикаторе с влажной ватой, но без свечи, в течение 1-2 сут.
При небольшом количестве испытуемых культур используют тот же желточный агар без сыворотки в одной чашке Петри. Чашку делят на 5 секторов (по числу углеводов). На каждый сектор пипеткой наносят по 1 капле стерильного 80%-ного раствора одного из углеводов в 0,2% растворе фенолового красного. Смесь углевода и индикатора предварительно стерилизуют в кипящей водяной бане 15 мин. После диффузии растворов углеводов в агар сектора засевают штрихами испытуемой культуры.
Посевы на средах с углеводами инкубируют без CO2!
к) Среда для определения чувствительности гонококка к антибиотикам. К расплавленному и охлажденному до 50°С питательному агару для гонококка (GC-агар) добавляют 1% (по объему) комплексной питательной добавки (взамен нестандартных биодобавок).
Состав комплексной питательной биодобавки (КПД):
Глюкоза — 100,0 г
L-цистеин-гидрохлорид* — 25,0 г
L-глютамин — 10,0 г
L-цистин — 1,1 г
Никотинамид-адениндинуклеотид (НАД) — 0,25 г
Витамин В12 — 0,1 г
Тиамина пирофосфат — 0,1 г
Гуанина гидрохлорид — 0,03 г
Железа нитрат [Fe(NO3)3*6H2O] — 0,02 г
Парааминобензойная кислота — 0,013 г
Тиамина гидрохлорид — 3,0 г
Дистиллированная вода — 1000,0 мл
* При определении чувствительности к карбапенемам и клавулоновой кислоте цистеин-гидрохлорид не применять!
Готовую питательную среду после добавления 1% раствора КПД, как и самое КПД, нельзя автоклавировать.
При разливе в чашки Петри, после застывания агара, чашки оставляют при комнатной температуре на 10-12 ч. Чашки с готовой средой можно хранить в герметичных пластиковых пакетах при +4°С не более 2 нед.
Некоторые штаммы гонококка плохо растут на среде без гемоглобина. В таких случаях их необходимо 2-3 раза пассировать на данной среде перед определением чувствительности.
Гонорея. Возбудитель гонореи. Гонококк. Эпидемиология гонореи. Источник гонореи. Морфология гонококков. Тинкториальные свойства гонококков.
Гонококк. Эпидемиология гонореи. Источник гонореи.
Источник гонореи — больной человек. Основной путь заражения гонореей — половой, возможно инфицирование плода при прохождении через родовые пути матери. Врождённая невосприимчивость отсутствует. После перенесённого заболевания невосприимчивость к вторичным заражениям не вырабатывается; возможны супер- и ре инфекции.
Животные резистентны к гонококкам, лишь внутрибрюшинное введение микробов вызывает гибель мелких лабораторных животных.
Морфология и тинкториальные свойства гонореи
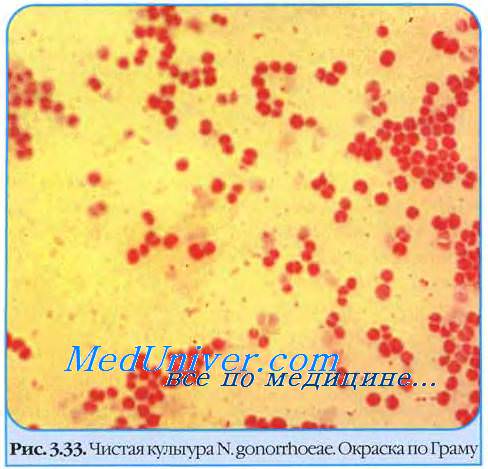
В свежих культурах гонококки представляют неподвижные диплококки размером 1,25-1,0x0,7-0,8 мкм, образующие капсулу .
Характерен полиморфизм гонококков — в мазках встречают относительно мелкие или крупные клетки, а также палочковидные формы. Хорошо окрашиваются анилиновыми красителями (метиленовым синим, бриллиантовым зелёным и др.). Образуют L-формы, в том числе под действием пенициллина. Под влиянием химиопрепаратов быстро меняют свойства и образуют грамположительные формы. Гонококки имеют сложно организованную клеточную стенку; наличие тех или иных её компонентов обусловливает их внутривидовую дифференцировку. По наличию пилей гонококки разделяются на пять типов (Т1-Т5).
Гонококки типов Т1 и Т2 снабжены пилями (Р+ и Р++), окружены капсулой и вирулентны, бактерии прочих типов авирулентны. Белок 1 составляет до 60% вещества клеточной мембраны и его идентификация составляет основу серотипирова-ния гонококков и распознавания бактерий методом ИФА. Белок II определяет специфические клинические проявления заболевания. Бактерии содержащие белки 1 и II обычно выделяют при поражениях мочевыводящих путей, а штаммы, содержащие белок I, но лишённые белка И — при диссеминированных поражениях.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

