Экг при инфекционных заболеваниях
Обновлено: 23.04.2024
Признаки миокардита на ЭКГ
• Миокардит обычно развивается на фоне инфекции. Важное клиническое значение имеет миокардит, осложняющий течение гриппа и коксакивирусной инфекции.
• Изменения на ЭКГ не отличаются единообразием. Часто имеет место легкое или выраженное нарушение возбудимости миокарда (отрицательный зубец Т с депрессией сегмента ST или без нее в отведениях I, II, III, а также в зависимости от тяжести клинической картины в отведениях V2-V6).
• ЭКГ-картину дополняют также признаки блокады правой или левой ножки ПГ, изменение длительности интервала PQ и нарушение ритма сердца.
Миокардит (воспаление сердечной мышцы) - редкое заболевание, которое наблюдается в основном у молодых людей. Нередко миокардит развивается на фоне инфекции. Наиболее известными клиническими формами заболевания являются гриппозный и ревматический миокардит.
Но миокардит может также осложнить течение коксакивирусной инфекции, мононуклео-за, сальмонеллеза и СПИДа (III стадия ВИЧ-инфекции).
Различные клинические формы миокардита характеризуются сходством симптомов. Больные обычно жалуются на сердцебиение, одышку, боль в области сердца, снижение толерантности к физической нагрузке, а также перебои в работе сердце.
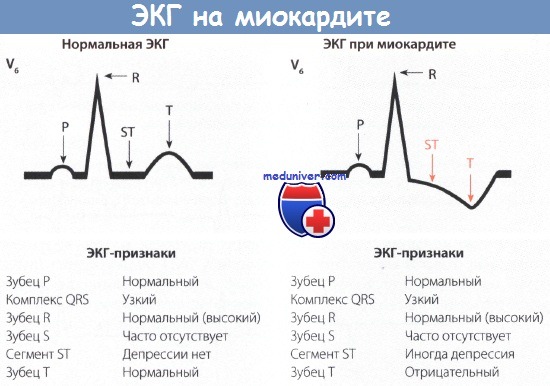
Электрокардиографическая картина при миокардите не отличается единообразием. На ЭКГ обычно отмечаются различные признаки нарушения возбудимости и проводимости.
При ревматическом миокардите наблюдается удлинение интервала PQ или часто его изменчивость от цикла к циклу. При тяжелом поражении миокарда появляется блокада правой или левой ножки ПГ. Наблюдаются также нарушение внутрипредсердной проводимости и удлинение интервала QT.
Часто наблюдаются более или менее выраженные нарушения возбудимости в виде отрицательного зубца Т в сочетании с депрессией сегмента ST или без нее. Эти нарушения проявляются в основном в I и II или II и III отведениях и, кроме того, также преимущественно в отведениях V5 и V6. Но в тяжелых случаях эти нарушения регистрируются в отведениях V2-V6.
Миокардит сопровождается различными нарушениями ритма сердца. Так, у больных миокардитом описаны синусовая тахикардия, наджелудочковая тахикардия, предсердная экстрасистолия, желудочковая экстрасистолия, ритм АВ-соединения, АВ-диссоциация, мерцание предсердий.
Проявлением миокардита, перикардита и гипотиреоза является также снижение вольтажа ЭКГ (амплитуда комплекса QRS в отведениях от конечностей
Проявления миокардита на ЭКГ:
• Отрицательный зубец Тс депрессией сегмента ST
• Удлинение интервала PQ
• Блокада правой или ЛНПГ
• Разнообразие изменений на ЭКГ
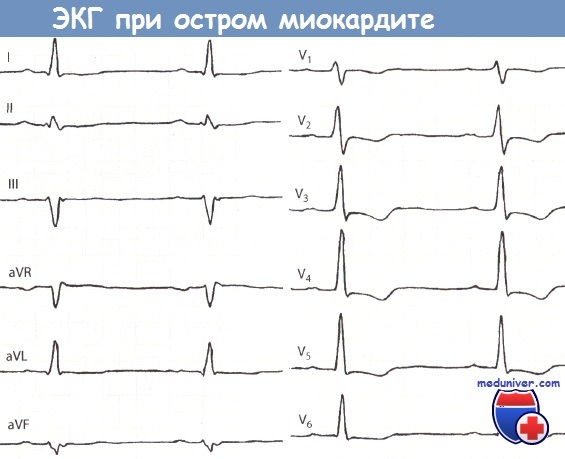
Острый миокардит.
Больной 20 лет. Незначительная депрессия сегмента ST и неглубокий отрицательный зубец Т в отведениях I, aVL.
Незначительная депрессия сегмента ST, но относительно глубокий зубецТ в отведениях V2-V5.
Учебное видео ЭКГ при миокардите, перикардите и ТЭЛА
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Оценены особенности поражений миокарда, развивающихся во время или после эпизодов острых инфекционных заболеваний у подростков. Установлено, что у подростков 15–19 лет с жалобами на утомляемость, боли в области сердца, одышку, сердцебиения, головокружения
The features of myocardial lesions developing in time or after the episodes of acute infectious diseases in teenagers were estimated. Teenagers at the age of 15–19 years old, with complaints of fatigability, heartache, shortness of breath, palpitations, dizziness on the background and after acute respiratory or acute intestinal infection showed changes corresponding to the diagnosis of probable myocarditis. Relief of symptoms of heart lesions takes place in most of patients during 1–3 months.
В настоящее время многочисленные исследования указывают на важную роль различных инфекционных агентов в развитии поражений миокарда. В качестве этиологического фактора, помимо хорошо изученного бета-гемолитического стрептококка, нередко выступают вирусы из группы герпеса, энтеровирусы, атипичные возбудители — микоплазмы, хламидии и ряд других. Изменения в тканях сердца и сосудов, развивающиеся при персистенции возбудителей, остаются одной из малоизученных проблем. Неспецифичность симптоматики, зачастую неопределенность жалоб вместе со сложностью подтверждения инфекционно-воспалительного процесса в сердечно-сосудистой системе приводят к запоздалой диагностике и несвоевременному назначению терапии. Позднее начало лечения негативно влияет на результаты, способствует формированию необратимых нарушений, значительно ухудшает прогноз.
Поражения сердца, формирующиеся в подростковом возрасте, имеют свои особенности. В этом возрасте практически отсутствует влияние атеросклероза, рассматривающегося на сегодняшний день как основной фактор развития и прогрессирования сердечно-сосудистой патологии. В результате этого нередко отмечается недооценка жалоб подростков лечащими врачами, недостаточное внимание к выявляемым при клиническом осмотре и по результатам дополнительных обследований отклонениям. В отсутствие ограничений физической активности и специальной терапии нарушения становятся хроническими, ограничивают трудоспособность, качество и нередко продолжительность жизни.
Эти данные указывают на необходимость подробного анализа клинических, лабораторных, электрокардиографических и ультразвуковых отклонений у пациентов, предъявляющих жалобы, которые могут быть связаны с формированием патологии сердца на фоне или после эпизода острого инфекционного заболевания.
Целью данной работы было оценить особенности поражений миокарда, развивающихся во время или после эпизодов острых инфекционных заболеваний, у подростков.
Материалы и методы исследования
Под наблюдением в основной группе находилось 27 подростков в возрасте от 15 до 19 лет, которые на фоне или после перенесенного эпизода острой респираторной (ОРИ, 17 подростков) или острой кишечной инфекции (ОКИ, 10 подростков) предъявляли жалобы, указывающие на возможное поражение сердца. Пациентов беспокоила утомляемость (27 пациентов — 100%), колющие или ноющие боли в области сердца (16 пациентов — 59%), одышка при привычных бытовых физических нагрузках (4 пациента — 15%) или только при ходьбе в быстром темпе и подъеме по лестнице (13 пациентов — 48%), учащенное сердцебиение (12 пациентов — 44%), головокружения (7 пациентов — 26%). Среди них было девушек — 13, юношей — 14. Этиология ОРИ и ОКИ была подтверждена у 12 подростков (44%). Были выявлены парагрипп (у 4 больных — 15%), аденовирусная инфекция (у 2 больных — 7%), респираторно-синцитиальная инфекция (у 2 больных — 7%), грипп (у 1 больного — 4%), ротавирусная инфекция (у 2 больных — 7%), сальмонеллез (Salmonella enteritidis — у 1 больного — 4%).
Для уточнения значимости выявляемых лабораторных, электрокардиографических и ультразвуковых изменений была сформирована группа сравнения, в которую включили 25 подростков с симптомами ОРИ или ОКИ на момент осмотра или в течение предшествующих 3 недель до него. Пациентов с ранее выявленной патологией сердечно-сосудистой системы и хроническими заболеваниями, закономерно сопровождающимися нарушениями функции сердца и сосудов, в группы наблюдения не включали.
Комплекс обследований для всех пациентов состоял из клинического анализа крови, биохимического анализа крови с определением уровней МВ-креатинкиназы (МВ-КК), аспарагиновой трансаминазы (АСТ), α-гидроксибутиратдегидрогеназы (α-ГБДГ), тропонина I количественно, антимиокардиальных антител; электрокардиографии (ЭКГ) в 12 стандартных отведениях, суточного мониторирования ЭКГ, эхокардиографии (ЭХО-КГ).
Анализ активности ферментов проводился с помощью оптимизированного ультрафиолетового теста и набора реагентов Diasys Diagnostic Systems GmbH & Co (Германия). Количественное определение тропонина I проводили иммуноферментным способом, используя набор реагентов DRG International Inc. (США). Комплекс органоспецифичных антифибриллярных, антисарколемных и антицитоплазматических антимиокардиальных антител определяли иммунофлюоресцентным полуколичественным методом с помощью набора Immco diagnostics (Нидерланды).
ЭХО-КГ-исследование выполняли с помощью ультразвукового сканера ACCUVIX XQ (производства MEDISON, Корея) в одномерном (М), двухмерном (D) и импульсно-волновом режимах согласно общепринятым на сегодняшний день рекомендациям [8, 9]. Измеряли конечно-диастолический (КДР) и конечно-систолический (КСР) размеры левого желудочка (ЛЖ), толщину задней стенки левого желудочка (ЗСЛЖ) и межжелудочковой перегородки (МЖП), размеры правого желудочка и предсердий; состояние створок клапанов и характер их движения. Визуально определяли состояние листков перикарда, измеряли сепарацию. С помощью программного обеспечения вычисляли конечно-систолический (КСО) и конечно-диастолический (КДО) объемы левого желудочка, ударный и минутный объемы, фракцию выброса (ФВ) ЛЖ. Диастолическую функцию определяли путем измерения максимальных скоростей трансмитрального и транстрикуспидального потоков в начале (пик Е) и в конце (пик А) диастолы, времени изоволюмического расслабления, времени замедления раннего диастолического наполнения в импульсно-волновом режиме. Полученные результаты сопоставляли с нормативными показателями для соответствующей возрастной группы с учетом площади поверхности тела.
Повторные осмотры, лабораторные, электрокардиографическое, эхокардиографическое исследования, суточное мониторирование ЭКГ проводили на 7–10, 30–40 сутки, затем — в конце каждого месяца наблюдения до купирования всех клинических симптомов, лабораторных и инструментальных отклонений.
Статистическая обработка результатов производилась на персональном компьютере с помощью программы Statistica, версия 6.1. Достоверность различий определяли с помощью Z-критерия и критерия χ 2 , достоверными считали значения при р < 0,05.
Результаты исследования
Как представлено в табл. 1, у подростков, имевших жалобы на утомляемость, боли в области сердца, сердцебиения, одышку, головокружения, при физикальном обследовании чаще выявляли систолический шум, приглушенность или глухость тонов сердца, тахи- или брадикардию, не соответствующую температуре тела и фазе инфекционного процесса, артериальную гипо- или гипертензию, гепатомегалию.
Анализ результатов электрокардиографического обследования пациентов показал, что характерными изменениями для основной группы были различные нарушения реполяризации с изменениями зубца Т, депрессией сегмента ST и снижение вольтажа зубца R. Как представлено в табл. 3, чаще всего отмечали сглаженность зубца Т в двух-трех отведениях.
При суточном мониторировании ЭКГ-отклонений выявляли значительно больше, чем при стандартной электрокардиографии, что показано в табл. 4. Помимо изменений зубца Т, в основной группе подростков достоверно чаще регистрировали эпизоды депрессии сегмента ST, суправентрикулярную изолированную, а также полиморфную и парную вентрикулярную экстрасистолию. В единичных случаях были зафиксированы и другие клинически значимые нарушения ритма и проводимости, не регистрировавшиеся на стандартной ЭКГ: парные суправентрикулярные экстрасистолы, пробежки суправентрикулярной и вентрикулярной тахикардии, паузы ритма, которых не отмечали в группе сравнения. На фоне жалоб у подростков чаще регистрировали нарушения вариабельности ритма: снижение функции концентрации, повышение функции разброса, повышение степени различия интервалов, что типично для вегетативной дисфункции и нарушений ритма.
По данным ЭХО-КГ (табл. 5), наиболее характерным изменением в основной группе была диастолическая дисфункция одного или обоих желудочков. Помимо этого, у подростков, предъявляющих жалобы, достоверно чаще отмечали гипертрофию ЗСЛЖ и/или МЖП, дилатацию одной из камер сердца, снижение ФВ ЛЖ, патологическую регургитацию на одном или более клапанах. У многих пациентов, как в одной, так и в другой группе, регистрировали пролапсы клапанов, достоверно чаще на фоне жалоб при суммировании пролапсов одного и более клапанов (р = 0,02; двусторонний Z-критерий).
Сочетание одновременно жалоб, клинических симптомов, лабораторных, электрокардиографических и эхокардиографических отклонений было обнаружено у 23 подростков (85%) из основной группы наблюдения. Прочих изменений, не отмеченных в таблицах, у пациентов не регистрировали.
К концу месяца купирование всех нарушений наблюдали у 10 подростков (37%), у 17 была зафиксирована положительная динамика как по лабораторным, так и по инструментальным данным. Однако из них у троих пациентов были впервые обнаружены антимиокардиальные антитела.
При дальнейшем наблюдении этих 5 пациентов выявленные нарушения сохранялись длительно, в течение 3 лет, с незначительной динамикой. Жалобы были меньше выражены, однако оставалась утомляемость (у 5 пациентов), эпизоды сердцебиений (у 3 пациентов). На ЭКГ отмечались нарушения реполяризации со сглаженностью зубца Т (у 5 пациентов), снижение вольтажа зубца R (у 3 пациентов), неполная блокада правой ножки пучка Гиса (у 3 пациентов). По данным суточного мониторирования ЭКГ, оставались суправентрикулярная (у 2 пациентов) и вентрикулярная полиморфная (у 2 пациентов) экстрасистолия, эпизоды сглаженности и инверсии зубца Т (у 3 пациентов), нарушения вариабельности ритма (у 5 пациентов). По результатам эхокардиографии у этих подростков оставалась диастолическая дисфункция правого или левого желудочка (в 2 случаях), пролапсы одного (у 3 пациентов) или двух (у 1 пациента) клапанов, с наличием патологической регургитации в последнем случае. Другие отклонения были купированы.
Выявленные изменения у подростков, перенесших или переносящих ОРИ или ОКИ: жалобы и данные клинического обследования, одновременно с повышением кардиоспецифичных показателей в крови, изменениями на ЭКГ, по ЭХО-КГ и при суточном мониторировании ЭКГ, учитывая современные данные проведенных исследований и имеющиеся рекомендации [1–3, 5, 6, 10, 11], следует трактовать как вероятный миокардит. Сочетание этих нарушений было выявлено у 23 из 27 пациентов, предъявлявших жалобы, указывающие на возможную патологию сердечно-сосудистой системы. Артериальная гипертензия, не характерная для поражений миокарда, наиболее вероятно связана с нейровегетативными нарушениями, хотя нельзя исключить и поражения сосудистой стенки на фоне инфекционного процесса. У 4 больных, имевших нормальные лабораторные показатели, не было выявлено нарушений реполяризации и снижения вольтажа зубцов R на ЭКГ, нарушений систолической и диастолической функции по данным ЭХО-КГ, клинически значимой аритмии при суточном мониторировании, патология миокарда маловероятна. Жалобы могут быть обусловлены соматоформной дисфункцией вегетативной нервной системы, закономерно сопровождающей острые инфекционные заболевания, что подтверждается частым обнаружением нарушений вариабельности ритма у обследованных больных. Вероятно, симптоматика миокардита развивается у пациентов на фоне симпатико-адреналового дисбаланса, что усугубляет все проявления. Повышение функции разброса со снижением функции концентрации ритма, выявляемое при суточном мониторировании, может указывать также и на вовлечение в инфекционно-воспалительный процесс источника ритма и проводящей системы сердца.
Выявленные у 11 пациентов антимиокардиальные антитела подтверждают миокардит. Другие лабораторные показатели: повышение уровней МВ-КК, α-ГБДГ, тропонина I — свидетельствуют о повреждении клеток миокарда [12], но не специфичны для какой-либо определенной патологии. Возраст пациентов, появление симптомов в непосредственной связи с ОРИ или ОКИ, отсутствие признаков врожденного или приобретенного порока сердца, по данным ЭХО-КГ, указывают на инфекционную этиологию изменений. Уровень АСТ может быть повышен при различной патологии не только сердца, но и печени, поджелудочной железы, скелетных мышц, эритроцитов, почек [12]. Все другие обнаруженные изменения, безусловно, подтверждают кардиальную природу выявленной гиперферментемии.
Отдельного внимания заслуживает частое обнаружение пролапсов клапанов в обеих группах подростков с преобладанием их среди пациентов, предъявлявших жалобы и имевших сочетание клинических, лабораторных, электрокардиографических и ультразвуковых отклонений. Исходя из этого вероятно влияние выявленных инфекционных агентов не только на кардиомиоциты, но и на соединительнотканные структуры.
Очевидно, что представленные изменения могут наблюдаться и в других возрастных группах пациентов. Однако с возрастом выше влияние атеросклеротических и гипертонических изменений, что затрудняет дифференциальную диагностику. Ожидаемо, что инфекционные поражения сердца будут суммироваться с имеющимися фоновыми проявлениями и в результате давать выраженную картину сочетанной патологии.
Выводы
Литература
Т. А. Руженцова 1 , доктор медицинских наук
А. В. Горелов, доктор медицинских наук, профессор, член-корреспондент РАН
Р. В. Попова
Ю. Н. Хлыповка
ФБУН ЦНИИЭ Роспотребнадзора, Москва
Поражения миокарда на фоне острых инфекционных заболеваний у подростков/ Т. А. Руженцова, А. В. Горелов, Р. В. Попова, Ю. Н. Хлыповка.
Для цитирования: Лечащий врач №11/2017; Номера страниц в выпуске: 46-50
Теги: стрептококк, вирусы, миокард, патология
Инфекционный эндокардит (ИЭ) относится к числу тяжелых заболеваний с высоким уровнем летальности. В отсутствии лечения смертность при ИЭ составляет 100%. В последние годы отмечается значительный рост числа больных эндокардитом в нашей стране и за рубеж
Инфекционный эндокардит (ИЭ) относится к числу тяжелых заболеваний с высоким уровнем летальности. В отсутствии лечения смертность при ИЭ составляет 100%. В последние годы отмечается значительный рост числа больных эндокардитом в нашей стране и за рубежом. По данным различных авторов, сегодня выросла заболеваемость в пожилом и старческом возрасте, а также среди лиц в возрасте до 30 лет, использующих внутривенное введение наркотиков [1, 2].
Известно, что ИЭ представляет собой заболевание инфекционной природы с первичной локализацией возбудителя на клапанах сердца, пристеночном эндокарде, протекающее с проявлениями системной инфекции, сосудистыми осложнениями и иммунной реакцией [3, 4, 5].
В данной работе обобщен опыт диагностики и ведения больных ИЭ на базе общетерапевтического отделения Александровской больницы Санкт-Петербурга за период 1998–2003 гг. Диагностика заболевания осуществлялась в соответствии с критериями Duke [8]. Диагноз ИЭ оценивался как достоверный при наличии двух главных критериев, а именно:
- при выделении типичного для ИЭ возбудителя при посевах крови больного;
- при определении эхокардиографических признаков поражения эндокарда - подвижные вегетации на клапанах сердца, абсцессов в области протеза клапана; образования внутрисердечных фистул и др., в сочетании с тремя или/и пятью вспомогательными критериями, к которым относились сосудистые осложнения (эмболии крупных артерий, септические инфаркты легких, внутричерепные кровоизлияния и др.), иммунологические феномены (гломерулонефрит, узелки Ослера, геморрагический васкулит и др.), а также фебрильная лихорадка, гепато-спленомегалия и другие проявления системной инфекции.
Нами было проведено обследование 105 больных ИЭ, из них у 80 человек в возрасте от 18 до 30 лет (первая группа) основным фактором риска заболевания являлась инъекционная наркомания.
Во второй группе больных (25 чел.) основными предрасполагающими факторами развития ИЭ были врожденные и приобретенные пороки сердца, а также протезированные клапаны.
У лиц старшей возрастной группы дополнительным фактором риска являлись дегенеративно-дистрофические изменения клапанов сердца.
Взаимосвязь характера поражения клапанов сердца и факторов риска ИЭ представлена в таблице 1.
По данным эхокардиографического исследования, у 100% больных первой группы были выявлены подвижные вегетации на створках трикуспидального клапана (ТК), что сопровождалось формированием его недостаточности I—III степени.
Во второй группе больных ИЭ отмечалось поражение левых камер сердца с образованием вегетаций на створках аортального и митрального клапанов. Изолированное поражение митрального клапана наблюдалось у двух человек с ревматическим пороком сердца (митральный стеноз), у одной больной с врожденным дефектом межжелудочковой перегородки и в единственном случае обструктивной формы гипертрофической кардиомиопатии.
Среди лиц пожилого и старческого возраста у девяти человек (36%) определялось изолированное поражение аортального клапана в отсутствии признаков аортального стеноза. Наряду с этим, у пяти больных (20%) в возрасте от 72 до 87 лет ИЭ развился на фоне аортального порока атеросклеротического генеза, причем у всех пятерых было выявлено сочетанное поражение аортального и митрального клапанов. Дегенеративно-дистрофические изменения других клапанов сердца определялись у 100% больных старшей возрастной группы.
Образование вегетаций на створках аортального клапана наблюдалось у двух больных с третичной формой сифилиса на фоне имеющегося аортального порока, связанного со специфическим процессом в аорте.
В двух случаях мы наблюдали развитие эндокардита протезированных клапанов.
При сопоставлении результатов посевов крови в двух группах больных определялись существенные различия как в частоте выделения микробной флоры, так и в видовом составе возбудителей эндокардита. По нашим данным, возбудителем ИЭ у больных-наркоманов в 71,3% наблюдений (57 чел.) являлся золотистый стафилококк, тогда как во второй группе, наряду с кокковой флорой, чаще обнаруживались грамотрицательные микроорганизмы (28%). Отрицательные результаты посевов крови значительно реже наблюдались в первой, чем во второй, группе больных ИЭ: 18,7% и 56% — соответственно. Данные относительно этиологической структуры ИЭ в обследуемых группах больных представлены в таблице 2.
Клиническая характеристика и особенности течения ИЭ
Клиническое течение и характер осложнений инфекционного эндокардита во многом зависят от локализации клапанных вегетаций — в правых или левых камерах сердца, а также степени вирулентности возбудителя заболевания.
Течение ИЭ у больных-наркоманов отличалось особой тяжестью и полисиндромностью. Причиной госпитализации у большинства больных были острые осложнения основного заболевания. Значительная часть больных поступала в реанимационное отделение стационара с клиническими симптомами одно- или двухсторонней многофокусной пневмонии, причиной которой являлась септическая тромбоэмболия ветвей легочной артерии (72% больных). Течение пневмонии сопровождалось тяжелой дыхательной недостаточностью, нередко с развитием респираторного дистресс-синдрома (РДСВ) и очагами деструкции в легких (12%). Проявления вторичной нефропатии, которые обнаруживались у 100% больных в первой группе, иногда ошибочно трактовались как обострение хронического гломеруло- или пиелонефрита, мочекаменной болезни, что служило поводом для госпитализации этих больных в урологическое и нефрологическое отделения.
Во второй группе больных основной причиной госпитализации была длительная фебрильная лихорадка в сочетании с анемией и гепатолиенальным синдромом. Наряду с этим, у пяти человек (20%) поводом для госпитализации послужила прогрессирующая сердечная недостаточность.
Основные клинические синдромы, наблюдаемые у больных ИЭ первой и второй групп, представлены в таблице 3.
По нашим наблюдениям, характерной особенностью клинического течения ИЭ у больных-наркоманов являлась высокая частота септической ТЭЛА с формированием множественных очагов инфильтрации в легких. У многих больных легочные тромбоэмболии носили рецидивирующий характер (31,3% больных) и нередко осложнялись развитием деструктивных очагов в легких.
Образование вегетаций у 100% больных первой группы сопровождалось недостаточностью трехстворчатого клапана I—III степени с формированием потоков регургитации. Вместе с тем, у большинства пациентов не определялось тяжелых нарушений центральной гемодинамики, связанных с дисфункцией ТК. В данной группе больных характерной клинической особенностью был обратимый характер нарушений гемодинамики на фоне проводимой терапии. Острая сердечная недостаточность с дилятацией полостей сердца и снижением фракции выброса до 40% и ниже наблюдалась у 28 больных (35,3%) в связи с присоединением острого миокардита или на фоне сочетанного поражения клапанов сердца.
Вторичная нефропатия являлась одним из самых распространенных синдромов в первой группе больных ИЭ. Острая почечная недостаточность наблюдалась у 16 больных, причем у 10 из них она носила обратимый характер и была связана с острым ДВС-синдромом, а также с острой сердечной недостаточностью с отеками. Инфекционно-токсическая нефропатия регистрировалась в 73,8% наблюдений и сопровождалась мочевым синдромом — гематурией, протеинурией, лейкоцитурией — при достаточном уровне клубочковой фильтрации.
Характерной особенностью ИЭ во второй группе было подострое течение заболевания с длительным периодом лихорадки на догоспитальном этапе, причем в пожилом и старческом возрасте лихорадка носила субфебрильный характер с редкими подъемами температуры до фебрильных цифр.
Большинство больных подострым инфекционным эндокардитом (ПИЭ) поступали в стационар в стадии развернутой клинической картины заболевания с клиническими признаками тромбоэмболии сосудов большого круга кровообращения. В данной группе больных наиболее распространенными следует признать такие осложнения, как церебральные эмболии с развитием ишемических и геморрагических инсультов, эмболии почечных сосудов с болевым синдромом и гематурией, а также формирование острых очаговых изменений в миокарде, связанных с эмболией коронарных сосудов или прикрытием устьев коронарных артерий вегетациями [9].
Септические тромбоэмболии церебральных сосудов нередко сопровождались развитием гнойного менингоэнцефалита с летальным исходом. Вместе с тем, при посевах крови у 56% больных второй группы не получено роста микробной флоры. Обращает на себя внимание тот факт, что септицемия у больных с положительными результатами посевов крови в 28% наблюдений была обусловлена грамотрицательной микрофлорой. В этой категории больных источником бактериемии являлись очаги хронической инфекции в мочеполовой системе, а у двух больных (по данным аутопсии) был выявлен двухсторонний апостематозный нефрит.
У значительного числа больных ПИЭ (62%) определялись признаки острой недостаточности кровообращения с застойными хрипами в легких, легочной гипертензией, увеличением полостей сердца и периферическими отеками.
В этой группе больных чаще, чем в первой, наблюдалась преренальная азотемия и ОПН, связанные с развитием острой недостаточности кровообращения.
Острый диффузный миокардит, типичными проявлениями которого были различные нарушения ритма, диагностирован у 27% больных второй группы.
Анемия со снижением уровня гемоглобина до 80 г/л и менее выявлена у 100% больных второй группы. Значительное увеличение СОЭ (более 45 мм/ч) наблюдалось у 85,8% больных подострым ИЭ.
Кожные изменения в виде геморрагических высыпаний, пурпуры Шенлейн-Геноха, а также другие проявления иммунного воспаления в обеих группах больных встречались нечасто — 6,3 и 4% в первой и второй группах, соответственно.
Лечение больных ИЭ
Консервативная терапия больных ИЭ проводилось с использованием антибиотиков широкого спектра действия в сочетании со средствами дезинтоксикационной, антикоагулянтной и метаболической терапии. В составе антибактериальной терапии больные получали цефалоспорины III-IV поколений в комбинации с аминогликозидами и метронидазолом. Из группы цефалоспоринов назначались: цефтриаксон (лонгацеф) 2 г в сутки внутривенно (в/в), или цефотаксим (тальцеф) 2 г в сутки в/в, или цефепим (максипим) 2 г в сутки в/в в сочетании с аминогликозидами (амикацин в суточной дозе 1,5 г в/в) и метронидазолом по 1,5-2 г в сутки в/в. В случае, если такая терапия оказывалась неэффективной или существовали противопоказания к вышеперечисленным препаратам, применялись антибиотики группы линкозаминов: клиндамицин 1,2 г в сутки в/в или линкомицин 3 г в сутки в/в в сочетании со фторхинолонами (ципрофлоксацин 400 мг в сутки в/в). В условиях отделения реанимации в течение пяти–семи дней проводилась терапия имипинемом (тиенамом) в дозе 2—4 г в сутки в/в или рифампицином в суточной дозе 0,45—0,6 г в/в. Средняя продолжительность курса антибиотикотерапии в обследуемой группе больных составила 28 + 3,5 дней.
Дезинтоксикационная терапия включала в себя внутривенные инфузии реополиглюкина, гемодеза, поляризующих смесей в сочетании с петлевыми диуретиками. Объем вводимой жидкости составлял в среднем 2-2,5 л в сутки. В течение всего периода инфузионной терапии осуществлялся контроль за функциональным состоянием почек, электролитным составом крови, суточным диурезом. В условиях отделения реанимации у всех больных осуществлялся мониторинг ЦВД. Инфузионная терапия проводилась в течение всего острого периода заболевания до купирования проявлений интоксикационного синдрома. Средняя продолжительность курса составила 22 + 4,5 дня.
Развитие легочной эмболии, особенно в сочетании с признаками острого ДВС-синдрома в стадии гиперкоагуляции, служило основанием для назначения антикоагулянтной терапии. Начальная доза гепарина составляла 10 тыс. ЕД внутривенно, струйно, за-тем — по 1000 ЕД в час внутривенно, капельно с переходом на подкожное введение до 30 тыс. ЕД в сутки. Введение гепарина осуществлялось под контролем показателей коагулограммы и времени свертывания крови. Одновременно проводились внутривенные трансфузии свежезамороженной плазмы по 300 мл в сутки с добавлением 2500–5000 ЕД гепарина. Анемия тяжелой степени (Нb менее 80 г/л, Ht ≤25) корригировалась переливаниями эритроцитарной массы (пять–семь доз). При наличии гипопротеинемии использовалось введение растворов аминокислот, альбумина или нативной плазмы. Выявление клинических и рентгенологических признаков отека легких на фоне рецидивирующего течения септической ТЭЛА служило показанием для назначения кортикостероидов (преднизолон от 120 до 200 мг в сутки внутривенно капельно). Терапия антикоагулянтами прямого действия в сочетании с трансфузиями криоплазмы проводилась до стойкого улучшения показателей гемостаза. Критериями нормокоагуляции являлись уровень фибриногена в плазме 3-4 г/л, отсутствие тромбоцитопении, нормализация ВСК, АЧТВ, тромбинового времени, а также отрицательные паракоагуляционные тесты. По нашим данным, купирование проявлений острого ДВС-синдрома на стадии гиперкоагуляции у 75% больных отмечалось на седьмой–десятый день от начала комплексной терапии.
У части больных формировалась резистентность к проводимой антибактериальной терапии, которая характеризовалась нарастанием интоксикации, фебрильной лихорадкой, прогрессирующей анемией, а также высевами из крови возбудителя ИЭ – золотистого стафилококка — в 65% наблюдений. При рентгенологическом обследовании данной категории больных с большой частотой определялись очаги деструкции легочной ткани, а у трех больных гнойный выпот в плевральной полости.
Длительное применение антибиотиков широкого спектра действия у 70,3% больных (38 чел.) сопровождалось развитием побочных эффектов антибактериальной терапии. Кандидоз полости рта глотки, пищевода, а также кишечный дисбактериоз III-IV стадии был выявлен у 36 больных (66,7%). Применение антибиотиков с гепатотоксическими свойствами (цефалоспорины, линкозамины, метронидазол) у двух больных (3,7%) с хроническим гепатитом С и В приводило к прогрессированию печеночной недостаточности, которая сопровождалась высокой ферментемией (АЛТ 1500 ЕД, АСТ 1000 ЕД) и желтухой.
Развитие застойной сердечной недостаточности с появлением акроцианоза, влажных хрипов в базальных отделах легких, периферических отеков в сочетании с кардиомегалией и падением фракции выброса до 50—45% наблюдалось у пяти больных (9,3%) на фоне массивной инфузионной терапии.
Длительная антикоагулянтная терапия в 20,4% (11 чел.) наблюдений сопровождалась повышением толерантности плазмы к гепарину, что клинически выражалось в развитии периферических флеботромбозов, в то время как гепарининдуцированной тромбоцитопении в обследуемой группе больных мы не наблюдали.
Положительные результаты консервативной терапии были получены у 70,2% больных (56 чел.) с поражением ТК и лишь у 32% пациентов (6 чел.) из второй группы. Исходом ИЭ в обеих группах больных являлось формирование недостаточности клапанов сердца.
Госпитальная летальность при ИЭ у наркозависимых лиц составила 29,4% (24 чел.), тогда как у больных с поражением левых камер сердца (вторая группа) уровень смертности составил 68% (19 чел.).
По данным аутопсии, основными причинами смерти больных ИЭ были:
- септикопиемия с формированием гнойных очагов в печени, почках селезенке, головном мозге с развитием полиорганной недостаточности (46,2%);
- сердечная недостаточность на фоне полипозно-язвенного эндокардита с разрушением клапанов сердца, а также острый миокардит с дилятацией полостей сердца (39,4%);
- вторичная нефропатия с развитием почечной недостаточности, отеком легких, отеком головного мозга (14,4%).
Таким образом, характерные особенности ИЭ у лиц с наркотической зависимостью — это острое течение заболевания с поражением правых камер сердца и рецидивами септической ТЭЛА. Возбудителем ИЭ у инъекционных наркоманов в 71,3% является высоковирулентный золотистый стафилококк. Формирование недостаточности трехстворчатого клапана I—III степени стало самым распределенным осложнением ИЭ у наркоманов. При этом у большинства больных не наблюдается тяжелых нарушений центральной гемодинамики, приводящих к развитию острой недостаточности кровообращения.
Подострый ИЭ у больных с предрасполагающими заболеваниями сердца, а также у лиц пожилого и старческого возраста протекает с преимущественным поражением левых камер сердца, причем в старшей возрастной группе преобладает моноклапанное поражение. Наличие сопутствующей патологии у лиц старше 60 лет маскирует течение основного заболевания, чем и обусловлены поздняя диагностика и высокая смертность больных. Для затяжного течения ИЭ характерна низкая высеваемость возбудителя, по сравнению с острыми формами заболевания. Развитие тромбоэмболий сосудов большого круга кровообращения является характерной клинической особенностью подострого ИЭ.
Положительный эффект от проводимой консервативной терапии наблюдается у большинства больных ИЭ с поражением ТК, тогда как при подостром эндокардите левых камер сердца консервативная терапия является малоэффективной у большинства больных.
Госпитальная летальность в обеих группах больных обусловлена диссеминацией возбудителя с формированием гнойных очагов и полиорганной недостаточностью, а также развитием острой недостаточности кровообращения и вторичной нефропатии.
Литература
- Буткевич О. М., Виноградова Т. Л. Инфекционный эндокардит. - М., 1997.
- Симоненко В. Б., Колесников С. А. Инфекционный эндокардит: современное течение, диагностика, принципы лечения и профилактики. - Клин. мед., 1999. - 3. - С. 44-49.
- Тазина С. Я., Гуревич М. А. Современный инфекционный эндокардит. - Клин. мед.,1999. - 12. - С. 19-23.
- Bansal R. C. Infective endocarditis. Med Clin North America 1995; 79 (5): 1205-1239.
- Bayer A. S., Bolger A. F., Taubert K. A. et al. Diagnosis and management of infective endocarditis and its complications. Circulation 1998; 98: 2936-2948.
- McKinsey D. S., Ratts T. E., Bisno A. I. Underlying cardiac lesions in adults with infective endocarditis. The changing spectrum. Amer J Med 1987; 82: 681-688.
- Lamas C. C. Eykyn S. J. Suggested modifications to the Duke criteria for the clinical diagnosis of native valve and prosthetic valve endocarditis: analysis of 118 pathologically proven cases. Clin Infect Dis 1997; 25: 713-719.
- Durack D. T., Lukes A. S., Bright D. K. et al. New criteria for diagnosis of Infective Endocarditis Utilization of Specific Echocardiographic Finding. Amer J Med 1994; 96: 200-209.
- Тюрин В. П., Дубинина С. В. Инфекционный эндокардит у лиц пожилого и старческого возраста. - Клин. мед., 2000. - 4. - С. 53-56.
В. И. Уланова
В. И. Мазуров, доктор медицинских наук, профессор
Медицинская академия последипломного образования, Санкт-Петербург
Миокардит — это клинический синдром, для которого характерно множество возможных причин и проявлений. Полагают, что вирусная инфекция является самой частой причиной миокардита, но аналогичные изменения могут вызывать и другие инфекционные и неинфекционны
Миокардит — это клинический синдром, для которого характерно множество возможных причин и проявлений. Полагают, что вирусная инфекция является самой частой причиной миокардита, но аналогичные изменения могут вызывать и другие инфекционные и неинфекционные факторы, воздействие которых приводит к воспалительной инфильтрации между кардиомиоцитами.
Весьма разнообразны не только причинные факторы этого патологического состояния, но и его проявления. Диагноз ясен при наличии ярких и характерных признаков острой дисфункции сердца, возникшей в связи с вирусным заболеванием, но при стертой клинической картине диагностика миокардита представляет собой весьма сложную задачу.
Определение. Миокардит — это такое патологическое состояние, при котором в миокарде протекает активный воспалительный процесс с некрозом и дегенеративными изменениями кардиомиоцитов; патоморфологическая картина отличается от изменений, наблюдаемых при инфаркте. Наблюдается гибель клеток и фиброз. Воспалительная инфильтрация может быть представлена любым типом иммунных клеток, при этом гистологическая природа воспалительной реакции нередко указывает на этиологический фактор.
Заболеваемость. Трудно назвать точные цифры, касающиеся миокардита, т. к. это патологическое состояние весьма гетерогенно: в ряде случаев оно протекает скрыто и поэтому не попадает в поле зрения врачей; его хроническая форма может привести к дилатационной кардиомиопатии с манифестацией через много лет после начала заболевания.
Миокардит обнаруживается в 1—4% случаев рутинных аутопсий. В Европе и Северной Америке вирусные инфекции считаются самой частой причиной миокардитов. Кардиальная патология, по некоторым оценкам, развивается в 5% всех случаев вирусных заболеваний; при этом клинически выраженное поражение сердца, согласно крупным исследованиям, наблюдается в 0,5—5,0% случаев.
На заболеваемость оказывают влияние экстремальные факторы, среди которых возраст, а также беременность и время года. Частота миокардита высока у грудных младенцев, второй пик приходится на подростковый возраст.
Этиология. Воспалительная реакция в миокарде может возникать от ряда различных воздействий, повреждающих кардиомиоциты (см. табл.). Вирусные инфекции считаются наиболее частой причиной возникновения миокардита.
Механизмы повреждения кардиомиоцитов при вирусных инфекциях активно исследуются: в настоящее время полагают, что вирусы изменяют антигены, экспрессируемые кардиомиоцитами, поэтому, кроме непосредственной репликации возбудителя, на эти клетки оказывает повреждающее воздействие постоянно текущая клеточная иммунная реакция.
Если это так, то иммунная реакция у данного больного определяет клинические проявления инфекции.
Вирусы Коксаки А и В, энтеровирусы и вирусы гриппа — наиболее частые этиологические факторы миокардита. Приблизительно у 25—40% пациентов, инфицированных ВИЧ (вирусом иммунодефицита человека), наблюдаются признаки дисфункции сердца, которая в 10% случаев проявляется клинически.
В последнее время находит все большее признание тот факт, что патология сердца может развиваться и как отдаленное осложнение лучевой терапии, при этом повреждаются миокард, клапаны или артерии — иногда через много лет после облучения. Более совершенные методики лучевой терапии призваны защитить от таких осложнений.
Патоморфология. Непосредственное воздействие ионизирующего облучения, влияние токсина (например, при дифтерии) или реакции аутоиммунного типа (такой как при инфекции Mycoplasma pneumoniae) способны привести к повреждению кардиомиоцитов и вызвать сердечную недостаточность и нарушения ритма, при этом клиническая картина зависит от степени повреждения.
Воспаление придает миокарду бледный оттенок с редкими мелкими кровоизлияниями. При микроскопии выявляется нарушение структуры мышечных волокон из-за интерстициального отека и изолированных очагов некроза. Воспалительный инфильтрат обычно представлен лимфоцитами.
В зависимости от этиологического фактора могут обнаруживаться более специфические гистологические признаки — такие как неказеозная гранулема при саркоидозе (см. рис. 1). В дальнейшем часто происходит полное разрешение процесса без остаточного фиброза, но в некоторых случаях наблюдается фокальное заживление с интерстициальным фиброзом.
Клинические признаки. Клинические проявления очень разнообразны и зависят от степени дисфункции сердца и от природы этиологического фактора.
Вирусному миокардиту может предшествовать продромальная фаза с гриппоподобными симптомами, лихорадкой, болями в мышцах и суставах и высыпаниями. Между проявлением этих признаков и возникновением симптомов сердечной патологии может пройти от нескольких недель до нескольких лет. Вирус Коксаки представляется самым кардиотоксичным, особенно у детей.
Поражение миокарда впервые проявляется в виде утомляемости, одышки, болей в груди и сердцебиения, иногда в виде обмороков. Эти симптомы объясняются недостаточностью систолы и повреждением проводящей системы.
Боль в груди может быть связана с положением тела и с движениями, что говорит о возможности перикардита. В тяжелых случаях наблюдается острая недостаточность левого или правого желудочка и кардиогенный шок. Из-за нарушений сердечного ритма может возникнуть внезапная смерть.
При физикальном обследовании выявляются признаки сердечной недостаточности: тахикардия (в классических случаях она выражена больше, чем можно было бы объяснить лихорадкой), ритм галопа, а в более тяжелых случаях — отек легких или периферические отеки. Размеры сердца обычно нормальные, может выслушиваться шум митральной регургитации. Иногда развивается фибрилляция предсердий. В некоторых случаях можно услышать шум трения перикарда.
Диагностика. Не существует специфических клинических признаков, на основании которых можно было бы поставить данный диагноз. Сочетание острого инфекционного заболевания и симптомов патологии миокарда дает основание заподозрить миокардит.
О патологии миокарда можно судить на основании данных ЭКГ (см. рис. 2), рентгенографии органов грудной клетки, эхокардиографии и определения уровня кардиальных ферментов. Патологические признаки на ЭКГ наблюдаются часто в виде неспецифических изменений сегмента SТ и зубца Т.
При рентгенографии органов грудной клетки выявляются признаки отека легочной ткани, сердце может быть увеличено. При эхокардиографии нередко обнаруживается дисфункция левого желудочка, причем это изменение может носить регионарный, а не диффузный характер. Неспецифические показатели воспаления: лейкоцитоз, скорость оседания эритроцитов и С-реактивный белок — также помогают поставить диагноз.
Наличие острой вирусной инфекции подтверждается при анализе мазков из зева, кала, а также на основании серологических тестов (которые могут выявить четырехкратное увеличение титра антител). Иногда удается выделить возбудитель из жидкости, взятой из полости перикарда.
Среди более сложных методов исследования можно отметить сканирование с галлием-67, которое способно выявить активный воспалительный процесс.
Некоторые специализированные центры пропагандируют биопсию миокарда.
Лечение миокардита проводится с целью:
- поддержания насосной функции сердца и снижения риска прогрессирования сердечной недостаточности,
- борьбы с аритмией,
- выявления и ликвидации источников токсичности.
В идеале всех больных с подозрением на поражение миокарда следует помещать в стационар и следить, насколько эффективно проводимое лечение.
Общие поддерживающие мероприятия включают постельный режим и ограничение физической активности. Эксперименты на животных ясно показали, что физическая нагрузка во время острого миокардита вредна; в период выздоровления надо рекомендовать больным ограничение занятий спортом. Это важно, учитывая, что многие пациенты, страдающие данным заболеванием, молодые люди.
В острой фазе миокардита за состоянием больных необходимо тщательно наблюдать. При застойной сердечной недостаточности эффективно обычное лечение диуретиками и ингибиторами ангиотензин-превращающего фермента, а также антикоагулянтная терапия — когда имеются признаки эмболии периферических или легочных сосудов, тяжелая желудочковая недостаточность или фибрилляция предсердий.
В некоторых случаях наблюдается клиническая картина кардиогенного шока и низкого желудочкового выброса — при этом необходима адекватная интенсивная терапия.
Может возникать аритмия, требующая специфической терапии. Изредка появляется необходимость во временном или постоянном вживлении искусственных водителей ритма. Общепризнанно, что после миокардита повышается риск внезапной кардиальной смерти, особенно у молодых пациентов.
Специфическая терапия, направленная на причинный фактор, носит ограниченный характер. Поскольку в большинстве случаев миокардит развивается на фоне вирусных инфекций и в его основе лeжaт иммунологические реакции, то в некоторых исследованиях изучалась роль антивирусной и иммунодепрессивной терапии. Многие из этих исследований плохо контролировались, и их результаты оказались неубедительными. В настоящее время нет четких данных, на основании которых можно было бы рекомендовать иммуномоделирующую терапию.
Лучше всего не назначать нестероидные противовоспалительные препараты, так как, по данным некоторых экспериментов на животных, при их применении усиливается повреждение сердца.
Большинство пациентов полностью выздоравливают без признаков остаточной кардиальной дисфункции. Эхокардиография позволяет точно и неинвазивно оценивать функцию сердца, и, по крайней мере пока работа сердца не вернется к норме, все больные должны получать ингибиторы ангиотензин-превращающего фермента.
При остаточной дисфункции миокарда требуется непрерывное лечение и наблюдение специалиста, так как в небольшом проценте случаев заболевание рецидивирует. Часто причинный фактор не удается выяснить, но когда он известен, необходимо его адекватным образом устранить.
Раджеш К. Харбанда, член Королевской коллегии врачей, Британский фонд по исследованиям сердца
Хауэрд Свонтон, доктор медицины, член Королевской коллегии врачей Больница Мидлсекса
1. Методика снятия ЭКГ
2. ЭКГ в норме
а) Синусовый ритм на ЭКГ
3. ЭКГ при гипертрофии предсердий - зубец P в норме и при патологии
4. ЭКГ при гипертрофии желудочков сердца
5. ЭКГ при блокадах ножек пучков Гиса
а) Блокада правой ножки пучка Гиса (ПНПГ)
б) Блокада левой ножки пучка Гиса (ЛНПГ)
6. ЭКГ при ишемической болезни сердца (ИБС)
7. Холтеровский мониторинг ЭКГ
8. Перикардит на ЭКГ
9. Миокардит на ЭКГ
10. Хроническое легочное сердце на ЭКГ
11. ТЭЛА на ЭКГ
12. Синдром WPW на ЭКГ
13. Гипокалиемия на ЭКГ
14. Синдром QT на ЭКГ
15. Нарушения ритма сердца на ЭКГ
а) Экстрасистолы
б) Суправентрикулярные тахикардии (СВТ)
в) Желудочковые тахикардии
- Мономорфные желудочковые тахикардии (ЖТ)
- Полиморфные желудочковые тахикардии и фибрилляции желудочков
- Тахикардия с широкими желудочковыми комплексами
д) Атриовентрикулярная блокад (АВ-блокада)
е) Синдром слабости синусового узла (СССУ)
ж) Нарушения ритма сердца при инфаркте миокарда
16. Электрокардиостимулятор на ЭКГ
17. Видео уроки по ЭКГ

В разделе собраны ссылки на видео уроки по ЭКГ. Каждый видео урок можно скачать для последующего просмотра.
18. Книги по кардиологии и ЭКГ доступные для скачивания
В данном разделе представлены книги по кардиологии с электрокардиографией доступные для скачивания бесплатно.
II. Статьи для углубленного изучения ЭКГ на основе Советской литературы
- Архивные материалы рассылки "Изучаем ЭКГ вместе" для углубленного изучения
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

