Экспериментальная инфекция на мышах
Обновлено: 22.04.2024
Лимфоцитарный хориоменингит мышей
Лимфоцитарный хориоменингит мышей
[Lymphocytic choriomeningitis, Humphreys' disease of guinia-pigs (англ.); Pneumopatie des Cobayes (франц.)]
Сравнительно недавно род аренавирусов был выделен в отдельную таксономическую группу. Он объединяет 10 представителей на основании общности морфологии, структуры, биохимических, биологических свойств и АГ-взаимосвязей. В группу входят вирусы Такарибе, вирус боливийской геморрагической лихорадки и вирус ЛХМ. Другие члены этого рода — вирусы АГ-группы Такарибе (Хунин, Мачупо, Ласса, Парана, Пичинде, Латино, Пистильо и Тамиами). Таксономически ареновирусы близки вирусам лейкоза птиц и мышей. Все они иммунологически связаны друг с другом, и их прототипом является вирус ЛХМ. Четыре представителя рода определенное значение имеют в патологии человека. Недавно был открыт еще один вирус, относящийся к аренавирусам — Lassa-вирус — возбудитель геморрагической лихорадки, характеризующейся высокой летальностью и контагиозностью. Болезнь с 1969 г. регистрируют в странах Западной Африки. Вирусы Хунин и Мачупо из комплекса вирусов Такарибе являются возбудителями аргентинской и боливийской лихорадок. Аренавирусы способны длительно находиться в организме грызунов — естественных хозяев и обусловливать вирусоносительство, характеризующееся вирусемией и вирусурией, вертикальной передачей потомству, что поддерживает их циркуляцию в популяции грызунов.
Клинические признаки и патологоанатомичекие изменения. ЛХМ — антропозооноз. Главным хозяином и источником для людей являются мыши. Тесная связь между заболеванием мышей и случаями заболевания людей подтверждается результатами серологических исследований. Болезнь протекает разнообразно, но чаше в виде острого серозного менингита. У диких мышей вирус вызывает латентную инфекцию. Внешне здоровые белые мыши могут быть носителями вируса и служить источником заболевания. При заражении лабораторных мышей адаптированными штаммами вируса возникает сильная реакция и животные погибают. У морских свинок отмечают симптомы генерализованной, часто смертельной болезни, характеризующейся крупозной пневмонией и появлением экссудата в лимфатических пространствах.
У людей может развиваться асептический менингит, грипп, менингоэнцефалит и общее остролихорадочное заболевание с летальным исходом. Часто лимфоцитарный менингит протекает без клинических проявлений. Наиболее распространены менингиальная и гриппоподобная форма болезни.
При вскрытии трупов животных отмечают инфильтрацию мозговых оболочек, сосудистых сплетений и стенок сосудов лимфоидными клетками, плазмоцитами, макрофагами и другими клетками. Местами видны участки узелкового глиоза. Инфильтрация лимфоидными клетками встречается в почках, слюнных и поджелудочной железах. Часто наблюдают серозный перитонит и гепатит. Последний встречается у морских свинок и обезьян.
Морфология и химический состав. Вирионы покрыты одномембранной оболочкой, имеют отростки и содержат одну или несколько электронно-плотных гранул диаметром 20—30 нм, напоминающих рибосомы. Гранулы — наиболее характерная особенность аренавирусов. Вирусные частицы образуются отпочкованием, главным образом от плазматической мембраны. В местах отпочкования мембрана клетки-хозяина становится плотнее и покрывается выступами. Позже в цитоплазме возникают паракристаллические зоны, состоящие из фибрилл.
Аренавирусы отличаются от других РНК-содержащих, чувствительных к ли-пидным растворителям вирусов, по следующим признакам: не имеют спирального типа симметрии, характерной для миксовирусов; более плеоморфны и содержат гранулы, не характерные для вируса краснухи и некоторых арбовирусов и онкорнавирусов типа С. РНП, содержащийся в вирионах, является группоспе-цифичным АГ и выявляется методами ИФ и в РСК. Кроме того, при центрифугировании вируса от него отделяется растворимый gs-АГ; в цитоплазме инфицированных клеток образуется большое количество гранул размером 20 нм, которые представляют либо рибосомы клетки, либо внутренние части самих вирионов. В перевиваемой культуре клеток Vero вирус вызывает характерное ЦПД (однако некоторые штаммы ВЛХМ не обладают этим свойством); вирус продолжительное время персистирует в организме грызунов; вирулентность ВЛХМ для мышей зависит от целостности тимусзависимой лимфоидной системы. Вирионы округлые, овальные или плеоморфные, диаметр их 50—300 нм в тонких срезах и 85—89 нм при негативном окрашивании. Оболочка состоит из мембраны с упорядоченной поверхностной структурой и близко расположенными ворсинками. Внутренняя часть частиц кажется неструктурной и содержит различное число электронно-плотных гранул диаметром 20—30 нм. Градиент плотности равен 1,24—1,15 г/см3. В вирионах ВЛХМ обнаружено несколько видов однонитевых РНК, среди которых 23S и 31S РНК являются собственно вирусными. Кроме того, в вирионах обнаружены 28S, 18S, 4S, 5S и 5,5S РНК. Три последних, по-видимому, рибосомного происхождения. Репродукция вируса не подавляется ингибиторами ДНК. Мол. м. нитей РНК не установлена.
При 56 °С вирус инактивируется в течение 1 ч. Хорошо сохраняется в 50 %-ном глицерине, при -70 'Сивлиофилизированном состоянии. Чувствителен к эфиру. Мертиолят в разведении 1:10 000 значительно понижает титр вируса в суспензии. Возбудитель лабилен при рН ниже 7,0.
В сыворотке реконвалесцентов образуются КСА и ВНА. Первые можно обнаружить через 1—3 неделю после начала болезни, вторые — не ранее чем через 6—10 недель. ВНА присутствуют в крови людей-реконвалесцентов в течение 3-х лет, а титр КСА снижается уже через 3—6 месяцев после начала болезни. Антигенная вариабельность и родство изучены недостаточно. Все аренавирусы имеют общий группоспецифический АГ, выявляемый методом ИФ и в некоторых случаях в PC К. Все штаммы вируса в иммунологическом отношении родственны. Ге-магглютинирующие свойства не установлены. У людей в период приступа лихорадки вирус находится в крови, в спинномозговой жидкости, мозге и в секрете носоглотки. Его можно выделить из легких и из мозга людей, погибших от ЛХМ. В крови лиц, которые никогда не болели хориоменингитом, обнаружены ВНА. Вирус выделяли также из кала и мочи мышей. У латентно больных лиц отмечают длительное вирусоносительство. Оно было обнаружено и у клинически здоровых мышей, морских свинок, обезьян и собак.
Экспериментальная инфекция. Патогенность различных штаммов ВЛХМ для экспериментальных животных различна. Наиболее пригодны для изучения данного вируса морские свинки и белые мыши. Последние регулярно заболевают при введении вируса в мозг или в носовую полость в разведениях Ю--3— 1(И. Через 5—12 дней после заражения шерсть у них взъерошивается, появляется дрожь и клонические конвульсии, при которых животные могут погибнуть. Смерть наступает через 1—3 дня после появления симптомов болезни. При введении вируса в небольших дозах после переболе-вания у мышей развивается иммунитет. Большие дозы вируса при введении в брюшную полость могут вызвать смерть животного. С возрастом чувствительность мышей к экспериментальной инфекции повышается.
Чувствительность линий мышей к данному вирусу различна. Наиболее чувствительны мыши линий Сс 57 Br, CBA, AKR, более резистентны мыши линии BALB/c, ДВА/2. Морские свинки, как и мыши, наиболее чувствительны при интрацеребральном заражении. После подкожного и внутрибрюшного введения вируса смерть наступает через 9—16 дней. У инфицированных хомяков отмечали лишь продолжительную вирусемию. Удавалось заразить обезьян различных видов, крыс и собак. Кроликов инфицировать трудно, легче в период беременности — вирус вызывает у них аборт. При внутрикожном заражении у кроликов появляется специфическая местная кожная реакция. У мышей-вирусоносителей при интрацеребральном введении стерильного бульона может развиваться вирусный менингит.
Вирус можно обнаружить в мозге, крови, селезенке, легких и в моче мышей и морских свинок. Он тесно связан с эритроцитами этих животных. Активно реплицирующиеся вирусы, такие, как ЛХМ, вирус вакцины, незначительно повреждают растворимый CTLA4 (CTLA4 tg мышей), экспрессирующийся у трансгенных мышей. Вирусы с абортивным циклом размножения (вирус везикулярного стоматита) в значительной степени снижает экспрессию IgG у таких мышей.
Культивирование. Вирус поддерживается интрацеребральным заражением мышей-сосунов. Он размножается также на ХАО КЭ, но специфических поражений не вызывает. Аренавирусы (вирус ЛХМ, вирус Такарибе и шт. НУР комплексаТакарибе) хорошо размножаются в первично-трипсинизированных культурах клеток эмбриона человека, мыши, кур, хомяка и в перевиваемых линиях HeLa, НЕР-2, СПЭВ, L и Vero. В большинстве культур клеток ЦПИ Вирус не вызывает. Они наблюдаются только после адаптации вируса. В монослойной культуре клеток КЭ после 12-дневного культивирования удавалось получить бляшки.
Первичная инфекция культур клеток вирусом характеризуется образованием дефектного интерферирующего и полноценного исходного вируса. При последовательном пассировании вируса появление дефектных и полноценных вирионов чередуется; через 50—100 пассажей стандартный вирус перестает образовываться, и продуцируются дефектные частицы. Несмотря на иммунологическое родство между штаммами ВЛХМ, отдельные штаммы различаются по интенсивности репродукции в культуре клеток L. Например, шт. Трауб достигал наивысшего титра через 32 ч, а шт. WCP — через 40 ч после заражения. Наиболее стабильным в отношении роста в культуре клеток L оказался шт. СА 1371. К данному вирусу особенно чувствительна перевиваемая культура клеток Vero. В определенных культурах клеток вирус дает персистентную инфекцию.
Вирус размножается в цитоплазме. При репродукции вируса отмечают чередование инфицирования и рефрактерности клеток, которые освобождаются от вирусной инфекции, после чего процесс повторяется. Механизм этого явления связан с изменением лизосом инфицированных клеток.
Источники и пути передачи инфекции. Инфекция распространяется аэрогенно и в передаче ее участвуют членистоногие — комары, постельные клопы, вши, обитающие на обезьянах. Вирус выделен от инфицированных клещей, а также от их потомства. Хомяки являются гипотетическими переносчиками инфекции. Домовые мыши выделяют вирус с носовым секретом, семенной жидкостью, мочой и калом и таким путем, вероятно, заражают окружающую среду.
Иммунитет и специфическая профилактика. Иммунитет у мышей инфицированных линий, возможно, обусловлен стойко переносимой инфекцией сосунков или активным иммунитетом взрослых. Элиминация вируса из организма персистентно инфицированных животных (вирусоносителей) связана с Т-клетами. Морских свинок удалось иммунизировать вирусом, модифицированным путем последовательных интрацеребральных пассажей на мышах. Вакцинация новорожденных мышей вакциной ДНК против вируса ЛХМ вызывает клеточные и гуморальные иммунные ответы, сохраняющиеся в течение большей части жизни мышей. Впервые продемонстрировано ex vivo появление вирусоспецифических клеток СВ8+, индуцированных вакцинацией ДНК. По нескольким параметрам (продукция цитокинов, содержанию интерферона, развитию литической способности и защитной активности) они не отличались от клеток памяти СД8+, индуцированных живой вирусной вакциной. В гуморальном ответе после обычной вакцинации преобладает IgG2a, а после ДНК-вакцинации новорожденных и взрослых мышей уровень IgG2a и IgGl одинаков. Это показывает, что однократная ДНК вакцинация в течение нескольких часов или дней после рождения обеспечивает длительные ответы Т-клеток СД8+ и В-клеток, не. требующие повторной иммунизации. С уничтожением диких мышей опасность заболевания человека уменьшается.
Криптоспоридиоз у больных ВИЧ-инфекцией в Российской Федерации характеризуется отсутствием диареи, которая большинством авторов расценивается в качестве одного из основных клинических проявлений указанной нозологической единицы. В попытке объяснить эту особенность нами была изучена вирулентность криптоспоридий на экспериментальной модели мышей линии SCID (Arrowood M. J. et al. 2005) и по определению показателя активности эксцистирования ооцист методом прямой иммунофлюоресценции с помощью диагностического набора CryptoCel (Cellabs, Австралия). В ходе выполненного исследования было установлено, что оба изученные параметра никаким образом не сочетались с наличием или же с отсутствием диареи у больных ВИЧ-инфекцией. В представленной статье обсуждаются возможные варианты объяснения этих особенностей.

1. Карташев В.В., Амбалов Ю.М., Бекетова Е.В и др. Криптоспоридиоз у больных с ранними стадиями ВИЧ-инфекции в Ростове-на-Дону // Инфекционные болезни. – 2008. – № 2. – С. 50-52.
2. Arrowood M.J. In vitro cultivation of cryptosporidium species // Clin.Microbiol. Rev. – 2002. – Vol. 15(3). – Р. 390-400.
3. Bukhari Z., Smith H.V. Cryptosporidium parvum: oocyst excretion and viability patterns in experimentally infected lambs // Epidemiol. Infect. – 1997. – Vol.119(1). – Р. 105-108.
4. Cacciо S.M., Pozio E. Advances in the epidemiology, diagnosis and treatment of cryptosporidiosis // Expert Rev Anti Infect. Ther. – 2006. – Vol.4(3). – Р. 429-443.
6. Hikosaka K., Satoh M., Koyama Y., Nakai Y. Quantification of the infectivity of Cryptosporidium parvum by monitoring the oocyst discharge from SCID mice // Vet. Parasitol. – 2005. – Vol. 25(34). – Р. 173-176.
7. Korich D.G., Marshall M.M., Smith H.V. Inter-laboratory comparison of the CD-1 neonatal mouse logistic dose-response model for Cryptosporidium parvum oocysts // J. Eukaryot Microbiol. – 2000. – Vol.47(3). – Р. 294-298.
8. Raccurt C.P., Brasseur P., Verdier R.I. et al. Human cryptosporidiosis and Cryptosporidium spp. in Haiti // Trop Med. Int. Health. – 2006. – Vol.11, no. 6. – P.929-934.
9. Tsushima Y., Karanis P., Kamada T. Viability and infectivity of Cryptosporidium parvum oocysts detected in river water in Hokkaido, Japan // J. Vet. Med. Sci. – 2003. – Vol. 65(5). – Р. 585-589.
Криптоспоридиоз у больных ВИЧ инфекцией в России характеризуется высокой частотой бессимптомных форм [1]. В литературе мы не нашли ни одной работы, в которой бы была выполнена оценка их вирулентности или жизнеспособности у больных ВИЧ инфекцией с наличием или при отсутствии диареи. Мыши линии SCID, у которых отсутствуют Т- и В-лимфоциты, представляют собой одну из наиболее адекватных экспериментальных моделей для оценки биологических свойств криптоспоридий, прежде всего, их инфекционности [6]. Удалось обнаружить только одну работу, в которой было выполнено исследование заразительности ооцист, выделенных от больных ВИЧ инфекцией, путем инокуляции новорожденным мышам [8].
Цель исследования – оценить вирулентность ооцист криптоспоридий, полученных от больных ВИЧ инфекцией с диареей и без нее, а также их жизнеспособность, сопоставить полученные результаты с клиническими проявлениями криптоспоридиоза у больных ВИЧ.
Материалы и методы. Для экспериментального заражения криптоспоридиями были использованы самки мышей SCID в возрасте 5-6 недель. На всех этапах животные содержались в стерильных условиях, получали стерильную пищу и стерильную воду, воздух подвергался круглосуточному кондиционированию и стерилизации. Для заражения были использованы ооцисты, предварительно выделенные из испражнений 24 больных ВИЧ-инфекцией, из числа которых у 12 человек на момент выявления криптоспоридиоза наблюдалась диарея, а у других 12 пациентов криптоспоридиоз не сопровождался диареей.
Концентрацию и очистку ооцист из испражнений больных ВИЧ-инфекцией осуществляли путем двойного последовательного центрифугирования в градиенте сахарозы и заключительного центрифугирования в градиенте хлорида цезия [2]. Каждому животному для заражения в состоянии эфирного наркоза вводили в желудок с помощью катетера по 1000 ооцист в 0,15 мл стерильной дистиллированной воды. После заражения каждое животное изолировали в отдельную клетку. Учитывая высокую резистентность ооцист к действию дезинфицирующих средств, предпринимали строгие меры по профилактике заражения персонала. Весь потенциально заразный материал перед утилизацией подвергали стерилизации в автоклаве.
Для сбора испражнений клетки с животным помещали в металлические кюветы, на дно которых наливали 2.5 % раствора K2Cr2O7 слоем 1–1,5 см. Это предотвращало высыхание испражнений, к тому же раствор K2Cr2O7 губительно действует на флору кишечника и дополнительно выполняет функцию дезодоранта. В 2,5 % растворе K2Cr2O7 ооцисты криптоспоридий сохраняют свою жизнеспособность на протяжении многих месяцев.
Спустя пять дней от момента заражения начинали исследовать испражнения животных с целью получения ряда дополнительных данных об экспериментальной инфекции у каждого животного, зараженного разными изолятами паразита от разных больных ВИЧ-инфекцией. Эти данные включали: а) продолжительность инкубационного периода, который исчислялся от момента заражения до первого обнаружения ооцист в испражнениях; б) время достижения пика концентрации ооцист в испражнениях животного; в) сравнительную оценку концентрации ооцист в испражнениях различных животных, инфицированных изолятами паразита от разных больных ВИЧ-инфекцией. Впервые эти показатели были предложены и использованы для оценки патогенности ооцист авторами из Японии [6].
Для обнаружения ооцист вначале взвешивали пластиковые центрифужные пробирки объемом 1,5 мл, каждую пробирку маркировали и фиксировали ее вес. Фрагмент свежих фекалий от каждого животного помещали в отдельную пробирку и снова ее взвешивали, вычисляя массу испражнений. Далее к испражнениям добавляли 0,1 М фосфатно-солевой буфер рН 7,4 в соотношении 1:5 (вес к объему), содержимое пробирок перемешивали при помощи механической мешалки до полной гомогенизации. Пробирки помещали в штатив в вертикальном положении и выдерживали в холодильнике при температуре 4º С в течение одного часа. После этого с помощью пипетки отбирали 25 мкл надосадочной жидкости, из которой готовили мазок на предметном стекле. Исследование ооцист в мазках проводили методом прямой иммунофлюоресценции с помощью набора CryptoCel (Cellabs, Австралия).
После достижения пика концентрации ооцист в испражнениях мышей, последних использовали в качестве источника ооцист для других лабораторных исследований. С этой целью испражнения мышей собирали ежедневно в пластиковые контейнеры индивидуально от каждого животного и хранили в холодильнике при температуре 4 º С в 2,5 % растворе K2Cr2O7. Один раз в неделю выполняли очистку и концентрацию ооцист из полученных от животных испражнений методом центрифугирования в градиенте сахарозы и градиенте хлорида цезия.
Оценку жизнеспособности ооцист, выделенных из испражнений больных ВИЧ инфекцией с криптоспоридиозом, проводили по показателю их эксцистирования, т.е. оценивали активность выхода спорозоитов из ооцист после воздействия стимулятора.
Перед исследованием из испражнений больных выделяли ооцисты криптоспоридий путем их концентрации и очистки в градиенте сахарозы и градиенте хлорида цезия.
Для стимуляции эксцистирования спорозоитов ооцисты в количестве 104 инкубировали в 100 мкл свежеприготовленного раствора таурохолата натрия с конечной концентрацией 0,75 % в фосфатно-солевом буфере при температуре 37 ºС в течение двух часов [2]. После инкубации ооцисты отмывали, добавляя в пробирки по 1 мл фосфатно-солевого буфера, содержимое пробирок центрифугировали при ускорении 5000 × g в течение 10 минут и удаляли надосадочную жидкость. К осадку добавляли фосфатно-солевой буфер в объеме 50 мкл, содержимое пробирок тщательно перемешивали. Для оценки эксцистирования производили микроскопическое исследование ооцист во влажном мазке на предметном стекле в световом микроскопе при увеличении 400×. Количество полностью или частично эксцистированных ооцист суммировали. Параллельно подсчитывали также и не освободившиеся от спорозоитов ооцисты. Когда общее число обнаруженных в препарате ооцист достигало ста, подсчет прекращали. Сумма частично и полностью эксцистированных ооцист представляла собой показатель их жизнеспособности в процентах
Результаты. Инфекцию удалось воспроизвести у всех 24 мышей, зараженных ооцистами из испражнений 24 больных ВИЧ инфекцией (12 больных криптоспоридиозом с диареей и 12 больных – без диареи). Клинические проявления криптоспоридиоза отсутствовали у всех зараженных животных. На протяжении всего эксперимента и в отдаленные сроки наблюдения все мыши остались живы.
Концентрация ооцист в испражнениях мышей достигала пика в период от 32-го до 52-го дня с момента заражения. Пик был достигнут на 32–39 день у 5 (20,8 %) животных, в том числе у всех трех, у которых было отмечено самое раннее появление ооцист. У 8 (33,3 %) мышей пик экскреции ооцист наблюдался на 40–47 день наблюдения, причем это было отмечено у всех тех 8 животных из 12, у которых появление ооцист в испражнениях наблюдалось в период с 13 по 15 день от заражения. У остальных 11 (45,8 %) мышей экскреция ооцист достигала максимума на 48–52 день эксперимента. Непараметрический коэффициент корреляции Спирмена позволил установить прямую связь между сроками первого появления ооцист в испражнениях мышей после заражения и временем достижения максимума их концентрации в кале (R=0,45 при p < 0,05). Связи этих показателей с наличием или отсутствием диареи также установить не удалось.
По истечении двух месяцев данного эксперимента было отмечено, что концентрация ооцист в испражнениях разных животных была неодинаковой. Наиболее высоким было содержание ооцист у 8 мышей, причем у всех 5 животных с пиком концентрации в ранние сроки после заражения. Низкая концентрация ооцист, напротив, определялись в испражнениях 7 мышей, причем все эти животные были из числа тех 11, у которых наблюдалось отсроченное достижение максимума экскреции ооцист в первые два месяца эксперимента. Статистический анализ показал, что имеется обратная зависимость между сроком первого обнаружения ооцист и их максимальной концентрацией в испражнениях мышей (R=-0,42 при p<0,05). Еще более выраженная обратная зависимость была выявлена между двумя другими параметрами, временем достижения максимальной концентрации ооцист, с одной стороны, и самой концентрацией ооцист в кале, с другой (R=-0,70 при p<0,001). Иными словами, концентрация ооцист в испражнениях была тем выше, чем в более ранние сроки от момента заражения они обнаруживались впервые, а также чем раньше их концентрация достигала пика. Установить связь этих параметров с наличием или отсутствием диареи у больных ВИЧ инфекцией с криптоспоридиозом не удалось.
Известно, что жизнеспособность и вирулентность ооцисткриптоспоридий может быть оценена с помощью различных методов, среди которых биологическая модель на мышах общепризнана в качестве золотого стандарта. Эта модель настолько чувствительна, что экспериментальная инфекция у новорожденных мышей может быть воспроизведена при заражающей дозе всего 25 ооцист [7], а у мышей SCID при заражающей дозе всего 10 ооцист.
В выборе заражающей дозы в 10 3 ооцист для одного животного мы ориентировались на исследования авторов из Японии [6]. По их данным о вирулентности криптоспоридий можно судить по срокам первого появления ооцист в испражнениях. В дополнение к рекомендованным этими авторами показателям мы исследовали также два других, таких как срок достижения максимума концентрации ооцист в кале мышей от момента заражения, а также сам показатель концентрации.
Биологическая модель позволила обнаружить разницу в вирулентности криптоспоридий, полученных от разных больных ВИЧ инфекцией. Наши исследования показали, что из 24 исследованных образцов испражнений больных ВИЧ только в 3 (12,5 %), если ориентироваться на сроки первого появления ооцист в кале мышей, или в 5 (20,8 %) образцах, если ориентироваться на время достижения пика экскреции ооцист, содержались высоковирулентные криптоспоридии. Это число высоковирулентных криптоспоридий может быть увеличено до 8 (33,3 %), если ориентироваться на самую высокую концентрацию ооцист паразита, которая была зафиксирована в испражнениях этих 8 мышей по итогам двух месяцев наблюдения. Таким образом, результаты экспериментальной инфекции у мышей SCID дают основание предполагать, что у подавляющей части больных ВИЧ криптоспоридиоз был вызван штаммами паразита с невысокой вирулентностью.
Связь изученных параметров экспериментальной инфекции у мышей с наличием или отсутствием диареи при криптоспоридиозе у больных ВИЧ инфекцией отсутствовала. Это свидетельствовало о том, что наличие или отсутствие диареи в большей мере определялось состоянием организма больного, чем вирулентностью и патогенностью каждого отдельного изолята паразита.
Оценка жизнеспособности ооцисткриптоспоридий, выделенных от больных ВИЧ инфекцией, по показателю эксцистирования. При изучении воды, как основного фактора передачи криптоспоридиоза, оценка жизнеспособности ооцист стала одной из неотъемлемых характеристик возбудителя. Напротив, при клинических исследованиях до последнего времени этот параметр пока не изучался, только в одной публикации авторы представили результаты оценки жизнеспособности ооцист, полученных от больных криптоспоридиозом, на биологической модели [8]. Ранее было показано, что оценка жизнеспособности ооцист методом витальной окраски нуклеиновых кислот 4',6-диамидино-2-фенилиндолом (DAPI) и пропидий йодидом (PI) имеет корреляцию, исчисляемую коэффициентом 0,997, с другим показателем – способностью ооцист освобождать спорозоиты (эксцистироваться) в определенных условиях [5]. С другой стороны, более поздние исследования выявили трудности при оценке результатов витальной окраски, обусловленные неспецифической адсорбцией красителя на примесях, содержащихся в исследуемом материале вместе с ооцистами [9]. Поэтому для оценки жизнеспособности ооцисткриптоспоридий, выделенных из испражнений больных ВИЧ инфекцией, нами был выбран показатель активности высвобождения из них спорозоитов (показатель эксцистирования).
Эсцистирование наступает в результате ряда стимулов, которые имитируют условия, имеющие место при попадании ооцист в организм хозяина. Например, стимулом к высвобождению спорозоитов является их инкубация при температуре 37 ºС. Это своеобразный сигнал паразиту, что он попал в организм теплокровного хозяина, где есть условия для размножения. Другим мощным стимулом для освобождения спорозоитов является воздействие на ооцисты желчных кислот и их солей. В естественных условиях заражения такой стимул к освобождению спорозоитов действует после прохождения ооцистами желудка (следует отметить, ооцисты являются высоко резистентными к действию кислой среды) и их попадании в тонкий кишечник, который является основным местом паразитирования. Комбинированное воздействие температуры 37 º С и желчных кислот (в нашем исследовании – таурохолата натрия) оказывает мощный кумулятивный эффект на освобождение спорозоитов, что позволяет добиваться эксцистирования уже спустя 45 минут инкубации ооцист в подобных условиях.
Исследование выполняло несколько задач. С одной стороны, оно представляло собой попытку ответить на вопрос, является ли бессимптомное течение криптоспоридиоза признаком начинающегося выздоровления, с другой – давало возможность оценить в сравнении эпидемиологическую опасность больного криптоспоридиозом с диарей и без диареи. Известно, что в периоде ремиссии или реконвалесценции при отсутствии клинических проявлений, больной продолжает выделять ооцисты, но среди них начинают преобладать нежизнеспособные формы [3, 4].
Исследование было выполнено у 25 больных с криптоспоридиозом с 4А стадией ВИЧ инфекции. Из их числа у 13 человек криптоспоридиоз протекал бессимптомно, а у 12 больных сопровождался диареей. Оценка активности эксцистирования в результате стимуляции очищенных ооцисткриптоспоридий 0,75 % раствором таурохолата натрия и инкубации при температуре 37 ºС в течение двух часов показала следующее. У 13 больных ВИЧ инфекцией без диареи средний показатель эксцистирования составил 82,7 %+11,4 %. У других 12 больных ВИЧ инфекцией, у которых криптоспоридиоз сопровождался диареей, показатель эксцистирования был 85,3 %+12,1 %. Статистически значимая разница этих двух показателей отсутствовала (p > 0,05).
Заключение. Таким образом, у больных ВИЧ инфекцией содержащиеся в испражнениях ооцисты характеризовались одинаково высокой степенью жизнеспособности независимо от наличия или отсутствия клинических проявлений в виде диареи. Использованный нами метод оценки жизнеспособности ооцист позволяет считать, что больные ВИЧ инфекцией с криптоспоридиозом без диареи представляют такую же эпидемиологическую опасность, как и больные с диареей. Высокий процент эксцистирования ооцисткриптоспоридий у больных с субклинической формой криптоспоридиоза не дает оснований полагать, что отсутствие диареи являлось признаком ремиссии или начавшегося выздоровления.
Энцефаломиелит мыши
Энцефаломиелит мышей — инфекция лабораторных мышей, проявляющаяся вялыми параличами преимущественно задних конечностей. Заболевание вызывают несколько вирусов: оригинальный шт. ТО-Тейлора, а также шт. FA, GD-VII и родственные им штаммы. Встречается повсеместно.
Штамм ТО впервые выделил в 1933 г. Тейлор из головного мозга белых мышей у которых наблюдал клинические признаки энцефалита. Аналогичный вирус Тейлора можно легко выделить из организма клинически здоровых белых мышей, что свидетельствует о широком вирусоносительстве.
Клинические признаки и патологоанатомические изменения. Вирус ТО обычно вызывает латентную инфекцию у лабораторных мышей. Аналогичные вирусы выделяли от диких мышей, хлопковых крыс и мешотчатых грызунов. Патологические изменения в ЦНС от шт. ТО сходны с поражениями, вызываемыми вирусом полиомиелита у человека. Отмечается деструкция клеток передних рогов, особенно спинного мозга, и связанная с ней воспалительная реакция. Изменения, обусловленные шт. FA и GD-VII, характеризуются диффузным энцефалитом и не совсем сходны с изменениями при полиомиелите у человека, как в случаях с вирусом ТО.
Штаммы вируса энцефаломиелита мышей Тейлора распределены в 2 группы: GDVII и DA (или ТО). Нейровирулентная группа, которая быстро убивает мышей, и демиелинизирующая группа, которая вызывает нелетальную инфекцию двигательных нервов с последующей персистентной инфекцией белого вещества с демиелини-зирующими повреждениями, сходными с множественным склерозом. На основании исследования 3-мерной структуры вируса предполагают, что различия в патогенезе двух групп вируса Тейлора являются результатом различий в процессах иммунологического или рецептор опосредованного узнавания.
Референтные шт. GDVII и DA. Штаммы подгруппы GDVII являются высоковирулентными и вызывают острый энцефаломиелит у мышей. При этом не наблюдается ни персистенции, ни демиелинизации. Штаммы DA менее вирулентны и устанавливают персистентную инфекцию в спинном мозге мышей несмотря на энергичную гуморальную иммунную реакцию, сопровождающуюся хронической демиелинизацией. Вирус представляет собой превосходную модель для изучения множественного склероза человека, при котором также наблюдается демиелинизация. Большинство клеток, инфицированных вирусом, производит 100—500 копий генома, что намного меньше, чем необходимо для определяемой экспрессии вирусных белков. Ограниченный синтез вирусных белков ведет к уменьшению цитопатического эффекта. Анализ последовательностей мутантных вирусов, устойчивых к нейтрализующим МКА к БД идентифицировал 4 аминокислотных мутации капсидных белков и все они локализовались на рецепторе или вблизи связывающего вирус. Мутантные вирусы показали уменьшение демиелинизирующей активности. Эти находки предполагают, что нейтрализация антител зависит от связывания вируса с клеточным рецептором и что демиелинизация и вирусная персистенция могут интерферировать с предотвращением прикрепления вируса к рецепторам особых типов клеток. Белок 17 кД (L-белок) синтезируется в штаммах субгруппы DA. Изучение вирусного мутанта DA без L-npo-теинового синтеза показало, что этот белок является важным для вирусного роста в особых типах клеток и является критическим для демиелинизирующей болезни и вирусной персистенции. Инактивация гена рецептора у-интерферона делает мышей I29/SV чувствительными к персистентнОой инфекции и ДБ, а инактивация гена у-интерферона у мышей 157ВL/6 придает им чувствительность к персистентной инфекции, а не к клинической ДБ. Эти различия фенотипа обусловлены различиями генетического фона. Полное секвенирование генома в потомстве F2 из двух скрещиваний показало, что ДБ является результатом двух независимых факторов: высокой вирусной нагрузки и локуса Tmevd5 в хромосоме 11.
Морфология, химический состав и устойчивость. РНК-содержащий вирус Тейлора имеет размеры 20—25 нм, устойчив в диапазоне рН 3—10, а также к эфиру, хлороформу, фенолу, гипертоническому раствору NaCl, глицерину, алюминиевым квасцам. Разрушается под воздействием 20 %-ного раствора этилового спирта, 50 %-ного ацетона, 2 %-ного раствора КМп04, 1,5 %-ного раствора формалина. Длительно сохраняется при низких температурах (-40 ° — 70 °С), неустойчив к прогреванию (50 °-70 °С) и высокочувствителен к лиофильному высушиванию. АГ структура не изучена. У больных мышей старше года обнаруживают ВНА, ПА, анти-ГА.
Штаммы ТО, FA и GD-VII родственны, но не идентичны. ВЭМТ индуцирует ген c-fos в чистых культурах покоящихся астроцитов мозга мыши. Экспрессия c-fos зависит от дозы ВЭМТ и достигает максимума при множественности заражения 100. Экспрессия c-fos максимальная через 30 мин и исчезает через 2 ч. Методом проточной цитометрии показано, что ВЭМТ быстро интернализируется после связывания со специфическим рецептором и активно реплицируется в цитоплазме астроцитов и что мРНК c-fos может транслироваться в ядре. Индукция c-fos нейтрализуется антителами к ВЭМТ. Очищенные белки VP1, VP2 и VP3 ВЭМТ не индуцируют экспрессию ВЭМТ. Быстрая индукция c-fos может являться первой стадией заражения астроцитов ВЭМТ.
Изучение структуры ВЭМТ позволило предположить, что глубокая впадина на поверхности вирионов участвует в прикреплении вируса к рецептору. Для проверки этого предположения у менее вирулентного варианта ВеАп ВЭМТ сконструировали замены четырех аминокислотных остатков (V1091, Р1153, А1225 и Р1379). В каждом из этих сайтов сделаны три аминокислотные замены: одна консервативная и две более радикальные. Получены семь жизнеспособных мутантов вируса и изучены их связывание с клетками ВНК-21, стабильность капсидов при 40 °, репликация РНК, кинетика роста в одиночном и множественных циклах заражения и трансляция вирусных белков. Три из указанных остатков участвуют в прикреплении вируса к клеточным рецепторам.
Шт. GD-VII в отличие от других (FA и ТО) агглютинирует эритроциты человека группы 0 при температуре 4 °С до разведения выше 1:2000. После обработки трипсином ГА-активность штамма повышается и проходит при температуре 20 °С с эритроцитами человека и 4 °С с эритроцитами обезьяны. После обработки трипсином два других штамма (FA и ТО) также приобретают ГА-свойства при температуре 20 °С.
Латентно инфицированные мыши выделяют вирус с фекалиями в течение 53 дней.
Экспериментальная инфекция. Экспериментальная инфекция шт. ТО воспроизводится на мышах 3—4-недельного возраста при интрацеребральном, интраназальном, интраперитонеальном и внутримышечном введениях (гибель при первом методе введения в 100 % случаев). Взрослые мыши не заболевают или легко переболевают и становятся вирусоносителями. Вирус проникает В ЦНС и другие органы через 2—5 дней после заражения. Он локализуется, в основном, в стенке кишечника и оттуда проникает в мезентериальные лимфоузлы и далее в ЦНС. У зараженных мышей старшего возраста может развиваться прогрессирующий вялый паралич, у еще более старших — латентная инфекция. После первичного выделения шт. GD-VII обычно вызывает вялый паралич, после пассирования на мышах — генерализованный энцефалит. Шт. FA также постоянно вызывает только диффузный энцефалит. Вялые параличи отмечают только после интраперитонеальной инокуляции.
Внутримышечная инокуляция любого из трех штаммов вызывает локальный миозит, по крайней мере шт. GD-VII, видимо, размножается в мышцах. Получена серия мутантов штамма DA со специфическими мутациями вирусного капсидного белка VP1, определяющего связь вируса с рецепторами клетки. Мутант вируса с заменой в петле IJ/PJ треонина на аспарагин (T81D) формирует крупные бляшки, но обладает пониженной способностью к репликации in vitro. При инъекции этого мутанта восприимчивым мышам выявляется измененный тропизм в острой стадии заболевания и не развивается хроническое демиелинизирующее заболевание. При замене треонина на валин (T81V) вирус не вызывает изменения, характерные для заболевания мышей. При замене в этой позиции триптофана (T81W) развивается сходное острое заболевание, но не развивается хроническая болезнь. Изменение аминокислот в гидрофобной области вдавления стенки, в позиции 91 VP1, в гидрофильный треонин (V91T), приводит к острому или хроническому заболеванию в отсутствие персистен-ции вируса. Таким образом, замены аминокислот в области петли I VP1 вируса приводят к изменению взаимодействия вируса с хозяином.
Культивирование. Вирус FA размножается в КЭ, зараженных на ХАО, в желточный мешок или в аллантоисную полость. Кроме эмбрионов, вирус размножается в культуре фибробластов КЭ, в культуре клеток печени и почек мышей, а также в ВНК-21. Особенности внутриклеточной репродукции не изучены. Шт. DA вызывает в клетках L929 персистенцию, которая обусловлена продукцией интерферона. Синтез РНК В клетках ВНК-21, зараженных шт. GDVI1 Или DA снижается через 3 ч после заражения, достигает максимального уровня через 6 ч, затем снижается. Изучена чувствительность первичных культур нейронов штаммами DAh GDVTI ВЭМТ. Высоковирулентный штамм GDVII заражает более 90 % Нейронов через 12 ч после инокуляции, а через 24 час. после заражения вызывает сильный цитопатический эффект. Антигены ВЭМТ обнаруживаются только через 24 ч после заражения вызывающим хрони-ческеую демиелинизирующую болезнь штаммом DA, который инфицирует не более 2 % нейронов даже через 6 дней. Заражение штаммом DA не вызывает цитопатичес-кого эффекта. С использованием рекомбинантных ВЭМТ показано, что капсид действительно отвечает за картину заражения, наблюдаемую in vitro. Таким образом, уровень нейровирулентности штаммов DA и GDVII коррелируете их способностью заражать культуры нейронов и контролируется капсидом. Штамм GD VII не индуцирует наработку полипептида вследствии его плохого размножения в мышиных L-клетках.
Источники и пути передачи инфекции. Источником инфекции при спонтанном энцефалите служат больные мыши, выделяющие вирус во внешнюю среду с калом и мочой, а также мыши-вирусоносители. Они являются основным резервуаром вирусов в природе. Заражаются мыши в основном алиментарным путем, через инфицированный экскрементами корм. Передавать вирус здоровым животным могут кровососущие насекомые.
Кроме белых мышей, восприимчивы серые дикие мыши, хлопковые крысы. У морских свинок удавалось вызвать латентную инфекцию. Кролики, белые и водяные крысы, лесные мыши и обезьяны к вирусу резистентны. На ранней стадии инфииирования мышей штаммом Даниеля вируса энцефаломиелита мышей вирус обнаруживается в нейронах и глии. В белом веществе вирус персистирует дольше, тогда как под воздействием иммунной системы происходит его ранняя элиминация из серого вещества. Из рыжей полевки выделен неизвестный ранее пикорнавирус, названный вирусом Люген. Принадлежность к пикорнавирусам была установлена на основании данных ЭМ и секвенирования. Рассчитанные аминокислотные последовательности капсидных белков VP2 и VP3 вируса Люген были сходны с таковыми вируса ЕСНО-22 (сходство около 70 %). 5'-некодирующая область РНК вируса Люген характеризовалась наибольшим сходством с кардиовирусами.
Иммунитет и специфическая профилактика. Иммунитет не изучен, специфическая профилактика не разработана. Новорожденные мышата и мышата-сосунки приобретают пассивный иммунитет с материнскими AT. Вскоре после отъема они становятся вирусоносителями и обладают повышенной резистентностью к инфекции. С возрастом процент вирусоносителей уменьшается: в 7,5 месяца он составлял всего 50 % и в дальнейшем понижался. Инфекция мышей вирусом энцефаломиелита Тейлора напоминает по клиническим проявлениям рассеянный склероз (PC) человека. Сконструированы экспрессирующие эукариотические векторы, кодирующие капсидные белки VP1, VP2 и VP3. Вакцинировали мышей SJL/J внутримышечно однократно, дважды или трехкратно кДНК различных капсидных белков. Затем мышей заражали в мозг. Трехкратная вакцинация мышей кДНК, кодирующей VP2 вируса, приводит к частичной защите их ЦНС от демиелинизирующего заболевания: уменьшались клинические симптомы и гистопатология. Вакцинация с помощью кДНК, кодирующей VP3, также приводила к уменьшению клинических проявлений. В то же время, вакцинация кДНК, кодирующей VP1, вызывала более тяжелое заболевание, причем симптомы заболевания появлялись раньше, а гистопатология усиливалась в сравнении с контролем. Это не коррелировало с титрами антител против и течением болезни. Таким образом, вакцинация с помощью ДНК способна изменять течение хронического демиелинизирующего заболевания. Это может найти применение в лечении PC.
Саличев А.В. 1 Гришина К.Г. 1 Ворович М.Ф. 1 Кожевникова Т.Н. 2 Санин А.В. 2 Пронин А.В. 2 Наровлянский А.Н. 2 Ожерелков С.В. 1
Исследована транскрипционная активность генов некоторых цитокинов (ЦТ)в головном мозге мышей при экспериментальной инфекции, вызвынной вирусом клещевого энцефалита (ВКЭ) после интрацеребрального заражения. Животные были разделены на группы с учетом выраженности признаков ВКЭ-инфекции. Показано, что ВКЭ-инфекция, сопровождающаяся неврологической симптоматикой, ассоциирована с высокими уровнями вирусной РНК в головном мозге. При этом регистрировались высокие уровни экспрессии генов провоспалительных ЦТ, что свидетельствует о выраженной воспалительной реакции, повреждающей головной мозг. Пероральное введение преднизолона достоверно снижало летальность инфицированных мышей. При и.ц. введении препарата на основе полипренилфосфата натрия (ППФ) наблюдалось снижение летальности с 67 % в группе животных, инфицированных ВКЭ, до 9 % в группе мышей, которым одновременно вводили ППФ и ВКЭ. При этом обнаружено, что и.ц. введение ППФ вызывает увеличение экспрессии гена IL6 в головном мозге в 5,4 раз по сравнению с контролем через 6 часов после введения, что, по-видимому, обусловливает активацию механизмов естественной резистентности и раннее подавление репродукции вируса. Эксперименты с антителами (АТ) к ВКЭ показали, что защитные свойства АТ проявляются лишь при условии их применения до или на ранних сроках после инфицирования. Введение АТ через 3–4 суток после интраперитонеального заражения мышей было неэффективно. Использование инъекций ППФ на поздних сроках относительно инфицирования также малоэффективно. По-видимому, это связано со значительным иммунопатогенным действием ВКЭ в этот период времени. В то же время введение ППФ с АТ оказывало защитное действие.

1. Противовирусная и иммуномодулирующая активность полипренилфосфатов при вирусных инфекциях / А.Н. Васильев, С.В. Ожерелков, В.В. Козлов, А.В. Пронин, А.В. Санин, Т.М. Парфёнова, А.В. Изместьева, А.Н. Амченкова, Т.Н. Кожевникова, Т.Н. Степанова, А.Н. Наровлянский // Антибиотики и Химиотерапия. – 2008. – Т. 53, № 3–4. – С. 3–8.
2. Кожевникова Т.Н. Морапренилфосфаты подавляют размножение вируса энцефаломиелита мышей Тейлера и накопление вирусного белка VP3 в чувствительных культурах клеток ВНК-21 и Р388D1 / Т.Н. Кожевникова, Е.Г. Викторова, В.Г. Козлов, А.Н. Наровлянский, А.В. Санин, А.В. Пронин, Ожерелков С.В. // Журн. Микробиол. – 2007. – № 3. – С. 26–30.
3. Влияние препаратов Гамапрена и Фоспренила, созданных на основе полипренолов растительного происхождения, на продукцию некоторых регуляторных цитокинов в норме и при экспериментальном клещевом энцефалите у мышей / Т.Н. Кожевникова, С.В. Ожерелков, А.В. Изместьева, В.Ю. Санина, А.Н. Наровлянский, А.В. Пронин, А.В. Санин // Рос. Иммунол. Журн. – 2008. – Т. 2(11), № 2–3. – С. 250.
4. Защитное действие нового противовирусного препарата Фоспренил при экспериментальном клещевом энцефалите / С.В. Ожерелков, А.В. Тимофеев, Г.П. Новикова, А.В. Деева, А.Н. Наровлянский, А.В. Санин, А.В. Пронин // Вопр. Вирусол. – 2000. – Т. 45, № 1. – С. 33–37.
5. Разнонаправленное влияние MIF и полипренилфосфата натрия на течение экспериментальной флавивирусной инфекции у мышей / А.В. Санин, А.П. Суслов, О.Ю. Третьяков, Р.В. Зварцев, А.В. Саличев, Т.Н. Кожевникова, В.Ю. Санина, Е.Г. Смирнова, С.В. Ожерелков // Журн. микробиол. – 2011. – № 5. – С. 56–61.
6. Исследование противовоспалительной активности фоспренила в эксперименте / А.В. Санин, С.А. Суханова, О.В. Проскурина, Н.М. Митрохин, И.В. Ганшина, Г.Ф. Судьина, В.Ю. Санина, А.А. Виденина, Т.Н. Кожевникова, А.А. Санин, С.В. Ожерелков, А.В. Саличев, А.В. Пронин, А.Н. Наровлянский // Российский ветеринарный журнал. – 2011. – № 4. – С. 17–20
7. Tick-borne Virus Diseases of Human Interest in Europe / Charrel R.N., Attoui H., Butenko A.M., Clegg J.C., Deubel V., Frolova T.V., Gould E.A., Gritsun T.S., Heinz F.X., Labuda M., Lashkevich V.A., Loktev V., Lundkvist A., Lvov D.V., Mandl C.W., Niedrig M., Papa A., Petrov V.S., Plyusnin A., Randolph S., Suss J., Zlobin V.I., De Lamballerie X. // Clinical Microbiology and Infection. 2004. no. 10(12). pp. 1040–1055.
Целью настоящего исследования было изучение молекулярных механизмов иммунопатогенного действия ВКЭ в головном мозге мышей с визуальными признаками инфекции и разработка экспериментального подхода к иммунотерапии КЭ.
Материал и методы исследования
Использовали вирус клещевого энцефалита (ВКЭ) /штамм Софьин/, высокопатогенный для мышей. ВКЭ получали из отделения энцефалитной вакцины Предприятия им. М.П. Чумакова. Вирус использовали в виде мозговой суспензии заболевших мышей-сосунков, заражённых и.ц. Предварительно вирус титровали на беспородных белых мышах массой 10–12 г, заражённых интраперитонеально (и.п.) или и.ц.
Наблюдение за животными проводили ежедневно в течение 21 суток. По окончании эксперимента проводили расчёт показателей:
1) выживаемости: отношение количества выживших мышей к общему количеству животных в группе (в %);
2) летальности: отношение количества погибших мышей к общему количеству животных в группе (в %);
3) средней продолжительности жизни (СПЖ) по формуле:
где t – СПЖ; ti – срок жизни каждого животного; N – число животных в группе. Оставшимся в живых животным приписывается условное время выживания, равное ∞. Для полученных значений рассчитывали величину среднего квадратического отклонения. Достоверность различий летальности и выживаемости животных определяли с помощью t-критерия Стьюдента.
ОТ-ПЦР в реальном времени
![]()
где CT(контроля) – среднее значение порогового цикла C(t) для контрольного образца; CT (образца) – среднее C(t) для экспериментального образца. Значения относительной экспрессии исследуемых генов нормировались по уровням относительной экспрессии гена HPRT1. Фрагменты кДНК исследуемых генов амплифицировали с использованием праймеров следующих последовательностей: HPRT1: прямой 5’GGATACAGGCCAGACTTTGTT 3’ и обратный 5’ GGCTTTTCCAGTTTCACTAATG 3’, IFNγ: прямой 5’ GAGGAACTGGCAAAAGGATG 3’ и обратный 5’ GCTGATGGCCTGATTGTCTT 3’, TNFα: прямой 5’ CAGACCCTCACACTCAGATCA 3’ и обратный 5’ CACTTGGTGGTTTGCTACGA 3’, IL1a: прямой 5’ CCCGTGTTGCTGAAGGAGT 3’ и обратный 5’ CCAGAAGAAAATGAGGTCGGT 3’, IL1b: прямой 5’ CAGGCTCCGAGATGAACAAC 3’ и обратный 5’ TCATGGAGAATATCACTTGTTGG 3’, IL2: прямой 5’ AGAAGATGAACTTGGACCTCTG 3’ и обратный 5’ TGTGTTGTCAGAGCCCTTTAG 3’ IL4: прямой 5’ TCCTCACAGCAACGAAGAAC 3’ и обратный 5’ TGCAGCTCCATGAGAACACTA 3’, IL6: прямой 5’ CGTGGAAATGAGAAAAGAGTTGT 3’ и обратный 5’ GCATCCATCATTTCTTTGTATCT 3’, IL10: прямой 5’ TGAGGCGCTGTCATCGATT 3’ и обратный 5’ GACACCTTGGTCTTGGAGCTT 3’, IL12a: прямой 5’ ATGAGCTGATGCAGTCTCTGAA 3’ и обратный 5’ ACTCTGTAAGGGTCTGCTTCTC 3’, IL12b: прямой 5’ TTCATCAGGGACATCATCAAAC 3’ и обратный 5’ TGACCTCCACCTGTGAGTTCTT 3’, IL15: прямой 5’ AACTGCTTTCTCCTGGAATTG 3’ и обратный 5’ CCAGATTCTGCTACATTCTTGTT 3’, IL18: прямой 5’ TGAAGAAAATGGAGACCTGGA 3’ и обратный 5’ TCTGGGGTTCACTGGCACT 3’, IL23: прямой 5’ ACTCAAGGACAACAGCCAGTTC 3’ и обратный 5’ AGTAGGGAGGTGTGAAGTTGCT 3’, CD4: прямой 5’ CCAAGATGAGACTGACCCTGAA 3’ и обратный 5’ TTCACCCCTCTGGATAAAACCT 3’, CD25: прямой 5’ CTGCAAGATGAAGTGTGGGAA 3’ и обратный 5’ TGTGGGTTGTGGGAAGTCTG 3’, TBEV: прямой 5’ GTACAACATGATGGGCAAGAGA 3’ и обратный 5’ GCCAGCCCAGGTAGTTCAAG 3’, ОТ-праймер 5’ TTGACAACTTCTTGAGGTGCCA 3’. ПЦР в реальном времени проводилась на амплификаторе CFX96, Bio-Rad, США. Анализ результатов ПЦР и статистическая обработка производились при помощи программного обеспечения Bio-Rad CFX Manager Software Ver. 1.6.
Результаты исследования и их обсуждение
Защитное действие ППФ при и.ц. способе заражения и введения препарата
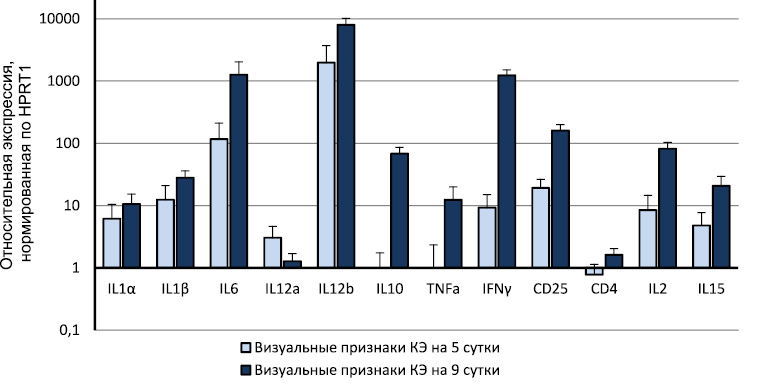
Рис. 1. Увеличение экспрессии генов некоторых иммуннорегуляторных молекул в головном мозге мышей с визуальными признаками КЭ по сравнению с интактными животными
Показано, что максимальное снижение летальности и увеличение СПЖ ППФ обеспечивает при и.ц. введении ВКЭ в дозе, вызывающей гибель 67 % животных (табл. 1).
Протективная активность ППФ при и.ц. заражении вирусом в 3-х разных 10-кратных разведениях и введении препарата мышам линии Balb/c (n = 15 мышей в группе).
Нами было изучено влияние ВКЭ и ППФ на экспрессию генов цитокинов в головном мозге на ранние сроки после и.ц. заражения или введения ППФ (рис. 2). При и.ц. введении среды 199 или вирусной суспензии было выявлено увеличение по сравнению с интактными животными экспрессии гена IL6, что является реакцией на черепно-мозговую травму при данном способе введения. В то же время уровень экспрессии гена IL6 в группе мышей, которым и.ц. вводили ППФ, превышал таковой уровень в группе мышей, которым и.ц. вводили среду 199, в 5,4 раза (p < 0,05). По-видимому, это свидетельствует о способности ППФ активировать механизмы врожденного иммунитета, что способствует раннему подавлению репродукции вируса.
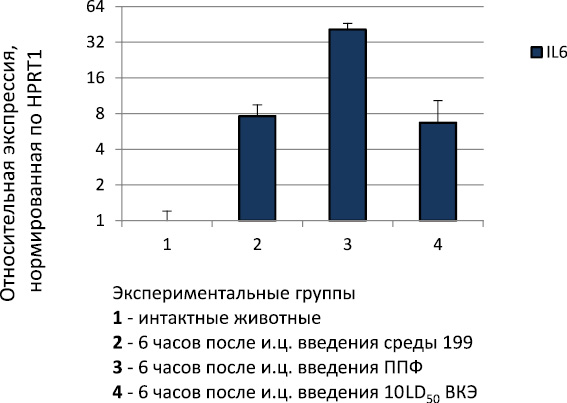
Рис. 2. Экспрессия гена IL6 в головном мозге мышей через 6 часов после и.ц. заражения или введения ППФ
Пероральное применение ППФ и преднизолона при периферическом заражении мышей
Оценка профилактического противовирусного действия ППФ и преднизолона, введенных per os, при экспериментальном клещевом энцефалите у беспородных мышей обоего пола массой 18–20 г (n = 15–16)
Примечание . Различия СПЖ в группах 1 и 2, 1 и 3, 2 и 3 статистически достоверны.
Профилактическое действие ППФ в сочетании с антителами к вирусу клещевого энцефалита
В следующей серии экспериментов животных заражали вирусом (в до 10LD50) и вводили внутримышечно: АТ, ППФ, АТ+ППФ (табл. 3) на –1-е, 0, 1-е, 3-и сутки относительно заражения ВКЭ. Наблюдение за животными проводили ежедневно в течение 21 суток. Результаты, представленные в табл. 3, показывают, что введение АТ к ВКЭ на ранних сроках (–1-е, 0, 1-е, 3-и сутки) относительно заражения вирусом приводит к защите животных в 100 % случаев, тогда как в контроле животные выживали лишь в 20 % (табл. 3., группы 3 и 1). Гораздо менее эффективно в.м. введение ППФ (табл. 3, группы 2 и 1). В то же время необходимо отметить, что сочетанное введение АТ и ППФ не приводило к утяжелению инфекционного процесса.
Профилактическое действие ППФ в сочетании с антителами к вирусу (на –1-е, 0, 1-е, 3-и сутки относительно заражения ВКЭ)
Профилактическое и лечебное действие ППФ в сочетании с антителами к вирусу. АТ и ППФ вводили в.м. по схемам: a – на 3 и 4 сутки после заражения; b – на 4, 5 и 6 сутки после заражения
Примечание. Количество мышей в группе n = 15. Различия СПЖ в группах 1 и 4, 2 и 4, 3 и 4, 5 и 6, 5 и 7, 6 и 7 статистически достоверны (p < 0,05).
Иная картина регистрировалась при введении АТ или АТ+ППФ на более поздних сроках: на 3-е, 4-е или на 4-е, 5-е, 6-е сутки относительно заражения ВКЭ (табл. 4). В данном случае антитела не оказывали защитного действия. Введение ППФ, напротив, защищало заражённых мышей в 20 % случаев, что в 1,5 раза выше контрольного показателя (табл. 4, группы 3 и 1). Одновременное введение АТ+ППФ существенно усиливало протективный эффект (табл. 4, группы 4 и 1; 3 и 4). Таким образом, применение иммуномодулятора в сочетании с АТ на более поздних сроках способствует защите от вирусной инфекции.
Использование в наших экспериментах преднизолона выявило его способность защищать животных от ВКЭ. Этот факт является показателем необходимости применения противовоспалительных препаратов при КЭ. Эксперименты с АТ к ВКЭ явно свидетельствуют о том, что защитные свойства АТ проявляются лишь при условии их применения на ранних сроках относительно инфицирования. В случае их использования на поздних сроках, защита от ВКЭ не регистрировалась. Таким образом, по крайней мере в условиях эксперимента использование АТ против КЭ в качестве лечебных препаратов недостаточно эффективно. Использование инъекций ППФ за 24-48 часов до проявления визуальных признаков КЭ также малоэффективно. По-видимому, это связано с тем обстоятельством, что иммунный ответ при КЭ в данный период времени уже сформировался и применение иммуномодулятора неэффективно. В то же время введение ППФ с АТ даже в этот период достаточно оправданно, так как ППФ полифункционален и обладает свойством коррекции иммунопатологических реакций, вызываемых АТ.
Неврологическая симптоматика экспериментальной ВКЭ-инфекции ассоциирована с целым каскадом увеличения экспрессии генов иммунорегуляторных молекул, что является проявлением активации клеток микроглии – резидентных макрофагов головного мозга – и привлечения в очаг воспаления дендритных клеток, нейтрофилов и T-лимфоцитов. Данное осложнение инфекционного процесса также характеризуется выраженным увеличением количества вирусной РНК в головном мозге зараженных животных по сравнению с особями, у которых не отмечалось видимых признаков заболевания в течение всего периода наблюдения. Несомненно, чрезмерная активация иммунных клеток, продуцирующих провоспалительные цитокины, в головном мозге является непосредственной причиной неврологических осложнений инфекционного процесса. Эффективная элиминация вируса из организма при помощи иммуноглобулина против ВКЭ достигается только при введении препарата антител до или на максимально ранних сроках после инфицирования. Учитывая, что препараты антител обладают определенным иммуностимулирующим свойством, введение их на поздних сроках после инфицирования в некоторых случаях может привести к утяжелению инфекционного процесса (в условиях эксперимента на лабораторных животных). Для предотвращения неврологических осложнений инфекционного процесса терапевтические мероприятия должны быть направленны на максимально раннюю элиминацию вируса из организма и на предотвращение развития чрезмерной воспалительной реакции и цитокинового шторма в головном мозге. При этом представляется оправданным применение противовирусных антител совместно с проведением иммуномодулирующей терапии.
Рецензенты:
Читайте также:

